토토에서의 제브라피시 비늘 재생 및 비늘의 Ex Vivo 배양
요약
이 프로토콜은 in vivo 재생 중 제브라피쉬의 엘라스모이드 비늘을 채취하고 시각화하는 방법을 설명합니다. 또한, 수확 후 최대 7일 동안 이러한 스케일의 생체 외 배양이 제시됩니다.
초록
골격계 질환은 종종 그 원인이 복잡하며 전 세계 수백만 명의 사람들에게 영향을 미칩니다. 인구 고령화로 인해 의료 시스템의 부담을 덜어줄 수 있는 새로운 치료법이 필요합니다. 이러한 질병은 복잡하기 때문에 실험실 환경에서 뼈 병태생리학을 정확하게 모델링하는 것은 어렵고 비용이 많이 듭니다. 이 분야의 과제는 잠재적인 치료 화합물을 테스트하는 데 사용할 수 있는 뼈 질환 모델링을 위한 비용 효율적이고 생물학적으로 관련된 플랫폼을 구축하는 것입니다. 이러한 플랫폼은 광물화된 매트릭스 환경에서 활동하는 뼈 형성 조골세포와 뼈 분해 파골세포의 세포 거동을 동적으로 시각화할 수 있어야 합니다. 제브라피쉬는 형질전환 리포터 라인을 포함한 유전 도구의 가용성과 일부 골격 조직(비늘 포함)이 성충이 될 때까지 반투명하게 유지되어 동적 이미징 옵션을 허용한다는 사실로 인해 모델로 점점 더 많이 사용되고 있습니다. 제브라피시 비늘은 조골세포와 파골세포를 모두 가지고 있고 매우 풍부하기 때문에 쉽게 접근할 수 있고 풍부하게 사용할 수 있는 독립적인 뼈 단위의 자원을 제공합니다. 또한, 일단 제거되면 성인 제브라피시 비늘은 완전히 재생되므로 생체 내에서 광물화된 조직의 시공간 성장을 연구할 수 있는 방법을 제공합니다.여기에서는 비늘의 재생을 수확하고 추적하기 위한 프로토콜에 대해 자세히 설명합니다. 마지막으로, 일주일 동안 생체 외 비늘의 안정적인 배양 및 시간 경과에 따른 저울의 광물화된 매트릭스에 대한 통제된 손상 후 치유 반응에 대한 프로토콜도 제시됩니다.
서문
뼈는 골격의 주요 부분을 형성하는 단단한 결합 조직으로, 운동을 가능하게 하고 신체의 미네랄 저장고 역할을 합니다. 건강한 뼈를 유지하기 위해서는 조골세포(단백동화)와 파골세포(뼈를 재흡수)의 결합 활동을 통해 뼈 형성과 퇴화 사이의 절묘한 균형이 필수적입니다. 이러한 균형은 노화나 호르몬 불균형으로 인해 깨지며, 종종 골다공증과 같은 뼈 취약성 질환을 유발한다1. 기존 약물은 뼈 취약성 질환을 표적으로 하는 것으로 승인되었지만 많은 약물이 부작용을 가지고 있습니다. 따라서 새로운 치료제가 필요하다1. 따라서 잠재적인 치료 화합물을 테스트하는 데 사용할 수 있는 생물학적으로 관련된 뼈 조직의 풍부한 공급원에 대한 필요성이 남아 있습니다.
전통적으로 설치류 모델과 세포 배양 시스템은 뼈 생물학을 연구하는 데 사용되었습니다. 그러나 제브라피시는 점점 더 선택의 대상이 되고 있습니다. 포유류 시스템은 아니지만 제브라피쉬는 설치류에 비해 뼈 연구에 특정 이점을 제공합니다. 여기에는 번식력과 유충의 반투명도가 포함됩니다. 성인이 되어서도 비늘과 지느러미를 포함한 일부 골격 조직은 반투명하게 유지되어 고해상도 생체 내 이미징이 가능하고 골격 돌연변이 2,3의 가용성이 증가합니다. 제브라피쉬의 지느러미와 비늘은 모두 제거 후 완전히 재생될 수 있습니다. 제브라피시 지느러미의 골격 재생 및 부상 복구는 광범위하게 연구되어 왔으며4,5 제브라피시 비늘은 현장에서 가장 새로운 뼈 모델이지만 체외 배양에 이점을 제공한다6.
비늘은 매우 풍부하며 각 물고기에는 물고기를 보호하는 덮개 역할을 하는 최소 300개의 비늘이 있습니다. 각 비늘은 콜라겐이 풍부한 골격 기질(skeletal matrix)의 뼈를 형성하는 조골세포(osteoblast)와 뼈를 흡수하는 파골세포(bone-resoring osteoclast)로 구성된 작은 광물화된 판이다(7). 제브라피시 비늘과 인간 뼈의 골화 과정은 중간엽 줄기세포를 조골세포로 분화시켜 광물화된 기질을 형성해야 합니다. 제브라피시 비늘은 뼈 재생 및 복구를 연구하는 데 사용할 수 있는 강력한 재생 능력으로 골격 연구에 큰 이점을 제공합니다. 그러나 조골세포와 파골세포가 모두 존재함에도 불구하고 제브라피시 비늘에는 인간의 뼈 리모델링과 기계 감각에 중요한 골세포가 없습니다. 비늘의 표면 위치는 한 쌍의 집게로 쉽게 제거할 수 있음을 의미합니다. 스케일을 제거하면 일련의 이벤트가 발생하고 스케일 재생이 시작됩니다 8,9. 그림 1과 같이 조골세포와 파골세포의 활동과 비늘의 광물화를 시각화하는 데 사용할 수 있는 다양한 염색 및 이미징 옵션이 있습니다. 또한, 제브라피쉬의 많은 관련 형광 형질전환 리포터 라인을 사용할 수 있다는 것은 재생 중 세포 역학을 시각화할 수 있다는 것을 의미합니다 7,10,11. 이 과정을 통해 물고기 옆구리의 비늘 재생의 초기 패턴을 관찰하여 이러한 재생된 비늘의 형태, 세포 활동 및 유전적 프로필을 연구함으로써 새로운 뼈 형성에 대해 더 잘 이해할 수 있습니다. 스케일 형성 및 재생의 생물학은 잘 특성화되어 있습니다. 중요한 것은, 비늘은 치료적으로 관련된 화합물에 대한 우수한 예측 능력을 나타낼 수 있으며12 글루코코르티코이드로 어류를 처리하면 골다공증성 표현형을 보여주기 위해 재생성되는 저울로 이어진다13. 재생 스케일의 전사체는 스케일 재생에서 활성화된 유전자가 인간 골격계 질환과 관련된 유전자에 대해 풍부하다는 것을 보여주며, 모델 시스템으로서의 관련성을 더욱 입증합니다 6,14.
마지막으로, 이러한 비늘은 최대 7일 동안 생체 외에서 배양할 수 있습니다. 일반적으로 단일 세포 유형으로 구성된 세포주 배양과 비교하여 체외 규모 배양은 자연 세포외 기질 8,12,15,16을 가진 조골세포와 파골세포를 모두 포함하는 자연 환경 내에서 체외 뼈 연구 기회를 제공합니다.
스케일 배양은 또한 새로운 골동화 작용 표적에 대한 약물 스크리닝을 수행할 수 있도록 합니다. 물고기에 비늘이 풍부하다는 것은 물고기 한 마리에서 96웰 플레이트의 플레이트를 최소 2개 이상 채울 수 있다는 것을 의미하며, 모든 단일 웰에 세포의 자연스러운 틈새와 함께 하나의 스케일이 포함된 멀티웰 형식의 복합 스크리닝이 가능합니다. 또한, 비늘이 얇기 때문에 약물 흡수를 예측할 수 있다12. 요약하면, 제브라피쉬의 엘라스모이드 비늘은 골격 연구에서 큰 잠재력을 가지고 있으며 뼈 형성 및 복구 중 세포 이벤트에 대한 더 많은 통찰력을 얻는 데 도움이 될 수 있습니다. 여기서는 생체 내 재생을 따르기 위한 비늘 수확 프로토콜과 생체 외 배양 비늘에 대해 설명합니다.
프로토콜
University Animal Scientific Unit(ASU)은 제브라피시 사육 지침에 따라 제브라피시 관리를 담당합니다. 스케일 수확, 살아있는 뼈 염색 및 살아있는 이미징을 포함한 모든 절차는 영국 내무부 프로젝트 라이선스(PP4700996)에 따라 승인되고 수행되었습니다. 이 원고에는 sp7:mCherry [Tg(osterix:mCherry-NTR)pd46] 계열의 젊은 성체 형질전환 제브라피시가 사용되었다17. 물고기는 생후 4개월의 수컷과 암컷을 모두 포함했습니다.
1. 생체 내 규모 재생
- 스케일 재생 실험을 시작하기 전에 그림 2와 같이 제브라피시를 주 수조에서 개별 수조로 옮기고(재료 표 참조) 실험 전반에 걸쳐 이미징을 한 후 개별 수조로 돌아갑니다. 이는 모든 재생 비늘이 실험을 위해 수확된 비늘인지 확인하기 위한 것입니다. 그룹 하우징은 다른 물고기로 인한 부상으로 인해 산발적으로 비늘을 잃을 수 있습니다.
알림: 물고기는 물고기 간의 싸움과 그에 따른 비늘 손실을 피하기 위해 개별적으로 배치됩니다. - 실험 설계에 따라 각 실험 물고기에 대한 정보(즉, 유전자형, 나이 및 성별)를 기록합니다. 카메라(스마트폰 카메라는 잘 작동함)를 사용하여 자 옆에 있는 각 물고기의 이미지를 찍어 물고기 크기/길이 및 건강 상태를 기록합니다.
- 실험 당일, 0.05%(v/v) 트리카인 메탄 설포네이트(MS222, 재료 표 참조)를 사용하여 제브라피시를 침지로 마취한 다음 이미징 또는 수확 중에 물고기가 움직이지 않도록 젖은 티슈가 있는 페트리 접시에 놓습니다.
- 생선을 옆으로 눕힙니다(일반적으로 일관성을 위해 왼쪽 측면이 사용됨). 적절한 배율의 실체현미경을 사용하여 측면 이미징을 수행합니다(일반적으로 본 연구에서는 2x, 4x 및/또는 6.3x 및 8x를 사용하여 전체 재생 영역과 자세한 관찰을 위한 확대 영역을 모두 캡처했습니다).
참고: 측면 이미징 시점은 실험 목적과 형질전환 리포터의 선택에 따라 다릅니다. 예를 들어, 스케일 재생 중 조골세포를 추적하기 위해 제안된 시점은 0일(온토유전학), 수확 후 2일(dph), 4dph, 7dph, 10dph, 14dph, 21dph입니다. 반복적인 마취로 인한 영향을 줄이려면 이미징 시간을 실험에 필요한 가장 적은 시점으로 유지하십시오. - 실체현미경 아래에서 미세한 핀셋과 집게를 사용하여 비늘을 수확합니다. 채취한 스케일을 수집 튜브로 옮겨 나중에 스케일 염색을 합니다.
알림: 수확할 수 있는 최대 비늘 수는 현지 윤리적 승인에 따라 다릅니다. 일반적으로 약 20-30개의 스케일을 채취하여 나중에 스케일 염색을 위해 개별 수집 튜브에 수집합니다(예: ALP, von Kossa14). - 스케일을 1.5 mL 또는 2 mL 수집 튜브로 수집합니다. 이것은 사용된 염색 기술에 따라 다릅니다.
- ALP 및 von Kossa 염색의 경우 스케일을 탈이온수가 포함된 수집 튜브로 옮기는 반면, TRAP 염색 또는 면역조직화학의 경우 4% PFA(고정 용액)가 포함된 수집 튜브로 스케일을 옮깁니다.
- 선택 사항: 스케일을 튜브로 옮기기 전에 필요한 경우 수확된 개별 스케일의 이미지를 캡처합니다.
알림: 제안된 스케일 수확 시점은 0일(온토유전학), 10일 및 21일(재생된 스케일)입니다.
2. 살아있는 뼈 염색
참고: 살아있는 골격 염색은 실험용 물고기가 형광 리포터에 대해 형질전환되지 않거나 단색 형질전환 리포터를 휴대할 때 수행할 수 있습니다. 살아있는 염색은 형질전환을 보완하는 데 사용할 수 있습니다. 예를 들어, sp7/osx 와 같은 조골세포 리포터를 한 가지 색상(예: GFP)으로 사용한 다음 Alizarin red(AR)로 뼈를 빨간색으로 염색할 수 있습니다. AR과 칼세인 그린은 같은 물고기에 함께 사용할 수 있습니다. 이 시나리오에서 AR은 노화된 뼈의 광물화된 매트릭스에 결합하여 원래 또는 존재 유전학적 뼈를 표지하는 데 사용되며 칼세인은 새로 형성된 뼈에 풍부한 칼슘 이온에 결합합니다. 예를 들어, 존재 유전 학적 척도를 염색 할 때 AR을 시각화 할 수 있지만 존재 학적 척도는 새로운 뼈 형성 수준이 낮기 때문에 칼세인 그린이 없거나 최소화 될 수 있습니다.
- 라이브 Alizarin Red(AR) 염색을 수행합니다.
- 0.5%(w/v) 원수 Alizarin 용액(10mL)과 1M 원수 HEPES(최종 농도, 10mM) 10mL를 혼합하여 2x AR 염색 용액 한 병을 준비합니다( 재료 표 참조).
- 1x Danieau 용액으로 최대 1L를 채우십시오( 재료 표 참조). 용액은 어둡게 보관하거나 호일로 싸야 합니다.
- 실험 당일, 500mL의 2x AR 용액을 제브라피시 시설로 가져오고, 500mL의 시스템 물(수족관에서)을 추가하여 1x 작동하는 AR 용액을 만듭니다.
- 수조에서 물고기를 1x 작동하는 AR 염색 용액으로 옮기고 15-20분 동안 그대로 둡니다. 시스템 물에서 15분 동안 '세척'하여 생선의 과도한 얼룩을 씻어냅니다.
- 라이브 Calcein Green 염색을 수행합니다.
- 1x Danieau 용액 900mL에 Calcein 분말 45mg을 첨가하여 2x Calcein Green 염색 용액 한 병을 준비합니다( 재료 표 참조). 분말이 완전히 녹을 수 있도록 자석 교반기를 사용하십시오.
- pH를 8로 조정합니다. 이것은 2x 스톡 Calcein Green 솔루션입니다. 용액은 최대 1개월 동안 어두운 곳에 보관하거나 호일로 포장할 수 있습니다.
- 실험 당일, 500mL의 2x Calcein Green 용액을 제브라피시 시설로 가져오고, 500mL의 시스템 물을 추가하여 1x 작동하는 Calcein Green 용액을 만듭니다. 갓 만든 Calcein 염색 용액을 사용하는 것이 좋습니다.
- 수조에서 물고기를 1x 작동하는 Calcein Green 염색 용액으로 옮기고 1-2시간 동안 그대로 둡니다. 물고기의 크기에 따라 더 긴 염색 시간이 필요할 수 있습니다.
- 생선의 과도한 얼룩을 시스템 물에서 15분 동안 '씻어내서' 씻어냅니다.
알림: 이 얼룩은 몇 시간 안에 희미해지므로 가능한 한 빨리 Calcein Green 염색 물고기를 이미지하십시오.
3. 수확 후 스케일에 알칼리성 인산가수분해효소(ALP) 염색
- 100mM Tris(HCl이 있는 pH 9.5)를 100mM NaCl 및 50mMMgCl2와 혼합하여 ALP 염색 용액을 준비합니다.
- 시중에서 판매되는 NBT/BCIP 원액을 사용하십시오( 자료표 참조).
- 저울을 탈이온수가 들어 있는 튜브로 옮깁니다.
- ALP 염색 용액에서 스케일을 5분 동안 헹굽니다.
- 한편, 200μL의 NBT/BCIP 용액을 10mL의 ALP 염색 완충액에 첨가하여 작업 염색 용액을 준비합니다. 이것은 염색 할 때 신선하게 준비해야합니다.
- 작동하는 ALP 염색 용액으로 15분 동안 스케일을 염색합니다.
- 탈이온수로 스케일을 헹구어 반응을 중지합니다.
4. 수확 후 저울에 Von KOSSA 염색
- 5%(w/v)의 질산은 용액을 준비합니다.
- 5%(w/v)의 티오황산나트륨 용액을 준비합니다.
- 수확된 스케일을 탈이온수가 들어 있는 튜브로 옮깁니다.
- 질산은 용액에 비늘을 넣고 강한 빛 아래에서 40분 동안 배양합니다.
알림: 질산은은 제거하기 어려운 얼룩을 남기므로 PPE(개인 보호 장비)를 착용하십시오. - 탈이온수로 저울을 5분 동안 두 번 세척합니다.
알림: 질산은 폐기물은 현지 지침에 따라 수거 및 폐기해야 합니다. - 티오황산나트륨에 저울을 5분 동안 배양합니다.
- 탈이온수로 저울을 5분 동안 두 번 세척합니다.
5. 비색 TRAP 염색
참고: 자세한 절차는 이전에 출판된 저작물18을 참조하십시오.
- 염색 용액을 준비합니다.
- 10mg/mL 나프톨 AS-MX 인산염 용액을 준비합니다.
- 나프톨 AS-MX 인산염 5mg을 칭량합니다( 재료 표 참조).
- 흄 후드에서 0.5mL의 N, N'-디메틸포름아미드가 포함된 튜브를 준비하고 5mg의 나프톨 AS-MX 인산염을 0.5mL의 N, N'-디메틸포름아미드에 용해시켜 10mg/mL의 나프톨 AS-MX 인산염 원액을 만듭니다(부드럽게 흔들어).
- 1.6mM 주석산나트륨에 50mM의 Fast Red Violet LB 원액을 준비합니다.
- pH 5에서 0.1M 아세트산 나트륨 50mL를 준비합니다(탈이온수 50mL에 아세트산 나트륨 0.41015g을 추가하고 100% 아세트산으로 pH를 5로 조정).
- 0.575g의 나트륨 L-타르타르산염 이염기성 이수화물( 재료 표 참조)을 0.1M 아세트산나트륨 완충액(pH = 5) 50mL에 녹입니다.
- 빠른 적자색 LB 소금 30mg을 추가합니다.
- PBS-0.1Tx를 준비합니다(500μL의 Triton-X를 PBS 500mL에 용해).
- PBS-0.1Tw를 준비합니다(Tween-20 500μL를 PBS 500mL에 용해).
- 10mg/mL 나프톨 AS-MX 인산염 용액을 준비합니다.
- 작동하는 TRAP 솔루션을 준비합니다.
- 흄 후드에서 두 원액을 함께 혼합합니다(10mg/mL 나프톨 AS-MX 인산염 용액 0.5mL 및 50mM 주석산나트륨에 1.6mM Fast Red Violet LB 원액 50mL).
알림: 이제 작업 용액을 흄 후드 외부에서 사용할 수 있습니다. 냉장고(호일로 싸서 포장)에 최대 한 달 동안 보관할 수 있습니다. 항체 또는 고정제에 민감한 다른 시약과 별도의 용기에 보관하십시오. 가능한 한 빛을 피하십시오. - 선택 사항: PBS 및 0.1% Tween-20(PBS-0.1%Tw)에서 표백 용액(TRAP 염색된 사후 고정 샘플)을 준비합니다.
- 0.5% 수산화칼륨(KOH)(10% 원액(w/v)에서)과 3% 과산화수소(H2O2)(33% 원액, 냉장고에 보관)의 최종 농도 혼합물을 준비합니다.
- 흄 후드에서 두 원액을 함께 혼합합니다(10mg/mL 나프톨 AS-MX 인산염 용액 0.5mL 및 50mM 주석산나트륨에 1.6mM Fast Red Violet LB 원액 50mL).
- 샘플 고정을 수행합니다.
- 실온(RT)에서 4분 동안 흔들거나 회전하는 1x PBS에서 40% PFA의 스케일을 고정합니다.
- 4% PFA를 제거하고 PBS-0.1Tx로 3분 이상 5분 이상 세탁합니다.
- TRAP 염색(가장 좋은 방법)으로 직접 이동하거나 PBS-0.1 Tx에 하룻밤 동안 보관하십시오.
- 비늘의 TRAP 염색을 수행합니다.
- PBS-0.1 Tx 용액을 제거하고 비색 TRAP 작업 용액(5.2.1단계)을 추가하여 샘플을 완전히 덮습니다(즉, 1.5mL 미세 원심분리 튜브에서 1mL).
- 어둠 속에서 흔들면서 RT에서 1-2시간 동안 배양합니다.
- 염색액을 제거하고 PBS-0.1 Tw로 3분 동안 5회 이상 세탁합니다.
- RT에서 30분 동안 4% PFA로 샘플을 사후 고정하고 어둠 속에서 부드럽게 흔듭니다.
- 각 단계마다 PBS-0.1 Tw로 3분 동안 5회 세척하여 PFA 용액을 제거합니다.
알림: 샘플은 어두운 곳에서 4°C에서 무기한으로 보관(보관 용액/현미경 슬라이드에 장착)할 수 있습니다.
6. 염색된 저울 장착
- 2.4g의 글리세롤에 Mowiol 4-88 결정을 6g의 모비올을 첨가하여 장착 매체를 준비합니다( 재료 표 참조). 임의의 바람직한 장착 매체를 사용할 수 있습니다.
- 탈이온수 6mL를 넣고 자석 교반기에 한 시간 동안 그대로 둡니다.
- 12mL의 0.2M Tris (pH 8.5)를 첨가하고 Mowiol 결정이 완전히 용해 될 때까지 약 53 ° C에서 배양합니다.
- 실온에서 20분 동안 2000 x g 으로 원심분리하여 용액을 정화합니다.
- 솔루션을 스토리지 컨테이너로 전송합니다. 장착 매체는 냉동실에 약 12개월 동안 보관할 수 있습니다. 해동된 Mowiol 용액은 최대 1개월 동안 안정적입니다.
- 현미경에 저울을 장착하고 매체를 장착할 때 슬라이드를 장착하고 커버슬립으로 덮고 현미경으로 봅니다.
7. 비늘의 Ex vivo 배양
참고: 이 단계는 de Vrieze et al.12에서 발췌한 것입니다.
- 멸균 환경에서 스케일을 수확하기 전에 골형성 배지와 배양판을 준비합니다.
- 골형성 배양 배지(OCM): 멸균 원심분리 튜브에서 1% 소 송아지 혈청, 1%(0.85% NaCl의 200mM L-알라닐-L-글루타민 디펩타이드), 1% 항생제/항진균제(100x) 용액, 4mM CaCl2, 10mM β-글리세로포스페이트, 1nM 피루브산나트륨 및 1% 암포테리신 B(옵션)의 최종 농도에서 표준 세포 배양 배지(고포도당, 글루타민 없음, 페놀 레드 없음)에서 15mL OCM을 만듭니다( 재료표 참조).
- OCM을 멸균 시약 저장소에 붓고 멀티채널 피펫을 사용하여 96웰 플레이트의 각 웰에 100μL를 추가합니다.
- 96웰 플레이트를 밀봉하고 플레이트를 보관합니다. OCM은 냉장고에 단기간(하룻밤에서 1주일) 보관할 수 있으며 사용 전 28°C에서 보관할 수 있습니다.
- 스케일 수확 및 PBS 세척을 수행합니다.
- 멸균 핀셋/겸자를 사용하여 비늘을 수확하고 멸균 PBS 용액이 포함된 페트리 접시에 보관합니다.
- 플레이트 설정을 수행합니다.
- 멸균 겸자를 사용하여 100μL의 OCM(28°C로 예열)이 있는 96웰 플레이트의 각 스케일을 Petri 접시의 각 스케일로 옮깁니다.
- 모든 비늘이 플레이트로 옮겨지면 플레이트를 실체현미경 아래로 가져옵니다. 미세한 멸균 피펫 팁을 사용하여 각 스케일을 웰 바닥으로 부드럽게 이동하고 웰 측면에서 멀리 떨어뜨려 이미지 획득 중 빛 반사를 방지합니다.
참고: 이 단계는 실시간 이미징을 수행하는 경우에만 필요합니다. - 플레이트를 인큐베이터 또는 라이브 이미징 시스템(LIS, 재료 표 참조)(28°C, 5% CO2로 설정)으로 조심스럽게 옮기면 스케일을 최대 7일 동안 배양할 수 있습니다.
- OCM을 새로 고칩니다(선택 사항).
- 냉장고에 보관된 OCM을 28°C로 데우세요.
- 96웰 플레이트를 멸균 환경으로 조심스럽게 옮깁니다. 멀티채널 피펫을 사용하여 각 웰에서 50μL를 흡입합니다. 이를 위해 팁을 벽에 대고 누르고 저울 흡입/이동/제거를 방지하기 위해 바닥까지 담그지 마십시오. 다양한 조건에 대한 새로운 팁을 사용하십시오.
- OCM을 멸균 시약 저장소에 붓고 멀티채널 피펫을 사용하여 각 웰에 60μL의 OCM을 추가합니다.
- 실체현미경 아래에 플레이트를 놓고 잘못 배치된 스케일이 있는지 확인합니다(벽에 너무 가깝거나, 떠 있거나, 매체 내의 수직 위치). 필요한 경우 미세한 멸균 피펫 팁으로 위치를 변경합니다.
- 플레이트를 인큐베이터/LIS에 다시 놓습니다.
알림: 실험에 일주기 리듬(CR)이 포함된 경우 혈청 쇼크가 생체 시계에 영향을 미칠 수 있으므로 배지를 새로 고치지 마십시오. CR을 연구하는 경우 조명 조건도 시계를 재설정한다는 점에 유의하십시오.
- 배양 후 스케일 염색 및 이미징(선택 사항)을 수행합니다.
- 6일간의 배양 후 고정하고 위에서 언급한 von Kossa 및 ALP와 같은 적절한 염색을 지시합니다.
- 또는 실험용 물고기에 형광 태그가 있는 경우 플레이트를 라이브 이미징 시스템에 넣습니다.
알림: 라이브 이미징 시스템을 사용하는 경우 실험에 적합한 온도 및 CO2 수준으로 설정되어 있는지 확인하십시오. 일반적으로 이 연구에서는 28°C 및 5%CO2 가 사용되었습니다. 적절한 필터와 이미징 시점(여기서는 조골세포 이동을 따르기에 충분한 2시간 또는 4시간 간격이 사용됨)과 저배율 대물렌즈(즉, 4배)를 선택하여 전체 웰의 균일한 이미징을 보장합니다. 이는 비늘이 특히 매체 교체 중에 우물 내부에서 움직이는 경향이 있기 때문입니다.
대표적 결과
스케일 재생
비늘 재생은 표준 형광 실체현미경으로 제브라피쉬의 옆구리를 촬영하여 추적할 수 있습니다. 그림 3A 는 4개월 된 제브라피쉬의 비늘 재생 중 비늘의 sp7/osx 발현 변화를 보여줍니다. 그림 3A 에 표시된 측면 이미징의 시점은 수확 후 존재 유전학(원래 스케일, 수확 전), 2일, 4일 및 10일입니다. 우리는 일반적으로 osx ( osterix 또는 sp7이라고도 함) 형질전환 계통(GFP(Tg(Ola.sp7:NLS-eGFP)19 또는 mCherry Tg(osterix:mCherry-NTR)pd46)17 을 사용하여 뼈를 만드는 조골세포를 표지할 때 골격계의 변화를 추적합니다. 새로 형성된 비늘의 초기 패턴은 재생 2일에서 볼 수 있습니다. 이러한 초기 스케일 재생 패턴은 일부 경우, 특히 골격 돌연변이에서 방해를 받습니다. 재생의 진행 상황을 추적하여 재생 용량과 속도를 분석할 수 있습니다. 스케일 채취 당일에는 그림 3B와 같이 동일한 실체현미경을 사용하여 측면 이미징 후 수확된 스케일의 개별 이미징을 수행할 수 있습니다. 재생된 비늘은 새로운 뼈 형성을 위해 조골세포가 필요하기 때문에 Day 0 온토제닉 스케일에 비해 osx 발현이 훨씬 더 높습니다.
Ex vivo 스케일 배양
물고기 옆구리의 재생 과정을 추적하여 새로운 뼈 형성 과정을 연구할 수 있지만, 이 모델을 사용하여 메스로 비늘에 상처를 입힘으로써 체외 규모 배양을 통해 골격 손상의 복구 및 치유를 연구할 수도 있습니다. 라이브 이미징 시스템을 사용하여 수리를 실시간으로 추적할 수 있습니다. 그림 4 는 조골세포에 osx: mCherry가 표지된 배양에서 3일 만에 온토유전학적 규모의 부상 치유 반응이 나타난 대표적인 결과를 보여줍니다. 배양 초기에 삽입된 손상 부위는 조골세포와 비늘 원형(scale circuli) 사이에 뚜렷한 간격이 있음을 보여줍니다(그림 4A). 타임 랩스 이미징을 통해 손상 부위를 향한 조골세포의 이동을 모니터링할 수 있습니다. 배양 3일 후, 갭의 폭이 줄어들고 갭과 새로 형성된 스케일 서클 사이에서osx 의 발현을 볼 수 있습니다(그림 4B). 또한 조골세포의 모양 측면에서 형태는 배양 초기에 더 원형이고 3일 후에는 더 길쭉합니다. 이러한 조골세포 출현의 변화는 자연 환경(물고기에 부착된 것)이 아닌 배양에 있기 때문일 수 있습니다.
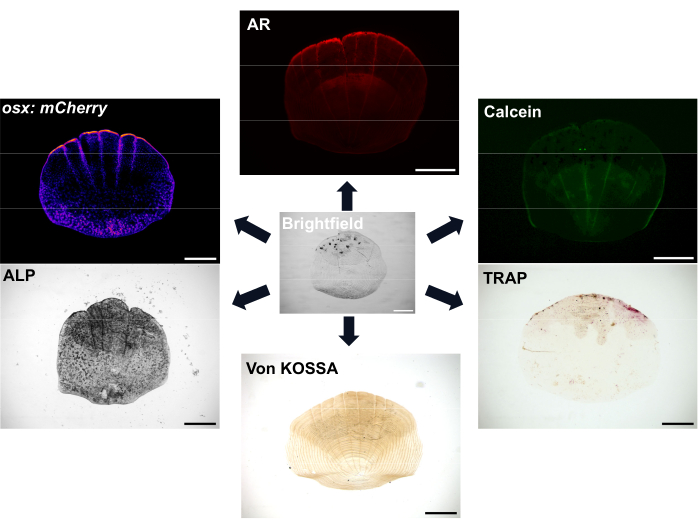
그림 1: 스케일에 대한 이미징 옵션의 예. 조골세포는 osx/sp7 형질전환 리포터 라인(GFP 또는 mCherry)으로 시각화할 수 있습니다. ALP 염색은 조골세포 활성을 보여주는 데 사용할 수 있습니다. TRAP 염색은 파골세포의 활성을 보여줄 수 있습니다. 알리자린 레드(AR)와 칼세인 그린은 모두 살아있는 물고기에 사용할 수 있는 염료입니다. AR은 광물화(mineralization)를, 칼세인(Calcein)은 새로 형성된 뼈를 표시합니다. 광물화의 정도는 von Kossa 염색으로도 나타낼 수 있습니다. 스케일 바: 500 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
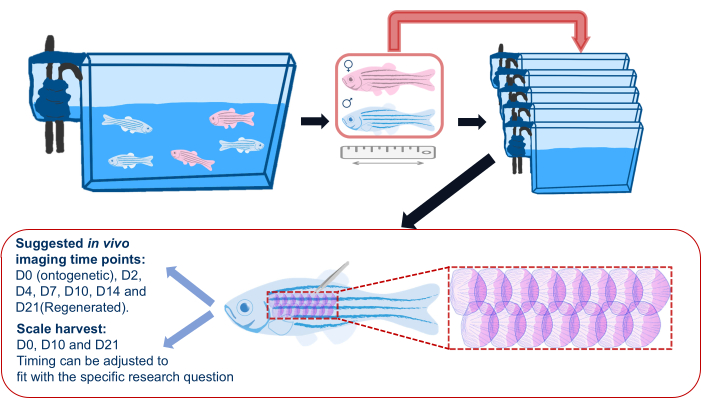
그림 2: 스케일 재생 실험의 개략도. 실험 전에 물고기가 개별 수조로 분리되는 것을 보여주는 스케일 재생 실험의 일반적인 개략도. 길이, 성별 및 건강 상태가 기록됩니다. 회로도는 또한 물고기 옆구리에 비늘을 수확하기 위해 제안된 영역과 제안된 이미징 시점을 보여줍니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
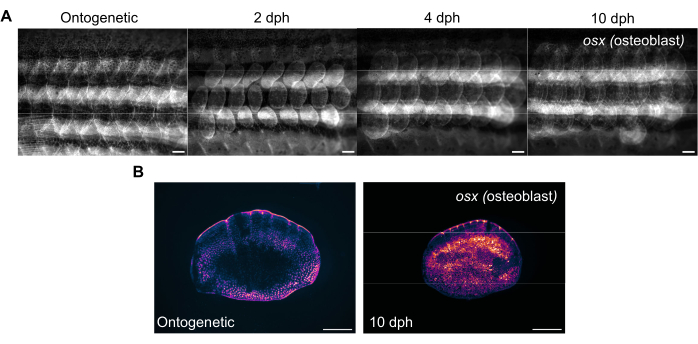
그림 3: 생후 4개월 된 제브라피시에서 채취한 비늘 재생 중 오스테릭스 발현(조골세포 시각화)의 대표 이미지. (A) OSX 발현의 변화를 추적하기 위해 0일차(수확 전, 온토유전학적 규모), 2일차(수확 후 일수), 2일차, 4dph, 10dph에 캡처한 측면 이미지. 스케일 바: 1mm. (B) 패널 (A)와 동일한 물고기에서 채취한 10dph의 존재 유전학적 스케일 및 스케일의 대표 이미지. 재생성 스케일의 중앙에 자홍색으로 표시된 것처럼 osx 표현의 수준이 증가한 것을 확인하십시오. 스케일 바: 500 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
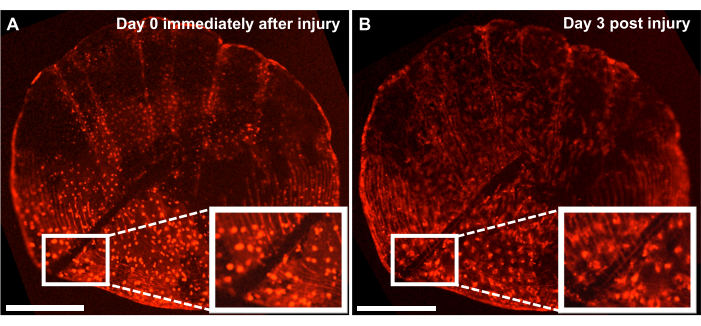
그림 4: 생후 4개월 된 제브라피시에서 실시간 이미징 시스템을 사용하여 캡처한 온토유전학적 규모의 골격 손상 복구 반응의 대표적인 결과. (A) 배양 수확과 같은 날(시점 0/day0)에 메스에 의해 발생한 손상이 있는 존재 유전학적 비늘. (B) 부상 후 3일 후에도 동일한 척도가 표시됩니다. 삽입은 부상 부위를 보여줍니다. 스케일 바: 500 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
토론
제브라피쉬의 엘라스모이드 비늘은 골격 연구를 위한 새로운 모델로서 뼈 유지, 재생 및 부상 복구에 대한 우리의 이해를 도울 수 있는 큰 잠재력을 가지고 있습니다. 물고기에 비늘이 풍부하기 때문에 중처리량에서 고처리량의 화합물 스크리닝이 가능하며, 사용되는 동물의 수를 줄이고 개체 내 변동을 제한할 수 있습니다. 여기에서는 재생 및 복구를 연구하기 위해 스케일 재생 및 체외 스케일 배양을 위한 프로토콜을 제시합니다.
이 프로토콜을 따를 때 몇 가지 중요한 단계를 고려해야 합니다. 비늘을 조심스럽게 제거하는 것은 필수적이며, 특히 형질전환 리포터 라인을 사용하여 수확으로 인한 세포 집단에 대한 교란을 제한할 때 더욱 그렇습니다. 존재 유전 학적 규모와 비교하려면 해당 영역에 자연 재생 비늘 (물고기의 수명 동안 자연적으로 발생할 수 있음)이 포함되어 있지 않은지 확인하십시오. 최적의 세포 생존과 배양 내 감염 최소화를 달성하기 위해 체외 배양을 위한 환경과 장비를 멸균 상태로 유지합니다.
특정 연구 질문에 따라, 재생 및 복구 동안 다른 세포 유형의 유전자 발현 프로파일을 시각화하기 위해 상이한 형질전환 리포터 라인을 결합하는 것과 같은 프로토콜에 대한 적응이 이루어질 수 있습니다11,14.
저울에서 수행할 수 있는 염색의 범위가 넓다는 것은 테스트된 각 화합물 또는 조건에 대해 다양한 각도에서 뼈에 미치는 영향을 볼 수 있음을 의미합니다. sp7/osx 리포터는 조골세포 수를 표시할 수 있고, ALP 염색은 조골세포 활성을 시각화할 수 있으며, TRAP 염색은 파골세포 활성을 시각화할 수 있으며, Calcein green 라이브 염색은 새로 형성되는 뼈를 라벨링할 수 있으며, Alizarin red 또는 von Kossa 염색은 스케일 광물화를 표시할 수 있습니다. 조골세포를 정량화하기 위한 루시페라아제 활성도 사용할 수 있다12. 이러한 염색 기법과 결합하면 주어진 뼈 효과에 대한 조골세포와 파골세포의 상대적 기여도를 알 수 있습니다. 비늘에는 포유류 뼈에 널리 퍼져 있는 골세포가 부족하며 뼈 기계 감각 반응의 주요 동인입니다. 이 모델에서 스케일 복구 및 재생은 주로 조골세포에 의해 구동되며 후속 리모델링은 파골세포에 의해 구동됩니다 8,9. 개인과 연령 그룹 간에 차이가 발생한다는 점에 유의하는 것이 중요합니다20. 이를 최소화하기 위해서는 위치에 따라 비늘 형태가 달라질 수 있기 때문에 비늘 채취 면적이 일정해야 하며, 나이와 크기가 일정하도록 동일한 형제 그룹의 물고기를 사용합니다. 그러나 물고기당 여러 개의 비늘을 수확할 수 있기 때문에 더 적은 수의 물고기를 사용하여 더 많은 실험을 실행할 수 있어 개체 내 변동성을 줄일 수 있습니다.
요약하면, 이러한 프로토콜은 존재 유전 및 재생 규모에 적용 할 수있는 실험 기술을 보여줍니다. 결론적으로, 엘라스모이드 비늘은 뼈 형성 및 복구에 대한 이해를 돕기 위해 골격 모델로서 큰 잠재력을 보여줍니다. 고처리량 골동화 화합물 스크리닝을 위한 동물 사용을 줄이는 데 도움이 됩니다.
공개
저자는 공개할 이해 상충이 없습니다.
감사의 말
어류 사육을 위한 동물 서비스 부서의 매튜 그린(Mathew Green)과 울프슨 바이오이미징 센터(Wolfson Bioimaging Centre)의 케이티 젭슨(Katy Jepson)에게 감사의 뜻을 전합니다. CLH, DB 및 QT는 Versus Arthritis(CLH Senior Fellowship 21937, DB and QT Intermediate Fellowship 22044)에서 자금을 지원했으며 RR은 (NHMRC APP1158758)에서 자금을 지원했습니다. 이 작업은 BBSRC 보조금(BB/T001984/1)의 지원도 받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 10x Phosphate buffered saline (PBS) | Gibco | 70013-016 | PBS |
| 12-Multichanel Pipette | Sartorius | 728230 | Multichanel pipette, Proline Plus Mechanical Pipette, 12 Channel, , 10-100 µL. |
| 15 mL Centrifuge tubes | Corning | 430791 | Centrifuge tube, CentriStar Cap, Polypropylene, RNAse/DNAse free, Non-pyrogenic |
| 4% Paraformaldehyde (PFA) | Sigma | P6148 | PFA |
| Alizarin red | Sigma | A5533 | |
| Amphotericin B | ThermoFisher Scientific | 15290026 | |
| Bemis Parafilm M Laboratory Wrapping Film | Fisher Scientific | 11772644 | Sealing film |
| Calcein powder | Sigma | C0875 | |
| Calcium Chloride | Thermo Scientific | L13191.30 | |
| Corning 96 well plate | Corning | 3596 | 96-well-plate, Clear, Flat Bottom Polystyrene TC-treated Microplates, Individually Wrapped, with Lid, Sterile |
| Cover slips | VWR | 631-0146 | |
| Cytiva HyClone Iron-Supplemented Calf Serum | Fisher Scientific | SH30072.03 | |
| Danieau | Sigma | ||
| DMEM | Life Technologies | 31053 | |
| Falcon tubes | Corning | 430828 | |
| Fast Red Violet LB stock solution | Sigma | F3381 | |
| GlutaMAX Supplement | Life Technologies | 35050 | |
| Glycerol | Sigma | 81381 | |
| Hepes | Sigma | H3375 | |
| Incubator | X | Incubator, Set up to 28 °C and 5% CO2 | |
| IncuCyte Zoom | Sartorious | X | Live Imaging System, Set up to 28 °C and 5% CO2 |
| Leica stereomicroscope | X | Sterioscope | |
| L-tartrate dibasic dihydrate | Sigma | 228729 | |
| Mgcl2 | BDH Laboratory Sup. | 261237T | |
| Microscope slides | Epredia | J2800AMNZ | |
| Mowiol 4-88 | Sigma | 9002-89-5 | |
| MQ water | X | ||
| N, N’-dimethylformamide (Merck: D4451) | Merck | D4451 | |
| NaCL | Fisher Chemical | S/3120/53 | |
| Naphthol AS-MX phosphate | Merck | N4875 | |
| NBT/BCIP solution | Sigma | #000000011681451001 | |
| Penicillin-Streptomycin | Life Technologies | 15140 | |
| Petri Dishes | Corning | 430589 | 35 mm sterile Petri dish, Non-treated, Nonpyrogenic, Polystyrene. |
| Reagent Reservoir | Startub | E2310-1025 | 25mL Reagent Reservoir |
| Silver nitrate | Sigma | 209139 | |
| Sodium acetate | Sigma | 52889 | |
| Sodium beta-glycerophosphate pentahydrate | Thermo Scientific | L03425.14 | |
| Sodium pyruvate solution | Sigma | S8636 | |
| Sodium tartrate | Sigma | S4797 | |
| Sodium thioculphate | Sigma | 563188 | |
| Tricaine methane sulfonate (MS222) | Sigma | E10521 | |
| Tris | Sigma | 252859 | |
| Triton-X100 | Sigma | T8787 | |
| Tween-20 | SLS | CHE3852 | |
| Tweezers Number 5 | Dumont | 500341 | Tweezer, INOX, biology grade |
| Zebrafish tanks | Tecniplast | ZB30BCP | 3.5 L - 28 cm x 11 cm x 17 cm |
| Zebrafish tanks | Tecniplast | ZB30BCP | 1 L - 28 cm x 7 cm x 11 cm |
참고문헌
- Tobias, J. H., et al. Opportunities and challenges in functional genomics research in osteoporosis: report from a workshop held by the causes working group of the osteoporosis and bone research academy of the Royal Osteoporosis Society on October 5th 2020,". Frontiers in Endocrinology. 11, (2021).
- Busse, B., Galloway, J. L., Gray, R. S., Harris, M. P., Kwon, R. Y. Zebrafish: An emerging model for orthopedic research. Journal of Orthopaedic Research. 38 (5), 925-936 (2020).
- Dietrich, K., et al. Skeletal biology and disease modeling in zebrafish. Journal of Bone and Mineral Research. 36 (3), 436-458 (2021).
- McGowan, L. M., Kague, E., Vorster, A., Newham, E., Cross, S., Hammond, C. L. Wnt16 elicits a protective effect against fractures and supports bone repair in zebrafish. JBMR Plus. 5 (3), 10461 (2021).
- Sehring, I., Weidinger, G. Zebrafish fin: Complex molecular interactions and cellular mechanisms guiding regeneration. Cold Spring Harbor Perspectives in Biology. 14 (7), 040758 (2022).
- Bergen, D. J. M., Kague, E., Hammond, C. L. Zebrafish as an emerging model for osteoporosis: a primary testing platform for screening new osteo-active compounds. Frontiers in Endocrinology. 10 (6), (2019).
- Aman, A. J., Fulbright, A. N., Parichy, D. M. Wnt/β-catenin regulates an ancient signaling network during zebrafish scale development. Elife. 7, 37001 (2018).
- Iwasaki, M., Kuroda, J., Kawakami, K., Wada, H. Epidermal regulation of bone morphogenesis through the development and regeneration of osteoblasts in the zebrafish scale. Developmental Biology. 437 (2), 105-119 (2018).
- Metz, J. R., de Vrieze, E., Lock, E. J., Schulten, I. E., Flik, G. Elasmoid scales of fishes as model in biomedical bone research. Journal of Applied Ichthyology. 28 (3), 382-387 (2012).
- Cox, B. D., De Simone, A., Tornini, V. A., Singh, S. P., Di Talia, S., Poss, K. D. In toto imaging of dynamic osteoblast behaviors in regenerating skeletal bone. Current Biology. 28 (24), 3937-3947 (2018).
- Tonelli, F., et al. Zebrafish: A resourceful vertebrate model to investigate skeletal disorders,". Frontiers in Endocrinology. 11, (2020).
- de Vrieze, E., Zethof, J., Schulte-Merker, S., Flik, G., Metz, J. R. Identification of novel osteogenic compounds by an ex-vivo sp7: Luciferase zebrafish scale assay. Bone. 74, 106-113 (2015).
- De Vrieze, E., Moren, M., Metz, J. R., Flik, G., Lie, K. K. Arachidonic acid enhances turnover of the dermal skeleton: Studies on zebrafish scales. PLoS One. 9 (2), 89347 (2014).
- Bergen, D. J. M., et al. Regenerating zebrafish scales express a subset of evolutionary conserved genes involved in human skeletal disease. BMC Biology. 20 (1), 21 (2022).
- Bergen, D. J. M., et al. High bone mass disorders: New insights from connecting the clinic and the bench. Journal of Bone and Mineral Research. , (2022).
- Pasqualetti, S., Banfi, G., Mariotti, M. Osteoblast and osteoclast behavior in zebrafish cultured scales. Cell and Tissue Research. 350 (1), 69-75 (2012).
- Singh, S. P., Holdway, J. E., Poss, K. D. Regeneration of amputated zebrafish fin rays from de novo osteoblasts. Developmental Cell. 22 (4), 879-886 (2012).
- Ethiraj, L. P., Fong, E. L. S., Liu, R., Chan, M., Winkler, C., Carney, T. J. Colorimetric and fluorescent TRAP assays for visualising and quantifying fish osteoclast activity. European Journal of Histochemistry. 66 (2), 3369 (2022).
- DeLaurier, A., et al. Zebrafish sp7:EGFP: a transgenic for studying otic vesicle formation, skeletogenesis, and bone regeneration. Genesis. 48 (8), 505 (2010).
- Carnovali, M., Banfi, G., Mariotti, M. Age-dependent modulation of bone metabolism in zebrafish scales as new model of male osteoporosis in lower vertebrates. Geroscience. 43 (2), 927-940 (2021).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유