살아있는 효모 세포에서 미토콘드리아 과산화물을 위한 비율계량 바이오센서인 mtHyPer7의 이미징
요약
과산화수소 (H 2 O2)는 산화 손상의 원인이자 신호 분자입니다. 이 프로토콜은 살아있는 효모에서 유전적으로 인코딩된 비율계량 바이오센서인 미토콘드리아 표적 HyPer7(mtHyPer7)을 사용하여 미토콘드리아H2O2를 측정하는 방법을 설명합니다. 무료로 제공되는 소프트웨어를 사용하여 이미징 조건을 최적화하고 정량적 세포 및 세포 내 분석을 수행하는 방법을 자세히 설명합니다.
초록
미토콘드리아 기능 장애 또는 기능 변화는 신경 퇴행성 및 근골격계 질환, 암 및 정상적인 노화를 포함한 많은 질병과 상태에서 발견됩니다. 여기에서, 유전적으로 인코딩된, 최소 침습적, 비율계량 바이오센서를 사용하여 세포 및 세포 내 해상도에서 살아있는 효모 세포의 미토콘드리아 기능을 평가하는 접근법을 설명합니다. 바이오센서인 미토콘드리아 표적 HyPer7(mtHyPer7)은 미토콘드리아에서 과산화수소(H2O2)를 검출합니다. 이는 원형으로 치환된 형광 단백질에 융합된 미토콘드리아 신호 서열과 박테리아 OxyR 단백질의H2O2-반응 도메인으로 구성됩니다. 바이오센서는 플라스미드 기반 구조에 비해 더 일관된 발현을 위해 CRISPR-Cas9 마커가 없는 시스템을 사용하여 생성되고 효모 게놈에 통합됩니다.
mtHyPer7은 미토콘드리아를 정량적으로 표적으로 하고, 효모 성장률이나 미토콘드리아 형태에 검출할 수 있는 영향을 미치지 않으며, 정상적인 성장 조건 및 산화 스트레스에 노출될 때 미토콘드리아H 2 O2에 대한 정량적 판독값을 제공합니다. 이 프로토콜은 스피닝 디스크 컨포칼 현미경 시스템을 사용하여 이미징 조건을 최적화하고 무료로 제공되는 소프트웨어를 사용하여 정량 분석을 수행하는 방법을 설명합니다. 이러한 도구를 사용하면 세포 내 및 집단 내 세포 간 모두에서 미토콘드리아에 대한 풍부한 시공간 정보를 수집할 수 있습니다. 또한, 여기에 설명된 워크플로우는 다른 바이오센서를 검증하는 데 사용할 수 있습니다.
서문
미토콘드리아는 산화적 인산화와 전자 수송을 통해 ATP를 생성하는 기능으로 잘 알려진 필수 진핵 세포 소기관이다1. 또한 미토콘드리아는 칼슘 저장, 지질, 아미노산, 지방산 및 철-황 클러스터의 합성, 신호 전달 2,3을 위한 장소입니다. 세포 내에서 미토콘드리아는 세포 유형과 대사 상태에 따라 달라지는 특징적인 형태와 분포를 가진 동적 네트워크를 형성합니다. 또한 미토콘드리아는 융합하고 분열할 수 있지만 세포 내의 모든 미토콘드리아가 동일한 것은 아닙니다. 수많은 연구에서 막 전위 및 산화 상태 4,5,6과 같은 속성에서 개별 세포 내에서 미토콘드리아의 기능적 이질성을 문서화했습니다. 이러한 미토콘드리아 기능의 변화는 부분적으로 mtDNA 돌연변이(핵 DNA보다 더 빠른 비율로 발생)로 인한 세포 소기관의 손상과 세포 기관 내부 및 외부에서 생성된 활성 산소 종(ROS)에 의한 산화 손상에 기인합니다 7,8,9. 세포소기관의 손상은 손상을 복구하거나 수리할 수 없을 정도로 손상된 미토콘드리아를 제거하는 미토콘드리아 품질 관리 메커니즘에 의해 완화됩니다10.
과산화수소(H2O2)는 세포 단백질, 핵산 및 지질에 대한 산화적 손상의 원인인 활성 산소종입니다. 그러나,H2O2는 표적 단백질(11,12)에서 티올의 가역적 산화를 통해 세포 활동을 조절하는 신호 분자로서도 작용한다. H2 O2 는 미토콘드리아 전자 수송 사슬에서 누출되는 전자와 NADPH 산화 효소 및 모노 아민 산화 효소 13,14,15,16,17,18,19,20과 같은 특정 효소에 의해 생성됩니다. 또한 티오레독신과 글루타티온21,22,23을 기반으로 하는 항산화 시스템에 의해 비활성화됩니다. 따라서 미토콘드리아 H2O2 수준의 분석은 정상적인 미토콘드리아 및 세포 기능과 산화 스트레스 조건에서이 대사 산물의 역할을 이해하는 데 중요합니다.
이 프로토콜의 전반적인 목표는 세포 기관(mtHyPer7)을 표적으로 하는 유전적으로 인코딩된 비율계량 H2O2 바이오센서인 HyPer7을 사용하여 미토콘드리아H2O2를 검출하는 것입니다. mtHyPer7은 녹색 형광 단백질(GFP)의 원형 치환 형태인 ATP9의 미토콘드리아 신호 서열(Su9 전서열)과 Neisseria meningitidis24의 OxyR 단백질의 H 2 O2결합 도메인으로 구성된 키메라입니다(그림 1). 원형으로 치환된 GFP에서는, 본래 GFP의 N- 그리고 C 말단은 융합되고 새로운 말단은 본래 GFP25와 비교된 그것의 괴기한 특성의 단백질 그리고 더 중대한 lability에 단백질에 더 중대한 기동성을 나누어 주는 발색단의 가까이에 형성됩니다. mtHyPer7의 OxyR 도메인과 H2O2의 상호 작용은 친화성이 높고H2O2선택적이며보존된 시스테인 잔기 및 이황화물 브리지 형성의 가역적 산화를 유도합니다. OxyR의 산화와 관련된 구조적 변화는 mtHyPer7에서 원형으로 치환된 GFP로 전달되며, 이는 환원 상태의 405nm에서H2O2-산화 상태(26)의 488nm로 mtHyPer7 발색단의 최대 여기의 스펙트럼 이동을 초래한다. 따라서 488nm 대 405nm에서 여기(excitation)에 대한 반응으로 mtHyPer7로부터의 형광 비율은H2O2에 의한 프로브의 산화를 반영합니다.
이상적으로, 바이오센서는 표적 분자에 대한 실시간, 절대적, 정량적 판독값을 제공해야 합니다. 그러나 불행히도 실제 측정에서 이것이 항상 가능한 것은 아닙니다. mtHyPer7과 같은 산화 센서의 경우 실시간 판독값은 이황화 브리지의 감소 속도에 영향을 받습니다. ROS 바이오센서에 의해 사용되는 환원 시스템은 서로 다르며, 이는 티오레독신 시스템에 의해 환원된 HyPer7과 효모 세포질27의 글루타티온에 의해 환원된 roGFP2-Tsa2ΔCR의 비교에서 볼 수 있듯이 프로브 반응 역학을 극적으로 변화시킬 수 있습니다. 따라서 mtHyPer7 비율로부터 상대적인H2O2농도에 대한 결론을 도출하려면 환원 시스템이 실험 중에 일정한 용량을 유지한다고 가정해야 합니다. 이러한 고려사항에도 불구하고, HyPer7 및 관련 프로브는 살아있는 세포(25,28,29)에서H2O2에 관한 정보를 획득하기 위해 다양한 맥락에서 사용되어 왔다.
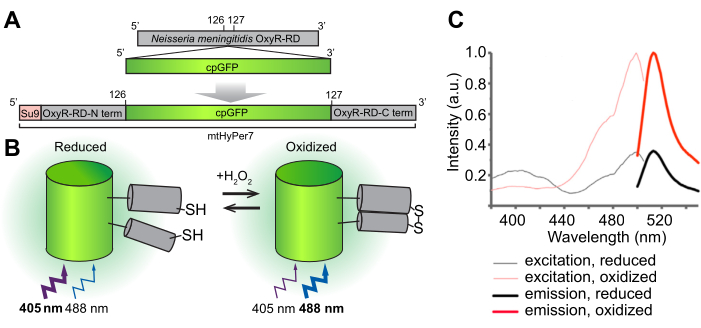
그림 1: H 2 O2바이오센서 mtHyPer7의 설계, 분자 메커니즘 및 여기/방출 스펙트럼. (A) mtHyPer7 프로브는 Neisseria meningitidis의 OxyR-RD 도메인에 원형 치환된 GFP를 삽입하여 유도됩니다. 그것은 Neurospora crassa (Su9)의 ATP synthase의 subunit 9에서 미토콘드리아 표적화 서열을 포함합니다. (B) mtHyPer7의H2O2-감지 메커니즘의 그림. RD 영역에서 시스테인이 산화되면 488nm에서 여기(excitation) 시 형광 방출이 증가하고 405nm에서 여기(excitation)에 의해 생성된 방출이 감소합니다. (C) 산화 및 환원 형태의 HyPer7의 여기 및 방출 스펙트럼. 이 그림은 Pak et al.24의 허가를 받아 재인쇄되었습니다. 약어: GFP = 녹색 형광 단백질; cpGFP = 원형으로 치환된 GFP. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
mtHyPer7의 이러한 비율계량 이미징은 미토콘드리아H2O2정량 분석에 중요한 이점을 제공합니다24,27; 프로브 집중을 위한 내부 제어를 제공합니다. 또한, H2O2 노광에 의해 생성된 여기 피크의 이동은 H2O2의 포화 농도에서도 완전하지 않다. 따라서 비율 이미징은 분석에 두 개의 스펙트럼 포인트를 통합하여 감도를 높일 수 있습니다.
여기에 사용된 mtHyPer7 프로브는H2O2에 대한 친화도가 매우 높고 pH24에 대한 민감도가 상대적으로 낮으며, 예쁜꼬마선충 미토콘드리아30을 성공적으로 표적으로 삼았습니다. 이 단백질은 효모27,31에도 사용되었습니다. 그러나 이전 연구에서는 mtHyPer7의 플라스미드 매개 발현에 의존했으며, 이로 인해 프로브 발현27에서 세포 간 변동성이 발생했습니다. 또한, 이 프로토콜에 기술된 구조체는 마커가 없는 통합을 위한 CRISPR 기반 접근법을 사용하여 염색체 X32의 보존된 유전자가 없는 영역에 통합되었습니다. 통합된 바이오센서 유전자의 발현은 또한 강력한 구성적 TEF1 프로모터에 의해 조절된다(그림 2). 결과적으로, 플라스미드-매개 바이오센서 발현을 사용하여 관찰된 것과 비교하여 효모 세포 집단에서 바이오센서의 보다 안정적이고 일관된 발현이 존재하며, 바이오센서를 지닌 세포는 선택적 배지를 필요로 하지 않고 증식될 수 있다.
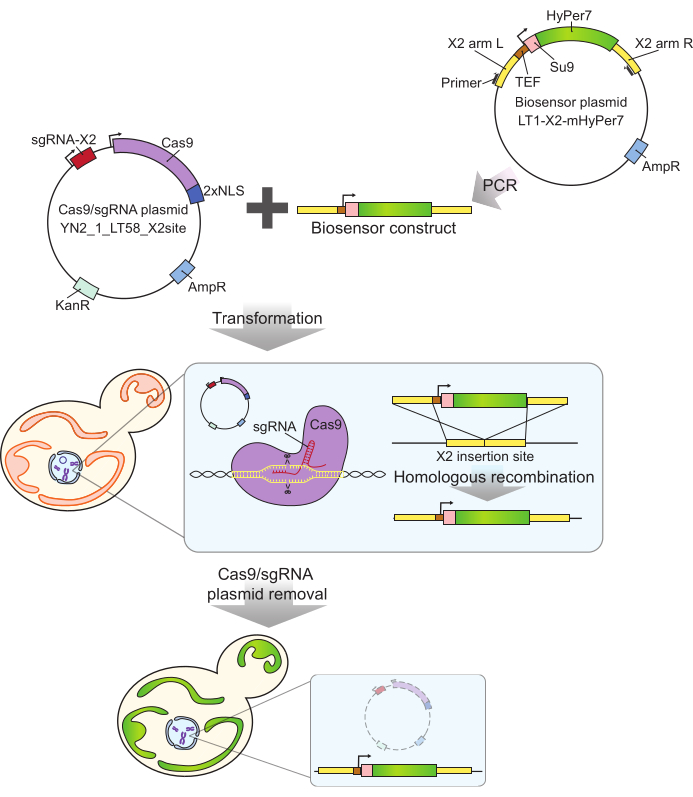
그림 2: CRISPR에 의한 mtHyPer7 발현 세포 생성. Cas9 및 sgRNA 함유 플라스미드(YN2_1_LT58_X2site) 및 PCR 증폭 mtHyPer7 함유 바이오센서 구조체는 리튬 아세테이트 형질전환에 의해 신생 효모 세포에 도입됩니다. 염색체 X(X2)의 유전자 없는 삽입 부위는 sgRNA와 Cas9 단백질에 의해 인식 및 절단되며, 바이오센서는 상동 재조합에 의해 게놈에 통합됩니다. 현미경 스크리닝, 콜로니 PCR 및 시퀀싱에 의해 성공적인 형질전환체를 확인한 후, Cas9 플라스미드는 비선택적 배지에서의 성장에 의해 제거(경화)됩니다. 약어: sgRNA = 단일 가이드 RNA; TEF = 전사 인핸서 인자. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
마지막으로, mtHyPer7은 다른 ROS 바이오센서에 비해 장점이 있습니다. 예를 들어, ROS를 검출하는 데 사용되는 유기 염료(예: 디하이드로에티듐[DHE]2 및 MitoSOX3)는 불균일하거나 비특이적인 염색을 생성할 수 있으며 종종 에탄올 또는 디메틸 설폭사이드와 같은 용매로 전달되므로 용매 효과에 대한 추가 제어가 필요합니다. ROS 바이오센서의 또 다른 부류는 형광 공명 에너지 전달(FRET) 기반 바이오센서(예를 들어, 세포 산화 환원 상태4에 대한 산화 환원 플루오르, 및 과산화물 센서 HSP-FRET5, OxyFRET 6 및 PerFRET6)이다. 이 프로브는 유전적으로 암호화되고 원칙적으로 매우 민감하며 잘 특성화된 미토콘드리아 신호 서열을 사용하여 미토콘드리아를 정량적으로 표적화할 수 있습니다. 그러나 교차 여기(cross-excitation) 및 블리드 스루(bleed-through)로 인한 배경과 FRET가 발생하기 위한 형광단의 근접성 및 방향에 대한 엄격한 요구 사항을 포함하여 FRET 기반 프로브를 사용하는 데 어려움이 있습니다33,34. 또한 FRET 프로브는 스펙트럼 이동 프로브에 비해 관심 세포에서 발현하기 위해 더 큰 구조가 필요한 두 개의 형광 단백질로 구성됩니다. 여기에 설명된 프로토콜은 HyPer7 기반 바이오센서의 강점을 활용하고, 살아있는 효모의 미토콘드리아에서 과산화물의 정량적 이미징을 위해 이 컴팩트하고 비율계량적이며 친화성이 높은 유전자 인코딩 프로브를 사용하기 위해 개발되었습니다.
프로토콜
1. 바이오센서 플라스미드 생성, 효모 게놈으로의 통합, 미토콘드리아에 대한 mtHyPer7의 표적화 및 미토콘드리아 형태, 세포 성장률 또는 산화 스트레스 민감도에 대한 영향 평가
NOTE: 바이오센서 구축 및 특성화에 사용되는 바이오센서 플라스미드 구축, 균주, 플라스미드 및 프라이머에 대해서는 보충 파일 1, 보충 표 S1, 보충 표 S2 및 보충 표 S3 을 각각 참조하십시오. 이 프로토콜에 사용되는 모든 재료, 시약 및 기기와 관련된 자세한 내용은 재료 표를 참조하십시오.
- 중합효소연쇄반응(polymerase chain reaction, PCR)을 통해 프라이머 Y290 및 Y291(그림 2)을 사용하여 바이오센서 플라스미드로부터 바이오센서 구조체를 증폭합니다.
- Cas9/guide RNA 플라스미드 500ng(YN2_1_LT58_X2site32)를 1.1단계(바이오센서 구성물)의 PCR 산물 50μL와 혼합합니다. 리튬 아세테이트 방법35 를 사용하여 혼합물을 신진 효모로 형질전환시키고 200mg/mL G418을 함유하는 YPD 플레이트 상의 형질전환체를 선택한다.
- 프라이머 Y292 및 Y293을 사용하여 게놈 DNA의 PCR 증폭에 의한 후보 형질전환체를 스크리닝합니다. 예상 크기(양수: 3.5kb, 음수: 0.3kb)의 삽입물을 갖는 형질전환체의 경우, 추가 검증을 위해 삽입된 영역을 시퀀싱한다.
- 성장 및 미토콘드리아 기능에 대한 바이오센서의 효과를 평가합니다(그림 3). 바이오센서가 세포 또는 미토콘드리아의 기능에 영향을 미치는 것으로 보이면 프로모터, 통합 부위 또는 모체 균주를 변경하여 영향을 최소화하십시오.
- 앞서 설명한 바와 같이, 산화 스트레스 요인(예를 들어, 파라콰트)의 존재 및 부재 하에서 성장율에 대한 바이오센서 구조체의 효과를 결정한다36.
- 중간 로그 위상 셀을 처리 유무에 관계없이 200μL의 해당 매체에서 0.0035의 600nm 광학 밀도(OD600)로 96웰 평면 바닥 플레이트의 각 웰에 희석합니다. 플레이트 리더를 사용하여 72시간 동안 20분마다 배양액의 광학 밀도를 측정합니다. 240시간 과정 동안 72분 간격으로 최대 성장률(기울기)을 OD의 최대 변화로 계산합니다.
- 형광 현미경으로 세포를 시각화하고 앞에서 설명한 대로 밝기와 미토콘드리아 형태를 평가합니다37.
- 세포를 중간 로그 단계까지 성장시키고 250nM MitoTracker Red로 30분 동안 미토콘드리아를 염색한 후 이미징 전에 두 번 세척합니다. 광시야 또는 컨포칼 형광 현미경에서 0.3μm 간격으로 6μm 깊이의 Z 스택을 캡처하고 육안으로 검사할 수 있습니다. 길쭉한 관 구조를 형성하는 미토콘드리아를 찾으십시오.
- 앞서 설명한 바와 같이, 산화 스트레스 요인(예를 들어, 파라콰트)의 존재 및 부재 하에서 성장율에 대한 바이오센서 구조체의 효과를 결정한다36.
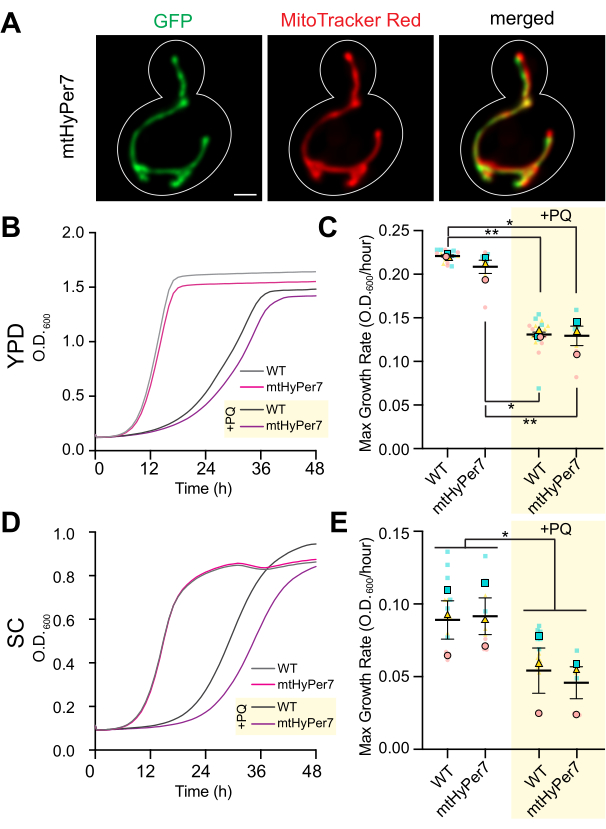
그림 3: mtHyPer7은 미토콘드리아를 표적으로 하며 미토콘드리아 형태, 세포 성장 또는 산화 스트레스에 대한 민감도에 영향을 미치지 않습니다. (A) mtHyPer7을 발현하는 살아있는 효모 세포의 미토콘드리아 형태. 왼쪽 패널: 488nm 여기로 시각화된 mtHyPer7. 중간 패널: 250nM MitoTracker Red로 라벨링된 미토콘드리아. 오른쪽 패널: 병합된 이미지. 최대 강도 투영이 표시됩니다. 셀 윤곽선은 흰색으로 표시됩니다. 척도 막대 = 1μm. (B,C) YPD 배지에서 2.5mM 파라콰트의 존재(+PQ) 또는 부재 하에서 성장한 mtHyPer7을 발현하는 야생형 세포 및 세포의 성장 곡선 및 최대 성장률. (디,이) SC 배지에서 2.5mM 파라콰트의 존재(+PQ) 또는 부재 하에서 성장한 야생형 및 mtHyPer7 발현 세포의 성장 곡선 및 최대 성장률. 모든 성장 곡선은 세 번의 독립적인 반복실험의 평균입니다. 최대 성장률은 평균의 평균 ± 표준 오차(SEM)로 표시됩니다. 성장 곡선 분석은 중간 로그 상 세포를 200μL의 해당 배지에서 0.0035의 OD600으로 희석하여 96웰 평평한 바닥 플레이트의 각 웰에 수행했습니다. 배양의 OD는 플레이트 리더를 사용하여 72시간 동안 20분마다 측정되었습니다. 각 균주/조건을 삼중으로 도금하고 평균 성장률을 표시했습니다. 최대 성장률(기울기)은 72시간 동안 240분 간격으로 OD의 변화를 사용하여 계산되었습니다. 약어: WT = 와일드 타입; PQ = 파라콰트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
2. 이미징을 위한 세포 배양 및 준비(그림 4)
- 이미징을 위해 합성 배지의 세포를 중간 로그 단계로 전파합니다. 5mL 중간 로그 상 배양은 분석을 위해 4개 또는 5개의 슬라이드에 충분한 세포와 총 >100개의 발아 세포를 제공합니다.
- 실험 전날 아침에 효모 세포의 단일 콜로니가 있는 50mL 원뿔형 바닥 튜브에 5mL의 합성 완전(SC) 배지를 접종하여 액체 전배양을 준비합니다.
- 200 rpm 및 30 °C의 궤도 셰이커에서 6-8 시간 동안 배양 전 단계를 배양합니다. 중간 로그 단계에 있어야 하는 사전 배양의 OD 600을 측정합니다: ~0.5-1 × 107 cells/mL, OD600 ~0.1-0.3.
- 다음 날 이미징을 위해 사전 배양을 사용하여 중간 로그 단계 배양을 준비합니다. 하룻밤 성장 후 중간 로그 단계 배양에 필요한 사전 배양의 양을 계산합니다(8-16시간). 세포가 SC 배지에서 성장할 때 배증 시간은 ~2시간입니다. 따라서, 5mL 야간 배양액의 접종을 위한 전배양의 부피(V)는 수학식 1을 사용하여 계산된다:
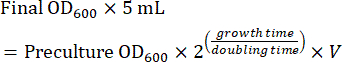 (1)
(1) - 50mL 원뿔형 바닥 튜브에 5mL의 SC 배지를 2.1.3단계에서 계산된 전배양량으로 접종합니다. 200rpm 및 30°C의 오비탈 셰이커에서 8-16시간 동안 성장합니다.
- 이미징 당일, 2.1.4단계에서 생성된 배양액이 중간 로그 단계(OD600 ~0.1-0.3)에 있는지 확인합니다. 6,000× g 에서 30초 동안 원심분리하여 중간 로그 상 배양 1mL의 세포를 농축합니다. 튜브에 10-20μL의 상층액을 남기고 상층액을 제거합니다. 마이크로피펫을 사용하여 잔류 배지와 부드럽게 혼합하여 세포 펠릿을 재현탁시킵니다.
- 송풍기 또는 보푸라기가 없는 티슈를 사용하여 유리 현미경 슬라이드에서 먼지를 제거하고 슬라이드에 세포 현탁액 1.8μL를 추가합니다. #1.5(170μm 두께)의 유리 커버슬립으로 셀을 덮고 기포가 유입되지 않도록 커버슬립을 비스듬히 천천히 내립니다.
- 즉시 이미지를 생성하고 이미징 후 10분 후에 슬라이드를 폐기합니다.
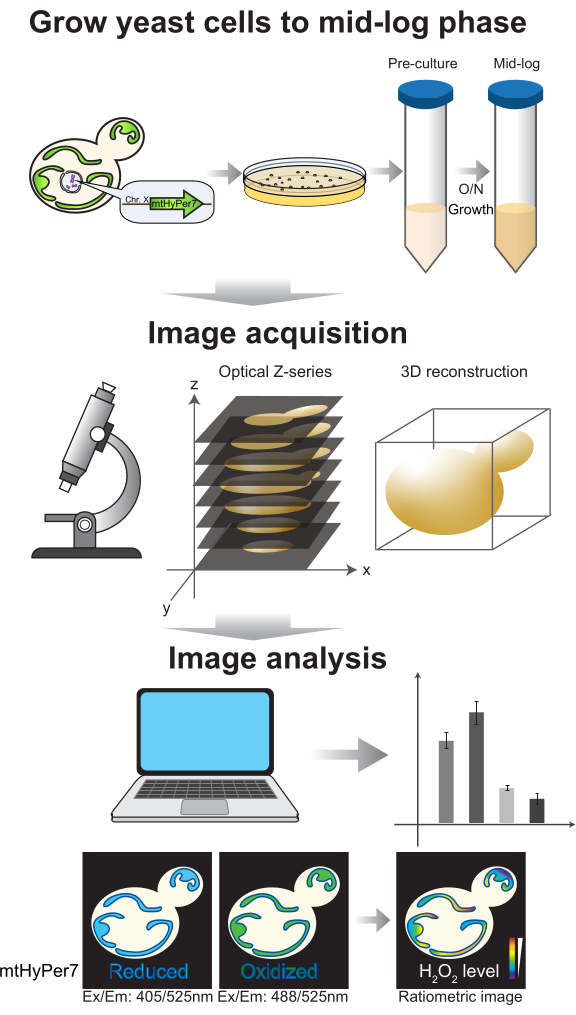
그림 4: 세포 성장 및 이미징. mtHyPer7을 발현하는 신진 효모 세포는 중간 로그 단계까지 성장합니다. Z 시리즈 이미지는 스피닝 디스크 컨포칼 현미경으로 수집된 다음 3D 재구성 및 분석을 거칩니다. 프로토콜 섹션 2-3을 참조하십시오. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 이미징 조건 및 이미지 수집 최적화(그림 5)
- 이미징 모드를 선택합니다. 후처리 없이 광학 절편을 하려면 스피닝 디스크 컨포칼 기기가 선호됩니다. 그러나 신호가 낮거나 이 기기를 사용할 수 없는 경우 광시야 이미징을 사용하여 광시야 이미지가 디콘볼루션되어 초점이 맞지 않는 흐림을 제거하도록 합니다(38).
- 옵틱을 선택합니다. 100x/1.45 Plan-Apochromat와 같은 높은 개구수 오일 이멀젼 렌즈를 사용하십시오.
- 여기 및 방출 파장을 선택합니다. 스피닝 디스크 컨포칼 이미징의 경우 405nm 및 488nm의 레이저 여기와 표준 GFP 방출 필터를 사용합니다. 광시야 이미징의 경우 발광 다이오드(LED) 또는 램프 구동을 사용하되, 필터 설정이 표준 GFP 필터를 통해 방출을 통과시키면서 구동의 변화를 허용하는지 확인하십시오.
알림: 예를 들어 GFP 큐브에서 여기 필터를 제거하고 LED 또는 필터 휠을 사용하여 여기를 선택하여 수행할 수 있습니다. - 노출 시간과 조명 강도를 선택합니다.
- 각 형광 채널에서 쉽게 검출할 수 있는 신호와 허용 가능한 분해능을 생성하는 획득 조건을 설정합니다. 예를 들어, sCMOS 카메라가 장착된 스피닝 디스크 컨포칼 현미경에서는 2 x 2 비닝, 20-40% 레이저 출력, 200-600ms 노출을 사용합니다.
- 영상 히스토그램을 검토합니다. 12비트 이미지(4,096개의 가능한 회색 레벨)에서 픽셀 값의 총 동적 범위는 채도 없이 최소 수백 개의 회색 레벨이어야 합니다(그림 5A). 또한 범위가 소음 수준보다 한 자릿수 높은지 확인하십시오. 4.1.3.1단계에서 설명한 대로 측정된 이미지의 셀이 없는 영역에서 픽셀 값의 표준 편차로 노이즈 수준을 계산합니다.
- 선택한 이미징 조건에서 광표백 또는 이미징 유도 미토콘드리아 스트레스를 테스트합니다. 과도한 광표백 또는 미토콘드리아H2O2의 증가가 관찰되면 레이저 출력을 줄이고 노출 또는 비닝을 증가시키십시오.
- 획득 간 지연 없이 타임랩스 일련의 이미지를 수집하여 이미징 조건이 미토콘드리아의 신호 안정성과 산화 스트레스에 미치는 영향을 평가합니다. 현미경 획득 소프트웨어 또는 ImageJ를 사용하여 각 형광 채널의 평균 픽셀 값을 측정하여 신호 안정성(<5% 변화; 그림 5B). 실험에 타임랩스 이미징이 포함되지 않은 경우 형광이 2-3회 반복되는 Z 스택(25-35 노출)에서 안정적인지 확인하십시오.
알림: 두 채널의 형광 감소는 광표백을 나타낼 수 있습니다. 그러나, 488nm-여기 채널의 증가를 동반한 405nm-여기 형광의 감소는 세포 기관에서 미토콘드리아H2O2및 이미징 유도 산화 스트레스의 증가를 나타낼 수 있다.
- 획득 간 지연 없이 타임랩스 일련의 이미지를 수집하여 이미징 조건이 미토콘드리아의 신호 안정성과 산화 스트레스에 미치는 영향을 평가합니다. 현미경 획득 소프트웨어 또는 ImageJ를 사용하여 각 형광 채널의 평균 픽셀 값을 측정하여 신호 안정성(<5% 변화; 그림 5B). 실험에 타임랩스 이미징이 포함되지 않은 경우 형광이 2-3회 반복되는 Z 스택(25-35 노출)에서 안정적인지 확인하십시오.
- 이미지를 획득합니다. Z 스택을 수집하는 경우 데이터 세트의 모든 이미지에 대해 Z 간격이 동일한지 확인하고 전체 셀을 포함합니다. 신생 효모의 경우 Z 간격 이 0.5μm 이고 총 스택 깊이 가 6μm인 이미지입니다. 투과광 이미지를 획득하여 셀 경계를 문서화할 수 있습니다.
- ImageJ39의 Fiji 배포판과 통계 소프트웨어 R을 사용하여 보충 파일 2 및 https://github.com/theresaswayne/biosensor 에서 사용할 수 있는 스크립트를 통해 수동 또는 반자동으로 이미지를 분석합니다(그림 6). 소프트웨어 지침에서 계층적 메뉴 명령은 굵은 글씨체로 "|"로 표시되며, 이는 메뉴 선택 시퀀스를 나타냅니다. 옵션과 버튼은 굵은 글씨체로 표시됩니다.
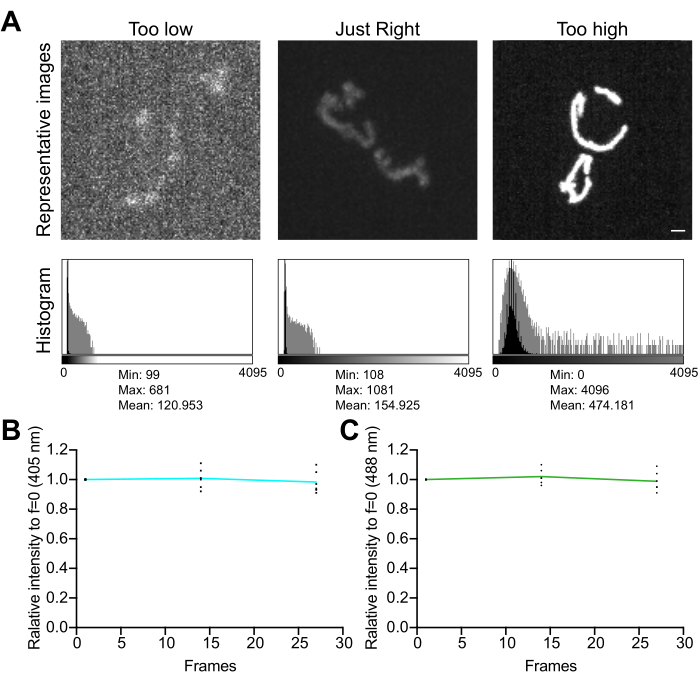
그림 5: 이미징 최적화 . (A) 정확한 강도 범위에 대한 이미지 및 히스토그램 평가. 스피닝 디스크 컨포칼 이미지의 최대 강도 투영이 표시됩니다. 히스토그램은 선형 Y축(검은색)과 로그 스케일 Y축(회색)으로 표시되어 이미지 동적 범위를 보여줍니다. 왼쪽 패널: 낮은 강도와 동적 범위의 노이즈가 있는 이미지입니다. 중앙 패널: 허용 가능한 동적 범위(~1,000 회색 레벨)와 강도가 있는 이미지입니다. 오른쪽 패널: 과도한 채도를 생성하기 위해 대비가 부적절하게 강화된 이미지입니다. 눈금 막대 = 1 μm. (B,C) mtHyPer7의 광표백 분석. 연속적인 Z 스택을 지연 없이 수집하고, Z 스택을 합산하고, 미토콘드리아의 평균 강도를 측정하여 첫 번째 시점으로 정규화했습니다. 처음 3개 시점(27개 노출)의 결과가 표시됩니다. (B) 여기 파장: 405nm. (C) 여기 파장 : 488 nm. 표시된 값은 3개의 독립적인 시행 각각에서 얻은 3개 세포의 평균입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. 스크립트를 사용한 반자동 분석
- 바이오센서 분석 스크립트(예: biosensor.ijm 또는 biosensor-image-subtraction.ijm)를 사용하여 비율 이미지를 생성하고 측정합니다.
- 사용할 스크립트를 선택합니다. 각 스크립트를 사용하는 프로토콜은 비슷합니다. 모든 차이점은 텍스트에 지정됩니다.
- biosensor.ijm: 이 스크립트에서 배경 및 노이즈는 사용자가 선택한 이미지 영역, 고정 값 또는 빼기 없음을 사용하여 수정됩니다. 배경 및 노이즈 보정 방법을 독립적으로 선택합니다.
- biosensor-image-subtraction.ijm: 이 스크립트에서 배경과 노이즈는 모두 동일한 사용자 선택 방법으로 처리되며, 빈 이미지, 이미지 내 사용자 선택 영역, 고정 값 또는 수정 없음 중 하나일 수 있습니다.
- 피지에서 3.5단계에서 획득한 다중 채널 Z 스택 이미지를 엽니다. 원하는 바이오센서 분석 스크립트 파일을 엽니다. 스크립트 편집기 창에서 실행을 클릭하여 스크립트를 실행합니다. 대화상자 창이 나타나면 요청된 정보를 입력합니다.
- 비율 계산을 위해 분자와 분모의 채널 번호를 선택합니다. mtHyPer7의 경우 분자는 488nm에서 여기된 채널이고 분모는 405nm에서 여기된 채널입니다. 투과광 이미지의 채널 번호(있는 경우)를 선택하고, 없는 경우 0을 선택합니다.
- 다음 네 가지 옵션 중에서 원하는 배경 빼기 방법을 선택합니다. 배경이 비교적 균일한 경우 이미지의 배경 레벨을 직접 측정하는 이미지 영역 선택을 선택합니다. 배경이 필드에 따라 크게 다른 경우 biosensor-image-subtraction.ijm 스크립트를 사용하고 빈 이미지를 선택합니다(보정을 위해 빈 이미지를 수집하려면 cell-free 시야 또는 cell-free 성장 배지로 만든 슬라이드에서 동일한 획득 조건으로 다중 채널 Z 스택을 캡처). 고정 값을 사용하면 이전에 측정된 배경 값을 입력할 수 있습니다. None 은 배경을 수정하지 않고 그대로 두지만 측정의 정밀도를 떨어뜨릴 수 있습니다.
- 원하는 노이즈 제거 방법을 선택합니다. 노이즈 값은 검출기 판독값에서 무작위 변동의 영향을 줄이기 위해 배경에서 빼고 마스킹된 채널 이미지에서 더 낮은 임계값으로 사용됩니다. 이전에 측정한 노이즈 수준을 입력할 수 있도록 이미지 영역 선택 또는 고정 값을 선택하면 이미징 조건이 일정하게 유지되는 경우 노이즈 수준이 일정하므로 일반적으로 잘 작동합니다. 또는 없음 을 선택하고 값 1을 하한 임계값으로 사용하면 측정값의 변동성이 증가할 수 있습니다.
- 미토콘드리아를 정확하고 일관되게 검출하기 위한 임계값 알고리즘을 선택하십시오. Otsu 또는 MaxEntropy 를 사용하는 것이 좋습니다. 이상적으로는 실험의 모든 이미지에 동일한 알고리즘을 사용하되 미토콘드리아를 정확하게 인식해야 합니다. 실험 중에 형태에 변화가 있는 경우 다른 임계값 방법을 사용합니다.
- 셀당 관심 영역(ROI) 수를 선택합니다. 예를 들어, 모봉 차이를 측정하는 경우 2를 선택합니다.
- 측정값 및 비율 이미지를 저장할 출력 폴더를 선택합니다.
- 배경 및 노이즈 보정에 대한 프롬프트를 따릅니다.
- 영역 선택(해당하는 경우): 배경 또는 노이즈 측정을 위해 이미지 영역 선택을 선택한 경우 프롬프트에 따라 사각형 ROI 도구를 사용하여 배경 영역(셀 또는 형광 아티팩트 외부)을 그립니다. 영역을 그린 후 [확인]을 클릭합니다.
- 고정 값 입력(해당하는 경우): 배경 또는 노이즈 측정에 대해 고정 값을 선택한 경우 프롬프트에 따라 각 형광 채널에 대한 배경 및/또는 노이즈 값을 입력합니다.
- 빈 참조 이미지(해당하는 경우): biosensor-image-subtraction.ijm 스크립트에서 배경 또는 노이즈 보정을 위해 빈 이미지를 선택한 경우 프롬프트에 따라 빈 이미지 파일을 선택합니다.
- 측정을 위한 ROI를 표시합니다. 중간 로그 단계 배양에서는 분석을 발아 세포로 제한합니다.
- 명시야 이미지를 기반으로 개별 세포 또는 세포 내 영역에 해당하는 ROI를 도출합니다. ROI 내에서 임계값이 있는 미토콘드리아만 측정되므로 ROI가 세포 윤곽과 정확히 일치할 필요는 없습니다. 또는 이전에 저장한 ROI 세트를 열거나, ROI 매니저에서 자세히를 클릭한 다음 ROI 파일을 선택합니다.
- 각 ROI를 생성한 후 T 를 눌러 선택한 ROI를 ROI 매니저에 추가합니다. ROI 관리자에서 모두 표시 를 선택하여 표시된 셀을 문서화합니다. 추가된 각 영역은 ROI 관리자 목록에 번호가 매겨진 항목으로 표시됩니다. 셀당 두 개 이상의 ROI(예: 어미 및 새싹)를 분석하는 경우 분석된 각 셀에 대해 동일한 순서로 ROI를 표시합니다.
- 원하는 ROI를 모두 ROI Manager에 추가한 후 셀 표시 대화 상자 창에서 확인을 클릭합니다.
- 측정 테이블 형식을 선택합니다. 표시되는 MultiMeasure 대화 상자 창에서 Measure all slices(모든 슬라이스 측정)를 선택합니다. 슬라이스당 한 행 옵션을 선택하여 원하는 형식의 테이블을 생성합니다. process_multiROI_tables 사용하십시오. 조각당 한 행 옵션으로 만든 테이블을 처리하는 R 스크립트; Append Results(결과 추가)를 선택하지 마십시오. 이 단계를 3번 반복합니다(분자[488], 분모[405] 및 비율[488/405] 이미지 측정용).
- 스크립트는 4.1.2.6단계에서 선택한 폴더에 출력 파일을 저장합니다.
- 사용할 스크립트를 선택합니다. 각 스크립트를 사용하는 프로토콜은 비슷합니다. 모든 차이점은 텍스트에 지정됩니다.
- 각 영역 또는 셀에 대한 가중 평균 비율 계산
- 이전 단계에서 얻은 결과를 사용하여 방정식 (2)를 사용하여 각 영역 또는 셀에 대한 가중 평균 비율을 계산합니다. "pixelwise" 또는 "regionwise" 비율을 계산합니다(자세한 내용은 토론 참조).
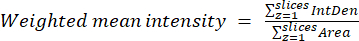 (2)
(2)
참고: 면적 및 통합 밀도(IntDen) 값에는 임계값이 있는 미토콘드리아 내의 픽셀만 포함됩니다. 이 계산은 process_multiROI_tables 사용하여 자동화할 수 있습니다. R 스크립트 및 R 통계 소프트웨어.
- 이전 단계에서 얻은 결과를 사용하여 방정식 (2)를 사용하여 각 영역 또는 셀에 대한 가중 평균 비율을 계산합니다. "pixelwise" 또는 "regionwise" 비율을 계산합니다(자세한 내용은 토론 참조).
- 채색된 비율 영상을 생성합니다. 색조(색상)의 변화는 강도의 변화보다 사람의 눈에 더 분명하므로 시각적으로 더 쉽게 해석할 수 있도록 비율 값을 색상 눈금으로 변환합니다. colorize_ratio_image.ijm 스크립트는 마스크된 비율 이미지를 채색합니다.
- 피지에서 4.1.6단계에서 생성된 비율 Z 스택 이미지를 엽니다. colorize_ratio_image.ijm 스크립트 파일을 엽니다. 스크립트 편집기 창에서 실행을 클릭하여 스크립트를 실행합니다. 대화상자 창이 나타나면 요청된 정보를 입력합니다.
- 채색 방법: 변조되지 않음 옵션에서는 모든 미토콘드리아 픽셀이 동일한 밝기로 나타납니다. 그러나 일부 이미지는 희미한 픽셀과 밝은 픽셀이 모두 비율 이미지에 기여하기 때문에 노이즈가 나타날 수 있습니다. 이 효과를 줄이려면 강도 변조 옵션을 사용합니다.
- 최소 및 최대 표시 값: 이 값은 색상이 지정될 비율 값의 범위를 제어합니다. 실험에서 관찰된 평균 최소값 및 최대값에 가까운 값을 선택합니다(4.2.1단계에서 계산된 가중 평균 비율 기준). 실험 내에서 동일한 이미징 조건으로 모든 이미지를 획득하고 동일한 최소값과 최대값을 가진 모든 이미지를 표시해야 합니다.
- 투영 모드: Z 스택은 전체 미토콘드리아 모집단을 표시하는 투영으로 표시됩니다. 투영은 채색하기 전에 만들어집니다. 최대 강도 투영(최대 비율 및 강도 값 유지)의 경우 Max(최대 )를 선택하고 평균 강도 투영의 경우 Average(평균 )를 선택합니다.
- 출력 폴더: 색상이 지정된 이미지를 저장할 폴더를 선택합니다.
- 변조되지 않음 옵션을 선택한 경우 색 구성표(룩업 테이블; LUT)가 나타납니다. 피지에 내장된 Fire 또는 Rainbow RGB LUT 또는 ImageJ의 .lut 형식(LUT 파일에서 가져오기)의 원하는 LUT를 사용합니다. Rainbow Smooth40 LUT를 사용하는 것이 좋습니다(보충 파일 2 및 GitHub에 포함됨).
- 스크립트는 4.3.1.4단계에서 선택한 폴더에 출력 파일을 저장합니다. 여기에는 색상화된 비율 이미지(Color_RGB.tif)와 비율 값과 이미지 색상(Color_with_bar.tif) 간의 대응을 보여주는 보정 막대가 있는 색상화된 비율 이미지가 포함됩니다.
- 피지에서 4.1.6단계에서 생성된 비율 Z 스택 이미지를 엽니다. colorize_ratio_image.ijm 스크립트 파일을 엽니다. 스크립트 편집기 창에서 실행을 클릭하여 스크립트를 실행합니다. 대화상자 창이 나타나면 요청된 정보를 입력합니다.
5. 수동 분석
참고: 이 접근 방식은 시간이 더 걸리지만 임계값을 전처리하고 설정하는 데 유연성을 허용합니다.
- 배경을 수정합니다.
- 피지에서 옵션을 설정합니다.
- Analyze( 분석) | 측정값을 설정합니다. 대화상자 창이 나타나면 Area, Mean, StdDev, IntDen, Display Label 체크박스를 선택합니다. 소수 자릿수를 3으로 설정합니다.
- Edit( 편집) | 옵션 | 입력/출력. 대화상자 창이 나타나면 Save row numbers(행 번호 저장) 및 Save column headers(열 머리글 저장) 체크박스를 선택합니다.
- 비율 계산의 민감도를 높이려면 각 형광 채널에서 배경을 뺍니다. 배경이 비교적 균일한 경우 이미지에서 셀이 없는 영역의 평균 강도를 측정하고 전체 이미지에서 이 값을 뺍니다(5.1.2.1단계). 또는 배경이 필드에 따라 크게 다른 경우 빈 이미지를 사용하여 수정합니다(5.1.2.2단계).
- 사용자가 선택한 영역을 빼 려면 이미지 | 색상 | 채널을 분할하고 나중에 필요하므로 모든 채널 이미지를 열어 둡니다. 각 형광 채널에 대해 배경(세포 외부)에 ROI를 그리고 Analyze | 측정 또는 스택의 경우 이미지 | 스택 | 스택 측정. 결과 테이블에 나타나는 ROI의 평균값을 관찰합니다. Edit( 편집) | None(없음)을 선택한 다음 Process(프로세스) | 수학 | 빼기. 대화상자 창이 나타나면 측정된 평균 배경 값을 가장 가까운 정수로 반올림하여 입력합니다.
참고: 반올림은 나중에 이진 연산에서 오류를 방지합니다. - 데이터 파일에서 빈 이미지를 빼려면 셀이 전혀 없는 시야 또는 셀이 없는 성장 배지로 준비된 슬라이드에서 빈 이미지를 수집합니다. Process( 프로세스) | 이미지 계산기. 표시되는 대화 상자 창에서 작업을 빼기로 설정하고 Image1 및 Image2를 각각 셀 이미지와 빈 이미지로 설정합니다. Create New Window and 32-bit Result(새 창 및 32비트 결과 만들기)를 선택합니다.
- 사용자가 선택한 영역을 빼 려면 이미지 | 색상 | 채널을 분할하고 나중에 필요하므로 모든 채널 이미지를 열어 둡니다. 각 형광 채널에 대해 배경(세포 외부)에 ROI를 그리고 Analyze | 측정 또는 스택의 경우 이미지 | 스택 | 스택 측정. 결과 테이블에 나타나는 ROI의 평균값을 관찰합니다. Edit( 편집) | None(없음)을 선택한 다음 Process(프로세스) | 수학 | 빼기. 대화상자 창이 나타나면 측정된 평균 배경 값을 가장 가까운 정수로 반올림하여 입력합니다.
- 피지에서 옵션을 설정합니다.
- 분석을 미토콘드리아로 제한하려면 분할을 수행합니다. 각 채널은 바이오센서의 상태에 따라 강도가 변할 수 있기 때문에 두 채널의 합을 사용하여 미토콘드리아의 면적을 일관되게 정의합니다.
- 합계 이미지를 만들려면 프로세스 | 이미지 계산기. 표시되는 대화 상자 창에서 작업을 추가로 설정하고 Image1 및 Image2를 순서에 관계없이 두 개의 배경에서 뺀 형광 채널로 설정합니다. Create New Window and 32-bit Result(새 창 및 32비트 결과 생성)를 선택하고 합계 이미지가 나타날 때까지 기다립니다.
- 합계 이미지에서 미토콘드리아를 정의하기 위한 임계값을 설정합니다.
- 이미지 | 조정 | 임계값. 임계값 창이 나타나면 어두운 배경 및 스택 히스토그램을 선택합니다. 메서드를 원하는 알고리즘(예: Otsu 또는 MaxEntropy)으로 설정합니다. 재현성을 위해 자동 임계값을 사용하되 자동 방법이 적합하지 않은 경우 임계값을 수동으로 조정합니다.
참고: 이상적으로는 실험의 모든 이미지에 동일한 알고리즘을 사용해야 하지만 실험 중 형태가 변경되면 일부 조건에서 다른 임계값 방법이 필요할 수 있습니다. - 임계값이 만족스러우면 Apply(적용)를 클릭합니다. 대화 상자 창이 나타나면 [마스크로 변환]을 선택합니다. 대화상자 창이 나타나면 검은색 배경을 선택하고 다른 상자는 선택하지 않은 상태로 둡니다. 분할 정확도를 평가하기 위해 결과 마스크 영상을 저장합니다.
- 이미지 | 조정 | 임계값. 임계값 창이 나타나면 어두운 배경 및 스택 히스토그램을 선택합니다. 메서드를 원하는 알고리즘(예: Otsu 또는 MaxEntropy)으로 설정합니다. 재현성을 위해 자동 임계값을 사용하되 자동 방법이 적합하지 않은 경우 임계값을 수동으로 조정합니다.
- Process(프로세스) | 수학 | 나눗셈. 값을 255로 설정하고 메시지가 표시되면 모든 이미지를 처리하는 옵션을 선택합니다.
- Apply the mask to the background subtracted fluorescence channels by click on Process(배경에서 뺀 형광 채널에 마스크를 적용) | 이미지 계산기. 표시되는 대화 상자 창에서 작업을 곱하기로 설정합니다. Image1과 Image2를 각각 분자 채널과 마스크로 설정합니다. 새 창 만들기 및 32비트 결과 만들기를 확인하십시오. 분모 채널로 마스크 곱셈을 반복합니다.
- 배경 픽셀을 NaN ("not a number")으로 설정하여 비율 계산을 위해 마스크된 각 채널을 준비합니다.
- 마스크된 분자 채널을 선택하고 Image | 조정 | 임계값. 임계값 창에서 설정을 클릭하고 나타나는 대화상자 창에서 최소 값을 계산된 노이즈 수준 또는 1로 설정하고 최대값은 그대로 둡니다.
- Threshold( 임계값 ) 창에서 Apply(적용)를 클릭합니다. 다음 대화 상자에서 NaN으로 설정을 선택합니다. 마스킹된 분모 채널에 대해 반복합니다.
- 비율 영상을 생성합니다.
- Process(프로세스) | 이미지 계산기. 대화상자 창이 나타나면 operation을 Divide로 설정합니다. Image1과 Image2를 각각 배경에서 뺀 마스크 분자 채널과 분모 채널로 설정합니다. mtHyPer7의 경우 분자는 488nm에서 여기된 산화 형태이고 분모는 405nm에서 여기된 환원된 형태입니다. 따라서 비율이 높을수록 H 2 O2가 높음을 나타냅니다.
- Create New Window and 32-bit Result(새 창 및 32비트 결과 만들기)를 선택합니다. 분석을 위해 비율 이미지를 저장합니다.
- 관심 영역을 표시하고 정량화합니다. 각 세포 또는 세포 내 영역이 선택되어 ROI Manager에서 ROI로 저장됩니다. ROI는 마스킹된 미토콘드리아 영역만 측정되므로 세포 윤곽과 완벽하게 일치할 필요는 없습니다.
- 편향을 방지하기 위해 투과광 영상을 사용하여 개별 세포(또는 세포 내 영역)에 대응하는 ROI를 생성합니다. 중간 로그 단계 배양에서는 세포 분열에 활발하게 관여하는 새싹을 가진 효모 세포로 분석을 제한합니다. 각 ROI를 생성한 후 T 를 눌러 ROI 매니저에 추가합니다. 모두 표시 를 선택하여 표시된 셀을 문서화합니다.
- 위에서 만든 비율 이미지를 클릭하고 ROI Manager에서 More ... | MultiMeasure입니다. 대화 상자 창이 나타나면 Measure all slices(모든 슬라이스 측정)를 선택합니다. Append Results(결과 추가)를 선택하지 마십시오. 슬라이스당 한 행 옵션을 선택하여 원하는 형식의 테이블을 생성합니다. process_multiROI_tables. R 스크립트는 R 통계 소프트웨어에서 조각당 한 행 옵션을 사용하여 만든 테이블을 처리합니다.
- 결과를 저장합니다. Results(결과 ) 창을 클릭한 다음 File(파일) | 저장을 클릭하고 결과 테이블을 .csv 또는 .xls 형식으로 저장합니다. 이미지 이름과 일치하도록 파일 이름을 설정합니다.
- ROI를 절약합니다. ROI Manager에서 먼저 ROI가 선택되지 않았는지 확인하고 Deselect(선택 취소)를 클릭한 다음 More(더보기) | 저장을 클릭합니다. 저장된 ROI를 피지의 원본 영상과 함께 열어 측정값을 영상과 상호 참조합니다.
- 이전 단계와 방정식 (3)에서 얻은 결과를 사용하여 셀 또는 영역당 가중 평균 비율을 계산합니다. "pixelwise" 또는 "regionwise" 비율을 계산합니다(자세한 내용은 토론 참조).
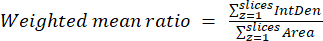 (3)
(3)
참고: 면적 및 통합 밀도 값에는 임계값이 적용된 미토콘드리아 내의 픽셀만 포함됩니다. 이 계산은 process_multiROI_tables 사용하여 자동화할 수 있습니다. R 통계 소프트웨어의 R 스크립트. - 채색된 비율 영상을 생성합니다.
참고: 컬러화된 이미지는 모든 미토콘드리아 픽셀이 동일한 밝기로 나타나는 비변조 또는 원본 이미지의 픽셀 강도를 사용하여 컬러 이미지의 강도를 설정하는 강도 변조가 가능합니다.- 변조되지 않은 컬러 이미지를 생성하려면:
- 위에서 생성된 비율 이미지를 엽니다. 이미지 | 복제 하여 이미지의 복사본을 생성한 다음 원본 이미지를 닫습니다.
- 이미지가 Z 스택인 경우 단일 슬라이스를 선택하거나 Z 투영을 생성하여 모든 미토콘드리아를 볼 수 있습니다. 최대 강도(각 XY 픽셀 좌표에서 최대 비율 및 강도 값 유지) 또는 평균 강도 투영을 사용합니다.
- 이미지 | 룩업 테이블을 클릭하고 LUT를 원하는 색 구성표(예: Rainbow RGB 또는 Fire[ImageJ에서 기본적으로 사용 가능])로 설정합니다. 또는 File(파일) | LUT를 가져오고 Rainbow Smooth40(추가 파일 2 및 GitHub에 포함)과 같은 ImageJ의 .lut 형식으로 원하는 LUT를 선택합니다. LUT의 0 값에 어두운 색이 할당되어 있는지 확인합니다.
- Image(이미지) | 조정 | 밝기/대비. 밝기/대비(Brightness/Contrast) 창에서 설정(Set)을 클릭하고 대화상자 창이 나타나면 최소(Minimum) 및 최대(Maximum) 표시 값에 원하는 값을 입력합니다. 관찰된 색상 차이를 최대화하려면 이 값을 모든 이미지에서 얻은 대략적인 최소값 및 최대값으로 설정합니다. 실험의 모든 이미지를 동일한 대비 수준으로 설정합니다.
참고: Apply(적용)를 클릭하면 픽셀 값이 변경되고 다음 단계에서 정확한 보정 막대가 생성되지 않으므로 클릭하지 마십시오. - Analyze(분석) | 툴 | 캘리브레이션 바. 표시되는 대화 상자 창에서 오버레이 옵션을 선택하고 원하는 경우 Image | 오버레이 | 오버레이 제거를 클릭합니다.
- 원하는 경우 Analyze(분석) | 툴 | 축척 막대. 대화상자 창이 나타나면 막대의 원하는 크기, 위치 및 색상을 설정합니다. 오버레이 옵션을 선택하여 사용된 LUT에 관계없이 막대의 색상을 유지합니다.
- 이미지를 클릭하여 게시할 RGB 이미지를 생성합니다. 오버레이 | 평평하게. 결과 이미지를 저장합니다.
참고: 이 이미지는 프레젠테이션 또는 출판용으로만 사용됩니다. 강도 값이 변경되므로 측정할 수 없습니다. 막대도 이미지에서 영구적으로 구워집니다.
- 강도 변조 이미지를 만들려면:
- 이미지 | 복제하여 이미지의 복사본을 생성한 다음 원본을 닫습니다.
- 이미지가 Z 스택인 경우 단일 슬라이스를 선택하거나 Z 투영을 생성하여 모든 미토콘드리아를 볼 수 있습니다.
- Image | 조정 | Brightness/Contrast(밝기/대비)를 클릭하고 Brightness/Contrast(밝기/대비) 창에서 Set(설정)을 클릭합니다. 대화상자 창이 나타나면 표시된 최소값 및 최대값에 원하는 값을 입력합니다. 관찰된 색상 차이를 최대화하려면 이를 모든 이미지에서 얻은 대략적인 최소값 및 최대값으로 설정하고 실험의 모든 이미지를 동일한 대비 수준으로 설정합니다. Apply(적용)를 클릭하여 픽셀 값의 크기를 조정합니다.
- 보정 막대를 만들려면 이 향상된 이미지를 복제하고 분석 | 툴 | 캘리브레이션 바. 이미지 및 오버레이를 클릭하여 RGB 형식으로 변환하십시오 . 오버레이 | 평평하게. 원하는 경우 프레젠테이션 또는 게시를 위해 5.6.2.12단계에서 얻은 강도 변조 RGB 이미지에 이 막대를 붙여넣습니다.
- File(파일) | 새로 만들기 | 이미지.... 대화 상자 창이 열리면 매개 변수를 다음과 같이 설정합니다. 유형: RGB; 채우기: 검정; 너비 및 높이: 9이미지의 너비 및 높이); 슬라이스: 1.
- Image(이미지) | 유형 | HSB 스택.
- Contrast-adjusted ratio(대비 조정 비율) 이미지를 클릭하여 Edit(편집) | All(모두)을 선택한 다음 Edit(편집) | 복사를 클릭합니다. 그런 다음 HSB 스택을 클릭하고 첫 번째 조각(색조)을 선택한 다음 편집 | 붙여 넣어 비율 값을 전송합니다.
- HSB 스택의 슬라이스 2(채도)를 선택합니다. Edit(편집) | 옵션 | 그림 물감. Edit(편집) | All(모두)을 선택한 다음 Edit(편집) | 채우기를 선택하고 대화상자 창이 열리면 아니요를 선택하여 현재 조각만 흰색으로 채웁니다.
- 원시 데이터 이미지를 열고 Image | 색상 | 채널 분할.
- Image Calculator를 사용하여 두 비율 채널의 평균을 생성하고 Process | 이미지 계산기. 대화 상자 창이 나타나면 연산을 평균으로 설정하고 Image1 및 Image2를 각각 분자 및 분모 영상으로 설정합니다. Create New Window(새 창 만들기)를 선택합니다.
- Edit(편집) | All(모두)을 선택한 다음 Edit(편집) | 복사를 클릭합니다. 그런 다음 HSB 스택을 클릭하고 세 번째 조각(값)을 선택한 다음 Edit(편집) | 붙여넣기를 클릭하여 강도 값을 전송합니다.
- 이미지를 클릭하여 HSB 스택을 RGB 색 공간으로 변환합니다 . 유형 | RGB 색상. 결과 이미지를 저장합니다.
- 변조되지 않은 컬러 이미지를 생성하려면:
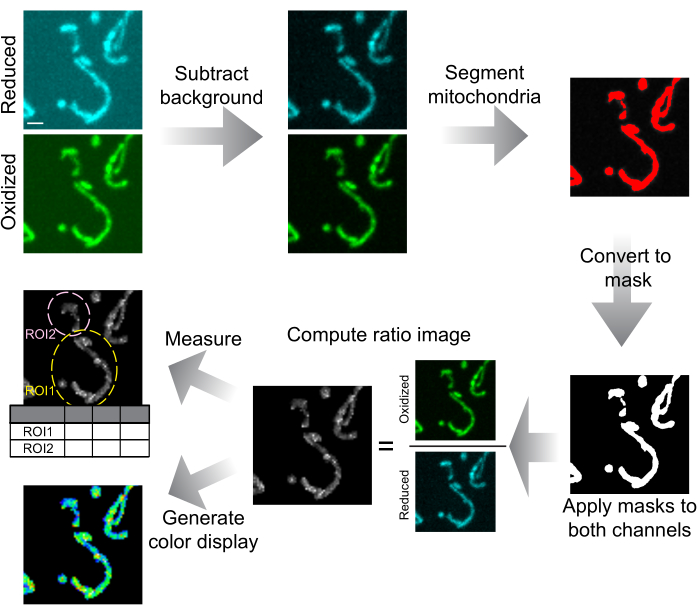
그림 6: 이미지 분석 및 표현 개략도. 스피닝 디스크 컨포칼 이미지는 먼저 배경에서 뺍니다. 미토콘드리아는 임계값에 의해 분할되고 각 슬라이스에 대한 마스크로 변환됩니다. 이러한 마스크는 두 채널 모두에 적용되며 마스킹된 이미지는 비율 이미지를 계산하는 데 사용됩니다. ROI는 세포 또는 세포 내 영역에서 mtHyPer7 비율을 측정하기 위해 그려집니다. 데이터 표현을 위해 컬러 비율 이미지도 생성할 수 있습니다. 눈금 막대 = 1μm. 약어: ROI = 관심 영역. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
대표적 결과
mtHyPer7이 미토콘드리아H2O2를 평가하기에 적합한 프로브임을 확인하기 위해 mtHyPer7의 국소화와 효모 미토콘드리아 및 세포 건강에 미치는 영향을 평가했습니다. mtHyPer7의 표적화를 평가하기 위해 미토콘드리아를 mtHyPer7을 발현하는 대조군 효모 세포와 효모에서 중요한 미토콘드리아 특이적 염료인 MitoTracker Red로 염색했습니다. MitoTracker Red 염색을 사용하여 미토콘드리아는 모-새싹 축을 따라 정렬되고 새싹 끝과 새싹 원위부에 있는 모세포 끝단에 축적된 긴 관형 구조로 분해되었습니다(41). 미토콘드리아 형태는 대조군과 mtHyPer7 발현 세포에서 유사했습니다. 또한 mtHyPer7은 MitoTracker Red-stained 미토콘드리아와 함께 국소화되었습니다(그림 3A). 따라서 mtHyPer7은 정상적인 미토콘드리아 형태나 분포에 영향을 미치지 않고 미토콘드리아를 효율적이고 정량적으로 표적으로 삼았습니다.
다음으로, 미토콘드리아의 세포 적합성 및 산화 스트레스에 대한 민감도에 대한 mtHyPer7의 효과를 평가하기 위해 추가 검증 실험을 수행했습니다. 농축 또는 합성 포도당 기반 배지(각각 YPD 또는 SC)에서 mtHyPer7 발현 세포의 성장률은 형질전환되지 않은 야생형 세포의 성장률과 유사합니다(그림 3B,D). 미토콘드리아의 산화 스트레스에 대한 가능한 영향을 평가하기 위해 대조군 및 mtHyPer7 발현 효모를 미토콘드리아에 축적되어 세포 소기관24,27에서 과산화물 수준을 높이는 산화 환원 활성 소분자인 낮은 수준의 파라콰트로 처리했습니다. mtHyPer7 발현이 미토콘드리아의 산화 스트레스를 유도하거나 산화 스트레스로부터 미토콘드리아를 보호하는 경우, mtHyPer7 발현 세포는 파라콰트 처리에 대한 민감도가 각각 증가하거나 감소해야 합니다. 낮은 수준의 파라콰트를 사용한 처리는 효모 성장률의 감소를 초래했습니다. 더욱이, 파라콰트의 존재 하에서 야생형 및 mtHyPer7 발현 세포의 성장률은 유사하였다(그림 3C,E). 그러므로, 바이오센서의 발현은 발아 효모 세포에서 현저한 세포 스트레스를 생성하거나 미토콘드리아 산화 스트레스에 대한 효모의 민감성을 변화시키지 않았다.
mtHyPer7이 신진 효모에서 미토콘드리아 H 2 O 2 를 연구하는 데 적합하다는 증거를 감안할 때, mtHyPer7이 중간 로그 단계 야생형 효모에서 미토콘드리아 H 2 O 2 와 외부에서 첨가 된 H 2 O2에 의해 유도 된 미토콘드리아 H 2 O 2의 변화를 검출 할 수 있는지 여부를 테스트했습니다. H2O2적정 실험을 수행하고, 미토콘드리아에서 평균 산화:환원(O/R) mtHyPer7 비율을 측정하였다.
자동화된 분석 스크립트는 여러 출력 파일을 생성했습니다.
비율 이미지(ratio.tif): 배경 보정되고 임계값이 있는 488nm 및 405nm 스택의 비율로 구성된 Z 스택입니다. 이 스택은 추가 처리 없이 피지에서 볼 수 있습니다. 그러나 보기 전에 프로토콜 단계 4.3 또는 5.6에 설명된 대로 대비를 높이거나 이미지를 채색하는 것이 좋습니다.
마스크 이미지(mask.tif): 분석에 사용되는 임계값 미토콘드리아 영역으로 구성된 Z 스택입니다. 이 이미지는 임계값의 정확도를 평가하는 데 사용해야 합니다.
분석에 사용되는 ROI(ROIs.zip): 이 파일을 피지에서 열면 원본 이미지와 함께 ROI가 이미지에 겹쳐져 결과 테이블과 원본 이미지를 상호 참조합니다. 각 ROI는 셀 번호와 ROI 번호로 이름이 바뀝니다.
분자, 분모 및 비율 이미지의 각 슬라이스에 대한 임계값 미토콘드리아의 면적, 평균 및 통합 밀도를 포함하는 측정 테이블(NumResults.csv, DenomResults.csv, Results.csv). 미토콘드리아가 없거나 초점이 맞지 않는 절편에서는 NaN이 기록됩니다.
배경 및 노이즈 보정, 임계값 설정 및 비율 계산에 사용되는 옵션을 문서화하는 로그 파일(Log.txt)입니다.
mtHyPer7의 O/R 비율은 외부에서 첨가된1-2mM에서 정체기에 도달한H2O2농도에 대한 용량 의존적 반응을 나타냈다(도 7). 놀랍게도, HyPer7 비율은 대조군보다 0.1mMH2O2에 노출된 세포에서 더 낮았지만, 이 차이는 통계적으로 유의하지 않았다. 이 현상에 대한 한 가지 설명은 낮은 수준의 스트레스 요인에 대한 노출이 항산화 메커니즘과 같은 스트레스 반응을 유도할 수 있는 호르메시스 반응일 수 있으며, 이는 차례로 프로브에 의해 검출될 수 있는 ROS의 양을 낮춥니다. 반대로 스트레스 요인 수준이 높을수록 내부 스트레스 반응을 압도하여 HyPer7의 판독값이 높아질 수 있습니다.
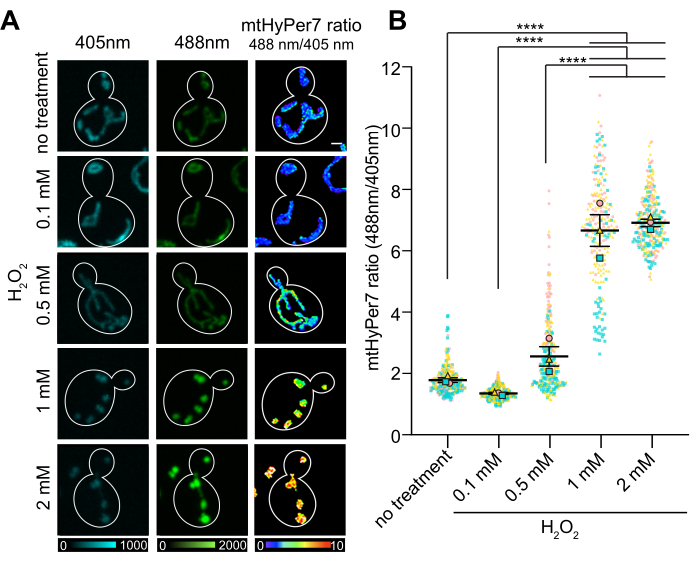
그림 7 : 외부에서 첨가 된 H 2 O 2에 대한 mtHyPer7의 반응. (A) 405 nm 및 488 nm 여기 이미지의 최대 투영 및 H 2 O 2 농도의 중간 로그 상 셀에서 mtHyPer7의 비율 계량 이미지의 평균 강도 투영. 의사 색상은 산화:감소된 mtHyPer7 비율(하단의 배율)을 나타냅니다. 눈금 막대 = 1μm. 셀 윤곽선은 흰색으로 표시됩니다. n > 조건당 100개 셀. (B) 다른 농도의 H 2 O2 로 처리 된 신진 효모 세포에서 mtHyPer7 산화 : 감소 된 비율의 정량화. 5개의 독립적인 시행의 평균이 표시되며, 각 시행마다 모양과 색상이 다른 기호가 표시됩니다. 산화 : 환원 된 mtHyPer7 비율의 평균 ± SEM : 1.794 ± 0.07627 (처리 없음), 1.357 ± 0.03295 (0.1 mM), 2.571 ± 0.3186 (0.5 mM), 6.693 ± 0.5194 (1 mM), 7.017 ± 0.1197 (2 mM). p < 0.0001(Tukey의 다중 비교 검정을 사용한 일원 분산 분석). p 값은 ****p < 0.0001로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
마지막으로, 이전 연구에서는 더 환원되고 과산화물을 덜 함유하는 더 적합한 미토콘드리아가 효모 딸 세포(yeast daughter cell)4에 의해 우선적으로 유전되고, 세포질 카탈라아제(cytosolic catalase)가 효모 딸 세포(yeast daughter cell)로 운반되어 활성화된다는 것을 밝혔다(42,43,44,45). 이 연구는 효모 세포 분열 중 미토콘드리아의 비대칭 유전과 딸 세포 적합성 및 수명, 모녀 연령 비대칭에서 이 과정의 역할을 문서화합니다. H2O2의 차이가모체와 새싹 사이에 존재하는지 여부를 테스트하기 위해, mtHyPer7을 새싹과 모세포에서 측정하였다. 효모 세포 내에서 미토콘드리아H 2 O 2 의 차이가 관찰되었으며, H 2 O 2 바이오 센서 판독 값의 미묘하지만 통계적으로 유의한감소가 모세포의 미토콘드리아와 비교하여 새싹의 미토콘드리아에서 감지되었습니다 (그림 8). 이러한 발견은 새싹의 미토콘드리아가 산화 스트레스로부터 더 잘 보호된다는 이전 발견과 일치합니다. 또한 mtHyPer7이 신진 효모의 세포 및 세포 내 분해능으로 미토콘드리아 H 2O2에 대한 정량적 판독 값을 제공 할 수 있다는 문서를 제공합니다.
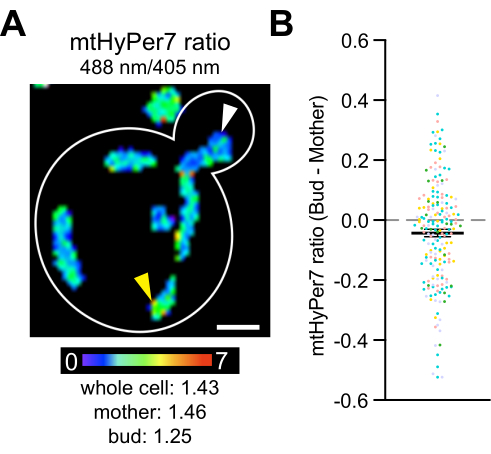
그림 8: 미토콘드리아 H2 O2 수준은 딸 세포에서 더 낮습니다. (A) 대표 셀에서 mtHyPer7의 비율계량 이미지의 최대 투영. 의사 색상은 산화:감소된 mtHyPer7 비율(하단의 배율)을 나타냅니다. 비율의 세포 내 차이가 분명합니다 (화살촉). 눈금 막대 = 1μm. 셀 윤곽선: 흰색. (B) 새싹과 모세포의 mtHyPer7 비율의 차이. 각 개별 셀에 대해 새싹 비율 값에서 어머니 비율 값을 빼고 점으로 표시했습니다. n = 5개의 독립적인 실험에서 풀링된 193개의 세포, 각 실험에 대해 서로 다른 색상의 기호로 표시됨. 새싹과 모세포의 mtHyPer7 비율 차이에 대한 평균 ± SEM: -0.04297 ± 0.01266. p = 0.0008(쌍체 t-검정) 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충표 S1: 본 연구에서 사용된 균주. 사용 된 효모 균주 목록. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충표 S2: 본 연구에 사용된 플라스미드. 사용된 플라스미드 목록. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충표 S3: 본 연구에 사용된 프라이머. 사용된 프라이머 목록. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 1: 바이오센서 플라스미드 구축을 위한 프로토콜. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 파일 2: 자동화된 분석을 위한 스크립트. 각 스크립트에 대해 샘플 입력 파일 및 출력 파일이 제공됩니다. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
이 프로토콜에서는 살아있는 신진 효모 세포에서 미토콘드리아H2O2를 평가하기 위해 바이오센서로서 mtHyPer7을 사용하는 방법이 설명되어 있습니다. 바이오센서는 CRISPR 기반 방법을 사용하여 구성되며 선택 가능한 마커를 사용하지 않고 효모 게놈의 보존된 유전자가 없는 영역에 도입됩니다. 플라스미드 기반 바이오센서와 비교했을 때, 통합 바이오센서는 모든 세포에서 일관된 수준으로 발현되어 보다 신뢰할 수 있는 정량화 결과를 제공합니다. mtHyPer7 발현 세포를 생성하는 데 선택 가능한 마커가 사용되지 않아 더 넓은 범위의 균주 배경을 사용할 수 있고 바이오센서 발현 세포의 유전자 변형을 용이하게 합니다. mtHyPer7 단백질은 미토콘드리아 형태, 기능, 분포 또는 세포 성장률에 눈에 띄는 영향 없이 미토콘드리아를 정확하게 표적으로 합니다. mtHyPer7은 외부에서 첨가된H2O2에 대한 용량 의존적 반응을 나타낸다. 또한 mtHyPer7은 세포 내 분해능으로 미토콘드리아 품질의 이질성을 보고할 수 있습니다. 마지막으로, 미토콘드리아 표적 바이오센서를 이미징하기 위해 광시야 현미경이 아닌 스피닝 디스크 컨포칼 현미경을 사용하면 형광단에 대한 광표백이 줄어들고 세포 내 차이를 분석하기 위한 고해상도 이미지가 생성됩니다.
한계 및 대안 접근 방식
이 방법은 세포가 커버슬립 아래에서 건조되기 때문에 10분 이상 세포를 이미징하는 데 적합하지 않습니다. 장기간의 이미징을 위해, 한천 패드 방법(46 )을 사용하거나 SC 배지로 채워진 유리-바닥 배양 접시에 세포를 고정시키는 것이 더 낫다.
바이오센서의 선택은 실험 조건 하에서 표적의 농도에 따라 결정되어야 합니다. HyPer7의 감도가 너무 높으면 HyPer3 또는 HyPerRed47,48과 같은 다른 HyPer 버전을 사용하는 것이 좋습니다. 그러나 다른 HyPer 프로브는 pH에 더 민감하다는 점에 유의해야 합니다. 더 높은 감도를 위해서는 퍼옥시레독신 기반 roGFP가 더 적합할 수 있습니다(roGFP2Tsa2ΔCR)27.
H 2 O2센서의 산화 정상 상태는 산화 및 환원 속도 모두와 관련이 있습니다. 바이오센서의 산화율은 주로H2O2에 의해 발생하지만, 환원율은 세포와 세포소기관에서 활성화되는 항산화 환원 시스템에 의존한다. HyPer7은 효모 세포질의 티오레독신 시스템에 의해 주로 감소되는 것으로 나타났으며, 그 환원은 roGFP2Tsa2ΔCR27보다 빠릅니다. 그러므로, 프로브의 상이한 환원 메카니즘 및 반응 동역학은H2O2바이오센서의 측정을 해석할 때 고려되어야 한다. 특히, 바이오센서 판독으로부터H2O2수준을 추론하기 위해서는, 환원 시스템이 실험 동안 일정한 용량을 유지한다고 가정해야 한다. 여기에 설명된 스크립트에 대한 대안으로서, 다양한 다른 소프트웨어가 산화 환원 센서(49)의 분석을 위해 자유롭게 이용가능하게 되었다.
중요 단계
모든 바이오센서의 경우, 바이오센서 자체가 측정 공정에 영향을 미치지 않는다는 것을 입증하는 것이 중요합니다. 따라서 각 실험 조건에서 균주의 성장과 미토콘드리아 형태를 비교하는 것이 중요합니다. 여기에서 미토콘드리아 형태는 막 전위 의존적 방식으로 미토콘드리아를 염색하는 MitoTracker Red를 사용하여 평가됩니다. 그러나 변형되지 않은 세포와 바이오센서로 변형된 세포의 미토콘드리아를 비교하려면 대체 막 전위 감지 미토콘드리아 필수 염료인 테트라메틸로다민 메틸 에스테르(TMRM) 또는 막 전위와 무관하게 미토콘드리아를 염색하는 MitoTracker Green을 사용하여 염색할 수 있습니다. 유해한 영향이 의심되는 경우 표현 수준을 줄이거나 통합 사이트를 변경하는 것이 도움이 될 수 있습니다.
프로브의 선량-반응 거동과 이미징 기법의 신호 대 노이즈 비율을 검증하는 것도 확실한 결과를 수집하는 데 필수적입니다. 그룹 내의 변동성이 그룹 간의 변동성을 초과하면 차이를 탐지하기가 어려워집니다. 집단 내 변동성은 실제 모집단 변동 또는 검출 과정의 잡음으로 인해 발생할 수 있습니다. 신호:노이즈 비율을 높이는 주요 단계는 이미지 획득(픽셀 값 범위 및 노이즈), 배경 빼기 및 임계값입니다.
계산 단계에서 노이즈 효과를 줄일 수도 있습니다. 가장 간단한 방법은 비율 이미지 측정(Results.csv)에서 가중 평균 강도를 계산하는 것이며, 여기서 각 픽셀은 여기 효율 간의 국소 비율을 나타냅니다. 이렇게 하면 "픽셀 단위" 비율이 생성됩니다. 그러나 영상 신호:잡음 비율이 낮으면 분자 채널과 분모 채널 모두에서 ROI에 대한 가중 평균 강도를 계산한 다음 이 두 가중 평균 간의 비율("지역별" 비율)을 계산하여 보다 강력한 결과를 얻을 수 있습니다.
이진화 방법을 선택하려면 피지 명령 이미지 | 조정 | 자동 임계값 을 사용하여 내장된 모든 피지 방법을 자동으로 시도할 수 있습니다. 세그멘테이션(임계값 설정)을 평가하기 위해 저장된 마스크는 Edit | 선택 | Create Selection을 ROI Manager에 추가하고( T 키를 눌러) Raw 이미지 파일에서 활성화합니다. 미토콘드리아가 적절하게 검출되지 않으면 다른 분할 방법을 시도해야 합니다.
이미지를 비교할 때는 동일한 이미징 조건으로 모든 이미지를 획득하고 동일한 대비 향상으로 모든 이미지를 표시하는 것이 중요합니다.
이미징 조건을 최적화할 때 미토콘드리아 이동을 고려해야 합니다. 미토콘드리아가 405nm와 488nm에서 여기 사이에서 크게 이동하면 비율 이미지가 정확하지 않습니다. 노출 시간을 <500ms로 유지하고 사용 가능한 가장 빠른 방법(예: 트리거 펄스 또는 음향 광학 조정 가능 필터)으로 여기를 변경하는 것이 좋습니다. Z 스택을 캡처할 때 다음 Z 단계로 이동하기 전에 각 Z 단계에 대해 두 가진을 모두 수행해야 합니다.
결과를 표시하기 위해 색조(색상)의 변화는 강도의 변화보다 사람의 눈에 더 분명합니다. 따라서 비율 값은 더 쉽게 시각적으로 해석할 수 있도록 색상 눈금으로 변환됩니다. 컬러화된 이미지는 모든 미토콘드리아 픽셀이 동일한 밝기로 나타나는 비변조 또는 원본 이미지의 픽셀 강도를 사용하여 컬러화된 이미지의 강도를 설정하는 강도 변조될 수 있습니다.
수정 및 문제 해결
파라콰트에 대한 챌린지를 통해 미토콘드리아 기능을 확인하는 대안으로, 세포는 복제 도금되거나 발효성 및 비발효성 탄소원에 접종될 수 있습니다.
배경 빼기의 경우 롤링 볼 빼기( Process | 배경 빼기...) 조명 불균일성을 제거하는 데에도 사용할 수 있습니다. 셀이 있어도 빼는 배경이 변경되지 않는지 확인해야 합니다( 배경 만들기 옵션을 선택하고 결과 검사).
요약하면, mtHyPer7 프로브는 살아있는 세포에서 효모 미토콘드리아의 형태학적 및 기능적 상태를 관련시키기 위한 일관되고 최소 침습적인 방법을 제공하며, 유전적으로 다루기 쉽고 쉽게 접근할 수 있는 모델 시스템에서 중요한 세포 스트레스 요인 및 신호 분자를 연구할 수 있습니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
저자는 전문적인 기술 지원을 제공한 Katherine Filpo Lopez에게 감사를 표합니다. 이 연구는 미국 국립보건원(NIH)(GM122589 및 AG051047)의 보조금으로 LP에 지원되었습니다.
이 연구는 컬럼비아 대학의 허버트 어빙 종합 암 센터(Herbert Irving Comprehensive Cancer Center)의 컨포칼 및 특수 현미경 공유 리소스(Confocal and Specialized Microscopy Shared Resource)를 사용했으며, NIH/NCI 암 센터 지원 보조금 P30CA013696(Cancer Center Support Grant )을 통해 부분적으로 자금을 지원받았습니다.
자료
| Name | Company | Catalog Number | Comments |
| 100x/1.45 Plan Apo Lambda objective lens | Nikon | MRD01905 | |
| Adenine sulfate | Sigma-Aldrich | #A9126 | |
| Bacto Agar | BD Difco | #DF0145170 | |
| Bacto Peptone | BD Difco | #DF0118170 | |
| Bacto Tryptone | BD Difco | #DF211705 | |
| Bacto Yeast Extract | BD Difco | #DF0127179 | |
| BamHI | New England Biolabs | R0136S | |
| BglII | New England Biolabs | R0144S | |
| Carbenicilin | Sigma-Aldrich | C1389 | |
| Carl Zeiss Immersol Immersion Oil | Carl Zeiss | 444960 | |
| Dextrose (D-(+)-Glucose) | Sigma-Aldrich | #G8270 | |
| E. cloni 10G chemical competent cell | Bioserch Technologies | 60108 | |
| FIJI | NIH | Schindelin et al 2012 | |
| G418 (Geneticin) | Sigma-Aldrich | A1720 | |
| GFP emission filter | Chroma | 525/50 | |
| Gibson assembly | New England Biolabs | E2611 | |
| Graphpad Prism 7 | GraphPad | https://www.graphpad.com/scientific-software/prism/ | |
| H2O2 (stable) | Sigma-Aldrich | H1009 | |
| HO-pGPD-mito-roGFP-KanMX6-HO | Pon Lab | JYE057/EP41 | Liao et al 20201 |
| Incubator Shaker | New Brunswick Scientific | E24 | |
| KAPA HiFi PCR kit | Roche Sequencing and Life Science, Kapa Biosystems, Wilmington, MA | KK1006 | |
| L-arginine hydrochloride | Sigma-Aldrich | #A8094 | |
| laser | Agilent | 405 and 488 nm | |
| L-histidine hydrochloride | Sigma-Aldrich | #H5659 | |
| L-leucine | Sigma-Aldrich | #L8912 | |
| L-lysine hydrochloride | Sigma-Aldrich | #L8662 | |
| L-methionine | Sigma-Aldrich | #M9625 | |
| L-phenylalanine | Sigma-Aldrich | #P5482 | |
| L-tryptophan | Sigma-Aldrich | #T8941 | |
| L-tyrosine | Sigma-Aldrich | #T8566 | |
| mHyPer7 plasmid | This study | JYE116 | |
| Microscope coverslips | ThermoScientific | 3406 | #1.5 (170 µm thickness) |
| Microscope slides | ThermoScientific | 3050 | |
| MitoTracker Red CM-H2Xros | ThermoFisherScientific | M7513 | |
| NaCl | Sigma-Aldrich | S9888 | |
| NEBuilder HiFi Assembly Master Mix | New England Biolabs | E2621 | |
| Nikon Elements | Nikon | Microscope acquisition software | |
| Nikon Ti Eclipse inverted microscope | Nikon | ||
| Paraquat (Methyl viologen dichloride hydrate) | Sigma-Aldrich | Cat. #856177 | |
| RStudio | Posit.co | Free desktop version | |
| Spectrophotometer | Beckman | BU530 | |
| Stagetop incubator | Tokai Hit | INU | |
| Uracil | Sigma-Aldrich | #U1128 | |
| Yeast nitrogen base (YNB) containing ammonium sulfate without amino acids | BD Difco | #DF0919073 | |
| YN2_1_LT58_X2site | Addgene | 177705 | Pianale et al 2021 |
| Zyla 4.2 sCMOS camera | Andor |
참고문헌
- vander Bliek, A. M., Sedensky, M. M., Morgan, P. G. Cell biology of the mitochondrion. Genetics. 207 (3), 843-871 (2017).
- McBride, H. M., Neuspiel, M., Wasiak, S. Mitochondria: more than just a powerhouse. Current Biology. 16 (14), 551-560 (2006).
- Shi, R., Hou, W., Wang, Z. -. Q., Xu, X. Biogenesis of iron-sulfur clusters and their role in DNA metabolism. Frontiers in Cell and Developmental Biology. 9, 735678 (2021).
- McFaline-Figueroa, J. R., et al. Mitochondrial quality control during inheritance is associated with lifespan and mother-daughter age asymmetry in budding yeast. Aging Cell. 10 (5), 885-895 (2011).
- Higuchi-Sanabria, R., et al. Mitochondrial anchorage and fusion contribute to mitochondrial inheritance and quality control in the budding yeast Saccharomyces cerevisiae. Molecular Biology of the Cell. 27 (5), 776-787 (2016).
- Higuchi-Sanabria, R., et al. Role of asymmetric cell division in lifespan control in Saccharomyces cerevisiae. FEMS Yeast Research. 14 (8), 1133-1146 (2014).
- Lam, Y. T., Aung-Htut, M. T., Lim, Y. L., Yang, H., Dawes, I. W. Changes in reactive oxygen species begin early during replicative aging of Saccharomyces cerevisiae cells. Free Radical Biology & Medicine. 50 (8), 963-970 (2011).
- Laun, P., et al. Aged mother cells of Saccharomyces cerevisiae show markers of oxidative stress and apoptosis. Molecular Microbiology. 39 (5), 1166-1173 (2001).
- Doudican, N. A., Song, B., Shadel, G. S., Doetsch, P. W. Oxidative DNA damage causes mitochondrial genomic instability in Saccharomyces cerevisiae. Molecular and Cellular Biology. 25 (12), 5196-5204 (2005).
- Roca-Portoles, A., Tait, S. W. G. Mitochondrial quality control: from molecule to organelle. Cellular and Molecular Life Sciences. 78 (8), 3853-3866 (2021).
- Sies, H., Berndt, C., Jones, D. P. Oxidative stress. Annual Review of Biochemistry. 86, 715-748 (2017).
- Sies, H., Jones, D. P. Reactive oxygen species (ROS) as pleiotropic physiological signalling agents. Nature Reviews Molecular Cell Biology. 21 (7), 363-383 (2020).
- Imlay, J. A., Fridovich, I. Assay of metabolic superoxide production in Escherichia coli. The Journal of Biological Chemistry. 266 (11), 6957-6965 (1991).
- Fridovich, I. Mitochondria: are they the seat of senescence. Aging Cell. 3 (1), 13-16 (2004).
- Quinlan, C. L., Perevoshchikova, I. V., Hey-Mogensen, M., Orr, A. L., Brand, M. D. Sites of reactive oxygen species generation by mitochondria oxidizing different substrates. Redox Biology. 1 (1), 304-312 (2013).
- Griendling, K. K., Minieri, C. A., Ollerenshaw, J. D., Alexander, R. W. Angiotensin II stimulates NADH and NADPH oxidase activity in cultured vascular smooth muscle cells. Circulation Research. 74 (6), 1141-1148 (1994).
- Griendling, K. K., Sorescu, D., Ushio-Fukai, M. NAD(P)H oxidase: role in cardiovascular biology and disease. Circulation Research. 86 (5), 494-501 (2000).
- Edmondson, D. E., Binda, C., Wang, J., Upadhyay, A. K., Mattevi, A. Molecular and mechanistic properties of the membrane-bound mitochondrial monoamine oxidases. Biochemistry. 48 (20), 4220-4230 (2009).
- Ramsay, R. R., Singer, T. P. The kinetic mechanisms of monoamine oxidases A and B. Biochemical Society Transactions. 19 (1), 219-223 (1991).
- Ramsay, R. R. Kinetic mechanism of monoamine oxidase A. Biochemistry. 30 (18), 4624-4629 (1991).
- Handy, D. E., Loscalzo, J. Redox regulation of mitochondrial function. Antioxidants & Redox Signaling. 16 (11), 1323-1367 (2012).
- Wood, Z. A., Schröder, E., Robin Harris, J., Poole, L. B. Structure, mechanism and regulation of peroxiredoxins. Trends in Biochemical Sciences. 28 (1), 32-40 (2003).
- Slade, L., et al. Examination of the superoxide/hydrogen peroxide forming and quenching potential of mouse liver mitochondria. Biochimica et Biophysica Acta. General Subjects. 1861 (8), 1960-1969 (2017).
- Pak, V. V., et al. Ultrasensitive genetically encoded indicator for hydrogen peroxide identifies roles for the oxidant in cell migration and mitochondrial function. Cell Metabolism. 31 (3), 642-653 (2020).
- Topell, S., Hennecke, J., Glockshuber, R. Circularly permuted variants of the green fluorescent protein. FEBS Letters. 457 (2), 283-289 (1999).
- Belousov, V. V., et al. Genetically encoded fluorescent indicator for intracellular hydrogen peroxide. Nature Methods. 3 (4), 281-286 (2006).
- Kritsiligkou, P., Shen, T. K., Dick, T. P. A comparison of Prx- and OxyR-based H2O2 probes expressed in S. cerevisiae. The Journal of Biological Chemistry. 297 (1), 100866 (2021).
- Baird, G. S., Zacharias, D. A., Tsien, R. Y. Circular permutation and receptor insertion within green fluorescent proteins. Proceedings of the National Academy of Sciences. 96 (20), 11241-11246 (1999).
- Abedi, M. R., Caponigro, G., Kamb, A. Green fluorescent protein as a scaffold for intracellular presentation of peptides. Nucleic Acids Research. 26 (2), 623-630 (1998).
- Onukwufor, J. O., et al. A reversible mitochondrial complex I thiol switch mediates hypoxic avoidance behavior in C. elegans. Nature Communications. 13 (1), 2403 (2022).
- Vega, M., et al. Antagonistic effects of mitochondrial matrix and intermembrane space proteases on yeast aging. BMC Biology. 20 (1), 160 (2022).
- Torello Pianale, L., Rugbjerg, P., Olsson, L. Real-time monitoring of the yeast intracellular state during bioprocesses with a toolbox of biosensors. Frontiers in Microbiology. 12, 802169 (2022).
- Imani, M., Mohajeri, N., Rastegar, M., Zarghami, N. Recent advances in FRET-based biosensors for biomedical applications. Analytical Biochemistry. 630, 114323 (2021).
- Zadran, S., et al. Fluorescence resonance energy transfer (FRET)-based biosensors: visualizing cellular dynamics and bioenergetics. Applied Microbiology and Biotechnology. 96 (4), 895-902 (2012).
- Gietz, R. D., Woods, R. A. Transformation of yeast by lithium acetate/single-stranded carrier DNA/polyethylene glycol method. Methods in Enzymology. 350, 87-96 (2002).
- Liao, P. -. C., Wolken, D. M. A., Serrano, E., Srivastava, P., Pon, L. A. Mitochondria-associated degradation pathway (MAD) function beyond the outer membrane. Cell Reports. 32 (2), 107902 (2020).
- Higuchi-Sanabria, R., Swayne, T. C., Boldogh, I. R., Pon, L. A. Live-cell imaging of mitochondria and the actin cytoskeleton in budding yeast. Methods in Molecular Biology. 1365, 25-62 (2016).
- Liao, P. -. C., Yang, E. J., Pon, L. A. Live-cell imaging of mitochondrial redox state in yeast cells. STAR Protocols. 1 (3), 100160 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Collins, T. J. ImageJ for microscopy. BioTechniques. 43, 25-30 (2007).
- Chazotte, B. Labeling mitochondria with MitoTracker dyes. Cold Spring Harbor Protocols. 2011 (8), 990-992 (2011).
- Aguilaniu, H., Gustafsson, L., Rigoulet, M., Nyström, T. Asymmetric inheritance of oxidatively damaged proteins during cytokinesis. Science. 299 (5613), 1751-1753 (2003).
- Erjavec, N., Larsson, L., Grantham, J., Nyström, T. Accelerated aging and failure to segregate damaged proteins in Sir2 mutants can be suppressed by overproducing the protein aggregation-remodeling factor Hsp104p. Genes & Development. 21 (19), 2410-2421 (2007).
- Erjavec, N., Cvijovic, M., Klipp, E., Nyström, T. Selective benefits of damage partitioning in unicellular systems and its effects on aging. Proceedings of the National Academy of Sciences. 105 (48), 18764-18769 (2008).
- Erjavec, N., Nyström, T. Sir2p-dependent protein segregation gives rise to a superior reactive oxygen species management in the progeny of Saccharomyces cerevisiae. Proceedings of the National Academy of Sciences. 104 (26), 10877-10881 (2007).
- Davidson, R., Liu, Y., Gerien, K. S., Wu, J. Q. Real-time visualization and quantification of contractile ring proteins in single living cells. Methods in Molecular Biology. 1369, 9-23 (2016).
- Bilan, D. S., et al. HyPer-3: a genetically encoded H2O2 probe with improved performance for ratiometric and fluorescence lifetime imaging. ACS Chemical Biology. 8 (3), 535-542 (2013).
- Ermakova, Y. G., et al. Red fluorescent genetically encoded indicator for intracellular hydrogen peroxide. Nature Communications. 5 (1), 5222 (2014).
- Fricker, M. D. Quantitative redox imaging software. Antioxidants & Redox Signaling. 24 (13), 752-762 (2016).
- Yang, E. J., Pernice, W. M., Pon, L. A. A role for cell polarity in lifespan and mitochondrial quality control in the budding yeast Saccharomyces cerevisiae. iSCIENCE. 25 (3), 103957 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유