PD-1/PD-L1 상호 작용의 PDL1-Vaxx 펩타이드 백신 유도 항체 봉쇄의 자기 형광 비드 기반 이중 리포터 흐름 분석
요약
체크포인트 억제제는 암과의 싸움을 위한 치료법을 개발하는 데 중요한 표적입니다. 이 보고서는 PD-1/PDL1 복합체 형성을 차단하는 중화 다클론 항체 생성을 유도하는 새로운 PDL1 펩타이드 기반 암 백신인 PDL1-Vaxx를 소개합니다. 이 작업은 또한 이 활성을 분석하기 위한 형광 비드 기반 분석법의 개발 및 테스트에 대해 자세히 설명합니다.
초록
단클론 항체로 관문 수용체(PD-1, PD-L1 및 CTLA-4)를 억제하는 것은 암 환자 치료를 위한 임상시험에서 큰 이점을 보여주었으며 현대 암 면역 요법의 주요 접근법이 되었습니다. 그러나 일부 환자만이 체크포인트 단일클론 항체 면역요법에 반응합니다. 따라서 암에 대한 새로운 치료 전략을 개발하는 것이 시급합니다. 새로운 B세포 펩타이드 에피토프 PDL1(Programmed Death Ligand 1) 암 백신이 개발되었으며, 아미노산 130-147은 GPSL 링커를 통해 MVF 펩타이드("난잡한" T 세포 홍역 바이러스 융합 단백질)에 연결됩니다. 전임상 시험에서 이 PDL1 백신(PDL1-Vaxx)은 동물에서 높은 면역원성 항체를 효과적으로 자극하는 것으로 나타났습니다. PDL1-Vaxx로 면역된 동물은 다양한 동물 암 모델에서 종양 부담이 감소하고 생존율이 연장되었습니다. 작용 기전은 백신 유도 항체가 종양 세포 증식을 억제하고 세포 사멸을 유도하며 PD-1/PD-L1 상호 작용을 차단한다는 것을 나타냅니다. 이 원고는 PD-1/PD-L1 상호 작용 및 PDL1-Vaxx에 대해 제기된 항 PDL1 항체에 의한 차단을 평가하기 위해 이중 리포터 흐름 분석 시스템을 사용하는 마그네틱 비드 기반 분석을 소개합니다.
서문
면역 체계의 T 세포, B 세포 및 세포 내 체크포인트에서 신호 전달 경로는 면역 활동을 조절합니다. 일부 암세포는 면역 기능을 억제하고 종양의 생존과 증식을 촉진하는 체크포인트 표적을 자극하여 면역 공격으로부터 스스로를 보호합니다. 관문 억제에 의한 종양학적 면역요법은 항체를 사용하여 신호 관문을 표적으로 삼고 차단하여 면역 체계의 항종양 기능을 회복시킵니다 1,2,3. 현재 매우 효과적인 항암 치료법으로는 프로그램된 죽음 단백질 1(PD-1)4을 표적으로 하는 단일클론 항체인 니볼루맙(nivolumab)과 프로그램된 죽음 리간드 1(PD-L1)을 표적으로 하는 아테졸리주맙(atezolizumab)이 있습니다5. 이 접근법은 암 환자 치료에 큰 임상적 성공을 거두었습니다. 그러나 현재 체크포인트 억제 전략의 임상적 유용성은 특히 단일 제제 요법에서 부작용 및 치료 내성에 의해 완화된다6. 면역 요법과 독성이 낮은 보다 효과적인 치료 전략의 조합이 암 치료에 시급히 필요하다 1,3,6.
지난 30년 동안 카우마야 박사의 연구실은 암 치료를 위한 펩타이드 암 백신과 펩타이드 모방 관련 제제를 개발해 왔으며, 그 중 일부는 임상 시험이 진행 중입니다 1,2,7,8,9,10,11,12,13,14 . 예를 들어, HER-2 병용 면역요법을 병용한 B-Vaxx는 임상시험에서 전이성 및/또는 재발성 고형 종양에 대한 환자 이점을 보여주었다12. 이 연구소의 최신 암 백신은 PD1-Vaxx 2,13 및 PDL1-Vaxx14로, 전임상 연구, 특히 병용 치료에서 큰 이점을 보여주었습니다. PD1-Vaxx는 미국과 호주에서 용량 증량 임상시험을 완료했다. PD1-Vaxx는 2023년 5월에 시작되는 임상 1b상 시험에서 아테졸리주맙과 병용될 예정이다. 이 보고서는 PDL1/PD-L1 상호작용을 차단하는 PDL1-Vaxx 유도 항체의 능력을 평가하는 데 중점을 둡니다.
PDL1-Vaxx 암 백신은 GPSL 펩타이드 링커를 통해 무차별 T 세포 홍역 바이러스 융합(MVF) 펩타이드에 연결된 PD-L1 아미노산 130-147을 함유한 새로운 B세포 펩타이드 에피토프 백신입니다. 전임상 연구에 따르면 PDL1-Vaxx는 다양한 동물 모델에서 항암 항체 생성을 자극하는 면역원성이 높고, 생존 기간을 연장하며, 종양 부담을 감소시키는 것으로 나타났다14. PD-L1 펩타이드에 대해 생성된 이러한 항체는 PD1/PD-L1 상호작용을 성공적으로 차단하여 항종양 활성을 유발할 수 있습니다. 이 보고서는 유세포 분석 장비에서 이중 리포터 판독과 함께 마그네틱 비드 기반 형식을 사용하여 PDL1-Vaxx 유도 항체에 의한 PD1/PD-L1 복합체 형성의 차단을 분석하는 분석을 소개합니다.
프로토콜
1. 실험 준비
알림: 이 단계에서 언급된 모든 시약/장비의 세부 정보는 재료 표에 나열되어 있습니다.
- 재조합 인간 PD-1(rhPD-1, 폴리히스티딘 태그)을 얻습니다. 사용하기 전에 멸균 여과된 인산염 완충 식염수(PBS), pH 7.4로 동결건조된 rhPD1을 재구성합니다.
- 비오틴화된 재조합 인간 PD-L1(rhPD-L1)을 얻습니다. 동결건조된 rhPD-L1을 사용하기 전에 멸균 탈이온수로 재구성합니다.
- streptavidin-conjugated R-phycoerythrin 검출 시약(SAPE)을 얻습니다. 모든 SAPE 용액은 냉장고 온도(예: 2-8°C)에서 빛으로부터 보호되어 보관하십시오.
- 형광 염색된 자기 마이크로스피어(직경 6.5μm, 마그네타이트가 내장된 폴리스티렌)와 비드 커플링 키트15 (사용하는 경우 재료 표 참조)를 얻습니다. 마이크로스피어에 대한 공유 결합에는 sulfo-NHS(sulfo-N-hydrosuccinimide) 및 EDC(N-[3-dimethylaminopropyl]-N'-ethylcarbodiimide hydrochloride)가 필요합니다.
참고: 마그네틱 비드 세트는 500개의 고유한 형광 태그와 함께 사용할 수 있으며, 이를 통해 다양한 비드 세트(16)를 식별하고 구별할 수 있습니다. 비드는 2.5 × 106 beads/mL 및 12.5 × 106 beads/mL의 스톡 농도로 제공됩니다. 빛으로부터 보호된 비드는 냉장고 온도(예: 2-8 °C)에서 보관하십시오. 비드 현탁액을 얼리지 마십시오. - 양성 및 음성 대조군 항체와 Brilliant Violet 421(BV421) 표지 2차 검출 항체를 얻습니다. 빛으로부터 보호되는 모든 형광 복합 분자를 저장하십시오.
- 저단백질 결합 튜브에서 모든 커플링 반응을 수행하고 저단백질 결합, 둥근 바닥, 96웰 마이크로타이터 플레이트에서 모든 분석 반응을 수행합니다. 분석 배양 단계를 위해 일회용 접착 호일 또는 플라스틱 96웰 마이크로플레이트 커버로 플레이트를 밀봉합니다. 마그네틱 플레이트 분리기를 사용하여 분석 세척 단계 중에 비드를 고정합니다.
참고: 듀얼 리포터 유동 분석 시스템에는 세 가지 레이저가 있습니다: (1) 비드 세트별 형광(분류 채널)을 식별하고 정량화하는 레이저; (2) 표적 특이적 피코에리트린(PE) 형광을 검출하고 정량화하는 것(리포터 채널 1; 532nm 여기, "주황색" 565-585nm 방출); (3) 두 번째 표적 분석물의 표적 특이적 BV421 형광을 검출하고 정량화하는 것(Reporter Channel 2; 405nm 여기, "청색" 421-441nm 방출).
2. rhPD-1을 마그네틱 비드에 연결
참고: 결합할 단백질에는 소 혈청 알부민(BSA), 아지드화나트륨, 글리신, 글리세롤, 트리스(하이드록시메틸)아미노메탄(트리스) 또는 아민 함유 첨가제가 없어야 하며 pH 7.4의 PBS에 현탁되어야 합니다. 본 명세서에 기술된 모든 필요한 시약 및 완충액을 포함하는 상용 커플링 키트를 사용할 수 있습니다( 재료 표 참조).
- 냉장고에서 모든 커플링 시약을 제거하고 18-22분 동안 실온(RT, 30°C)과 평형을 이룹니다.
- 제품 정보 시트에 따라 잠시 소용돌이치거나, 초음파 처리 또는 회전하여(15-30rpm에서 30분) 스톡 마이크로스피어를 재현탁합니다.
- 1 × 106 개의 마그네틱 비드를 1.5mL 저단백질 결합 마이크로 원심분리기 튜브에 옮깁니다( 재료 표 참조).
- 100 μL의 활성화 완충액15: 0.1 M NaH2PO4 (monobasic), pH 6.2로 비드를 세척합니다.
참고: 0.1M 2-모르폴리노에탄술폰산(MES), pH 6.0을 대체 활성화 및 커플링 버퍼로 포함하는 사전 구성된 커플링 키트를 사용하여 커플링을 수행할 수도 있습니다( 재료 표 참조).- 비드가 들어있는 튜브를 자기 분리기에 1-2분 동안 놓습니다.
참고: 또는 비드를 ≥8,000× g 에서 1-2분 동안 미세 원심분리로 분리할 수 있습니다. - 튜브가 여전히 자기 분리기에 있는 상태에서 자석 고정 또는 펠릿 비드에서 피펫으로 상층액을 흡입합니다.
- 자석에서 마이크로 원심분리기 튜브를 제거하고 80μL의 커플링 버퍼를 추가합니다( 재료 표 참조).
- 반응 튜브를 부드럽게 소용돌이 치게하고 20 초 동안 초음파 처리하여 비드를 분산시킵니다.
- 비드가 들어있는 튜브를 자기 분리기에 1-2분 동안 놓습니다.
- sulfo-NHS 및 EDC로 비드를 활성화합니다.
참고: sulfo-NHS의 원액은 활성화 완충액에 용해된 50mg/mL입니다. EDC의 원액은 또한 활성화 완충액에 용해된 50mg/mL입니다. 활성화 완충액과 대기 중의 수분 모두 EDC 분해를 일으킵니다. 저장된 EDC 용액을 사용하는 것은 바람직하지 않습니다. 단계 전에 신선한 EDC 용액을 충분히 만들고 용액이 준비되면 즉시 사용하십시오. 초과 EDC 용액은 폐기하십시오.
주의: EDC는 눈에 심한 자극을 일으키며 호흡기 및 피부 자극제입니다.- 세척 및 활성화된 비드가 들어 있는 마이크로퓨지 튜브에 10μL의 sulfo-NHS를 추가합니다.
- 10μL의 EDC 원액을 비드와 sulfo-NHS가 들어 있는 마이크로퓨지 튜브에 추가합니다.
- 감광성 마이크로스피어를 빛으로부터 보호하고 RT(18-22°C)에서 15-30rpm에서 20분 동안 로테이터에서 회전합니다. 대안적으로, 튜브는 10분 간격으로 비드를 재분배하기 위해 부드럽게 소용돌이치는 경우 활성화 단계 동안 정지된 상태를 유지할 수 있습니다.
- 비드에서 과도한 커플링 시약을 씻어냅니다.
- 활성화된 비드가 들어 있는 튜브를 자기 분리기에 1-2분 동안 놓습니다.
- 튜브가 여전히 자기 분리기에 있는 상태에서 자석 고정 또는 펠릿 비드에서 피펫으로 상층액을 흡입합니다.
- 자석에서 마이크로 원심분리기 튜브를 제거하고 100μL의 활성화 버퍼를 추가합니다.
- 반응 튜브를 부드럽게 소용돌이쳐 비드를 분산시킵니다.
- 2.6.1-2.6.4 단계를 두 번 더 반복하여 총 세 번 세탁합니다. 세척이 끝나면 비드는 대략 10 ×10 6 beads/mL의 농도로 100μL의 활성화 버퍼에 현탁됩니다.
- rhPD-1 펩타이드를 활성화된 비드에 결합합니다.
- 활성화된 비드가 들어 있는 튜브에 390 μL의 활성화 버퍼를 추가하여 총 비드 현탁액 부피를 최대 490 μL까지 만듭니다.
- 활성화된 비드가 들어 있는 튜브에 10μL의 PD-1 펩타이드 용액(PBS에 용해된 1mg/mL)을 추가하여 활성화된 비드 현탁액에 1μg의 PD-1 펩타이드를 추가합니다.
- 마이크로 원심분리기 튜브를 간단히 소용돌이쳐 PD-1과 활성화된 비드를 균일하게 분배합니다.
- 회전(15-30 rpm)과 함께 RT(18-22 °C)의 어두운 곳에서 2시간 동안 PD-1로 비드를 배양합니다.
- Assay/Wash Buffer(PBS-TBN: 1x PBS, pH 7.4 + 0.1% BSA + 0.05% Tween-20 + 0.05% NaN3 15)를 사용하여 비드를 두 번(2x) 세척합니다.
- 활성화된 비드가 들어 있는 튜브를 자기 분리기에 1-2분 동안 놓습니다.
- 튜브가 여전히 자기 분리기에 있는 상태에서 자석 고정 또는 펠릿 비드에서 피펫으로 상층액을 흡입합니다.
- 자석에서 마이크로 원심분리기 튜브를 제거하고 100μL의 활성화 버퍼를 추가합니다.
- 반응 튜브를 부드럽게 소용돌이쳐 비드를 분산시킵니다.
- 2.8.1-2.8.4 단계를 한 번 더 반복하여 총 두 번 세탁합니다. 세척이 끝나면 비드는 10 ×10 6 beads/mL의 농도로 100μL의 활성화 완충액에 현탁됩니다.
참고: Assay/Wash 버퍼는 저장 매체로도 사용되지 않는 경우 아지드화나트륨(방부제) 없이 만들 수 있습니다. - rhPD-1 결합 비드는 즉시 사용하지 않을 경우 2-8°C의 냉장고 어두운 곳에 보관하십시오. 단백질 결합 비드는 최대 18개월 동안 안정적입니다.
3. 비드에 대한 성공적인 rhPD-1 결합 평가
참고: rhPD-1 결합 마이크로스피어는 비오틴화된 rhPD-L1과 반응하며, 후자는 SAPE로 배양한 후 유세포 분석기에서 평가하여 검출합니다. 이를 통해 마그네틱 비드에 대한 PD-1 결합과 rhPD-1 및 rhPD-L1 단백질 간의 기능적 상호 작용을 검증할 수 있습니다.
- PBS-TBN에서 비오틴화된 rhPD-L1의 2중 연속 희석 시리즈를 생성합니다(원액 rhPD-L1 용액은 1mg/mL). 테스트할 최종 rhPD-L1 농도 범위는 8μg/mL 용액에서 313pg/mL 용액까지입니다. 각 rhPD-L1 희석액의 부피 150μL를 생성: 각 반응에 대해 50μL, 조건당 2개의 반응, 피펫팅 손실을 수용하기에 충분한 초과분.
- rhPD-L1 희석 미세분리 튜브에 8 μg/mL, 4 μg/mL, 2 μg/mL, 1 μg/mL, 0.5 μg/mL, 0.25 μg/mL, 0.125 μg/mL, 0.063 μg/mL, 0.031 μg/mL로 라벨을 붙입니다. 0 μg/mL 튜브(PBS-TBN만 해당)는 no-PD-L1 대조군으로 사용됩니다.
- 라벨링된 모든 rhPD-L1 희석 튜브에 PBS-TBN 150μL를 사전 로드합니다.
참고: 테스트할 최종 rhPD-L1 최고 농도는 8μg/mL이며, rhPD-L1은 반응 혼합물에 첨가 시 1:1로 희석되므로 "8μg/mL"이라고 표시된 희석 튜브는 최종 농도를 나타내며 실제로 16μg/mL rhPD-L1을 포함합니다. 모든 희석 튜브의 라벨은 반응 첨가 후의 최종 rhPD-L1 농도를 나타냅니다. - 최고 농도의 rhPD-L1 희석액(실제 16μg/mL)을 생성합니다. 이는 1mg/mL rhPD-L1 원액(1,000μg/16μg = 62.5)을 2단계로 62.5배 희석한 것입니다.
- 84μL의 PBS-TBN과 16μL의 rhPD-L1 원액(1mg/mL, 즉 1,000μL)을 마이크로 원심분리 튜브에 결합합니다. 이는 6.25배 희석이며, 결과 농도는 160μg/mL rhPD-L1입니다.
- "8 μg/mL"라고 표시된 튜브에서 270 μL의 PBS-TBN과 30 μL의 rhPD-L1 희석액(160 μg/mL)을 결합합니다. 이는 10배 희석이며, 결과 농도는 실제로 16μg/mL입니다. "8μg/mL" 튜브 라벨은 반응 첨가 후 최종 농도를 나타냅니다.
- 3.1.3단계에서 생성된 rhPD-L1 희석액 150μL("8μg/mL")를 "4μg/mL" 튜브에 옮기고 마이크로 원심분리기 튜브 캡을 닫은 다음 잠시 와류하여 용액을 혼합합니다.
- rhPD-L1 희석 시리즈가 완료될 때까지 3.1.4단계를 순차적으로 반복합니다. 생성 후 "8μg/mL"에서 "0.063μg/mL" 사이의 모든 튜브와 0μg/mL 대조군에는 150μL의 용액이 포함되어야 하고 마지막 튜브인 "0.031μg/mL"에는 300μL의 용액이 포함되어야 합니다. 이렇게 하면 중복 반응에서 50μL의 각 비오틴화된 rhPD-L1 희석액을 테스트할 수 있는 충분한 양의 각 희석액이 생성되며, 피펫팅 손실을 수용하기에 충분한 초과량이 남게 됩니다.
- 혈구계17을 사용하여 rhPD-1 결합 비드를 계수합니다.
- 스톡 rhPD-1 결합 비드를 2,500 비드/50 μL/반응에 충분한 부피로 5 × 104 비드/mL로 희석합니다.
- 5 × 104 beads/mL rhPD-1 결합 비드 현탁액을 소용돌이치게 하고, 현탁액 50μL를 96웰 둥근 바닥 마이크로타이터 플레이트의 라벨링/매핑된 각 웰에 피펫팅하여 테스트 중인 각 rhPD-L1 희석에 대해 중복 웰이 생성되도록 합니다.
- 3.1단계에서 생성된 각 비오틴화 rhPD-L1 희석 튜브 50μL를 마이크로타이터 플레이트의 적절한 웰에 추가합니다.
- 마이크로타이터 플레이트를 일회용 호일 또는 플라스틱 접착 플레이트 실러로 덮고 궤도 셰이커(600rpm)에서 RT(18-22°C)의 어두운 곳에서 1시간 동안 플레이트를 배양합니다.
- 비드에서 과도한 비오틴화 rhPD-L1을 씻어냅니다.
- 밀봉된 플레이트를 궤도 셰이커에서 마그네틱 플레이트 분리기로 2분 동안 옮겨 비드를 고정합니다.
- 접착판 실러를 조심스럽게 제거하고 자석과 마이크로타이터 플레이트가 단단히 결합되어 있는지 확인한 다음 플레이트를 뒤집어 상층액을 싱크대 또는 생물학적 위험 액체 폐기물 용기에 적절하게 버립니다. 거꾸로 된 플레이트를 흡수성 종이 티슈 쿠션에 부드럽지만 세게 두드려 남아 있는 상층액을 제거합니다.
- 마그네틱 플레이트 분리기에서 마이크로타이터 플레이트를 제거하고 각 웰에 PBS-TBN 150μL를 피펫팅합니다.
- 밀봉되지 않은 플레이트를 마그네틱 세퍼레이터에 2분 동안 올려 비드를 고정합니다.
- 자석과 마이크로타이터 플레이트가 단단히 결합되어 있는지 확인하고 플레이트를 뒤집어 상층액을 싱크대 또는 생물학적 위험 액체 폐기물 용기에 적절하게 버립니다. 거꾸로 된 플레이트를 흡수성 종이 티슈 쿠션에 부드럽지만 세게 두드려 남아 있는 상층액을 제거합니다.
- 플레이트 세척 단계 3.7.3-3.7.5를 두 번 반복하여 각각 150μL의 PBS-TBN으로 총 3회 세척합니다. 마지막 세척 단계가 끝날 때 우물에 상층액이 남아 있지 않은지 확인하십시오. 우물 바닥에 고정된 비드가 건조되는 것을 방지하기 위해 꾸준히 작업하십시오.
- SAPE 검출 시약을 추가합니다.
- SAPE 원액을 PBS-TBN의 작동 농도 6μg/mL로 희석합니다. 모든 반응 웰이 100μL/웰을 받을 수 있도록 충분한 SAPE 작업 용액 부피를 준비하고, 피펫팅 손실을 수용할 수 있는 충분한 여분을 준비합니다.
- 마그네틱 플레이트 분리기에서 마이크로타이터 플레이트를 제거합니다.
- 각 반응 웰에 100μL의 SAPE 작동 용액을 추가하고 피펫팅으로 세척된 비드를 재현탁합니다.
- 호일 또는 플라스틱 접착 플레이트 실러로 96웰 마이크로타이터 플레이트를 밀봉하고 600rpm의 궤도 셰이커에서 RT(18-22°C)의 어두운 곳에서 1시간 동안 배양합니다.
- 인큐베이터에서 마이크로타이터 플레이트를 제거하고 마그네틱 플레이트 분리기로 옮겨 비드를 고정하고 접착 플레이트 실러를 제거하고 3.7.3-3.7.5단계에 설명된 대로 150μL PBS-TBN으로 비드를 세 번 세척합니다.
- 최종 세척을 제거한 후 마그네틱 플레이트 분리기에서 플레이트를 제거하고 웰당 100μL의 PBS-TBN에 비드를 재현탁합니다.
- 결과를 분석합니다.
- 유동 분석 기기의 플레이트( 재료 표 참조)를 읽고 다음 기기 설정을 사용하여 각 반응의 형광 강도 중앙값(MFI)을 측정합니다. 흡인 부피 = 50μL; 최소 비드 수 = 100개의 비드; 시간 초과 설정 = 40초; 게이팅 = 7,000-17,000; 작동 모드 = 단일 리포터. 각 조건에 대해 중복 웰이 실행되고, 추가 데이터 계산 및 그래프 작성을 수행하기 전에 각 조건에 대한 두 개의 출력 MFI 값의 평균이 계산됩니다.
참고: 각 희석액의 MFI 값은 농도에 따른 결합을 나타내야 하며, 이는 비드에 대한 허용 가능한 rhPD-1 결합 효율을 나타내고 재조합 PD-1/PD-L1 단백질의 양호한 상호 작용을 확인해야 합니다.
- 유동 분석 기기의 플레이트( 재료 표 참조)를 읽고 다음 기기 설정을 사용하여 각 반응의 형광 강도 중앙값(MFI)을 측정합니다. 흡인 부피 = 50μL; 최소 비드 수 = 100개의 비드; 시간 초과 설정 = 40초; 게이팅 = 7,000-17,000; 작동 모드 = 단일 리포터. 각 조건에 대해 중복 웰이 실행되고, 추가 데이터 계산 및 그래프 작성을 수행하기 전에 각 조건에 대한 두 개의 출력 MFI 값의 평균이 계산됩니다.
4. PD-L1 마그네틱 비드 기반 PD-1/PD-L1 차단 분석
참고: 이 분석은 재조합 PD1/PD-L1 상호 작용에 대한 가용성 매개체(예: 항-PDL1-펩타이드 항체)의 차단 활성을 평가합니다. 간단히 말해서, 비오틴화된 rhPD-L1은 다양한 PDL1-Vaxx 펩타이드 접종 후 토끼에서 생성된 항체로 사전 배양됩니다. 그런 다음 rhPD-1 결합 마그네틱 비드를 사용하여 rhPD-L1 + 항-PDL1 항체 혼합물을 포획하고, rhPD-1 결합 비드에 대한 rhPD-L1 결합을 streptavidin-PE를 첨가하여 정량화합니다. PE 형광 신호는 테스트된 항-PDL1 항체/억제제의 차단 활성과 반비례합니다. 항-PDL1-펩타이드 항체 결합은 BV421 결합 항-토끼(항-PDL1-펩타이드 항체용) 또는 항-인간(대조군 항체용) 2차 항체의 결합과 기기의 두 번째 채널에서 BV421 형광을 평가하여 동시에 평가됩니다. 분석 단계는 그림 1에 그림으로 자세히 설명되어 있습니다.
- PDL1-Vaxx 유도 다클론 항체 후보, 음성 대조군 항체(트라스투주맙, 허셉틴, 인간화 항-HER2 단클론 항체) 및 양성 대조 항체(아테졸리주맙, 인간화 항-PDL1 IgG1 단클론 항체)를 포함한 테스트 항체의 2중 연속 희석 시리즈를 준비합니다. 각 반응은 할당된 항체 희석액의 25μL를 사용하므로, 표시된 부피는 조건당 중복 웰에서 각 반응을 수행하기에 충분하며(즉, 조건당 50μL), 피펫팅 손실을 수용하기 위해 일부 초과분이 남아 있습니다.
- 각 백신 유도 항-PDL1-펩타이드 항체 및 대조 항체에 대해 테스트된 최종 항체 농도 범위가 1,000μg/mL에서 8μg/mL인지 확인합니다. 모든 항체의 원액을 2,000μg/mL로 준비합니다.
- 각 항체에 대해 희석 튜브를 1,000μg/mL, 500μg/mL, 250μg/mL, 125μg/mL, 63μg/mL, 31μg/mL, 16μg/mL 및 8μg/mL로 라벨링하고 항체 이름을 포함합니다. 각 항체에 대해 "0μg/mL" 튜브를 추가하며, 이는 차량 전용(PBS-TBN) 대조군이 됩니다.
참고: 반응 혼합물에 첨가하면 항체 농도가 1:1로 희석됩니다. 항체 희석 튜브는 반응에 첨가한 후 최종 항체 농도로 표시되며 실제로 라벨링된 항체의 양보다 두 배의 항체를 함유하고 있습니다. - "0 μg/mL" 차량 전용 대조 튜브를 포함하여 "500 μg/mL" 이하로 표시된 모든 항체 희석 튜브에 75 μL의 PBS-TBN을 추가합니다.
- 각 항체에 대해 2,000μg/mL 원액 150μL를 "1,000μg/mL"라고 표시된 각 튜브에 피펫팅합니다. 이것은 각 항체에 대한 모든 후속 희석을 만드는 데 사용됩니다.
- 각 항체에 대해 "1,000 μg/mL" 튜브에서 시리즈 중 다음으로 낮은 희석액(즉, "500 μg/mL")이 있는 튜브로 75 μL를 피펫으로 전달하여 완전한 희석 시리즈를 생성합니다. 새로 완성된 희석 튜브를 닫고 잠시 소용돌이친 후 "500μg/mL" 튜브에서 "250μg/mL" 튜브로 75μL를 옮겨 희석 시리즈의 구성을 계속합니다. 모든 항체에 대해 마지막 희석인 "8μg/mL"가 만들어질 때까지 이 패턴을 반복합니다.
참고: 각 항체에 대해 완료된 희석 시리즈에서 가장 낮은 희석량인 8μg/mL를 제외한 모든 튜브에 대해 75μL 부피가 있어야 하며 150μL의 부피를 포함해야 합니다. 각 반응은 25μL의 항체 희석을 사용하므로 이러한 부피는 조건당 중복 웰(즉, 조건당 50μL)에서 각 반응을 수행하기에 충분하며, 피펫팅 손실을 수용하기 위한 추가 용량이 있습니다.
- 희석된 항체 25μL를 96웰 마이크로타이터 플레이트의 지정된 웰에 넣습니다.
- 비오틴화된 rhPD-L1을 PBS-TBN에서 4μg/mL의 작업 농도로 희석하여 조건당 중복 웰에 25μL(즉, 조건당 50μL)를 포함하기에 충분한 부피로 피펫팅 손실을 수용하기 위해 추가로 희석합니다.
참고: 이 연구에서 4μg/mL에서 비오틴화된 rhPD-L1은 이전 커플링 평가에서 측정된 최대 MFI 신호의 약 50%를 생성했으며 PD-1/PD-L1 봉쇄 분석에 사용되었습니다. - 각 반응 웰에 25μL의 비오틴화된 rhPD-L1(4μg/mL)을 첨가하고, 마이크로타이터 플레이트를 호일 또는 플라스틱 접착 씰로 덮고, 600rpm의 오비탈 플레이트 셰이커에서 흔들면서 실온(18-22°C)에서 1시간 동안 배양합니다.
- rhPD-1 결합 비드를 50,000 beads/mL로 희석하고, 50 μL/well(2,500 beads/well)에 충분한 부피와 피펫팅 손실을 수용하기 위한 추가 용량을 사용합니다.
- Shaker에서 96웰 마이크로타이터 반응판을 제거하고 접착판 씰을 제거합니다.
- 각 웰에 50μL의 rhPD-1 결합 비드 혼합물을 추가합니다.
- 플레이트를 밀봉하고 600rpm의 궤도 셰이커에서 RT(18-22°C)의 어두운 곳에서 1시간 동안 배양합니다.
- 밀봉된 플레이트를 궤도 셰이커에서 마그네틱 플레이트 분리기로 2분 동안 옮겨 비드를 고정합니다.
- 접착판 실러를 조심스럽게 제거하고 자석과 마이크로타이터 플레이트가 단단히 결합되어 있는지 확인한 다음 플레이트를 뒤집고 상층액을 버립니다. 거꾸로 된 판을 흡수성 종이 티슈 쿠션에 부드럽게 두드려 과도한 상층액을 제거합니다.
- 비드에서 과잉 반응 시약을 씻어냅니다.
- 마그네틱 플레이트 분리기에서 마이크로타이터 플레이트를 제거하고 각 웰에 150μL의 PBS-TBN을 추가합니다.
- 마이크로타이터 플레이트를 마그네틱 플레이트 분리기에 2분 동안 올려 비드를 고정합니다.
- 자석과 마이크로타이터 플레이트가 단단히 결합되어 있는지 확인하고 플레이트를 뒤집고 상층액을 버립니다. 거꾸로 된 판을 흡수성 종이 티슈 쿠션에 부드럽게 두드려 과도한 상층액을 제거합니다.
- 플레이트 세척 단계 4.11.1-4.11.3을 두 번 반복하여 PBS-TBN으로 총 3회 세척합니다. 최종(세 번째) 세척 용액을 제거하기 전에 SAPE 시약이 준비되었는지 확인하십시오(아래).
- SAPE 검출 시약을 추가합니다.
- 원액 SAPE 원액을 PBS-TBN에서 6μg/mL 작동 농도로 희석합니다. 100 μL/웰에 충분한 부피를 만들고, 피펫팅 손실을 수용하기 위해 추가로 부피를 늘립니다.
- 100μL/웰의 SAPE 작동 용액을 각 반응 웰에 추가하고 피펫팅을 통해 비드를 재현탁합니다.
- 플레이트를 밀봉하고 600rpm의 궤도 셰이커에서 RT(18-22°C)의 어두운 곳에서 1시간 동안 배양합니다.
- 반응에서 과잉 SAPE를 디캔팅합니다.
- 밀봉된 플레이트를 궤도 셰이커에서 마그네틱 플레이트 분리기로 2분 동안 옮겨 비드를 고정합니다.
- 접착판 실러를 조심스럽게 제거하고 자석과 마이크로타이터 플레이트가 단단히 결합되어 있는지 확인한 다음 플레이트를 뒤집고 상층액을 버립니다. 거꾸로 된 플레이트를 흡수성 종이 티슈 쿠션에 부드럽게 두드려 과도한 SAPE가 포함된 상층액을 제거합니다.
- 비드에서 여분의 SAPE를 씻어냅니다.
- 마그네틱 플레이트 홀더에서 마이크로타이터 플레이트를 제거합니다.
- 각 웰에 150μL의 PBS-TBN을 추가하여 비드를 재현탁합니다.
- 마이크로타이터 플레이트를 마그네틱 플레이트 분리기에 2분 동안 올려 비드를 고정합니다.
- 자석과 마이크로타이터 플레이트가 단단히 결합되었는지 확인하고 플레이트를 뒤집고 상층액을 버립니다. 거꾸로 된 판을 흡수성 종이 티슈 쿠션에 부드럽게 두드려 과도한 상층액을 제거합니다.
- 4.15.1-4.15.4단계를 반복하여 PBS-TBN으로 총 3번의 세탁을 위해 두 번의 추가 세척 단계를 수행합니다. 최종(3차) 세척액을 제거하기 전에 BV421 응고된 2차 검출 항체를 준비(다음 단계)합니다.
- BV421 응고 2차 항체를 추가합니다.
- BV421-congugated anti-human IgG(인간화 대조군 항체 검출용) 및 BV421-congugated anti-rabbit IgG(PDL1-Vaxx-induced polyclonal antibodies 검출용)( 재료 표 참조)를 각각 100μL/well을 사용하기에 충분한 부피로 Wash/Assay Buffer에서 1:400으로 희석하고, 피펫팅 손실을 수용하기 위한 추가 용량을 사용합니다.
- 희석된 BV421 복합 항인간 IgG 또는 BV421 접합 항토끼 IgG 100μL를 적절한 웰에 추가합니다.
- 플레이트를 밀봉하고 600rpm의 궤도 셰이커에서 RT(18-22°C)의 어두운 곳에서 1시간 동안 배양합니다.
- 비드에서 과잉 BV421 접합 2차 항체를 디캔팅합니다.
- 밀봉된 플레이트를 궤도 셰이커에서 마그네틱 플레이트 분리기로 2분 동안 옮겨 비드를 고정합니다.
- 접착판 실러를 조심스럽게 제거하고 자석과 마이크로타이터 플레이트가 단단히 결합되어 있는지 확인한 다음 플레이트를 뒤집고 상층액을 버립니다. 거꾸로 된 플레이트를 흡수성 종이 조직 쿠션에 부드럽게 두드려 과도한 BV421 접합 2차 항체가 포함된 상청액을 제거합니다.
- 비드에서 과잉 BV421 접합 2차 항체를 세척합니다.
- 각 웰에 150μL의 PBS-TBN을 추가하여 비드를 재현탁합니다.
- 마이크로타이터 플레이트를 마그네틱 플레이트 분리기에 2분 동안 올려 비드를 고정합니다.
- 자석과 마이크로타이터 플레이트가 단단히 결합되었는지 확인하고 플레이트를 뒤집고 상층액을 버립니다. 거꾸로 된 판을 흡수성 종이 티슈 쿠션에 부드럽게 두드려 과도한 상층액을 제거합니다.
- 4.19.1-4.19.3 단계를 반복하여 PBS-TBN으로 총 4번의 세탁에 대해 3개의 추가 세척 단계를 수행합니다.
- 마지막(4번째) 세척 버퍼를 제거한 후 마그네틱 플레이트 분리기에서 마이크로타이터 플레이트를 제거하고 피펫터를 사용하여 100μL PBS-TBN/웰에 비드를 재현탁합니다.
- 결과를 분석합니다.
- 듀얼 리포터 유량 분석 시스템의 플레이트를 읽고 다음 기기 설정을 사용하여 각 반응의 MFI를 측정하십시오: 흡인 부피 = 50μL; 최소 비드 수 = 100개의 비드; 시간 초과 설정 = 40초; 게이팅: 7,000-17,000; 작동 모드 = 듀얼 리포터.
- 듀얼 리포터 시스템을 사용하면 리포터 채널 1이 주황색 PE 형광(rhPD-1 접합 비드에 부착된 rhPD-L1의 양)을 측정하고 리포터 채널 2가 청색 BV421 형광(rhPD-L1에 결합된 부착된 차단 항체의 양)을 측정하도록 합니다.
- 각 조건에 대해 중복된 웰을 실행하고, 추가 데이터 계산 및 그래프 작성을 수행하기 전에 각 조건에 대한 두 개의 출력 MFI 값의 평균을 구합니다.
- 각 표본의 MFI 값을 음의 대조군으로 표준화하고 각 표본에 대한 억제 백분율을 계산합니다.
억제 % = (100 × [음성 대조군 MFI − 샘플 MFI]) / 음성 대조군 MFI
알림: 음수 제어 MFI 값(금지 없음)이 가장 높은 값입니다. 결합된 PD-L1 신호(MFI)는 100%이며, rhPD-1에 대한 rhPD-L1 결합의 억제는 0%로 정의된다.
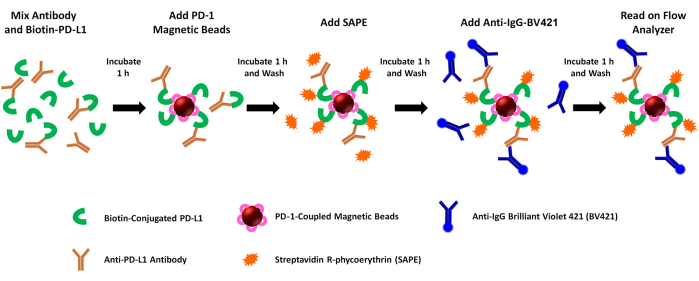
그림 1: 듀얼 리포터 PD-1/PD-L1 봉쇄 분석의 개략도. 비오틴화 재조합 인간 PD-L1(rhPD-L1)은 PD-1/PD-L1 체크포인트 복합체 형성을 위해 rhPD-1 결합 마그네틱 비드와 결합하기 전에 선택된 PDL1-Vaxx 유도 항-PDL1 항체로 사전 배양됩니다. 그런 다음 복합체 rhPD-L1을 검출하고 스트렙타비딘 결합 피코에리트린(SAPE, 주황색 형광단)을 첨가하여 표시합니다. PDL1-Vaxx 항원결정기에 대한 항체는 마그네틱 비드에 사전 결합된 rhPD-1에 복합화된 rhPD-L1을 표적으로 하며, Brilliant Violet 421 접합 2차 항체(BV421, blue fluorophore)를 사용하여 조명합니다. PD-1(PE 신호)에 복합화된 비오틴화된 rhPD-L1과 rhPD-L1(BV421 신호)을 인식하고 결합하는 항-PDL1 항체는 두 개의 개별 리포터 채널에서 두 형광단에 대한 샘플을 조사하는 이중 리포터 유세포 분석 기기를 사용하여 동시에 분석됩니다. 각 샘플의 출력 값은 각 형광단의 형광 강도 중앙값입니다. 그런 다음 다른 PDL1-Vaxx 유도 항체에 의한 PD1/PD-L1 복합체 형성 억제는 실험 신호를 rhPD-L1과 결합하지 않는 음성 대조군 단클론 항체를 사용하여 생성된 신호와 비교하여 추정합니다(0% 억제). 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
대표적 결과
이 분석은 잠재적인 암 치료제로 연구되고 있는 rhPD-L1 백신 펩타이드에 대해 생성된 4개의 고유한 다클론 항체에 의한 PD-1/PD-L1 상호 작용의 억제를 정밀하게 정량화할 수 있었습니다. 이 분석의 개략도는 그림 1에 나와 있습니다. rhPD-1 접합 비드에 결합하는 비오틴화된 rhPD-L1의 양과 4개의 PLD1-Vaxx 유도 항체 후보에 의한 이 결합의 억제는 rhPD-L1에 직접 결합하는 스트렙타비딘-PE 검출 시약을 사용하여 Reporter Channel 1에서 측정되었습니다(그림 2).
4개의 다클론 항-PDL1-펩타이드 항체 모두 미세구체에 고정된 PD-1과 rhPD-L1의 상호작용을 다양한 범위로 차단했습니다. 다양한 항-PDL1 펩타이드 항체의 억제율은 최대 테스트 농도인 1,000μg/mL에서 48%에서 74% 사이였습니다. 양성 대조군 단클론 항체 아테졸리주맙은 4μg/mL의 최대 테스트 농도14 에서 PD-1/PD-L1 상호작용의 92% 차단을 달성했습니다(그림 2). 모든 실험적 PDL1-Vaxx 항체는 PD-1/PD-L1 시스템과 상호작용할 것으로 예상되지 않은 음성 대조 항체인 트라스투주맙(trastuzumab)과 비교하여 rhPD-1 접합 비드에 대한 rhPD-L1 결합의 농도 의존적 억제를 보여주었습니다.
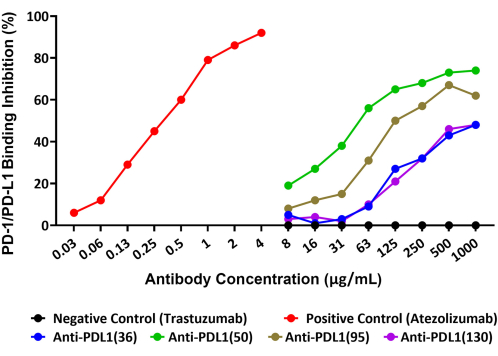
그림 2: 새로운 형광 비드 기반 면역분석법으로 나타난 항-PDL1-펩타이드 항체에 의한 rhPD-1과 rhPD-1의 상호작용 차단. 재조합 인간 PD-1을 자기 마이크로스피어에 결합한 다음 비드를 다른 항-PDL1-펩타이드 항체와 함께 사전 배양한 비오틴화된 rhPD-L1로 배양했습니다. 스트렙타비딘-피코에리트린 검출 시약을 사용하여 비오틴에 결합하고, 따라서 PD-1에 결합할 수 있는 rhPD-L1의 상대적 양을 평가했습니다. PDL1 펩타이드 백신(항-PDL1[36], 항-PDL1[50], 항-PDL1[95], 항-PDL1[130])에 대해 토끼에서 키운 다클론 항체는 억제 활성을 테스트했으며 테스트된 최고 농도에서 재조합 PD-1/PD-L1 상호 작용의 48%-74% 차단을 보여주었습니다. 아테졸리주맙(Atezolizumab, 다른 항-PDL1 단일클론항체)을 양성 대조군으로 사용하였다. 관련 없는 상업용 단클론 항체 트라스투주맙(trastuzumab, anti-HER2)을 음성 대조군으로 사용하였다. 이 그림은 Guo et al.14에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
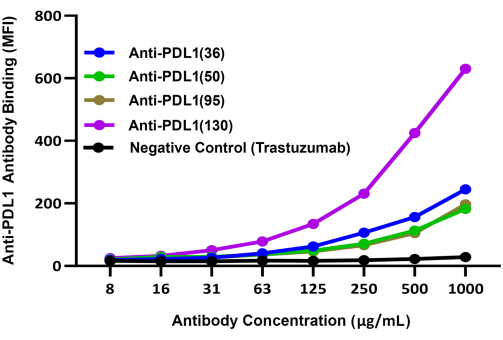
그림 3: rhPD1 코팅된 마그네틱 비드에 복합화된 rhPD-L1에 대한 다양한 PDL1-Vaxx 유도 항체의 결합 비교. 브릴리언트 바이올렛 421 접합 2차 검출 항체를 사용하여 rhPD-1 코팅 비드를 통해 다양한 토끼 다클론 항-PDL1-펩타이드 항체와 rhPD-L1의 결합을 비교했습니다. BV421 청색 형광 신호는 이중 리포터 기기의 리포터 채널 2에 기록되었습니다. 이 신호는 실험용 항-PDL1-펩타이드 항체의 상대적 결합 효율과 상관관계가 있습니다. PD-1/PD-L1과 다른 체크포인트를 표적으로 하는 단일클론항체인 트라스테주맙(trastezumab, anti-HER2)을 음성 대조군으로 사용했다. MFI는 조건별 중복 반응 웰에서 측정된 평균 비드 중앙값 형광 강도를 나타냅니다. 이 그림은 Guo et al.14에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
rhPD-L1과 결합하는 4개의 실험적 PDL1-Vaxx 유도 후보 항체의 상대적 능력은 기기의 두 번째 리포터 채널에서 평가된 별도의 검출 시스템(BV421 접합 항 토끼 IgG)을 사용하여 비교되었습니다. 이러한 결과는 4개의 다클론 항-PDL1-펩타이드 항체 모두가 농도 의존적 방식으로 rhPD-L1에 결합함을 나타냈다14 (그림 3). 항 PDL1(130) 항체는 PDL1-Vaxx 유도 항체 후보 4개 중 가장 높은 rhPDL1 결합 신호를 보였다.
토론
관문관련 암 면역요법의 목적은 종양 생존 및 진행에서 관문단백질과 중요한 리간드 사이의 상호작용을 방해하는 것이다2. 이 연구 그룹은 PD-1/PD-L1 체크포인트 3,8,13,14를 표적으로 하여 차단하는 항체 반응을 유도하는 새로운 PD-1 및 PD-L1 백신을 적극적으로 개발하고 있습니다. 이전에, 재조합 PD1/PD-L1 상호작용의 억제에 대한 항-PDL1-펩티드 항체의 효과를 평가하기 위해 효소 결합 면역흡착 분석(ELISA)의 두 가지 변형을 수행하였다14. (1) 첫 번째 변이체에서 rhPD-L1을 마이크로타이터 플레이트에 코팅한 다음 플레이트에 희석된 항-PDL1 백신 후보 유도 항체로 배양했습니다. 그런 다음 비오틴화된 rhPD-1을 첨가하고 스트렙타비딘-고추냉이 과산화효소 접합체와 비색 기질을 사용하여 고정화된 rhPD-L1에 대한 결합을 정량화하여 항체에 의한 재조합 PD-1/PD-L1 상호작용의 억제를 평가했습니다. 우리는 이것을 직접 봉쇄 분석으로 정의했습니다. (2) 두 번째 변형체에서, PD-1은 마이크로타이터 플레이트에 코팅되었다. 비오틴화된 rhPD-L1은 각각의 항-PLD1 후보 유도 다클론 항체와 함께 별도의 반응 튜브에서 사전 배양되었습니다. 그런 다음 rhPDL1/anti-PDL1 혼합물을 고정화된 rhPD-1을 함유하는 플레이트 웰에 첨가하고 반응시켰습니다. 잠재적으로 차단되는 PDL1-Vaxx 유도 항체의 존재 하에서 고정화된 rhPD-1과 반응한 모든 rhPDL1은 후속 스트렙타비딘-HRP 및 비색 기질 배양을 통해 검출되었습니다. 우리는 이것을 역 봉쇄 분석으로 정의했습니다.
항-PDL1-펩티드 항체에 의한 재조합 PD-1/PD-L1 상호작용의 역 봉쇄는 항체 농도-의존적 방식으로 신호의 억제(즉, PD-1/PD-L1 차단)를 나타냈지만,14 직접 봉쇄 접근법은 일관된 결과를 제공하지 않았다(도시되지 않음). 비드 기반 듀얼 리포터 차단 분석은 ELISA 결과를 검증하고 유동상에서 PD-1/PD-L1 상호 작용의 차단을 조사하기 위해 개발되었으며, 이를 통해 웰 바닥에서 재조합 단백질을 고정화하는 것과 관련된 잠재적인 입체 장애/결합 에피토프 가용성 문제를 제거합니다. 마이크로스피어 분석은 역 봉쇄 분석을 사용한 ELISA 차단 결과와 직접적인 상관관계가 있었습니다(그림 2). 또한 형광 기반 면역분석법은 비색 ELISA18에 비해 향상된 분석 감도와 확장된 동적 범위를 제공할 수 있으며, 또한 다중 비드 기반 분석은 단일 반응 내에서 두 개의 독립적인 면역분석을 동시에 수행할 수 있습니다. rhPD-1에 대한 마이크로스피어의 공유 결합에 사용된 sulfo-NHS 및 EDC는 직접 봉쇄 분석과 역 차단 분석 간에 성능 차이가 나타나고 ELISA와 Luminex 비드 기반 재조합 PD-1/PD-L1 상호 작용 분석 간에 관찰된 감도 차이를 유발할 수 있습니다. 이러한 차이의 원인이 될 수 있는 메커니즘을 연구하기 위해 추가적인 화학 및 분자 수준 조사가 필요합니다.
ELISA14와 비드 기반 분석은 모두 PDL1-Vaxx 유도 항-PDL1 항체가 PD1/PD-L1 체크포인트 복합체 형성을 억제할 수 있음을 보여줍니다. 펩타이드 기반 PDL1-Vaxx는 PD-1/PD-L1 상호작용을 차단할 수 있는 항-PDL1 항체를 성공적으로 유도합니다. 이 접근법은 전임상 동물 연구 3,13,14에 의해 뒷받침되는 암 치료를 위한 새로운 치료 전략이 될 수 있습니다. 계획된 임상시험은 암 환자의 관문 면역 요법 및 질병 통제에 대한 PDL1-Vaxx의 효능을 결정할 것입니다.
공개
Pravin T.P. Kaumaya는 Imugene, Ltd.의 컨설턴트입니다.
감사의 말
저자는 연구 지원을 해준 Luminex Corporation(텍사스 주 오스틴)의 MBA인 Sherry Dunbar 박사와 과학 및 집필 지원을 제공한 Biomedical Publishing Solutions(플로리다주 파나마 시티, mattsilver@yahoo.com)의 Matthew Silverman 박사에게 감사를 표합니다. 이 연구는 미국 국립보건원(National Institutes of Health, R21 CA13508 및 R01 CA84356)과 호주 시드니의 Imugene Ltd(OSU 900600, GR110567 및 GR124326)의 Pravin T. P. Kaumaya에게 수여되었습니다.
자료
| Name | Company | Catalog Number | Comments |
| Buffers | |||
| Activation Buffer: 0.1 M NaH2PO4, pH 6.2 | Millipore/Sigma | S3139 | |
| Assay/Wash Buffer: PBS-TBN (1x PBS, pH 7.4 + 0.1% BSA + 0.05 % (v/v) Tween-20; 0.05% NaN3) | Millipore/Sigma | P3563 (PBS+Tween20), A7888 (Bovine serum albumin), S8032 (sodium azide) | |
| Coupling Buffer: 50 mM 2-morpholinoethanesulfonic acid (MES), pH 5.0 | MilliporeSigma | M2933 | |
| Coupling Reagents | |||
| 1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride (EDC) | ThermoFisher Scientific (Waltham, MA) | 77149 | |
| xMAP Antibody Coupling Kit (if desired), includes: | Luminex Corp. (Austin, TX) | 40-50016 | |
| EDC, 10 mg | |||
| sNHS solution, 250 µL | |||
| Activation/Coupling Buffer: 0.1 M 2-morpholinoethanesulfonic acid (MES), pH 6.0 | |||
| Wash Buffer: 1x PBS, pH 7.4 + 0.1% BSA + 0.05 % (v/v) Tween-20; 0.05% NaN3 (PBS-TBN) | |||
| Sulfo-NHS (N-hydroxysulfosuccinimide) | ThermoFisher Scientific (Waltham, MA) | 24510 | |
| Instrumentation and Ancillary Lab Supplies | |||
| xMAP INTELLIFLEX (dual-reporter instrument) | Luminex Corp. (Austin, TX) | INTELLIFLEX-DRSE-RUO | |
| Low protein-binding round bottom 96-well plate | ThermoFisher Scientific (Waltham, MA) | 07-200-761 | |
| Luminex Magnetic Plate Separator (or comparable) | Luminex Corp. (Austin, TX) | CN-0269-01 | |
| Luminex Magnetic Tube Separator (or comparable) | Luminex Corp. (Austin, TX) | CN-0288-01 | |
| MagPlex Microspheres (magnetic, fluorescent, 6.5-µm-diameter beads) | Luminex Corp. (Austin, TX) | MC-1**** (varies by bead label) | |
| Protein LoBind microcentrifuge tubes | ThermoFisher Scientific (Waltham, MA) | 022431081 | |
| Peptides, Antibodies, & Detection Reagents | |||
| Atezolizumab (humanized anti-PDL1 IgG1 monoclonal antibody), positive control | Genentech/Roche (San Francisco, CA) | n/a (prescription medications) | |
| Biotinylated recombinant human PDL1 | Sino Biological (Wayne, PA) | 10084-H49H-B | |
| Brilliant Violet 421-congugated donkey anti-human IgG | Jackson Immunoresearch Laboratories Inc. (Westgrove, PA) | 709-675-149 | |
| Brilliant Violet 421-congugated donkey anti-rabbit IgG | Jackson Immunoresearch Laboratories Inc. (Westgrove, PA) | 711-675-152 | |
| Recombinant human PD-1 (poly-histidine tagged) | Acro Biosystems (Newark, DE) | PD1-H5256 | |
| Streptavidin-conjugated R-phycoerythrin (SAPE) | Agilent (Santa Clara, CA) | PJRS34-1 | |
| Trastuzumab (Herceptin, humanized anti-HER2 monoclonal antibody), negative control | Genentech/Roche (San Francisco, CA) | n/a (prescription medications) |
참고문헌
- Kaumaya, P. T. B-cell epitope peptide cancer vaccines: a new paradigm for combination immunotherapies with novel checkpoint peptide vaccine. Future Oncology. 16 (23), 1767-1791 (2020).
- Pandey, P., et al. Revolutionization in cancer therapeutics via targeting major immune checkpoints PD-1, PD-L1 and CTLA-4. Pharmaceuticals. 15 (3), 335 (2022).
- Guo, L., Overholser, J., Good, A. J., Ede, N. J., Kaumaya, P. T. P. Preclinical studies of a novel human PD-1 B-cell peptide cancer vaccine PD1-Vaxx from BALB/c mice to beagle dogs and to non-human primates (cynomolgus monkeys). Frontiers in Oncology. 12, 826566 (2022).
- Brahmer, J. R., Hammers, H., Lipson, E. J. Nivolumab: Targeting PD-1 to bolster antitumor immunity. Future Oncology. 11 (9), 1307-1326 (2015).
- Shah, N. J., Kelly, W. J., Liu, S. V., Choquette, K., Spira, A. Product review on the Anti-PD-L1 antibody atezolizumab. Human Vaccines & Immunotherapeutics. 14 (2), 269-276 (2018).
- Postow, M. A., Sidlow, R., Hellmann, M. D. Immune-related adverse events associated with immune checkpoint blockade. The New England Journal of Medicine. 378 (2), 158-168 (2018).
- Kaumaya, P. T. A paradigm shift: Cancer therapy with peptide-based B-cell epitopes and peptide immunotherapeutics targeting multiple solid tumor types: Emerging concepts and validation of combination immunotherapy. Human Vaccines & Immunotherapeutics. 11 (6), 1368-1386 (2015).
- Guo, L., Kaumaya, P. T. P. First prototype checkpoint inhibitor B-cell epitope vaccine (PD1-Vaxx) en route to human Phase 1 clinical trial in Australia and USA: Exploiting future novel synergistic vaccine combinations. British Journal of Cancer. 125 (2), 152-154 (2021).
- Dakappagari, N. K., Douglas, D. B., Triozzi, P. L., Stevens, V. C., Kaumaya, P. T. Prevention of mammary tumors with a chimeric HER-2 B-cell epitope peptide vaccine. Cancer Research. 60 (14), 3782-3789 (2000).
- Dakappagari, N. K., et al. Conformational HER-2/neu B-cell epitope peptide vaccine designed to incorporate two native disulfide bonds enhances tumor cell binding and antitumor activities. The Journal of Biological Chemistry. 280 (1), 54-63 (2005).
- Kaumaya, P. T., et al. Phase I active immunotherapy with combination of two chimeric, human epidermal growth factor receptor 2, B-cell epitopes fused to a promiscuous Tcell epitope in patients with metastatic and/or recurrent solid tumors. Journal of Clinical Oncology. 27 (31), 5270-5277 (2009).
- Bekaii-Saab, T., et al. Phase I immunotherapy trial with two chimeric HER-2 B-cell peptide vaccines emulsified in montanide ISA 720VG and Nor-MDP adjuvant in patients with advanced solid tumors. Clinical Cancer Research. 25 (12), 3495-3507 (2019).
- Kaumaya, P. T. P., Guo, L., Overholser, J., Penichet, M. L., Bekaii-Saab, T. Immunogenicity and antitumor efficacy of a novel human PD-1 B-cell vaccine (PD1-Vaxx) and combination immunotherapy with dual trastuzumab/pertuzumab-like HER-2 B-cell epitope vaccines (B-Vaxx) in a syngeneic mouse model. Oncoimmunology. 9 (1), 1818437 (2020).
- Guo, L., Overholser, J., Darby, H., Ede, N. J., Kaumaya, P. T. P. A newly discovered PD-L1 B_cell epitope peptide vaccine (PDL1-Vaxx) exhibits potent immune responses and effective anti-tumor immunity in multiple syngeneic mice models and (synergizes) in combination with a dual HER-2 B-cell vaccine (B-Vaxx). Oncoimmunology. 11 (1), 2127691 (2022).
- . Luminex Corporation. The xMAP® Cookbook, 5th edition Available from: https://info.luminexcorp.com/en-us/research/download-the-xmap-cookbook?utm_referrr=https%3A%2F%2Fwww.luminexcorp.com%2F (2022)
- MagPlex® Microspheres Documentation. Product information sheet. Luminex Corporation Available from: https://www.luminexcorp.com/magplex-microspheres/#overview (2014)
- Green, M. R., Sambrook, J. . Estimation of cell number by hemocytometry counting. 2019 (11), (2019).
- Selecting the Detection System - Colorimetric, Fluorescent, Luminescent Methods for ELISA Assays. Corning Inc Available from: https://www.corning.com/catalog/cls/documents/application-notes/CLS-DD-AN-458.pdf (2019)
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유