In vitro에서 배양된 포유류 세포에서 ortho -phthaldehyde를 사용한 산화 및 환원 형태의 글루타치온의 신속한 정량화
요약
산화된 글루타치온과 환원된 형태의 글루타치온(각각 GSSG 및 GSH)의 정량화는 오르토프탈알데히드(OPA)를 사용하여 달성되었습니다. OPA는 GSH에 접합되면 고농도 형광성이 되지만 감소될 때까지 GSSG를 접합할 수 없습니다. 여기에서는 정규화를 위해 단백질 정량을 사용하여 두 가지를 모두 정량화하는 다중 파라메트릭 분석에 대해 설명합니다.
초록
글루타치온은 오랫동안 세포의 항산화 반응을 결정하는 핵심 바이오마커로 여겨져 왔습니다. 따라서 활성 산소 종 연구를 위한 주요 마커입니다. 이 방법은 오르토-프탈알데히드( OPA)를 사용하여 글루타치온의 세포 농도를 정량화합니다. OPA는 sulfhydryl 결합을 통해 환원된 글루타치온(GSH)과 접합하여 연속적으로 이소인돌을 형성하여 고형광 접합체를 생성합니다. 산화 글루타치온(GSSG)과 GSH의 정확한 결과를 얻으려면 이 프로토콜에서 구현된 마스킹제와 환원제의 조합이 필요합니다. 치료법은 또한 세포 생존력에 영향을 미칠 수 있습니다. 따라서 단백질 분석을 통한 정규화가 이 다중 파라미터 분석에서 제시됩니다. 이 분석은 GSH에 특정한 0.234 - 30μM(R2=0.9932±0.007 (N=12))의 의사 선형 검출 범위를 보여줍니다. 제안된 분석법은 또한 환원된 글루타티온과 결합하기 위해 마스킹제 N-에틸말레이미드를 첨가하여 산화된 글루타치온을 측정할 수 있으며, 환원제 트리스(2-카르복시에틸) 포스핀을 도입하여 GSSG의 이황화물 결합을 절단하여 두 개의 GSH 분자를 생성합니다. 이 분석은 단백질 정량을 위한 검증된 bicinchoninic acid assay 및 세포 독성 평가를 위한 adenylate kinase assay와 함께 사용됩니다.
서문
활성산소종(ROS)은 산화 스트레스의 주요 유발 인자입니다. 산화 스트레스는 DNA 돌연변이, 세포 노화/사멸, 다양한 암, 당뇨병, 신경 질환(예: 파킨슨병 및 알츠하이머병) 및 기타 여러 생명을 쇠약하게 하는 질환의 생성에 대해 잘 확립되어 있습니다 1,2,3,4,5. ROS에 대한 주요 방어는 티올산, 비효소 항산화제이며, 이는 양성자 공여체 6,7로 작용하여 산화제 또는 라디칼을 감소시킬 수 있습니다. 글루타치온(GSH)과 시스테인은 포유류에서 발견되는 가장 흔한 두 가지 티올이며, 8 다양한 다른 저분자량 티올(예: 에르고티오네인)이 존재하며, GSH와 시스테인은 문헌9,10,11에서 가장 일반적으로 측정된 비효소 항산화제이며 ROS 8,12,13,14와 싸우는 데 가장 큰 관련성을 가지고 있습니다.
GSH가 산화 방지제로 이용될 때, GSH의 2개의 분자는 이황화물 유대를 통해 함께 공유 결합으로 글루타티온 이황화물 (GSSG)를 만들기 위하여 연결됩니다. GSH의 고갈은 종종 산화 스트레스15,16의 지표로 사용됩니다. GSSG는 세포에서 상대적으로 반응성이 있어 다른 단백질 티올과 이황화물 결합 형성을 유발할 수 있기 때문에 세포에서 GSSG의 증가는 종종 활성 내보내기 프로세스에 의해 제한되지만, 이 평가는 GSSG의 검출과 결합될 수도 있습니다16.
GSH 및 GSSG를 측정하는 기존의 방법은 간단한 공정이 아니며 용해 시약을 사용한 세포 추출을 포함한 수많은 단계가 필요합니다17,18. 여기에 설명된 프로토콜은 이러한 방법을 단순화하고 세포 단백질 함량 또는 아데닐레이트 키나아제 방출을 사용하여 비효소 티올을 정확하게 측정하고 정규화할 수 있도록 합니다. 또한 GSH/GSSG 추출 전에 세포 생존율을 측정할 수 있습니다. 여러 방법은 이전에 환원 및 산화된 비효소 티올을 효율적으로 표적화하고 정량화하려고 시도했습니다. HPLC 19,20,21, 플레이트 분석(생화학적) 22,23,24,25의 사용을 포함한 방법 및 5,5-dithio-bis-(2-nitrobenzoic acid)(DTNB/Ellman's reagent)19, Monochlorobimane(mBCI)26,27,28과 같은 티올 접합에 대한 일반적인 시약을 사용합니다.. 몇몇 회사는 또한 글루타티온 검출을 위한 독점 키트를 준비했습니다. 그러나, 그들은 사용된 치료법에 따라 문제를 제기하는 시약 부호환성을 발표하지 않는다29.
이 프로토콜은 오르토-프탈알데히드(OPA) 접합을 통해 환원된 티올(예: GSH)을 검출하여 각각 340/450 Ex/Em에서 검출 가능한 형광 신호를 생성하는 다중 파라메트릭 분석을 간략하게 설명합니다. 이 분석은 마스킹제(N-에틸말레이미드) 및 GSSG 환원제(트리스(2-카르복시에틸) 포스핀)을 사용하여 GSH와 GSSG를 동시에(플레이트에서) 검출할 수 있도록 합니다. 이 다중 바이오마커 프로토콜은 또한 세포 용해 단계에서 최종 측정 완료 시 샘플의 정규화를 위한 bicinchoninic acid assay를 통해 또는 세포 배지의 adenylate kinase assay를 통해 단백질을 정량화할 수 있는 기회를 제공합니다. 이 분석은 대부분의 실험실에서 쉽게 구할 수 있는 여러 시약을 사용하여 수행할 수 있으며 몇 가지 추가적인 일반적이지 않은 화학 물질만 수행하면 됩니다. 이 프로세스는 간단하고 접근하기 쉬우며 힘든 단계 없이 2시간 이내에 수행할 수 있습니다.
이 프로토콜에서는 이전에 ROS를 유도하는 것으로 나타났거나 산화 스트레스30,31을 유도하는 것으로 의심되는 다양한 나노 물질이 선택되었습니다. 다양한 세포주에 대한 이러한 나노 물질의 노출 효과와 항산화 티올을 정량화하는 데 있어 분석의 효과를 확인하기 위해 농도 범위를 조사했습니다.
프로토콜
참고: 다음 프로토콜은 비신코닌산(BCA) 단백질 분석 및 아데닐레이트 키나아제(AK) 분석과 함께 사용하여 샘플을 처리로 정규화할 수 있도록 설계되었습니다. 작업자가 재료 준비 및 사용 전반에 걸쳐 적절한 복장과 Howie 실험실 가운, 니트릴 장갑 및 클래스 I 보안경과 같은 필요한 안전 장비를 착용하고 있는지 확인하십시오. 프로토콜은 여러 단계로 나뉩니다.
1. 재고 및 작업 솔루션 준비
- 1mM HCl에서 100mM GSH 표준물질의 원액을 준비합니다(이중 증류수(ddH2O)에서 37% HCl로 제조).
알림: 37% HCl과 같은 고농도 산에서 희석하는 경우 클래스 I 흄 후드에서 물에 산을 추가하는 올바른 과정을 확인하십시오. - 절대 에탄올에 22.35mM OPA 스톡을 준비합니다. 클래스 I 흄 후드에서 이 단계를 수행합니다. ddH2O에서 25mM N-에틸말레이미드(NEM)를 준비합니다. 클래스 I 흄 후드에서 이 단계를 수행합니다.
참고: 이 세 가지 용액은 -20°C에서 최대 3개월 동안 보관할 수 있습니다. - 0.01 웰에 필요한 500 μL의 총 부피로 0.01 M Tris (2- 카르복시 에틸) 포스 핀 (TCEP)을 준비합니다. ddH2O를 사용하여 100mM 스톡에서 희석한 100mM GSH 표준물질 100μL를 준비합니다.
- 면역침전(IP) 용해 완충액 또는 다음 제형을 사용하십시오: Tris-HCl 394mg(최종 농도 25mM), NaCl 877mg(최종 농도 150mM), EDTA 29mg(최종 농도 1mM), 100% NP-40 또는 IGEPAL CA-630 1mL(최종 농도 1% V/V), 글리세롤 5mL(최종 농도 5% V/V), 84mL의 ddH2O. 부드럽게 교반하여 성분을 혼합하고 pH를 7.4로 조정합니다. 100mL 용량 플라스크에 디캔팅하고 나머지 ddH2O 용량을 추가하여 최종 용량 100mL에 도달합니다. 0.22 μm 필터를 통해 제균 필터를 사용하고 2-8 °C에서 최대 6개월 동안 보관합니다.
참고: 용해 용액은 이 분석에서 오염물/간섭 물질로 작용합니다. 따라서, 위의 제형이 지정됩니다. - 에틸렌디아민 테트라아세트산(PBS-EDTA)이 보충된 0.1M 인산염 완충 식염수 1L를 3가지 pH 값, 특히 7.2, 8.5 및 9.0으로 준비합니다. 1 mM EDTA (292.24 mg / L) 또는 다음 10x (1 L) 제형이 보충 된 상업용 0.1 M PBS 완충액을 사용하십시오 : 80 g NaCl, 2.0 g KCl, 14.4 g Na2HPO4, 2.4 g KH2PO4, 800 mL의 ddH2O. 첨가 및 혼합; 최대 1L까지 충전합니다. 멸균을 위해 용액을 고압 멸균하고 실온에서 12개월 동안 보관합니다. 10x 스톡 용액에서 PBS의 작동 용액을 만들고 EDTA(앞에서 언급한 농도)로 보충합니다.
참고: pH는 매우 중요합니다. 프로토콜을 시작하기 전에 pH가 정확한지 확인하십시오. - ddH2O(1mM, 500μM, 250μM, 125μM, 62.5μM, 31.25μM, 15.625μM 및 7.8125μM)를 사용하여 1mM GSH의 1:2 연속 희석을 수행합니다. 각 농도의 10μL를 표준 웰에 추가합니다(중복 수행). 샘플은 용해 완충액에서 추가로 희석됩니다. 따라서 농도는 나중에 원래 농도의 1/5이 됩니다(200, 100, 50, 25, 12.5, 6.25, 3.125, 1.5625μM).
참고: 보정을 위한 최종 농도는 30μm, 15μm, 7.5μm, 3.75μm, 1.875μm, 937.5nm, 468.8nm 및 234.4nm입니다.
2. 분석 준비
참고: 이 프로토콜은 ATCC에서 상업적으로 구매한 인간 세포주 HepG2, A549 및 J774를 사용합니다. 이 세포주는 대학의 동물 및 조직 배양법 및 규정에 의해 설명된 승인된 지침에 따라 활용되었습니다.
- 분석 시작 24시간 전, 표 1에 나타난 농도의 종자 세포; 그러나 사용되는 세포주/유형 및 처리에 따라 필요에 따라 밀도를 조정하십시오. 10% 열불활성화 태아 송아지 혈청(HIFS), 1% Penstrep(10,000U/mL 페니실린/ 10mg/mL 스트렙토마이신) 및 1% 비필수 아미노산이 함유된 완전 성장 배지(Eagles modified essentials medium(EMEM))에서 세포를 성장시킵니다.
- 기존의 세포 파종 방법을 이용한 세포 종자32. 분석 후 현미경을 사용하지 않는 경우 완전히 검은 색 판에 세포를 종파합니다. 현미경을 통해 사용하기 전에 T75 플라스크의 밀도 및 전반적인 건강 상태에 대해 세포를 평가합니다.
- 깨끗하고 멸균된 2등급 생물 안전 작업대에서 엄격한 무균 기술에 따라 세포 배지를 폐기하고 ~15mL의 멸균, 실온(RT) PBS로 세포를 부드럽게 세척한 다음 폐기합니다.
- 세포 플라스크에 멸균 1x 트립신 5mL를 넣고 세포 단층이 덮이도록 부드럽게 흔들어 준 다음 세포 분리를 용이하게 하기 위해 37°C에서 5분 동안 인큐베이터에 넣습니다.
- 열-불활성화 태아 송아지 혈청(10%), 약 10mL를 함유한 성장 배지를 추가하여 트립신 생성을 중단합니다.
- 세포를 50mL 원심분리기 튜브로 옮기고 5분 동안 200 x g 으로 펠릿합니다. 배지를 버리고 동일한 배지 5mL로 교체합니다. 균질하고 뭉침이 관찰되지 않을 때까지 튜브에 세포를 재현탁시킵니다.
- 20μL의 세포 현탁액을 제거하고 계수를 위해 혈구계에 넣습니다. 필요한 세포 수가 계산되면 희석을 수행하여 올바른 세포 밀도를 가진 용액을 만듭니다.
- 96웰 플레이트(350 μL 용량)에 세포를 포함하는 피펫 미디어, 웰당 최대 부피 200 μL. 5%CO2 가 있는 37°C 인큐베이터에 세포를 24시간 동안 넣어 플레이트 표면에 부착합니다.
- 총 글루타치온과 GSSG를 모두 평가하려면 두 조건 모두에 대한 샘플을 처리하십시오. 6개의 웰을 파종하고 처리하여 GSH 및 GSSG에 각각 2세트씩 3개의 기술 반복을 제공합니다(그림 1 은 레이아웃을 보여줍니다).
- 분석을 시작하기 전에 모든 시약이 적절하게 준비되었는지 확인하십시오. 사용할 때까지 얼음 위에 보관/냉장 보관해야 하는 pH 7.4 PBS(EDTA 없음)를 제외하고 완충액 구성 또는 분석에 사용을 시작하기 전에 모든 완충액 구성 요소와 시약이 RT 상태에 있는지 확인하십시오.
참고: 분석 내에서 원하는 반응이 발생하고 플레이트 리더를 통해 정확한 정량화를 할 수 있도록 기포 형성을 최소한으로 제한하는 것이 매우 중요합니다.
| 세포주 | 파종 밀도(96-well plate) |
| 헵G2 | 10,000 cells/well |
| 대답 549 | 5,000 cells/well |
| 제이774 | 10,000 cells/well |
표 1: 선택한 세포주에 대해 제안된 파종 밀도. 제시된 데이터에 사용된 세 가지 다른 세포주, 특히 A549, J774 및 HepG2에 대한 서로 다른 시딩 밀도가 입증되었습니다.
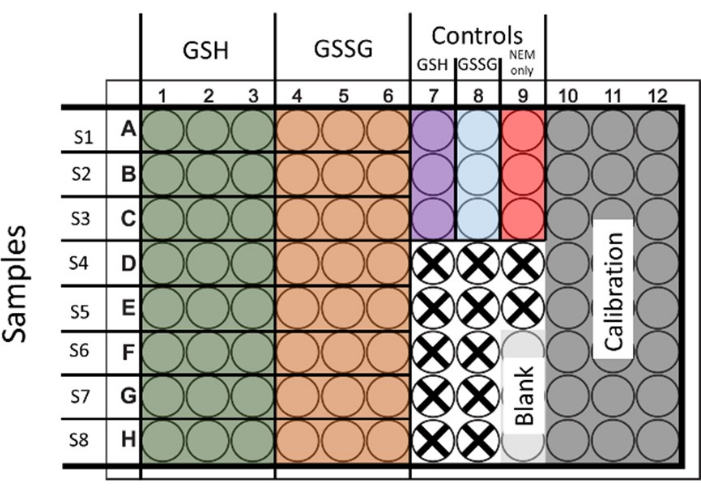
그림 1: 총 글루타치온과 글루타치온 이황화물의 동시 측정을 위한 96개의 웰 플레이트의 파종에 대해 제안된 레이아웃. 교정 및 제어를 위한 웰도 시연됩니다. 사용되지 않는 우물은 십자가로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
3. 나노 물질 처리
- 나노 물질 (특히 ZnO, TiO2, CuO 및 Ag)을 μg 가능 중량 척도로 계량합니다. 나노물질당 1mg/mL의 초기 농도를 얻기 위해 계산을 수행합니다.
- 나노 물질 용액을 초음파 발생기로 옮기고 초음파 처리 bath (38W)를 사용하여 16 분 동안 초음파 처리하여 균질 한 용액을 생성합니다. 125, 62.5, 31.25, 15.625 μg/mL에서 각 나노 물질에 대해 일련의 희석을 만듭니다.
- 인큐베이터에서 세포를 제거하고 RT PBS로 가볍게 세척합니다. 모든 PBS가 제거되었는지 확인한 후 대조군(HIFS가 없는 배양 배지)을 사용하여 플레이트에 100μL의 처리제를 추가합니다. 세포에 처리를 적용한 후 37°C 인큐베이터(5% CO2)에서 4시간 동안 나노물질과 함께 배양합니다. 그런 다음 아래 프로토콜을 사용하여 GSH(GSSG, 단백질 농도 및 AK 방출)를 정량화합니다.
4. 분석 프로토콜
- 치료에 노출된 후(그림 2A) 아데닐레이트 키나아제(AK) 활성(선택 사항)을 통해 생존 가능성을 평가합니다. 제조업체의 지침에 따라 이 분석을 위해 상용 키트를 사용하십시오.
- 200 x g 의 원심분리기에서 플레이트를 5분 동안 회전시켜 펠릿 처리와 세포 파편을 가볍게 제거합니다(그림 2B).
- 각 샘플에서 20μL의 매체 상층액을 부드럽게 제거하고 제어 웰(위에 지정된 대로)과 피펫팅을 동일한 레이아웃 형식으로 인접한 96웰 흰색 플레이트에 넣습니다(그림 2C).
- AK 키트의 작업 용액 100μL를 각 웰에 추가하고 플레이트를 빛으로부터 차폐한 다음 실온에서 10분 동안 현상합니다. 플레이트 리더를 사용하여 1000 counts/s에서 발광을 기록합니다.
- GSH 표준물질의 경우 각 웰에 총 40μL의 글루타치온 완충액을 추가합니다(그림 2D, 옵션, 정량화에 필요).
- 플레이트에 남아 있는 매체를 흡입하고 얼음처럼 차가운 0.1M PBS, pH 7.2로 3번 세척하고 표준을 제외하고 각 세척(그림 2E)을 폐기합니다. GSH 보정이 플레이트에 로드될 때까지 플레이트에 최종 세척을 그대로 두십시오.
- 각 글루타치온 농도 10μL와 블랭크(ddH2O)를 세 번에 걸쳐 웰에 추가합니다.
- 최종 PBS 세척을 제거하고 원하는 목표 정량화를 위해 표 2에 따라 혼합물을 각 웰에 추가합니다(그림 2E). 전체 버퍼가 있는 시간에 민감한 작업 손실로 인해 이 단계를 시작하기 전에 필요한 볼륨을 계산합니다. 분석 과정을 시작하기 전에 이러한 시약 혼합물이 만들어졌는지 확인하되 사용하기 전에 30분 이상 방치하지 마십시오.
- 오비탈 플레이트 셰이커에 놓고 플레이트를 300RPM에서 2분 동안 흔들어 놓습니다(그림 2F).
- Shaker에서 제거하고 NEM 컨트롤 웰을 제외한 각 웰에 5μL의 0.01M TCEP 용액을 추가합니다. 플레이트를 셰이커에 다시 넣고 10분 동안 배양합니다(그림 2F).
- 플레이트를 원심분리기로 옮기고 200 x g 에서 5분 동안 회전시킵니다. 각 샘플 웰에서 25 μL를 다른 96 웰 플레이트(투명)로 옮깁니다. 이것은 단백질 농도에 활용됩니다(단계 4.15 참조; 그림 2G). 표준물질 또는 분석 컨트롤을 이전하지 마십시오.
- 각 웰의 최종 부피가 30μL인지 확인하십시오. 이 요구 사항을 충족하기 위해 제어 및 표준에서 볼륨을 제거합니다(그림 2H).
- 각 웰에 170μL의 작업 OPA 용액을 추가하고 플레이트를 빛으로부터 차폐한 다음 셰이커에 15분 동안 놓습니다(그림 2I).
- Ex340/Em450에서 플레이트 리더를 사용하여 형광을 판독합니다(그림 2J). 측정 단계에서 기포가 없는지 확인하십시오. 이는 반응과 플레이트 리더를 통한 정량화 모두에 해로운 영향을 미칠 것입니다.
- 용해된 세포의 단백질 함량을 정량화하려면 상용 BCA 분석 키트를 사용하십시오. 4.12단계에서 채취한 샘플을 웰당 25μL의 새로운 96웰 플레이트(투명)로 옮깁니다.
- IP 용해 완충액에 희석한 소 혈청 알부민(BSA) 표준물질을 사용하고 웰당 25μL씩 삼중으로 플레이트에 추가합니다. 정확한 농도는 BCA 키트 프로토콜에 정의되어 있습니다.
- BCA 키트에서 시약 A와 B의 50:1 비율로 구성된 작업 용액을 준비하고 샘플, 표준물질 및 대조군이 포함된 각 웰에 200μL를 추가합니다. 플레이트를 빛으로부터 보호하고 37°C에서 30분 동안 배양합니다(그림 2K).
- 인큐베이터에서 샘플을 제거하고 실온에서 5분 동안 평형을 유지한 다음 562nm에서 플레이트 리더를 통해 흡광도를 판독합니다(그림 2L).
| 총 글루타치온 농도 용해 시약 혼합물 | |
| 구성 요소 | 음량 |
| 용해 완충액 | 50μL의 |
| 총 부피 / 웰 | 50μL의 |
| 산화된 글루타치온 농도 용해 시약 혼합물 | |
| 구성 요소 | 음량 |
| 용해 완충액 | 49.5μL의 |
| 넴 (25mM) | 0.5μL |
| 총 부피 / 웰 | 50μL의 |
| 혼합물 조성 후 30분 이내에 두 용액을 모두 사용하십시오. | |
| OPA 탐지 솔루션 구성 요소 | 음량 |
| OPA 3mg/mL | 5μL의 |
| PBS(pH 9.0) | 165μL의 |
| 총 부피 / 웰 | 170μL의 |
표 2: 프로토콜 수행에 필요한 시약의 양. 총 글루타치온, 글루타티온 이황화물 및 필요한 작업 시약을 측정하기 위해 웰당 필요한 부피. 필요한 볼륨이 계산되고 전송을 통한 볼륨 손실을 설명하기 위해 초과분이 포함되는지 확인합니다.
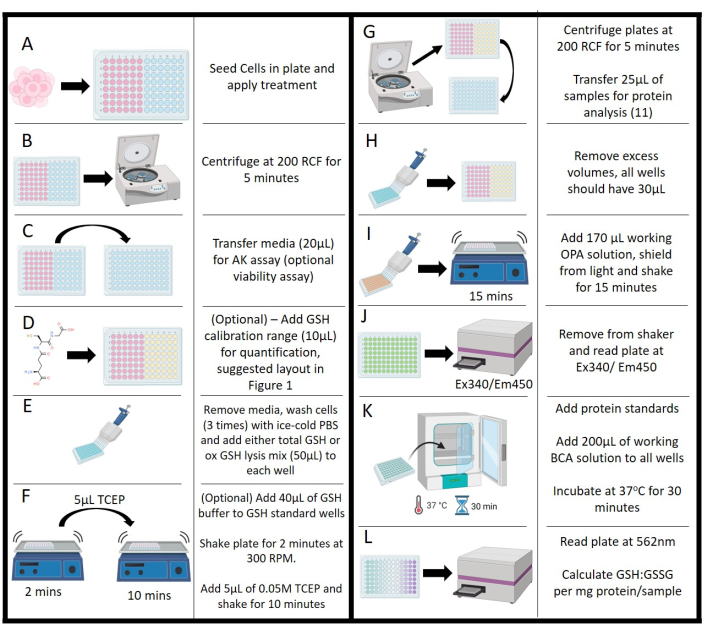
그림 2: 프로토콜의 개략적인 표현. (A) 세포의 초기 파종, 배양 및 처리. (B) 부유 물질로부터 매체를 분리하기 위한 원심분리. (C) Adenylate kinase 분석을 위한 배지 전달. (D) 보정 범위에 대한 글루타치온 농도 추가. (E) 세척 단계 및 용해 시약 첨가. (F) 완충액 첨가 및 진탕 단계로 트리스(2-카르복시에틸) 포스핀 첨가. (G) 단백질 분석을 위한 배지 제거를 위한 용해된 세포의 원심분리. (H) 플레이트 전체의 볼륨을 균등화하기 위한 미디어 제거. (I) 진탕 배양과 함께 ortho-phthalaldehyde 작업 용액의 추가. (J) 플레이트 리더를 통한 오르토-프탈알데히드 형광 측정. (K) 단백질 측정을 위한 Bicinchoninic acid assay를 위한 배양 단계. (L) 단백질 농도 측정, 글루타치온의 정상화 허용: 글루타티온 디설파이드 값. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
대표적 결과
이 프로토콜에 따라 A549 및 J774 세포주를 각각 5,000 cells/well 및 10,000 cells/well의 밀도로 파종하고 37°C에서 5%CO2 에서 48시간 동안 배양했습니다. 나노물질 처리 후 AK 분석은 보충 표 1에 나타내고, 단백질 농도는 보충 표 2에 나타내었다.
캘리브레이션 그래프
그림 3에 표시된 것은 3개의 서로 다른 세포 유형(보정에 영향을 미치지 않아야 함)의 3개의 개별 플레이트에서 명시된 농도 범위(0.234 - 30 μM 최종 농도)를 사용하여 3개의 서로 다른 비연속적인 날에 사용한 3개의 보정입니다. 3개의 샘플이 표시되지만 12의 N이 관찰되었으며 평균 R2 값이 0.9932 ± 0.007인 유사한 선형 회귀를 보여주었습니다.
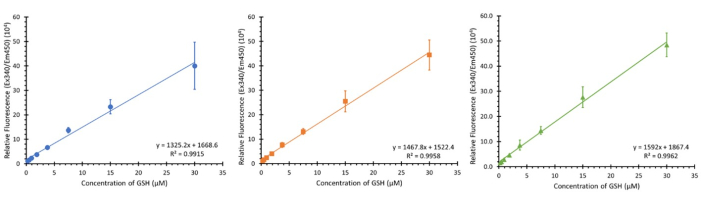
그림 3: 분석을 위한 글루타치온 보정 그래프. 별도의 in-plate 글루타치온 보정 범위의 3개의 보정 그래프, 각각 일주일 간격으로 수행됨; 오차 막대 ± SD (n=3, N=12) n=기술적 복제, N=생물학적 복제. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
샘플 결과
HepG2, A549 및 J774 세포는 산화 스트레스를 통해 세포 메커니즘의 변화를 유도하는 것으로 의심되는 다양한 나노 물질의 평가에 활용되었습니다. 설명된 검출 및 정량화 프로토콜이 활용되었습니다.
3회 측정(AK, BCA 및 GSH/GSSG)에서 수신된 데이터는 다음과 같이 처리되었습니다. AK 및 BCA 분석은 정규화를 위해 구현되었습니다. 권장 키트를 사용하는 AK 분석은 세포 매체로 방출되는 AK의 양에 대한 가장 빠르고 간단한 데이터를 제공합니다. AK 값의 증가는 세포 사멸을 증가시킬 것으로 예상됩니다. 따라서 -ve(Alive) 및 +ve(Dead) 컨트롤이 필요합니다. 이렇게 하면 백분율을 기준으로 정규화가 가능합니다.
BCA 분석은 더 긴 과정이지만 단백질 정량화(mg/mL)를 통해 정량화 가능한 결과를 얻을 수 있습니다. 이것은 AK에서와 같이 -ve 또는 +ve 컨트롤을 필요로 하지 않지만 값의 정규화를 달성하기 위해 일반적인 -ve 컨트롤(처리되지 않은 셀)이 여전히 필요합니다.
이 대표적인 결과 섹션에서는 처리(나노 물질)가 AK 분석에 간섭을 일으킬 가능성이 있음이 밝혀졌습니다. 따라서 모든 정규화는 BCA 데이터를 사용하여 수행되었습니다. 따라서 정보는 단백질 mg/mL당 검출된 종의 농도(GSH 또는 GSH+GSSG(단, GSSG 농도를 얻기 위해 총 GSH+GSSG 농도에서 GSH 농도를 빼는 작업이 수행됨)로 표시됩니다(BCA 분석을 통해). 원하는 경우, 이를 원하는 처리로부터 GSH:GSSG의 변화를 평가하기 위한 비율로 변환할 수 있습니다.
그림 4는 OPA 프로토콜을 사용하여 획득하고 BCA(μg/mL)를 통해 단백질 발현으로 정규화된 세 가지 다른 세포주(A549, J774 및 HepG2)의 GSSG 비율 데이터이며, 추가 GSH 및 GSSG 값을 지정하는 추가 데이터는 보충 그림 1에서 확인할 수 있습니다.
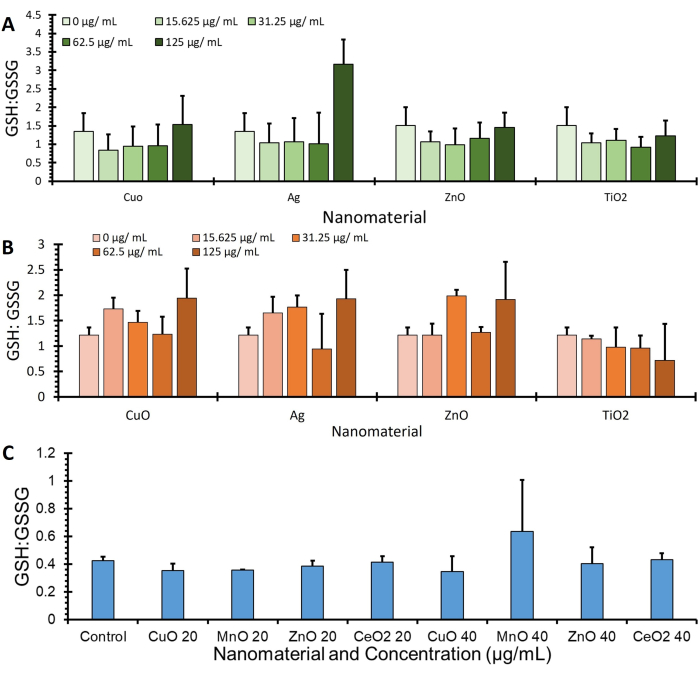
그림 4: 글루타치온: 분석 수행 시 글루타치온 이황화 비율. 글루타치온: 3개 세포주, 즉 (A) A549, (B) J774 및 (C) HepG2의 글루타치온 이황화 비율이 표시됩니다. 세포를 4시간 동안 처리(무혈청 배지의 다양한 나노물질)로 배양했습니다. 이 프로토콜을 사용하여 세포를 처리하여 글루타티온 및 글루타티온 디설파이드의 변화를 정량화하고 단백질 정량화를 통해 정규화, SE의 오차 막대(n=3, N=3)± 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
플레이트에는 분석이 올바르게 실행되었는지 확인하기 위한 일련의 제어 장치도 포함되어 있습니다. NEM은 OPA 검출 미디어와의 상호 작용이 부족함을 보여주기 위해 개별 구성 요소로 추가됩니다. 보정 표준은 GSH 농도에 따른 선형 증가를 보여주며, 이는 OPA 검출 시약이 GSH 농도 증가에 효과적으로 결합할 수 있는 효과적인 용량을 보여줍니다.
이 분석법은 특히 티올에서 일반적으로 발견되는 유리 설프히드릴기(예: GSH, 일반적으로 항산화제로 간주됨)를 표적으로 한다는 점에 유의해야 합니다. 한 가지 잠재적인 상호 작용은 OPA와 단백질 티올의 결합으로, 이로 인해 부정확한 데이터 수집이 발생할 수 있습니다. 따라서 BCA 분석은 데이터를 단백질로 정규화하고 유리 GSH의 정확한 반영을 허용하는 중요한 단계입니다.
보충 그림 1: 글루타치온, 글루타치온 디설파이드 및 글루타티온을 보여주는 그림: 3개 세포주, 즉 (A) A549, (B) J774 및 (C) HepG2의 글루타치온 이황화 비율. 세포를 4시간 동안 처리(무혈청 배지의 다양한 나노물질)로 배양했습니다. 세포는 글루타치온 및 글루타티온 디설파이드의 변화를 정량화하기 위해 이 프로토콜을 사용하여 처리되었으며 단백질 정량화, SE(n=3, N=3)± 오차 막대를 통해 정규화되었습니다 . 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 1: A549 및 J774 세포에 대한 아데닐레이트 키나아제 값의 메타데이터. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 2: A549, J774 및 HepG2 세포에 대한 보정을 통한 Bicinchoninic acid 값의 메타데이터. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
앞서 언급한 바와 같이, 세포 산화 환원을 이해하고, 산화 스트레스 상태를 모니터링하고, 항산화 반응을 모니터링하는 것은 암 및 신경 퇴행과 같은 수많은 질병을 이해하고 예방하는 데 항상 중요했습니다33,34. 여기에서 시연된 것은 빠르고 최소한의 준비로 정확한 GSH: GSSG 검출의 접근성을 높임으로써 중개 환경을 개선하는 수단입니다.
이 프로토콜은 BCA 단백질 분석 및/또는 AK 분석을 통한 2가지 정규화 수단을 사용하여 세포 내 글루타치온/티올 종(환원 및 산화)을 측정하기 위한 다중 파라메트릭 분석 시퀀스를 보여줍니다. 이 분석은 또한 초기 매개체 추출 단계를 통해 다양한 다른 마커를 검출하도록 수정할 수 있으며, 보정 범위를 제외하고 단순히 산화/감소된 티올 비율을 제공하는 방식으로 단순화할 수 있습니다.
분석물질의 평가를 고려할 때 mBCI와 OPA를 모두 탐색하고 사용을 비교했습니다. mBCl은 초기에 우수한 신호 잠재력을 보여주었지만 사용에서 상당한 제한이 발견되었습니다. 주로 살아있는 세포를 사용하는 것이 mBCl을 가장 잘 사용하는 것을 보여줍니다. 그러나, 세포 용해 후에, 신호는 소멸되는 것으로 발견되었고, OPA35에 비해 멀티웰 형식에서 일반적으로 감소된다. 또 다른 문제는 mBCl을 통한 GSSG의 측정인데, 이에 대한 문헌이 부족하고 프로토콜 최적화/탐색을 통해 mBCl을 통한 GSSG의 정확한 감지가 이루어지지 않았습니다.
OPA 분석은 0.234 - 30 μM GSH 농도 범위에서 R2 평균 0.9932 ± 0.007 (N=12)로 상당히 신뢰할 수 있는 보정 범위를 제공한다는 것을 입증했습니다. 이 범위는 문헌35에서 발견되는 이전 참조 범위로 인해 선택되었습니다. 이론적으로 이러한 범위를 벗어난 글루타치온을 검출하는 것이 가능하지만 시약의 농도, 배양 시간 및 검출에 사용되는 장비를 수정해야 할 수 있습니다. 각 플레이트에는 정량화를 위해 자체 표준 범위가 필요하다는 점에 유의해야 합니다. 다른 날에 수행된 플레이트 간의 약간의 시간 차이는 측정 중에 얻은 값에 큰 영향을 미칠 수 있습니다.
이 프로토콜에서 정확하고 신뢰할 수 있는 데이터를 얻는 것은 몇 가지 중요한 단계를 엄격하게 준수하는 데 달려 있습니다. 프로토콜에 필요한 다양한 버퍼를 구성할 때 pH가 정확해야 합니다. 따라서 pH 9를 요구하는 완충액은 이 값의 ± 0.1을 초과하는 편차가 없어야 합니다. 이는 버퍼 성분이 잘못된 pH에서 용액 밖으로 침전될 가능성이 있기 때문입니다. 이 프로토콜을 정확히 따르면 이 문제를 방지할 수 있습니다.
처리를 완전히 제거하고 용해하기 전에 정확한 세척을 하는 것도 플레이트 판독 단계에서 아티팩트와 부정확한 데이터 획득을 방지하는 데 중요합니다. 세포가 용해되면(단계 4.8) 처리를 제거할 수 없으며 플레이트를 회수할 수 없습니다. 프로토콜 전체에 추가되는 완충액/시약의 부피가 샘플과 표준물질 간에 다르기 때문에 사용자가 4.12 및 4.13 단계에서 다양한 부피를 인식하는 것이 중요합니다. 또한 분석 작업자는 이러한 다양한 부피를 인식하고 정확한 측정을 달성할 수 있도록 모든 부피가 동일한지 확인하도록 지시받습니다. 샘플과 표준물질 사이의 부피가 눈에 띄게 크지 않기 때문에 샘플 웰에 과도한 용액이 있는 것과 관련하여 쉽게 실수를 저지를 수 있습니다.
이 프로토콜에는 정확하고 신뢰할 수 있는 데이터를 획득하는 데 중요한 단계에 의존하는 제한 사항이 있습니다. 이 분석을 수행하는 사용자는 기포 형성과 같은 원치 않는 문제를 방지하기 위해 합리적인 수준의 실험실 기술을 보유해야 합니다. 기포 형성은 마이크로플레이트 내에서 반응이 발생하는 용량과 형광 측정 모두에 큰 영향을 미칩니다. 이 프로토콜에 사용된 용해제에는 세제가 포함되어 있어 기포 형성을 방지하는 데 어려움을 겪을 수 있는 초보 연구자에게는 어려움을 겪을 수 있습니다. 즉각적인 원심 분리로 이 오류를 복구할 수 있습니다. 프로토콜은 또한 세포 유형과 관련하여 잠재적으로 제한됩니다. 세포주 A549, J774 및 HepG2는 이 프로토콜에 대한 데이터를 최적화하고 생성하는 데 활용되었습니다. 다른 세포주는 정확한 데이터를 얻기 위해 다른 seeding 밀도와 프로토콜의 최적화가 필요할 수 있습니다.
이 프로토콜은 여러 기존 분석에 비해 많은 이점을 제공합니다. 프탈알데히드를 사용한 티올 검출이 새로운 개념은 아니지만, 필요한 재료와 장비가 제한된 마이크로플레이트에서 이와 같은 결합 분석 형식으로 활용하면 모든 실험실에서 이 프로토콜에 액세스할 수 있는 큰 잠재력을 얻을 수 있습니다. 상업 공급업체의 대부분의 Thiol/GSH 키트는 시약의 구성을 공개하지 않습니다. 따라서 비호환성/간섭의 가능성을 예측하기 어려울 수 있습니다. 여기에서는 이러한 잠재력을 제한하기 위해 사용되는 모든 시약의 각 구성 요소를 제시합니다.
이 프로토콜은 또한 초기 치료 기간이 완료되면 다소 빠르게 수행됩니다. 배양 단계 사이의 사용자 처리를 고려하면 이 프로토콜의 티올 정량 측면은 1시간 이내에 수행할 수 있습니다. 시료는 동시에 용해되고 결합되어 시료의 자동 산화를 방지하며, 이는 이러한 반응 종에 최적입니다. 프로토콜에 명시되어 있지는 않지만, 샘플은 기술적으로 플레이트에 용해되고 밀봉될 수 있으므로 향후 분석을 위해 동결할 수 있습니다. 그러나 프로토콜에 대한 이러한 변경은 검토되지 않았습니다.
공개
저자는 이해 상충이 없음을 선언합니다.
감사의 말
이 연구는 유럽 프로젝트인 GRACIOUS(GA760840)와 SUNSHINE(GA952924)의 지원을 받았습니다. 저자들은 또한 이 프로토콜의 개발에 어떤 식으로든 도움을 준 모든 사람들의 노력에 감사를 표하고 싶습니다.
자료
| Name | Company | Catalog Number | Comments |
| 0.22µm filter (optional-For lysis buffer) | Fisher scientific | 12561259 | |
| 100mL volumetric flask | Fisher scientific | 15290866 | |
| 1L Volumetric flask | Fisher scientific | 15230876 | |
| 250mL beaker (optional-For lysis buffer) | Fisher scientific | 15409083 | |
| 8-Channel micropipette (20-200µL) | SLS | FA10011D2 | |
| 8-Channel micropipette (2-20µL) | SLS | B2B06492 | |
| 96 well plates - black with clear bottom, TC treated | Fisher scientific | 10000631 | Preferred plate for seeding and fluoresence, use TC treated clear if unavailable |
| 96 well plates - clear (TC treated and untreated) | Fisher scientific | 10141161 | If black plates with clear bottom is not available/ suitable use TC treated clear |
| 96 well plates - white, Not TC treated | Fisher scientific | 11457009 | |
| A549 (lung carcinoma) cell line | ATCC | CCL-185 | |
| Absolute ethanol | Merck (Sigma-Aldrich) | 1.08543 | |
| Aluminium foil | Fisher scientific | 11779408 | For protecting plates from light |
| BCA Assay Kit | Thermo | 23225 | |
| Benchtop Centrifuge (with 96 plate rotor) | Eppendorf | 5804 | |
| Ethylenediaminetetraacetic acid (EDTA) | Merck (Sigma-Aldrich) | E9884 | |
| Glutathione (GSH) | Merck (Sigma-Aldrich) | G6013 | |
| Glutathione disulfide (GSSG) | Merck (Sigma-Aldrich) | G4501 | |
| Glycerol | Merck (Sigma-Aldrich) | G5516 | |
| HCl, 37% | Merck (Sigma-Aldrich) | 258148 | Dilute to 1mM for GSH stock, pH adjustment also |
| HepG2 (Hepatocarcinoma) cell line | ATCC | HB-8065 | |
| IGEPAL CA-630 | Merck (Sigma-Aldrich) | 18896 | Use either IGEPAL CA-630 or NP-40 for solution, not both |
| IP lysis buffer | Fisher scientific | 11825135 | |
| J774 (monocyte, macrophage) cell line | ATCC | TIB-67 | |
| KCl | Merck (Sigma-Aldrich) | P3911 | |
| KH2PO4 | Merck (Sigma-Aldrich) | P0662 | |
| Micropipette (20-200µL) | SLS | B2B06482 | |
| Micropipette (2-20µL) | SLS | B2B06478 | |
| Microplate shaker | VWR | 444-0041 | |
| Na2HPO4 | Merck (Sigma-Aldrich) | S9763 | |
| NaCl | Merck (Sigma-Aldrich) | S9888 | |
| NaOH, 10M | Merck (Sigma-Aldrich) | 72068 | For pH adjustment only |
| N-Ethylmaleimide (NEM) | Merck (Sigma-Aldrich) | E3876 | |
| NP-40 | Merck (Sigma-Aldrich) | 492016 | Use either IGEPAL CA-630 or NP-40 for solution, not both. NP-40 alternative suggested |
| Ortho -Phthaldialdehyde (OPA) | Merck (Sigma-Aldrich) | P1378 | |
| PBS 0.1M | Merck (Sigma-Aldrich) | P2272 | PBS can either be acquired pre-made or made in house, see notes |
| Plate reader (with fluoresence capacity) | Tecan | SPARK | |
| Stir bar (optional-For lysis buffer) | Fisher scientific | 16265731 | |
| Toxilight bioassay kit (AK assay) | Lonza | LT17-217 | |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP) 0.5M in H2O | Alfa Aesar | H51864 | Can also be purchased crystalised and suspended |
| TRIS-HCl | Merck (Sigma-Aldrich) | 93363 | |
| X100 phosphatase and protease cocktail | Fisher scientific | 10025743 |
참고문헌
- Barnham, K. J., Masters, C. L., Bush, A. I. Neurodegenerative diseases and oxidative stress. Nat Rev Drug Discov. 3 (3), 205-214 (2004).
- Arfin, S., et al. Oxidative stress in cancer cell metabolism. Antioxidants. 10 (5), 642 (2021).
- Cooke, M. S., Evans, M. D., Dizdaroglu, M., Lunec, J. Oxidative DNA damage: mechanisms, mutation, and disease. The FASEB Journal. 17 (10), 1195-1214 (2003).
- Ghezzi, P., Jaquet, V., Marcucci, F., Schmidt, H. H. H. W. The oxidative stress theory of disease: levels of evidence and epistemological aspects. Br J Pharmacol. 174 (12), 1784-1796 (2017).
- Bhattacharyya, A., Chattopadhyay, R., Mitra, S., Crowe, S. E. Oxidative stress: An essential factor in the pathogenesis of gastrointestinal mucosal diseases. Physiol Rev. 94 (2), 329-354 (2014).
- Yin, F., Sancheti, H., Cadenas, E. Mitochondrial thiols in the regulation of cell death pathways. Antioxi Redox Sig. 17 (12), 1714-1727 (2012).
- Balcerczyk, A., Bartosz, G. Thiols are main determinants of total antioxidant capacity of cellular homogenates. Free Rad Res. 37 (5), 537-541 (2003).
- McBean, G. J. Cysteine, glutathione, and thiol redox balance in astrocytes. Antioxidants. 6 (3), 62 (2017).
- Nimse, S. B., Pal, D. Free radicals, natural antioxidants, and their reaction mechanisms. RSC Adv. 5 (35), 27986-28006 (2015).
- Nordberg, J., Arnér, E. S. J. Reactive oxygen species, antioxidants, and the mammalian thioredoxin system1. Free Rad Biol Med. 31 (11), 1287-1312 (2001).
- Pham-Huy, L. A., He, H., Pham-Huy, C. Free radicals, antioxidants in disease and health. Int J Biomed Sci. 4 (2), 89 (2008).
- Harris, I. S., DeNicola, G. M. The complex interplay between antioxidants and ROS in cancer. Trend Cell Biol. 30 (6), 440-451 (2020).
- Traverso, N., et al. Role of glutathione in cancer progression and chemoresistance. Oxid Med Cell Longev. 2013, 972913 (2013).
- Day, R. M., Suzuki, Y. J. Cell proliferation, reactive oxygen and cellular glutathione. Dose-Resp. 3 (3), 425-442 (2005).
- Aquilano, K., Baldelli, S., Ciriolo, M. R. Glutathione: new roles in redox signaling for an old antioxidant. Front Pharmacol. 5, 196 (2014).
- Zitka, O., et al. Redox status expressed as GSH: GSSG ratio as a marker for oxidative stress in paediatric tumour patients. Onco Lett. 4 (6), 1247-1253 (2012).
- Childs, S., Haroune, N., Williams, L., Gronow, M. Determination of cellular glutathione: glutathione disulfide ratio in prostate cancer cells by high performance liquid chromatography with electrochemical detection. J Chrom A. 1437, 67-73 (2016).
- Giustarini, D., et al. glutathione disulfide, and S-glutathionylated proteins in cell cultures. Free Rad Biol Med. 89, 972-981 (2015).
- Özyürek, M., et al. Determination of biothiols by a novel on-line HPLC-DTNB assay with post-column detection. Analytica Chimica Acta. 750, 173-181 (2012).
- Zhang, L., Lu, B., Lu, C., Lin, J. Determination of cysteine, homocysteine, cystine, and homocystine in biological fluids by HPLC using fluorosurfactant-capped gold nanoparticles as postcolumn colorimetric reagents. J Sep Sci. 37 (1-2), 30-36 (2014).
- Tsiasioti, A., Georgiadou, E., Zacharis, C. K., Tzanavaras, P. D. Development and validation of a direct HPLC method for the determination of salivary glutathione disulphide using a core shell column and post column derivatization with o-phthalaldehyde. J Chromat B. 1197, 123216 (2022).
- Huang, D., Ou, B., Prior, R. L. The chemistry behind antioxidant capacity assays. J Agri Food Chem. 53 (6), 1841-1856 (2005).
- Berker, K. I., Güçlü, K., Tor, &. #. 3. 0. 4. ;., Demirata, B., Apak, R. Total antioxidant capacity assay using optimized ferricyanide/prussian blue method. Food Anal Meth. 3 (3), 154-168 (2010).
- Rahman, I., Kode, A., Biswas, S. K. Assay for quantitative determination of glutathione and glutathione disulfide levels using enzymatic recycling method. Nat Prot. 1 (6), 3159-3165 (2007).
- Kampa, M., et al. A new automated method for the determination of the Total Antioxidant Capacity (TAC) of human plasma, based on the crocin bleaching assay. BMC Clin Pathol. 2 (1), 3 (2002).
- Fernández-Checa, J. C., Kaplowitz, N. The use of monochlorobimane to determine hepatic GSH levels and synthesis. Anal Biochem. 190 (2), 212-219 (1990).
- Nauen, R., Stumpf, N. Fluorometric microplate assay to measure glutathione S-transferase activity in insects and mites using monochlorobimane. Anal Biochem. 303 (2), 194-198 (2002).
- Stevenson, D., Wokosin, D., Girkin, J., Grant, M. H. Measurement of the intracellular distribution of reduced glutathione in cultured rat hepatocytes using monochlorobimane and confocal laser scanning microscopy. Toxicol in vitro. 16 (5), 609-619 (2002).
- McBeth, C., Stott-Marshall, R. J. Interference of reversible redox compounds in enzyme catalysed assays–Electrochemical limitations. Anal Biochem. 662, 114972 (2023).
- Yu, Z., et al. Reactive oxygen species-related nanoparticle toxicity in the biomedical field. Nanoscale Res Lett. 15 (1), 115 (2020).
- Boyles, M., et al. Development of a standard operating procedure for the DCFH2-DA acellular assessment of reactive oxygen species produced by nanomaterials. Toxicol Mech Meth. 32 (6), 439-452 (2022).
- Segeritz, C. P., Vallier, L. Cell culture: Growing cells as model systems in vitro. Basic Sci Meth Clin Res. , 151-172 (2017).
- Ma, Q. Role of nrf2 in oxidative stress and toxicity. Ann Rev Pharmacol Toxicol. 53, 401-426 (2013).
- Calabrese, V., Cornelius, C., Dinkova-Kostova, A. T., Calabrese, E. J., Mattson, M. P. Cellular stress responses, the hormesis paradigm, and vitagenes: novel targets for therapeutic intervention in neurodegenerative disorders. Antioxid redox Signal. 13 (11), 1763-1811 (2010).
- Ishkaeva, R. A., Zoughaib, M., Laikov, A. V., Angelova, P. R., Abdullin, T. I. Probing cell redox state and glutathione-modulating factors using a monochlorobimane-based microplate assay. Antioxidants. 11 (2), 391 (2022).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유