진균 및 바이러스성 병원체에 대한 숙주 면역의 항원 특이적 분석을 위한 이중 공동 자극을 사용한 전혈 분석
* 이 저자들은 동등하게 기여했습니다
요약
전혈 기반 면역분석은 진단 및 연구 목적으로 항원 특이적 면역을 분석할 수 있는 간편하고 자원 효율적인 도구를 제공합니다. 이 기사는 소아 환자 및 소동물을 위한 소량 버전을 포함하여 진균 및 바이러스성 병원체에 대한 숙주 면역의 포괄적인 분석을 위해 이중 공동 자극을 갖춘 최적화된 전혈 기반 프로토콜을 제공합니다.
초록
빠르고 자원 효율적인 시료 처리, 높은 처리량 및 높은 견고성은 고급 항원 특이적 면역분석의 효과적인 과학 및 임상 적용에 매우 중요합니다. 전통적으로 이러한 면역분석법, 특히 유세포분석법 또는 효소 결합 면역흡착 반점 분석에 의한 항원 특이적 T세포 분석은 말초 혈액 단핵 세포의 분리에 의존하는 경우가 많습니다. 이 과정은 시간이 많이 걸리고, 많은 사전 분석 교란 요인이 발생할 수 있으며, 많은 양의 혈액이 필요합니다. 전혈 기반 분석은 향상된 사전 분석 견고성과 더 낮은 혈액량 요구 사항을 갖춘 손쉬운 대안을 제공합니다. 또한 전혈 기반 분석을 통해 분리된 세포 subset을 사용하는 분석으로 포착되지 않는 세포 간 상호 작용을 보존할 수 있습니다. 최근에는 다양한 진균 및 바이러스 항원에 반응하여 항원 특이적 T 세포 기능과 복잡한 세포 간 상호 작용을 종합적으로 분석하기 위해 이중 anti-CD28 및 anti-CD49d 동시 자극을 이용한 정제된 전혈 면역분석법이 제안되고 있습니다. 이 프로토콜은 자극 튜브 준비, 혈액 자극 및 유세포 분석, 사이토카인 분비 분석 및 전사 분석을 위한 다운스트림 샘플 처리에 대한 지침을 제공합니다. 여기에는 소아 환자를 대상으로 한 연구 또는 소동물(예: 생쥐)을 대상으로 한 전임상 연구에서 유세포 분석 및 사이토카인 기반 T 세포 모니터링에 더 쉽게 접근할 수 있도록 하는 검증되고 기능적으로 동등한, 이전에 발표되지 않은 저용량 프로토콜(250 μL)이 포함됩니다. 전체적으로 이러한 프로토콜은 임상 및 중개 연구 환경 모두에서 복잡한 항원 특이적 면역 분석을 위한 다목적 도구 상자를 제공합니다.
서문
항원 특이적 면역, 특히 특이 T 세포 반응의 정량화 및 특성 분석은 면역생물학 및 백신 접종 연구뿐만 아니라 일부 진단 검사에서도 중추적인 역할을 합니다. 전통적으로 항원 특이적 면역분석은 일반적으로 분리된 말초 혈액 단핵 세포(PBMC)에 의존했습니다. 그러나 이러한 세포를 분리하는 것은 시간과 자원이 많이 소요되며 종종 상대적으로 많은 혈액량이 필요합니다. 또한, 분석 전 보관 중 과립구 활성화 및 그에 따른 T 세포 교란을 방지하기 위해1 샘플의 신속한 처리가 가장 중요한데, 이는 임상 실습에서 실현 불가능한 경우가 많습니다. 이러한 한계는 고처리량 연구 시나리오 및 임상 루틴에서 항원 특이적 면역분석법의 실용성을 저해합니다. 따라서 최근 몇 년 동안 사용하기 쉽고 잠재적으로 자동화 가능한 전혈 기반 접근법의 개발은 면역분석 응용 분야의 새로운 영역을 열었습니다. 그러나 현재 상업적으로 이용 가능한 시스템은 일반적으로 T 세포를 위한 최적의 공동 자극 환경이 부족하고 사전 분석 지연에 취약합니다. 예를 들어, 널리 사용되는 전혈 기반 IFN-γ 방출 분석은 사전 분석 혈액 저장 6시간 후 19%의 양성에서 음성 복귀율을 보입니다2. 이러한 한계를 극복하기 위해 이중 anti-CD28 및 anti-CD49d 동시 자극을 가진 최적화된 프로토콜이 개발되었습니다 3,4,5,6.
여기에 제시된 프로토콜은 항원 특이적 T 세포의 정확하고 재현성 있는 정량화 및 특성 분석, 항원 유도 사이토카인 반응 평가 및 최소 혈액량, 즉 자극 튜브당 500μL의 혈액에서 기타(유세포 분석 또는 전사) 기능 면역 마커를 가능하게 합니다. 이 프로토콜의 또 다른 장점으로는 짧은 수작업 시간, 분석 전 교란 요인에 대한 높은 복원력, 상대적으로 생리적인 생체 외 환경에서 기능적 세포 간 상호 작용의 보존 등이 있습니다. 전혈 기반 유세포 측정 항원 특이적 T 세포 특성 분석과 기존 PBMC 기반 분석에서 생성된 데이터의 비교 가능성은 이전에 곰팡이 특이적 T 세포 정량화의 맥락에서 입증되었습니다6. 또한, 피험자의 혈액에 대한 직접적인 자극은 최적의 PBMC 자극을 위해 일반적으로 필요한 자가 혈청, 동종 혈청 또는 이종 혈청을 보충할 필요성을 없애줍니다. 세포 분리를 생략하면 전단 및 온도 스트레스가 감소하여 세포 생존력이 향상됩니다. 가장 중요한 것은 전혈 기반 분석법이 PBMC의 분리를 위한 그래디언트 원심분리 중에 손실된 과립구 집단을 보존한다는것입니다 7. 따라서 이 분석 설정은 과립구와 단핵 세포 사이의 기능적 상호 작용 루프를 보존하고 캡처합니다4.
주목할 점은 이 프로토콜은 다양한 판독 방식을 수용하기 위해 최소한의 수정만 필요하며 동일한 자극 튜브에서 사이토카인 방출 및 전사 반응의 이중 분석도 가능하다는 것입니다. 특히, 자극 후 배양 상층액에서 사이토카인을 분석하는 반면, 세포 펠릿은 후속 전사체 분석을 통해 RNA 분리에 사용할 수 있습니다. 다양한 판독 방식에 대한 일반적인 작업 흐름은 그림 1에 요약되어 있습니다.
최근 몇 년 동안 Mycobacterium tuberculosis 8,9, Bordetella pertussis3, Orientia tsutsugamushi10 및 SARS-CoV-2 5,11,12와 같이 연구 및 임상 환경에서 병원체 반응 면역 모니터링을 위해 점점 더 많은 전혈 기반 분석법이 개발되고 있습니다. 예를 들어, M. tuberculosis, Influenza A 바이러스 및 SARS-CoV-2를 포함한 여러 항원에 대해 이전에 확립된 시스템이 사용되었지만, T-helper(Th) 세포 자극에 최적화된 공동 자극 인자는 사용하지 않습니다 13,14,15. 이러한 분석에 필요한 혈액량은 기존의 PBMC 기반 분석법 또는 상업적으로 이용 가능한 전혈 자극 키트에 사용되는 혈액량보다 이미 현저히 낮지만, 소아과, 신생아학, 중환자실(ICU) 환자 및 소동물 모델의 전임상 연구에 적용하기 위해 훨씬 더 적은 샘플 부피가 보장될 수 있습니다. 예를 들어, 생쥐에서 말단 혈액 샘플링 (예 : 심장 천자)조차도 일반적으로 최대 0.7-1mL의 혈액을 생성합니다. 따라서 자극 튜브당 250μL의 혈액량에서 항원 반응성 T 세포 반응의 정확한 정량화 및 특성화를 위해 이전에 확립된 전혈 기반 면역분석 프로토콜 4,6을 더욱 축소할 수 있는 가능성이 이 프로토콜의 일부로 평가되었습니다.
프로토콜
뮌헨 루트비히 막시밀리안 대학교(Ludwig Maximilians University Munich)의 윤리 위원회(프로젝트 번호 21-0689)는 인간 혈액 샘플 수집을 승인했습니다. 또한 대표 데이터 세트의 일부는 뮌헨 루드비히 막시밀리안 대학교 윤리 위원회의 승인을 받은 Corona-Register-Study 번호 20-426에 따라 생성되었습니다. 정보에 입각한 동의를 얻었습니다.
1. 전혈 자극 튜브의 준비
참고: 이 단계는 Lauruschkat et al.4 및 Weis et al.6에서 조정되었습니다. 표 1 은 자세한 시약 농도 및 부피를 요약한 것입니다.
- 멸균 조건(멸균 작업대)에서 항원 및 공동 자극 항체가 있는 항응고제가 없는 2.7mL 혈액 수집 튜브를 준비합니다. 네거티브 컨트롤을 포함하여 각 튜브에 α-CD28 1μg/mL와 α-CD49d 1μg/mL를 추가합니다. 최종 농도(250 μL 또는 500 μL)를 결정할 때 전혈 자극을 위해 추가할 혈액량을 고려하십시오. 챔버 구조와 시료 접근성을 유지하려면 혈액 수집 튜브에서 플런저를 집어넣지 마십시오.
- 연구 설계에 따라 음성 대조 튜브에 추가 자극이 없어야 하는지( 표 1과 같이 자극되지 않은 배경 대조군) 또는 연구 코호트가 항원 특이적 T 세포를 보유하지 않거나 최소한으로 보유해야 하는 항원을 사용해야 하는지(예: HIV 음성 혈청 개체의 HIV 펩타이드 풀 16).
- 항원 특이적 자극의 경우, 예비 실험에서 적정을 통해 이상적인 항원 농도를 최적화합니다. 아래의 대표 데이터를 생성하려면 1.2 μg/mL HSV-1 용해물, 0.6 nM/펩타이드/mL CMV pp65, 0.6 nM/펩타이드/mL SARS-CoV-2 Prot_S, 50 μg/mL Aspergillus fumigatus lysate 및 1 ng/mL CRX-527과 같은 최적화된 항원 농도를 사용하십시오.
- 특히 림프구 감소증 환자 또는 면역억제 약물 요법을 받는 환자를 대상으로 한 연구의 경우 양성 대조군을 포함합니다. 거대세포바이러스, 파라인플루엔자 바이러스, 인플루엔자 바이러스 펩타이드로 구성된 CPI 양성 대조 용액(0.6 nM/펩타이드/mL)을 사용합니다.
참고: 대안적으로, PMA(10 μg/mL) ± ionomycin(1 μg/mL)과 같은 합성 자극을 사용할 수 있지만, 이는 생리적 반응을 덜 유발하고 유세포 분석의 집단 마커로 일반적으로 사용되는 표면 항원의 발현에 영향을 미칠 수 있습니다(특히 CD417). 공동 자극 항체는 대부분의 합성 양성 대조 자극과 함께 필요하지 않으며 세포 생존 능력과 반응성에 부정적인 영향을 미칠 수도 있습니다. - 모든 자극 튜브에서 시약 부피를 일치시키려면 RPMI 1640 배지를 다음 총 부피까지 추가하십시오: 유세포 분석을 위한 전체 크기 분석: 50 μL; 사이토카인 분석 및 전사체학을 위한 전체 크기 분석: 500 μL; 유세포 분석을 위한 소규모 분석: 25 μL; 사이토카인 분석 및 전사체학을 위한 소규모 분석: 250 μL.
알림: 여러 세트의 자극 튜브를 준비하는 경우 오염 위험이 낮고 공동 자극 요인 및 자극의 양이 적기 때문에 모든 성분을 포함하는 마스터 믹스를 준비하는 것이 좋습니다. - 준비된 튜브를 즉시 사용하거나 -20°C에서 냉동 보존하십시오. 대부분의 시약은 최대 4주 동안 보관할 수 있습니다. 그러나 새로운 시약/자극에 대한 최대 보관 기간을 사전 검증합니다.
2. 전혈 샘플의 자극 및 배양
- 전혈 자극을 받기 약 30-60분 전에 바로 사용할 수 있는 자극 튜브를 해동하고 실온에 보관합니다.
- 리튬 헤파린 항응고제가 있는 혈액 수집 튜브를 사용하여 기증자/환자의 정맥혈을 수집합니다. 수집된 혈액량이 개별 실험 요구 사항, 즉 음성 및 양성 대조를 포함한 소규모 분석의 750가지 조건에 대해 최소 3μL가 필요한지 확인합니다. 상업적으로 획득한 혈액 수집 튜브의 경우 16 - 25 IU/mL 혈액의 헤파린 작동 농도를 달성하기 위해 완전히 채우십시오.
참고: 대표 데이터셋을 생성하기 위해 모집된 건강한 성인 피험자의 인구통계학적 데이터는 표 2에 나와 있습니다. - 필요한 양의 헤파린화 전혈(각각 소규모 또는 전체 크기 분석의 경우 250μL 또는 500μL)을 멸균 작업대 아래에서 피펫팅하여 자극 튜브로 옮깁니다.
참고: 멸균 작업대를 사용할 수 없거나 감염 위험이 최소화된 샘플(즉, 사전 선별된 인간 피험자 또는 동물의 혈액)로 작업할 때 멸균 주사기를 사용하여 샘플을 자극 튜브로 옮길 수 있습니다. 또한 이 방법을 사용하면 채혈 직후 병상에서 시료를 처리할 수 있어 사전 분석 보관 및 T 세포 손상을 최소화할 수 있습니다. 혈액을 주입하기 전에 채혈 튜브와 모든 자극 튜브의 고무 씰을 알코올 소독제로 광범위하게 소독하십시오. 소독제를 최소 1분 동안 건조시키십시오. - 자극 튜브를 5x-10x 조심스럽게 뒤집습니다. 자극 튜브를 37°C 인큐베이터에 넣습니다. CO2 인큐베이터는 필요하지 않습니다. 비특이적 호중구 활성화를 방지하려면 채혈 튜브를 냉장 보관하지 마십시오.
참고: 이 프로토콜은 검체 운송을 허용하기 위해 실온에서 최대 8시간의 사전 분석 혈액 보관에 대해 검증되었습니다. 가능하다면, 공동 자극 인자가 림프구 생존력을 향상시킬 것이기 때문에, 수집 부위의 자극 튜브에 전혈을 주입하고 자극 튜브의 중앙 실험실로 혈액을 운반하는 것이 바람직하다(18,19). - 세포 내 염색이 있는 유세포 분석에 사용되는 샘플의 경우에만 4시간 배양 후 각 자극 튜브에 brefeldin A(최종 농도 10μg/mL)를 추가합니다.
- RPMI에서 1mg/mL 브레펠딘 A 용액을 준비하고 100μL 시료 부피당 1μL의 용액을 추가합니다(즉, 사전 혼합 자극 칵테일 + 전혈량). 튜브의 뚜껑을 열고 멸균 작업대 아래에서 피펫팅하여 brefeldin A를 추가합니다. 캡슐을 다시 잡고 37°C 인큐베이터로 37°C에서 16-18시간(총 20-22시간) 동안 다시 넣습니다.
- 사이토카인 분비 분석 또는 전사 분석의 경우 브레펠딘 A를 첨가하지 말고 37°C에서 24-26시간 동안 샘플을 지속적으로 배양하십시오.
참고: Brefeldin A는 Golgi 장치를 억제하여 사이토카인 분비 및 세포 표면으로의 단백질 수송을 중단합니다. 분비 또는 표면 발현은 궁극적으로 재내재화 후 각각 단백질 손실 및 분해를 초래하기 때문에 엑소사이토시스 억제제는 유세포 분석 연구를 위한 사이토카인 및 일부 활성화 마커(예: CD154)의 세포 내 축적 및 염색에 필수적입니다. 그러나 브레펠딘 A는 또한 전사체에서 볼 수 있는 생리학적 세포 과정을 방해하고 배양 상층액20,21의 사이토카인 분비 분석을 무효화하므로 이러한 판독을 병렬로 수행하기 위해 두 개의 별도 시험관(브레펠딘 A가 있는 시험관과 없는 시험관)을 사용해야 합니다.
3. 유세포 분석을 위한 시료 준비
- 각 자극 튜브에 500μL의 0.5M EDTA 용액을 추가하고 실온에서 15분 동안 샘플을 배양하여 튜브 표면에서 부착 세포를 분리합니다.
- 시료를 새로운 15mL 원심분리기 튜브로 옮깁니다. 자극 튜브를 1mL의 적혈구 용해 완충액으로 헹구어 남아 있는 혈액 세포를 채취한 다음 완충액과 세포를 동일한 15mL 원심분리 튜브에 추가합니다.
- 15mL 튜브를 600 x g에서 7분 동안 원심분리합니다. 상층액을 조심스럽게 버리십시오.
- 혈액 세포 펠릿을 적혈구 용해 완충액에 재현탁시킵니다(그림 2A). 전혈 500μL에는 적혈구 용해 완충액 5mL를, 전혈 250μL에는 3mL를 사용합니다.
참고: 사용된 특정 완충액(자체 또는 상용 제품)에 대해 최적의 적혈구 용해 조건을 사전 평가해야 합니다. 여기에 제공된 지침은 재료 표에 나열된 적혈구 용해 완충액에 맞게 최적화되었습니다. - 샘플이 투명해질 때까지 실온에서 샘플을 배양합니다(그림 2B). 과립구 용해 및 응집을 방지하려면 배양 시간이 6분을 초과하지 마십시오. 성공적인 적혈구 용해의 지표는 유체를 통해 15mL 튜브의 숫자와 스케일을 볼 수 있는 능력입니다(그림 2C).
- 15mL 튜브를 600 x g에서 7분 동안 원심분리합니다. 상층액을 조심스럽게 버리고 세포 펠릿이 여전히 눈에 띄게 빨간색이면 3.4-3.5단계를 반복합니다.
- 세포 펠릿을 1mL의 HBSS에 재현탁시키고 세포를 2mL 반응 튜브로 옮깁니다.
- 2mL 튜브를 400 x g에서 5분 동안 원심분리합니다. 상층액을 조심스럽게 버리십시오.
- 세포내 염색 키트 및 사용된 항체에 대한 제조업체의 지침에 따라 유세포 분석을 수행합니다.
참고: 대표 데이터셋을 생성하는 데 사용된 항체 패널은 표 3에 요약되어 있습니다.
4. 사이토카인 분석을 위한 시료 준비
- 2.6단계 후 자극 튜브에서 희석된 혈액을 1.5mL 튜브로 옮깁니다.
- 1.5mL 튜브를 2000 x g에서 20분 동안 원심분리합니다. 상층액을 새 1.5mL 튜브에 조심스럽게 피펫팅하고 사이토카인 분석에 즉시 사용하거나 -80°C에서 상층액을 냉동 보존합니다.
- 상층액을 ≥ 7000 x g (1.5mL 튜브 내)에서 5분 동안 다시 원심분리하여 분석 전, 특히 해동 후에 잔류 세포 파편을 제거합니다. cytokine assay 프로토콜에 따라 샘플의 사전 희석을 수행합니다.
- 세포 펠릿을 1mL의 RNA 보호 완충액에 재현탁시키고 후속 RNA 분리를 위해 -80°C에서 냉동 보존합니다. 또는 RNA 분리 키트(또는 자체 프로토콜)에 대한 지침에 따라 즉각적인 RNA 분리를 위해 세포 펠릿을 용해 완충액에 재현탁시킵니다.
참고: 필요한 경우 후속 RNA 처리 프로토콜에 따라 RNA 보호 버퍼를 추가하기 전에 3.4-3.5와 유사한 적혈구 용해 단계를 추가할 수 있습니다.
결과
병원체 관련 항원을 사용한 전혈 자극 후 항원 특이적 면역 반응의 다중 모드 분석
대표 데이터 세트를 생성하기 위해 SARS-CoV-2 백신 접종을 받은 HSV-1 및 CMV 혈청 양성인 건강한 성인 기증자를 선택했습니다. 자극되지 않은 대조군 외에도 위에서 설명한 대로 다음과 같은 자극이 사용되었습니다: 단순 헤르페스 바이러스 1(HSV) 용해물(제조업체 권장, 미공개 데이터), 거대세포바이러스(CMV)pp65 22, 중증 급성 호흡기 증후군 코로나바이러스 2(SARS-CoV-2)Prot_S 5,23, 아스페르길루스 푸미가투스 용해물(유비쿼터스 환경 병원체)4,24, CRX-527(지질다당류를 기반으로 하는 톨 유사 수용체 4 자극제로, 그 자체로 T 세포를 활성화해서는 안 됨)25 및 CPI(CMV, 파라인플루엔자 바이러스 및 인플루엔자 바이러스 펩타이드로 구성된 CD4+ T 세포 활성화에 대한 양성 대조군)26. 유세포 분석 데이터와 gating 전략은 그림 3에 나와 있습니다. 일반적으로 희귀 세포 집단(50,000 - 100,000 lymphocytes)을 표적으로 삼을 때 가능한 한 많은 림프구를 측정하는 것이 권장되며, 측정의 정밀도와 신뢰성은 총 이벤트 수에 따라 달라진다27. 자극되지 않은 샘플은 개별 세포 subset(예: CD3+CD4+ 세포)의 gating에 사용됩니다. 메모리 T-세포 표현형을 위한 CD45RO 및 CCR7의 게이트는 전체 CD3+CD4+ 집단에서 설정한 다음 활성화 마커 양성 집단으로 전달되어야 하는데, 후자의 낮은 이벤트 수는 종종 뚜렷한 집단의 명확한 식별을 방해하기 때문입니다. 예를 들어 림프구 생존율의 차이를 설명하기 위해 개별 게이트에 대해 약간의 조정이 필요할 수 있습니다. CD154 (또는 CD40 리간드)의 상향 조절은 글로벌하고 일관되며 빠르게 유도 된 T-helper cell activation marker28,29로 설명되었습니다. IFN-γ은 가장 두드러진 1형 특이적 T 세포 활성화 마커 중 하나로 간주됩니다30,31. 중요한 것은 이 분석이 다양한 추가 활성화, 탈진 및 사이토카인 마커와 함께 테스트 및 발표되었다는 것입니다(표 4 및24 참조).
자극되지 않은 샘플에서 활성화 마커 양성 집단의 빈도는 비특이적 배경을 나타내며 항원 자극 빈도에서 차감되었습니다. 비특이적 배경을 뺀 후, 대표 공여자는 각각 0.75%(HSV), 0.09%(CMV), 0.06%(SARS-CoV-2), 0.34%(A. fumigatus), 0.00%(CRX-527) 및 1.21%(CPI) 특이 CD154+/CD3+CD4+ T-도우미 세포를 가지고 있었습니다. IFN-γ 발현도 유사하게 분석할 수 있으며, 그 결과 0.12%(HSV), 0.07%(CMV), 0.03%(SARS-CoV-2), 0.04%(A. fumigatus), 0%(CRX-527) 및 0.74%(CPI) IFN-γ+/CD3+CD4+ 세포가 생성됩니다.
T 세포 집단은 naive T 세포 (TN, CD45RO-CCR7+), 중앙 기억 T 세포 (TCM, CD45RO+CCR7+), 효과 기억 T 세포 (TEM, CD45RO+CCR7-) 및 효과 T 세포 (및 CD45RA, TE/TEMRA, CD45RO-CCR7-를 재발현하는 효과 기억 T 세포)로 더 세분화 할 수 있습니다. 전 세계 CD3+CD4+ T 세포 중 대표 공여체는 비자극 샘플을 사용하여 측정한 바와 같이 각각 38.34%의 TN, 38.33%의 TCM, 20.77%의 TEM 및 2.56%의 TE/TEMRA를 가지고 있었습니다(그림 3A). 그러나 항원 특이적 반응성 T-helper 세포(CD154+IFN-γ+) 중에서는 TCM과 TEM이 각각 22.14%와 73.97%로 가장 두드러진 부분집합이었다.
추가적인 백혈구 집단에 대한 데이터는 이 방법론을 사용하여 이전에 발표된 바 있다24. 사용된 항체 조합은 추가 참조를 위해 표 4 에 제시되어 있다.
또한 이 방법론의 잠재력을 최대한 발휘하기 위해 두 번째 자극 샘플 세트에 대해 IFN-γ ELISA를 수행했습니다(brefeldin A를 추가하지 않음). IFN-γ ELISA 키트의 검출 범위를 초과하는 것을 방지하기 위해 CPI 자극 샘플의 혈장을 1:4로 사전 희석했습니다. 다음 IFN-γ 농도를 측정하고 피험자의 혈액량의 mL당 정규화했습니다(즉, 자극 튜브와 ELISA 전 희석 모두에서 희석을 위해 보정됨: 0pg/mL(비자극), 69.4pg/mL(HSV), 471pg/mL(CMV), 17.8pg/mL(SARS-CoV-2), 61.9pg/mL(A. fumigatus), 34.0pg/mL(CRX-527) 및 1958pg/mL(CPI).
마지막으로, RNA는 일관된 결과로 동일한 샘플에서 분리되었습니다. 평균 수율은 719ng였으며 평균 흡광도는 260nm/280nm이며 1.98입니다.
전체적으로, 이 데이터 세트는 제시된 프로토콜이 최소 혈액량, 즉 다중 자극 및 판독 양식에 대해 총 8mL를 사용하여 다양한 감염 관련 항원의 다면적 판독 스펙트럼 및 수반 분석을 허용한다는 것을 보여줍니다.
항원 자극 전혈을 사용하여 백신 접종 반응을 추적하기 위한 전사 분석을 위한 대표 데이터 세트
항원 자극 전혈에 대해 수행된 전사 연구에 대한 원칙 증명으로, BNT162b2(SARS-CoV-2 mRNA 백신)32,33 초기 2회 접종 백신 시리즈 후 7-9개월 후 첫 번째 부스터 백신 접종 직전과 1개월 후 9명의 건강한 성인 피험자로부터 혈액을 수집했습니다. 500 μL의 무자극 및 Prot_S 자극 전혈의 평균 RNA 수율은 1.1μg의 고순도 RNA였으며 평균 260/280 흡수 비율은 1.99였습니다. nCounter 분석 후, RNA 수는 패널의 12개 하우스키핑 유전자(기하 평균)로 정규화되었습니다. 그 후, Prot_S-자극된 샘플과 자극되지 않은 배경 대조군에서 정규화된 mRNA 수의 비율을 각 피험자 및 유전자에 대해 측정했습니다. 백신 접종 후 측정과 백신 접종 전 측정의 중앙값 대 중앙값 비율을 결정하고, 재료 표에 나열된 소프트웨어 패키지를 사용하여 경로 농축 분석을 수행했습니다. 표준 경로의 풍부화는 절대 z-점수 값 ≥ 1.25 및 Benjamini-Hochberg 조정 p-값 < 0.05에서 유의한 것으로 간주되었습니다. 현저하게 다르게 농축된 경로가 그림 4A에 요약되어 있으며, Prot_S에 대한 백신 접종 후 반응과 백신 접종 전 반응의 배경 조정 변화의 단순화된 네트워크가 그림 4B에 나와 있습니다. 또한, 부스터 백신 접종 후 항원 제시 세포 성숙 및 Prot_S 유도 T 세포 활성화와 관련된 대표 유전자의 더 강력한 배경 조정 유도가 그림 4C< 나와 있습니다. 마지막으로, 대부분의 기증자에서 백신 접종 후 배경 조정된 Prot_S 특이적 1형 T-도우미 세포(CD69+IFN-γ+)의 증가는 두 번째 자극 튜브 세트를 사용한 유세포 분석으로 확인되었습니다(p = 0.03, 그림 4D).
전체 규모 및 소량 전혈 기반 면역분석 프로토콜에서 바이러스 반응성 T 세포 반응 비교
다음으로, 건강한 지원자에서 바이러스 반응성 CD154+IFN-γ+ T-도우미 세포(CD3+CD4+ 세포)의 빈도를 전체 크기(500 μL, WB) 및 소량(250 μL, WBS) 전혈 항원 자극 프로토콜을 사용하여 비교했습니다(그림 5). 이전에 보고된34개의 바와 같이, 이중 공동 자극(평균, WB 및 WBS에 대해 각각 0.010% 및 0.011%)에도 불구하고 CD154+IFN-γ+ 세포의 최소 비특이적 배경 주파수가 두 프로토콜 중 하나에서 관찰되었습니다. 주목할 점은, 항원 특이적 반응에서 비특이적 배경 반응이 제거되더라도, 이는 이전에 논의된 바와 같이 여전히 분석 부정확성 증가에 기여한다는 점이다27. 상승된 배경 신호(즉, >0.07-0.1% CD154+ Th 세포 또는 >0.05% CD154+IFN-γ+ 세포)는 시료 오염, 피험자의 급성 감염 또는 부적절한 사전 분석 시료 처리의 결과일 수 있습니다.
혈청 양성 공여체(n=5)의 평균 HSV 용해물 반응성 T 세포 빈도는 WB 및 WBS 시스템에서 각각 0.151% 및 0.107%인 반면, 혈청 음성 공여체(n=4)에서는 0.012% 및 0.004%였습니다. CMV pp65 펩타이드 풀에서 혈청 양성 공여체(n=4)는 0.041% 및 0.049%의 반응성 T 세포를 보인 반면, 혈청 음성 공여체(n=5)는 0.001% 및 0.004%였습니다. Lin의 일치 상관 계수는 HSV의 경우 0.868, CMV의 경우 0.985로 강한 상관 관계가 있음을 시사합니다(그림 5A). 특히, CMV 특이적 T 세포 검사는 최근 재활성화 사건이 없는 건강한 혈청 양성 피험자에서 음성일 수 있습니다. 총 및 항원 반응성 CD3+CD4+ T-helper 세포 레퍼토리는 모두 CCR7 및 CD45RO 발현을 기반으로 추가로 분화되었습니다(그림 5B). 안심할 수 있듯이, WB 및 WBS 프로토콜을 사용하여 얻은 결과는 전체 및 항원 반응 인구 모두에서 유사했습니다. 예상대로, 두 분석 모두에서 더 분화된 기억 Th 세포(즉, 효과기 기억 세포)의 비율은 전체 Th-세포 집단보다 항원 반응성 T 세포에서 더 높았습니다. 예상했던 대로, 단지 소수의 순진한 T 세포만이 바이러스 자극제에 의해 활성화되었다(그림 5B).
또한, 또 다른 실험 세트에서는 IFN-γ ELISA에 의해 자극된 배양 상층액을 분석했습니다(그림 5C). 최소한의 비특이적 배경이 관찰되었습니다(WB 및 WBS 프로토콜에서 각각 평균 1.29pg/mL 및 2.18pg/mL). HSV 양성 혈청 기증자의 혈액 샘플은 WB 및 WBS 시스템에서 각각 111pg/mL 및 125pg/mL의 평균 배경 조정 HSV 유도 IFN-γ 농도를 보여주었습니다. 대조적으로, 혈청 음성 샘플의 IFN-γ 농도는 두 시스템 모두에서 일관되게 10pg/mL 미만이었습니다(Lin의 일치 상관 계수 = 0.972, 그림 5C). 마찬가지로, CMV 혈청 양성 기증자의 혈액에 대한 pp65 자극은 WB 및 WBS 시스템에서 각각 258pg/mL 및 272pg/mL의 평균 IFN-γ 농도를 산출한 반면, 혈청 음성 샘플을 사용한 두 시스템 모두에서 최소 pp65 유도 IFN-γ 분비가 관찰되었습니다(Lin의 일치 상관 계수 = 0.953, 그림 5C).
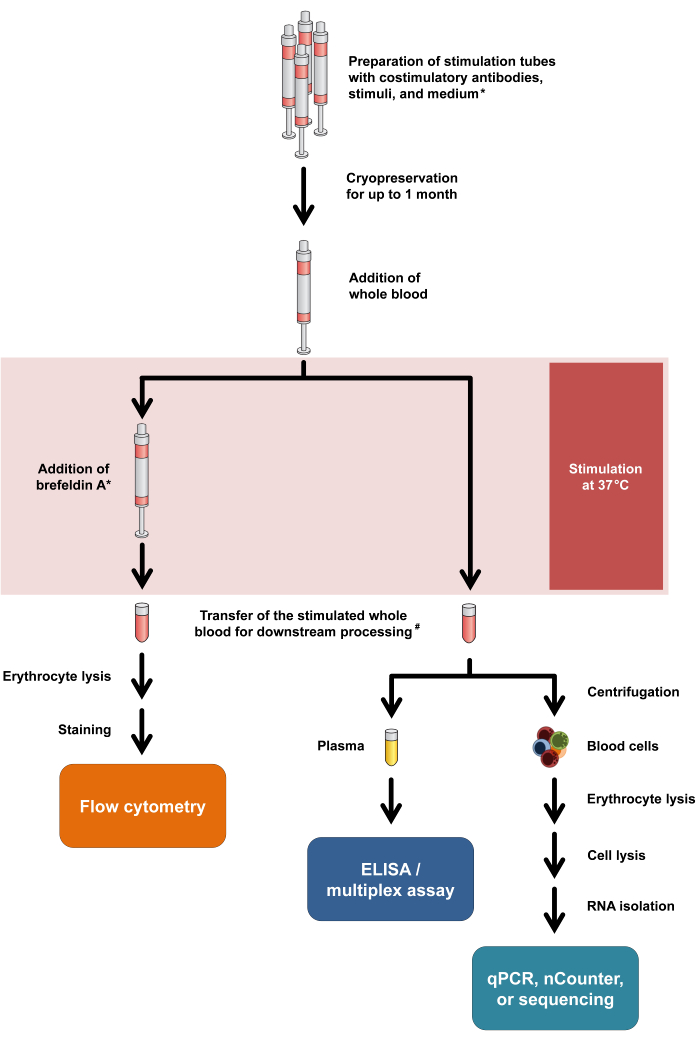
그림 1: 실험 절차 및 판독값을 요약한 순서도. 별표는 Brefeldin A가 일부 T 세포 활성화 마커(예: CD154) 및 세포 내 사이토카인 염색에 필요하다는 것을 의미합니다. 프로토콜 단계 2.5 및 2.6을 참조하십시오. #: 유세포 분석용 혈액은 처음에 적혈구 용해를 위해 15mL 원심분리기 튜브로 옮겨지는 반면, 사이토카인 분석 및 전사체학을 위한 혈액은 1.5mL 미세원심분리기 튜브로 옮겨집니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 2: 적혈구 용해. 자극된 혈액을 (A) 적혈구 용해 완충액에 재현탁한 후 (B) 액체가 맑아 보일 때까지 배양하지만 6분 이상 지속되지 않아야 합니다. (C) 등급이 매겨진 15mL 튜브를 사용할 때 점점 더 반투명해지는 샘플을 통해 눈금이 보여야 합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
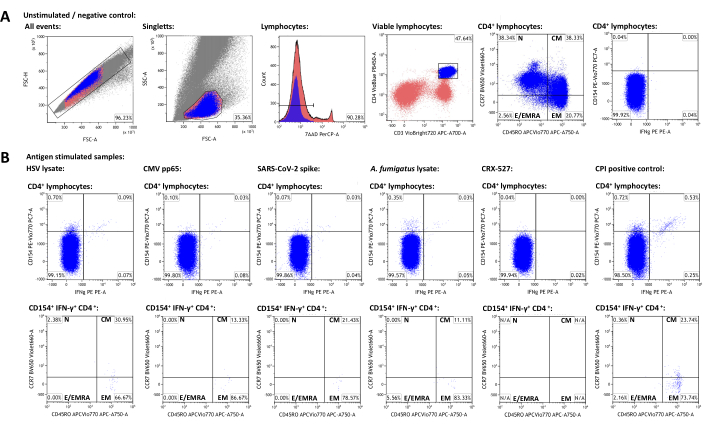
그림 3: 대표적인 데이터셋 및 유세포분석 게이팅 회로도. (A) 단일항 이벤트는 FSC-A 및 FSC-H 속성으로 식별됩니다. 이 중 림프구는 FSC-A와 SSC-A를 사용하여 게이트됩니다. 림프구는 CD3+CD4+ T-helper cell로 분화됩니다. CD45RO 및 CCR7 발현 수준은 메모리 및 효과기 세포 집단의 표현형에 사용됩니다. IFN-γ 및 CD154를 활성화 마커로 사용하였다. 게이트는 자극되지 않은 샘플의 IFN-γ-CD154- 모집단을 기반으로 설정되었습니다. 게이트는 이어서 자극된 샘플(B)로 옮겨졌습니다. 활성화된 T 세포의 메모리 집단의 특성 분석은 CCR7/CD45RO 사분면 게이트를 CD3+CD4+ 집단에서 IFN-γ+CD154+CD3+CD4+ 집단으로 전달하여 달성되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
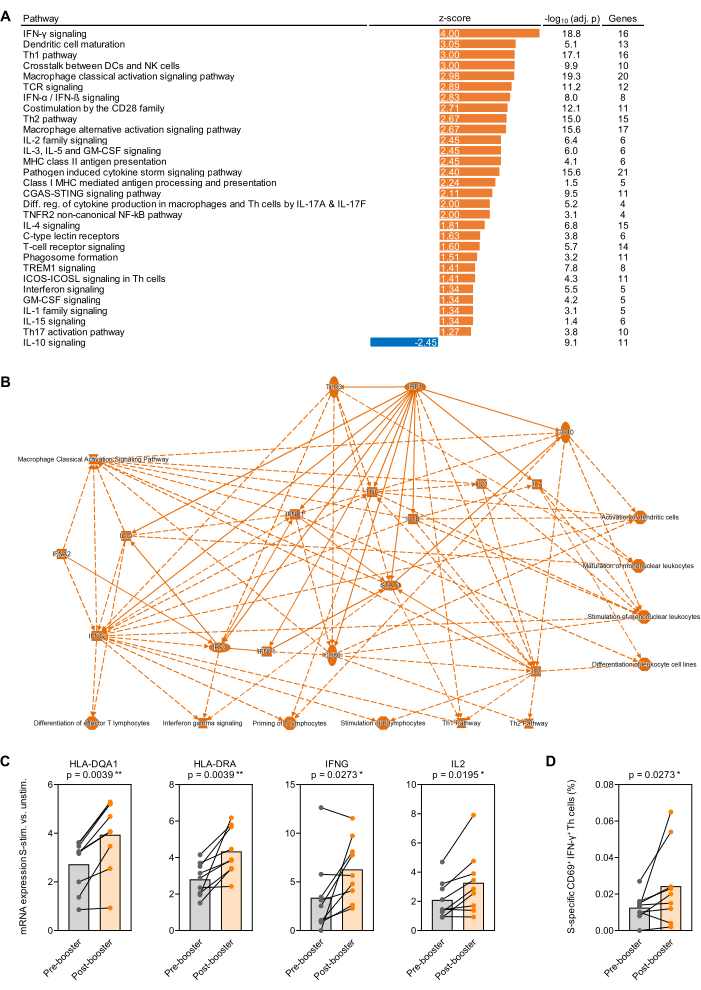
그림 4: SARS-CoV-2 부스터 백신 접종 후 항원 유도 전사 변화. (A) SARS-CoV-2 스파이크 단백질(Prot_S) 자극 전혈에서 BNT162b2 mRNA 부스터 백신 접종 전과 비교하여 9명의 건강한 성인 피험자를 대상으로 전사 경로의 배경 조정 농축을 분석했습니다. Benjamini-Hochberg 조정(BH-adj.) p-값 <0.05(-log10[BH-adj. p] >1.3) 및 절대 z-점수>1.25)가 있는 면역 관련 표준 경로가 표시됩니다. (B) S 자극 전혈에서 더 강하게 농축된 유전자 및 경로를 요약하는 단순화된 네트워크, 부스터 백신 접종 후와 전, 비교. (C) 부스터 백신 접종 전후에 Prot_S 자극 전혈에서 항원 제시 및 T 세포 활성화와 관련된 대표 유전자의 배경 조정 발현 수준. 쌍체 Wilcoxon 테스트. (D) 부스터 백신 접종 전후의 Prot_S 특이적 IFN-γ+CD69+ T 세포의 배경 보정 빈도. 쌍체 Wilcoxon 테스트. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
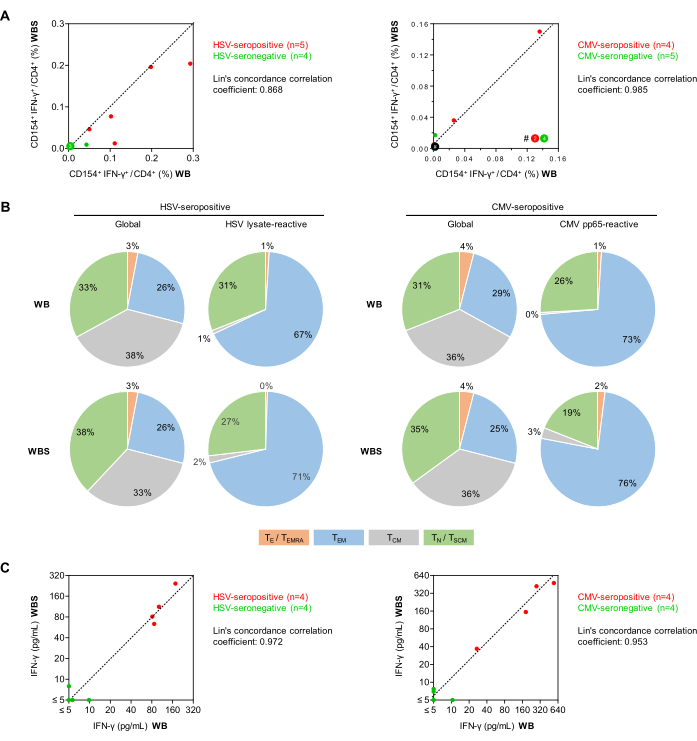
그림 5: 유세포 분석 및 ELISA에서의 항바이러스 T 세포 반응성. (A) 확립된(WB) 및 소량(WBS) 전혈 분석에서 배경 보정된 CD154+IFN-γ+/CD3+CD4+ T 세포 주파수(유세포 분석)의 상관 관계 플롯이 표시됩니다. 녹색 및 빨간색 점은 각각 테스트된 바이러스에 대해 혈청 음성과 혈청 양성인 피험자를 나타냅니다. (B) CD45RO 및 CCR7 발현의 유세포 분석을 사용하여 혈청 양성 기증자(각각 n = 5 및 4)의 혈액을 사용하여 HSV 용해물 또는 CMV pp65로 자극한 후 글로벌 CD3+CD4+ T 세포 및 항원 반응성 IFN-γ+CD154+CD3+CD4+ T 세포 중에서 메모리/효과 T 세포 표현형을 측정했습니다. 평균 분포가 표시됩니다. 녹색: 미성숙 T 세포(TN), CD45RO-CCR7+. 회색: 중앙 기억 T 세포(TCM), CD45RO+CCR7+. 파란색: 이펙터 메모리 T 세포(TEM), CD45RO+CCR7-. 주황색: CD45RA(TE/TEMRA), CD45RO-CCR7-을 재발현하는 이펙터 T 세포 및 이펙터 메모리 T 세포. (C) WB 및 WBS 분석을 사용하여 측정한 배경 보정 IFN-γ 방출(ELISA)의 상관 관계 플롯. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
표 1: 자극관 내용물. 자극 및 용매의 재고 농도가 요약됩니다. 본격적인 전혈 분석(WB)은 500μL의 리튬 헤파린화 전혈을 사용하여 수행되는 반면 소규모 버전(WBS)에는 250μL의 혈액만 필요합니다. WBS의 경우 모든 시약 볼륨은 WB 볼륨의 절반입니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 2: 대표 데이터 세트를 생성하기 위해 샘플링된 건강한 성인 피험자의 인구 통계학적 데이터. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 3: T-세포 분석을 위한 대표적인 유세포 분석 패널. 이 유세포 분석 패널은 대표 데이터 세트를 생성하는 데 사용되었습니다. 결과는 그림 3에 자세히 나와 있습니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
표 4: 이전에 발표된 유세포 분석 패널. 이러한 항체 조합을 사용한 데이터는 이전에 Tappe et al.24에 의해 발표되었습니다. 이 표를 다운로드하려면 여기를 클릭하십시오.
토론
항원 특이적 면역분석은 숙주-미생물 상호 작용에 대한 통찰력을 제공하고, 백신 접종 및 면역 요법 연구에 중추적인 역할을 하며, 기회 감염 환자에서 진단 및 예후 양식으로 점점 더 많이 인식되고 있습니다35. 이 프로토콜은 최소한의 혈액량(항원당 250-500μL)을 사용하여 항원 특이적 면역의 강력한 다중 모드 분석을 가능하게 하는 간편한 항원 자극 시스템을 설명합니다. 축소된 250 μL 프로토콜은 이전에 확립된 500 μL 프로토콜과 비교할 때 항원 특이적 T 세포 빈도, 표현형 및 사이토카인 생성의 우수한 상관 관계를 산출했습니다. 시료 처리36의 일부 단계에서 소량 용액을 사용할 수 있음에도 불구하고, 저자가 아는 한, 현재 사용 가능한 상용 시스템은 유세포 분석, 사이토카인 방출 분석 및 250-500 μL의 혈액량에서 전사체학을 통한 T 세포 주도 기능 면역 반응의 항원 자극 및 다면적 기능 분석을 안정적으로 지원할 수 없습니다. 유사한 스펙트럼의 연구 응용 분야를 용이하게 하는 가장 널리 사용되는 상용 시스템은 3mL 자극 환경에서 1mL의 혈액량을 사용하므로 여기에 제시된 프로토콜에 비해 상당히 높은 비용과 필요한 항원의 양이 발생합니다(13,14,15).
항원 특이적 T 세포 6,37,38의 유세포 정량을 위한 전혈 기반 프로토콜의 지속적인 최적화에도 불구하고 유세포 측정 측정에는 몇 가지 단점이 있습니다. 특히, 이러한 작업은 본질적으로 힘들게 남아 있으며, 상당한 작업자 간 변동성(예: 주관적인 게이팅 프로세스)과 실험실 간의 다양한 장비 설정, 보상 프로토콜 및 획득 매개변수로 인해 표준화하기 어렵습니다. 비록 표준화된 보고(39)와 자동화된 분석 및 게이팅 소프트웨어의 사용이 점점 더 복잡해지는 다색 데이터 세트(40,41)의 표준화 및 비교성을 향상시킬 수 있지만, 여기에 설명된 자극 프로토콜은 다양한 비-유세포측정 판독 방식을 수용하도록 설계되었다.
특히, 사이토카인 방출 분석은 수작업 시간이 짧고 상대적으로 저렴한 장비로 수행할 수 있으며, 일상적인 임상 응용 분야에 맞게 쉽게 표준화할 수 있는 경우가 많습니다. 더욱이, 이 프로토콜을 사용한 이전 연구에서 나타난 바와 같이, 현대의 다중 분석을 통해 최소한의 시료 부피에서 다수의 사이토카인 반응을 측정할 수 있으므로, 연구 환경에서 복잡한 사이토카인 서명의 프로파일링이 가능하다24,42. 주목할 점은, 이중 공동 자극을 특징으로 하는 이 강력한 프로토콜은 의인성 면역억제를 받는 환자에서도 비림프구 감소증 환자(혈액 >800림프구/μL 혈액)에서 항원 특이적 사이토카인 반응의 신뢰할 수 있는 정량화를 용이하게 한다는 것입니다26,34. 사이토카인 방출 분석의 단점으로, 특히 백혈구 감소증 환자에서 분비된 사이토카인을 개별 세포 집단으로 추적할 수 없습니다. 일부 경우에는 가능한 경우 세포 특이적 자극을 사용하여 이를 완화할 수 있습니다. 그러나 사이토카인 농도와 다른 판독 양식의 조합 및/또는 임상 혈액학에 기반한 사이토카인 반응의 조정(즉, 백혈구 분화를 통한 전체 혈구 수)이 필요할 수 있습니다. 특히, 여기에 제시된 프로토콜은 동일한 샘플에서 사이토카인 판독과 전사 서명의 조합을 허용하여 전체 사이토카인 서명에 세포 맥락과 특이성을 추가할 수 있는 잘 정의된 전사 활성화 마커의 일치 분석을 가능하게 합니다.
완전한 표준화와 더 나은 임상적 실용성을 향한 미래의 단계는 시료 처리에서 분석물 판독에 이르기까지 이러한 분석의 완전 자동화가 될 것입니다. 개별 세포 집단의 정밀한 자동 분리가 성공적으로 확립되었지만43,44 항원 특이적 T 세포 분석은 여전히 실험실 직원이 간헐적인 처리 단계를 수행해야 합니다. 그러나 세포 분리 및 취약한 PBMC 처리를 생략하고 상용 자동화 호환 자극 튜브를 사용하면 기능적 면역분석을 위한 간단하고 완전히 자동화된 전혈 기반 워크플로우의 구현을 용이하게 할 수 있습니다.
전체적으로, 본 문서에 제시된 것과 같은 다목적 전혈 기반 프로토콜은 새로운 환자 코호트 및 소동물에 대한 전임상 연구를 포함한 연구 분야로 항원 특이적 기능 면역분석의 응용 분야를 확장할 수 있는 중요한 가능성을 가지고 있습니다. 항원 특이적 기능 면역분석은 현재 쥐 모델에서 거의 실현 불가능하거나 여러 동물의 혈액 고인 및/또는 비장 세포와 같은 비표준화 세포 추출물의 사용이 필요합니다. 기회 감염(예: 면역 관문 억제제, 조혈 성장 인자, 사이토카인 등)에 대한 숙주 방어를 강화하기 위한 면역 요법 중재에 대한 관심이 높아지고 혁신적인 백신 접종 기술이 급증함에 따라 항원 특이적 기능 면역분석법은 전임상 감염성 질환 연구와 다양한 환자 집단의 임상 응용 분야에서 점점 더 많은 역할을 할 것으로 예상됩니다. 여기에 제시된 견고하고 저렴하며 사용하기 쉬운 저용량 항원 자극 시스템은 미개척 영역에서 포괄적인 항원 특이적 면역 분석을 용이하게 할 수 있습니다. 더욱이, 이 간편한 프로토콜의 사전 분석 견고성은 면역분석 애플리케이션을 임상 루틴에 더 잘 통합할 수 있는 기회를 창출할 수 있으며, 이를 통해 감염성 질환의 개인화된 바이오마커 기반 관리에 한 걸음 더 다가갈 수 있습니다.
공개
저자가 공개해야 할 이해 상충은 없습니다.
감사의 말
혈청 항체 측정을 수행해 주신 아우크스부르크 대학병원 실험실 의학 및 미생물학 연구소(Institute for Laboratory Medicine and Microbiology)의 임상 화학 및 감염 혈청학 부서에 감사드립니다. 전사체학 시설을 제공해 주신 Friederike Liesche-Starnecker 박사와 아우크스부르크 대학병원 병리학 및 분자 진단 연구소에 감사드립니다. 백신 물류 및 검체 채취를 지원해 주신 아우크스부르크 대학병원의 Marie Freitag에게 감사드립니다. Aspergillus fumigatus lysate를 제공해 주신 Olaf Kniemeyer 박사와 독일 예나의 Hans-Knoell-Institute에 감사드립니다. 연구 이니셔티브 Bay-VOC(자금 지원 번호 GE2-2452-200-D37666/2022), 바이에른 주 과학예술부, 독일 아우크스부르크 대학교가 이 작업을 지원했습니다.
자료
| Name | Company | Catalog Number | Comments |
| 7-AAD Solution | Miltenyi Biotec | 130-111-568 | |
| Anti-IFN-g-PE, human, REA600, 100 tests | Miltenyi Biotec | 130-113-498 | |
| Aspergillus fumigatus lysate | N/A | N/A | Kindly provided by the Hans-Knoell Institute Jena, Germany |
| Brilliant Violet 650 anti-human CD197 (CCR7) Antibody | BioLegend | 353234 | |
| Buffer EL | Qiagen | 79217 | Erythrocyte lysis buffer |
| CD154-PE-Vio770, human, REA238, 100 tests | Miltenyi Biotec | 130-113-614 | |
| CD279 (PD1)-VioBright 515, human, 100 tests | Miltenyi Biotec | 130-120-386 | |
| CD28 pure, human - functional grade | Miltenyi Biotec | 130-093-375 | |
| CD3-VioBright R720, human, REA613, 100 tests | Miltenyi Biotec | 130-127-377 | |
| CD45RO-APC-Vio770, human, REA611, 100 tests | Miltenyi Biotec | 130-113-557 | |
| CD49d pure, human | Miltenyi Biotec | 130-093-279 | |
| CD4-VioBlue, human, REA623, 100 tests | Miltenyi Biotec | 130-114-534 | |
| CD69-PE-Vio615, human, REA824, 100 tests | Miltenyi Biotec | 130-112-617 | |
| CO2 Incubator | PHCbi | MCO-170AICD-PE | |
| CPI Positive Control Solution | ImmunoSpot | CTL-CPI-001 | |
| CRX-527 | Invivogen | tlrl-crx527 | |
| CytExpert Acquisition and Analysis Software | Beckman Coulter | Version 2.4 | Flow cytometer operating softwware |
| CytoFlex S B2-R3-V4-Y4 | Beckman Coulter | B75408 | Flow cytometer |
| GraphPad Prism | GraphPad | Version 10.1.0 | |
| Herpes simplex virus 1 lysate | AID Autoimmun Diagnostika | ELSP 5916K | |
| HU IFN G Uncoated ELISA 2X96T PLT | Thermo Fisher Scientific | 88-7316-22 | |
| HydroFLex Microplate Washer | Tecan | 30220085 | |
| Infinite M Plex | Tecan | 30213614 | Multimode Microplate Reader |
| Kaluza Analysis Software | Beckman Coulter | Version 2.1.00003.20057 | Flow cytometric data analysis software |
| MACS Inside Stain Kit | Miltenyi Biotec | 130-090-477 | |
| Mastercycler X50l | Eppendorf | 6303000010 | |
| Nanodrop One | Thermo Fisher Scientific | ND-ONE-W | |
| nCounter Sprint Cartridge | Nanostring | 100078 | |
| nCounter Sprint Profiler | Nanostring | 100170 | |
| nCounter Sprint Reagent Pack | Nanostring | 100077 | |
| nSolver | Nanostring | Version 4.0 | Nanostring nCounter data analysis software |
| Octeniderm farblos 250 ml FL | Schuelke | 118211 | |
| Omnifix F Solo, 1 ml, ohne Kanüle, 3-teilig | Braun | 9161406V | Syringes |
| PepTivator CMV pp65, human, 60nmol | Miltenyi Biotec | 130-093-435 | |
| PepTivator SARS-CoV-2 Prot_S, research grade, for stimulation of 1×108 cells | Miltenyi Biotec | 130-126-700 | |
| QIAshredder | Qiagen | 79654 | |
| RNA Protect | Qiagen | 76526 | |
| RNeasy Plus Mini Kit | Qiagen | 74134 | |
| RPMI 1640 Medium, GlutaMAX Supplement, HEPES | Thermo Fisher Scientific | 72400047 | |
| Safe 2020 1.5 Microbiological Safety Cabinet | Thermo Fisher Scientific | 51026959 | |
| S-Monovette lithium-heparin, 4.9 ml | Sarstedt | 04.1939.001 | Blood collection tubes |
| S-Monovette neutral, 2.7 ml | Sarstedt | 05.1729 | Stimulation environment tubes |
| Sterican Safety G 19 x 1 1/2'' 1,1 x 40 mm | Braun | 4670052S-01 | Needles |
| Stop Solution, 100 ML | Thermo Fisher Scientific | BMS409.0100 | |
| Wash Buffer 20X, 500 ML | Thermo Fisher Scientific | BMS408.0500 | |
| Water, 1 l | Carl Roth | 3478.1 | |
| XT Hs Exhaustion CSO | Nanostring | 115000466 | Nanostring Immune Exhaustion Panel |
참고문헌
- Mckenna, K. C., Beatty, K. M., Vicetti Miguel, R., Bilonick, R. A. Delayed processing of blood increases the frequency of activated CD11b+ CD15+ granulocytes which inhibit t cell function. J Immunol Methods. 341 (1-2), 68-75 (2009).
- Doberne, D., Gaur, R. L., Banaei, N. Preanalytical delay reduces sensitivity of quantiferon-tb gold in-tube assay for detection of latent tuberculosis infection. J Clin Microbiol. 49 (8), 3061-3064 (2011).
- Corbiere, V., et al. A semi high-throughput whole blood-based flow cytometry assay to detect and monitor bordetella pertussis-specific th1, th2 and th17 responses. Front Immunol. 14, 1101366 (2023).
- Lauruschkat, C. D., et al. Development of a simple and robust whole blood assay with dual co-stimulation to quantify the release of t-cellular signature cytokines in response to aspergillus fumigatus antigens. J Fungi (Basel). 7 (6), 462 (2021).
- Riou, C., et al. simplified whole blood-based multiparameter assay to quantify and phenotype SARS-COV-2-specific T-cells. Eur Respir J. 59 (1), 2100285 (2022).
- Weis, P., et al. Development and evaluation of a whole blood-based approach for flow cytometric quantification of CD154+ mould-reactive T cells. Med Mycol. 58 (2), 187-196 (2020).
- Boyum, A. Isolation of lymphocytes, granulocytes and macrophages. Scand J Immunol. 5, 9-15 (1976).
- Chen, G., Wang, H., Wang, Y. Clinical application of quantiferon-tb gold in-tube in the diagnosis and treatment of tuberculosis. Eur J Clin Microbiol Infect Dis. 39 (4), 607-612 (2020).
- Manuel, O., Kumar, D. Quantiferon-tb gold assay for the diagnosis of latent tuberculosis infection. Expert Rev Mol Diagn. 8 (3), 247-256 (2008).
- Inthawong, M., et al. A whole blood intracellular cytokine assay optimised for field site studies demonstrates polyfunctionality of CD4+ t cells in acute scrub typhus. PLoS Negl Trop Dis. 17 (3), e0010905 (2023).
- Johnson, S. A., et al. Evaluation of quantiferon SARS-COV-2 interferon-gamma release assay following SARS-COV-2 infection and vaccination. Clin Exp Immunol. 212 (3), 249-261 (2023).
- Kruttgen, A., et al. Evaluation of the quantiferon SARS-COV-2 interferon-ɣ release assay in mrna-1273 vaccinated health care workers. J Virol Methods. 298, 114295 (2021).
- Duffy, D., et al. Standardized whole blood stimulation improves immunomonitoring of induced immune responses in multi-center study. Clin Immunol. 183, 325-335 (2017).
- Duffy, D., et al. Functional analysis via standardized whole-blood stimulation systems defines the boundaries of a healthy immune response to complex stimuli. Immunity. 40 (3), 436-450 (2014).
- Smith, N., et al. Defective activation and regulation of type i interferon immunity is associated with increasing COVID-19 severity. Nat Commun. 13 (1), 7254 (2022).
- Lauruschkat, C. D., et al. CD4+ T cells are the major predictor of hcmv control in allogeneic stem cell transplant recipients on letermovir prophylaxis. Front Immunol. 14, 1148841 (2023).
- Pelchen-Matthews, A., Parsons, I. J., Marsh, M. Phorbol ester-induced downregulation of cd4 is a multistep process involving dissociation from p56lck, increased association with clathrin-coated pits, and altered endosomal sorting. J Exp Med. 178 (4), 1209-1222 (1993).
- Boise, L. H., et al. CD28 costimulation can promote t cell survival by enhancing the expression of bcl-xl. Immunity. 3 (1), 87-98 (1995).
- Udagawa, T., Woodside, D. G., Mcintyre, B. W. Alpha 4 beta 1 (CD49d/CD29) integrin costimulation of human t cells enhances transcription factor and cytokine induction in the absence of altered sensitivity to anti-cd3 stimulation. J Immunol. 157 (5), 1965-1972 (1996).
- Baumann, J., et al. Golgi stress-induced transcriptional changes mediated by mapk signaling and three ets transcription factors regulate mcl1 splicing. Mol Biol Cell. 29 (1), 42-52 (2018).
- Miller, S. G., Carnell, L., Moore, H. H. Post-golgi membrane traffic: Brefeldin a inhibits export from distal golgi compartments to the cell surface but not recycling. J Cell Biol. 118 (2), 267-283 (1992).
- Zandvliet, M. L., et al. Co-ordinated isolation of CD8(+) and CD4(+) t cells recognizing a broad repertoire of cytomegalovirus pp65 and ie1 epitopes for highly specific adoptive immunotherapy. Cytotherapy. 12 (7), 933-944 (2010).
- Kramer, K. J., et al. Single-cell profiling of the antigen-specific response to bnt162b2 sars-cov-2 rna vaccine. Nat Commun. 13 (1), 3466 (2022).
- Tappe, B., et al. COVID-19 patients share common, corticosteroid-independent features of impaired host immunity to pathogenic molds. Front Immunol. 13, 954985 (2022).
- Stover, A. G., et al. Structure-activity relationship of synthetic toll-like receptor 4 agonists. J Biol Chem. 279 (6), 4440-4449 (2004).
- Page, L., et al. Impact of immunosuppressive and antifungal drugs on pbmc- and whole blood-based flow cytometric CD154(+) Aspergillus fumigatus specific t-cell quantification. Med Microbiol Immunol. 209 (5), 579-592 (2020).
- Hedley, B. D., Keeney, M. Technical issues: Flow cytometry and rare event analysis. Int J Lab Hematol. 35 (3), 344-350 (2013).
- Bacher, P., Scheffold, A. Flow-cytometric analysis of rare antigen-specific T cells. Cytometry A. 83 (8), 692-701 (2013).
- Frentsch, M., et al. Direct access to CD4+ t cells specific for defined antigens according to cd154 expression. Nat Med. 11 (10), 1118-1124 (2005).
- Osum, K. C., Jenkins, M. K. Toward a general model of CD4(+) t cell subset specification and memory cell formation. Immunity. 56 (3), 475-484 (2023).
- Lighvani, A. A., et al. T-bet is rapidly induced by interferon-gamma in lymphoid and myeloid cells. Proc Natl Acad Sci U S A. 98 (26), 15137-15142 (2001).
- Lamb, Y. N. Bnt162b2 mrna COVID-19 vaccine: First approval. Drugs. 81 (4), 495-501 (2021).
- Arbel, R., et al. Bnt162b2 vaccine booster and mortality due to COVID-19. N Engl J Med. 385 (26), 2413-2420 (2021).
- Lauruschkat, C. D., et al. T-cell immune surveillance in allogenic stem cell transplant recipients: Are whole blood-based assays ready to challenge elispot. Open Forum Infect Dis. 8 (1), 547 (2021).
- Albert-Vega, C., et al. Immune functional assays, from custom to standardized tests for precision medicine. Front Immunol. 9, 2367 (2018).
- . Biolegend Available from: https://www.biolegend.com/de-de/products/dry-human-aim-assay-cocktail-kit-23591?GroupID=GROUP28 (2024)
- Lauruschkat, C. D., et al. Susceptibility of a. Fumigatus-specific t-cell assays to pre-analytic blood storage and pbmc cryopreservation greatly depends on readout platform and analytes. Mycoses. 61 (8), 549-560 (2018).
- Wurster, S., et al. Quantification of a. Fumigatus-specific cd154+ t-cells-preanalytic considerations. Med Mycol. 55 (2), 223-227 (2017).
- Britten, C. M., et al. T cell assays and miata: The essential minimum for maximum impact. Immunity. 37 (1), 1-2 (2012).
- Cossarizza, A., et al. Guidelines for the use of flow cytometry and cell sorting in immunological studies (third edition). Eur J Immunol. 51 (12), 2708-3145 (2021).
- Le Lann, L., et al. Standardization procedure for flow cytometry data harmonization in prospective multicenter studies. Sci Rep. 10 (1), 11567 (2020).
- Lauruschkat, C. D., et al. Chronic occupational mold exposure drives expansion of aspergillus-reactive type 1 and type 2 t-helper cell responses. J Fungi (Basel). 7 (9), 698 (2021).
- Pascual-Garcia, M., et al. Lif regulates cxcl9 in tumor-associated macrophages and prevents cd8(+) t cell tumor-infiltration impairing anti-pd1 therapy. Nat Commun. 10 (1), 2416 (2019).
- Paull, D., et al. Automated, high-throughput derivation, characterization and differentiation of induced pluripotent stem cells. Nat Meth. 12 (9), 885-892 (2015).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유