Lower Dipteran Fly Bradysia (Sciara) coprophila의 실험실 유지 보수 : 새로운 / 오래된 신흥 모델 유기체
요약
이 논문은 Lower dipteran fly Bradysia (Sciara) coprophila의 실험실 유지 관리 (짝짓기 및 먹이 포함)를 간략하게 설명합니다.
초록
하부 dipteran fly, Bradysia (Sciara) coprophila 의 실험실 재고는 100 년 이상 유지되어 왔습니다. B. coprophila 의 실험실 유지를 위한 프로토콜이 여기에 제시되어 있습니다. 이러한 프로토콜은 B. coprophila 를 연구하는 실험실의 수가 급증하면서 (1) 남성 감수분열 I의 단극 방추체를 포함하는 독특한 생물학적 특징을 활용하는 데 유용할 것입니다. (2) 남성 감수분열 II에서 X dyad의 비분리; (3) 모계 상동체와 부계 상동체를 구별하기 위한 염색체 각인; (4) 생식계통 제한(L) 염색체; (5) 염색체 제거 (남성 감수분열 I에서 부계 염색체; 초기 배아에서 1-2 개의 X 염색체; 초기 배아의 소마(soma)에서 L 염색체); (6) 어머니에 의한 성별 결정(Y 염색체가 없음); (7) 유충 타액선 폴리텐 염색체의 DNA 퍼프 자리에서 발달적으로 조절된 DNA 증폭.
이제 B. coprophila 게놈의 염기서열 분석 및 조립의 최근 발전과 게놈 공학을 위한 형질전환 방법론 개발을 사용하여 염색체 역학의 이러한 많은 고유한 특징을 탐구할 수 있습니다. 연구를 위해 B. coprophila 를 사용하는 성장하는 과학계는 여기에 설명된 파리의 짝짓기 프로토콜(아들 또는 딸만 가질 어머니를 위한 표현형 마커, 생화학 실험을 위한 대량 짝짓기에 대한 세부 정보), 배아 부화 확인, 유충 먹이 및 사육에 대한 기타 설명의 이점을 얻을 수 있습니다.
서문
생물학적 원리를 완전히 이해하려면 생명의 나무에 걸쳐 있는 다양한 유기체에 대한 연구가 필요합니다. 19세기 말까지 광범위한 유기체가 설명되었지만 20세기 중반까지 실험 연구는 12 개 미만의 모델 유기체로 제한되었습니다. 게놈 시대가 도래하고 생명의 나무1에 있는 모든 종의 게놈 염기서열을 분석하는 것이 목표됨에 따라 우리는 이제 실험실 실험에 사용되는 유기체의 유형을 확장하고 그 다양성의 이점을 누릴 수 있는 위치에 있습니다. 실험을 위한 새로운 모델 유기체의 이러한 확장은 실험실에서 이를 유지할 수 있는 전제 조건을 가지고 있습니다. 여기에서는 이러한 신흥/기존 모델 유기체 중 하나를 기르기 위한 프로토콜이 설명됩니다.
지구상에 존재하는 대부분의 동물은 곤충2의 4개의 초방사선에 의해 설명된다. 곤충 내에는 약 158,000 종의 Diptera(참파리)3가 있으며, 약 3000 종은 Sciaridae (검은 곰팡이 모기)과에 속합니다4. 초파리(Drosophila)는 딥테란 파리 중에서 가장 철저하게 연구된 파리이다. 하부 디프테란 파리(Nematocera), 브라디시아(이전에는 Sciara라고 불렸음) 코프로필라(coprophila)는 2억 년 전에 "고등 디프테란" 파리(Brachycera)인 초파리(Drosophila)에서 갈라져 나왔다. 따라서 B. coprophila는 D. melanogaster와의 비교 연구에 유리한 분류학적 위치에 있습니다(그림 1). 더욱이, B. coprophila는 그 자체로 연구할 가치가 있는 많은 독특한 생물학적 특징을 가지고 있습니다 5,6,7. 이러한 특징 중 다수는 유기체의 모든 세포가 동일한 DNA 함량을 갖는 DNA 불변성의 규칙을 따르지 않습니다. B. coprophila에서, (i) 부계 게놈은 남성 감수분열 I의 단극 방추체에서 제거됩니다. (ii) 남성 감수분열 II에서 X 다이아드의 비분리가 있습니다. (iii) 생식계통 제한(L) 염색체가 소마에서 제거됩니다. (iv) 개인의 성별에 따라 초기 배아에서 하나 또는 두 개의 X 염색체가 제거됩니다. 모계 상동체와 부계 상동체를 구별하기 위한 염색체 각인은 B. coprophila에서 처음 발견되었으며 이러한 염색체 제거 사건의 많은 부분에 작용합니다. 염색체 제거 외에도 DNA 불변성의 또 다른 우회는 유충 타액선 폴리텐 염색체의 DNA 퍼프 유전자좌에서 발달적으로 조절되는 유전자좌 특이적 DNA 증폭을 통해 발생합니다. 이러한 독특한 특징에 대한 연구는 B.coprophila의 실험실 유지 보수를 필요로합니다. 그러한 연구를 용이하게하기 위해 축산에 대한 세부 사항이 여기에 제시되어 있습니다.
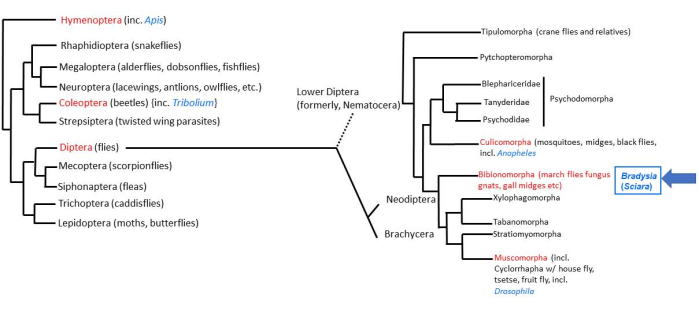
그림 1 : Bradysia (Sciara) coprophila의 계통 발생. 인기 있는 모델 유기체는 파란색 글꼴로 표시되고 분류 순서는 빨간색 글꼴로 표시됩니다. Bradysia와 다른 Sciarid 곰팡이 모기뿐만 아니라 모기는 lower dipteran flies (이전에는 Nematocera의 하위 목)인 반면, Drosophila 종은 높은 dipteran 파리 (하위 주문 : Brachysera)입니다. 그림 왼쪽의 정보는 Misof et al.33에서 발췌한 것입니다. 오른쪽 정보는 Bertone et al.34 및 Wiegmann et al.2에서 발췌한 것입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
이전에는 Sciara 속이 진핵 생물에 대해 가장 많은 종 (700 종)을 가지고 있었기 때문에 Steffan은이를8로 세분화했습니다. 그 후, Shin은 Sciaridae 과를 Sciarinae (Sciara, Trichosia, Leptosciarella를 포함한 6 개 속), Megalosphyinae (Bradysia 속 포함) 및 Pseudolycoriella 포함한 3 개의 다른 그룹으로 세분화 할 것을 제안했습니다 9. Sciaridae의 계통 발생은 최근 몇 년 동안 여러 그룹에 의해 더 연구되었습니다 9,10,11. 지난 수십 년 동안 Sciaridae 계통의 많은 유기체의 이름이변경되었습니다 12. 100년 이상에 걸친 대부분의 문헌에서는 우리가 연구하는 유기체를 Sciara coprophila라고 언급하고 있지만, 현재의 분류학적 이름은 현재 Bradysia coprophila(동의어 Bradysia tilicola 및 기타 동의어)입니다.10 그들은 전 세계적으로 발견되며 버섯과 다른 곰팡이를 먹기 때문에 일반적으로 곰팡이 모기로 알려져 있습니다. 그들은 1804 년 유럽의 Meigen13에 의해 처음 기술되었으며 그 후 북미의 Johannsen 14,15에 의해 기술되었습니다. B. coprophila는 Cold Spring Harbor Laboratory에서 수집되었으며 실험실 재고는 1900 년대 초 Charles Metz가 Thomas Hunt Morgan과 함께 Columbia University의 대학원생이었을 때 설립되었습니다. 따라서 현재의 주식은 한 세기에 걸친 근친 교배를 반영합니다. 마찬가지로, B. coprophila의 생물학은 Helen Crouse (Barbara McClintock과 함께 박사 학위를 받았음)에 의한 수십 년간의 세포 유전학 연구에 의해 더욱 명확해졌습니다.
1930년대에 Bradysia(Sciara)는 유전자 연구를 위한 모델 시스템으로 Drosophila melanogaster와 경쟁했습니다. 많은 독특한 생물학적 특징에도 불구하고 B. coprophila는 방사선 유도 표현형 돌연변이가 유전 연구에 필요하고 B. coprophila가 D. melanogaster16보다 감마 조사에 약간 더 저항력이 있음에도 불구하고 방사선 유도 표현형 돌연변이가 유전 연구에 필요하고 후자에서 달성하기가 더 쉬웠기 때문에 인기 있는 모델 유기체로 D. melanogaster에 의해 가려졌습니다. 현대 유전체학 시대에 이것은 더 이상 문제가 되지 않습니다. B. coprophila에 대한 게놈 염기서열 17,18,19 (Urban, Gerbi, and Spradling, data not shown) 및 Method for transformation 20,21 (Yamamoto and Gerbi, data not shown)이 최근에 사용 가능해졌기 때문에, 연구를 위해 이를 채택한 과학자 커뮤니티가 이를 새롭게 활용할 수 있는 시기가 무르익었습니다. 이 문서에서는 실험실 유지 관리 절차에 대해 설명합니다.
B. coprophila는 Y 염색체가 없으며 자손의 성별은 어머니에 의해 결정됩니다. 긴 paracentric inversion을 가진 X'("X-prime") 염색체를 가진 여성은 딸만 낳는 반면, 표준(비반전) X 염색체에 대해 동형접합성인여성은 아들만 낳습니다5(그림 2). X' 염색체19에 대한 염기서열 정보는 사용할 수 있지만, X' 염색체가 자손이 여성이 될 것이라는 것을 어떻게 결정하는지에 대한 분자 메커니즘은 아직 밝혀지지 않았습니다. 남성은 X' 염색체를 가지고 있지 않으며, 수정 후 여성은 X'X(X'의 이형접합) 또는 XX입니다. 성체 X'X 암컷은 날개의 표현형 마커로 XX 암컷과 구별할 수 있습니다(그림 3). X'X 암컷(딸만 낳을 예정)은 X'(HoLo2 스톡에서와 같이)22의 지배적인 물결 모양(W) 날개 마커로 인식할 수 있습니다. 대안적으로, XX 암컷 (아들 만 낳을 예정)은 91S 스톡23에서와 같이 X의 열성 몸집이 작은 (p) 날개 마커로 인식 할 수 있습니다. 이 경우 X'Xp 암컷은 전신(몸집이 아님) 날개를 가지며 딸만 낳습니다. 스톡 6980은 부풀어 오른 (sw) 정맥24에 대한 X 염색체에 열성 마커와 X'의 우성 마커 Wavy를 운반하여 교배에 대한 선택을위한 두 개의 마커를 허용합니다. Wavy의 발현 정도는 다양할 수 있으며 음식이 제한적이거나 온도가 너무 뜨거워지는 과밀한 바이알에서 더 약해 보입니다. 물결 모양의 날개 표현형은 유충이 일반적인 21 °C 대신 추운 방 (4 ° -8 ° C)에 보관되는 경우 매우 강합니다. 열성 쁘띠 윙 마커는 가변적이지 않고 식별하기가 매우 쉽지만 91S 스톡은 HoLo2 스톡보다 건강하지 않기 때문에 덜 자주 사용됩니다. B. coprophila 짝짓기 계획이 여기에 제시되어 있으며(그림 2), HoLo2, 7298 및 W14 스톡(보충 파일 1), 91S 스톡(보충 파일 1), 6980 스톡(보충 파일 1) 및 전좌 스톡(보충 파일 1)에 대해 자세히 설명되어 있습니다. 전좌 주식은 더 이상 존재하지 않습니다. 그들은 리보솜 RNA 유전자25,26,27을 포함하는 X의 짧은 팔에서 이종 염색체 (H1, H2 및 H3)의 상호 전위였습니다.
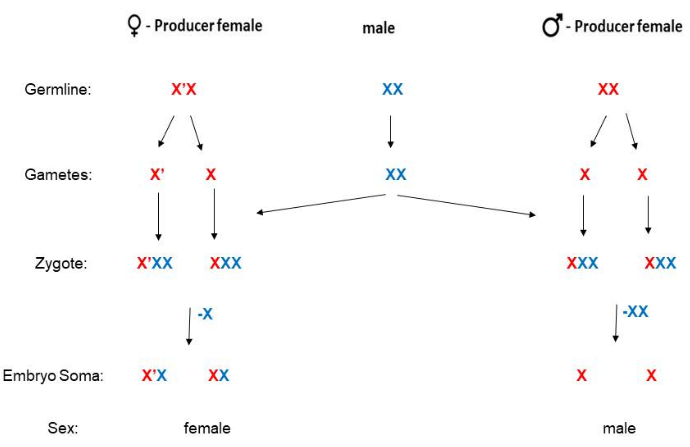
그림 2: B. coprophila의 짝짓기 계획. 이 유기체는 Y 염색체가 없습니다 (남성 소마는 단일 X를 가지고 있습니다). 어머니는 자식의 성별을 결정한다. XX 어머니는 아들만 있고 X'X 여자는 딸만 있습니다. X '염색체는 X 염색체와 비교할 때 긴 paracentric inversion을 가지고 있습니다. X(또는 X') 염색체의 부계 또는 모계 혈통은 이 그림에서 각각 파란색 또는 빨간색으로 표시됩니다. 정자는 상염색체에 대해 반수체이지만 감수분열 II의 비분리로 인해 X 염색체의 사본이 두 개 있습니다. 초기 배아의 체세포 계통은 각각 여성 또는 남성인 경우 부계에서 파생된 X의 하나 또는 두 개의 복사본을 제거합니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.

그림 3: B. coprophila의 날개 표현형. 성충 암컷 파리는 다양한 날개 표현형을 보인다: (A) 직선 날개(XX), (B) 물결 날개(X'WX), (C) 차가운 루 m에 유충을 저장한 후 쭈글쭈글한 모양을 가진 극단적인 물결 날개(X'WX) 표현형, (D) 흔적 같은 작은 날개(XpXp), (E) 야생형(XX)이 있고 정맥이 부풀어 오르지 않은 직선 날개, (F) 날개의 위쪽 가장자리 및/또는 양쪽 날개 끝 부분에 작은 기포(검은색 화살표)가 나타나는 부풀어 오른 정맥이 있는 직선 날개(XswXsw), (G) 한쪽 또는 양쪽 날개에 물집(흰색 화살표)이 발생하는 부종의 극단적인 예. 수컷은 X 염색체가 없기 때문에 물결 모양의 날개를 가질 수 없지만 91S 스톡 또는 6980 스톡에서 각각 몸집이 작거나 부풀어 오른 날개를 가지고 있습니다. 축척 막대 = 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
재고 관리의 목표는 교배종의 절반이 암컷을 생산하는 어머니로부터, 나머지 절반이 수컷을 생산하는 어머니의 교배종인 교배를 수행하여 다음 세대에 후속 교배를 위해 동일한 수의 여성과 남성 성인을 갖도록 하는 것입니다. 그러나 수컷의 수명주기가 암컷보다 짧고 성인 남성이 성인 암컷보다 최대 일주일 먼저 출현하기 때문에 계획도 필요합니다. 자연은 같은 날짜에 교배에서 암컷 유충보다 1-2 일 후에 수컷 배아가 유충으로 출현함으로써 남녀 간의 이러한 비동시성을 수용합니다. 그러나 수컷과 암컷 성체가 동시에 실험실 교배를 할 수 있도록 하기 위해 암컷 유충이 든 바이알을 21°C가 아닌 실온에 두거나 약간 더 낮은 온도(예: 16°C)에서 수컷 유충이 든 바이알을 배치함으로써 암컷 발달을 다소 가속화할 수 있습니다. 더 확실한 또 다른 방법은 월요일에 여성 생산자 어머니와 십자가를 하고, 같은 주 금요일에 남성 생산자 어머니와 십자가를 건너는 것입니다. 우리가 사용하는 가장 쉬운 방법은 매주 같은 날에 여성 프로듀서 및 남성 프로듀서 엄마와 함께 십자가를 공연하고 매주 연속으로 그 날에 십자가를 공연하는 것입니다. 이 접근법에서, 1주차에 교배된 성체 암컷은 2주차에 교배에서 나온 성체 남성과 교배할 수 있습니다.
암컷 B. coprophila 의 수명주기는 21 ° C에서 올릴 때 5 주입니다 (표 1). 수명주기의 길이는 더 서늘한 온도에서 또는 영양이 부족한 경우 다소 길어집니다. 수컷 B. coprophila 의 수명주기는 암컷보다 0.5-1 주 전에 번데기가 되기 때문에 ~ 4-4.5 주입니다. 각 유충 instar의 끝은 스테로이드 호르몬 ecdysone 수준의 파열에 의해 유발되는 큐티클의 탈락으로 표시됩니다. 3개의 유충 인스타가 있는 D. melanogaster 와 달리 B. coprophila 는 4개의 유충 인스타를 가지고 있습니다.
| 발달 단계 | 결합 후 일수(dpm) | 스테이지 길이(일) |
| 낳은 알 | 1-2 | |
| 배 | 1-2에서 7-8 | ~7일 |
| 유충 | ||
| 애벌레는 1, 2, 3을 인스타합니다. | 7-8에서 16-19 | ~10 |
| 4번째 애벌레 인스타 프리아이스팟 | 16-19에서 21-24 | 5 |
| 4번째 애벌레 인스타 아이스팟 스테이지 | 21-24에서 25-28 | 4 |
| 번데기 | 25-28에서 30-33 | 5 |
| 성인 | 짝짓기를 한 경우 21 °C에서 1-2 일 동안 살거나 짝짓기를 하지 않으면 16 °C에서 2-3 주 동안 산다. | |
표 1: 21°C에서 암컷 B. coprophila 의 수명주기.
B. coprophila 는 15 °C-25 °C 범위의 어느 곳에서나 보관할 수 있으며 더 낮은 온도에서 발달이 더 천천히 진행됩니다. 이 곤충은 습한 환경(관엽 식물이나 버섯 침대의 토양에서 발견됨)을 선호하므로 인큐베이터에 탈이온수가 담긴 비커를 보관합니다. B. coprophila 는 뚜껑이 헐렁하고 물 비커가 들어있는 금속 빵 상자에 넣어 실온에서 보관 할 수 있지만 더운 기후에서는 위험 한 37 ° C28에서 열 충격을받습니다. 마이클 애쉬버너(Michael Ashburner)와 다른 연구자들은 D. 멜라노가스터를 추위에 보관하여 재고 보관에 필요한 시간을 줄이려고 노력하였으나 거의 성공하지 못하였다. 대조적으로, B. coprophila 의 주요 장점은 중간 단계 유충이 있는 바이알을 한 달에 한 번만 먹이는 최소한의 관리로 냉장실(4-8 °C)의 개방형 선반에 최대 3개월 동안 보관할 수 있다는 것입니다. 그들은 번데기 단계까지 추위에서 매우 천천히 발달하며 바이알을 21 °C로 되돌릴 때 가임기 가능한 성인으로 나타납니다. 아마도 이것은 그들이 야생에서 월동하는 것을 모방한 것일 것입니다. 이러한 추위에 의한 발달 지연은 중간 단계의 B. coprophila 유충16에 감마선을 조사한 후 관찰된 것과 비슷할 수 있지만, 정상적인 발달 진행에 대한 돌이킬 수 없는 지점을 지난 후기 단계 유충에서는 발달 지연이 나타나지 않습니다.
프로토콜
여기에 설명된 프로토콜은 Charles Metz, Helen Crouse 및 Susan Gerbi가 순차적으로 감독하는 Bradysia (Sciara) 주식 센터의 100년 경험과 다른 사람들의 의견을 나타냅니다.
1. 교배 십자가
- 28mm 직경의 유리 바이알당 성인 여성 1명과 성인 남성 2명을 사용하십시오. 딸이나 아들만 낳을 엄마의 날개 표현형을 인식하는 데 100% 성공하면 바이알당 두 마리의 암컷과 두 마리의 수컷을 사용하여 유충/바이알의 수를 늘립니다. 암컷보다 마취에서 더 빨리 깨어나는 수컷을 추가하기 전에 각 바이알에 암컷을 추가합니다.
알림: 아래 설명은 CO2가 있다고 가정합니다. 또는 에테르를 사용하여 성인 파리를 마취시킬 수 있습니다. - 성충 파리를 마취하기 위해 에테르를 사용하는 경우, 접힌 실험실 물티슈(예: 킴와이프) 패드를 코플린 병의 둥근 유리 뚜껑 안쪽에 테이프로 붙이고 스포이드를 사용하여 병에서 약간의 에테르를 옮겨 실험실 닦음 패드를 적십니다(그러나 포화되지 않고 너무 젖어서 에테르 액체가 떨어져 파리가 익사할 위험이 있음). 아래 1.6 단계의 경우 성인이 움직임을 멈출 때까지 젖은 에테르 패드를 열린 바이알 위에 ~1분 동안 놓습니다. 성충을 흰색 세라믹 타일 플레이트 (흰색 플라이 패드 대신 사용)로 옮기면 주기적으로 (파리의 다리가 경련하기 시작할 때) 접시의 파리 위에 갓 에테르로 적신 패드를 ~ 1 분 동안 유지합니다.
주의 : 에테르는 가연성이므로 냉장고가 아닌 환기 후드에 보관해야 합니다. - 성인 암컷의 바이알이 담긴 트레이, 성인 남성이 담긴 트레이, 2.2%(wt/vol) 한천이 들어 있는 빈 바이알이 담긴 트레이를 팔이 닿는 곳에 배치합니다. 실험실 벤치에 "여성" 또는 "남성"과 어머니의 날개 표현형이 적힌 플래카드 메모를 놓아 십자가를 위해 선택된 성인이 있는 바이알이 한 그룹의 모든 바이알에는 남성 자손만 있고 다른 그룹의 모든 바이알에는 여성 자손만 있는 올바른 그룹에 배치됩니다.
알림: 성인이 물방울에 달라붙을 수 있으므로 바이알 내에 응축 물방울이 없는지 확인하십시오. 바이알을 플라스틱 상자에 보관한 경우 사용하기 전에 바이알을 실온의 실험실 벤치에 놓고 응축수가 증발하도록 합니다. - CO2 가스와 램프를 켭니다.
알림: 광섬유가 있는 광원은 열을 덜 방출하여 마취된 파리가 더 빨리 깨어나기 때문에 선호됩니다. - 성인이 있는 바이알을 고무 패드에 세게 두드려 성인이 바이알 바닥으로 떨어지도록 하고 플러그를 제거합니다. CO2 건 노즐을 삽입하고 플러그를 다시 추가하십시오.
- 노즐 방아쇠를 눌러 CO2 가 성인을 마취하기 위해 ~1분 동안 바이알로 흐르도록 합니다.
- CO2 가 건 노즐이 아닌 흰색 플라이 패드로 흐르도록 풋 페달에 발을 올려 놓습니다. 파리가 흰색 플라이 패드에 있는 동안 내내 발 페달을 밟고 있습니다(또는 파리의 다리가 경련하기 시작할 때마다 간헐적으로 발 페달을 밟으십시오).
- 바이알에서 노즐과 플러그를 제거하고 해부 현미경으로 흰색 플라이 패드 위에 바이알을 뒤집습니다.
- 거꾸로 된 바이알의 바닥을 현미경에 대고 두드려 성체가 바이알에서 흰색 플라이패드로 떨어지도록 합니다.
- 가장 뚱뚱한 성체(최근에는 하얀 복부로 봉합됨)를 선택하고 끝이 가는 집게를 사용하여 성체의 중간 또는 뒷다리를 부드럽게 들어 올립니다. 짝짓기 춤에 사용되는 앞다리를 다치게 하지 마십시오. 날개가 짧고 완전히 발달하지 않아 날개 표현형을 점수화할 수 없기 때문에 몸이 완전히 하얗고 아직 검게 변하지 않은 성인은 사용하지 마십시오. 더 날씬한 복부를 가진 성인은 여전히 사용할 수 있지만 생식력이 감소합니다. 날개가 몸에서 수직으로 솟아오른 마른 성인은 죽었으므로 사용하지 마십시오.
- 다른 손으로 2.2%(wt/vol) 한천이 있는 바이알에서 플러그를 제거합니다. 성인과 함께 겸자를 잡고 있는 손으로 겸자를 바이알의 상단 내벽에 세게 두드려 성인이 바이알 바닥으로 떨어지도록 합니다. 플러그를 바이알에 교체합니다.
- 위의 1.5-1.11단계를 반복하여 여성 성인이 들어 있는 각 바이알을 설정합니다. 붓을 사용하여 흰색 플라이 패드에서 사용하지 않은 파리를 쓸어 부모 바이알로 다시 쓸어냅니다. 부모 바이알의 라벨에 체크 표시를 하여 짝짓기에 사용되었음을 나타냅니다(필요한 경우 다시 사용할 수 있음).
- 일상적인 재고 관리를 위해 여성 생산자 어머니가 있는 6-8개의 바이알과 남성 생산자 어머니의 6-8개 바이알을 설정합니다(그림 4). 한 성인 바이알의 바이알 절반을 어머니(또는 아버지)로 설정하고 새 바이알의 나머지 절반은 다른 성인용 바이알을 사용하여 유전적 병목 현상을 최소화합니다.
- 때때로, 잘못된 분리 사건으로 인해 암컷 생산 바이알에서 뛰어난 수컷이 생성될 수 있습니다. 다 자란 암컷이 들어 있는 유리병에 뛰어난 수컷이 있으면 제거하고 으깨서 그 수컷을 죽입니다. 가능하면 해당 바이알에서 모든 암컷을 버리고 더 많은 성인 암컷이 닫혀 교배에 안전하게 사용할 수 있을 때까지 몇 일 동안 기다리십시오.
참고: 해당 바이알에 있는 암컷을 교배용으로 사용하지 않는 것이 바람직합니다. 왜냐하면 그들은 뛰어난 수컷과 교미하여 비옥한 교배를 생산하지 않을 수 있기 때문입니다.
- 때때로, 잘못된 분리 사건으로 인해 암컷 생산 바이알에서 뛰어난 수컷이 생성될 수 있습니다. 다 자란 암컷이 들어 있는 유리병에 뛰어난 수컷이 있으면 제거하고 으깨서 그 수컷을 죽입니다. 가능하면 해당 바이알에서 모든 암컷을 버리고 더 많은 성인 암컷이 닫혀 교배에 안전하게 사용할 수 있을 때까지 몇 일 동안 기다리십시오.
- 성체 암컷이 모든 바이알에 추가되면 1.5-1.11단계를 반복하여 이미 암컷 파리가 들어 있는 각 바이알에 두 개의 성체 수컷(그림 4)을 추가합니다. 암컷이 있는 유리병을 고무 패드에 두드려 두 마리의 수컷을 순차적으로 추가할 때 빠져나가지 않도록 합니다.
알림: 빨리 작업하고 성인 파리를 죽일 수 있으므로 과도하게 마취하지 마십시오. - 각 바이알에 스톡, 교배종(암컷 또는 수컷 자손의 경우), 어미가 성인 바이알 #1 또는 #2에서 유래했는지 여부, 짝짓기 날짜를 나타내는 라벨을 추가합니다. 또한 위의 정보를 노트북에 입력하고 각 십자가에 대해 설정된 바이알의 수를 명시합니다.
알림: 트레이에서 수컷 생성 바이알과 암컷 생성 바이알을 분리하기 위해 종이 타월을 추가하는 것이 편리합니다. - 유리병을 조리대 위에 ~15분 동안 그대로 두어 성인이 깨어나 날아다닐 수 있도록 합니다. 암컷과 수컷이 뒤쪽에서 뒤쪽으로 향하는 곳에서 짝짓기를 하고 있는지 관찰하십시오(수컷 걸쇠는 암컷의 뾰족한 산란관을 잡을 것입니다)(그림 4, 하단).
참고: 성인 암컷은 성인 수컷을 한 번만 받아들이므로 짝짓기 과정에서 수컷과 암컷이 분리될 수 있고 암컷이 다시 짝짓기를 하지 않을 수 있으므로 짝짓기 후 바이알을 밀치지 마십시오. - 짝을 이룬 바이알이 있는 트레이를 인큐베이터(예: 21°C)에 놓습니다. 트레이에 재고 이름(예: HoLo2)과 5주 주기의 주(1주, 2주, 3주, 4주 또는 5주)로 라벨을 붙입니다.
알림: 방금 짝짓기를 한 파리가 있는 트레이를 인큐베이터의 별도 부분이나 다른 인큐베이터에 보관하여 유충이 나올 때까지 바이알에 먹이를 주지 않도록 상기시킵니다(아래 설명 참조).
2. 대량 짝지어주기
참고: 일반적으로 B. coprophila 어미 한 마리는 60마리의 새끼를 낳습니다. 실험을 위해 더 많은 수의 자손이 필요한 경우, 위에서 설명한 단일 쌍 교배 대신 대량 교배를 수행할 수 있습니다. 대량 교배는 표준 28cm 직경의 유리 바이알에서 수행할 수 있으며, 이때 하루 후에 유도 난자 및 배아 수집을 위해 어미를 수집합니다. 그러나 더 많은 수의 유충이 필요한 경우 과밀을 방지하기 위해 표면이 더 큰 항아리에서 대량 교미가 수행됩니다. 유충이 숨을 쉴 수 있는 공기를 얻을 수 있도록 항아리 뚜껑에 여러 개의 작은 구멍을 뚫습니다.
- 위의 섹션 1의 단계를 따르되 끝이 가는 집게를 사용하여 모든 여성 생산자 어머니(또는 모든 남성 생산자 어머니)를 흰색 플라이패드의 앞쪽 모서리로 이동합니다. 10-15 명의 마취 된 뚱뚱한 성인 여성을 사용하고 뚜껑에 작은 구멍이 뚫린 바이알 또는 항아리에 붓으로이 그룹을 쓸어 넣습니다.
참고: 2.1단계와 2.2단계를 수행합니다. 비옥한 십자가를 방지할 수 있는 과잉 마취를 피하기 위해 대량 짝짓기를 위해 빠르게. - 20-25 마취 된 뚱뚱한 성인 남성을 선택하고 끝이 가는 집게로 흰색 플라이 패드의 앞쪽 모서리로 이동시킵니다.
- 마개나 뚜껑을 제거할 때 빠져나가지 않도록 암컷이 있는 유리병이나 항아리를 고무 패드에 세게 두드려 붓을 사용하여 흰색 플라이 패드에서 마취된 성인 남성 무리를 쓸어냅니다.
3. 대량 교배 후 배아 채취
- 짝짓기 후 하루(24시간) 1.5-1.11단계를 수행하여 성체 파리(암컷과 수컷의 혼합)를 마취하고 흰색 플라이패드로 옮깁니다.
참고: 성체 파리가 짝짓기를 할 때 난자 형성이 아직 완료되지 않았으며, 이는 마무리 감수분열을 유발합니다. 성숙한 난자는 난자가 배출될 때 정자에 저장된 정자에 의해 수정된다 29. 난자 형성이 완료되는 데는 1-2일이 소요될 수 있으므로 교미 후 알을 낳기 전에 1일이 허용됩니다. - 끝이 가는 집게를 사용하여 성인 암컷의 날개를 잡고 날개를 한천에 삽입한 2.2%(wt/vol) 한천이 포함된 직경 100mm 페트리 접시에 놓습니다. 흰색 플라이패드의 각 성인 여성에 대해 이 단계를 순차적으로 반복합니다. 플라이 패드에 있는 성인 남성을 버리십시오.
- 모든 암컷 파리가 한천에 찔리면 암컷 파리가 발작과 같은 움직임을 보일 때까지 집게로 머리를 부드럽게 짜서 알을 낳도록 유도합니다. 또는 그녀의 흉부를 부드럽게 쥐어짜십시오. 그런 다음 30-60분 이내에 수정란 클러스터를 낳습니다. 물에 적신 실험실 물티슈로 적신 뚜껑으로 페트리 접시를 덮어 계란이 뚜껑에 정전기적으로 끌리는 것을 방지합니다.
4. 유충의 "부화" 확인
- 짝짓기 1주일 후에 유충의 "부화"를 확인하십시오. 바이알에서 플러그를 제거하고 해부 현미경을 사용하여 유충 여부를 점수화합니다. 그들의 검은 턱은 열리고 닫히기를 반복하고 천천히 앞으로 나아갈 것입니다. 유충이 몇 마리 밖에 없는 경우 바이알 라벨에 "few"라고 적어 해당 바이알에 더 적은 양을 먹이도록 상기시킵니다. 해당 십자가가 있는 트레이의 각 바이알을 검사하고 노트북에 있는 유충이 있는 바이알의 수를 해당 짝짓기에 설정된 바이알 수 옆의 열에 입력합니다.
알림: 짙은 노란색 알은 발달하지 않습니다. 흰 알이 발달할 가능성이 있으며 유충이 나오기 1일 전에 알의 앞쪽 끝에 검은색 색소(미래의 턱)가 발달합니다. 끝이 검은 구로 끝나는 흰색 필라멘트로 곰팡이를 유충으로 착각하지 마십시오 - 곰팡이는 한천에서 앞으로 기어 다니는 유충과 달리 움직이지 않습니다. - 유충이 있는 각 유리병에 짚을 조금(한 번만) 추가하여 과도한 습도를 조절하고 유충을 위한 은신처를 제공합니다.
- 트레이를 인큐베이터(예: 21°C)로 옮기고 이전 주에 교배한 유충 트레이를 놓고 새로 나온 유충을 바이알에 먹이기 시작합니다(먹이기에 대한 아래 섹션 참조).
알림: 일반적으로 유충은 죽은 어머니 근처에 무리를 지어 그녀를 먹기 시작합니다. 아마도 이것은 어미의 장에서 유충의 장으로 효모를 옮기는 것으로 추정됩니다. 유충이 나오는 날 또는 그 후 2일 이내에 먹이를 시작할 수 있습니다. 주의: 먹이를 늦게 주면 유충은 서로를 잡아먹게 되며 바이알당 하나의 뚱뚱한 유충만 남게 됩니다! - 아직 유충이 없는 바이알을 일주일에 3일 동안 계속 확인하십시오. 7-10일 후에도 유충이 나타나지 않으면 바이알을 버리거나 바이알 세척을 위해 보관하십시오.
5. 음식 만들기
참고: 모든 식품 재료에는 살충제가 없어야 합니다!
- 큰 스푼을 사용하여 다음 재료를 부피별로 측정하고 금속 또는 유리 팬(예: 8인치 x 8인치 금속 베이킹 팬)에 넣습니다: 귀리 짚 4부(8큰술), 표고버섯 가루 2부(4큰술), 시금치 가루 1부(2큰술), 쐐기풀 가루 1부(2큰술). 큰 스푼을 사용하여 팬에 재료를 잘 섞습니다.
알림: 또는 각각 2부 대신 시금치 가루 또는 쐐기풀 가루 1부를 사용할 수 있습니다. - 팬을 알루미늄 호일로 덮고 20-30분 동안 건조 주기로 오토클레이브합니다. 하룻밤 또는 그 이상 실온으로 식히십시오.
- 팬에서 호일을 제거하고 굳은 멸균 식품 혼합물을 부수고 큰스푼으로 갈아서 가루 혼합물을 만듭니다.
- 맥주 효모 1부(수북한 2큰술)를 넣고 고압멸균된 식품 혼합물에 잘 섞습니다.
알림: 맥주 효모는 효모를 죽일 수 있으므로 고압멸균되지 않습니다. - 식품 혼합물을 멸균 뚜껑이 있는 병에 옮깁니다.
참고: 대량 결합에 사용되는 것과 동일한 유형의 240mL 병을 사용할 수 있으며 위의 조리법으로 병을 채울 수 있습니다. 마찬가지로, 동일한 유형의 멸균된 뚜껑이 있는 항아리는 호일로 덮인 팬에 고압멸균된 짚으로만 채워야 합니다.
6. 수유
알림: 유충의 나이와 양에 따라 주는 음식의 양을 조절하십시오. 대량 짝짓기로 많은 유충이 있는 항아리에 많은 음식을 주십시오. 발달 단계를 위해 며칠 동안 보관되는 유충이 있는 페트리 접시에 음식을 가볍게 뿌립니다. 아래에 설명된 섭식 방법은 Charles Metz 29의 실험실에서 개발되었으며, 그의 실험실과 Helen Crouse, Susan Gerbi 및 기타 사람들이 한 세기 동안 성공적으로 사용해 왔습니다.
- 손을 씻고 잘 헹구어 비누를 제거하십시오.
알림: 장갑은 각 바이알에 제공되는 음식의 양을 조절하기 위해 손가락의 느낌을 감소시키므로 권장하지 않습니다. - 뚜껑이 있는 멸균 용기와 갈은 짚이 있는 멸균 용기와 음식이 담긴 멸균 용기를 유충이 보관되는 인큐베이터(예: 21°C)에 보관합니다. 항아리에서 뚜껑을 제거하고 쉽게 접근할 수 있도록 깨끗한 그릇(예: 사탕 접시)에 음식을 붓습니다. 남은 음식이 들어있는 병의 뚜껑을 교체하십시오. 음식이 담긴 열린 그릇을 금속 또는 유리로 된 작은 쟁반에 보관하십시오. 이렇게 하면 진드기나 다른 곤충이 쟁반 벽을 기어 나와 음식과 함께 그릇에 들어가는 것을 방지할 수 있습니다.
- 두 번째와 세 번째 손가락 사이(또는 엄지와 두 번째 손가락 사이)에 음식을 집습니다. 다른 손으로 트레이에서 바이알을 제거하고 플러그를 제거하고 수유하는 동안 손가락으로 잡고 있습니다. 바이알에서 유충의 나이와 수를 검사하고 음식을 들고 있는 두 손가락을 서로 맞대고 회전시켜 바이알에 적절한 양의 음식을 넣습니다. 새로 출현한 유충이 있는 유리병은 몇 알의 먹이만 있으면 됩니다. 더 오래된 유충이 있는 바이알은 한천의 상단을 덮고 있는 얇은 먹이 층이 있어야 합니다.
- 바이알에 흰색 곰팡이가 있는 경우 실험실 물티슈에 70% 에탄올을 뿌려 긴 금속 프로브(예: 나무 손잡이)를 닦아내고 플러그를 제거한 다음 깨끗한 프로브를 바이알에 삽입하여 한천 표면의 곰팡이를 탭합니다. 곰팡이가 많으면 프로브를 소용돌이쳐 프로브 주위에 곰팡이를 감아 바이알에서 제거합니다. 유충이 살고 있으므로 한천의 상단을 방해하지 마십시오. 소량의 음식만 넣고 바이알의 플러그를 교체합니다. 프로브를 보관하거나 다른 바이알을 청소하는 데 사용하기 전에 70% 에탄올에 적신 실험실 물티슈로 프로브를 깨끗이 닦으십시오.
- 트레이의 모든 바이알이 주입되면 인큐베이터의 트레이를 교체하고 6.3단계와 같이 공급을 위해 다음 트레이를 제거합니다.
- 수유가 완료되면 그릇에 남은 음식을 미리 멸균한 병에 붓고 용기의 뚜껑을 닫고 인큐베이터에 보관합니다.
7. 페트리 플레이트에 유충 또는 번데기 수집
- 소량의 유충의 경우 70% 에탄올로 닦은 금속 프로브 또는 주걱을 사용하여 바이알의 한천 최상층을 파고 일부 유충이 있는 부착된 한천을 2.2%(wt/vol) 한천으로 반쯤 채워진 100mm 직경의 멸균 페트리 접시에 옮깁니다.
- 유충의 수가 많은 경우 바이알 바닥의 벽을 따라 주걱을 삽입하여 바이알에서 한천 플러그를 쉽게 빼내고 빈 페트리 접시에 앞면이 위로 향하게 놓습니다. 해부 현미경을 사용하여 한천 마개 상단에서 유충을 찾아 끝이 가는 집게로 2.2%(wt/vol) 한천으로 반쯤 채워진 100mm 직경의 멸균 페트리 접시에 옮깁니다.
- 해부 현미경을 사용하여 끝이 가는 집게가 있는 유충을 동일한 발달 단계의 그룹으로 분류합니다.
참고: 약간의 발달 비동기로 인해 Petri 플레이트에는 2.2%(wt/vol) 한천을 가진 분류된 유충의 여러 다른 클러스터가 있을 것입니다. - 약간의 음식을 뿌리고 유충이 있는 페트리 접시를 인큐베이터에 넣습니다. 원하는 발달 단계를 선택하기 위해 해부 현미경으로 관찰하기 위해 매일 제거하십시오.
참고 : DNA 퍼프 연구의 경우, 초기 안점 유충은 10x5, 12x6, 14x7 및 가장자리 눈 / 드롭 턱 단계를 진행하며 이러한 각 단계에서 ~ 1 일 30,31. 눈의 1/4에서 1/2이 색소로 채워진 번데기를 선택하여 번데기 고환에 감수분열 I 및 II 단계가 있습니다.
8. 유충의 냉장실 보관
- 백업으로, 약 4 개의 암컷 유충 바이알과 2 주 연속 교배에서 얻은 수컷 유충 4 바이알을 냉장실에 보관하십시오.
- 백업 저장을 위해 초기4th instar(pre-eye-spot stage)인 유충을 먹이고 냉장실 선반의 열린 트레이에 넣으십시오. 이 바이알을 한 달에 한 번만 먹이십시오.
- 2-3 개월 후에 추위에서 짝짓기 십자가의 연속 2 주에서 16 개의 바이알을 제거하십시오 (달력에 알림으로 표시하십시오). 인큐베이터(예: 21 °C)에 넣어 정상적으로 먹이고 성체로 성장하여 십자가에 사용할 수 있도록 합니다.
- 바이알을 냉장실에서 꺼낼 때 초기 4번째 instar 유충이 있는 새 바이알 세트를 냉장실에 넣어 이 바이알을 항상 재고의 백업으로 사용할 수 있도록 합니다.
참고: 냉장실 보관 후 생존력은 다양한 발달 단계에 대해 체계적으로 테스트되지 않았지만 우리의 경험에 따르면 초기 4번째 instar 유충의 냉장 보관이 잘 작동하는 것으로 나타났습니다.
9. 바이알 세척
- 성체가 죽은 후(에클로젼 후 ~2-3주 후) 인큐베이터에서 바이알을 제거하고 60-70°C에서 1시간 동안 두어 남아 있는 유기체를 죽입니다.
- 면 플러그를 제거하고 플라스틱 상자에 보관하십시오.
- 주걱을 사용하여 바이알의 한천 플러그를 쓰레기통에 긁어냅니다.
- 바이알을 하룻밤 동안 또는 접시 냄비의 물에 더 오래 담가둡니다.
- 이 용도로만 보관된 시험관 브러시(화학 물질이나 비누가 있는 용기에는 사용하지 않음)를 사용하고 흐르는 수돗물 아래에서 바이알을 위아래로 문지릅니다. 세척한 바이알을 열린 면이 아래로 향하게 하여 금속 바구니에 넣습니다. 세척된 바이알로 바구니를 채웁니다.
알림: 잔류 비누는 B. coprophila를 죽일 수 있으므로 바이알에 비누를 사용하지 마십시오. - 바구니에 철망 뚜껑을 추가하고 뚜껑을 제자리에 고정한 상태에서 바구니를 뒤집어 모든 바이알을 탈이온수로 채웁니다. 뚜껑을 제자리에 고정한 상태에서 바스켓을 뒤집어 바이알에서 탈이온수를 비웁니다. 탈이온수를 4번 헹굽니다.
- 세척된 바이알이 있는 바구니를 종이 타월이나 개방형 메쉬 플랫폼(예: 실험실 카트)에 올려 하룻밤 또는 그 이상 건조시킵니다. 건조 바이알은 서랍에 보관하십시오.
알림: 진드기의 침입을 유발할 수 있으므로 세척하기 전에 죽은 성인이 담긴 유리병을 너무 오래 두지 마십시오.
10. 쏟아지는 한천
- 큰 용기(금속 바구니 또는 금속 트레이)에 깨끗한 바이알을 채우고 각 바이알에 면 플러그를 추가합니다. 바이알을 세척할 때 오래된 바이알에서 가져온 플러그를 재사용하고 플러그가 분해되어 폐기해야 할 때까지 플러그를 반복적으로 사용하십시오. 막힌 바이알로 용기를 건조 사이클로 ~30분 동안 멸균하고 실온으로 냉각시켜 오토클레이브 용기에 보관합니다. 항상 고압멸균된 플러그형 바이알이 있는 두 개의 용기(하나는 활발하게 사용 중이고 다른 하나는 예비)를 손에 두십시오.
- 11.0L 삼각 플라스크에 한천 분말 1g을 넣고 증류수 500mL를 추가하여 ~24 바이알(~21 mL/바이알)을 붓기에 충분한 2.2%(wt/vol) 한천 용액을 만듭니다. 플라스크를 휘젓고 전자레인지에 넣습니다.
알림: 이제부터는 내열성 오토클레이브 장갑을 사용하여 플라스크를 다루십시오. 필요한 경우 동일한 2.2%(wt/vol) 한천 용액을 페트리 플레이트(수확된 유충의 경우) 또는 항아리(대량 짝짓기의 경우)에 부을 수 있습니다. - 전자레인지에 1분, 플라스크를 꺼내 휘젓고 전자레인지에 넣었다가 다시 전자레인지에 1분간 돌린다. 이 작업을 여러 번 반복합니다.
- 전자레인지의 유리문을 통해 플라스크를 감상하세요. 한천 용액이 거품을 일으키고 끓기 시작하면 즉시 수동 정지 버튼을 사용하십시오. 이 시점에서 플라스크를 휘젓지 말고(끓을 수 있음) 오븐에서 카운터로 조심스럽게 제거하고 몇 분 동안 그대로 두십시오.
- 멸균된 바이알에서 플러그를 제거하고 한 손으로 잡습니다. 다른 손을 사용하여 ~2.5cm 높이의 2.2% 한천을 멸균된 바이알에 붓습니다. 그런 다음 플러그를 바이알에 교체합니다. 모든 한천이 부어질 때까지 이것을 반복합니다.
알림: 바이알에 한천을 너무 적게 붓으면 사용 중에 더 빨리 건조되고 바이알 벽에서 줄어들게 됩니다. 바이알에 한천을 너무 많이 부으면 해부 현미경으로 유충의 "아기 부화"를 측정할 때 최상층에 초점을 맞추기가 어렵습니다. - 쏟아진 바이알을 실온에서 1-2일 동안 카운터에 두어 한천이 굳어지고 수분이 완전히 증발하도록 합니다. 십자가를 짝짓기 위해 바이알을 사용하거나 꽉 끼는 뚜껑이 있는 플라스틱 상자에 옆으로 눕혀 보관하십시오. 상자에 뚜껑을 덮기 전에 바이알 위에 물을 적신 종이 타월을 놓습니다(이렇게 하면 한천이 건조되어 바이알 벽에서 줄어들어지는 것을 방지할 수 있습니다). 바이알을 부은 상자를 실온에서 며칠 동안 보관하거나 4°C 냉장고 또는 냉장실에서 최대 2주 동안 보관하십시오. 보관된 바이알을 사용하기 전에 상자에서 바이알을 꺼내 실온의 카운터에 한두 시간 동안 두어 바이알 내부에서 응결이 증발하도록 합니다(성충 파리가 응축수에 달라붙어 익사할 수 있음).
11. 바이알용 플러그 만들기
- 깨끗한 바이알을 스티로폼 50mL 시험관 홀더에 넣습니다(튜브가 똑바로 서도록 강제로 밀어 넣습니다). 정사각형의 무명천(2-4겹 두께)을 잘라 유리병 위에 놓습니다.
- 이전에 만든 플러그의 무명천 조각을 무명천 위에 올려 더 두꺼운 층을 만듭니다. 무명천 위에 솜을 놓고 바이알을 눌러 바이알의 상단 인치 정도를 단단히 채우십시오.
- 무명천의 끝 부분을 함께 잡고 끈으로 묶습니다. 여분의 끈과 여분의 무명천을 자릅니다(끈을 묶을 수 있도록 끈의 꼬리를 충분히 남겨두고 플러그를 편안하게 잡을 수 있는 충분한 무명천을 남겨 두십시오).
알림: 플러그가 꼭 맞도록 끼우십시오. 한 손에 들고 있는 동안 검지와 검지로 빼낼 수 있어야 합니다. 바이알을 플러그로 잡았을 때 떨어지면 너무 헐거워진 것입니다. 빼냈을 때 펑하는 소리가 크게 나면 너무 빡빡한 것일 수 있습니다. 플러그가 너무 꽉 조이거나 플러그에 단단하고 건조한 한천 층이 있으면 파리가 질식할 수 있습니다. 플러그가 너무 느슨하거나 바이알 측면에서 미끄러지는 경우 조리대를 두드려 약간 더 넓은 크기로 찌그러뜨릴 수 있습니다.
12. 일반적인 주간 일정(효율성을 극대화하려면 나열된 순서대로 작업 수행)
- 월요일 (~30분)
- 유충으로 바이알을 먹이십시오.
- 플러그가 있는 멸균 깨끗한 바이알에 한천을 붓습니다.
- 수요일 (~2시간)
- 죽은 성인이 담긴 바이알을 오븐에 1시간 동안 넣고 세척을 위해 보관합니다.
- 유충 "아기 부화"를 확인하십시오.
- 유충으로 바이알을 먹이십시오.
- 매주 짝짓기 교배를 수행합니다.
- 필요에 따른 기타 의무: 필요에 따라 예비 공급을 확보하기 위해 플러그가 있는 깨끗한 바이알을 오토클레이브합니다. 필요에 따라 새로운 음식과 오토클레이브 짚을 만드십시오. 음식과 밀짚에 필요한 오토클레이브 항아리.
- 금요일 (~30분)
- 유충 "아기 부화"를 확인하십시오.
- 유충으로 바이알을 먹이십시오.
대표적 결과
여기에 설명된 프로토콜은 B. coprophila를 키우는 데 성공한 것으로 입증되었습니다. 최근에 멸종된 뚱뚱한 성체를 짝짓기를 위해 선택하면(그림 4), 교배종의 90% 이상이 번식력이 있고 자손을 낳을 수 있습니다. 임신 성공률은 주식에 따라 다릅니다(표 2). 주식 7298 (물결 모양의 마커가 있는 X' 염색체)은 가장 건강한 주식이었지만 게놈 재배열을 생성하는 DNA 이동 요소의 활성화로 인해 감소기를 겪었다32. HoLo2 스톡은 7298에서 파생된 건강한 균주를 나타내며, 게놈 재배열이 안정화된 것으로 보이며, 스톡 센터의 부모 7298 스톡을 대체했습니다. HoLo2 스톡은 B. coprophila 게놈의 염기서열을 분석하는 데 사용된 스톡이며 다양한 실험실 그룹에서 가장 널리 사용되는 스톡입니다. 최근에는 HoLo2 파리의 CRISPR 돌연변이 유발을 사용하여 형광 눈 마커와의 형질전환에 사용할 백색 눈 표현형을 가진 W14 스톡을 생성했습니다(Yamamoto 및 Gerbi, 데이터는 표시되지 않음). W14 균주는 매우 견고합니다. 6980 스톡(물결 모양의 날개 및 부풀어 오른 정맥 마커)은 다소 덜 견고하고 91S 스톡(작은 날개 마커)은 훨씬 덜 견고합니다.
성공적인 교배는 배아를 낳습니다(그림 5). 배아는 7번째에서 9번째 분열 분열에서 각인된 부계 X 염색체의 제거를 겪습니다. 또한, 생식계통 제한 L 염색체는 5번째에서 6번째 분열 분열에서 배아의 체세포 계통에서 제거됩니다. 배아는 유충으로 나타나며, 이는 존재할 수 있는 곰팡이와 혼동되어서는 안 됩니다(그림 6). 안점(성인 눈에 대한 반점)은 4번째 유충 인스타의 후반부에 나타납니다(그림 7). 안점의 크기는 DNA 퍼프 증폭의 시작 및 진행을 위한 편리한 표현형 마커를 제공하며, 이는 자연적으로 발생하는 발달 조절 부위 특이적 염색체 내 DNA(유전자) 증폭의 알려진 두 가지 예 중 하나입니다. 그 후, 번데기가 발달하고 번데기의 눈을 채우는 색소의 양은 정자 형성에서 감수분열 I 및 II에 대한 발달 표지자로 작용할 수 있으며(그림 8) 이러한 분열에서 독특한 염색체 행동을 보입니다.

그림 4: 성체 B. coprophila 파리의 짝짓기. 상단 패널은 HoLo2 스톡에 있는 세 가지 유형의 성체 파리, 즉 물결 모양의 날개를 가진 암컷 생산 어미(X'WX 성체 암컷), 곧은 날개를 가진 수컷 생산 어미(XX 성체 암컷), 곧은 날개를 가진 수컷(X0 성체 수컷)을 보여줍니다. 암컷 파리의 뒤쪽 끝에 있는 뾰족한 산란관과 수컷 파리의 뒤쪽 끝에 있는 갈고리 모양의 걸쇠에 유의하십시오. 아래쪽 패널은 수컷과 암컷의 짝짓기를 보여주며, 수컷 걸쇠가 암컷의 산란관을 움켜쥔 것입니다. 정자는 암컷의 정자에 저장되고 난자가 외부로 배출될 때 수정됩니다. 성인의 길이는 2.0mm(수컷), 2.5mm(암컷)입니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
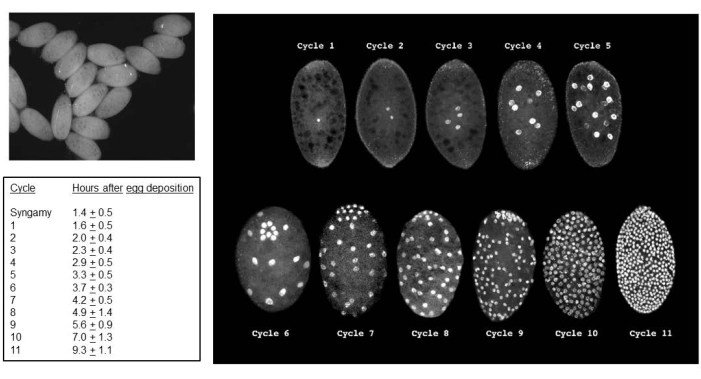
그림 5: B. 코프로필라 배아(B. coprophila embryos). 왼쪽 상단 패널은 해부 현미경에서 표준 빛을 사용하는 배아의 모습입니다. 세포융합 세포질의 핵은 검은 점으로 나타납니다. 오른쪽 패널은 형광 현미경을 사용하여 배아의 프로피듐 요오드화물 염색 핵을 시각화합니다. 배아의 평균 길이는 200미크론이고 평균 너비는 150미크론입니다. 생식 세포의 핵은 사이클 6 (배아가 앞으로 기울어짐) 및 7-9에서 볼 수 있듯이 배아의 후극에 모여 있으며, 그 후에는 체세포핵이 산재 해 있습니다. 체세포 계통에서 L 염색체 제거는 분열 분열 5 또는 6에서 발생합니다. 체세포 계통에서 X 염색체 제거는 7번째, 8번째 또는 9번째 분열 분열에서 발생합니다. 셀룰라화는 사이클 11의 간기 동안 발생합니다. 왼쪽 표는 22°C에서 각 분할 주기의 평균 시간을 보여줍니다. 왼쪽 테이블과 오른쪽 패널은 de Saint Phalle과 Sullivan35의 허가를 받아 개조되었습니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
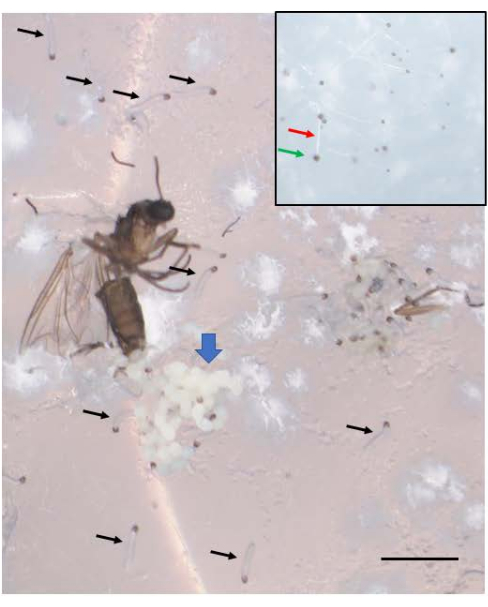
그림 6: B. coprophila 배아가 유충으로 출현합니다. 알을 낳은 후 사망한 성인 암컷의 산란관 근처에서 배아 군집(파란색, 두꺼운 화살표)이 보입니다. 알을 낳은 지 일주일 후, 배아는 어린 유충이되며, 그 중 일부는 검은 화살표로 표시됩니다. 새로 나온 유충은 앞쪽 끝에 검은 턱과 반투명한 몸체를 가지고 있습니다. 그들은 한천 표면 위에서 움직이며 움직이지 않는 곰팡이와 혼동해서는 안됩니다. 삽입물에는 흰색 필라멘트(빨간색 화살표)와 끝에 검은색 포자(녹색 화살표)가 있는 곰팡이가 있으며 새로 나온 유충보다 약간 작습니다. 축척 막대 = 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
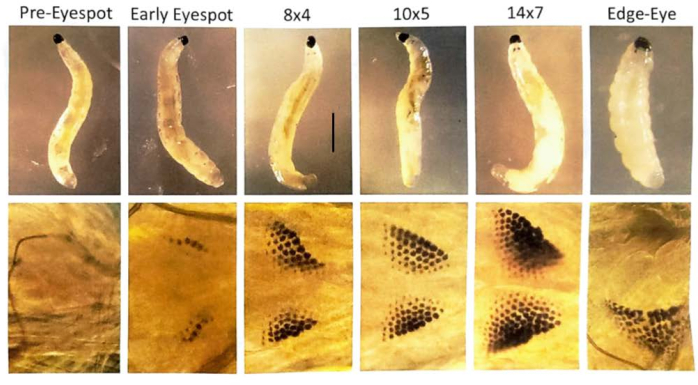
그림 7: B. coprophila 유충의 안점 단계. 눈반점은 턱 바로 뒤의 유충 앞쪽에 형성되며 수가 증가하는 색소 과립으로 구성됩니다. 안점은 성인의 눈에 대한 항문입니다. 상단 패널은 해부 현미경으로 시각화된 유충을 보여줍니다. 하단 패널은 위상차 현미경을 사용하여 증류수 한 방울과 위에 가볍게 떠 있는 커버슬립으로 현미경 슬라이드에 유충을 시각화한 안점을 확대한 것입니다. 안점 단계의 명명법은 Gabrusewycz-Garcia30 에 따르며, 여기서 과립의 수는 가장 긴 행(예: 12)에서 계산되고 가장 긴 행을 제외한 추가 행의 수가 표시됩니다(예: 안점 단계 12x6의 경우 6). 타액선 폴리텐 염색체에서 부위 특이적 DNA 증폭의 시작은 안점 단계 10x5에서 시작하여 유전자좌에서 전사의 폭발과 DNA 퍼프의 확장이 있을 때 14x7에서 완료됩니다(31). 후속 가장자리 눈/드롭 턱 단계에서 안점 과립이 합쳐지기 시작하고 정중선에서 측면으로 멀어집니다. 유충 몸체의 길이가 짧아집니다. 또한, 이 단계에서 DNA 퍼프가 응축됩니다. 21°C에서 각 안점 단계를 통과하는 데 약 하루가 걸립니다. 축척 막대 = 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
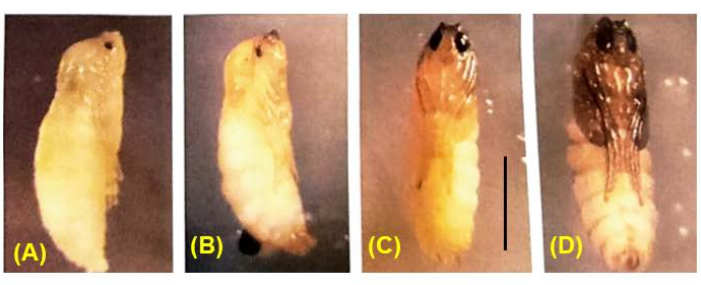
그림 8: B. coprophila pupae의 발달. 번데기가 생기는 동안, 신경계를 제외한 모든 유충 조직은 조직분해되고 상상 디스크의 세포 분열에 의해 발생하는 성체 조직으로 대체됩니다. 몸색은 흰색에서 황갈색으로, 갈색에서 검은색으로 바뀝니다. 색소는 점차적으로 번데기를 채웁니다. 감수분열 I과 II는 색소36으로 채워진 1/4에서 1/2의 눈을 가진 수컷 번데기에서 발생한다. 축척 막대 = 1mm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
| 주식 이름 | 마커 | 출산율 | 코멘트 |
| 7298 | 물결 모양(W) 날개 | ~75% | |
| 홀로2 | 물결 모양(W) 날개 | ~90% | 에서 파생 된 7298 |
| 승14 | 물결 모양(W) 날개; 하얀 눈 | ~95% | HoLo2에서 파생 |
| 6980 | 물결 모양(W) 날개; 부풀어 오른 (SW) 정맥 | ~65% | |
| 91년대 | 약한 물결 모양(W) 날개; 몸집이 작은 (P) 날개 | ~50% | Wavy 마커는 91S를 구출하기 위해 십자가에 도입되었습니다. |
표 2 : Bradysia (Sciara) coprophila의 주식. Gerbi6의 표 1에는 이러한 마커와 더 이상 존재하지 않는 다른 마커가 나열되어 있습니다. X27의 중심 말단에 있는 5개의 전좌(T1, T23, T29, T32, T70)는 Gerbi6의 그림 8에 요약되어 있지만 더 이상 존재하지 않습니다.
보충 파일 1: HoLo2(및 7298 및 W14) 교차, 91S 교차 및 구조, 6980 교차, 전위 교차. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
B. coprophila의 축산을 위해 여기에 제시된 프로토콜은 이 유기체의 고유한 생물학적 특징을 탐구하기 위한 실험을 위해 실험실에서 이 유기체를 키우고자 하는 과학자들에게 유용할 것입니다. B. coprophila29를 유지하기 위해 한천 염기에 효모와 버섯 분말을 뿌려 먹이는 방법에 대한 초기 설명은 Metz 실험실에서 14 종의 Sciarid 파리를 기르는 데 사용되었습니다5. 그 후, 쐐기풀 및/또는 시금치 분말의 첨가가 B. coprophila의 활력을 더욱 증가시키는 것이 관찰되었습니다(Gabrusewycz-Garcia, personal communication). 이러한 방법은 현재 배양 중인 Bradysia impatiens와 Lycoriella ingenua를 포함하여 Sciaridae 가족 내의 관련 종의 유지에 성공적이었습니다(Robert Baird, personal communication).
다른 방법(예: 아래에 설명된 대체 먹이 방법)이 B. coprophila를 키우기 위해 시도되었지만, 여기에 설명된 프로토콜은 가장 비옥한 지방 성체를 얻고 곰팡이의 성장을 최소화하기 위해 한천의 표면적당 가장 유리한 유충 비율을 갖도록 최적화되었습니다. 규모를 확장하기 위해 위의 프로토콜 2에 설명된 대로 유리 바이알에서 대량 결합을 수행할 수 있습니다. 대안적으로, 몇 마리(2-4)마리의 성인 암컷을 초파리 를 기르는 데 사용되는 것과 같은 플라스크에 두 배 많은 성인 남성과 함께 넣을 수 있습니다(일회용 6온스 = 177.4mL 정사각형 바닥 초파리 폴리프로필렌 병). 두 경우 모두에서, 연구자는 플라스크에 모든 여성 생산자 또는 모든 남성 생산자 어머니만 포함되어 있다는 것을 완전히 확신해야 합니다.
번데기와 성충은 먹지 않기 때문에 유충에게만 먹이를 주십시오. 유충이 번데기로 변한 경우 바이알에 먹이를 주지 마십시오(이것의 징후는 처음으로 일찍 출현하는 성충 파리가 나타날 때입니다). 성체가 닫히면 바이알을 더 차가운 인큐베이터(예: 16°C)에 넣으면 성체가 더 오래 살 수 있습니다. 일주일에 세 번(예: 월요일, 수요일, 금요일) 먹이를 주고 유충이 자라면서 바이알당 주는 음식의 양을 늘립니다. 넉넉하게 먹이면 뚱뚱하고 비옥한 성인으로 보상받을 수 있습니다. 그러나 너무 많이 먹이면 흰 곰팡이가 나타나며 이는 바이알에 쌓이는 음식의 양을 줄이라는 신호입니다. 또한 너무 많이 먹이면 한천 위에 두꺼운 먹이 패드가 생겨 성충이 나오기 어렵게 됩니다(집게로 패드를 제거할 수 있지만 패드로 유충을 꺼내지 않도록 주의하십시오. 전혀 하지 않는 것이 가장 좋습니다). 유충이 거의 없는 유리병("few"로 표시)은 더 적은 양의 음식이 필요합니다. 너무 적게 먹이면 유충이 먹이를 찾기 위해 유리병의 벽을 기어오를 것입니다. 영양이 부족한 유충은 번식력이 떨어지는 작은 성충을 낳습니다.
대체 수유 방법
일주일에 3번이 아닌 유충 단계에서 한 번만 유충에게 먹이를 주기 위한 다양한 방법이 시도되었습니다. B. coprophila 는 초파리 스타일의 식품에서 자라지 않습니다. John Urban (개인 커뮤니케이션)은 B. coprophila 식품을 한천에 섞어 보았지만 곰팡이가 너무 많이 자랐습니다. 그는 두 가지 곰팡이 억제제(테고셉트와 프로피온산)를 조합하여 또는 따로 첨가하여 여러 가지 다른 농도를 시도하면 모두 곰팡이를 억제하는 수준에서 B. coprophila 에 독성이 있음을 발견했습니다. 한천은 pH 6-7(중성)이어야 하며, B. coprophila 는 산성 pH(프로피안산과 마찬가지로)에서 병에 걸립니다. 또는 일주일에 세 번 먹이를 주지 않기 위해 바늘 없이 주걱이나 주사기를 사용하여 걸쭉한 효모 페이스트(Red Star 활성 건조 효모를 약간의 증류수와 혼합하여 적시게 하는 것)를 짝짓기 후 1주일 후(즉, 유충이 나오기 시작할 무렵) 각 유리병의 한천 위에 덩어리로 분배해 보았습니다.
일주일에 세 번 먹이는 것을 피하는 또 다른 방법은 각 바이알에 살아있는 곰팡이 배양액을 추가하는 것입니다. Bath and Sponsler(37 )는 Sabouraud의 배지가있는 경 사진 한천 표면은 Chaetoconidia (최고) 속의 곰팡이 배양 또는 Baplosporangia 또는 Xllescheria로 줄무늬가되어야한다고보고했습니다. 곰팡이는 B. coprophila 가 도입되기 몇 일에서 일주일 전에 성장했습니다. 그 후에는 수유가 필요하지 않았습니다. 이 방법의 변형은 Ellen Rasch (개인 의사 소통)에 의해서도 사용되었습니다. 우리 손에서는 이 방법으로 바이알이 너무 젖어 유충이 익사했지만, 살아있는 곰팡이가 있는 바이알에 비해 유충 수를 최적화하기 위해 다시 시도할 수 있었습니다.
아서 포러(Arthur Forer)는 학파리와 같은 방법으로 B. 코프로필라(B. coprophila )를 기르는 데 어느 정도 성공을 거두었다(38). 이 접근 방식을 통해 번데기는 축축한 종이 마셰에서 자랐습니다. 그 후, 성충을 교배시키고 알을 신선하고 촉촉한 종이 마셰에 쌓았습니다. 그 결과 태어난 유충은 페트리 접시에 담아 종이 에 담아 일주일에 두 번 쐐기풀 잎 가루를 먹였습니다. 번데기를 새장에 넣어 이 과정을 반복했습니다.
Yukiko Yamashita (개인 커뮤니케이션)는 습도가 높은 화분과 온실에서 자연에서 발견되는 조건을 모방하여 토양에서 B. coprophila를 기르려고 노력했지만 성공하지 못했습니다. 그러나 습도 수준이 높아지면 곰팡이가 문제가 될 수 있습니다. 그럼에도 불구하고 축축한 토양은 축축한 토양이 있는 플라스틱 상자에 Pseudolycoriella(이전에는 Bradysia) hygida 유충을 키우는 데 성공적으로 사용되었습니다. 그들은 분해 된 Ilex paraguariensis 잎을 먹이며, 1.2 % 효모 추출물, 1.4 % 옥수수 전분, 0.8 % 오트밀 가루, 1.2 % 한천12로 보충됩니다. 유사하게, 축축한 토양은 분쇄 된 강낭콩과 함께 축축한 이탄 이끼로 대체하여 Sciarid 파리를 키울 수 있습니다39,40.
브라디시아의 실험실 배양을 유지하기 위해 또 다른 방법들이 사용되었다: (i) 효모와 건조된 혈액 비료를 첨가한 고압멸균 감자41; (ii) 건조된 혈액을 첨가할 수 있는 분뇨 42,43,44 45; (iii) 면봉이 있는 플라스틱 용기와 다진 콩이 든 적신 종이 타월46.
진드기
진드기는 Drosophila에서 B. coprophila로 전염될 수 있습니다. 이를 최소화하기 위해, B. coprophila는 Drosophila 주식에 가깝지 않은 별도의 인큐베이터 또는 방에 보관하는 것이 가장 좋습니다. 또한, Drosophila를 다루기 전에 이른 아침에 B. coprophila 유지 관리 작업을 수행하십시오. 진드기는 또한 관엽 식물에서 B. coprophila로 옮겨질 수 있으므로 식물을 B. coprophila와 같은 방에 두지 마십시오. 진드기가 바이알에 침입하면 B. coprophila의 몸에 기어 다니는 작은 흰색 구형 유기체로 볼 수 있습니다. 초파리의 진드기를 파괴하는 화학 처리는 화학 물질이 B. coprophila를 죽이기 때문에 B. coprophila에 사용할 수 없습니다 (B. coprophila는 페놀과 같은 유기 가스에도 민감합니다). B. coprophila 주식에서 진드기를 제거하는 유일한 치료법은 한천 판에서 배아를 수동으로 수집하고 진드기가 없는지 각각 검사한 다음 가는 붓을 사용하여 신선한 한천 유리병에 옮기는 것입니다. 면으로 채워진 거즈 플러그와 셀룰로오스 아세테이트 폼 플럭(Drosophila 폴리프로필렌 바이알에 사용됨)은 모두 바이알에 진드기가 들어가는 것을 방지하는 데 도움이 됩니다.
축산 프로토콜의 유용성
여기에 설명된 프로토콜은 성장하는 과학자 커뮤니티가 B. coprophila 를 새로운/오래된 신흥 모델 유기체로 키워 고유한 생물학적 특징을 연구할 수 있도록 할 것입니다. 새로운 실험실 그룹은 Bradysia (Sciara)의 독특한 생물학적 특징을 유지하고 조사하기 위해 성장하는 커뮤니티에 가입하도록 권장됩니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
축산 프로토콜을 세밀하게 조정해 준 이전 B. coprophila 재고 보유자(Jacob E. Bliss, Paula Bonazinga, Anne W. Kerrebrock, Ingrid M. Mercer, Heidi S. Smith)와 연구 인력(특히 Robert Baird, Michael S. Foulk, Donna Kubai, John M. Urban, Yutaka Yamamoto)에게 특별한 감사를 드립니다. B. coprophila 치료에 대한 초기 지침은 Helen V. Crouse, Natalia Gabrusewycz-Garcia, Reba M. Goodman, Charles W. Metz 및 Ellen Rasch에 의해 제공되었습니다. Yukiko Yamashita와 Anne W. Kerrebrock에게 Bradysia (Sciara) 재고 센터를 맡아준 것에 대해 감사를 표합니다. 그림을 준비하는 데 도움을 주신 Brian Wiegmann(그림 1), John M. Urban(그림 4 상단 패널), Laura Ross(그림 4 하단 패널), Yutaka Yamamoto(그림 5 왼쪽 패널), Leo Kadota(그림 7 및 그림 8)에게 감사드립니다. 사진 촬영과 촬영에 도움을 준 Ava Filiss와 Brown University Multidisciplinary Laboratory에 감사드립니다. 이 원고에 대한 의견을 제시해 준 로버트 베어드(Robert Baird)에게 감사를 표한다. B. coprophila 에 대한 우리의 연구 및 유지는 NIH GM121455에서 S.A.G.에 이르기까지 가장 최근의 지원을 포함하여 NIH와 NSF의 지원을 받았습니다. B. coprophila 에 대한 자세한 내용은 현재 건설 중인 Bradysia (Sciara) Stock Center 웹사이트(https://sites.brown.edu/sciara/ 및 https://sciara.wi.mit.edu)에서 확인할 수 있습니다.
자료
| Name | Company | Catalog Number | Comments |
| Agar (bacteriological) | U.S. Biological | A0930 | https://www.usbio.net; |
| CO2 FlyStuff Foot Pedal | Genesee Scientific | 59-121 | |
| CO2 FlyStuff Blowgun | Genesee Scientific | 54-104 | |
| CO2 FlyStuff UltimaterFlypad | Genesee Scientific | 59-172 | https://www.geneseesci.com |
| Ether fume hood | Labconco | 3955220 | Sits on top of lab bench |
| Filter replacement cat # 6961300 | |||
| Food: Brewer’s Yeast Powder | Solgar | Obtain from Amazon or health food store | |
| https://www.solgar.com; | |||
| Food: Nettle Powder (pesticide free) | Starwest Botanicals | 209460-51 | |
| Food: Shitake Mushrooms (pesticide free) | Starwest Botanicals | 202127-5 | https://www.starwest-botanicals.com; |
| Food: Spinach Powder ( pesticide free) | Starwest Botanicals | 209583-5 | |
| Food: Straw (pesticide free ) | Starwest Botanicals | 209465-3 | |
| Jar: clear glass, polypropylene lid | Fisher Scientific: | FB02911765 | 73 mm dia, 89 mm ht (240 ml) https://www.fishersci.com; |
| Needle Probe, wooden handle | US Geo Supply Inc | SKU: 4190 | 5.75” long probe, stainless steel needle https://usgeosupply.com; (970)-434-3708 |
| Vials: glass, preferred: | Wilmad LabGlass | ||
| Wilmad-glass custom vials | 28-33 mm inner dia, 33 mm outer dia, 9.5 cm ht Wilmad: https://www.SP-WilmadLabglass.com | ||
| Vials: glass (cheaper and ok) | Fisher Scientific | 03-339-26H | 29 mm outer dia, 9.5 cm h https://www.fishersci.com; |
| Vials: glass (a bit narrow) | Genesee Scientific | 32-201 | 24.5 mm outer dia,9.5 cm h thttps://www.geneseesci.com |
| Vials: polypropylene | Genesee Scientific | 32-114 | 28.5 mm outer dia,9.5 cm ht |
| Vial Plugs | |||
| roll of non-absorbent cotton | Fisher Scientific | 22-456881 | |
| cheesecloth | Fisher Scientific | 22-055053 | https://www.fishersci.com; |
참고문헌
- Lewin, H. A., et al. Earth BioGenome project: Sequencing life for the future of life. Proc Natl Acad Sci USA. 115 (17), 4325-4333 (2018).
- Wiegmann, B. M., et al. Episodic radiations in the fly tree of life. Proc Nat Acad Sci USA. 108 (14), 5690-5695 (2011).
- Yeates, D. K., Wiegmann, B. M. Phylogeny of Diptera. Manual of Afrotropical Diptera.Suricata. 3, 149-161 (2017).
- Vilkamaa, P., Burdíková, N., Ševčík, J. The genus Spinopygina gen. nov. (Diptera, Sciaridae) from Western North America: Preliminary molecular phylogeny and description of seven new species. Insects. 14 (2), 173 (2023).
- Metz, C. W. Chromosome behavior, inheritance and sex determination in Sciara. Amer Naturalist. 72 (743), 485-520 (1938).
- Gerbi, S. A., Hennig, N. Unusual chromosome movements in Sciarid flies. Results and Problems in Cell Differentiation. Vol 13 Germ Line - Soma Differentiation. 13, 71-104 (1986).
- Gerbi, S. A., Larracuente, A., Hanlon, S. Non-random chromosome segregation and chromosome eliminations in the fly Bradysia (Sciara). 34;Non-Mendelian Inheritance and Meiotic Drive.", Chromosome Research.(special issue). 30, 273-288 (2022).
- Steffan, W. A. A generic revision of the family Sciaridae (Diptera) of America North of Mexico. University of California Publications in Entomology. 44, 1-77 (1966).
- Shin, S., Jung, S., Menzel, F., Heller, K., Lee, H. Molecular phylogeny of black fungus gnats (Diptera: Sciaroidea: Sciaridae) and the evolution of larval habitats. Molec Phylogenetics Evolution. 66 (3), 833-846 (2013).
- Mohrig, W., Heller, K., Hippa, H., Vilkamaa, P., Menzel, F. Revision of the black fungus gnats (Diptera: Sciaridae) of North America. Studia Dipterologica. 19 (1-2), 141-286 (2013).
- Ševčík, J., et al. Molecular phylogeny of the megadiverse insect infraorder Bibionomorpha sensu lato (Diptera). PeerJ. 4, e2563 (2016).
- Menzel, F., et al. Pseudolycoriella hygida (Sauaia and Alves)-An overview of a model organism in genetics, with new aspects in morphology and systematics. Insects. 15 (2), 118 (2024).
- Meigen, J. W. . Klassifikazion und Beschreibung der europäischen zweiflügligen Insekten (Diptera Linn). 1 (1), (1804).
- Johannsen, O. A. The fungus gnats of North America part I. Maine Agricultural Experimental Station Bulletin. 172, 209-276 (1909).
- Johannsen, O. A. Mycetophilidae of North America. Maine Agricultural Experimental Station Bulletin. 200, 57-146 (1912).
- Urban, J. M., et al. Bradysia (Sciara) coprophila larvae up-regulate DNA repair pathways and down-regulate developmental regulators in response to ionizing radiation. Genetics. (3), (2024).
- Hodson, C. N., Jaron, K. S., Gerbi, S., Ross, L. Gene-rich germline-restricted chromosomes in black-winged fungus gnats evolved through hybridization. PLoS Biology. 20 (2), e3001559 (2021).
- Urban, J. M., et al. High contiguity de novo genome assembly and DNA modification analyses for the fungus fly, Sciara coprophila, using single-molecule sequencing. BMC Genomics. 22, 643 (2021).
- Baird, R. B., et al. Recent evolution of a maternally acting sex-determining supergene in a fly with single-sex broods. Mol Biol Evol. 40 (7), (2023).
- Yamamoto, Y., Gerbi, S. A. Making ends meet: targeted integration of DNA fragments by genome editing. Chromosoma. 127 (4), 405-420 (2018).
- Yamamoto, Y., Gerbi, S. A. Development of transformation for genome editing of an emerging model organism. Genes. 13 (7), 1108-1124 (2022).
- Metz, C. W., Smith, H. B. Further observation on the nature of the x-prime (X') chromosome in Sciara. Proc Nat Acad Sci USA. 17 (4), 195-198 (1931).
- Crouse, H. V. X-ray induced sex-linked recessive lethals and visibles in Sciara coprophila. Amer Naturalist. 95 (880), 21-26 (1961).
- Metz, C. W., Ullian, S. S. Genetic identification of the sex chromosomes in Sciara (Diptera). Proc Nat Acad Sci USA. 15 (2), 82-85 (1929).
- Crouse, H. V. X heterochromatin subdivision and cytogenetic analysis in Sciara coprophila (Diptera, Sciaridae). I. Centromere localization. Chromosoma. 63, 39-55 (1977).
- Crouse, H. V., Gerbi, S. A., Liang, C. M., Magnus, L., Mercer, I. M. Localization of ribosomal DNA within the proximal X heterochromatin of Sciara coprophila (Diptera, Sciaridae). Chromosoma. 64 (4), 305-318 (1977).
- Crouse, H. V. X heterochromatin subdivision and cytogenetic analysis in Sciara coprophila (Diptera, Sciaridae). II. The controlling element. Chromosoma. 74, 219-239 (1979).
- Mok, E. H., et al. Maintenance of the DNA puff expanded state is independent of active replication and transcription. Chromosoma. 110 (3), 186-196 (2001).
- Smith-Stocking, H. Genetic studies on selective segregation of chromosomes in Sciara coprophila Lintner. Genetics. 21 (4), 421-443 (1936).
- Gabrusewycz-Garcia, N. Cytological and autoradiographic studies in Sciara coprophila salivary gland chromosomes. Chromosoma. 15, 312-344 (1964).
- Wu, N., Liang, C., DiBartolomeis, S. M., Smith, H. S., Gerbi, S. A. Developmental progression of DNA puffs in Sciara coprophila: amplification and transcription. Dev Biol. 160 (1), 73-84 (1993).
- Yamamoto, Y., Gustafson, E. A., Foulk, M. S., Smith, H. S., Gerbi, S. A. Anatomy and evolution of a DNA replication origin. Chromosoma. 130 (2-3), 199-214 (2021).
- Misof, B., et al. Phylogenomics resolves the timing and pattern of insect evolution. Science. 346 (6210), 763-767 (2014).
- Bertone, M. A., Courtney, G. W., Wiegmann, B. M. Phylogenetics and temporal diversification of the earliest true flies (Insecta: Diptera) based on multiple nuclear genes. Syst Entomol. 33, 668-687 (2008).
- de Saint Phalle, B., Sullivan, W. Incomplete sister chromatid separation is the mechanism of programmed chromosome elimination during early Sciara coprophila embryogenesis. Development. 122 (12), 3775-3784 (1996).
- de Saint Phalle, B., Oldenbourg, R., Kubai, D., Salmon, E. D., Gerbi, S. A. Paternal chromosome elimination and X non-disjunction on asymmetric spindles in Sciara male meiosis. BioRxiv. , (2021).
- Bath, J. D., Sponsler, O. L. An alternative method for the culture of Sciara larvae. Science. 109 (2828), 255 (1949).
- Forer, A. Crane fly spermatocytes and spermatids: A system for studying cytoskeletal components. Methods Cell Biol. 25, 227-252 (1982).
- Gillespie, D. R. A simple rearing method for fungus gnats Corynoptera sp. (Diptera: Sciaridae) with notes on life history. J Entomol Soc Br Colum. 83, 45-48 (1986).
- Gardiner, R. B., Jarvis, W. R., Shipp, J. L. Ingestion of Pythium spp. by larvae of the fungus gnat Bradysia impatiens (Diptera: Sciaridae). Ann Appl Biol. 116, 205-212 (1990).
- Hungerford, H. B. Sciara maggots injurious to potted plants. J Econ Entomol. 9 (6), 538-549 (1916).
- Thomas, C. A. A method for rearing mushroom insects and mites. Entomol News. 40, 222-225 (1929).
- Austin, M. D., Pitcher, R. S. A laboratory method for rearing Sciara and phorid flies. Entomol Mon Mag. 72, 12-15 (1936).
- Butt, F. H., Galtsoff, P. S., Lutz, F. E., Welch, P. S., Needham, J. G. Culture of Sciara. Culture methods for invertebrate animals. , 400-401 (1937).
- Hudson, E. K. Regulation of greenhouse sciarid fly populations using Tetradonema plicans (Nematoda: Mermithoidea). J Invert Pathol. 23 (1), 85-91 (1974).
- Wilkinson, J. D., Daughterty, D. M. Comparative development of Bradysia impatiens (Diptera: Sciaridae) under constant and variable temperatures. Ann Entomol Soc Am. 63 (4), 1079-1083 (1970).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유