Small and Large Intestinal Monolayer interface를 사용한 소 오가노이드 기술의 발전
요약
이 연구는 오가노이드에서 소 장 2D 단층을 생성하기 위한 프로토콜을 제시하여 숙주-병원체 상호 작용 연구를 위한 향상된 접근성을 제공합니다. 여기에는 멤브레인 무결성 및 기능을 평가하는 방법이 포함되며, 소의 위장 생리학을 모방하는 in vitro 모델을 발전시킵니다. 이 접근법은 향상된 치료 전략을 포함하여 상당한 생물 의학 및 농업 이점을 약속합니다.
초록
위장 생리학과 그 질병에 대한 지식을 발전시키는 것은 생체 내 장 조직을 충실하게 모방하는 정밀하고 종 특이적인 in vitro 모델의 개발에 달려 있습니다. 이는 심각한 공중 보건 위험을 초래하는 병원체의 중요한 저장소인 소에서 숙주-병원체 상호 작용을 조사하는 데 특히 중요합니다. 기존의 3D 오가노이드는 장 상피의 정점 표면에 대한 접근이 제한적이며, 이는 2D 단층 배양물의 출현으로 극복된 장애물입니다. 오가노이드 세포에서 파생된 이러한 배양은 보다 접근하기 쉬운 연구를 위해 노출된 발광 표면을 제공합니다. 이 연구에서는 소의 소장 및 대장 오가노이드 세포에서 2D 단층 배양을 생성하고 유지하기 위한 자세한 프로토콜을 소개합니다. 이 방법에는 면역세포화학 염색 기법과 함께 경상피 전기 저항 및 세포주위 투과성을 통해 막 무결성을 평가하기 위한 프로토콜이 포함됩니다. 이러한 프로토콜은 2D 소 단층 배양 시스템을 구축하고 특성화하기 위한 토대를 마련하여 공중 보건에 중요한 생물의학 및 중개 연구에서 이러한 방법 응용 프로그램의 경계를 넓힙니다. 이 혁신적인 접근법을 사용하면 소의 장 생리학의 정상 상태와 질병 상태를 모두 탐구하기 위한 생리학적으로 적절한 체외 모델을 개발할 수 있습니다. 생물 의학 및 농업 발전에 대한 의미는 심오하며, 소의 장 질환에 대한 보다 효과적인 치료법을 위한 길을 열어 동물 복지와 식품 안전을 모두 향상시킵니다.
서문
장 오가노이드로 알려진 3차원(3D) 배양에서 장 상피 줄기 세포의 배양은 장 기능, 영양 및 병원체와의 상호 작용을 조사하기 위한 체외 기술의 상당한 발전을 나타냅니다 1,2. 이러한 오가노이드는 다양한 장 세포 계통을 포괄하는 3D 형태로 자가 복제 및 조직화함으로써 생체 내 장 상피의 복잡한 구조를 모방합니다3. 이 기능은 장 생물학에 대한 이해를 발전시킬 수 있는 상당한 잠재력을 강조합니다.
장내 오가노이드 기술을 농장 동물에 적용하는 것에 대한 관심이 높아짐에 따라 배양 및 유지 관리 기술의 개선이 필요하게 되었습니다 4,5. 이 기술의 관련성은 농장 동물의 장 건강을 연구하는 데 미치는 잠재적 영향에 의해 강조되며, 이는 농장 동물의 생산성에 중요한 역할을 하며, 결과적으로 동물 복지 및 운영 비용에 영향을 미침으로써 식품 동물 산업의 경제성에 중요한 역할을 합니다 6,7. 특히, 장내 오가노이드 배양을 사용하여 소의 장 기능을 조사하는 것이 가장 중요한데, 이는 장내 오가노이드 배양균이 Salmonella spp. 및 Escherichia coli (E. coli) O157:H78과 같은 인수공통감염병성 장 병원체의 저장소로서의 역할을 하기 때문이다. 이러한 병원체는 장의 특정 분절에 국한되어 있기 때문에 연구에서 정밀도를 높이기 위해 장 분절별로 장 오가노이드 배양 방법을 구별하는 것이 필수적이다9.
장 오가노이드 연구에서 중요한 장애물은 상피 세포의 정점 표면10에 대한 접근이 제한되어 있다는 것입니다. 세포외 기질(ECM) 내에서 배양할 때, 세포는 자연적으로 기저 표면이 바깥쪽을 향하고 정점 표면이 안쪽을 향하도록 방향을 잡는다10. 이 문제를 해결하기 위해 3D 오가노이드를 단일 세포로 분리하고 반투과성 세포 배양 삽입물에 파종하는 방법을 제시합니다. 이 설정은 정점 표면과 기저측 구획 사이의 인터페이스를 설정합니다. 이 프로토콜은 소의 장 오가노이드에서 유래한 세포가 경상피 전기 저항(TEER) 측정 및 세포주위 투과성 분석을 통해 입증된 바와 같이 일관된 2D 단층을 형성할 수 있음을 보여줍니다. 또한, 면역형광 및 전자현미경을 통해 오가노이드 유래 2D 단층 세포에서 브러시 경계와 긴밀한 접합을 가진 세포 극성의 발달을 확인했으며, 이는 생체 내 장 상피의 특성을 반영합니다.
이 연구에서 회장은 소장을 나타내고 직장은 대장을 의미합니다. 이러한 선택은 회장11을 전위시킬 수 있는 살모넬라 종(Salmonella spp.)과 소의 직장9에 주로 서식하는 것으로 알려진 대장균 O157:H7과 같은 관련 장 병원체를 기반으로 합니다. 이러한 특정 장 분절의 선택은 연구의 정확성을 위해 장 오가노이드 배양 방법을 장 영역에 맞게 조정해야 할 필요성을 강조합니다. 이러한 방법은 이러한 장 분절에서 오가노이드 유래 2D 단층 인터페이스를 효과적으로 배양하는 절차를 자세히 설명하며, 소의 장 건강, 병원체 감염 및 장내 마이크로바이옴과 숙주 간의 상호 작용을 탐구하기 위한 강력한 모델을 제공합니다.
프로토콜
장 크립트는 지역 도축장에서 공급받은 잉여 장 검체에서 조달하였으며, 기증자의 신호는 보충 표 1에 나와 있습니다. 오가노이드는 도축장에서 인도적으로 안락사된 동물에서 추출한 조직을 사용하여 생성되었으며, 이 연구를 위해서만 동물을 조달한 것은 아닙니다. 따라서 본 연구는 IACUC 심사 대상에서 제외되며, 윤리 선언문은 적용되지 않습니다.
1. 오가노이드 유래 2D 단층 배양을 위한 세포 배양 인서트의 ECM 코팅
알림: 모든 절차는 생물 안전 캐비닛에서 멸균 재료와 무균 기술을 사용하여 수행됩니다. 달리 명시되지 않는 한 모든 시약은 절차 내내 얼음 위에 보관됩니다.
- 마이크로튜브에 기저 배지와 2%(v/v) ECM 기반 하이드로겔을 철저히 혼합하여 각 0.33cm2 세포 배양 삽입물을 코팅하기 위해 100μL의 ECM을 준비합니다.
- 멸균된 겸자로 포장에서 개별 세포 배양 삽입물을 제거하고 바닥이 평평한 24웰 세포 배양 플레이트의 웰에 개별적으로 넣습니다.
- 1.1단계에서 준비한 ECM 코팅 100μL를 1.2단계에서 준비한 각 세포 배양 삽입체의 정점 챔버에 적용합니다.
- 뚜껑을 교체하고 코팅된 세포 배양 삽입물이 들어 있는 세포 배양 플레이트를 37°C 및 5% CO2 의 가습 인큐베이터에서 1시간 동안 배양합니다.
- 회장 오가노이드 세포의 경우, 인서트는 1시간 배양 후 바로 사용할 수 있습니다. 직장 오가노이드 세포의 경우 1시간 배양 후 ECM 코팅을 직장 단층 배양 배지로 교체하고 밤새 배양합니다(표 1). TEER 측정을 수행하기 위한 경우 빈 대조군을 위한 추가 세포 배양 삽입물을 준비합니다.
| 회장 | 직장 | |
| ECM 코팅 배양 시간 | 1시간 | 1시간 후 단층 배양 배지에서 하룻밤 |
| 보충제 오가노이드 배양 배지 | ||
| CHIR99021 | ||
| LY2157299 | LY2157299 | |
| Y-27632 | Y-27632 | |
| 소 태아 세럼 | 소 태아 세럼 | |
| Cell seeding 밀도(cells/well) | 5 엑스 105 | 3 엑스 105 |
표 1: 성체 소 회장 및 직장 오가노이드에서 유래한 2D 단층을 생성하기 위한 최적화된 프로토콜 요약.
2. 소 회장 및/또는 직장 오가노이드 세포 파종 및 2D 단층 배양
참고: 이 섹션에 설명된 프로토콜은 소 회장 및 직장 오가노이드를 사용하며, 이는 설명된 기술5를 사용하여 48웰 플레이트에서 배양 및 유지되었습니다. 최적의 결과를 얻으려면 초기 확립 후 3배 이상 통과하고 가장 최근 통과 후 3일 이상 배양된 안정적으로 유지되는 오가노이드를 사용하는 것이 좋습니다.
- 성숙한 오가노이드가 포함된 ECM 기반 하이드로겔 돔을 방해하지 않고 진공 시스템에 부착된 일회용 유리 파스퇴르 피펫을 사용하여 오가노이드 배양 배지를 제거하고 웰당 300μL의 얼음처럼 차가운 ECM 해중합 용액을 추가합니다. 4 °C에서 최소 1시간 동안 배양합니다.
참고: 또는 ECM 해중합 용액을 첨가한 후 ECM 기반 하이드로겔 돔이 포함된 오가노이드를 기계적으로 파괴하고 4°C에서 배양하기 전에 15mL 원뿔형 튜브에 현탁액을 수집합니다. 이 방법은 2D 단층 배양에 사용할 수 없는 오가노이드를 동일한 플레이트에서 동시에 배양할 때 권장됩니다. 오가노이드 배양의 밀도는 세포 배양 삽입물에 최적의 seeding을 위해 필요한 오가노이드 배양 웰의 수에 큰 영향을 미칩니다.- 고밀도 오가노이드 배양(보충 그림 1A)의 경우, 직장 세포 배양 삽입물은 1:1 - 1:2 범위의 파종 비율을 사용하며, 이는 하나의 배양 웰이 1-2개의 웰을 파종할 수 있음을 의미합니다. 회장의 경우 비율을 1:1로 유지하십시오. 대조적으로, 저밀도 배양(보충 그림 1B)에는 더 많은 배양 웰이 필요합니다. 직장 세포 배양 삽입물 1개(3-4:1 비율)에는 3-4개의 직장 오가노이드 배양 웰을 사용하고, 회장 세포 배양 삽입물 1개(4-5:1 비율)에는 4-5개의 회장 오가노이드 배양 웰을 사용합니다.
- ECM 기반 하이드로겔이 완전히 용해되었는지 육안으로 검사하고 15mL 코니컬 튜브에 오가노이드 현탁액을 수집합니다.
- 200 x g 및 4°C에서 5분 동안 원심분리하여 오가노이드를 펠릿합니다. 상층액을 버립니다. 10μM Y-27632가 보충된 재조합 세포 해리 효소 용액 1mL에 펠릿을 재현탁시킵니다.
- 효과적인 오가노이드 해리를 촉진하기 위해 효과적인 오가노이드 해리를 촉진하기 위해 3-3분마다 소용돌이로 3-5초의 간헐적인 흔들림과 함께 37°C 수조에서 10분 동안 배양합니다.
- 효소 분해 후 5mL의 기저 배지를 추가하고 P1000 마이크로피펫으로 공격적으로 피펫팅하여 오가노이드를 단일 세포로 더욱 파괴합니다. 현탁액에 오가노이드 덩어리가 있는지 검사하고, 여전히 육안으로 눈에 띄는 경우 피펫팅을 반복하여 단일 세포 해리를 향상시킵니다.
- 70μm 셀 스트레이너가 있는 50mL 원뿔형 튜브를 준비합니다. 1-2mL의 기초 배지를 적용하여 여과기를 미리 적십니다.
- 스트레이너를 통해 셀 현탁액을 여과하여 잔류 ECM 기반 하이드로겔 파편과 큰 셀 덩어리를 제거합니다. 원래 15mL 튜브와 70μm 세포 여과기를 추가로 10mL의 기초 배지로 헹굽니다.
참고: 세포 현탁액이 여과기를 쉽게 통과하지 못하는 경우 불완전한 오가노이드 해리의 징후일 수 있습니다. 수집된 세포 현탁액을 동일한 70μm 세포 스트레이너를 통해 재통과를 시도할 수 있습니다. 추가적인 효소적 또는 기계적 파괴가 필요할 수 있습니다. - 200 x g 및 4 °C에서 5분 동안 원심분리에 의한 펠릿 단일 세포 현탁액. 상층액을 제거하고 세포 계수를 수행하기 위해 적절한 부피의 기저 배지로 세포를 재현탁합니다.
- trypan blue 염색 후 혈구계로 생존 가능한 세포를 계수하여 수집된 총 세포 수를 계산합니다.
- 200 x g 및 4 °C에서 5분 동안 원심분리에 의한 펠릿 단일 세포 현탁액. 상층액을 제거하고 각 단층 배양 배지에서 세포를 적절한 파종 밀도로 재현탁시킵니다(표 1).
- 회장 오가노이드 세포의 경우 500nM LY2157299, 10μM Y-27632 및 20% 소 태아 혈청(FBS)이 보충된 오가노이드 배양 배지인 200μL의 회장 단층 배양 배지에 세포 배양 삽입물당 5 x 105 세포의 파종 밀도를 달성하기 위해 세포를 2.5 x 106 cells/mL 농도로 재현탁합니다.
- 직장 오가노이드 세포의 경우 100 nM CHIR99021, 500 nM LY2157299, 10 μM Y-27632로 보충된 오가노이드 배양 배지인 200 μL의 직장 단층 배양 배지에 세포 배양 삽입물당 3 x 105 cells의 seeding 밀도를 달성하기 위해 세포를 1.5 x 106 cells/mL 농도로 재현탁합니다. 및 20% FBS.
- ECM 코팅된 세포 배양 인서트가 있는 24웰 세포 배양 플레이트를 회수하고 코팅을 방해하지 않도록 신중한 진공 흡입으로 세포 배양 인서트의 정점 챔버를 비웁니다.
- 2.10단계에서 준비한 200μL의 단일 세포 현탁액을 세포 배양 삽입물의 정점 챔버에 부드럽게 적용합니다. 블랭크 대조군의 경우 정점 챔버에 세포 없이 200μL의 배양 배지를 추가합니다. 블랭크 대조군의 경우 정점 챔버에 세포 없이 200μL의 배양 배지를 추가합니다.
- 적절하게 보충된 단층 배양 배지 500μL(회장 세포와 직장 세포에 따라 다름)를 각 웰의 기저측 챔버에 적용합니다.
- 37 °C 및 5 % CO2 의 가습 인큐베이터에서 배양하여 세포 접착 및 성장을 촉진하여 세포 배양 삽입물에 합류 2D 단층을 형성합니다.
- 세포 파종 후 48시간부터 격일로 정점 챔버와 기저측 챔버의 배양 배지를 교체합니다. blank control과 cell-containing insert에 대해 동일한 배양 시간을 보장합니다.
3. TEER 측정
참고: 여기에 설명된 방법은 한 쌍의 Ag/AgCl 전극이 있는 상피 전압계로 알려진 상업적으로 사용 가능한 수동 TEER 측정 시스템을 사용합니다(그림 1A). 2D 단층에서 TEER를 측정하려면 블랭크 웰을 측정해야 합니다. 샘플과 동일한 방식으로 빈 판독값을 채취해야 합니다.
- 인큐베이터에서 오가노이드 유래 2D 단층과 블랭크가 있는 세포 배양 인서트가 포함된 플레이트를 검색합니다. 접시를 약 10분 동안 실온에 두십시오.
- 70% 에탄올로 전극을 소독하고 완전히 건조시키십시오.
- 짧은 끝이 정점 챔버에 있고 긴 끝이 기저측 챔버에 있는 전극을 조심스럽게 도입합니다(그림 1A).
알림: 셀 단층을 방해하지 않도록 각별한 주의가 필요합니다. - 판독값이 평형을 이루도록 허용하고 안정화될 때 값을 옴 단위로 기록합니다.
알림: 전압옴계의 감도는 전기 저항 측정을 수행하는 동안 옴 값의 변동이 발생하는 정도입니다. 신뢰할 수 있는 판독값은 측정값이 안정화되고 지속적으로 안정기 값 주위를 맴돌 때 얻어집니다. - 다음 공식에 따라 2D 단층의 TEER를 결정합니다.
TEER(Ω x cm2) = 세포 배양 삽입물의 표면적(cm2) x 순 전기 저항
여기서 순 전기 저항은 셀 단층 인서트의 측정된 저항에서 블랭크 인서트의 측정된 저항을 뺀 값과 같습니다. 24-well plate용 세포 배양 인서트의 표면적은 0.33cm2입니다.
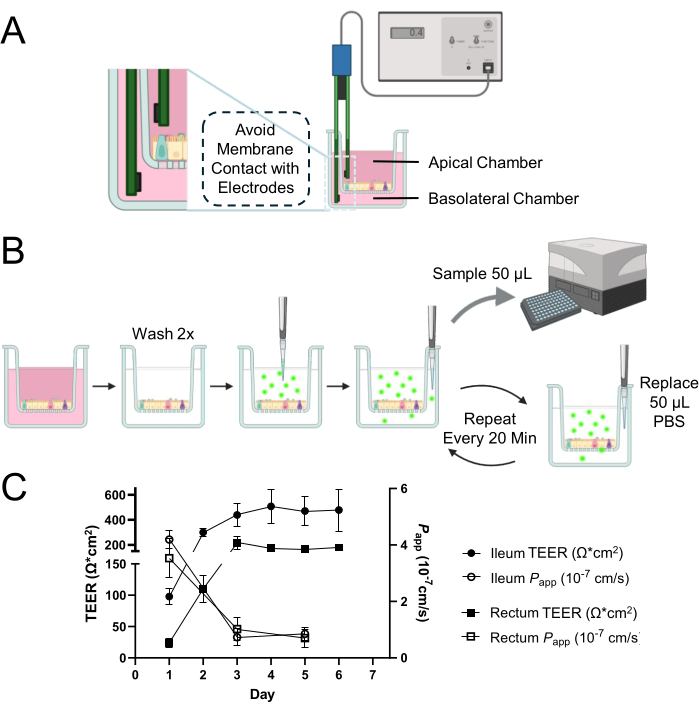
그림 1: 소 장 오가노이드 유래 2D 단층의 상피 장벽 무결성 평가. (A) TEER 측정을 위한 세포 배양 삽입물의 정점 및 기저측 챔버 내 전극의 적절한 위치 개략도. 짧은 전극은 정점 챔버에 삽입되고 긴 전극은 멤브레인과의 접촉을 피하도록 주의하여 기저측 챔버에 배치됩니다. (B) 투과성 분석 과정의 개략도. 세포 배양 챔버를 따뜻해진 PBS로 2회 세척하고 PBS에 용해된 0.5mg/mL 4kDa FITC-dextran tracer를 정점 챔버에 적용합니다. 기저측 챔버에서 반복된 50μL 부분 표본은 배양 기간 동안 기저측 챔버의 총 부피를 유지하기 위해 동일한 부피의 PBS를 교체하여 샘플링합니다. 부분 표본의 형광 강도는 세포 단층 전체에서 4kDa FITC-dextran 추적자의 확산을 정량화하기 위해 마이크로플레이트 리더를 사용하여 측정됩니다. (C) 시간 경과에 따른 회장 및 직장 단층 내 장벽 무결성의 동적 발달은 TEER 측정(회장의 경우 닫힌 원, 직장의 경우 닫힌 사각형으로 표시) 및 투과성 분석(회장의 경우 열린 원, 직장의 경우 열린 사각형으로 표시)을 사용하여 4kDa FITC-dextran 추적자를 사용하여 평가했습니다. 배양 3일째까지 두 가지 유형의 단층 모두 각각의 TEER 및 투과성 프로파일에 의해 입증된 바와 같이 안정적이고 기능적인 상피 장벽의 확립을 보여주었습니다. 결과는 두 개의 기술 반복실험이 있는 두 개 이상의 독립적인 실험의 평균입니다. 오차 막대는 측정의 SEM을 나타냅니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
4. Paracellular 투과성 분석
참고: 이 분석에는 120분 동안 2D 단층을 가로질러 정점 챔버에서 기저측 챔버로 플루오레세인 이소티오시아네이트(FITC)-덱스트란의 확산으로 인한 형광 강도 측정이 포함됩니다(그림 1B). 최적의 결과를 얻으려면 분석 중 빛에 대한 노출을 최소화하고 형광의 감소 또는 소멸을 방지하기 위해 모든 샘플링 직후 마이크로플레이트 리더에서 측정을 수행하는 것이 좋습니다. 각 웰은 한 번만 사용할 수 있으며 후속 분석에서 재사용할 수 없습니다. 각 분석에 대한 기술 복제로 사용할 최소 2개의 웰을 준비합니다. 예를 들어, 그림 1C에 제시된 결과를 얻기 위해 총 6개의 웰이 필요하며, 여기서 분석은 3개의 서로 다른 시점(배양 1일, 3일, 5일)에서 중복으로 실행되었습니다.
- 인산염 완충 식염수(PBS)에서 4kDa FITC-dextran으로 표준 곡선 희석 시리즈를 준비합니다. 각 희석에 대해 50 μL를 96웰 플레이트에 세 번 피펫팅합니다.
참고: 0에서 0.5mg/mL 범위의 5-7회 희석액을 연속으로 만드는 것이 좋습니다. - 495 nm의 여기 파장과 535 nm의 방출 파장에서 사전 보정된 마이크로플레이트 리더에서 표준물질의 형광 강도를 측정합니다.
- 형광 강도 결과를 사용하여 선형 회귀를 계산하여 표준 곡선을 만듭니다.
- 인큐베이터에서 오가노이드 유래 2D 단층이 있는 세포 배양 삽입물이 포함된 플레이트를 검색합니다. 평가할 오가노이드 유래 2D 단층이 들어 있는 세포 배양 삽입물의 정점 및 기저측 챔버에서 단층 배양 배지를 제거합니다.
- 각 챔버를 각각 200μL(정점 챔버) 및 500μL(기저측 챔버)의 사전 예열된 PBS로 2번 부드럽게 세척합니다.
- 정점 챔버에서 세척 용액을 제거하고 PBS의 0.5mg/mL 4kDa FITC-dextran 추적자 200μL를 세포 배양 삽입물의 정점 챔버에 적용합니다.
- 37 °C 및 5 % CO2 의 가습 인큐베이터에서 20 분 동안 배양합니다.
- 배양된 24웰 플레이트의 기저측 챔버에서 50μL를 샘플링하고 마이크로플레이트 리더 호환 96웰 플레이트로 옮깁니다.
- 샘플링된 웰의 기저측 챔버에서 50μL의 신선한 PBS를 교체합니다.
- 사전 보정된 마이크로플레이트 리더에서 495nm의 excitation wavelength와 535nm의 방출 파장에서 즉시 형광 강도를 측정합니다.
- 4.6분까지 4.4.10-20분마다 120단계를 반복합니다. 분석이 끝날 때 2D 단층의 보존이 필요한 경우 정점 챔버와 기저측 챔버를 모두 새로운 PBS 2x로 헹구고 새로운 단층 배양 배지로 교체한 다음 배양합니다.
참고: 2D 단층의 추가 평가, 즉 TEER 측정, 면역형광 염색 등을 수행할 수 있습니다. 그러나 잔류 형광 추적자가 있을 가능성이 있고 분석에 영향을 줄 수 있으므로 권장하지 않습니다. - 다음 공식을 사용하여 겉보기 투과성 계수(Papp)를 결정합니다.
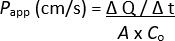
ΔQ / Δt = 특정 기간 동안 단층을 세포 배양 삽입체의 기저측 챔버로 통과시킨 형광 추적자의 농도로, 형광 강도로 측정되고 표준 곡선을 통해 μg/mL로 외삽됩니다.
A = 세포 배양 삽입물의 표면적
Co = 세포 배양 삽입물의 정점 챔버에 추가된 형광 추적자의 농도(μg/mL)
5. 오가노이드 유래 2D 단층의 면역형광 염색
- 진공 흡입으로 세포 배양 삽입물에서 단층 배양 배지를 제거하고 200μL의 4% 파라포름알데히드(PFA)를 추가합니다. 세포 고정을 위해 실온에서 15-30분 동안 배양합니다.
- 진공 흡입으로 PFA를 제거하고 100μL의 PBS 2x로 세척합니다.
- PBS의 2% 소 혈청 알부민(BSA)에 0.3% Triton X-100 100μL를 넣고 실온에서 10분 동안 배양하여 세포를 투과시킵니다.
- 진공 흡입으로 상층액을 제거하고 100μL의 PBS 2x로 세척합니다.
- 상층액을 제거하고 PBS에서 2% BSA로 교체하고 차단을 위해 실온에서 1시간 동안 배양합니다.
- 상층액을 제거하고 PBS에서 2% BSA로 희석된 1차 항체 100μL를 적용하고 실온에서 1시간 동안 또는 4°C에서 밤새 배양합니다.
참고: 사용된 1차 항체의 농도는 재료 표에 나와 있습니다. 지정하지 않는 한 제조업체의 권장 사항을 따릅니다. - 상층액을 제거하고 100μL의 PBS 3x로 세척합니다.
- PBS에서 2% BSA로 희석된 2차 항체 100μL를 적용하고 실온에서 1시간 동안 또는 4°C에서 밤새 배양합니다.
참고: 사용된 1차 항체가 형광 프로브와 결합되는 경우 이 단계를 건너뛸 수 있습니다. 사용된 2차 항체의 농도는 재료 표에 나와 있습니다. 지정하지 않는 한 제조업체의 권장 사항을 따릅니다. - 상층액을 제거하고 100μL의 PBS 3x로 세척합니다.
- 선택 사항: F-액틴 및 핵(DAPI)의 카운터 염색을 위해 PBS에서 두 프로브를 적절한 희석(제조업체 권장 사항에 따라)으로 혼합하여 준비하고 100μL를 적용한 다음 실온에서 30분 동안 배양합니다. 상층액을 제거하고 100μL의 PBS 3x로 세척합니다.
- 세포 배양을 조심스럽게 잘라내고 메스 블레이드로 멤브레인을 삽입한 다음 장착 용액이 있는 유리 슬라이드에 장착합니다. 커버 슬립을 놓고 관찰하십시오.
대표적 결과
이 프로토콜은 소장 및 대장에서 강력한 소 장 오가노이드 유래 2D 단층을 안정적으로 생성하여 생체 내 장 상피의 복잡성을 모방합니다. 이 방법은 최적화된 조건에서 배양된 건강한 소의 장낭 표본에서 개발된 성숙한 오가노이드를 활용합니다. 흥미롭게도, 오가노이드 유래 2D 단층에 대한 성공적이고 반복 가능한 조건은 장 분절에 고유합니다(표 1). 이는 관심 장내 분절에 최적화된 배양 기법을 보유하는 것의 중요성을 강조합니다.
해리된 성숙한 오가노이드를 세포 배양 삽입물에 파종한 후 1일 후에 2D 단층이 형성되는 것처럼 보였습니다(그림 2A). 그러나 이러한 초기 출현에도 불구하고 회장 및 직장 단층 모두에 대한 TEER 측정은 이 단계에서 낮게 유지되었습니다(그림 1C). 또한, 파라세포 투과성 분석을 통해 배양 1일만에 단층이 세포층을 가로질러 4kDa FITC-dextran tracer를 통과시킬 수 있음을 밝혔습니다(그림 1C). 배양 3일 째까지 두 가지 유형의 오가노이드 유래 2D 단층은 모두 상당한 성숙을 보였으며, 이는 TEER 값 증가와 4kDa FITC-dextran 추적자에 대한 내성으로 입증되었으며, 이러한 추세는 배양 5일차까지 계속되었습니다.
특히 주목할 만한 것은 종 간 변동성으로, 유사한 조건 12,13,14,15에서 인간 및 개 배양물에 비해 소 오가노이드 유래 2D 단층 배양물의 TEER 값이 낮음에도 불구하고 멤브레인의 무결성이 그대로 유지됩니다. 이 결론은 투과성 분석에서 단층의 적절한 반응에서 도출된 것으로, 소 샘플의 낮은 TEER 값이 반드시 장벽 기능의 부족을 반영하는 것은 아니라는 것을 시사합니다. 이러한 무결성은 기능적 상피 장벽에 매우 중요하며 TEER 측정과 함께 투과성 분석 결과의 신중한 해석을 통해 효과적으로 입증됩니다.
주사 전자 현미경을 사용하여 2D 단층의 정점 표면에서 세포 경계와 잘 발달된 미세 융모를 시각화하고 특수 미세해부학적 구조를 표시하여 회장 및 직장 오가노이드 유래 2D 단층의 성숙을 더욱 강화했습니다(그림 2B). 또한 2D 단층의 면역형광 염색을 통해 회장(그림 3A) 및 직장(그림 3B) 오가노이드 유래 2D 단층 모두에서 정점 브러시 경계, 기저외측 부착 접합부 및 점액 생성 잔 세포의 존재를 확인했습니다. 이러한 결과는 개발된 2D 단층이 구성과 형성이 복잡하여 온전한 장 상피의 주요 특징을 표현할 뿐만 아니라 다중 계통 세포 집단으로 구성되어 있음을 강조합니다.
성공적인 2D 단층 개발은 세포가 ECM에 부착하고 합류를 위해 성장하여 온전한 상피층을 만드는 데 달려 있습니다. 특히, 세포 배양 삽입물에서 배양 중 불균일한 ECM 분포 또는 최적이 아닌 조건으로 인해 세포층의 부분적인 분리가 발생할 수 있으며, 특히 가장자리를 따라 두드러질 수 있습니다(그림 4Ai). 이 문제는 세포가 최적 밀도보다 높은 밀도로 파종되거나 파종 세포가 배양 표면 전체에 고르게 분포되어 있지 않은 경우 더욱 복잡해지며, 이러한 시나리오는 종종 오가노이드가 단일 세포 현탁액으로 불완전하게 분리되어 발생합니다. 이러한 불균일한 분포는 세포 배양 삽입물에서 단층 및/또는 3D 형태 형성 내에 틈을 형성할 수 있습니다(그림 4Aii). 대조적으로, 세포의 과소 파종은 예상 배양 기간 동안 단층 개발이 실패하거나 지연되는 결과를 초래할 수 있으며, 이는 의도치 않게 2D 단층 시스템을 활용하는 후속 연구의 효율성에 영향을 미칠 수 있습니다(그림 4Aiii). 또한, 배양 시스템의 오염은 단층 내에 틈을 형성하여 배양의 후반 단계에서 한 번 형성된 합류 단층을 파괴할 수도 있습니다(그림 4Aiv). 지속적인 TEER 값과 세포주위 투과성 반응은 앞서 언급한 잠재적 실패 원인이 이러한 분석 이전에 발생하지 않은 경우에도 공격적인 세척 또는 취급 기술로 인한 세포층의 교란에 의해 영향을 받을 수 있습니다(그림 4B). 따라서 단층 형성 또는 파괴에 대한 신중한 세포 취급 및 평가는 문제 해결 전략의 효과적인 적용을 통해 오가노이드 유래 2D 단층의 성공적인 개발을 위해 가장 중요합니다.
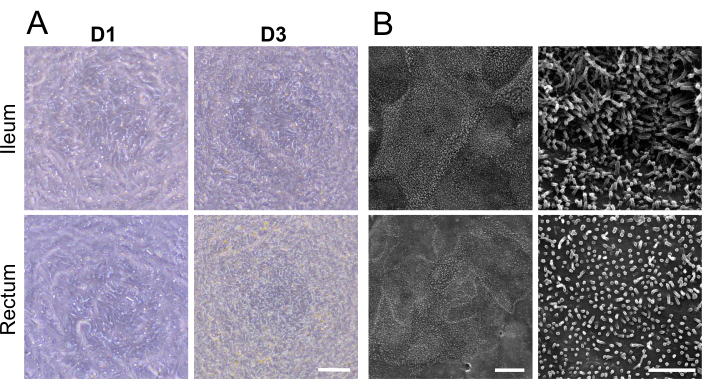
그림 2: 소 회장 및 직장 오가노이드 유래 2D 단층의 현미경 특성화. (A) 세포 배양 삽입물에서 배양 1일차 및 3일차(D1 및 D3)의 2D 단층의 대표적인 위상차 현미경 이미지. 스케일 바 = 100 μm. (B) 더 낮은(왼쪽) 및 더 높은(오른쪽) 배율을 가진 2D 단층의 대표적인 주사 전자 현미경 이미지. 미세융모를 포함한 상세한 세포 표면 구조는 회장(상단) 및 직장(하단) 단층 모두에서 감상할 수 있습니다. 왼쪽 눈금 막대 = 10 μm, 오른쪽 눈금 막대 = 2 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
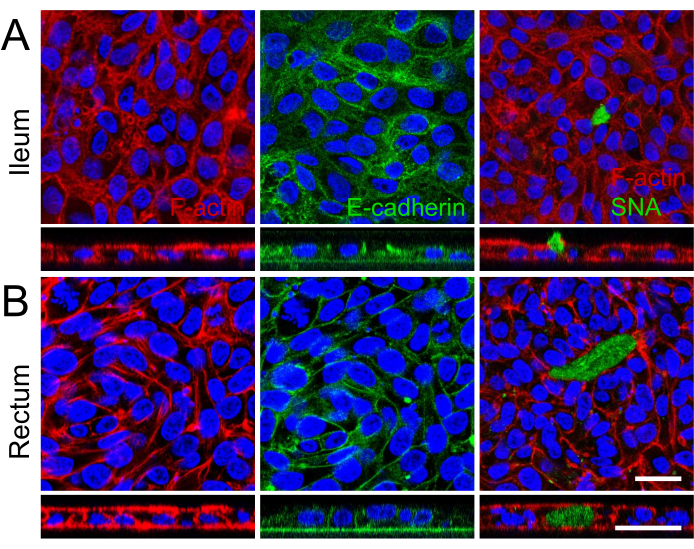
그림 3: 회장 및 직장 오가노이드에서 파생된 2D 단층의 면역형광 특성 분석. (ᅡ, 나) 패널 (A)은 회장을 나타내고 패널 (B)은 직장 오가노이드를 보여줍니다. 왼쪽에서 F-actin 섬유는 Phalloidin(빨간색)으로 강조되어 세포골격 구조와 정점 브러시 테두리 형성을 보여줍니다. 중간 이미지는 E-cadherin(녹색)으로 표시된 부착 접합부의 기저측 국소화를 캡처하며, 이는 세포-세포 접착 및 단층 무결성을 나타냅니다. 오른쪽에는 SNA(녹색)로 점액을 생성하는 잔 세포의 존재가 표시되며, 회장 단층에서 점액의 정점 분비를 묘사하는 z-stack 이미지가 있습니다. 모든 이미지의 핵은 DAPI(파란색)로 대조염색되었습니다. 또한 모든 이미지에 대한 z-stack 이미징은 배양 삽입물 내에서 단일 세포 층의 형성을 추가로 보여줍니다. 눈금 막대 = 25 μm. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
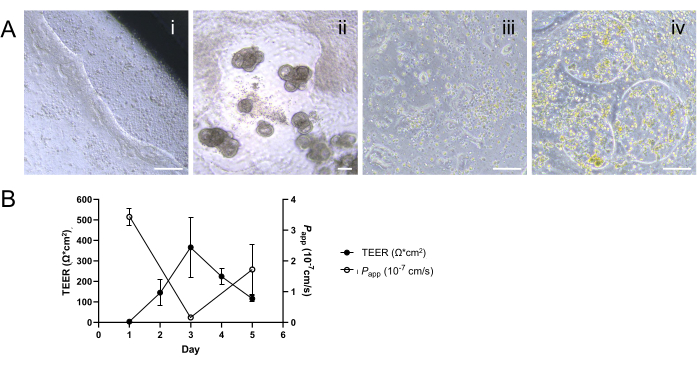
그림 4: 차선의 2D 단층 형성의 특성화. (A) (i) 세포 배양 삽입물의 가장자리를 따라 단층이 부분적으로 분리되는 것을 보여주는 대표적인 위상차 이미지; (ii) 3D 파생물의 발달 및 단층 내 틈의 형성; (iii) 세포의 고르지 못한 부착으로 표시된 최적의 파종 밀도보다 낮기 때문에 불완전하거나 지연된 단층 형성; (iv) 나중 단계에서 한 번 형성된 2D 단층 내에 틈이 형성되며, 이는 의심되는 오염으로 인해 발생할 수 있습니다. 스케일 바 = 100 μm. (B) 3일차 이후 투과성 프로파일 증가와 함께 TEER 측정 감소는 안정적이고 기능적인 상피 장벽을 구축하지 못했음을 나타냅니다. 결과는 두 번의 기술 반복을 사용한 단일 실험의 평균 ± 평균의 표준 오차(SEM)로 표시됩니다. 이 그림의 더 큰 버전을 보려면 여기를 클릭하십시오.
보충 그림 1: ECM 기반 하이드로겔에서 소 장 오가노이드 배양물의 밀도 변화. ECM 기반 하이드로겔에서 배양된 소 장 오가노이드; (A) 고밀도 및 (B) 저밀도. 스케일 바 = 100 μm. 이 파일을 다운로드하려면 여기를 클릭하십시오.
보충 표 1: 요약된 조직 기증자 신호. 이 파일을 다운로드하려면 여기를 클릭하십시오.
토론
장관의 건강은 소의 생산성과 전반적인 복지 모두에 가장 중요하다16. 오가노이드 유래 2D 단층 기술을 활용하여 과학자들은 이제 체외 환경 내에서 소 장 상피의 복잡한 구조를 보다 정확하게 모방할 수 있습니다5. 이 혁신적인 접근법은 다세포 계통을 포함하여 장 내벽의 다양한 세포 구성을 재현할 뿐만 아니라 장 생리학 및 병리학을 이해하는 데 필수적인 점액 분비 및 미세 융모의 존재와 같은 주요 기능적 특성을 포착합니다3. 회장과 직장의 분절에 대한 맞춤형 배양 프로토콜의 개발은 소의 장 건강을 연구할 수 있는 능력을 크게 향상시키는 고급 플랫폼을 탄생시켰습니다. 이 정교한 접근 방식을 통해 인수공통감염병 병원체와 소의 장내 환경 간의 상호 작용에 대한 자세한 조사를 수행할 수 있습니다. 체외에서 소 장내 생태계의 고유한 측면을 면밀히 복제하고 연구할 수 있는 능력은 가축의 건강을 개선하고 인수공통전염병의 확산을 완화하기 위한 표적 전략을 개발하는 데 중요한 진전을 이루었습니다.
그럼에도 불구하고 소 장 오가노이드를 사용하여 성공적인 2D 단층 개발을 보장하기 위해서는 오가노이드와 해리된 단세포 모두의 건강과 활력을 유지하는 것이 중요합니다. 신중한 취급과 스트레스 최소화는 세포 무결성과 기능을 보존하는 데 가장 중요하며, 이는 오가노이드의 효과적인 성장과 그에 따른 기능적 단층 생성에 필수적입니다. 또한 균일한 단층을 달성하려면 큰 덩어리를 형성하지 않고 오가노이드를 단일 세포로 성공적으로 분리해야 합니다. 이러한 덩어리는 세포 분포를 방해하고 단층의 구조를 손상시킬 수 있습니다. 따라서 원활한 해리를 위한 정밀한 기술을 사용하는 것이 중요하며, 그 결과 일관된 단일 세포 현탁액을 얻을 수 있습니다. 또한 세포 접착 중 및 과도한 비부착 세포를 씻어낼 때 교란을 최소화하는 것이 도움이 됩니다. 이 접근 방식은 3D 형태 형성과 관련된 잠재적인 문제를 해결하여 단층의 전반적인 품질을 향상시키는 데 특히 중요합니다.
생물학적 기원을 가진 ECM-기반 하이드로겔에 대한 주목할 만한 도전과제는 조성17의 배치-배치-배치 변동이다. 설명된 프로토콜 및 물질을 사용하여 이러한 현상이 관찰되지는 않았지만, ECM 조성의 배치 간 변동은 성공적인 단층 개발에 문제를 일으킬 수 있습니다. ECM 제품, 브랜드 또는 로트 번호가 변경될 때 단층 형성이 저하되는 경우, 세포 배양 삽입물을 코팅하는 데 필요한 적절한 ECM 농도를 결정하기 위해 최적화 단계가 필요할 수 있습니다.
또한 변경하기 전에 배양 배지를 실온으로 조정하는 것은 열 충격을 완화하고 세포 건강을 보호하며 오가노이드 및 단층 배양물의 품질을 유지하는 데 도움이 되는 중요한 단계입니다. 부드러운 세척 방법은 형성 및 후속 분석 중에 단층의 무결성을 유지하는 데 가장 중요하며, 중단을 피하면 결과의 부정확성을 방지할 수 있습니다. PBS를 Hank's Balanced Salt Solution(HBSS)으로 대체하면 주세포 투과성 분석과 같이 PBS에 반복적으로 세척하거나 장기간 노출되는 동안 문제가 되었을 때 단층 박리를 최소화하는 데 도움이 되는 것으로 나타났습니다. 마지막으로, 회장 및 직장과 같은 장관의 다른 분절에 있는 세포의 특정 요구 사항을 충족하도록 배양 배지를 맞춤화하는 것은 생체 내 조건을 정확하게 복제하는 데 필수적입니다. 이러한 특이성은 최적의 세포 건강과 기능을 보장하여 소의 장 생리학 및 병원체와의 상호 작용에 대한 정확한 모델링을 용이하게 함으로써 오가노이드 연구에서 이러한 중요한 단계를 강조합니다.
부드러운 세포 처리 방법을 사용하는 것 외에도 세포 계수 및 TEER 측정과 관련된 우수한 기술 역량을 구축하는 것은 기능하는 2D 단층의 성공적인 개발에 매우 중요합니다. 너무 낮거나 너무 높은 파종 밀도는 각각 세포의 과대 또는 과소 계수로 인해 발생하므로 단층 성장이 저하될 수 있습니다. 세포 수를 주의 깊게 검토하고 부정확한 파종 밀도가 의심되는 경우 적절한 파종 밀도를 보장하는 것이 좋습니다. 또한 부적절한 TEER 측정 기술로 인해 전극의 부주의한 긁힘으로 인해 단층이 파괴될 수 있습니다. 전극을 정점 챔버에 조심스럽게 도입하고 멤브레인 표면에 대해 수직 방향을 유지하는 데 특히 주의를 기울이면 단층에 대한 우발적인 손상 위험을 완화하는 데 도움이 될 수 있습니다.
여기에 설명된 준세포 투과성 분석 방법은 이전 프로토콜(18)에서 채택된 것이다. 결과의 정확성과 신뢰성을 개선하기 위해 120분 동안 여러 번의 샘플링과 샘플링된 부분 표본을 동일한 양의 PBS로 교체하는 것을 포함하여 보고된 프로토콜에 대한 수정이 이루어졌습니다. 챔버 내 총 부피를 유지하는 것은 삼투압 균형을 보존하고, 세포 무결성을 보장하고, 정확한 투과성 평가에 필수적인 농도 구배를 유지하고, 수송 속도에 영향을 줄 수 있는 정수압의 변화를 방지하는 등 여러 가지 이유로 중요합니다. 샘플링된 형광 추적자 함유 PBS의 부피와 동일한 새로운 PBS로 기저측 챔버를 보충하는 이러한 관행은 이러한 조건을 보존하는 데 중추적인 역할을 하여 단층 투과성에 대한 정확하고 의미 있는 평가를 가능하게 합니다. paracellular permeability assay는 단층을 통한 추적 분자의 움직임을 직접 평가하여 TEER 측정을 보완하는 역할을 합니다. 더욱이, 다양한 실험실에서 TEER 값을 비교하는 것은 관련 통찰력을 얻지 못할 수 있는데, 이는 이러한 값이 온도 및 세포 유형, 통로 수 및 배양 배지(19)의 구성을 포함하여 세포가 배양되는 특정 조건과 같은 수많은 변수에 의해 영향을 받을 수 있기 때문이다. paracellular permeability assay는 상피 장벽(20) 내의 부착 및 단단한 접합부의 효과적인 발현에 대한 기능적 시험관 내 평가를 제공합니다.
3D 오가노이드에서 2D 단층의 개발은 배양 기술의 상당한 발전을 의미하지만, 2D 단층과 관련된 한계를 인식하는 것이 중요합니다. 한 가지 주요 단점은 이것이 in vivo 환경에서 발견되는 동적 자극이 부족한 정적 배양 시스템으로 남아 있다는 것입니다. 또한 배양 시스템 내의 산소 함량을 수정하는 것은 뚜껑이 있는 배양 플레이트를 포함하는 개방형 설정으로 인해 문제가 발생하여 혐기성 박테리아와의 장기 공동 배양에 적합하지 않습니다. 이러한 한계는 보다 제어되고 생리학적으로 관련된 환경을 제공하는 미세유체 시스템(21)과 같은 보다 역동적인 배양 플랫폼을 채택함으로써 잠재적으로 해결될 수 있습니다. 또한, 현재의 배양 조건은 줄기 세포 성장을 유지하는 데 유익한 영양소가 풍부하지만 상피 세포의 생리적 분화를 유도하는 데는 최적이 아닐 수 있음을 인식하는 것이 중요합니다. 이러한 불일치는 in vivo 조건을 밀접하게 모방하고 차별화 프로세스를 지원하기 위해 향후 연구에서 최적화의 필요성을 강조합니다. 이러한 한계를 해결하고 이러한 접근 방식을 개선함으로써 오가노이드 배양 기술의 유용성과 적용 가능성이 향상되어 체외에서 위장관의 복잡한 역학 및 상호 작용을 복제하는 데 더 가까워집니다.
소 회장 및 직장 조직에서 2D 단층을 생성하기 위한 프로토콜은 연구자들에게 소장 및 대장 상피의 내강 계면에 대한 귀중한 시험관 모델을 제공합니다. 이 모델은 기초 동물 영양 연구, 특히 다양한 조건에서 영양소가 어떻게 흡수되는지 조사하는 데 적용할 수 있는 광범위한 가능성을 열어줍니다. 주목할만한 관심 분야는 위장 투과성의 비정상적인 증가를 특징으로 하는 장누수 증후군에 대한 조사이며, 이는 종종 식단 변화와 극한의 환경 온도에 의해 유발됩니다22,23. 또한 이 모델은 장내 마이크로바이옴과 숙주 간의 복잡한 상호 작용을 탐구하는 데 필수적인 도구 역할을 합니다. 이를 통해 공생 미생물이 숙주 유기체의 건강에 어떤 영향을 미칠 수 있는지에 대한 연구를 할 수 있으며, 수의학 및 의학의 중요한 측면을 다룰 수 있습니다 1,24. 또한, 인간 식품 매개 병원체는 가축 장 8,9,25의 다른 분절에서 공생체로 자주 발견되며, 이 프로토콜은 이러한 인수공통감염병이 각각의 틈새에서 번성할 수 있도록 하는 특정 조건에 대한 자세한 연구를 가능하게 합니다.
이 연구를 통해 직장 및 회장 오가노이드 유래 단층이 성공적인 발달을 위해 서로 다른 조건을 필요로 한다는 것이 관찰되었습니다. 특히, 직장 오가노이드 유래 단층을 기저 배지에서 2% ECM 기반 하이드로겔로 준비된 세포 배양 삽입물에 1시간 동안 처음 파종했을 때 큰 구멍과 세포 슬라잉이 관찰되었습니다. 이 문제는 특수 직장 단층 배양 배지로 전환하고 배양 기간을 파종 전 하룻밤으로 연장하여 해결한 반면, 회장 오가노이드 유래 단층은 더 짧은 준비 프로토콜을 사용하여 성공적으로 개발되었습니다. 더욱이, 배양 배지에 CHIR99021을 첨가하면 직장 단층(26 )의 확립이 일관되게 개선되었지만, 회장 단층(27)에는 필요하지 않았다. 또한, 회장 단층은 직장 오가노이드에 비해 성공적인 발달을 위해 더 높은 세포 밀도가 필요했습니다27. 이러한 최적화된 조건(표 1)은 저항성 장벽 무결성을 유지하는 단층을 반복적으로 개발했으며, 이는 특정 장 분절에 맞게 배양 조건을 조정하는 것의 중요성을 강조합니다.
in vivo gut의 다세포 계통 복잡성을 정확하게 반영하는 모델에 대한 접근은 이러한 조사에 매우 중요합니다. 이를 통해 연구자들은 장 환경의 자연 조건을 밀접하게 모방할 수 있어 실험을 위한 보다 신뢰할 수 있는 기반을 제공할 수 있습니다. 이 프로토콜을 통해 연구자는 연구 역량을 향상시키는 강력한 모델을 갖추게 되어 잠재적으로 연구 분야에서 획기적인 발견으로 이어질 수 있습니다. 이러한 접근 방식은 장 건강과 질병을 이해하는 데 기여할 뿐만 아니라 가축 관리 및 식품 안전을 개선하기 위한 전략 개발에도 도움이 됩니다.
공개
저자는 선언할 이해 상충이 없습니다.
감사의 말
이 연구는 미국 국립보건원(National Institutes of Health, K01OD030515, R21OD031903 YMA)과 WSU VCS 레지던트 및 대학원생 연구 보조금(GDD)의 지원을 받았습니다. 저자는 기증 소를 공급해 준 참여 도축장에 감사의 뜻을 전합니다.
자료
| Name | Company | Catalog Number | Comments |
| Basal Medium | |||
| Advanced DMEM/F12 (1X) | Gibco | 12634-010 | n/a |
| GlutaMAX-I (100X) | Gibco | 35050-061 | 2 mM |
| HEPES (1M) | Gibco | 15630-080 | 10 mM |
| Pen Strep Glutamine (100X) | Gibco | 10378-016 | 1X |
| Organoid Culture Medium (Supplements to Basal Medium) | |||
| A-83-01 | Sigma-Aldrich | SML0788-5MG | 500 nM |
| B27 Supplement (50X) | Gibco | 17504-001 | 1X |
| [Leu15]-Gastrin I human | Sigma-Aldrich | G9145-.5MG | 10 nM |
| Murine EGF | PeproTech | 315-09-500UG | 50 ng/mL |
| Murine Wnt-3a | PeproTech | 315-20-10UG | 100 ng/mL |
| N-Acetyl-L-cysteine | MP Biomedicals | 194603 | 1 mM |
| N-2 MAX Media Supplement (100X) | R&D Systems | AR009 | 1X |
| Nicotinamide | Sigma-Aldrich | N0636-100G | 10 mM |
| Noggin Conditioned Medium | n/a | n/a | 10 vol/vol % |
| Primocin | InvivoGen | ant-pm-2 | 100 µg/mL |
| R-Spondin-1 Conditioned Medium | n/a | n/a | 20 vol/vol % |
| SB202190 | Sigma-Aldrich | S7067-25MG | 10 µM |
| Monolayer Culture Medium (Supplements to Organoid Culture Medium) | |||
| CHIR99021 | Sigma-Aldrich | SML1046-5MG | 2.5 µM |
| HI FBS | Gibco | 10438-034 | 20 vol/vol % |
| LY2157299 | Sigma-Aldrich | SML2851-5MG | 500 nM |
| Y-27632 | StemCellTechnologies | 72308 | 10 µM |
| Reagents | |||
| Alexa Fluor 488 Mouse anti-E-cadherin | BD Biosciences | 560061 | 1:200 dilution |
| Alexa Fluor 647 Phalloidin | Invitrogen | A22287 | 1:400 dilution |
| BSA | Cytiva | SH30574.02 | 2 w/vol % |
| Cell Recovery Solution | Corning | 354253 | n/a |
| DAPI Solution (1 mg/mL) | Thermo Scientific | 62248 | 1:1000 dilution |
| DPBS (1X) | Gibco | 14190-144 | n/a |
| Fluorescein Isothiocyanate–Dextran | Sigma-Aldrich | FD4-100MG | 0.5 mg/mL |
| Matrigel Matrix | Corning | 354234 | n/a |
| Paraformaldehyde Solution (4%) | Thermo Scientific | J19943K2 | n/a |
| ProLong Gold antifade reagent | Invitrogen | P36930 | n/a |
| SNA, EBL, Fluorescein | Vector Laboratories | FL-1301 | 1:100 dilution |
| Triton X-100 | Thermo Scientific | A16046.AE | 0.3 vol/vol % |
| TrypLE Express | Gibco | 12605-028 | n/a |
| Trypan Blue Solution, 0.4% | VWR Life Science | K940-100ML | n/a |
| Materials and Equipment | |||
| 0.4 µm Cell Culture Insert | Falcon | 353095 | |
| 24-well Cell Culture Plate | Corning | 3524 | |
| 48-well Cell Culture Plate | Thermo Scientific | 150687 | |
| 70 µm Sterile Cell Strainer | Fisher Scientific | 22-363-548 | |
| 96-well Cell Culture Plate | Greiner Bio-One | 655086 | |
| Centrifuge | Eppendorf | 5910Ri | |
| CO2 Incubator | Thermo Scientific | 370 | |
| Epithelial Volt-Ohm Meter | Millipore | Millicell ERS-2 | |
| Hemocytometer | LW Scientific | CTL-HEMM-GLDR | |
| Inverted Confocal Microscope | Leica Microsystems | SP8-X | |
| Inverted Phase-Contrast Microscope | Leica Microsystems | DMi1 | |
| Microscope Cover Glass | Fisher Scientific | 12-540-B | |
| Microplate Reader | Molecular Devices | SpecrtraMax i3x | |
| Microscope Slides | Fisher Scientific | 22-034-486 | |
| Pasteur Pipets | Fisher Scientific | 13-678-20C | |
| Scalpel Blade | iMed Scientific | - | #11 carbon steel |
| Vortex Mixer | Scientific Industries | SI-0236 | |
| Software | |||
| LAS X imaging software | Leica Microsystems | LAS X 3.7.6.25997 | |
| Microplate Reader software | Molecular Devces | SoftMax Pro 7.1.2 |
참고문헌
- Min, S., Kim, S., Cho, S. W. Gastrointestinal tract modeling using organoids engineered with cellular and microbiota niches. Exp Mol Med. 52 (2), 227-237 (2020).
- Fitzgerald, S. F., et al. Shiga toxin sub-type 2a increases the efficiency of Escherichia coli O157 transmission between animals and restricts epithelial regeneration in bovine enteroids. PLoS Pathogens. 15 (10), e1008003 (2019).
- Dutta, D., Heo, I., Clevers, H. Disease modeling in stem cell-derived 3D organoid systems. Trend Mol Med. 23 (5), 393-410 (2017).
- Beaumont, M., et al. Intestinal organoids in farm animals. Vet Res. 52 (1), 33 (2021).
- Kawasaki, M., Dykstra, G. D., McConnel, C. S., Burbick, C. R., Ambrosini, Y. M. Adult bovine-derived small and large intestinal organoids: In vitro development and maintenance. J Tissue Eng Regene Med. 2023, e3095002 (2023).
- Kvidera, S. K., et al. Intentionally induced intestinal barrier dysfunction causes inflammation, affects metabolism, and reduces productivity in lactating Holstein cows. J Dairy Sci. 100 (5), 4113-4127 (2017).
- Crawford, C. K., et al. Inflammatory cytokines directly disrupt the bovine intestinal epithelial barrier. Sci Rep. 12 (1), 14578 (2022).
- Heredia, N., García, S. Animals as sources of food-borne pathogens: A review. Animal Nutri. 4 (3), 250-255 (2018).
- Naylor, S. W., et al. Lymphoid follicle-dense mucosa at the terminal rectum is the principal site of colonization of enterohemorrhagic Escherichia coli O157:H7 in the bovine host. Infect Immun. 71 (3), 1505-1512 (2003).
- Co, J. Y., et al. Controlling epithelial polarity: A human enteroid model for host-pathogen interactions. Cell Rep. 26 (9), 2509-2520.e4 (2019).
- Pullinger, G. D., et al. Systemic translocation of Salmonella enterica Serovar Dublin in cattle occurs predominantly via efferent lymphatics in a cell-free niche and requires type III secretion system 1 (T3SS-1) but not T3SS-2. Infect Immun. 75 (11), 5191-5199 (2007).
- Nickerson, K. P., et al. A versatile human intestinal organoid-derived epithelial monolayer model for the study of enteric pathogens. Microbiol Spectr. 9 (1), e0000321 (2021).
- Varani, J., McClintock, S. D., Aslam, M. N. Cell-matrix interactions contribute to barrier function in human colon organoids. Front Med. 9, 838975 (2022).
- Freire, R., et al. Human gut derived-organoids provide model to study gluten response and effects of microbiota-derived molecules in celiac disease. Sci Rep. 9, 7029 (2019).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), e0231423 (2020).
- Kogut, M. H., Arsenault, R. J. Editorial: Gut health: The new paradigm in food animal production. Front Vet Sci. 3, 71 (2016).
- Lingard, E., et al. Optimising a self-assembling peptide hydrogel as a Matrigel alternative for 3-dimensional mammary epithelial cell culture. Biomater Adv. 160, 213847 (2024).
- Turksen, K. . Permeability Barrier: Methods and Protocols. , (2011).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J Lab Autom. 20 (2), 107-126 (2015).
- Frost, T. S., Jiang, L., Lynch, R. M., Zohar, Y. Permeability of epithelial/endothelial barriers in Transwells and microfluidic bilayer devices. Micromachines. 10 (8), 533 (2019).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cell Mol Gastroenterol Hepatol. 5 (4), 659 (2018).
- Sanz-Fernandez, M. V., et al. Targeting the hindgut to improve health and performance in cattle. Animals. 10 (10), 1817 (2020).
- Gressley, T. F., Hall, M. B., Armentano, L. E. Ruminant nutrition symposium: Productivity, digestion, and health responses to hindgut acidosis in ruminants. J Anim Sci. 89 (4), 1120-1130 (2011).
- O'Hara, E., Neves, A. L. A., Song, Y., Guan, L. L. The role of the gut microbiome in cattle production and health: Driver or passenger. Ann Rev Animal Biosci. 8 (2020), 199-220 (2020).
- Beach, J. C., Murano, E. A., Acuff, G. R. Prevalence of Salmonella and Campylobacter in beef cattle from transport to slaughter. J Food Protect. 65 (11), 1687-1693 (2002).
- Kawasaki, M., Ambrosini, Y. M. Accessible luminal interface of bovine rectal organoids generated from cryopreserved biopsy tissues. PLoS One. 19 (3), e0301079 (2024).
- Kawasaki, M., McConnel, C. S., Burbick, C. R., Ambrosini, Y. M. Pathogen-epithelium interactions and inflammatory responses in Salmonella Dublin infections using ileal monolayer models derived from adult bovine organoids. Scientific Reports. 14 (1), 11479 (2024).
재인쇄 및 허가
JoVE'article의 텍스트 или 그림을 다시 사용하시려면 허가 살펴보기
허가 살펴보기더 많은 기사 탐색
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. 판권 소유