Method Article
Dissecção de Órgãos do Zebrafish Adulto
Neste Artigo
Resumo
Este protocolo descreve um procedimento para identificar e dissecar os órgãos do peixe-zebra adulto.
Resumo
Nos últimos 20 anos, o peixe-zebra tornou-se um organismo modelo poderoso para a compreensão do desenvolvimento de vertebrados e doença. Embora a análise experimental do embrião e larva é extensa ea morfologia tem sido bem documentada, descrições da anatomia do peixe-zebra adulto e estudos de desenvolvimento das estruturas e órgãos adultos, juntamente com técnicas para trabalhar com adultos estão faltando. Os órgãos da larva sofrer mudanças significativas em sua estrutura geral, morfologia e localização anatômica durante o larval para a transição do adulto. Externamente, a larva transparente desenvolve sua característica adulto padrão pigmentar listrada e emparelhado nadadeiras pélvicas, enquanto internamente, os órgãos submetidos a enorme crescimento e remodelação. Além disso, o primórdio gônadas bipotential desenvolve em ambos os testículos ou ovários. Este protocolo identifica muitos dos órgãos do adulto e demonstra métodos para dissecção do cérebro, gônadas, sistema gastrointestinal, coração e rim de peixe-zebra adulto. Os órgãos dissecados podem ser utilizados para hibridização in situ, imuno-histoquímica, histologia, extração de RNA, análise de proteínas, e outras técnicas moleculares. Este protocolo vai ajudar na ampliação de estudos na zebrafish para incluir a remodelação dos órgãos larval, a morfogênese de órgãos específicos para as investigações adultos e outros sistemas de órgãos do adulto.
Protocolo
- Um peixe-zebra macho será dissecado em primeiro lugar, seguido por um peixe fêmea. Antes de iniciar a dissecação, anestesiar um peixe na tricaina 0,2% e depois sacrificá-lo por incubação em água gelada por 15 minutos.
- Comece acariciando levemente o peixe seco numa toalha de papel e colocá-lo em uma esteira de dissecação. Externamente, peixe-zebra tem única dorsal, nadadeiras caudais e anal e emparelhado barbatanas peitorais e pélvicas (Figura 1).
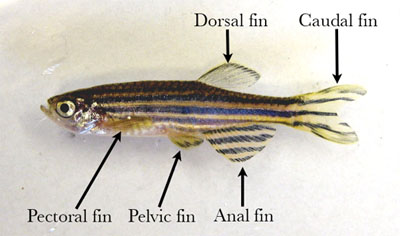
Figura 1. Peixes machos adultos com barbatanas rotulados. - Pin o peixe para o tapete dissecando através da parte carnuda da cauda e na parte ventral da cavidade ocular.
- Snip a pele na barriga do peixe só anterior à barbatana anal. Cortar a pele eo músculo subjacente ao longo da barriga da nadadeira anal à opérculo (o revestimento rígido sobre o gill) (Figura 2, etapa 1).

Figura 2. Passos na remoção de pele e músculos da parede do corpo para expor os órgãos internos. - Em seguida, retire o opérculo ea barbatana peitoral, incluindo a cintura peitoral (na região, de espessura óssea na base da nadadeira) (Figura 2, etapa 2). Cortar a pele e músculo subjacente início de cima do agora exposto gill posteriormente ao longo do lado do peixe e, em seguida, até o fin anal (Figura 2, etapa 3).
- Remova cuidadosamente a pele eo músculo subjacente do lado do peixe. Muitos dos órgãos internos são agora visíveis (Figura 3).
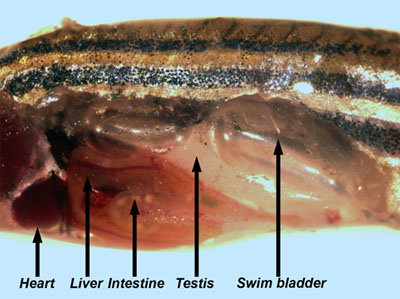
Figura 3. Peixes machos adultos com parede do corpo e do músculo removido permitindo a visualização dos órgãos internos. - Os testículos são longas, brancas, órgãos pares que estão ligados à parede do corpo dorsal. Remover um testículo e coloque-o em um prato de PBS. Examinar os testículos com a luz refletida para visualizar os túbulos seminíferos (Figura 4), que contêm cistos com vários estágios de células germinativas em desenvolvimento de spermatagonia para espermátides (Leal et al., 2009).
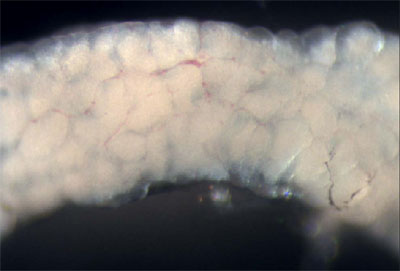
Figura 4. Dissecação de um testículo. As estruturas brancas arredondadas são os túbulos seminíferos. - Em seguida, remova o sistema gastrointestinal da cavidade do corpo do peixe. O fígado pode ser identificado pelo seu grande tamanho, morfologia lobed, cor tannish e vascularização extensiva. A vesícula biliar, um verde saco cheio de líquido translúcido, eo baço, que aparece vermelho brilhante, são encontrados dentro das vísceras.
- Separar os intestinos do resto dos órgãos e esticá-la. O anterior, as regiões média e posterior do intestino são definidos pela altura das pregas epiteliais (Wallace et al., 2005).
- Coloque um pedaço do intestino em PBS e observar as dobras epiteliais usando luz transmitida.
- Em seguida, examine a bexiga natatória. A bexiga natatória consiste em uma câmara posterior, que é ligado ao esôfago através do ducto pneumático, e uma câmara anterior, que é conectado ao ouvido interno através do aparelho weberiano (Finney et al., 2006).
- Remova e descarte a bexiga natatória. Unpin os peixes e re-pin lado ventral que até dissecar o rim, que está localizado ao longo da parede do corpo dorsal. O rim é uma estrutura translúcida rosa associados com a aorta dorsal e as células pigmentadas. O rim é dividido em cabeça, corpo e cauda regiões (Figura 5). Dissecar um pedaço do rim e colocá-lo em PBS. Separar os tecido renal para revelar os túbulos renais.
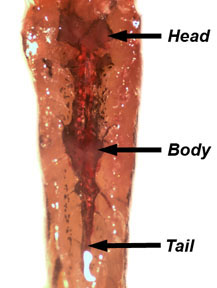
Figura 5. Localização de cabeça, corpo e cauda renal ao longo da parede do corpo dorsal. - Dissecar um peixe fêmea. Como descrito anteriormente, euthanize o peixe em água gelada e seque antes fixando-o para o tapete de dissecação. Retire a pele do lado do peixe como se demonstrou anteriormente. O ovário é uma estrutura bilobado que é suspenso na cavidade do corpo por um mesovário vascularizada.
- Remover um lobo do ovário, colocá-lo em PBS, e examiná-lo com luz transmitida. Os ovócitos podem ser separadas usando agulhas finas e depois encenado (Figura 6, Selman et al., 1993). Estágio I oócitos são aproximadamente 10 - 150 microns em tamanho e translúcido. Oócitos fase II são cerca de 150 - 350 microns em tamanho e definido pelo aparecimento de grânulos corticais. Oócitos fase III são 350-750 microns em tamanho e são opacas devido ao acúmulo de vitelo. Oócitos estágio maduro IV e V são translúcidas e geralmente não encontrados nos ovários de fêmeas que recentemente acoplado.
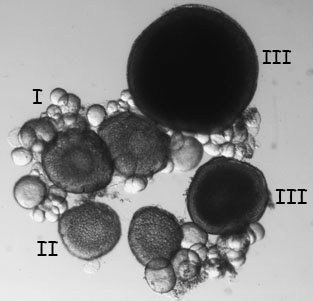
Figura 6. Palco ao vivo I, II, III e oócitos observado sob umdissecando microscópio com luz transmitida. - Em seguida, dissecar o coração do peixe. O coração está localizado posterior e ventral à brânquia. Comece por cortar o coração e todo o tecido circundante e colocando-o em PBS. Dissecar cuidadosamente afastado o tecido que envolve o coração, tomando cuidado para não danificar o átrio delicado.
- Coloque o coração dissecado em solução de Ringer para observar o batimento cardíaco.
Identificar o átrio, ventrículo e bulbo arterial (Figura 7, Hu et al., 2001).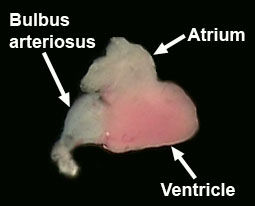
Figura 7. Dissecada coração adulto. - Completar a dissecção, removendo o cérebro do peixe. Comece por Unpinning o peixe e retirar a cabeça com uma lâmina de barbear. Remover o tecido mole tanto quanto possível, a partir do lado ventral do crânio, com fórceps. Remove os olhos com uma tesoura pequena mola. Ruptura de abrir o crânio e remover o osso do lado ventral do cérebro. Agora coloque a cabeça em um prato de PBS e remover os ossos do crânio e da pele do lado dorsal do cérebro.
- Identificar os bulbos olfativos, telencéfalo, habenula, tectum óptico, cerebelo e medula (Figura 8, Wullimann et al, 1996;. Schilling, 2002).
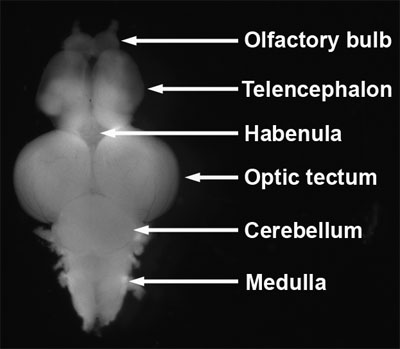
Figura 8. Cérebro zebrafish Dissecada adulto. Vista dorsal, anterior ao topo.
Divulgações
Agradecimentos
Este trabalho foi financiado pelo NIH conceder R01 HD050901 a MCM e bolsa de estudos da American Cancer Society de pós-doutorado # PF-05-041-01-DDC para TG.
Materiais
Reagentes:
0,2% tricaina (etílico 3-aminobenzoato)
200 mg tricaina pó
97,9 ml de água DD
~ 1 ml 1 M Tris (pH 9)
Ajustar o pH para 7,0
Tampão fosfato salino (PBS)
4,0 g NaCl
0,1 g KCl
100 ml 0,1 M PO 4 tampão, pH 7,3
150 ml dH 2 O
Solução de Ringer
6.7g NaCl
0,2 g KCl
0,2 g CaCl 2
Hepes 1.2g
1 LH 2 O
Ajustar o pH para 7,2
Equipamento:
Prato de dissecação com esteira
Microscopia Eletrônica de Ciências
catalogo 70540
Vannas Primavera tesoura
Multa Ferramentas Ciência
catalogo 91500-09
Referências
- Finney, J. L., Robertson, G. N., McGee, C. A., Smith, F. M., Croll, R. P. Structure and Autonomic Innervation of the Swim Bladder in the Zebrafish (Danio rerio). J Comp Neurol. 495, 587-606 (2006).
- Hu, N., Yost, H. J., Clark, E. B. Cardiac morphology and blood pressure in the adult zebrafish. Anat Rec. 264, 1-12 (2001).
- Leal, M. C., Cardoso, E. R., Nóbrega, R. H., Batlouni, S. R., Bogerd, J., França, L. R., Schulz, R. W. Histological and stereological evaluation of zebrafish (Danio rerio) spermatogenesis with an emphasis on spermatogonial generations. Biol Reprod. 81, 177-187 (2009).
- Schilling, T. F., Nusslein-Volhard, C., Dahm, R. The morphology of larval and adult zebrafish. Zebrafish: A Practical Approach (The Practical Approach Series). , (2002).
- Selman, K., Wallace, R., Sarka, A., Qi, X. Stages of oocyte development in the Zebrafish, Brachydanio rerio. J. Morphol. 218, 203-224 (1993).
- Wallace, K. N., Akhter, S., Smith, E. M., Lorent, K., Pack, M. Intestinal growth and differentiation in zebrafish. Mech Dev. 122, 157-173 (2005).
- Wullimann, M. F., Rupp, B., Reichert, H. . Neuroanatomy of the zebrafish brain : a topological atlas. , (1996).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados