Method Article
Imagem de receptor de estrogênio α-in Rat Arteríolas Pial usando um Microscópio Digital imunofluorescência
Neste Artigo
Resumo
O objetivo deste artigo é demonstrar um método para otimizar a detecção de imunofluorescência de receptor de estrogênio α (ERα) em ratos pial fatias arterial utilizando um microscópio digital de imunofluorescência.
Resumo
Muitos dos efeitos do estrogênio sobre a reatividade vascular são mediados através da interação com receptores de estrogênio 1, 2, 3. Apesar de dois sub-tipos de existir (receptor de estrogênio α e β), receptor de estrogênio α-foi identificado em ambos os músculos do suave e nas células endoteliais da pial segmentos arteriais usando coloração fluorescente combinada com microscopia confocal a laser de varredura 4. Além disso, ER-α está localizado no núcleo e no citoplasma das artérias basilar de ratos 5. Os receptores são abundantes e apresentam forte fluorescência, mas clara visualização de grupos distintos de receptores é difícil provavelmente devido ao número de camadas de células localizadas em muitos dos segmentos de navios pial. Além disso, muitos relatórios utilizando técnicas de imuno-histoquímica emparelhado com microscopia confocal mal detalhe os requisitos críticos para a reprodução de experiências 6. Nosso propósito para este artigo é descrever uma técnica simples para otimizar tele coloração e visualização de ER-α usando transversal fatias de arteríolas pial obter cérebros de ratos do sexo feminino. Nós primeiro perfundir ratos com Evans corante azul para identificar facilmente artérias superfície pial que isolar sob um microscópio de dissecação. Uso de um criostato de cortar 8 mM seções transversais das artérias nos permite obtenção de cortes finos vasos de modo que os aviões navio diferentes são mais bem visualizados. Cortando o navio em vez de usar de um segmento de pequenos vasos tem a vantagem de facilitar a visualização das camadas endoteliais e musculares lisas. Além disso, o uso de um microscópio de imunofluorescência digitais com software prorrogado profundidade produz imagens claras de 10-12 aviões navio diferente e é menos dispendioso do que o uso de um microscópio confocal de varredura a laser.
Protocolo
1. Isolamento e preparação de Artérias Pial
- Enquanto o rato é inserir anestesiados e segura de um cateter em uma artéria e perfundir com 1% de azul de Evans em 1X PBS. Vasos Pial mancha bem com o corante azul de Evans tornando-os mais fáceis de isolar.
- Extrair o cérebro e armazenar a -70 ° C até serem necessárias. Idealmente, o cérebro deve ser armazenado no máximo 2 meses.
- Usando um microscópio de dissecação remover arteríolas pial (média de diâmetro 35-50 mm) da superfície do cérebro. Retire cuidadosamente todas as arteríolas azul manchado de dorsal e lateral da superfície do córtex usando uma pinça de ponta fina. Remover o tecido cortical aderente excesso antes de colocar no fixador.
- Corrigir as arteríolas colhidas em 2% paraformaldeído em 0,1 M PBS fria por 30 min.
- Para preparar as arteríolas para seccionamento derramar meio de incorporação sobre o congelamento do disco / chuck (set a -20 ° C).
- Seção lugar arteríola plana sobre o mandril umand esperar para congelar. Firmemente colocar o navio-up diretamente no disco congelamento criostato sobre a incorporação da mídia com a ponta da artéria voltado para você. Segure-o com uma pinça até que ela está solidamente congelado.
- Coloque o disco de congelamento com o vaso na cabeça criostato e cortar 8 mM anéis arteríola pial com o criostato.
- Montagem das seções arteríola em cromo-potássio-gelatina slides subbed.
- Armazenar as lâminas preparadas em uma caixa de lâminas na geladeira a 4 ° C durante a noite.
2. ER-α coloração imunofluorescência
1 dia
- Remover os slides da geladeira; trazer cada à temperatura ambiente.
- Para lavar os slides derramar 1-1,5 ml 0,1 M PBS (o suficiente para cobrir todas as seções) deixe descansar por 10 minutos, escorra e repita o procedimento mais duas vezes. Cada borda do slide tem um marcador hidrofóbicas. Conseqüentemente, o líquido permanece na superfície da lâmina. Com cada lavagem o líquido é derramadopara fora e substituído por novas 0,1 M PBS.
- Incubar as lâminas em 1 ml de cloreto de amônio 50 mM por 30 min em temperatura ambiente para reduzir a fluorescência endógena.
- Lavar as lâminas em 0,1 M min 3x10 PBS. como descrito em 2.2
- Slides bloco em 0,1% Triton X-100 mais 1% de soro de cabra normal (NGS), em PBS por 30 min. para reduzir a ligação não específica.
- Incubar as amostras com o anticorpo primário (coelho policlonal anti-ER-α; 1:500) em PBS + 0,1% Triton-X + NGS 1% durante a noite a 4 ° C.
Dia 2
- Remover os slides da geladeira; trazer cada à temperatura ambiente.
- Lavar as lâminas em 0,1 M min 3x10 PBS. como descrito em 2.2
- Incube com Oregon Verde 488 secundário anti-coelho na NGS 1% 0,1% Triton-X100 + PBS por 2 horas no escuro a temperatura ambiente. A partir deste passo, os próximos passos devem ser feitas no escuro.
- Lavar as lâminas em 0,1 M min 3x10 PBS. como descrito em 2.2
- Sob uma vecapa ntilated, gota coloque 1 de 4 ', 6-diamidino-2-phenylindole (DAPI), mais meios de montagem de vasos e em seguida, coloque uma lamínula sobre a amostra.
- Aplicar unha clara polonês para selar as bordas da lamínula. Não mova os slides até que esteja completamente seco, o que leva aproximadamente 24 horas.
3. Fluorescência de Imagem Digital
- Para imagens de ER-α no vaso pial fatia usamos uma Nikon Eclipse 80i microscópio digital fluorescentes com filtros de 3 cores (azul, verde e vermelho) equipado com uma câmera digital.
- Inserir os slides preparados com o manchado segmentos de navios pial sob o microscópio e ajustar para visualizar as áreas de interesse fluorescente etiquetado. Iniciar com ampliação de x100 x600, em seguida, aumentar para ampliação.
- Use a câmera para capturar imagens em DAPI (azul) e (verde) FITC canais de núcleos celulares (DAPI) e ER-α (Oregon Green) usando software Nikon Foco Extended Profundidade para converter visão múltiplas de segmentos de navios em imagens 2-D.
4. Resultados representativos:
Nós localizada receptor de estrogênio α-in pial vasos arteriais utilizando sondas fluorescentes e otimizado nossa visualização do receptor usando microscopia de fluorescência digital. Para detectar a presença do receptor, um anticorpo policlonal de coelho primário e um verde Oregon 488 anticorpo marcado secundário foi utilizado para a imagem dos receptores nas artérias pial isoladas a partir da superfície do cérebro. Além disso, uma mancha nuclear (DAPI) foi utilizado para identificar o núcleo das células e determinar se pudéssemos detectar receptores localizados no núcleo desde ER-α tem sido relatada a estar presente na cyotosol celular e do núcleo. Além disso, realizamos experimentos de confirmação para validar a especificidade do anticorpo primário e verificar ligação do secundário ao anticorpo primário.

Figura 1. Coloração imunofluorescência para ER-α (verde) e contracoloração com DAPI (azul) em um anel de artéria pial isolado de cérebro de rato fêmea. Fig. 1A mostra as imagens fundidas, sugerindo a presença de alguns estrogênio receptor intranuclear-a. (Seta) Fig. 1B e 1C são a imagem focalizada de ER-α, que é uma combinação de Z-stack imagens. Imagens foram tiradas no x600 e ampliação são de cortar o anel do mesmo navio em diferentes planos. Setas indicam receptor de estrogênio α.
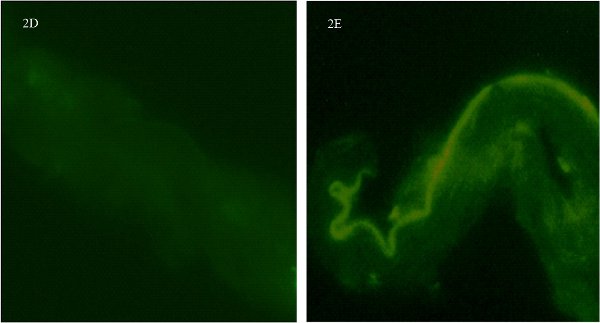
Figura 2. Coloração imunofluorescência para grupos de controle em um anel de artéria pial isolado de cérebro de rato fêmea. Fig. 2D mostra o navio sem o anticorpo primário. Fig. 2E mostra o navio sem o anticorpo secundário (autofluorescência nota distintas ao longo do lado endotelial). Imagens foram tiradas no x600 e ampliação são de cortar o anel do mesmo navio em difereaviões nt.
Discussão
Anteriormente, mostrou que, após lesão cerebral isquêmico transitório mundial a capacidade da artéria pial para mudar o diâmetro em resposta a ambos os vasodilatadores 7, 8 e 9 vasoconstritores é marcadamente deprimido em jovens ratas ovariectomizadas. Reposição estrogênica crônica restaura respostas vasomotoras 7-9. Além disso, reposição de estrogênio atrasada reverte os efeitos benéficos do estrogênio sobre a capacidade da artéria pial vasodilatador 10 levando-nos a questionar se a longo prazo a depleção de estrogênio afeta ER-α densidade na cerebrovasculature. Nós planejamos usar a rotulagem de imunofluorescência combinado com western blotting para avaliar mudanças na ER-α expressão em resposta à depleção de estrogênio crônica. Porque tivemos alguma dificuldade na visualização de grupos distintos de receptores que modificou o método que demonstramos aqui. Portanto, o nosso principal objetivo neste estudo foi a primeira a desenvolver um método relativamente simples para otimizar o visualização dos receptores nas arteríolas pial. De acordo com vários relatos 6,11,12 achamos necessário fazer ajustes para o tipo de tecido que estávamos investigando, a espessura da amostra, a distribuição de ER-α no reservatório, bem como o grau de ligação não específica .
Nosso método é muito eficaz para visualizar a presença de ER-α em fatias navio pial. Mas como outros já anteriormente apontado o uso bem sucedido desses métodos é altamente dependente da especificidade e concentrações dos anticorpos, a localização subcelular das proteínas de fixação de juros, e protocolos de bloqueio e manipulação de tecidos 12. Antes de visualização de preparações nossa embarcação que passou um tempo para trabalhar fora todas estas variáveis. Temos como destaque precisávamos ajustar algumas da nossa abordagem neste artigo.
Partimos para otimizar a visualização ER-α nas arteríolas pial e este apresentou alguns desafios.Primeiro, o tamanho médio de uma artéria de ratos pial é entre 35-50 mM fazer isolamento e remoção da superfície do cérebro um pouco complicado. Descobrimos que a perfusão com Evans blue dye antes do sacrifício torna a dissecção das artérias mais fácil. Evan azul pode afetar de fluorescência, mas sentimos que a vantagem de usar este corante superam as suas desvantagens menor. Em nosso protocolo os vasos são lavadas várias vezes. Isso minimiza o corante residual nos vasos e reduz os possíveis efeitos do corante em fluorescência. Outra dificuldade que encontramos foi a de que a espessura dos segmentos navio pial fez clara visualização dos receptores difícil. Além disso, não poderíamos obter imagens particularmente claro provavelmente devido ao fato de que ER-α foi espalhadas várias camadas de células. Nós tentamos trabalhar com fatias navio longitudinal (como outros), mas devido ao pequeno tamanho pial era difícil lidar com os navios e evitar torção dos vasos durante a montagemem lâminas, mesmo usando um microscópio. Finalmente, conseguimos a nossa técnica modificada usando um criostato e corte o vaso cruz-sábio em a 8 anéis mm de espessura. Os anéis são mais fáceis de manusear e várias podem ser montados em um slide.
Uma vez que adquiriu os vasos que sentiu a necessidade de testar a eficácia do primeiro flash congelamento do tecido, em seguida, fixar os vasos como sugerido por Danseshatalb e associados 11. Embora não tenhamos encontrado imunofluorescência fundo um pouco menos, também observou que os receptores manchada menos intensamente tornando a visualização dos receptores mais difícil. Conseqüentemente, nós preferimos primeiro a congelar o cérebro inteiro e armazenar até que seja necessário (geralmente entre 1-2 meses). Em seguida, retire os vasos, como descrito e corrigir os vasos antes de cortar com o criostato. como demonstramos aqui.
Um passo necessário é para executar os controles com os dois principais eo anticorpo secundário separadopara determinar a especificidade e imunofluorescência fundo. Receptor de estrogênio α-anticorpos pode ser difícil de trabalhar. Na verdade, tentamos três diferentes anticorpos primários (monoclonal 1 e 2 policlonal) antes estávamos satisfeitos com o sucesso de nossa coloração receptor. Como parte de nossos controles, primeiro verificou a especificidade do anticorpo primário por omissão da adição do anticorpo primário. Figura 2D mostra o navio sem o anticorpo primário. Não há coloração e apenas um sinal de fundo pouco. Uma vez que o anticorpo primário policlonal é, há alguma coloração de fundo difusa não-específicas. Em segundo lugar, acrescentou o anticorpo primário, mas não o anticorpo secundário (Fig. 2E). Pode-se ver uma boa margem representando o autofluoresence ao longo das fronteiras endotelial dos vasos. Isto é consistente com a obra de Dan e associados 5. No entanto, nem os pequenos pontos de imunofluorescência que representam ER-α, nem a ref aparência granularselecionar as presença de receptores numerosos podem ser detectadas sem a combinação de ambos os anticorpos primário e secundário. Observamos um padrão distinto de autofluoresence ao longo das margens endotelial dos vasos. Estes testes independentes para a especificidade de anticorpos são importantes, pois confirmam a especificidade do anticorpo para o ER-α eo anticorpo secundário liga-se ao primário.
Em conclusão, como demonstrado por outros 4, 5 vasos sanguíneos do cérebro contêm numerosos ER-α sub-tipo de receptores. Em nossas mãos, preparando 8μm cruz fatias seccional de artérias isoladas pial aumenta coloração e visualização dos receptores. Métodos tradicionais usam microscopia confocal para examinar as amostras. Ter a capacidade de ver seriados óptica a partir de amostras de espessura é um benefício importante da microscopia confocal. No entanto, a compra de um microscópio confocal boa pode ser muito caro. Usando software Extended Profundidade (FED), descobrimos quepoderia reduzir nossos custos de equipamento. Usando um microscópio de fluorescência com a EDF foram obtidas imagens claras e são capazes de visualizar pial arterial ER-α em vários níveis usando Z-stacks. Um benefício significativo do software FED é que ela permite captura de imagem de forma a efetivamente criar uma imagem 3-D a partir das imagens. Para laboratórios que não têm acesso a um microscópio confocal ou os fundos para comprar um microscópio fluorescente digitais com software apropriado pode ser uma opção prática e menos onerosa, dependendo dos objetivos do pesquisador.
Divulgações
As opiniões expressas são de responsabilidade dos autores e não refletem a política ou posição oficial da Universidade Militar de Ciências da Saúde, o Departamento de Defesa, ou o governo dos Estados Unidos.
Agradecimentos
O trabalho para este projeto foi suportado por concessões do National Institutes of Health R01-NR5339 e da Universidade Militar de Ciências da Saúde-R061LD.
Materiais
| Name | Company | Catalog Number | Comments |
| Nome do reagente | Companhia | Número de catálogo | |
| Azul de Evans | Sigma | E-2129 | |
| PBS 10X | Sigma | P-5493 | |
| Paraformaldeído | Fisher Scientific | T353 | |
| Tissue-Tek Compound outubro | VWR | 25608-930 | |
| Cloreto de amônio | Sigma | A9434 | |
| Triton X-100 | Sigma | T9284 | |
| Soro normal de cabra | Invitrogen | 16210-064 | |
| ER-α anticorpo policlonal de coelho | Santa Cruz | H-184 | |
| Oregon verde 488 de cabra anti IgG de coelho | Invitrogen | O-11038 | |
| Vectashield montagemmeio para fluorescência com DAPI | Vector Lab | H-1200 |
Referências
- Smiley, D. A., Khalil, R. A. Estrogen compounds, estrogen receptors and vascular cell signaling in the aging blood vessels. Curr. Med. Chem. 16, 1863-1887 (2009).
- Miller, V. M., Duckles, S. P. Vascular actions of estrogens: functional implications. Pharmacol. Rev. 60, 210-241 (2008).
- Duckles, S. P., Krause, D. N. Cerebrovascular effects of oestrogen: multiplicity of action. Clin. Exp. Parmacol. Physiol. 34, 801-808 (2007).
- Stirone, C., Duckles, S. P., Krause, D. N. Multiple forms of estrogen receptor-a incerebral blood vessels: regulation by estrogen. Am. J. Physiol. Endocrinol. Metab. 284, E184-E192 (2003).
- Dan, P., Cheung, J. C., Scriven, D. R., Moore, E. D. Epitope-dependent localization of estrogen receptor-alpha, but not -beta, in en face arterial endothelium. Am. J. Physiol. Heart Circ. Physiol. 284, 1295-1306 (2003).
- Fritschy, J. M. Is my antibody staining specific? How to deal with pitfalls of immunohistochemistry. Eur. J. Neurosci. 28, 2365-2370 (2008).
- Watanabe, Y., Littleton-Kearney, M. T., Traystman, R. J., Hurn, P. D. Estrogen restores post-ischemic pial and microvascular dilation. Am. J. Physiol. Heart and Circ. 281, H155-H160 (2001).
- Li, M., Zeynalov, E., Li, X., Miyazaki, C., Koehler, R. C., Littleton-Kearney, M. T. Effects of estrogen on postischemic pial artery reactivity to ADP. Microcirculation. 16, 403-413 (2009).
- Qin, X. Y., Hurn, P. D., Littleton-Kearney, M. T. Estrogen restores postischemic sensitivity to thromboxane mimetic U46619 in rat pial artery. Cereb. Blood. Flow. Metab. 25, 1041-1046 (2005).
- Miyazaki, C., Koelher, R. C., Littleton-Kearney, M. T. Effects of HET0016 and estrogen on pial artery vasodilatory capacity. FASEBJ Abstracts. , (2007).
- Daneshtalab, N., Dore, J. J. E., Smeda, J. S. Troubleshooting tissue specificity and antibody selection: procedures in immunohistochemical studies. J. Pharmacol. Toxical. Methods. 61, 127-135 (2010).
- Lorincz, A., Nusser, Z. Specificity of immunoreactants. J. Neurosci. 28, 9083-9086 (2008).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados