É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
A cirurgia de derivação, coração direito Cateterismo e Vascular morfometria em um modelo de rato para induzida Fluxo de Hipertensão Arterial Pulmonar
Neste Artigo
Resumo
This protocol describes a surgical procedure to create a model for flow-induced pulmonary arterial hypertension (PAH) in rats and the procedures to analyze the principle hemodynamic and histological end-points in this model.
Resumo
In this protocol, PAH is induced by combining a 60 mg/kg monocrotalin (MCT) injection with increased pulmonary blood flow through an aorto-caval shunt (MCT+Flow). The shunt is created by inserting an 18-G needle from the abdominal aorta into the adjacent caval vein. Increased pulmonary flow has been demonstrated as an essential trigger for a severe form of PAH with distinct phases of disease progression, characterized by early medial hypertrophy followed by neointimal lesions and the progressive occlusion of the small pulmonary vessels. To measure the right heart and pulmonary hemodynamics in this model, right heart catheterization is performed by inserting a rigid cannula containing a flexible ball-tip catheter via the right jugular vein into the right ventricle. The catheter is then advanced into the main and the more distal pulmonary arteries. The histopathology of the pulmonary vasculature is assessed qualitatively, by scoring the pre- and intra-acinar vessels on the degree of muscularization and the presence of a neointima, and quantitatively, by measuring the wall thickness, the wall-lumen ratios, and the occlusion score.
Introdução
O objetivo desse método é criar um modelo reproduzível para a hipertensão arterial pulmonar grave, induzida por fluxo em ratos e medir o seu princípio hemodinâmica e pontos finais histopatológicos.
A hipertensão arterial pulmonar (HAP) é uma síndrome clínica que engloba um aumento progressivo na resistência vascular pulmonar, levando à falência ventricular direita e morte. Dentro do espectro da doença subordinador de doenças de hipertensão pulmonar (PH), HAP é a forma mais grave e uma que permanece sem cura 1. A arteriopatia subjacente na HAP é caracterizada por uma forma típica de remodelação vascular que provoca a oclusão do lúmen do vaso. Muscularização de navios não muscularização normais e hipertrofia da camada navio medial são considerados fenômenos precoce da doença em HAP, também são vistos em outras formas de PH 2, e são pensados para ser reversível 3. Conforme a HAP umdvances, a camada íntima começa a remodelar, eventualmente formando lesões neointimais característicos 2. -Type neointimal remodelamento vascular pulmonar é exclusivo para PAH e está actualmente a ser considerada irreversível 4.
Conforme a HAP é uma doença rara, os avanços na sua compreensão pathobiological e desenvolvimento de novas terapias têm se baseou fortemente em modelos animais. O modelo monocrotalin (MCT) em ratos é um simples modelo de hit single que tem sido, e ainda é, frequentemente utilizado. MCT é uma toxina que causa lesão aos arteríolas pulmonares e inflamação regionais 5. 60 mg / kg de MCT leva a um aumento da pressão arterial pulmonar média (PAP), a resistência vascular pulmonar (RVP), e a hipertrofia ventricular direita (HVD) depois de 3 - 4 semanas 6. O histomorfologia é caracterizada por hipertrofia medial isolada, sem lesões neointimais 5. o MCTmodelo de rato representa, assim, uma forma moderada de PH, e não HAP, embora seja normalmente apresentado como o último.
Em crianças com HAP associada a um shunt congênita da esquerda para a direita (HAP-CHD), aumento do fluxo sanguíneo pulmonar é considerado como o gatilho essencial para o desenvolvimento de lesões neointimais 7, 8, 9. Em ratos, o aumento do fluxo sanguíneo pulmonar pode ser induzida através da criação de uma derivação entre a aorta abdominal e a veia cava, uma técnica descrita pela primeira vez em 1990 10. Alternativas para criar aumento do fluxo pulmonar são por pneumonectomia unilateral ou subclávia à anastomose da artéria pulmonar 11. desvantagens conceituais desses modelos consistem em potencial de crescimento compensatório do pulmão remanescente e ativação da via de adaptação induzida pela pneumonectomia, ou de lesão iatrogênica da vasculatura pulmonar devidoa anastomose da artéria pulmonar, tanto confundindo os efeitos do aumento do fluxo sanguíneo pulmonar.
Quando um shunt aorto-cava é criado e aumento do fluxo sanguíneo pulmonar é induzida como um segundo hit em ratos tratados com MCT, lesões neointimais característicos ocorrem, e uma forma grave de HAP e falência do ventrículo direito associada (RVF) Desenvolver 3 semanas após o aumento fluir 12. A progressão hemodinâmica da HAP neste modelo pode ser avaliada in vivo pelo ecocardiograma e cateterismo cardíaco direito. O histomorfologia vascular, espessura da parede do vaso, o grau de oclusão arteriolar, e os parâmetros para a falência do ventrículo direito formam os pilares da caracterização ex vivo da HAP.
Este método descreve protocolos detalhados para a cirurgia de derivação aorto-cava (AC-shunt), cateterismo cardíaco direito e avaliação qualitativa e quantitativa de histomorfologia vascular.
Protocolo
Procedimentos envolvendo indivíduos animais foram aprovados pelo Comité Central Holandês para Experimentação Animal e do Comité de Cuidados com Animais da Universidade Medical Center Groningen (NL). foram usados tanto em ratos Wistar e Lewis com pesos entre 180 e 300 g.
1. Habitação e aclimatação
- Depois da chegada ao biotério central, ratos de casas em grupos de 5 por gaiola. Durante um período de aclimatação de 7 dias, acostumar os ratos a manipulação humana, mas não realizar quaisquer procedimentos experimentais.
2. Preparação e Injecção de estéril Monocrotalin
- Para 1 mL de 60 mg / mL monocrotalin (MCT) solução, pesar 60 mg de monocrotalin num tubo de 2 mL. Adicionar 700 ul de NaCl a 0,9%. Adicionar 200 mL de HCl 1M. Aquecer a solução no tubo sob água corrente da torneira quente e vortex-lo. Use N NaOH 6 para levar o pH no sentido 7.0. Use técnica estéril para a preparação do MCT para injeção em roedores.
- Injectar 1 mL de ml de solução estéril de 60 mg / MCT por kg por via subcutânea no pescoço (0,3 mL de 60 mg / ml para uma MCT-300 g de rato). NOTA: Nós não preferem usar volumes menores devido à maior chance de que a dose injectada não será apropriado.
Cirurgia Shunt 3. Aorta-cava
- Anestesia.
- Encher a câmara de indução com 5% de isoflurano / O2 a 100% (fluxo: 1 L / min) e colocar o rato na câmara. Verifique para a profundidade adequada da anestesia através da realização de uma pitada dedo do pé traseiro. Pesa-se o rato.
- Raspar e limpar o abdômen por uma área que é de aproximadamente 8 cm de comprimento e 3 cm de largura. Coloque o rato em sua parte traseira em uma esteira de calor (37 ° C) coberto por um tapete estéril.
- Colocar o focinho num ventilação máscara / capa com 2-3% de isoflurano / O2 a 100% (fluxo: 1 L / min). Verifique a profundidade da anestesia através da realização de uma pitada dedo da pata traseira. Aplicar pomada para evitar a secura e sob anestesia.
- shunt Surgery.
- Esfregar a pele com cloreto de-hexidine para a desinfecção. Injectar 0,01 mg / kg de buprenorfina por via subcutânea para analgesia pós-operatória.
- Utilize instrumentos estéreis para a cirurgia. Faça uma incisão com uma lâmina de bisturi nº 10 no abdômen na linha média, a partir de 1 cm abaixo do diafragma uma estendendo-se para baixo a apenas acima da genitália.
- Levanta o intestino com um cotonete de algodão, cobrir os intestinos em, uma gaze molhada estéril (NaCl a 0,9%), e colocá-los para o lado esquerdo do animal.
- Use cotonetes para separar as membranas que se ligam a aorta abdominal e veia cava inferior para os tecidos circundantes.
NOTA: Não dissecar as membranas entre a aorta ea veia cava. - Usando fórceps lasca, remover a gordura da aorta perivascular acima da bifurcação, apenas no lado direito da aorta e apenas no local onde a agulha será inserida.
- Use cotonetes para separar a aorta ea veia cava a partir mm supe 2rior ao local onde a agulha será inserida, de modo a criar espaço para uma braçadeira Biemer.
- Nesta área, em primeiro lugar colocar uma ligadura solta (5-0 sutura) em torno da aorta. Criar tensão na ligadura, colocando um grampo Kocher sobre ele, e, em seguida, colocar o Kocher superior ao da incisão (Figura 1A). Coloque a braçadeira Biemer apenas superior à ligadura (Figur e 1A).
- Com um cotonete de algodão, comprimir a veia cava como distalmente possível para obstruir o fluxo (Figura 1A). Dobrar uma agulha (18 L neste protocolo) num ângulo de 45 graus, com o orifício de apontador para o exterior (Figura 1A).
- Em um ângulo de 90 graus, inserir a agulha na aorta, acima da bifurcação, com o orifício da agulha que aponta para a esquerda (Figura 1A). Manipular a ponta da agulha para a esquerda e inseri-lo na veia cava.
NOTA: A ponta da agulha deve ser agora visible na veia cava (Figura 1B). - Usar um segundo cotonete para empurrar o restante sangue na aorta para fora do local de inserção para prevenir a trombose. Seca-se a área em torno da derivação com uma gaze estéril a fim de que a cola para colar de forma adequada.
- Retire a agulha toda para fora da aorta e aplicar imediatamente uma gota de cola de tecido para o local da punção na aorta. Certifique-se não cola o cotonete para o tecido. Soltar a aorta.
- Verifique se o shunt manualmente puxando e soltando a ligadura na proximal aorta para o shunt. Afrouxamento deve colorir a distal da veia cava para a derivação no vermelho brilhante e criar turbulência no local shunt.
NOTA: O aperto vai virar o sangue na veia cava volta ao vermelho escuro. - Colocar os intestinos de volta no animal. Feche a camada de músculo e pele com reabsorvíveis 4-0. Ventilar o animal com 100% de O2 para se recuperar da anestesia.
NOTA: Não deixe um animal autônoma até que tenha recuperado a consciência suficiente para manter decúbito esternal.
- Cirurgia Sham.
- Executar todos os procedimentos anteriores excepto para a inserção da agulha no interior da aorta.
- cuidados pós-cirúrgicos.
- Colocar o rato em uma gaiola única e em uma incubadora a 37 ° C até à manhã seguinte.
- Cerca de 6 horas após a cirurgia, injetar de 0,01 mg / kg de buprenorfina por via subcutânea para analgesia pós-operatória. Repita na manhã seguinte se o rato mostra sinais de desconforto.
NOTA: Os primeiros 3 dias após a cirurgia, os ratos tendem a comer e beber menos (isto é particularmente importante quando ração ou água potável são misturados com drogas). A maioria dos ratos mostram um comportamento normal de 3 dias após a cirurgia. Se não, acompanhar de perto. A perda de peso superior a 15% em uma semana é considerada anormal, e esses ratos deve ser sacrificados por a extracção do volume de sangue circulante, enquanto sob anestesia.
4. Desenvolvimento de PAH
NOTA: Neste protocolo, o animal é sacrificado pela extração do volume de sangue circulante, enquanto sob anestesia.
- Sacrificar um dia após a cirurgia (MF8) para as primeiras respostas celulares e funcionais ao aumento do fluxo sanguíneo pulmonar (por exemplo, gene-regulação ou fatores de transcrição precoce).
- Sacrificar uma semana após a cirurgia (MF14) para um fenótipo PAH vascular em estágio inicial (hipertrofia medial sem lesões neointimais).
- Sacrifício 2 semanas após a cirurgia (MF21) para um fenótipo PAH vascular em estágio avançado (marcada hipertrofia medial ea formação neointimal) com elevação ligeira na RVP e PAP.
- Sacrificar 3 semanas após a cirurgia (MF28) para um fenótipo PAH vascular em fase terminal (oclusão neointimal marcada) e elevação forte na RVP e PAP. Os sinais clínicos de falência ventricular direita são comuns nesta fase.
- Sacrifício após o dia 28 (MF-RVF) Para a falência do ventrículo direito associada à HAP (RVF), clinicamente definida como dispneia, letargia grave, e perda de peso (<10% em 1 semana). Terminar ratos quando um desses sinais está presente. Frequentemente, os ratos desenvolvem estes sintomas entre os dias 28 e 35 e, se deixada sem vigilância, morrer espontaneamente durante este intervalo de tempo.
5. Direito cateterismo cardíaco
- Anestesia.
- Encher a câmara de indução com 5% de isoflurano / O2 a 100% (fluxo: 1 L / min) e colocar o rato na caixa. Verifique para a profundidade adequada da anestesia através da realização de uma pitada dedo do pé traseiro. Pesa-se o rato.
- Raspar e limpar o pescoço no lado direito-ventral do rato e, para o protocolo de ecocardiografia, o tórax e abdômen superior.
- Colocar o rato de costas sobre um tapete de calor (37 ° C) e colocar o focinho num ventilação máscara / capa com 2-3% de isoflurano / O2 a 100% (fluxo: 1 L / min). O focinho deve ser enfrentado para o pesquisador.
- Verifique a profundidade da anestesia. Tenha cuidado com os ratos com hipertensão pulmonar grave. Se a taxa cardíaca diminui, reduzir a profundidade da anestesia. Preferível, executar todas as medidas dentro de 20 min. Aplicar pomada para evitar a secura e sob anestesia.
- protocolo de ecocardiografia.
- Realizar a ecocardiografia de acordo com o protocolo descrito por Brittain et ai. em JoVE 13.
- protocolo de cateterismo.
NOTA: Este protocolo utiliza uma cânula rígida pré-formada com uma ponta dobrada a 20 graus para guiar o cateter de silicone de 15 cm com uma esfera de 2 mm da ponta. Uma agulha 20-G com seu orifício ligeiramente dobrados para o interior é usado para inserir a cânula na veia jugular direita (veja a lista de materiais). Os ratos em qualquer fase de progressão e controlo HAP podem ser utilizados no presente protocolo.- Desinfectar o pescoço com cloreto de-hexidine. Faça um 1,5 cm incisão com uma lâmina de bisturi # 10 no lado direito-ventraldo pescoço, da clavícula direita ao osso mandibular.
- Espalhe o tecido com uma tesoura. Com uma pinça, puxe o tecido separados até a veia jugular aparece. Dissecar as membranas em torno da veia jugular com a pinça dissidentes.
- Coloque a tensão na veia jugular, colocando uma ligadura soltas (5-0 sutura) em torno do vaso. Aumentar a tensão e fita a ligadura sobre a máscara de ventilação (Figura 2A).
- A jusante do local de inserção, colocar uma ligadura solta em torno do vaso para apertar depois de a cânula in situ, de modo a evitar fugas e perdas de pressão.
- Utilizando as alças de uma pinça, dobrar ligeiramente a ponta de uma agulha de 20-L com o orifício para o interior para realizar a cânula com o cateter.
- Introduzir a ponta da agulha 20-G para dentro da veia e rapidamente colocar a cânula que contém o cateter no interior do vaso. Retire a agulha e, em seguida, feche a ligaduraque foi preparado no passo 5.3.4.
- Conduzir a cânula que contém o cateter na veia jugular. A ponta da cânula é uma curva de 20 graus (ver o passo 5.3.5). Manobra da cânula sob a clavícula e avançar um pouco para entrar no átrio direito (Figura 2C).
- Para entrar no ventrículo direito, momento a ponta da cânula para a esquerda, para o coração (Figura 2D). No monitor de cabeceira, uma curva de pressão RV deve aparecer, combinando Figura 2D.
- Quando a curva de pressão VD é constante, anote a pressão do ventrículo direito sistólica e diastólica 1 (sRVP1 / dRVP1).
- Manipular a ponta da cânula para a esquerda e para cima. Avançar o cateter no interior da cânula (Figura 2E).
- Avance o cateter na artéria pulmonar principal (PA). Nenhuma resistência deve ser sentida quando se passa da válvula pulmonar.
NOTA: Quando o cateter entra na artéria pulmonar principal, o dpressão iastolic vai subir. No monitor de cabeceira, uma curva de pressão PA deve aparecer, combinando Figura 2E. - Quando a curva de pressão PA é constante, anote as pressões sistólica, diastólica e média pressão PA 1 (sPAP1, dPAP1, mPAP1).
- Além disso avançar o cateter no interior da cânula até que a bola na ponta do cateter fica entalado numa artéria pulmonar. Observar a curva de pressão sobre a queda monitor de cabeceira e combinar a curva de pressão em cunha na Figura 2F.
- Quando a curva de pressão em cunha é constante, anote as pressões sistólica, diastólica e média pressão em cunha.
- Puxe o cateter lentamente e, posteriormente, medir e anotar os valores para sPAP2, dPAP2, mPAP2, sRVP2 e dRVP2, como exibido no monitor de cabeceira.
- Quando no RV, ligeiramente puxar a cânula e cateter para medir a pressão média do átrio direito (PAD). A curva deve coincidir com a curva RAP na Figura 2A.
NÃOTE: Neste protocolo, os ratos são sacrificados após o protocolo de cateterismo por a extracção do volume de sangue circulante, enquanto sob anestesia.
6. Morfologia Avaliação e morfometria
NOTA: Neste protocolo, o animal é sacrificado pela extração do volume de sangue circulante, enquanto sob anestesia. Os ratos em qualquer fase de progressão e controlo HAP podem ser utilizados no presente protocolo.
- Após o sacrifício, tirar os pulmões, cortando a traqueia cerca de 5 mm acima da bifurcação brônquica e os navios que ligam os pulmões ao coração. Coloque os pulmões em soro fisiológico frio. Dissecar o pulmão esquerdo. Corte o brônquio principal esquerdo na bifurcação.
- Encha uma seringa de 50 ml com paraformaldeído a 4%, anexar um tubo com uma cânula para a seringa, e pendurar a seringa cerca de um metro acima da tabela de trabalho. Encaixar a cânula no brônquio principal esquerdo para passivamente encher o pulmão com paraformaldeído.Lidar com paraformaldeído com cautela.
- Incubar o pulmão esquerdo em paraformaldeído durante 48 h.
- Desidratar o pulmão esquerdo por incubação consecutivamente em 70% de etanol (1 hora), 80% de etanol (1 hora), 90% de etanol (1 hora), etanol a 100% (3 h), xilol (2 h), e parafina ( 2 h).
- Incorporar o pulmão esquerdo em parafina, com o hilo do pulmão de frente para a cassete.
- Corar as secções de pulmão, 4 mícrons embebidos em parafina usando uma coloração Verhoeff ou Elastica-van Gieson, de acordo com as instruções do fabricante 29. Certifique-se as lâminas elásticas são bem diferenciados (como na Figura 3). Digitalizar os cortes corados em 40X.
- Divida o pulmão em 4 quadrantes. Em cada quadrante, encontrar 10 navios, com um diâmetro exterior <50 mm (intra-acinares) e 10 navios, com um diâmetro exterior> 50 mm (pré-acinares). Tire uma foto (2 x 40 imagens por pulmão). Zoom aleatoriamente até 20x e fotografar todos os naviosneste campo de visão para minimizar o viés de seleção.
- Excluir embarcações que têm uma proporção mais longo / curto de diâmetro> 2, uma forma circular incompleto, ou um colapso de mais do que um quarto da parede do vaso.
NOTA: Um exemplo de um vaso excluída é mostrada na Figura 3b Faça cada foto na mesma ampliação (40x) e incluem uma barra de escala. - Abrir ImageJ e a primeira imagem. Desenhar uma linha reta na barra de escala na imagem para definir a escala através de "Analyse" e "escala Set." Por "distância conhecida," utilizar o valor na barra de escala da imagem. Use micrómetros (um) como a unidade de comprimento. Defina a escala para global.
- Usando "seleções à mão livre", desenhar uma linha sobre o bordo interior da área luminal (Figura 3), e usar "medir" (Crtl m) para medir nesta área. Em seguida, desenhe uma linha ao redor do exterior elástica lIC lâmina (Figura 3) para medir a área total do vaso.
- Calcular luminal e o diâmetro exterior (
 ) usando
) usando  .
. - Calcular a espessura de parede utilizando
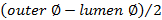 .
. - Calcula-se a razão de parede / lúmen usando
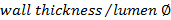 .
. - Calcular a pontuação oclusão usando
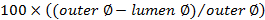 .
. - Pontuação do navio em muscularização (sem, muscularização parcial, ou total) (Figura 3B).
Nota: Os recipientes com uma lâmina elástica dupla para mais de metade da circunferência são definidos como totalmente muscularização. As embarcações com uma lâmina elástica dupla menos de metade da circunferência são definidos como parcialmente muscularização. - Marcar o recipiente na presença de um NeoiNtima (sim ou não) (Figura 3C).
Nota: Os recipientes sem uma lâmina elástica interna claramente definido combinado com oclusão (muitas vezes excêntrico) luminal são definidas como lesões neointimal.
Resultados
Os resultados representativos são apresentados na Figura 4. Os resultados apresentados mostram características do MCT + FLUXO em ratos Lewis nos seguintes grupos: Controle (n = 3), MF8 (n = 5), MF14 (n = 5), MF28 (n = 5) e MF-RVF ( n = 10). As análises estatísticas foram realizadas utilizando o one-way ANOVA com correção de Bonferroni.
60 mg / kg MCT e aumentou a vantagem fluxo sanguíneo pulmonar a um a...
Discussão
Este método descreve o procedimento cirúrgico de shunt aorto-cava em ratos pré-tratados com MCT para criar HAP induzida pelo fluxo e as técnicas para avaliar o princípio hemodinâmica e pontos finais histopatológicos que caracterizam HAP e este modelo.
Passos críticos dentro do Protocolo e solução de problemas
Cirurgia e pós-cirurgia. Durante a cirurgia de derivação aorto-cava, a etapa mais crítica é a dissecção da aorta e veia cava. As membranas que...
Divulgações
The authors have nothing to disclose.
Agradecimentos
This study was supported by the Netherlands Cardiovascular Research Initiative, the Dutch Heart Foundation, the Dutch Federation of University Medical Centers, the Netherlands Organization for Health Research and Development, and the Royal Netherlands Academy of Sciences (CVON nr. 2012-08, PHAEDRA, The Sebald fund, Stichting Hartekind).
Materiais
| Name | Company | Catalog Number | Comments |
| Shunt Surgery | |||
| Sterile surgical gloves | |||
| Duratears Eye ointment | Alcon | 10380 | |
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Histoacryllic tissue glue | B. Braun Medical | 1050052 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Safil 4-0 sutures violet resorbable | B. Braun Medical | ||
| 18 G needle | Luer | NN1838R BD | tip bent in 45 degrees orifice to the outside |
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Temgesic Buprenorphine | RB Pharmaceuticals | 5429 | subcutaneous injection |
| Sodium Chloride 0.9% | |||
| Ventilation mask Rat | |||
| Scalple blade | |||
| Biemer clamp 18 mm, 5 mm opening | AgnTho | 64-562 | |
| Heat mat | |||
| Kocher Clamp | |||
| Shaving machine | |||
| Microscope | Leica | ||
| Right Heart Catheterization | |||
| Sterile surgical gloves | |||
| Eye ointment | Duratears | ||
| Chloride-Hexidine | |||
| Cotton swabs | |||
| Gauzes 10 x 10 cm | Paul Hartmann | 407825 | |
| Silkam 5-0 sutures black non-resorbable | B. Braun Medical | F1134027 | |
| Needle 20 G | Luer | Tip slightly bent to the inside | |
| Cannula 20 G | Luer | to introduce catheter, tip pre-formed in 20 degrees | |
| Silastic Catheter 15 cm long | 0.5 mm ball 2 mm from tip | ||
| Pressure transducer | Ailtech | ||
| Bedside monitor Cardiocap/5 | Datex-Ohmeda | ||
| Shaving machine | |||
| 10 mL Syringe | |||
| Sodium Chloride 0.9% | for flushing | ||
| Vascular Morphology | |||
| 50 mL Syringe | |||
| 4% Formaldehyde | |||
| 18 G cannula with tube | |||
| Verhoef staining kit | Sigma-Aldrich | HT254 | http://www.sigmaaldrich.com/catalog/product/sigma/ht254?lang=en®ion=US |
| Digital slide scanner | Hamamatsu | C9600 | |
| ImageJ | |||
| Elastic (Connective Tissue Stain) | Abcam | ab150667 | http://www.abcam.com/elastic-connective-tissue-stain-ab150667.html http://www.abcam.com/ps/products/150/ab150667/documents/ab150667-Elastic%20Stain%20Kit%20(website).pdf |
Referências
- Hoeper, M. M., Bogaard, H. J., Condliffe, R., et al. Definitions and diagnosis of pulmonary hypertension. J Am Coll Cardiol. 62, D42-D50 (2013).
- Stacher, E., Graham, B. B., Hunt, J. M., et al. Modern age pathology of pulmonary arterial hypertension. Am J Respir Crit Care Med. 186 (3), 261-272 (2012).
- Levy, M., Maurey, C., Celermajer, D. S., et al. Impaired apoptosis of pulmonary endothelial cells is associated with intimal proliferation and irreversibility of pulmonary hypertension in congenital heart disease. J Am Coll Cardiol. 49 (7), 803-810 (2007).
- Sakao, S., Tatsumi, K., Voelkel, N. F. Reversible or irreversible remodeling in pulmonary arterial hypertension. Am J Respir Cell Mol Biol. 43 (6), 629-634 (2010).
- Gomez-Arroyo, J. G., Farkas, L., Alhussaini, A. A., et al. The monocrotaline model of pulmonary hypertension in perspective. Am J Physiol Lung Cell Mol Physiol. 302 (4), L363-L369 (2012).
- Jones, J. E. Serial noninvasive assessment of progressive pulmonary hypertension in a rat model. Am J Physiol - Heart Circ Physiol. 283 (1), 364-371 (2002).
- Hoffman, J. I., Rudolph, A. M., Heymann, M. A. Pulmonary vascular disease with congenital heart lesions: Pathologic features and causes. Circulation. 64 (5), 873-877 (1981).
- van Albada, M. E., Berger, R. M. Pulmonary arterial hypertension in congenital cardiac disease--the need for refinement of the evian-venice classification. Cardiol Young. 18 (1), 10-17 (2008).
- Dickinson, M. G., Bartelds, B., Borgdorff, M. A., Berger, R. M. The role of disturbed blood flow in the development of pulmonary arterial hypertension: Lessons from preclinical animal models. Am J Physiol Lung Cell Mol Physiol. 305 (1), L1-L14 (2013).
- Garcia, R., Diebold, S. Simple, rapid, and effective method of producing aortocaval shunts in the rat. Cardiovasc Res. 24 (5), 430-432 (1990).
- Okada, K., Tanaka, Y., Bernstein, M., Zhang, W., Patterson, G. A., Botney, M. D. Pulmonary hemodynamics modify the rat pulmonary artery response to injury. A neointimal model of pulmonary hypertension. Am J Pathol. 151 (4), 1019-1025 (1997).
- van Albada, M. E., Schoemaker, R. G., Kemna, M. S., Cromme-Dijkhuis, A. H., van Veghel, R., Berger, R. M. The role of increased pulmonary blood flow in pulmonary arterial hypertension. Eur Respir J. 26 (3), 487-493 (2005).
- Brittain, E. Echocardiographic assessment of the right heart in mice. JVis Exp. (e81), (2013).
- Dickinson, M. G., Bartelds, B., Molema, G., et al. Egr-1 expression during neointimal development in flow-associated pulmonary hypertension. Am J Pathol. 179 (5), 2199-2209 (2011).
- Borgdorff, M. A., Bartelds, B., Dickinson, M. G., Steendijk, P., de Vroomen, M., Berger, R. M. Distinct loading conditions reveal various patterns of right ventricular adaptation. Am J Physiol Heart Circ Physiol. 305 (3), H354-H364 (2013).
- Ruiter, G., de Man, F. S., Schalij, I., et al. Reversibility of the monocrotaline pulmonary hypertension rat model. Eur Respir J. 42 (2), 553-556 (2013).
- van Albada, M. E., Bartelds, B., Wijnberg, H., et al. Gene expression profile in flow-associated pulmonary arterial hypertension with neointimal lesions. Am J Physiol Lung Cell Mol Physiol. 298 (4), L483-L491 (2010).
- Dickinson, M. G., Kowalski, P. S., Bartelds, B., et al. A critical role for egr-1 during vascular remodelling in pulmonary arterial hypertension. Cardiovasc Res. 103 (4), 573-584 (2014).
- van der Feen, D. E., Dickinson, M. G., Bartelds, M. G., et al. Egr-1 identifies neointimal remodeling and relates to progression in human pulmonary arterial hypertension. Jheart lung transplant. 35 (4), 481-490 (2016).
- Rungatscher, A. Chronic overcirculation-induced pulmonary arterial hypertension in aorto-caval shunt. Microvasc Res. 94, 73-79 (2014).
- O'Blenes, S. B., Fischer, S., McIntyre, B., Keshavjee, S., Rabinovitch, M. Hemodynamic unloading leads to regression of pulmonary vascular disease in rats. J Thorac Cardiovasc Surg. 121 (2), 279-289 (2001).
- Sakao, S., Taraseviciene-Stewart, L., Lee, J. D., Wood, K., Cool, C. D., Voelkel, N. F. Initial apoptosis is followed by increased proliferation of apoptosis-resistant endothelial cells. FASEB J. 19 (9), 1178-1180 (2005).
- Spiekerkoetter, E. FK506 activates BMPR2, rescues endothelial dysfunction, and reverses pulmonary hypertension. J Clin Invest. 123 (8), 3600-3613 (2013).
- Nickel, N. P., Spiekerkoetter, E., Gu, M., et al. Elafin reverses pulmonary hypertension via caveolin-1-dependent bone morphogenetic protein signaling. Am J Respir Crit Care Med. 191 (11), 1273-1286 (2015).
- Meloche, J., Potus, F., Vaillancourt, M., et al. Bromodomain-containing protein 4: The epigenetic origin of pulmonary arterial hypertension. Circ Res. 117 (6), 525-535 (2015).
- Happé, C. M. Pneumonectomy combined with SU5416 induces severe pulmonary hypertension in rats. Am J Physiol Lung Cell Mol Physiol. 310 (11), L1088-L1097 (2016).
- Ranchoux, B., Antigny, F., Rucker-Martin, C., et al. Endothelial-to-mesenchymal transition in pulmonary hypertension. Circulation. 131 (11), 1006-1018 (2015).
- de Raaf, M. A. SuHx rat model: Partly reversible pulmonary hypertension and progressive intima obstruction. Eur Respy J. 44 (1), 160-168 (2014).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados