É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Isolamento de células-tronco mesenquimais de tecido pulpar e co-cultura com células cancerosas para estudar suas interações
Neste Artigo
Resumo
Nós fornecemos os protocolos para avaliação de células-tronco mesenquimais isoladas de polpa dentária e interações de células de câncer de próstata baseadas em métodos diretos e indiretos co-cultura. Médio de condição e membranas de trans-bem são apropriadas analisar a atividade indireta parácrina. Semeando diferencialmente manchado células juntos é um modelo adequado para a interação célula-célula direto.
Resumo
Câncer como um processo de várias etapas e doença complicada é não só regulado pelo crescimento e proliferação das células individuais, mas também controlada por interações de ambiente e célula-célula de tumor. Identificação de câncer e interações de células-tronco, incluindo alterações no ambiente extracelular, interações físicas e fatores secretados, poderá permitir a descoberta de novas opções de terapia. Aliamos técnicas de co-cultura conhecidos para criar um sistema de modelo para as células-tronco mesenquimais (MSCs) e câncer interações célula. No estudo atual, as células-tronco polpa dental (DPSCs) e interações de células de câncer de próstata PC-3 foram examinadas por técnicas de co-cultura diretos e indiretos. Médio de condição (CM) obtidos de DPSCs e 0,4 µm de tamanho de poros bem trans membranas foram usadas para estudar a atividade parácrina. Co-cultura de diferentes tipos de células juntos foi realizada para estudar a interação célula-célula direto. Os resultados revelaram que CM aumentou a proliferação celular e diminuição da apoptose em cultura de células de câncer de próstata. Tanto CM e sistema de trans-bem aumentaram a capacidade de migração celular de células PC-3. Células coradas com membrana diferentes corantes foram semeadas em vasos cultura mesmo, e DPSCs participaram em uma estrutura auto-organizada com PC-3 células sob essa condição de co-cultura direto. Em geral, os resultados indicaram que as técnicas de cultura co poderiam ser útil para câncer e interações MSC como um sistema modelo.
Introdução
Células-tronco mesenquimais (MSCs), com a capacidade de diferenciação e contributo para a regeneração dos tecidos mesenquimais como osso, cartilagem, músculo, ligamento, tendão e adiposo, têm sido isoladas de quase todos os tecidos do corpo adulto1 , 2. além de fornecer homeostase do tecido, produzindo células residentes em caso de inflamação crônica ou lesão, eles produzem vitais citocinas e fatores de crescimento para orquestrar a angiogênese, sistema imunológico e tecido remodelação3. A interação do MSCs com tecido de câncer não é bem compreendida, mas acumula evidências sugerem que o MSCs podem promover tumor iniciação, progressão e metástase4.
A capacidade de localização de MSCs à área lesada ou cronicamente inflamada torna um candidato valioso para terapias baseadas em células-tronco. No entanto, os tecidos de câncer, "nunca cura feridas", também liberar citocinas inflamatórias, moléculas pro-angiogênico e fatores de crescimento vitais, que atraem MSCs para a área de cancerogenous5. Embora existam limitada relatórios mostrando efeitos inibitórios do MSCs no cancro crescimento6,7, sua progressão do câncer e metástase, promovendo efeitos tem sido extensivamente relataram8. MSCs afectam directa ou indirectamente carcinogênese de maneiras diferentes, incluindo a supressão de células do sistema imunológico, secreção de fatores de crescimento/citocinas que oferecem suporte a proliferação de células cancerosas e migração, reforçar a atividade angiogênico e regulação 9,de transição epitelial-mesenquimal (EMT)10. Ambiente de tumor consiste de vários tipos de células, incluindo fibroblastos associada a câncer (CAFs) e/ou miofibroblastos, células endoteliais, adipócitos e células do sistema imunológico11. Destes, CAFs são o tipo de célula mais abundante na área do tumor que secretam várias quimiocinas promover câncer de crescimento e a metástase8. Ficou demonstrado que MSCs derivadas da medula óssea podem diferenciar em CAFs no tumor estroma12.
Células-tronco polpa dental (DPSCs), caracterizadas como os primeiros MSCs de derivado de tecido dentais por Gronthos et al . 13 em 2000 e então amplamente investigados por outros14,15, express pluripotência marcadores como Oct4, Sox2e Nanog16 e pode se diferenciar em várias células linages17. Análise de expressão de gene e proteína provou que DPSCs produzir níveis comparáveis de fatores de crescimento/citocinas com outros MSCs como fator de crescimento endotelial vascular (VEGF), angiogenin, fator de crescimento fibroblástico 2 (FGF2), interleucina-4 (IL-4), IL-6, IL-10, e fator de células-tronco (SCF), bem como ligante de quinase-3 fms-como tirosina (Flt - 3L) que pode promover a angiogênese, modulam as células imunes e suporte câncer célula proliferação e migração18,19,20 . Enquanto as interações do MSCs com ambiente de câncer têm sido bem documentadas na literatura, a relação entre DPSCs e células de câncer não foi avaliada ainda. No presente estudo, estabelecemos estratégias de tratamento médio de co-cultura e condição para uma linhagem de células de câncer de próstata metastático altamente, PC-3 e DPSCs para propor a ação potencial do mecanismo de MSCs dentais na progressão do câncer e metástase.
Protocolo
Termo de consentimento informado dos pacientes foi obtido após a aprovação do Comitê de ética institucional.
1. cultura e isolamento de DPSC
- Transferir os dentes do siso obtidos de adultos jovens com idades entre os 17 e os tubos de 20 a 15 mL contendo modificado Eagle médio (DMEM de Dulbecco completa) [baixa glicose DMEM meios de comunicação, suplementados com 10% de soro fetal bovino (FBS) e 1% penicilina/estreptomicina / solução de anfotericina (PSA)], dentro de 8 h após a ressecção. Manter o material de tecido frio (4 ° C) durante a transferência, para evitar potenciais morte celular.
- Remover o tecido pulpar por forceps de extração de estéril do centro do dente com cuidado, coloque o tecido pulpar no frio meio DMEM completo em pratos de cultura de tecido de 10 cm e pique-os em pedaços pequenos (2-3 mm) por bisturi.
Nota: Todos os procedimentos experimentais devem ser efectuados sob condições estéreis em capa de fluxo laminar. Esta técnica não enzimáticos tem sido utilizado anteriormente21,22,23. - Tecidos de celulose pequeno lugar dentro da cultura de tecidos trataram placas 6 boas e adicionar 200 µ l de mídia DMEM completa para cobrir cada pedaços de tecido de celulose pequena.
- Incube os poços de cultura de tecidos, a 37 ° C numa atmosfera de ar umidificado (80% de umidade) com 5% de CO2 por 2 h fornecer acessório de tecido.
Nota: Este passo pode ser prolongado para 3-4 h, controlando a evaporação da mídia. - Adicionar o volume apropriado (2-2,5 mL) de meio DMEM completo aos poços e incubar a 37 ° C numa atmosfera de ar umidificado com 5% de CO2 para as células a se espalhar no tecido.
Nota: As células se tornam visíveis após cerca de 4 dias e atingem a confluência após 8-9 dias. - Quando células alcançar 80% de confluência, retire mídia 6-poços chapas, lavar com 2 mL de soro de tampão fosfato (PBS) e adicionar 2 mL de tripsina. Incube durante 2 min em uma incubadora a 37 ° C, com atmosfera de ar umidificado e 5% de CO2. Em seguida, adicione 2 mL de meio DMEM completo seguido de incubação de 2 min para inibir a tripsina. Centrifugar as células a 300 x g por 5 min para células de Pelotas.
- Células de passagem para os frascos em completa DMEM mídia e loja para novas experiências. Adicionar 15 mL de mídia DMEM completa para os frascos de T-75 e células de transferência de dois poços da placa para frascos de T-75 um 6-poços e incubar a 37 ° C, com atmosfera de ar umidificado e 5% de CO2.
2. caracterização do DPSCs
- Realize análises morfológicas.
- Células da semente (passo 1.6) na cultura do tecido revestido frascos (ou placas boas 6) em meio DMEM completo pelo menos 8 passagens observar a morfologia celular.
- Visualizar células por microscópio de luz e definir a morfologia de células semelhantes a fibroblastos. Células devem anexar para os pratos de cultura e morfologia da célula como eixo.
Nota: Como alternativa, células podem ser cultivadas como células únicas por até 14 dias no poço-placas para observar a capacidade de formação de colônia que é uma característica específica de fibroblastos e MSCs.
- Realize análises de marcador de superfície.
- Trypsinize as células da etapa 1.7. Retire o frasco de cultura de tecidos T-75 mídia, lavar com 2 mL de PBS e adicionar 2 mL de tripsina. Incube durante 2 min em uma incubadora a 37 ° C, com atmosfera de ar umidificado e 5% de CO2. Em seguida, adicione 2 mL de meio DMEM completo seguido de incubação de 2 min para inibir a tripsina. Centrifugar as células a 300 x g por 5 min para células de Pelotas.
- Consertar as células com paraformaldeído 4% por 20 min em temperatura ambiente em tubos de 1,5 mL e em seguida, lave-os com 500 µ l de PBS 3 vezes para remover paraformaldeído.
- Incube as células fixas com os anticorpos contra CD29, CD34, CD14, CD45, CD90, CD105, CD166 e CD73 durante 1 h a 4 ° C em 100 µ l de PBS.
Nota: A concentração de anticorpo usado é de 0,5 µ g/mL. CD34, CD14 e CD45 são utilizados como marcadores negativos, enquanto CD29, CD90, CD105, CD166 e CD73 são utilizados como marcadores de superfície celular positivo para MSCs. - Lavar as células 3 vezes com PBS e usar respectivos anticorpos secundários como isotiocianato de fluoresceína (FITC), ficoeritrina (PE), etc. para rotulagem. Incube as células com anticorpos secundários de 1: 500 diluído em 100 µ l de PBS durante 30 min a 4 ° C e lavagem 3 vezes com PBS.
- Mantenha as amostras no escuro para análise de citometria de fluxo e detectar positivos e negativos de coloração por citometria de fluxo.
Nota: Use células controle imaculado para organizar a dispersão para a frente e lateral. Organize gating de positivamente manchado populações excluindo células mortas, detritos e população não-corada. Use 100 µm bocal com pressão de bainha de 45 libras por polegada quadrada e coletar 10.000 eventos para determinar o DPSCs positivos, organizando canais.
- Execute a diferenciação de DPSCs.
- Células de4 sementes 1 × 10 em placas de 24 poços em completar a mídia DMEM e incubam por 24 h a 37 ° C numa atmosfera de ar umidificado com 5% de CO2.
- Formular a diferenciação mídia usando competir meio DMEM como base media. Prepare a mídia osteogênica misturando 100 nM dexametasona, β-glicerofosfato de 10 mM e o ácido ascórbico 0,2 mM. Prepare a mídia chondrogenic misturando 1 × insulina-transferrina-selênio (ITS-G), 100 dexametasona nM, 100 ng/mL transformadora fator de crescimento beta (TGF-β), 14 μg/mL de ácido ascórbico e 1 mg/mL albumina de soro bovino (BSA). Prepare a mídia adipogenic misturando 100 dexametasona nM, 5 insulina μg/mL, 0,5 mM 3-isobutil-1-methylxanthine (IBMX) e 60 μM indometacina.
Nota: Mídia de diferenciação pode ser mantida a 4 ° C pelo menos uma semana. - Mudar meios de crescimento para osteo, Alexandra ou mídia de adipo-genic diferenciação e meios de atualizar duas vezes por semana durante duas semanas.
- Confirmar a diferenciação por von Kossa e Alcian coloração azul, atividade enzimática (atividade da fosfatase alcalina), imunocitoquímica e análises de reação em cadeia (qPCR) polimerase quantitativa de acordo com os protocolos descreveram anteriormente21.
- Executar von Kossa e Alcian blue citológicas em células que são corrigidas com paraformaldeído 4% à temperatura ambiente durante 10 min. lavam as células fixas com PBS e manchá-las com o kit de vonKossa de acordo com as recomendações do fabricante para observar os depósitos de cálcio .
- Prepare o Alcian azul coloração solução dissolvendo-se 1,00 g de corante de azul de Alcian em 100 mL de ácido acético a 3% (v/v) para manchar ainda mais. Lavar as células fixas com PBS e células por 30 min com solução de azul de Alcian de mancha. Visualize as amostras coradas por um microscópio de luz.
3. preparação de condição médio (CM)
- Substitua a mídia de células da etapa 1.7 com fresco completa DMEM 24 h antes da coleta do CM.
Nota: Recomenda-se passagem 2-4. - Recolha médio condição (CM) cultivadas DPSCs quando as células chegam a confluência de 80%. Centrifugue a mídia coletadas a 300 x g por 5 min remover restos de material e célula de resíduos de tecido.
Nota: Como alternativa, use filtros de seringa 0,2 µm para remover restos de meio de condição. - Recolher o sobrenadante e armazenar a-20 ° C para novas experiências.
Nota: Mantenha o sobrenadante a-80 ° C para armazenamento a longo prazo.
4. tratamento de células cancerosas com CM
- Realize análises de viabilidade celular.
- Semente PC-3 células (células de câncer de próstata humano) em placas de 96 poços, com uma densidade de células de 5 × 103 células/poço em completar DMEM e incubam em uma câmara umidificada em 37 ° C e 5% CO2 por 24 h.
- Trate as células com 10, 20, 30, 40 e 50% de CM (v/v) misturadas com DMEM completa por 24 h.
- Medir a viabilidade celular usando 3-(4,5-dimethyl-thiazol-2-yl)-5-(3-carboxymethoxy-phenyl)-2-(4-sulfo-phenyl)-2H-tetrazolium (MTS)-ensaio conforme descrito anteriormente,24.
- Execute a fim de nick do dUTP transferase terminal deoxynucleotidyl rotulagem análises (TUNEL).
- Semente PC-3 células em cultura de células de 6-poços chapas em uma densidade de células de 2 × 105 células/poço e incubam durante uma noite em uma câmara umidificada a 37 ° C e 5% de CO2 .
- Misture 20% CM (v/v) com completar meio DMEM e aplicar às células por 24 h.
- Trypsinize células e suspender em 50 μL de mistura de reação de TUNEL (rotulagem solução + solução enzimática, fornecido com o kit) e incubar a 37 ° C por 60 min em atmosfera umidificada e 5% CO2 .
Nota: Para tripsinização, remova a mídia de placas de cultura de célula 6-poços, lavar com 1 mL de PBS e adicione 500 µ l de tripsina. Incube durante 2 min em uma incubadora a 37 ° C, com atmosfera de ar umidificado e 5% de CO2. Adicione 1 mL de meio DMEM completo seguido de incubação de 2 min para inibir a tripsina. Centrifugar as células a 300 x g por 5 min para células de Pelotas. - Enxaguar com PBS e analisar as células em PBS usando citometria de fluxo.
- Realize análises de qPCR.
- Semente PC-3 células em cultura de células de 6-poços chapas em uma densidade de células de 2 × 105 células/poço e incubam durante uma noite em uma incubadora umidificada a 37 ° C e 5% de CO2 .
- Misture 20% CM (v/v) com completar meio DMEM e aplicar às células por 24 h.
- Trypsinize células e coletar centrifugado para isolamento e cDNA síntese de RNA.
Nota: Remova a mídia de placas de cultura de célula 6-bem, lavar com 1 mL de PBS e adicione 500 µ l de tripsina. Incube a 2 min em uma incubadora a 37 ° C, com atmosfera de ar umidificado e 5% de CO2. Adicione 1 mL de meio DMEM completo seguido de incubação de 2 min para inibir a tripsina. Centrifugar as células a 300 x g por 5 min para células de Pelotas. - Realize experimentos de qPCR de acordo com o protocolo descrito anteriormente,25.
- Execute a migração celular das células cancerosas.
- Semente de 1 × 105 PC-3 células em placas de 12-poços e incubá-los numa incubadora umidificado durante a noite a 37 ° C e 5% de CO2.
- Arranhar as células com uma ponta estéril 200 μL e mudar o meio imediatamente com meio fresco contendo diferentes concentrações de CM [por exemplo, 10, 20, 30, 40 e 50% de CM (v/v) misturado com DMEM completa].
- Observar riscos sob um microscópio invertido e tirar fotos em intervalos de tempo diferentes (0 e 24 h).
- Medir o encerramento do zero usando o software Image J usando a fórmula:
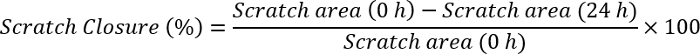
Nota: Abra a imagem zero com o software Image J. Desenhe uma linha que tem a mesma magnitude que a barra de escala que já existe na imagem. Clique em analisar, definir escala e observar a distância, em pixels, como a ampliação da linha desenhada. Escreva o tamanho da barra de escala para a parte de distância conhecida, organizar unidade (pixels, centímetros, etc) e clique em okey. Vá para a seção de analisar novamente e clique em medições. Isto dará primeiro o tamanho da barra de escala como a unidade selecionada. Clique em uma aresta da risque e arraste até atingir a outra extremidade da risque. Observe o valor para cada ponto de tempo (0 h e 24 h). Conecte esses valores na fórmula acima e calcular o risco encerramento.
5. célula de migração por contacto indirecto de células cancerosas e DPSCs
- Sementes de 3 × 104 DPSCs para placa 24 inserções com 0,4 μm pore e incubá-los numa incubadora umidificado durante a noite a 37 ° C.
- Células de PC-3 sementes para 24-bem placas em uma densidade de célula de 5 × 104 e incubá-los numa incubadora umidificado durante a noite a 37 ° C e 5% de CO2.
- PC-3 células com uma ponta estéril 200 μL de coçar, mudar o meio com meio fresco e colocar inserções carregando DPSCs para PC-3 células.
- Observar as células sob um microscópio invertido e tirar fotos em intervalos de tempo diferentes (0 e 24 h) para analisar a migração celular.
6. co-cultura ensaio e análise de citometria de fluxo
- Rotular o PC-3 células e DPSCs usando PKH67 (verde) e PKH26 (vermelho) célula fluorescente vinculador corantes, respectivamente,26.
- Trypsinize células PC-3 e DPSCs, respectivamente. Remova a mídia do frasco de cultura de tecidos T-75, lave com 2 mL de PBS e adicionar 2 mL de tripsina. Incube durante 2 min em uma incubadora a 37 ° C, com atmosfera de ar umidificado e 5% de CO2. Adicione 2 mL de meio DMEM completo seguido de incubação de 2 min para inibir a tripsina.
- Centrifugar as células em 300 x g durante 5 min, descartar o sobrenadante e ressuspender pelotas de célula na solução corante preparada em tampão diluente-C fornecido pelo kit (veja a Tabela de materiais).
- Incubar as células na solução corante por 10 min e finalizar a reação de coloração adicionando-se 100 µ l de FBS. Centrifugar as células em 300 x g durante 5 min, desprezar o sobrenadante e lavar as células com meio de cultura completo antes de cultivo co.
- Placa rotulada células (5 × 104/bem) nas 6-poços chapas na proporção de 1:1 (DPSCs: PC3). Manter pilhas co cultivadas em DMEM completa.
- Recolha pilhas após períodos de incubação de 24h ou 48h por centrifugação de células a 300 x g durante 5 min e lavagem com PBS.
- Ressuspender as células em 300 µ l de fluorescência-ativado da pilha classificação Reserva (FACS) em 5 mL redondo fundo tubos de citometria de fluxo. Vórtice de dispersar os agregados de células bem antes da análise da amostra.
- Use um bocal de 100 µm com pressão de bainha de 45 libras por polegada quadrada.
Nota: A taxa de fluxo extremamente elevada pode diminuir a sensibilidade da deteção de fluorescência. - Use controle unstained células e células coloridas únicas para ajuste apropriado para a frente e tensão de laser de dispersão de lado para tipos de células e de compensação, como mencionado anteriormente,27.
Nota: Utilize o gating para células vivas para excluir os restos celulares, células mortas ou agregados. - Colete 10.000 eventos (100.000 é preferível) para determinar o percentuais positivos DPSCs verdes e vermelho PC-3 células, organizando FL-1 (verde) e canais de FL-2 (vermelho).
Resultados
Figura 1 descreve as características gerais do Mestrado de DPSCs sob condições de cultura. DPSCs exercer a morfologia celular dos fibroblastos, como depois de chapeamento (figura 1B). Antígenos de superfície de MSC (CD29, CD73, CD90, CD105 e CD166) são altamente expressos enquanto marcadores hematopoiéticas (CD34, CD45 e CD14) são negativas (Figura 1). Alterações a nível morfológico e mol...
Discussão
Contribuição do MSCs para ambiente de tumor é regulada por diversas interações incluindo híbrido célula geração através de células fusões, entosis ou citocinas e chemokine atividades entre células-tronco e células de câncer28. Organização estrutural, interações célula-célula e fatores secretados determinam o comportamento de células de câncer em termos de promoção de tumor, progressão e metástase para o tecido circundante. Sistemas adequados ex vivo mod...
Divulgações
Os autores não têm nada para divulgar.
Agradecimentos
Este estudo foi suportado pela Universidade de Yeditepe. Todos os dados e os dados utilizados neste artigo foram publicados anteriormente34.
Materiais
| Name | Company | Catalog Number | Comments |
| DMEM | Invitrogen | 11885084 | For cell culture |
| FBS | Invitrogen | 16000044 | For cell culture |
| PSA | Lonza | 17-745E | For cell culture |
| Trypsin | Invitrogen | 25200056 | For cell dissociation |
| PBS | Invitrogen | 10010023 | For washes |
| Dexamethasone | Sigma | D4902 | Component of differentiation media |
| β-Glycerophosphate | Sigma | G9422 | Component of osteogenic differentiation medium |
| Ascorbic acid | Sigma | A4544 | Component of osteo- and chondro-genic differentiation medium |
| Insulin-Transferrin-Selenium (ITS −G) | Invitrogen | 41400045 | Component of chondrogenic differentiation medium |
| TGF-β | Sigma | SRP3171 | Component of chondrogenic differentiation medium |
| Insulin | Sigma | I6634 | Component of adipogenic differentiation medium |
| Isobutyl-1-methylxanthine (IBMX) | Sigma | I7018 | Component of adipogenic differentiation medium |
| Indomethacin | Sigma | I7378 | Component of adipogenic differentiation medium |
| MTS Reagent | Promega | G3582 | Cell viability analyses |
| TUNEL Assay | Sigma | 11684795910 | Apoptotic analyses |
| 24-well plate inserts | Corning | 3396 | For trans-well migration assay |
| PKH67 | Sigma | PKH67GL | For co-culture cell staining |
| PKH26 | Sigma | PKH26GL | For co-culture cell staining |
| Paraformaldehyde | Sigma | P6148 | For cell fixation |
| von Kossa Kit | BioOptica | 04-170801.A | For cell staining (differentiation) |
| Alcian blue | Sigma | A2899 | For cell staining (differentiation) |
Referências
- Camberlain, G., Fox, J., Ashton, B., Middleton, J. Mesenchymal stem cells: their phenotype, differentiation capacity, immunological features, and potential for homing. Stem Cells. 25 (11), 2739-2749 (2007).
- Demirci, S., Doğan, A., Şahin, F. . Dental Stem Cells. , 109-124 (2016).
- Fox, J. M., Chamberlain, G., Ashton, B. A., Middleton, J. Recent advances into the understanding of mesenchymal stem cell trafficking. British journal of haematology. 137 (6), 491-502 (2007).
- Chang, A. I., Schwertschkow, A. H., Nolta, J. A., Wu, J. Involvement of mesenchymal stem cells in cancer progression and metastases. Current cancer drug targets. 15 (2), 88-98 (2015).
- Dvorak, H. F. Tumors: wounds that do not heal. New England Journal of Medicine. 315 (26), 1650-1659 (1986).
- Lu, Y. -. r., et al. The growth inhibitory effect of mesenchymal stem cells on tumor cells in vitro and in vivo. Cancer biology & therapy. 7 (2), 245-251 (2008).
- Secchiero, P., et al. Human bone marrow mesenchymal stem cells display anti-cancer activity in SCID mice bearing disseminated non-Hodgkin's lymphoma xenografts. PloS one. 5 (6), e11140 (2010).
- Hong, I. -. S., Lee, H. -. Y., Kang, K. -. S. Mesenchymal stem cells and cancer: friends or enemies?. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. 768, 98-106 (2014).
- Brennen, W. N., Chen, S., Denmeade, S. R., Isaacs, J. T. Quantification of Mesenchymal Stem Cells (MSCs) at sites of human prostate cancer. Oncotarget. 4 (1), 106 (2013).
- Klopp, A. H., Gupta, A., Spaeth, E., Andreeff, M., Marini, F. Concise review: dissecting a discrepancy in the literature: do mesenchymal stem cells support or suppress tumor growth. Stem cells. 29 (1), 11-19 (2011).
- Albini, A., Sporn, M. B. The tumour microenvironment as a target for chemoprevention. Nature Reviews Cancer. 7 (2), 139 (2007).
- Quante, M., et al. Bone marrow-derived myofibroblasts contribute to the mesenchymal stem cell niche and promote tumor growth. Cancer cell. 19 (2), 257-272 (2011).
- Gronthos, S., Mankani, M., Brahim, J., Robey, P. G., Shi, S. Postnatal human dental pulp stem cells (DPSCs) in vitro and in vivo. Proceedings of the National Academy of Sciences. 97 (25), 13625-13630 (2000).
- Mori, G., et al. Dental pulp stem cells: osteogenic differentiation and gene expression. Annals of the new York Academy of Sciences. 1237 (1), 47-52 (2011).
- Mori, G., et al. Osteogenic properties of human dental pulp stem cells. Journal of biological regulators and homeostatic agents. 24 (2), 167-175 (2010).
- Kerkis, I., et al. Isolation and characterization of a population of immature dental pulp stem cells expressing OCT-4 and other embryonic stem cell markers. Cells Tissues Organs. 184 (3-4), 105-116 (2006).
- Potdar, P. D., Jethmalani, Y. D. Human dental pulp stem cells: applications in future regenerative medicine. World journal of stem cells. 7 (5), 839 (2015).
- Ahmed, N. E. -. M. B., Murakami, M., Hirose, Y., Nakashima, M. Therapeutic potential of dental pulp stem cell secretome for Alzheimer's disease treatment: an in vitro study. Stem cells international. 2016, (2016).
- Gorin, C., et al. Priming dental pulp stem cells with fibroblast growth factor-2 increases angiogenesis of implanted tissue-engineered constructs through hepatocyte growth factor and vascular endothelial growth factor secretion. Stem cells translational medicine. 5 (3), 392-404 (2016).
- Wakayama, H., et al. Factors secreted from dental pulp stem cells show multifaceted benefits for treating acute lung injury in mice. Cytotherapy. 17 (8), 1119-1129 (2015).
- Doğan, A., et al. Differentiation of human stem cells is promoted by amphiphilic pluronic block copolymers. International Journal of Nanomedicine. 7, 4849 (2012).
- Taşlı, P. N., Doğan, A., Demirci, S., Şahin, F. Boron enhances odontogenic and osteogenic differentiation of human tooth germ stem cells (hTGSCs) in vitro. Biological trace element research. 153 (1-3), 419-427 (2013).
- Yalvac, M., et al. Isolation and characterization of stem cells derived from human third molar tooth germs of young adults: implications in neo-vascularization, osteo-, adipo-and neurogenesis. The pharmacogenomics journal. 10 (2), 105 (2010).
- Doğan, A., et al. Sodium pentaborate pentahydrate and pluronic containing hydrogel increases cutaneous wound healing in vitro and in vivo. Biological trace element research. 162 (1-3), 72-79 (2014).
- Doğan, A., Yalvaç, M. E., Yılmaz, A., Rizvanov, A., Şahin, F. Effect of F68 on cryopreservation of mesenchymal stem cells derived from human tooth germ. Applied biochemistry and biotechnology. 171 (7), 1819-1831 (2013).
- Rizvanov, A. A., et al. Interaction and self-organization of human mesenchymal stem cells and neuro-blastoma SH-SY5Y cells under co-culture conditions: A novel system for modeling cancer cell micro-environment. European Journal of Pharmaceutics and Biopharmaceutics. 76 (2), 253-259 (2010).
- Troiano, L., et al. Multiparametric analysis of cells with different mitochondrial membrane potential during apoptosis by polychromatic flow cytometry. Nature protocols. 2 (11), 2719 (2007).
- Melzer, C., von der Ohe, J., Lehnert, H., Ungefroren, H., Hass, R. Cancer stem cell niche models and contribution by mesenchymal stroma/stem cells. Molecular cancer. 16 (1), 28 (2017).
- Aguirre, A., Planell, J., Engel, E. Dynamics of bone marrow-derived endothelial progenitor cell/mesenchymal stem cell interaction in co-culture and its implications in angiogenesis. Biochemical and biophysical research communications. 400 (2), 284-291 (2010).
- Bogdanowicz, D. R., Lu, H. H. . Biomimetics and Stem Cells. , 29-36 (2013).
- Plotnikov, E., et al. Cell-to-cell cross-talk between mesenchymal stem cells and cardiomyocytes in co-culture. Journal of cellular and molecular. 12 (5a), 1622-1631 (2008).
- Bogdanowicz, D. R., Lu, H. H. Studying cell-cell communication in co-culture. Biotechnology journal. 8 (4), 395-396 (2013).
- Brunetti, G., et al. High expression of TRAIL by osteoblastic differentiated dental pulp stem cells affects myeloma cell viability. Oncology reports. 39 (4), 2031-2039 (2018).
- Doğan, A., Demirci, S., Apdik, H., Apdik, E. A., Şahin, F. Dental pulp stem cells (DPSCs) increase prostate cancer cell proliferation and migration under in vitro conditions. Tissue and Cell. 49 (6), 711-718 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados