É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Fluorometria Sítio-Dirigida Funcional em Células Nativas para Estudo da Excitabilidade do Músculo Esquelético
Neste Artigo
Resumo
A fluorometria sítio-dirigida funcional é um método para estudar movimentos do domínio de proteínas em tempo real. A modificação desta técnica para sua aplicação em células nativas agora permite a detecção e rastreamento de movimentos de sensores de voltagem únicos a partir de canais de Ca2+ dependentes de voltagem em fibras musculares esqueléticas isoladas de murino.
Resumo
A fluorometria sítio-dirigida funcional tem sido a técnica de escolha para investigar a relação estrutura-função de numerosas proteínas de membrana, incluindo canais iônicos dependentes de voltagem. Esta abordagem tem sido usada principalmente em sistemas de expressão heteróloga para medir simultaneamente as correntes de membrana, a manifestação elétrica da atividade dos canais e medidas de fluorescência, relatando rearranjos de domínio local. A fluorometria sítio-dirigida funcional combina eletrofisiologia, biologia molecular, química e fluorescência em uma única técnica abrangente que permite o estudo de rearranjos estruturais em tempo real e função através de fluorescência e eletrofisiologia, respectivamente. Normalmente, essa abordagem requer um canal de membrana dependente de voltagem projetado que contenha uma cisteína que possa ser testada por um corante fluorescente reativo a tiol. Até recentemente, a química tiol-reativa utilizada para a marcação fluorescente sítio-dirigida de proteínas era realizada exclusivamente em oócitos e linhagens celulares de Xenopus , restringindo o escopo da abordagem a células primárias não excitáveis. Este relato descreve a aplicabilidade da fluorometria sítio-dirigida funcional em células musculares esqueléticas adultas para estudar os passos iniciais do acoplamento excitação-contração, o processo pelo qual a despolarização elétrica das fibras musculares está ligada à ativação da contração muscular. O presente protocolo descreve as metodologias para projetar e transfectar canais de Ca2+ voltagem-dependentes (CaV1.1) em fibras musculares do flexor curto dos dedos de camundongos adultos usando eletroporação in vivo e as etapas subsequentes necessárias para medidas funcionais de fluorometria sítio-dirigida. Esta abordagem pode ser adaptada para estudar outros canais iônicos e proteínas. O uso de fluorometria sítio-dirigida funcional do músculo de mamíferos é particularmente relevante para o estudo de mecanismos básicos de excitabilidade.
Introdução
A capacidade de rastrear rearranjos conformacionais de canais iônicos em resposta a um estímulo elétrico conhecido em uma célula viva é uma fonte de informações valiosas para a fisiologiamolecular1. Os canais iônicos dependentes de voltagem são proteínas de membrana que detectam mudanças na tensão transmembrana, e sua função também é afetada por mudanças de tensão2. O desenvolvimento das técnicas de pinça de voltagem no século passado permitiu aos fisiologistas estudar, em tempo real, as correntes iônicas transportadas por canais iônicos dependentes de voltagem em resposta à despolarização da membrana3. O uso da tecnologia de pinça de voltagem tem sido crucial na compreensão das propriedades elétricas de células excitáveis, como neurônios e músculos. Na década de 1970, o refinamento das pinças de tensão permitiu a detecção de correntes de fechamento (ou movimento de carga) em canais de cálcio (Ca V) e sódio (NaV) dependentes de tensão 4,5. As correntes de gating são correntes capacitivas não-lineares que surgem do movimento de sensores de tensão em resposta a mudanças no campo elétrico através da membrana celular6. As correntes de gating são consideradas uma manifestação elétrica de rearranjos moleculares que precedem ou acompanham a abertura dos canaisiônicos7. Embora essas medições de corrente forneçam informações valiosas sobre a função do canal, tanto as correntes iônicas quanto as correntes de sincronização são leituras indiretas de rearranjos conformacionais inter e intramoleculares de canais dependentes de voltagem7.
A fluorometria sítio-dirigida funcional (FSDF; também conhecida como fluorometria de clamp de voltagem, VCF) foi desenvolvida no inícioda década de 19908 e, pela primeira vez, forneceu a capacidade de visualizar diretamente as mudanças conformacionais locais e a função de uma proteína de canal em tempo real. Usando uma combinação de mutagênese de canais, eletrofisiologia e sistemas de expressão heteróloga, é possível marcar e rastrear fluorescentemente as partes móveis de canais ou receptores específicos em resposta ao estímulo ativador 9,10. Esta abordagem tem sido extensivamente utilizada para estudar os mecanismos de detecção de tensão em canais iônicos dependentes de voltagem 8,10,11,12,13,14,15,16,17,18,19. Para revisões autorizadas, ver 10,20,21,22,23.
Os canais Ca V e NaV, críticos para a iniciação e propagação de sinais elétricos, são compostos por uma subunidade α1 principal, que possui um poro central e quatro domínios de detecção de tensão não idênticos2. Além de sua estrutura primária distinta, os canais de Ca V e NaV são expressos como complexos de multisubunidades com subunidades auxiliares24. Os canais de potássio dependentes de voltagem (K V) consistem em quatro subunidades que se parecem com um único domínio de Na V ou CaV25. A subunidade α1 formadora de poros e sensor de tensão dos canais de Ca V e NaV é formada por um único polipeptídeo que codifica para quatro domínios individuais de seis segmentos transmembrana únicos (S1-S6; Figura 1A) 24,26. A região composta pelos segmentos transmembrana de S1 a S4 forma o domínio de detecção de tensão (VSD) e os segmentos transmembrana de S5 e S6 formam o domínio de poros26. Em cada CIV, a α-hélice S4 contém arginina ou lisina carregada positivamente (Figura 1A,B) que se movem em resposta à despolarização da membrana7. Várias décadas de pesquisa e os resultados de abordagens experimentais altamente diversas suportam a premissa de que os segmentos S4 se movem para fora, gerando correntes de fechamento, em resposta à despolarização da membrana6.
O FSDF mede as mudanças de fluorescência de um corante tiol-reativo conjugado a um resíduo específico de cisteína (isto é, a α-hélice S4) em um canal iônico ou outra proteína, projetada via mutagênese sítio-dirigida, à medida que o canal funciona em resposta à despolarização da membrana ou a outros estímulos10. De fato, o FSDF foi originalmente desenvolvido para investigar se o segmento S4 em canais de KV, proposto para ser o principal sensor de tensão do canal, se move quando as cargas de gating se movem em resposta a mudanças no potencial de membrana 8,10. No caso de canais iônicos dependentes de tensão, o FSDF pode resolver rearranjos conformacionais independentes dos quatro VSDs (rastreando um VSD a qualquer momento), simultaneamente com medições de função de canal. De fato, usando essa abordagem, demonstrou-se que as CIVs individuais parecem estar envolvidas diferencialmente em aspectos específicos da ativação e inativação do canal 12,27,28,29,30. A identificação da contribuição de cada VSD para a função dos canais é de alta relevância e pode ser usada para elucidar melhor a operação do canal e potencialmente identificar novos alvos para o desenvolvimento de fármacos.
O uso de FSDF em sistemas de expressão heteróloga tem sido extremamente útil para aprofundar nossa compreensão da função do canal a partir de uma perspectiva reducionista10,23. Como muitas abordagens reducionistas, apresenta vantagens, mas também tem limitações. Por exemplo, uma grande limitação é a reconstituição parcial do nanoambiente do canal no sistema heterólogo. Frequentemente, os canais iônicos interagem com inúmeras subunidades acessórias e inúmeras outras proteínas que modificam sua função31. Em princípio, diferentes canais e suas subunidades acessórias podem ser expressos em sistemas heterólogos com o uso de múltiplas construções codificadoras de proteínas ou plasmídeos policistrônicos, mas seu ambiente nativo não pode ser totalmente reconstituído30,32.
Nosso grupo publicou recentemente uma variante da FSDF em fibras musculares esqueléticas dissociadas nativas para o estudo dos passos iniciais do acoplamento excitação-contração (CCE)33,34, processo pelo qual a despolarização elétrica das fibras musculares está ligada à ativação da contraçãomuscular35,36. Pela primeira vez, essa abordagem permitiu o rastreamento de movimento de sensores de tensão S4 individuais do canal Ca2+ do tipo L dependente de tensão (CaV1.1, também conhecido como DHPR) no ambiente nativo de uma fibra muscular diferenciada adulta37. Isso foi conseguido considerando múltiplas características desse tipo celular, incluindo a atividade elétrica da célula permitindo a despolarização autopropagada induzida por estimulação rápida, a capacidade de expressar o plasmídeo de cDNA através da eletroporação in vivo, a alta expressão natural e organização compartimental dos canais dentro da célula, e sua compatibilidade com dispositivos de imagem de alta velocidade e gravação eletrofisiológica. Previamente, utilizamos um microscópio confocal de varredura de linha de alta velocidade como dispositivo de detecção37. Agora, uma variação da técnica é apresentada usando um fotodiodo para aquisição do sinal. Este sistema de detecção baseado em fotodiodos poderia facilitar a implementação desta técnica em outros laboratórios.
Aqui, um protocolo passo-a-passo para utilizar FSDF em células nativas para o estudo do movimento individual do sensor de tensão de CaV1.1 é descrito. Embora o canal CaV1.1 tenha sido usado como exemplo ao longo deste manuscrito, esta técnica pode ser aplicada a domínios extracelularmente acessíveis de outros canais iônicos, receptores ou proteínas de superfície.
Protocolo
Este protocolo foi aprovado pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Maryland. O protocolo a seguir foi dividido em várias subseções, consistindo de (1) desenho de construto molecular e seleção de corante reagente de cisteína, (2) eletroporação in vivo , (3) dissecção muscular e isolamento de fibras, (4) descrição do setup de aquisição, (5) avaliação da atividade elétrica positiva da fibra e coloração de cisteína com proteína fluorescente verde (EGFP) aprimorada, e (6) aquisição e processamento de sinais. Além disso, no início de cada seção, algumas considerações relevantes são detalhadas ao aplicar FSDF em uma fibra muscular esquelética. Todas as seções do protocolo devem ser realizadas com equipamentos de proteção individual adequados, incluindo jaleco e luvas.
1. Projeto de construção molecular e seleção de corantes reagentes de cisteína
- O design da construção é uma parte crítica do sucesso do experimento. Primeiro, gere uma construção de cDNA CaV1.1 do tipo selvagem, fluorescentemente marcada, e avalie sua expressão no tipo celular apropriado. Para fibras musculares, uma forte eficiência de transfecção pode ser alcançada usando um plasmídeo que carrega um promotor de citomegalovírus (CMV). Neste protocolo, foi utilizado um plasmídeoEGFP-Ca V1.1 de coelho já caracterizado38.
NOTA: Ao projetar a construção de cDNA para introduzir um resíduo de cisteína em um canal iônico dependente de voltagem, a posição da cisteína é crítica e deve ser cuidadosamente considerada. A cisteína deve ser acessível a partir do espaço extracelular para permitir uma reação corante conjugado ao tiol (Figura 1C,D) e deve ser proximal à região de S4 para rastrear precisamente seu movimento em resposta à despolarização. No entanto, para permitir a extinção da fluorescência do corante em resposta ao movimento da proteína, o fluoróforo conjugado de cisteína introduzido deve estar na interface de dois ambientes diferentes (por exemplo, membrana e líquido extracelular; Figura 1E). Além disso, é fundamental garantir que a cisteína inserida não interfira na função proteica. - Para obter uma ideia sobre a localização adequada da cisteína, reúna informações sobre a estrutura do canal ou de outros experimentos de fluorometria de outras proteínas do canal relacionadas. Para o projeto de construções Ca V 1.1projetadas com cisteína, avalie a estrutura crio-eletrônica resolvida (crio-EM) do canal26 e compare a inserção de cisteína de trabalhos anteriores de canais relacionados, como CaV1.2 12, ou outros canais, como Shaker11 e NaChBac 39.
- Uma vez escolhida a posição adequada da cisteína, use um kit comercial de mutagênese dirigida por local para introduzir substituições de cisteína. No presente protocolo, as seguintes modificações de cisteínas foram projetadas independentemente em cada extremidade citosólica do segmento sensor de voltagem S4 do CaV1.1: VSD-I (L159C), VSD-II (L522C), VSD-III (V893C), VSD-IV (S1231C) e UniProtKB: P07293 (Figura 1B).
- Para fibras musculares esqueléticas, utilizar o 5-carboxitetrametilrodamina metanoetiossulfonato (MTS-5-TAMRA), que apresenta difusão adequada e rápida para o sistema de membrana tubular transversa, que é uma invaginação da membrana superficial e a localização predominante dos canais de CaV1.1. MTS-5-TAMRA apresenta diminuição da fluorescência na transição da membrana lipídica para um ambiente aquoso (Figura 1E).
NOTA: Os derivados do Dylight ou Alexa-maleimida mancham a membrana superficial, mas não o sistema tubular transversal.
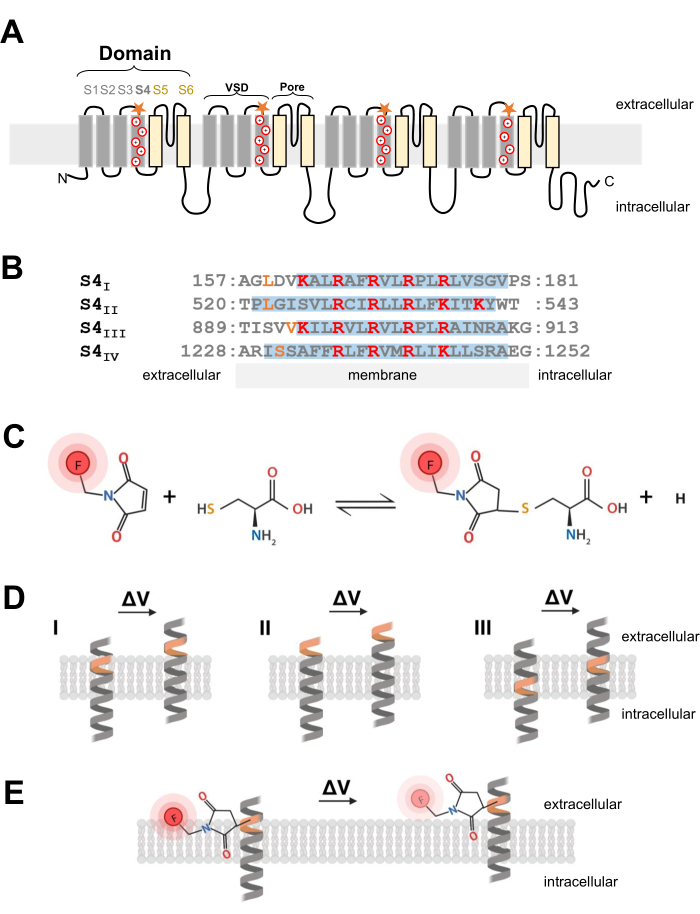
Figura 1: Esquema da reação tiol-cisteína na interface de uma α-hélice transmembrana. (A) Topologia de membrana CaV 1.1 tipo L. Os sinais de mais representam resíduos básicos dentro da α-hélice S4 e as estrelas laranjas indicam o local onde a cisteína foi introduzida via mutagênese sítio-dirigida. (B) Alinhamento da sequência de S4I a S4IV do coelho CaV1.1 (UniProtKB: P07293). Resíduos de arginina e lisina carregados positivamente críticos para detecção de tensão são destacados em vermelho, enquanto substituições de cisteína projetadas são indicadas em laranja. Este painel foi adaptado da referência37. (C) Reação da molécula fluorescente cisteína-tiol. (D) Diagrama ilustrando a inserção da mutagênese da cisteína dentro de uma α-hélice transmembrana sensível à voltagem. A cisteína deve ser enterrada na membrana em repouso e ser acessível extracelularmente após a despolarização (ΔV; I). O rastreamento da cisteína é tipicamente improvável de ocorrer se a cisteína alvo já estiver acessível a partir do espaço extracelular antes da despolarização (II) ou se a cisteína não for acessível a partir do espaço extracelular após a despolarização (III). (E) Após a reação com a molécula fluorescente de tiol, o movimento de α-hélice em resposta à despolarização diminui a emissão de fluorescência MTS-5-TAMRA. O sinal fluorométrico é gerado pelo movimento da hélice de S4 e o subsequente movimento do corante em relação ao plano da membrana e ao meio aquoso. Clique aqui para ver uma versão maior desta figura.
2. Eletroporação in vivo
OBS: Os experimentos de eletroporação foram conduzidos conforme descrito anteriormente38 com modificações. Na seção seguinte, o protocolo é projetado para a eletroporação de um coxim do pé do mouse. Os volumes precisam ser ajustados se ambas as patas estiverem preparadas.
- Alíquota 25-100 μL de solução plasmidial a 2-5 μg/μL em um tubo de 1,5 mL colocado sobre gelo.
- Preparar uma solução de 0,5 ml de hialuronidase 2 mg/ml em solução salina estéril e filtrar a solução através de um filtro estéril de proteína de baixa ligação de 0,2 μm montado numa seringa de 1 ml. Conservar num tubo de 1,5 ml à temperatura ambiente.
- Com um aparelho de anestesia calibrado, anestesiar um camundongo usando isoflurano a 3%-4,5% em O2 (1 L/min) colocando-o na câmara de anestesia. Confirme a anestesia adequada do animal apertando a ponta da cauda usando uma pinça. Nenhuma reação deve ser observada quando a anestesia ideal é atingida.
- Retire o rato da câmara de anestesia e coloque uma máscara nasal de anestesia sobre o rato. Coloque o animal de costas em uma almofada de aquecimento isotérmica coberta com uma almofada de banco estéril. Continuar a anestesia com máscara de roedor com isoflurano a 3% em O2 (1 L/min).
- Para evitar o ressecamento ocular durante o procedimento, aplique uma fina camada de creme de lágrima artificial nos olhos do animal com uma ponta de algodão estéril. Desinfete a pata do animal usando um lenço estéril saturado em álcool etílico.
- Com uma agulha de insulina estéril de 29 G de 0,5 pol, aspirar 20 μL de solução de hialuronidase. Penetrar na pele ao nível do calcanhar e deslizar a agulha por via subcutânea em direção à base dos pododáctilos (Figura 2A). Injete lentamente a solução enquanto move progressivamente a agulha para trás. Um bolo ou inchaço deve ser observado sob a pata (Figura 2B).
NOTA: Dependendo da idade do animal e do tamanho da pata, é provável que a quantidade total de solução não possa ser injetada. Muitas vezes, pode ocorrer um pequeno vazamento através do ponto de injeção. - Repetir o passo 2.6 com a outra pata, se desejar, utilizando outra agulha estéril após a desinfecção adequada da pata, como no passo 2.5.
- Desconecte a anestesia retirando o animal da máscara nasal e devolva o camundongo à gaiola com acesso a comida e água ad libitum. A recuperação completa da anestesia deve ser observada em ~5 min. Coloque o tubo contendo a solução plasmidial na bancada para permitir que atinja a temperatura ambiente.
- Após 1 h, anestesiar o animal uma segunda vez, colocá-lo sobre a almofada de aquecimento e desinfetar a pata conforme descrito nos passos 2.3-2.5.
- Injetar 10-20 μL da construção de cDNA, usando a mesma técnica descrita no passo 2.6. A quantidade total de construto injetado é de 50-100 μg por pata. Repita o procedimento com a pata contralateral, se desejar, usando outra seringa estéril.
- Manter o animal sob anestesia na almofada de aquecimento isotérmico por 5 min para permitir que a solução de cDNA se disperse uniformemente pelo tecido.
- Ligue o aparelho de eletroporação e conecte-o ao conjunto de eletrodos duplos, conforme recomendado pelo fabricante.
- Desinfete o conjunto de eletrodos duplos usando um lenço saturado em álcool etílico. Estabilize a pata com uma mão e primeiro insira um eletrodo sob a pele na parte de trás do calcanhar. Em seguida, insira o segundo eletrodo na base dos dedos, garantindo que as orientações de ambos os eletrodos sejam perpendiculares ao eixo do pé (Figura 2C). Orientar a sonda em uma posição que não restrinja o pé ou a perna em uma orientação angular extrema.
NOTA: A inserção de eletrodos pode ser facilitada com o uso de pinças e afiando regularmente as pontas dos eletrodos. Dependendo da idade do animal, o tamanho da pata pode variar e o espaçamento entre eletrodos deve ser adaptado de acordo. - Eletroporar os músculos aplicando 20 pulsos, 20 ms de duração/cada, a 1 Hz. Para agulhas de eletrodo espaçadas em 1 cm, ajuste a tensão para ~100 V. Isso deve ser adaptado se o espaçamento entre eletrodos for modificado para atingir ~100 V/cm. Uma ligeira flexão dos dedos deve ser observada durante a entrega do pulso se os eletrodos estiverem posicionados corretamente.
- Repetir os passos 2.13 e 2.14 com a pata contralateral, se desejado.
- Desconectar a anestesia e colocar o animal em uma gaiola, isolado de seu contra-companheiro não eletroporado com acesso ad libitum de ração e água por 2 h. A recuperação completa da anestesia deve ser observada em ~10 min. Coloque o animal de volta dentro da gaiola.
NOTA: A expressão do(s) construto(s) de cDNA é altamente dependente da proteína codificada. O turnover proteico, a quantidade e a qualidade do cDNA, do promotor do plasmídeo e de outras variáveis podem afetar a expressão do construto. Neste experimento, a expressão ótima da subunidade α1S de CaV1.1 com um promotor de CMV requer 4 a 6 semanas, mas pode ser detectada a partir de 2 semanas por até 12-15 meses.
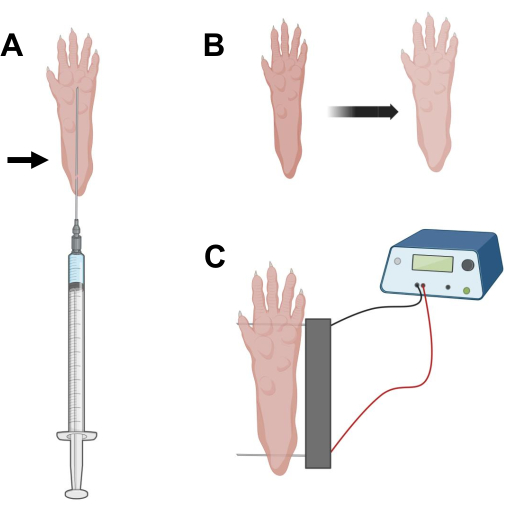
Figura 2: Diagrama de injeção de cDNA e eletroporação posicionamento do eletroporação em pé de camundongo para eletroporação. (A) Posição da agulha para injeção de hialuronidase e cDNA sob coxim de pé de camundongo. A seta indica o ponto de inserção através da pele. (B) Uma ligeira descoloração da pele e um ligeiro aumento do tamanho da pata devem ser observados transitoriamente após a injeção. (C) Posicionamento do arranjo de eletrodos para eletroporação. Clique aqui para ver uma versão maior desta figura.
3. Dissecção muscular e isolamento das fibras
LEGENDA: A dissociação das fibras musculares esqueléticas foi realizada conforme descrito anteriormente37,40,41 com modificações. Na seção a seguir, o protocolo é adequado para duas almofadas de pé do mouse.
- Antes da dissociação da fibra, prepare a placa coberta de silgardo adicionando uma parte do agente de cura a 10 partes de elastômero (% p/p) em uma placa de Petri plástica de 60 mm para atingir uma espessura de ~5 mm. Deixe a placa coberta de elastômero curar durante a noite antes de usar. Este pode ser reutilizado várias vezes se armazenado adequadamente e desinfetado com álcool etílico a 70% antes e após o uso.
- Preparar 4 mg de colagenase tipo I em 2 mL de meio essencial mínimo spinner (S-MEM) suplementado com 10% de soro fetal bovino (SFB; concentração final de 2 mg/mL). Transferir a solução para uma placa de plástico não revestida de 35 mm e colocar o prato numa incubadora a 37 °C, 5% CO2.
NOTA: S-MEM é uma formulação modificada de MEM sem glutamina e Ca2+. A ausência de Ca2+ nesta etapa reduz a contratura das fibras durante a digestão enzimática e trituração. - Adicionar 5 mL de S-MEM suplementado com FBS a 10% em uma placa plástica não revestida de 60 mm e armazenar na incubadora a 37 °C, 5% CO2.
- Eutanásia dos animais por asfixia via CO2 seguida de luxação cervical. Para reduzir a contaminação durante o isolamento celular primário, submergir a carcaça do animal em álcool etílico 70% por ~10 s. Retire e seque a carcaça com papel absorvente e corte os pés com uma tesoura entre o tornozelo e o joelho (Figura 3A).
- Fixar um pé do animal, com a pata voltada para cima, com pinos de dissecção na placa coberta de elastômero sob microscópio de dissecção em aumento de 10x.
- Com tesoura de dissecção e pinça fina, retirar a pele da pata para expor o músculo flexor curto dos dedos (FDB) (Figura 3B). Para evitar o ressecamento do tecido, adicione uma gota de S-MEM 10% FBS ao músculo usando uma pipeta de 1.000 μL.
- Ao nível do calcanhar, incisar o tendão e dissecar cuidadosamente o músculo FDB do calcanhar ao dedo dos pés (Figura 3B). Evite ao máximo a tensão no músculo durante a realização da dissecção. Muita força aplicada sobre os tecidos resultará em danos às fibras musculares. Coloque o músculo imediatamente na solução de colagenase.
- Repetir os passos 3.5-3.7 com o pé contralateral. Colocar o músculo dissecado na solução de colagenase em estufa a 37 °C, 5% CO 2 durante2 h 45 min a 3 h 15 min. Adaptar o tempo de incubação em função da atividade enzimática da colagenase e da idade do animal.
- Enquanto o tecido muscular estiver incubando, adicione 300 μL de MEM frio sem soro ou antibióticos no centro de uma placa de fundo de vidro de 35 mm. Adicionar 2 μL de laminina gelada a 1,20 mg/mL diretamente à MEM. Repita o processo para o número de pratos desejados. Colocar as placas na incubadora de cultura celular a 37 °C, 5% CO2 durante pelo menos 1 h para permitir a polimerização da laminina.
- Quando a digestão enzimática estiver completa, transfira o músculo para a placa de cultura celular de 60 mm contendo S-MEM 10% FBS com o uso de uma pipeta de vidro polido a fogo de grande diâmetro (5 mm) e um bulbo de látex.
- Usando uma pipeta de vidro polido a fogo de menor diâmetro (2 mm) e um bulbo de látex, triture suavemente o músculo sob um microscópio de dissecção (Figura 3C). As fibras musculares dissociadas devem começar a se desprender do tecido e ser liberadas na solução.
NOTA: Como regra geral, menos trituração (15-30 passagens de pipeta) é sempre preferível, pois muito prolongamento da trituração pode estressar ou até mesmo danificar as fibras. - Usando uma pinça fina, remova qualquer tecido não muscular, como nervos, tendões ou vasos sanguíneos (Figura 3D).
- Adicione 2 mL de MEM 2% FBS quente a cada prato de fundo de vidro revestido com laminina de 35 mm. Usando uma pipeta de 200 μL e uma ponteira de pipeta plástica estéril, transfira as fibras musculares dissociadas para a placa de fundo de vidro revestida com laminina de 35 mm (Figura 3E).
NOTA: Alcançar uma baixa densidade de fibras e permitir que as fibras sejam bem separadas umas das outras é importante para evitar a sobreposição de fibras. - Coloque a placa de fundo de vidro de 35 mm na incubadora a 37 °C, 5% CO2. As fibras podem ser usadas em um período de tempo de 2-20 h.
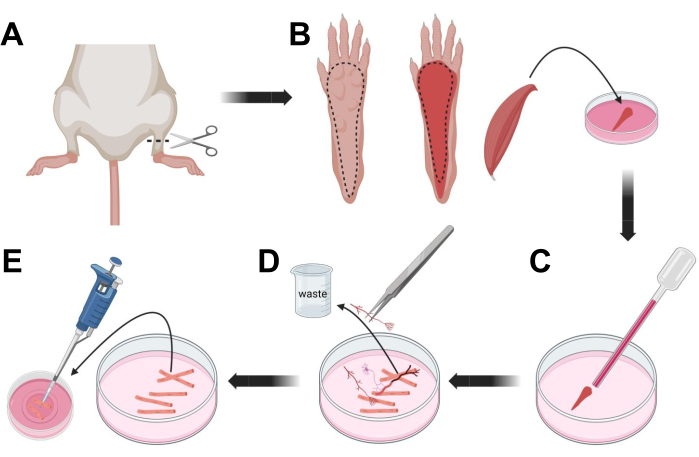
Figura 3; Dissecção e dissociação das fibras musculares FDB. (A) Após a dissecção do pé acima da articulação do tornozelo (linha tracejada), a pele sob a pata do pé é removida, seguindo a linha tracejada para expor o músculo FDB (B). O músculo é dissecado e colocado em solução de colagenase. (C) Após a incubação, o músculo é triturado para dissociar e obter fibras musculares individuais. (D) Pinças finas são usadas para remover tecido não muscular e detritos antes de transferir fibras musculares para a placa de cultura de fundo de vidro revestida com laminina. Clique aqui para ver uma versão maior desta figura.
4. Descrição da configuração da aquisição
NOTA: O arranjo de aquisição é comparável ao descrito antesde 42 com modificações (Figura 4A).
- Ligue todos os componentes: computador, conversor AD/DA e amplificador path-clamp, microscópio, estágio motorizado, manipulador(es), fonte de alimentação para o fotodiodo, fonte de luz, obturador de luz, gerador de pulso e editor de protocolo.
- Ative a lógica transistor-transistor (TTL) disparando o sinal OUT do AD/DA para controlar o gerador de pulsos, o obturador de luz e o editor de protocolo.
- Use o sinal de saída TTL do gerador de pulsos e conecte-se a um canal AD do amplificador para verificar o disparo temporal preciso. O controle adequado da consistência do disparo deve ser avaliado cuidadosamente antes do experimento para garantir a sincronização adequada do aparelho.
NOTA: No caso do CaV1.1, esperar ver o sinal máximo em menos de 4-10 ms após a estimulação (tempo para desenvolver o movimento de carga máxima5). O sinal é rápido e a resolução temporal precisa é fundamental para comparar com outras medidas, como transiente de cálcio ou movimento de carga medido via pinça de tensão. - Para focalizar a luz de excitação em uma área ou ponto específico da fibra (Figura 4B), use um diafragma posicionado no caminho da luz de excitação. Isso permite a aquisição do sinal apenas em uma área onde o sinal do EGFP-CaV1.1 é máximo (Figura 4B).
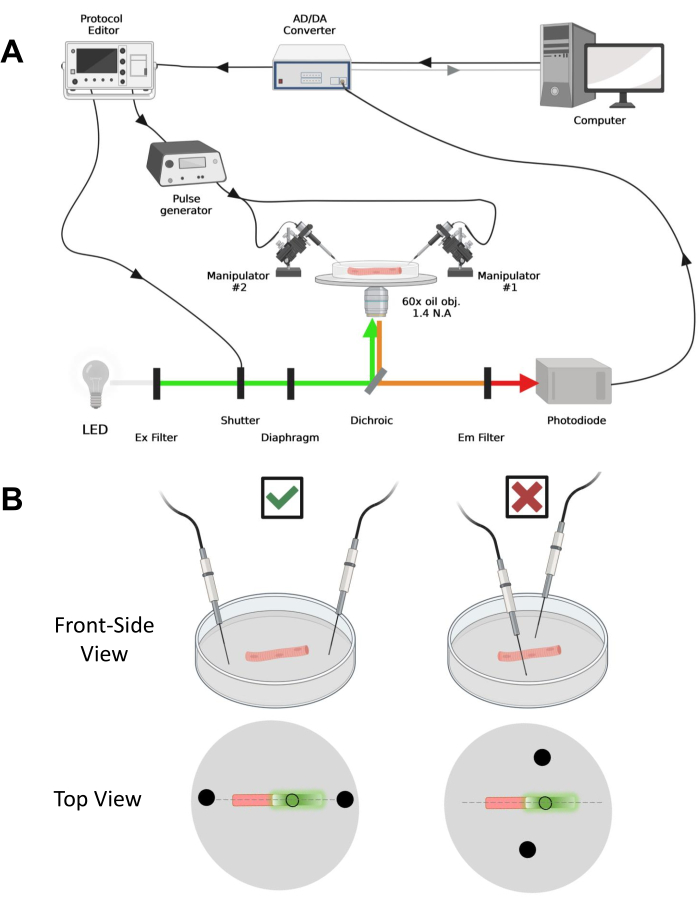
Figura 4: Descrição do sistema de registo. (A) Diagrama ilustrativo da conexão entre os diferentes componentes do sistema de registro. A configuração consiste em um microscópio invertido com um estágio motorizado, uma fonte de luz de diodo emissor de luz (LED), um obturador de luz, um circuito de monitoramento de luz baseado em fotodiodo feito sob medida com uma função track and hold43, um conversor AD/DA (de um amplificador de patch clamp), um gerador de pulso analógico, uma unidade de estimulação de campo externo acoplada a eletrodos de estimulação de campo, manipuladores motorizados e softwares comerciais para aquisição, sincronização e geração de protocolos. O eletrodo para estimulação de campo é feito de dois fios de platina soldados a cabos de cobre ligados ao gerador de pulsos através de um conector BMC. Filtros específicos de excitação e emissão são usados para detectar sinais EGFP e MTS-5-TAMRA. Para excitar o EGFP, uma lâmpada de xenônio com um filtro de excitação (Ex) de 488 nm (± 20 nm) e um filtro LP510 nm Em é usado. Para MTS-5-TAMRA, uma fonte de luz LED de 530 nm e um filtro LP550 nm Em é usado. (B) Vista de uma fibra expressando uma construção EGFP-CaV1.1-cys com os eletrodos de estimulação de dois campos (círculos pretos) orientados adequadamente (esquerda) e inadequadamente (direita) no eixo principal das fibras (linha tracejada). O círculo preto não preenchido representa a área de aquisição com diâmetro controlado pela abertura do diafragma, colocada à frente da fonte de luz. Clique aqui para ver uma versão maior desta figura.
5. Avaliação da atividade elétrica da fibra positiva para EGFP e coloração de cisteína
NOTA: A estimulação do campo das fibras musculares esqueléticas é realizada como descrito antesde 41 com modificações. Essa abordagem é usada para (1) identificar fibras saudáveis, funcionais e eletricamente responsivas, (2) corar as fibras com o corante fluorescente reativo à cisteína e (3) registrar o sinal fluorescente em resposta ao potencial de ação propagado. Cada etapa desta seção e a seguinte devem ser conduzidas em um ambiente de baixa luminosidade para reduzir o clareamento de corantes fluorescentes.
- Coloque a placa de fundo de vidro de 35 mm contendo fibras musculares dissociadas no palco do microscópio. Remover cuidadosamente o meio de cultura com uma pipeta de 1.000 μL e substituir por 2 mL de solução de Ringer à temperatura ambiente (ver Tabela 1 para composição). Várias rodadas de substituição de mídia podem ser necessárias para remover totalmente o meio de cultura celular original contendo cisteínas livres.
- Usando um manipulador mecânico ou motorizado, coloque os dois fios de platina perpendicularmente ao fundo da placa. Certifique-se de que os terminais do eletrodo estejam alinhados em relação ao eixo longitudinal da fibra e a alguns milímetros de distância das extremidades da fibra, e que a separação entre os eletrodos seja de 5 mm (Figura 4B). Ajuste ainda mais o posicionamento do eletrodo girando a placa ou montando cada eletrodo em um micromanipulador independente (Figura 4B).
- Acenda a luz transmitida e encontre as fibras no campo de visão usando uma objetiva de 20x. Mova o cubo de filtro EGFP para o caminho de luz.
OBS: Utilizando microscópio equipado com epifluorescência e objetiva de baixa magnificação (2x), é possível avaliar a eficiência da transfecção do construto em todo o músculo antes da dissociação das fibras, avaliando a expressão do EGFP (Figura 5A). - Usando um obturador de luz controlado remotamente, ative a luz de excitação de 488 nm para identificar as fibras positivas para EGFP. Armazene a localização da fibra x-y no prato usando um estágio de microscópio motorizado. O sinal EGFP é frequentemente heterogêneo dentro da fibra (Figura 4B). Centralize a posição salva no sinal EGFP mais brilhante.
- Depois de identificar as fibras positivas para EGFP, retorne à primeira localização salva. Usando um interruptor de gatilho manual, forneça dois pulsos de estimulação sequenciais com uma duração de 1 ms e amplitude de 20 V. Defina a polaridade dos pulsos para alternar.
- Após a estimulação, observar duas contrações concêntricas de fibras homogêneas em resposta aos dois pulsos de polaridade oposta. Uma contração local ou a ausência de contração em respostas a pulsos de polaridade alternada indicam respostas passivas locais não propagadas ou não excitabilizadas41. Exclua essas fibras para o resto do experimento.
- Adicionar 2 μL de solução MTS-5-TAMRA 10 mM diretamente no prato e misturar suavemente com uma pipeta de 1.000 μL (concentração final de 10 μM). Tome cuidado para não mover o prato, ou as posições de fibra armazenada serão perdidas. Incubar por 4-5 min para permitir a difusão da molécula fluorescente de tiol no lúmen do sistema tubular transverso.
- Aplicar estímulos bipolares repetitivos para evocar trens potenciais de ação sucessivos a uma taxa de 50 Hz por 300 ms a cada 1 s por 5 min.
NOTA: Os trens de pulso dão acessibilidade às cisteínas inseridas no S4 do EGFP-CaV1.1 para reagir com MTS-5-TAMRA. A capacidade da fibra de contrair-se mecanicamente em resposta à estimulação é importante para que o conteúdo do lúmen tubular transversal circule com o meio extracelular. - Retire a solução corante do prato com uma pipeta de 1.000 μL e substitua por 2 mL de solução de Ringer à temperatura ambiente. Duas ou três rodadas podem ser necessárias para remover totalmente o MTS-5-TAMARA não conjugado. Deixe a fibra corada se recuperar do protocolo de coloração por pelo menos 10 min.
- Como no passo 5.6, reavalie a saúde e a atividade elétrica da fibra observando a contração simétrica da fibra em resposta à polaridade alternada. Excluir fibras que não respondem a ambos os estímulos do resto do experimento.
- Mova o cubo do filtro MTS-5-TAMRA para o caminho de luz. Usando um obturador de luz controlado remotamente, ative a luz de excitação de 533 nm para confirmar a coloração homogênea MTS-5-TAMRA nas fibras.
NOTA: Ao serem corados com MTS-5-TAMRA, cisteínas modificadas e endógenas reagem com o derivado maleimida (Figura 5B). Assim, é difícil avaliar a reação adequada com a cisteína de interesse. CaV1.1 é expresso principalmente no túbulo transversal, formando um padrão distinguível de banda dupla. Usando um microscópio confocal ou de epifluorescência, uma imagem x-y poderia ser usada para confirmar a coloração adequada e a entrada e difusão dos túbulos transversais de MTS-5-TAMRA (Figura 5C).
6. Aquisição e processamento de sinais
NOTA: Antes de realizar medições fluorométricas, a aquisição do sinal deve ser cuidadosamente projetada para obter a relação sinal/ruído ideal. Taxas de amostragem mais lentas permitem maior detecção de luz, reduzindo o número de pontos que seriam adquiridos durante o rearranjo conformacional de proteínas. No caso do EGFP-CaV1.1-cys, o movimento de carga induzido por uma forma de onda de potencial de ação ocorre em ~1-10 ms37. Para obter múltiplos pontos para acompanhar a evolução do movimento ao longo do tempo, a aquisição foi ajustada para 50 μs por ponto.
- Coloque a fibra no meio do campo de visão com um sistema de ampliação adequado. Para esses experimentos, utilizou-se uma objetiva invertida com abertura numérica (NA) de 60x óleo e 1,4. Otimizar a iluminação e a posição da fibra com o estágio motorizado e o diafragma para iluminar uma área circular do diâmetro da fibra, onde o sinal EGFP é máximo (Figura 4B).
- Uma vez posicionada a fibra para aquisição, oriente os dois fios de platina de estimulação de campo montados independentemente em cada extremidade da fibra. Alinhar os fios no eixo principal das fibras em linha reta e espaça-os 5 mm com a fibra no centro (Figura 4B).
- Ajuste os filtros de aquisição, excitação e emissão para as configurações adequadas para MTS-5-TAMRA. Inicie o experimento executando o protocolo escrito no software de aquisição. Esta etapa aciona todos os dispositivos downstream (ou seja, editor de protocolo, obturador de luz, gerador de pulso).
NOTA: Este protocolo permite um breve período (ou seja, 10 ms) de aquisição basal antes da entrega do estímulo de campo para permitir medidas subsequentes de fluorescência de repouso. - Inicie um único ou um trem de potenciais de ação com um pulso quadrado de 0,5 ou 1 ms, 20 V. Minimize ao máximo o tempo total de aquisição para evitar o clareamento de sinais.
NOTA: Mesmo se o registro no centro da fibra, um sinal de fluorescência relacionado ao movimento pode ocorrer e pode ser confundido com o sinal fluorescente devido à mudança conformacional proteína-fluoróforo (Figura 5D). O sinal induzido pela contração deve ser retardado em relação ao tempo esperado de movimento de carga pós-estimulação37. - Para distinguir ainda mais o sinal decorrente dos movimentos de S4 daquele devido à contração da fibra, adicione 1 μL de N-benzil-p-tolueno sulfonamida 100 mM (BTS; concentração final de 50 μM) à solução de gravação para minimizar as respostas contráteis e repita o passo 6.4. Os sinais detectados pela segunda vez após a imobilização farmacológica da fibra correspondem ao movimento molecular da hélice marcada S4 (Figura 5D).
NOTA: Nenhum sinal deve ser detectado no controle EGFP-CaV1.1 sem cisteína projetada após supressão de movimento com BTS. - Usando as mesmas configurações, adquira um sinal semelhante em um local dentro da placa onde nenhuma fibra muscular ou detritos estão presentes para obter um valor de fluorescência de fundo.
- Importe os arquivos que contêm o curso de tempo da fluorescência bruta [Fr(t)] da fibra e da fluorescência de fundo [Fb(t)] para o software de análise de dados. Faça a média da coluna que contém Fb(t) para obter um valor Fb homogêneo. Subtrair Fb do Fr(t) para obter os valores absolutos de fluorescência [F(t)]. Suavize o sinal resultante com uma função de suavização, se necessário.
NOTA: Com este sistema de detecção e a frequência de aquisição, decidimos usar uma função de média adjacente com uma janela de 50 pontos para suavização. - Média dos valores basais de F(t) em um intervalo de tempo de 10 ms antes da estimulação para obter um valor de fluorescência de repouso (F0). Subtrair F0 do F(t) suavizado para obter a mudança absoluta na fluorescência [ΔF(t)]. Então, para expressar a mudança de fluorescência ao longo do tempo em relação à fluorescência de repouso (ΔF/F0), divida ΔF(t) por F0.
- Para avaliar a extensão do clareamento do sinal, defina dois pontos do sinal ΔF/F0 ao longo do tempo, antes e após a estimulação e longe do sinal fluorométrico. Ajuste uma função linear a esses dois pontos para obter um rastreamento de linha de base. Subtraia a linha de base para ΔF/F0 ao longo do tempo para corrigir o clareamento do sinal.
- Subtrair da coluna de tempo o atraso entre o início da aquisição e o sinal de realimentação da estimulação, para ter t = 0 correspondente ao início do estímulo elétrico.
NOTA: Para permitir comparações de sinal múltiplo, muitas vezes é necessário normalizar a amplitude do sinal. Diferentes abordagens podem ser usadas dependendo do objetivo do experimento. Na seção de resultados a seguir, estávamos interessados na cinética do sinal, então usamos um método simples que consiste em normalizar cada sinal pelo valor mínimo atingido (isto é, o pico de passagem negativo).
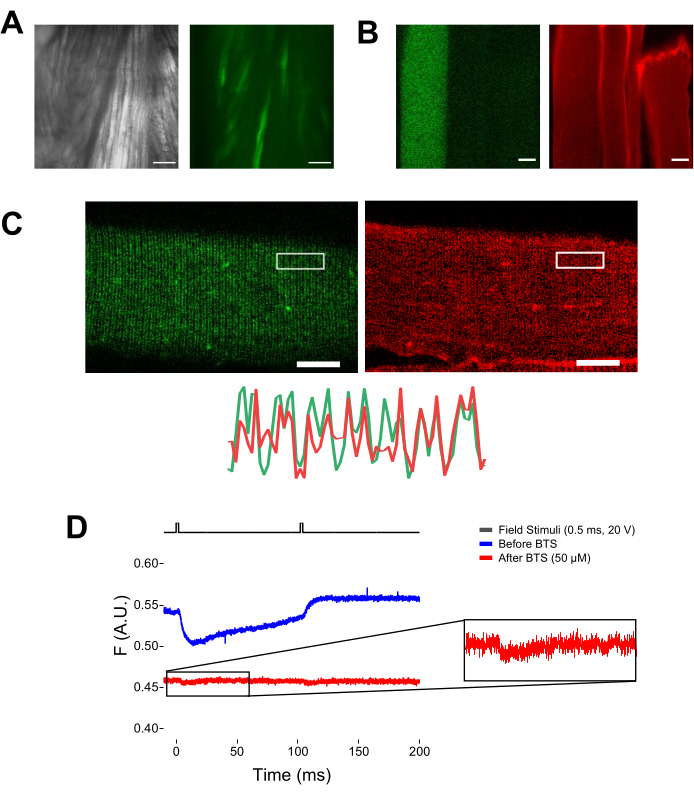
Figura 5: Imagem de fibras musculares expressando EGFP-CaV1.1-cys sem e com coloração MTS-5-TAMRA e registro fluorométrico bruto representativo. (A) Exemplos de imagens transmitidas (esquerda) e fluorescentes (direita) do músculo dissecado e não dissociado expressando um construto EGFP-CaV1.1 VSD-III. Barra de escala: 100 μm. (B) Imagem representativa de uma fibra muscular expressando um construto EGFP-CaV1.1 VSD-III antes (esquerda) e após (direita) coloração MTS-5-TAMRA. Cisteínas endógenas de fibras não transfectadas também são coradas pelo corante. Barra de escala: 30 μm. (C) Imagem confocal de uma construção EGFP-Ca V 1.1 VSD-III (esquerda) e coloração MTS-5-TAMRA (direita) mostram um padrão clássico de banda dupla característico da localização de CaV1.1 no sistema tubular transverso da fibra muscular (inferior). Barra de escala: 25 μm. (D) Registro fluorométrico representativo em resposta a dois estímulos e medido com fotodiodo antes (traço azul) e após (traço vermelho) da imobilização das fibras com N-benzil-p-tolueno sulfonamida (BTS). A linha preta superior indica o protocolo de despolarização das fibras via estimulação de campo externo. Clique aqui para ver uma versão maior desta figura.
Resultados
Quando potenciais de ação propagadores são acionados em resposta à estimulação de campo repetitivo, é possível rastrear o movimento específico do sensor de voltagem em resposta a uma frequência específica de despolarização. Como mostrado na Figura 6A, o movimento das hélices marcadas com VSD-II pode ser rastreado em resposta a cada uma das duas despolarizações sucessivas aplicadas a 10 Hz (ou seja, espaçadas por 100 ms). O clareamento do sinal pode ser corrigido subtraindo-s...
Discussão
Aqui, um protocolo passo-a-passo para conduzir FSDF em fibras musculares para o estudo dos movimentos individuais do sensor de voltagem a partir do canal CaV1.1 é descrito. Embora o número de etapas e a diversidade de abordagens combinadas nesta técnica possam parecer complexas, a maioria dessas técnicas é frequentemente usada rotineiramente em laboratórios de biofísicos/biólogos celulares. Assim, a aparente complexidade reside principalmente na combinação de todas as várias abordagens em uma única...
Divulgações
Os autores declaram a inexistência de conflitos de interesse.
Agradecimentos
Agradecemos ao Dr. J. Vergara (Universidade da Califórnia, Los Angeles) por compartilhar o plasmídeo selvagem EGFP-CaV1.1 (coelho). Agradecemos ao Yale Department of Physiology Electronics Laboratory e especialmente a Henrik Abildgaard pelo projeto e construção do fotodiodo com circuito track and hold. Este trabalho foi apoiado pelos subsídios do National Institutes of Health R01-AR075726 e R01-NS103777
Materiais
| Name | Company | Catalog Number | Comments |
| Hyaluronidase | SIGMA ALDRICH | H3884-50mg | |
| 0.5 mL Eppendorf tube | Millipore Sigma | EP022363719-500EA | |
| 1 mL syringe | Millipore Sigma | Z683531-100EA | tuberculine slip tip |
| 1/2” long 29-gauge sterile insulin needle and syringe | Becton Dikinson | 324702 | |
| 35 mm non coated plastic plate | Falcon, Corning | 353001 | |
| 60 mm non coated plastic plate | Falcon, Corning | 351007 | |
| Alcoholic whip | PDI | B60307 | |
| Alexa-533 cube LP | Chroma | 49907 | Ex: 530/30x; BS: 532; Em: 550lp |
| Arc lamp | Sutter Instrumets | LB-LS 672 | |
| Artificial tears cream | Akorn | NDC 59399-162-35 | |
| Borosilicate glass Pasteur pipet 5 3/4" | VWR | 14672-200 | |
| BTS (N-benzyl-p-toluene sulphonamide) | SIGMA ALDRICH | 203895 | |
| collagenase type I | SIGMA ALDRICH | C0130-1g | |
| Cotton tip | VWR | VWR-76048-960-BG | |
| Double electrode array (for electroporation) | BTX harvard apparatus | 45-0120 | 10mm 2 needle array tips |
| EGFP cube | Chroma | 39002AT | Ex: 480/30x; BS 505; Em: 535/40m |
| Electroporation apparatus device | BTX harvard apparatus | ECM 830 | |
| EPC10 | HEKA Elektronik GmbH (Harvard Bioscience) | 895000 | |
| FBS | Biotechne, R&D Systems | RND-S11150H | Fetal Bovine Serum - Premium, Heat Inactivated |
| glass coverslip 35 mm dish | MatTek Life Science | P35G-1.5-14-C | |
| Isoflurane | Fluriso (Isoflurane) Liquid for Inhalation | 502017-250ml | |
| Isothermal heating pad | Braintree scientific inc | 39DP | |
| Laminin | Thermo Fisher | INV-23017015 | Laminin Mouse Protein, Natural |
| Latex bulb | VWR | 82024-554 | |
| LED 530 nm | Sutter Instrumets | 5A-530 | |
| Low binding protein 0.2 μm sterile filter | Pall | FG4579 | acrodisk syringe filter 0.2um supor membrane low protein binding non pyrogenic |
| MEM | Invitrogen | INV-11380037 | |
| MTS-5-TAMRA | Biotium | 89410-784 | MTS-5-TAMRA |
| OriginPro Analysis Software | OriginLab Corporation | OriginPro 2022 (64-bit) SR1 | |
| Photodiode | Custom Made | NA | |
| PlanApo 60x oil 1.4 N.A/∞/0.17 | Olympus | BFPC2 | |
| Platinum wire 0.5 mm, 99.9 % metals basis | SIGMA | 267228-1G | To manufacyte field stimulation electrode |
| Pulse Generator | WPI | Pulsemaster A300 | |
| Shutter drive controller | Uniblitz | 100-2B | |
| Shuttter | Uniblitz | VS2582T0-100 | |
| S-MEM | Invitrogen | INV-11380037 | |
| Sterile bench pad | VWR | DSI-B1623 | |
| Sterile saline | SIGMA ALDRICH | S8776 | |
| Sylgard 184 Silicone Elastomer kit | Dow Corning | 1419447-1198 | |
| Vaporizer for Anesthesia | Parkland Scientific | V3000PK | |
| Voltage generator | Custom Made | NA |
Referências
- Catterall, W. A., Wisedchaisri, G., Zheng, N. The chemical basis for electrical signaling. Nature Chemical Biology. 13 (5), 455-463 (2017).
- Armstrong, C. M., Hille, B. Voltage-gated ion channels and electrical excitability. Neuron. 20 (3), 371-380 (1998).
- Hodgkin, A. L., Huxley, A. F. A quantitative description of membrane current and its application to conduction and excitation in nerve. The Journal of Physiology. 117 (4), 500-544 (1952).
- Armstrong, C. M., Bezanilla, F. Currents related to movement of the gating particles of the sodium channels. Nature. 242 (5398), 459-461 (1973).
- Schneider, M. F., Chandler, W. K. Voltage dependent charge movement of skeletal muscle: a possible step in excitation-contraction coupling. Nature. 242 (5395), 244-246 (1973).
- Bezanilla, F. Gating currents. The Journal of General Physiology. 150 (7), 911-932 (2018).
- Bezanilla, F. The voltage sensor in voltage-dependent ion channels. Physiological Reviews. 80 (2), 555-592 (2000).
- Mannuzzu, L. M., Moronne, M. M., Isacoff, E. Y. Direct physical measure of conformational rearrangement underlying potassium channel gating. Science. 271 (5246), 213-216 (1996).
- Akabas, M. H. Cysteine modification: probing channel structure, function and conformational change. Advances in Experimental Medicine and Biology. 869, 25-54 (2015).
- Priest, M., Bezanilla, F. Functional site-directed fluorometry. Advances in Experimental Medicine and Biology. 869, 55-76 (2015).
- Cha, A., Bezanilla, F. Characterizing voltage-dependent conformational changes in the Shaker K+ channel with fluorescence. Neuron. 19 (5), 1127-1140 (1997).
- Pantazis, A., Savalli, N., Sigg, D., Neely, A., Olcese, R. Functional heterogeneity of the four voltage sensors of a human L-type calcium channel. Proceedings of the National Academy of Sciences. 111 (51), 18381-18386 (2014).
- Savalli, N., Kondratiev, A., Toro, L., Olcese, R. Voltage-dependent conformational changes in human Ca(2+)- and voltage-activated K(+) channel, revealed by voltage-clamp fluorometry. Proceedings of the National Academy of Sciences. 103 (33), 12619-12624 (2006).
- Zheng, J., Zagotta, W. N. Gating rearrangements in cyclic nucleotide-gated channels revealed by patch-clamp fluorometry. Neuron. 28 (2), 369-374 (2000).
- Bannister, J. P. A., Chanda, B., Bezanilla, F., Papazian, D. M. Optical detection of rate-determining ion-modulated conformational changes of the ether-à-go-go K+ channel voltage sensor. Proceedings of the National Academy of Sciences. 102 (51), 18718-18723 (2005).
- Bruening-Wright, A., Elinder, F., Larsson, H. P. Kinetic relationship between the voltage sensor and the activation gate in spHCN channels. The Journal of General Physiology. 130 (1), 71-81 (2007).
- Osteen, J. D., et al. KCNE1 alters the voltage sensor movements necessary to open the KCNQ1 channel gate. Proceedings of the National Academy of Sciences. 107 (52), 22710-22715 (2010).
- Smith, P. L., Yellen, G. Fast and slow voltage sensor movements in HERG potassium channels. The Journal of General Physiology. 119 (3), 275-293 (2002).
- Gonzalez, C., Koch, H. P., Drum, B. M., Larsson, H. P. Strong cooperativity between subunits in voltage-gated proton channels. Nature Structural & Molecular Biology. 17 (1), 51-56 (2010).
- Gandhi, C. S., Olcese, R. The voltage-clamp fluorometry technique. Methods in Molecular Biology. 491, 213-231 (2008).
- Horne, A. J., Fedida, D. Use of voltage clamp fluorimetry in understanding potassium channel gating: a review of Shaker fluorescence data. Canadian Journal of Physiology and Pharmacology. 87 (6), 411-418 (2009).
- Zhu, W., Varga, Z., Silva, J. R. Molecular motions that shape the cardiac action potential: Insights from voltage clamp fluorometry. Progress in Biophysics and Molecular Biology. 120 (1-3), 3-17 (2016).
- Cowgill, J., Chanda, B. The contribution of voltage clamp fluorometry to the understanding of channel and transporter mechanisms. The Journal of General Physiology. 151 (10), 1163-1172 (2019).
- Catterall, W. A., Lenaeus, M. J., Gamal El-Din, T. M. Structure and pharmacology of voltage-gated sodium and calcium channels. Annual Review of Pharmacology and Toxicology. 60, 133-154 (2020).
- MacKinnon, R. Determination of the subunit stoichiometry of a voltage-activated potassium channel. Nature. 350 (6315), 232-235 (1991).
- Wu, J., et al. Structure of the voltage-gated calcium channel Ca(v)1.1 at 3.6 Å resolution. Nature. 537 (7619), 191-196 (2016).
- Capes, D. L., Goldschen-Ohm, M. P., Arcisio-Miranda, M., Bezanilla, F., Chanda, B. Domain IV voltage-sensor movement is both sufficient and rate limiting for fast inactivation in sodium channels. The Journal of General Physiology. 142 (2), 101-112 (2013).
- Cha, A., Ruben, P. C., George, A. L., Fujimoto, E., Bezanilla, F. Voltage sensors in domains III and IV, but not I and II, are immobilized by Na+ channel fast inactivation. Neuron. 22 (1), 73-87 (1999).
- Muroi, Y., Arcisio-Miranda, M., Chowdhury, S., Chanda, B. Molecular determinants of coupling between the domain III voltage sensor and pore of a sodium channel. Nature Structural & Molecular Biology. 17 (2), 230-237 (2010).
- Savalli, N., et al. The distinct role of the four voltage sensors of the skeletal CaV1.1 channel in voltage-dependent activation. The Journal of General Physiology. 153 (11), e202112915 (2021).
- Muller, C. S., et al. Quantitative proteomics of the Cav2 channel nano-environments in the mammalian brain. Proceedings of the National Academy of Sciences. 107 (34), 14950-14957 (2010).
- Perni, S., Lavorato, M., Beam, K. G. De novo reconstitution reveals the proteins required for skeletal muscle voltage-induced Ca2+ release. Proceedings of the National Academy of Sciences. 114 (52), 13822-13827 (2017).
- Beam, K. G., Horowicz, P. . Excitation-Contraction Coupling in Skeletal Muscle. , (2004).
- Schneider, M. F., Hernandez-Ochoa, E. O. . Muscle: Fundamental Biology and Mechanisms of Disease. , 811-822 (2012).
- Rios, E., Pizarro, G. Voltage sensor of excitation-contraction coupling in skeletal muscle. Physiological Reviews. 71 (3), 849-908 (1991).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage sensing mechanism in skeletal muscle excitation-contraction coupling: coming of age or midlife crisis. Skeletal Muscle. 8 (1), 22 (2018).
- Banks, Q., et al. Voltage sensor movements of CaV1.1 during an action potential in skeletal muscle fibers. Proceedings of the National Academy of Sciences. 118 (40), e2026116118 (2021).
- DiFranco, M., Quinonez, M., Capote, J., Vergara, J. DNA transfection of mammalian skeletal muscles using in vivo electroporation. Journal of Visualized Experiments. (32), e1520 (2009).
- Blunck, R., Starace, D. M., Correa, A. M., Bezanilla, F. Detecting rearrangements of shaker and NaChBac in real-time with fluorescence spectroscopy in patch-clamped mammalian cells. Biophysical Journal. 86 (6), 3966-3980 (2004).
- Liu, Y., Carroll, S. L., Klein, M. G., Schneider, M. F. Calcium transients and calcium homeostasis in adult mouse fast-twitch skeletal muscle fibers in culture. The American Journal of Physiology. 272 (6), C1919-C1927 (1997).
- Hernandez-Ochoa, E. O., Vanegas, C., Iyer, S. R., Lovering, R. M., Schneider, M. F. Alternating bipolar field stimulation identifies muscle fibers with defective excitability but maintained local Ca(2+) signals and contraction. Skeletal Muscle. 6, 6 (2016).
- Klein, M. G., Simon, B. J., Szucs, G., Schneider, M. F. Simultaneous recording of calcium transients in skeletal muscle using high- and low-affinity calcium indicators. Biophysical Journal. 53 (6), 971-988 (1988).
- Irving, M., Maylie, J., Sizto, N. L., Chandler, W. K. Intrinsic optical and passive electrical properties of cut frog twitch fibers. The Journal of General Physiology. 89 (1), 1-40 (1987).
- Hernandez-Ochoa, E. O., Schneider, M. F. Voltage clamp methods for the study of membrane currents and SR Ca(2+) release in adult skeletal muscle fibres. Progress in Biophysics and Molecular Biology. 108 (3), 98-118 (2012).
- Banks, Q., et al. Optical recording of action potential initiation and propagation in mouse skeletal muscle fibers. Biophysical Journal. 115 (11), 2127-2140 (2018).
- Bannister, R. A. Bridging the myoplasmic gap II: more recent advances in skeletal muscle excitation-contraction coupling. The Journal of Experimental Biology. 219, 175-182 (2016).
- Bannister, R. A., Beam, K. G. Ca(V)1.1: The atypical prototypical voltage-gated Ca2+ channel. Biochimica et Biophysica Acta. 1828 (7), 1587-1597 (2013).
- Beard, N. A., Wei, L., Dulhunty, A. F. Ca(2+) signaling in striated muscle: the elusive roles of triadin, junctin, and calsequestrin. European Biophysics Journal. 39 (1), 27-36 (2009).
- Polster, A., Perni, S., Bichraoui, H., Beam, K. G. Stac adaptor proteins regulate trafficking and function of muscle and neuronal L-type Ca2+ channels. Proceedings of the National Academy of Sciences. 112 (2), 602-606 (2015).
- Perni, S. The builders of the junction: roles of Junctophilin1 and Junctophilin2 in the assembly of the sarcoplasmic reticulum-plasma membrane junctions in striated muscle. Biomolecules. 12 (1), 109 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados