In vitro Modelo de Embarcação Humana Fetal On-chip para Estudo da Mecanobiologia do Desenvolvimento
Neste Artigo
Resumo
Descreve-se aqui um fluxo de trabalho simples para diferenciar células endoteliais de células-tronco pluripotentes humanas, seguido de um protocolo detalhado para sua estimulação mecânica. Isso permite o estudo da mecanobiologia do desenvolvimento das células endoteliais. Esta abordagem é compatível com ensaios a jusante de células vivas coletadas do chip de cultura após estimulação mecânica.
Resumo
O coração é o primeiro órgão a se estabelecer funcionalmente durante o desenvolvimento, iniciando assim a circulação sanguínea muito cedo na gestação. Além de transportar oxigênio e nutrientes para garantir o crescimento fetal, a circulação fetal controla muitos eventos cruciais do desenvolvimento que ocorrem dentro da camada endotelial através de pistas mecânicas. Sinais biomecânicos induzem alterações estruturais dos vasos sanguíneos, estabelecem especificação arteriovenosa e controlam o desenvolvimento de células-tronco hematopoéticas. A inacessibilidade dos tecidos em desenvolvimento limita a compreensão do papel da circulação no início do desenvolvimento humano; Portanto, modelos in vitro são ferramentas fundamentais para o estudo da mecanobiologia de vasos. Este trabalho descreve um protocolo para diferenciar células endoteliais de células-tronco pluripotentes induzidas por humanos e sua subsequente semeadura em um dispositivo fluídico para estudar sua resposta a pistas mecânicas. Esta abordagem permite o cultivo a longo prazo de células endoteliais sob estimulação mecânica seguida de recuperação das células endoteliais para caracterização fenotípica e funcional. O modelo in vitro aqui estabelecido será instrumental para elucidar os mecanismos moleculares intracelulares que transduzem a sinalização mediada por pistas mecânicas que, em última instância, orquestram o desenvolvimento dos vasos durante a vida fetal humana.
Introdução
Durante o desenvolvimento embrionário, o coração é o primeiro órgão a estabelecer a funcionalidade1, com contrações detectáveis desde o estágio mais precoce da formação do tubo endocárdico2. A circulação, juntamente com as pistas mecânicas mediadas pelo fluxo de sangue dentro do vaso, controla muitos aspectos cruciais do desenvolvimento inicial. Antes do estabelecimento da circulação fetal, a vasculatura é organizada em um plexo capilar primário; Com o funcionamento cardíaco, esse plexo se reorganiza em vasculatura venosa e arterial3. O papel das pistas mecânicas na especificação arteriovenosa é refletido pela expressão pan-endotelial de marcadores arteriais e venosos antes do início do fluxo sanguíneo4.
As forças hemodinâmicas não só controlam o desenvolvimento da própria vasculatura, mas também desempenham um papel fundamental no controle da formação de células sanguíneas. As células-tronco hematopoéticas e progenitoras (HSPCs) emergem de células endoteliais especializadas denominadas endotélio hemogênico 5,6,7,8, presentes em diferentes regiões anatômicas dos embriões exclusivamente na fase inicial do desenvolvimento. Modelos deficientes cardíacos, juntamente com modelos in vitro, têm demonstrado que pistas mecânicas instruem e aumentam a produção de HSPC a partir do endotélio hemogênico 9,10,11,12,13,14.
Demonstrou-se que diferentes tipos de dinâmica de fluxo controlam diferencialmente o ciclo celular15, sabidamente importantes tanto na especificação do endotélio hemogênico 16,17 quanto das células arteriais18. Em conjunto, pistas mecânicas são determinantes críticos da identidade e função celular durante o desenvolvimento. Novos dispositivos fluídicos in vitro nos permitem superar as limitações envolvidas com o estudo da mecanobiologia do desenvolvimento durante o desenvolvimento do sangue humano in vivo.
O objetivo geral do protocolo deste manuscrito é descrever, passo a passo, o pipeline experimental para estudar o efeito do estresse de cisalhamento em células endoteliais humanas derivadas in vitro de células-tronco pluripotentes induzidas humanas (hiPSCs). Este protocolo contém instruções detalhadas sobre a diferenciação de hiPSCs em células endoteliais e sua posterior semeadura em chips fluídicos para o protocolo de estimulação. Com isso, diferentes células endoteliais derivadas in vitro podem ser testadas quanto à sua capacidade de detectar a tensão de cisalhamento analisando sua orientação em resposta ao fluxo. Isso permitirá que outros laboratórios abordem questões sobre a resposta ao estresse de cisalhamento e suas consequências funcionais em diferentes identidades de células endoteliais.
Protocolo
NOTA: Todas as técnicas de cultura celular devem ser realizadas em condições estéreis em capela de fluxo laminar e as células devem ser incubadas a 37 °C em atmosfera umedecida com 5% de CO2. As instruções para toda a preparação de citocinas tanto para a manutenção (rhbFGF) quanto para o protocolo de diferenciação (rhBMP4, rhVEGF, rhbFGF, rhIL6, rhFLT3L, rhIGF1, rhIL11, rhSCF, rhEPO, rhTPO, rhIL3) estão na Tabela Suplementar S1.
1. Cultura de hiPSCs - descongelamento, manutenção e congelamento de células
- Preparação de meio de manutenção, fatores de crescimento e outros reagentes
- Preparar o meio de cultura adicionando todo o suplemento de meio livre de soro hESCs, 36 mL de albumina de soro bovino (BSA) a 25% e 1 mL de 55 mM de β-mercaptoetanol ao meio basal Dulbecco's Modified Eagle Medium/F12 (DMEM/F-12) (ver Tabela de Materiais).
- Ressuspender 1 mg de inibidor de Rho quinase (iRock) em 1 mL de DMSO, fazer alíquotas de 50 μL e armazená-las a -20 °C.
NOTA: Estas alíquotas podem ser mantidas a -20 °C durante 1 ano. Uma vez descongelados, podem ser mantidos a 4 °C por 1 semana. - Descongelar a solução de vitronectina (VTN-N) em gelo e alíquota de 60 μL por frasco para injetáveis antes de armazenar a -80 °C. Imediatamente antes de revestir as placas, diluir o estoque de 60 μL em 6 mL de solução salina tamponada com fosfato (DPBS) de Dulbecco; a concentração final de 5 μg/mL.
- descongelamento da linhagem celular hiPSC
NOTA: A linhagem de células-tronco pluripotentes humanas SFCi55 foi previamente derivada internamente e extensivamente utilizada para diferenciação em vários tipos celulares e diferentes linhagens embrionárias 19,20,21,22.- Revestir um poço de uma placa de 6 poços com 1 mL de solução de VTN-N por 1 h a 37 °C.
NOTA: Após a incubação, as placas revestidas podem ser armazenadas a 4 °C por até 1 semana. - Aspirar a solução de VTN-N com pipeta de aspiração e adicionar 1 mL de meio de cultura pré-aquecido suplementado com 20 ng/mL de rhbFGF (Tabela Suplementar S1).
- Descongelar rapidamente o frasco para injetáveis que contém as hiPSC em banho-maria e transferir a célula para 5 ml de meio de cultura pré-aquecido.
- Gire as células para baixo por 3 min a 300 × g à temperatura ambiente.
- Ressuspender o pellet celular em 0,5 mL de meio de cultura suplementado com 20 ng/mL de rhbFGF.
- Transfira as células para um poço revestido contendo já 1 mL de meio.
- Adicionar 5 μL de iRock nos poços contendo as células num total de 1,5 ml de meio.
- Cultive as células na incubadora, troque o meio diariamente durante a semana e alimente as células duas vezes, adicionando o dobro do volume normal de meio às células para garantir a alimentação no fim de semana.
NOTA: As células são cultivadas na presença de iRock apenas durante 24 horas.
- Revestir um poço de uma placa de 6 poços com 1 mL de solução de VTN-N por 1 h a 37 °C.
- Manutenção e passagem de hiPSCs
- Trocar o meio diariamente com meio de cultura fresco pré-aquecido suplementado com 20 ng/mL de rhbFGF.
- Passar pelas células quando elas atingirem aproximadamente 80% de confluência, geralmente duas vezes por semana.
- Para passar as células, revestir uma placa com VTN-N, conforme descrito anteriormente nos passos 1.2.1 e 1.2.2.
- Aspirar o meio dos poços com células e lavá-los com DPBS.
- Aspirar a DPBS e adicionar 1 mL de reagente de dissociação (ver Tabela de Materiais) e incubar por 1 min.
- Aspirar o reagente de dissociação e incubar por mais 3 min. Bata firmemente na placa 10 vezes de cada lado.
NOTA: A etapa de dissociação pode precisar de otimização específica do tipo de célula no tempo de incubação e no procedimento de toque. - Adicionar 1 mL de meio de cultura às células e, com uma pipeta de Pasteur, lavar uma vez com o meio para garantir que a maioria das colônias seja coletada.
- Adicione 150 μL da suspensão celular a cada poço para fornecer uma relação de passagem de 1 poço para 6.
NOTA: Imediatamente após o descongelamento de um novo frasco, é melhor passar as células em uma proporção mais baixa, como 1:1 ou 1:2 por uma ou duas passagens, para permitir que elas atinjam uma fase de crescimento constante antes de passar a uma proporção de 1:6. - Cultive as células na incubadora, troque o meio diariamente durante a semana e alimente as células uma vez no fim de semana.
- congelamento de linhagens celulares hiPSCs
NOTA: Congelar as células dentro de suas duas primeiras passagens após o descongelamento para garantir a manutenção de um lote constante de frascos congelados para iniciar a cultura. Congelar as células quando atingirem uma confluência de aproximadamente 80%.- Trocar o meio para meio de cultura fresco pré-aquecido suplementado com 20 ng/mL de rhbFGF e 5 μL de iRock e incubar por pelo menos 1 h.
- Desanexe as células conforme descrito nos passos 1.3.2.2-1.3.2.5.
- Coletar as células destacadas em um tubo de centrífuga de 15 mL contendo 5 mL de meio de cultura.
- Centrifugar durante 3 min a 300 × g à temperatura ambiente.
- Aspirar o sobrenadante e adicionar 1 ml de solução de criopreservação (ver Tabela de Materiais).
- Usando uma pipeta de Pasteur, pipete suavemente as células para cima e para baixo para misturá-las na solução de criopreservação.
Observação : evitar pipetagem excessiva, que pode resultar na dissociação dos clusters de células. - Divida a suspensão celular em dois frascos de criopreservação com 0,5 mL cada.
- Transfira os frascos para injetáveis de criopreservação para um recipiente de criopreservação pré-arrefecido a 4 °C.
- Transfira o recipiente com as células para um congelador de -80 °C durante 24 h antes de transferir os frascos para injetáveis para azoto líquido para armazenamento a longo prazo.
2. Diferenciação de hiPSCs em células endoteliais
- Preparação de meios de diferenciação, citocinas e fatores de crescimento
- Preparar meio de diferenciação livre de soro (SFD) de acordo com a Tabela 1. Use este meio do Dia 0 ao Dia 5 de diferenciação.
- Preparar meio sem soro para células CD34+ (SFM-34) adicionando 34 suplementos nutricionais e 5 mL de suplemento de L-glutamina ao meio basal de 34 SFM (ver Tabela de Materiais). Use este meio a partir do dia 6 de diferenciação.
- Ressuspender 1 mg de CHIR99021 em 716 μL de DMSO para obter uma solução de 3 mM. Incubar à temperatura ambiente até ressuspender totalmente; se necessário, aqueça rapidamente a 37 °C. Faça alíquotas de 20 μL e guarde-as a -20 °C por até 6 meses. Use imediatamente após o descongelamento e não congele novamente ou armazene.
- Ressuspender as citocinas de acordo com as instruções da Tabela Suplementar S1. Conservar todas as alíquotas de citocinas a -80 °C.
- Diferenciação de células endoteliais
OBS: Para cada dia de diferenciação, preparar 18 mL (3 mL meio/poço) de meio SFD pré-aquecido, de acordo com as misturas de citocinas descritas em Tabela 2.- Dia 0 - formação dos corpos embrionários (BEs)
- Preparar 18 mL de meio SFD com a citocina Mix 1 de acordo com a Tabela 2, para cada placa de 6 poços (3 mL/poço).
- Adicionar 2 ml de meio SFD pré-aquecido com a citocina Mix 1 em cada poço de uma placa de 6 poços repelente de células (ver Tabela de Materiais).
- Para formar EBs, siga as etapas descritas nas etapas 1.3.2.2-1.3.2.4.
NOTA: Certifique-se de que os hiPSCs sejam 70-80% confluentes para iniciar a diferenciação. - Adicionar 1 mL de meio SFD pré-aquecido com citocinas Mix 1 a cada poço de aglomerados celulares destacados.
- Use uma pipeta de Pasteur para transferir suavemente os aglomerados celulares para um único poço de poço repelente de células para a formação de EB na proporção de 1:1.
- Após a colocação da placa na incubadora, mova-a para frente e para trás, para a direita e para a esquerda, para dispersar os EBs uniformemente no poço.
- Dia 1 - mudança média para os EBs
NOTA: Esta etapa só é necessária se, no dia 1 de diferenciação, houver muitas células únicas em suspensão ao lado das EBs.- Preparar 18 mL de meio SFD com a citocina Mix 1 de acordo com a Tabela 2, para cada placa de 6 poços (3 mL/poço).
- Gire a placa com os EBs para movê-los para o centro e colete-os usando uma pipeta de Pasteur em um tubo centrífugo de 15 mL.
NOTA: Se os EBs parecerem agrupados como em cordas, separe-os pipetando-os para cima e para baixo com um P1000 antes de coletá-los no tubo centrífugo de 15 mL. - Aguarde 5-10 min para que os EBs se acomodem no fundo do tubo.
NOTA: Se os EBs forem muito pequenos, centrifuga-os por 5 min a 100 × g para ajudá-los a se acomodar. - Lave as placas repelentes de células com água estéril ou DPBS para remover quaisquer células ou detritos.
- Aspirar cuidadosa e lentamente o sobrenadante dos EBs sem deslocá-los.
- Adicionar 2 mL de SFD com Mix 1 de citocinas a cada poço das placas repelentes de células.
- Ressuspender as EBs usando 1 mL de meio SFD com Mix 1 citocinas para cada poço inicial - para uma placa de 6 poços, adicionar 6 mL de meio.
- Transfira os EBs para as placas repelentes de células em volume de 1 mL por poço, que já contém 2 mL de meio SFD.
- Após a colocação da placa na incubadora, mova-a para frente e para trás, para a direita e para a esquerda, para dispersar os EBs uniformemente no poço.
- Dia 2 - adição de CHIR99021
- Gire os EBs no centro da placa e adicione CHIR99021 conforme Tabela 2 na lateral do poço para evitar o contato direto com as células.
NOTA: Se o meio não foi alterado no Dia 1, substitua todo o meio em vez de adicionar CHIR sozinho. Preparar 18 mL de meio SFD com a Mistura 2 de acordo com a Tabela 2, para cada placa de 6 poços (3 mL/poço). - Após a colocação da placa na incubadora, mova-a para frente e para trás, para a direita e para a esquerda, para dispersar os EBs uniformemente no poço.
- Gire os EBs no centro da placa e adicione CHIR99021 conforme Tabela 2 na lateral do poço para evitar o contato direto com as células.
- Dia 3 - mudança do meio para as EBs e adição de citocinas Mix 3
- Preparar 18 mL de meio SFD com citocinas Mix 3 de acordo com a Tabela 2, para cada placa de 6 poços (3 mL/poço).
- Recolher os EB conforme descrito nos passos 2.2.2.2-2.2.2.4.
- Adicionar 2 mL pré-aquecidos de meio SFD com citocinas Mix 3 às placas repelentes de células.
- Aspirar cuidadosamente o sobrenadante dos EBs. Adicionar 1 mL/poço de SFD com Mix 3 citocinas.
- Distribuir os EBs entre os poços conforme descrito nas etapas 2.2.2.8-2.2.2.9.
- Dia 6 - troca de meio para SFM-34 e adição de citocinas Mix 4
- Preparar 18 mL de meio SFD com citocinas Mix 4 de acordo com a Tabela 2, para cada placa de 6 poços (3 mL/poço).
- Recolher os EB conforme descrito nos passos 2.2.2.2-2.2.2.4.
- Adicionar 2 mL de meio SFM-34 pré-aquecido com Mix 4 citocinas às placas repelentes de células.
- Aspirar cuidadosamente o sobrenadante dos EBs. Adicionar 1 mL/poço de SFM-34 com citocinas Mix 4.
- Distribuir os EBs entre os poços conforme descrito nas etapas 2.2.2.8-2.2.2.9.
- Dia 0 - formação dos corpos embrionários (BEs)
3. Isolamento de células CD34+ e semeadura no chip
NOTA: As células CD34+ são isoladas através de uma abordagem de isolamento positivo com um kit de microesferas CD34 (ver Tabela de Materiais), que contém microesferas CD34 conjugadas a anticorpos monoclonais de ratinho anti-anticorpos CD34 humanos e reagente de bloqueio FcR (IgG humana). É importante validar a eficiência do isolamento da coluna corando as células antes e após o isolamento para análise por citometria de fluxo, Abaixo é indicado quando as células precisam ser levadas para esta análise.
- Preparar materiais e reagentes.
- Preparar o tampão de lavagem adicionando 5 mL de solução de BSA a 5% e 200 μL de EDTA 0,5 M a 45 mL de DPBS para obter PBS + BSA 0,5% + EDTA 2 mM. Prepare fresco para cada isolamento, filtre-esterilize e mantenha refrigerado até o uso.
- Revestir cavacos fluídicos com solução de laminina preparada diluindo a rhLaminin 521 1:50 em DPBS Ca 2+ Mg2+. Revestir cada cavaco com o volume adequado para o cavaco em uso e incubar na incubadora por 2 h antes da semeadura.
NOTA: Outras matrizes podem ser empregadas para o revestimento e devem ser testadas para o tipo de célula/experimento específico. - Preparar o meio SFM-34 da Mistura 4 suplementando 18 mL do meio SFM-34 com as citocinas da Mistura 4 de acordo com a Tabela 2 e colocar a mistura em um tubo de 50 mL na incubadora com a tampa levemente desaparafusada para facilitar as trocas gasosas.
- Coloque os conjuntos de perfusão selecionados e qualquer outra tubulação a ser usada na incubadora para desgaseificação.
- Dia 8 - dissociação das EBs e isolamento de CD34+
- Recolher os EB conforme descrito nos passos 2.2.2.2-2.2.2.5.
- Adicionar 1 mL de reagente de dissociação celular por poço inicial de EBs coletados (se 6 poços foram coletados, adicionar 6 mL).
- Transferir de volta 1 mL da suspensão de EB no reagente de dissociação celular para cada poço da placa repelente de células.
- Incubar por 10 min na incubadora.
- Pipetar suavemente os EBs para cima e para baixo contra o poço com um P1000, não mais do que 10 vezes.
- Repita as etapas 3.2.4-3.2.5.para um total de 3x.
NOTA: Se os EBs forem difíceis de dissociar, repita as etapas acima 4x no total. - Adicionar 5 mL de tampão de lavagem para cada poço de EBs dissociados.
- Recolher as células num tubo de centrífuga de 50 ml, passando-as através de um filtro de 40 μm. Tome 10 μL da suspensão celular para contar as células.
NOTA: Para testar a eficiência do isolamento, transfira 105 células/tubo para dois tubos diferentes (controle não corado e amostra de teste pré-contaminada) que serão usados posteriormente para citometria de fluxo (conforme descrito nas etapas 4.3.9-4.3.13). Para uma placa de 6 poços, ~106 células devem ser coletadas após a filtração. - Gire as células para baixo por 10 min a 300 × g.
- Ressuspenda as células em 300 μL de tampão de lavagem, pipetando suavemente algumas vezes para se certificar de que não há aglomerações. Continue seguindo o protocolo do fabricante (consulte a Tabela de Materiais).
- Semeadura de células CD34+ em chips fluídicos
OBS: O chip fluídico utilizado no protocolo tem altura do canal de 0,6 mm e comprimento de 50 mm, para uma área total de crescimento de 2,5cm2 (Figura Suplementar S1). Este tipo de cavaco é semeado com um volume total de suspensão celular de 150 μL. Diferentes chips podem ser usados, e o volume de semeadura e a densidade celular devem ser adaptados de acordo com a área de crescimento. Otimização adicional pode ser necessária dependendo da linhagem celular usada e seu crescimento.- Ressuspender as células CD34+ isoladas em 300 μL de meio SFM-34 pré-aquecido com citocinas Mix 4.
- Tome 10 μL da suspensão celular e conte as células.
- Ressuspender 2,5 × 105 células em um volume final de 150 μL suplementado SFM-34; adicionar 0,5 μL de iRock.
NOTA: Para testar a eficiência do isolamento, transfira 105 células/tubo para um tubo (amostra de teste pós-triada) que será usado posteriormente para citometria de fluxo (conforme descrito nas etapas 4.3.9-4.3.13). - Aspirar lentamente a laminina dos cavacos fluídicos colocando a ponta de um P200 dentro do reservatório na borda do canal.
NOTA: Se o líquido for difícil de coletar, levante lentamente um lado do cavaco para ajudar o líquido a se mover para o reservatório oposto. - Adicione a suspensão da célula firmemente no canal para garantir que nenhuma bolha seja formada.
NOTA: Execute as etapas 3.3.4-3.3.5 de forma rápida, mas suave, para evitar o ressecamento da laminina e a formação de bolhas nos canais do chip. Se bolhas forem formadas, levante um lado do chip e toque suavemente na lâmina para mobilizar as bolhas; Quando chegarem ao reservatório, subirão para a interface aérea e não poderão entrar no canal. - Transfira o chip para a incubadora e deixe-os durante a noite para que as células fiquem completamente presas ao canal e pareçam alongadas.
- Quando as células estiverem totalmente aderidas, aspirar o meio como na etapa 3.3.4 e substituí-lo por 200 μL de SFM-34 suplementado com citocinas.
- A partir de agora, substitua o meio diariamente até que as células atinjam 90%-100% de confluência.
4. Aplicação de fluxo contínuo às células endoteliais - Aorta-on-a-chip
- Preparar materiais e reagentes.
- Preparar o meio SFM-34 da Mistura 4 suplementando 18 mL do meio SFM-34 com as citocinas da Mistura 4 de acordo com a Tabela 2 e colocá-la em um tubo de 50 mL na incubadora com a tampa levemente desaparafusada para facilitar as trocas gasosas.
- Coloque os conjuntos de perfusão selecionados e qualquer tubulação a ser usada para a instalação fluídica na incubadora para desgaseificação.
- Montagem do sistema fluídico
- Instale o conjunto de perfusão na unidade de acordo com o protocolo do fabricante.
NOTA: Lembre-se de usar grampos no sistema. Se forem usadas braçadeiras deslizantes para esta etapa, elas precisam ser deslizadas na tubulação antes de se conectarem ao chip. - Anexe um novo chip fluídico e adicione o meio SFM-34 suplementado com citocinas, certificando-se de preencher ambos os reservatórios em condições estéreis na coifa.
- Execute o programa de remoção de bolhas e a etapa de calibração.
- Retirar a unidade fluídica com o conjunto conectado da incubadora e transferi-la para a coifa; Pegue também os chips contendo as células da incubadora.
- Aperte a tubulação em ambos os lados do chip de teste.
- Remova a tubulação do chip de teste.
NOTA: Verifique se não há bolhas no conector Luer no final da tubulação. Se as bolhas estiverem visíveis, aspira-as cuidadosamente usando uma pipeta P200 e, se necessário, adicione mais meio para garantir que o conector esteja preenchido com meio. - Conecte o chip que contém as células com a tubulação.
- Retire ou abra as abraçadeiras.
- Transfira o sistema para a incubadora e conecte a bomba de ar à unidade fluídica.
- Iniciar o programa pré-selecionado utilizando o software dedicado à bomba (Figura Suplementar S2) com o aumento gradual da tensão de cisalhamento descrito na Tabela 3.
NOTA: Dependendo do experimento específico necessário, o programa de estimulação pode precisar de otimização. Descreve-se aqui um aumento gradual da tensão de cisalhamento levando ao valor final de 5 dyn/cm2, que mimetiza a tensão de cisalhamento calculada para ser experimentada pela parede da aorta dorsal no início da circulação fetal9. Independentemente da tensão de cisalhamento final que será empregada, é necessário aumentar gradualmente ao longo do tempo para permitir que as células se adaptem à força sem fazer com que as células se desprendam do chip. Se o protocolo de estimulação selecionado for superior a 3 dias, as citocinas devem ser complementadas no sistema adicionando 1 mL de SFM-34 contendo as citocinas Mix 4 que normalmente seriam adicionadas a 18 mL. Para fazer isso, o programa da bomba é rapidamente pausado e 500 μL de meio suplementado é adicionado a cada uma das duas seringas no conjunto fluídico.
- Instale o conjunto de perfusão na unidade de acordo com o protocolo do fabricante.
- Coleta de células para análise
- Pré-aqueça o tampão de dissociação em banho-maria.
- Retire a unidade fluídica da incubadora e mova-a para o capô.
- Aperte a tubulação flanqueando o cavaco em ambos os lados e remova a tubulação dos reservatórios no chip.
- Retire suavemente o meio do chip e substitua-o por DPBS Ca 2+ Mg2+ para lavar as células.
NOTA: Esta etapa de lavagem com PBS pode ser ignorada se as células começarem a se desprender. - Adicionar suavemente 150 μL de tampão de dissociação e incubar durante 3 minutos a 37 °C.
OBS: Verifique ao microscópio se as células são unilaterais e destacadas; caso contrário, incube por mais 2 min. É essencial que as células sejam completamente descoladas do canal antes de aspirar o meio, pois o chip não permite auxiliar o desprendimento celular por pipetagem. Outras soluções podem ser empregadas para desprender as células, como tripsina ou tampões à base de EDTA. - Coletar o tampão de dissociação contendo as células de um reservatório e transferir para um tubo centrífugo de 15mL e lavar o canal uma vez com DPBS para coletar todas as células destacadas.
- Adicionar 1 ml de tampão de lavagem ao tubo de 15 ml com as células e tomar 10 μL para contar as células.
- Divida a suspensão celular em tubos de citometria de fluxo para ter 10a 5 células por tubo de ensaio.
- Gire os tubos por 5 min a 300 × g.
- Preparar a solução corante para ter 50 μL para cada tubo de ensaio a manchar. Adicione o CD34 PerCP-efluor710 ou CD34-PE na diluição de 1:100 e 1:200, respectivamente.
- Ressuspender as células em 50 μL de solução corante e incubar por 30 min a 4 °C.
- Lave as células adicionando 2 mL de tampão de lavagem e gire por 5 min a 300 × g.
- Ressuspender os pellets em 100 μL de solução corante e adquirir os dados usando um citômetro de fluxo.
NOTA: As células também podem ser lisadas diretamente no chip para extração de RNA usando 150 μL de tampão de lise de RNA ou fixadas para aquisição de imagens usando paraformaldeído a 4% em DPBS por 10 min à temperatura ambiente.
- Análise da orientação da célula
- Analise as imagens para quantificar as mudanças na orientação celular usando FIJI23 (Figura Suplementar S3).
- Abra o gerenciador de Região de Interesse (ROI) no Analyze | Ferramentas | Menu do gerenciador de ROI .
- Desenhe os contornos da célula manualmente usando a ferramenta de seleção de polígonos e adicione-os ao gerenciador de ROI clicando em Adicionar ou usando o atalho CTRL+T .
- Meça a orientação de cada ROI escolhendo a medida de elipse Ajustar no Analisar | Definir menu Medidas .
- Aplique a medição a todos os ROIs através do Mais... Comando multimedida no gerenciador de ROI.
NOTA: Esta etapa ajustará uma elipse a cada ROI e gerará uma tabela contendo o comprimento dos eixos de elipse maior e menor, bem como o ângulo. - Exporte a tabela para um arquivo CSV a ser importado para outro software para plotagem.
NOTA: O script usado para as parcelas está disponível em https://gist.github.com/nicolaromano/708b3231d730ee7f70763a7cf885
0ddc.
- Analise as imagens para quantificar as mudanças na orientação celular usando FIJI23 (Figura Suplementar S3).
Resultados Representativos
Descrevemos aqui um protocolo de diferenciação e mecanoestimulação de células endoteliais derivadas de hiPSCs que permite o estudo de sua resposta a pistas mecânicas (Figura 1). Esse protocolo resulta na produção de células endoteliais funcionalmente mecanossensíveis. Fornecemos aqui resultados representativos e descrevemos o fenótipo esperado para avaliar como as células respondem à estimulação de citocinas durante a diferenciação.
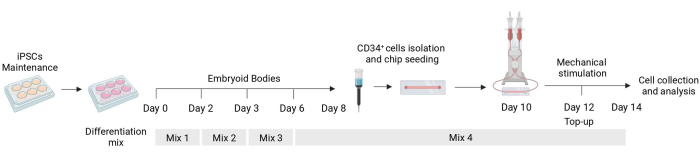
Figura 1: Esquema do protocolo de diferenciação e estimulação mecânica. Esquema do protocolo de diferenciação mostrando o tempo das diferentes misturas de citocinas, o isolamento celular CD34+ , semeadura fluídica de chips e análise final das células estimuladas mecanicamente. Clique aqui para ver uma versão maior desta figura.
Cultura de hiPSCs
É importante iniciar o protocolo a partir de hiPSCs que estão crescendo corretamente em condições de auto-renovação. Um bom indício da qualidade da cultura é a velocidade de seu crescimento. Após o descongelamento, as células podem precisar de 2-3 semanas para atingir a fase correta de crescimento que garantirá uma boa diferenciação. Quando as células podem ser passadas duas vezes por semana na proporção de 1:6 atingindo confluência quase total, este é o tempo em que elas estão prontas para serem diferenciadas no mesmo dia em que precisam ser passadas.
Diferenciação de hiPSCs em células endoteliais
A primeira etapa da diferenciação, que consiste na formação de corpos embrionários (EBs), é dependente de linhagem celular e pode necessitar de alguma otimização para a linhagem celular específica em uso. A dissociação descrita nas etapas do protocolo 1.3.2.2-1.3.2.4 pode ser modificada reduzindo ou estendendo a incubação com o reagente de dissociação e a subsequente dissociação com a pipeta de Pasteur. Além disso, outros reagentes de dissociação podem ser usados para esta etapa, além da dissociação física das colônias com uma ferramenta de corte ou uma ponta de pipeta P100. EBs de boa qualidade mostram uma borda definida no dia 2 da diferenciação e parecem claras e brilhantes quando observadas ao microscópio; áreas mais escuras podem indicar morte celular dentro das EBs (Figura 2).
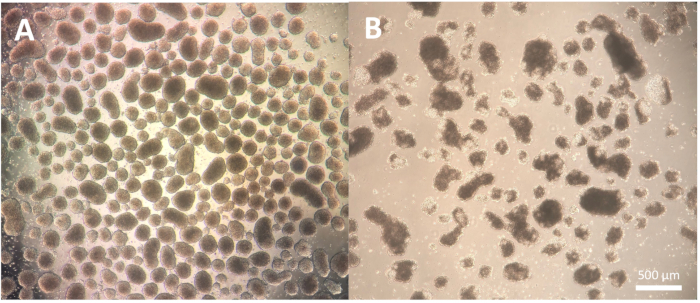
Figura 2: Morfologia dos corpos embrionários. (A) Corpos embrionários do Dia 2 mostrando bordas externas bem definidas e tamanho consistente. (B) Dia 2 corpos embrionários de má qualidade apresentando extensa morte celular levando à desagregação da estrutura. Barra de escala = 500 μm. Clique aqui para ver uma versão maior desta figura.
No dia 2, a adição de CHIR99021 às EBs inibe a proteína GSK-3, resultando na ativação da via Wnt. Diferentes linhagens celulares apresentam diferentes respostas ao tratamento com CIR, e isso deve ser testado quantificando-se o número de células CD34+ obtidas no 8º dia usando diferentes concentrações (Figura 3).
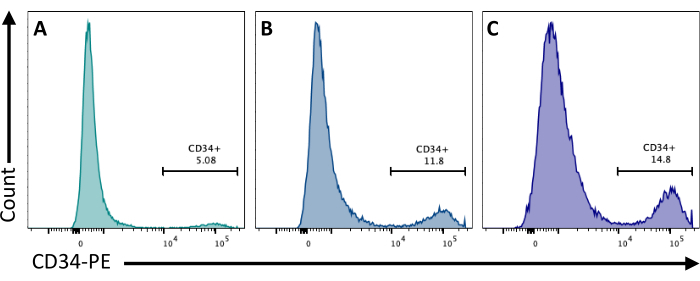
Figura 3: Diferenciação das células endoteliais com diferentes tratamentos com CHI. Comprometimento das células endoteliais quantificado por citometria de fluxo no dia 8 de diferenciação pela expressão da membrana CD34, após tratamento com CHIR no dia 2 em (A) 3 μM, (B) 5 μM e (C) 7 μM. Os dados de citometria de fluxo foram obtidos usando citômetros de cinco laser e software dedicado (ver Tabela de Materiais). Clique aqui para ver uma versão maior desta figura.
Isolamento de células CD34+
É importante validar que o enriquecimento de CD34+ usando as esferas magnéticas fornece pelo menos 80% de CD34+ após a eluição da coluna. Para garantir pureza suficiente, uma alíquota de células obtida a partir do isolamento magnético pode ser analisada por citometria de fluxo, certificando-se de usar um clone de anticorpos diferente daquele usado para o enriquecimento magnético. Neste caso, o clone 4H11 foi utilizado e ~85% de pureza foi obtida após o enriquecimento (Figura 4).
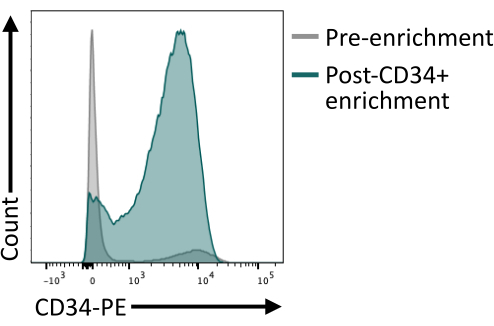
Figura 4: Expressão de CD34 na membrana antes e após o enriquecimento por classificação magnética. No 8º dia, corpos embrionários dissociados (cinza) e células após enriquecimento magnético (verde) foram corados para expressão de CD34 e analisados por citometria de fluxo, mostrando sucesso no enriquecimento pós-triagem. Os dados de citometria de fluxo foram obtidos utilizando-se citômetros cinco laser e software dedicado (ver Tabela de Materiais). Clique aqui para ver uma versão maior desta figura.
Semeando células no canal fluídico
Ao semear as células no canal fluídico, é crucial rastrear a adesão e proliferação das células endoteliais. Após a semeadura, as células levam ~5 h para aderir totalmente ao canal (Figura 5A). Uma solução alternativa de revestimento também pode ser testada para melhorar a aderência nesta fase. Para confirmar que as células testadas são mecanossensíveis e, portanto, capazes de responder à estimulação mecânica, a orientação celular pode ser testada ao longo do tempo. As células antes da estimulação apresentam orientação aleatória (Figura 5A e Figura 5C) e reorientam-se paralelamente à direção do fluxo (Figura 5B,C). O protocolo aqui descrito permite a coleta das células do canal para realizar análises a jusante, por exemplo, citometria de fluxo, para o estudo de seu imunofenótipo de membrana, fornecendo a identidade endotelial das células estimuladas (Figura 5D,E).
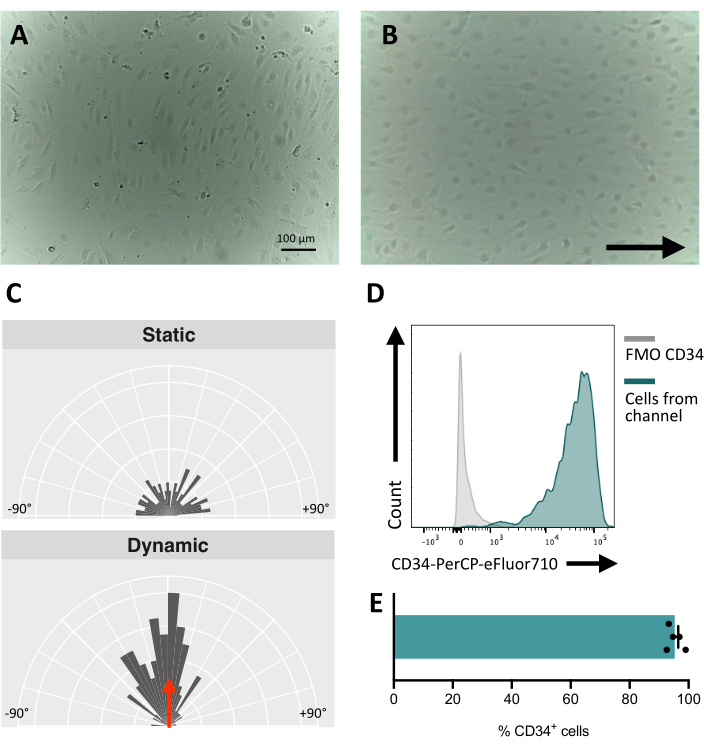
Figura 5: Mecanorresponsividade das células endoteliais derivadas de hiPSCs . (A) Camada confluente de células CD34+ isoladas 48 h após a semeadura. (B) Camada reorientada de células endoteliais 3 dias sob cultura dinâmica. (C) Análise da orientação das células endoteliais após 5 dias de cultura dinâmica. (D) Perfil de expressão de CD34 de células cultivadas sob fluxo por 5 dias. (E) Porcentagem de células CD34+ da população celular recuperada do canal fluídico. As imagens foram obtidas utilizando-se microscópio invertido em incubadora; os dados de citometria de fluxo foram obtidos utilizando-se citômetros cinco laser e software dedicado (ver Tabela de Materiais). Barras de escala = 100 μm (A,B). Clique aqui para ver uma versão maior desta figura.
| Reagentes | Concentração de estoques | Volume adicionado | Concentração final |
| Meio Dulbecco Modificado de Iscove (IMDM) | - | 333 mL | - |
| Ham's F-12 Mistura de nutrientes (F-12) | - | 167 mL | - |
| Suplemento N-2 (100x) | 100 x | 5 mL | 1x |
| Suplemento B-27 (50x) | 50 x | 10 mL | 1x |
| Ácido ascórbico | 10 mg/mL | 1,25 mL | 25 μg/mL |
| α-Monotioglicerol (MTG) | 11.5 milh | 19,5 μL | 448,5 μM |
| Albumina sérica humana | 100 mg/mL | 2,5 mL | 0,5 mg/mL |
| Holo-Transferrina | 100 mg/mL | 0,75 mL | 150 μg/mL |
Tabela 1: Composição e receita de 500 mL de meio de Diferenciação Sem Soro (SFD).
| Dias de diferenciação | Mistura de Citocinas | Citocinas | Concentração final |
| Dia 0 - 2 | Mistura 1 | BMP4 | 20 ng/mL |
| Dia 2 | Mistura 2 | CHIR99021 | 7 μM |
| A partir do dia 3 | Mistura 3 e 4 | VEGF | 15 ng/mL |
| bFGF | 5 ng/mL | ||
| A partir do dia 6 | Mistura 4 | IL6 | 10 ng/mL |
| FLT3L | 10 ng/mL | ||
| IGF1 | 25 ng/mL | ||
| IL11 | 5 ng/mL | ||
| CCAH | 50 ng/mL | ||
| EPO | 3 U/mL | ||
| TPO | 30 ng/mL | ||
| IL3 | 30 ng/mL |
Tabela 2: Misturas de citocinas utilizadas para diferenciação das células endoteliais, dias em que são adicionadas ao meio SFD e concentração final.
| Tensão de cisalhamento (dyn/cm2) | Tempo (h) |
| 0.5 | 1 |
| 1 | 1 |
| 1.5 | 1 |
| 2 | 1 |
| 2.5 | 1 |
| 3 | 1 |
| 3.5 | 1 |
| 4 | 1 |
| 4.5 | 1 |
| 5 | Até o final do experimento |
Tabela 3: Valores das tensões de cisalhamento para a cultura dinâmica e duração de sua aplicação.
Figura Suplementar S1: Geometria e dimensões do cavaco e da tubulação utilizados para este protocolo. Clique aqui para baixar este arquivo.
Figura Suplementar S2: Guia passo a passo para o software que controla a bomba de ar com uma descrição de cada passo. Clique aqui para baixar este arquivo.
Figura Suplementar S3: Guia para a análise de orientação usando FIJI mostrando o desenho da forma da célula, ajuste elíptico e medição final. Clique aqui para baixar este arquivo.
Tabela Suplementar S1: Tamanho da unidade, volume de ressuspensão e concentrações de estoque para citocinas utilizadas no protocolo de diferenciação. Clique aqui para baixar este arquivo.
Discussão
O protocolo que descrevemos aqui permite a geração de células endoteliais mecanossensíveis a partir de células-tronco pluripotentes humanas e o estudo de sua resposta à estimulação mecânica mediada por tensão de cisalhamento controlada. Este protocolo é inteiramente baseado em citocinas e totalmente compatível com reagentes GMP para potencial tradução na produção de células para terapia celular.
A derivação de hiPSCs fornece aos cientistas um modelo instrumental para os estágios iniciais do desenvolvimento embrionário que permite o estudo de processos que de outra forma são difíceis de estudar in vivo24. De fato, os tecidos embrionários humanos disponíveis para pesquisa são coletados de embriões sem circulação, e isso pode ter um impacto significativo na assinatura molecular controlada por pistas mecânicas. A abordagem descrita aqui permite imagens ao vivo e estudo em tempo real da resposta celular à tensão de cisalhamento. A combinação de hiPSCs com fluídicas fornece um modelo de estudo que supera a disponibilidade limitada e a inacessibilidade dos tecidos fetais em desenvolvimento quando o início da circulação remodela e controla o estabelecimento do sistema cardiovascular e sanguíneo 3,9,10,25.
Uma limitação do protocolo é que as células endoteliais derivadas desse protocolo podem não refletir as várias identidades das diferentes células endoteliais presentes nos tecidos em desenvolvimento. Para superar essa limitação, uma combinação específica de citocinas pode ser necessária durante o processo de diferenciação que precede a estimulação fluídica para obter a identidade desejada ou fenótipo tecido-específico26. O isolamento de subpopulações endoteliais pode ser obtido por meio de um imunofenótipo mais refinado durante a etapa de isolamento. Este protocolo isola células endoteliais com base apenas na expressão de CD34, permitindo assim o isolamento em coluna em vez da classificação celular ativada por fluorescência (FACS); Isso reduz a morte celular e o risco de contaminação. Além disso, este protocolo é projetado especificamente para estudar o papel da tensão de cisalhamento mediada pelo fluxo laminar. Abordagens fluídicas alternativas deverão ser empregadas para estudar o efeito de outras pistas mecânicas, como estiramento ou compressão, ou outros tipos de fluxo, como fluxo perturbado ou perturbado.
Demonstramos anteriormente que as células endoteliais derivadas da iPSC mimetizam identidades celulares arteriovenosas heterogêneas27 semelhantes às observadas na aorta dorsal fetal28,29,30. Isto é de particular importância no contexto do desenvolvimento dos vasos e especificação celular, conhecidos por serem controlados pela circulação sanguínea. Estudos em diferentes modelos mostraram que a falta de circulação resulta em alteração na especificação arteriovenosa11,14,31. Os mecanismos que conectam pistas mecânicas com a especificação de células ainda são desconhecidos e o pipeline descrito aqui permite estudos funcionais refinados que não puderam ser testados in vivo.
Esse pipeline descreve a produção e a estimulação de células endoteliais derivadas de hiPSCs utilizando canais fluídicos comercialmente disponíveis, evitando a necessidade de moldagem dos dispositivos como para os dispositivos de polidimetilsiloxano (PDMS) amplamente utilizados12. Além disso, o uso de chips PDMS torna a coleta das células estimuladas particularmente desafiadora, enquanto com este protocolo, as células podem ser facilmente recuperadas do canal. Isso melhora significativamente o poder analítico, permitindo análises subsequentes, como análises proteômicas e transcriptômicas, citometria de fluxo e ensaios funcionais, que podem precisar de cultura adicional ou ensaios in vivo .
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Este trabalho foi apoiado pelo Research Advanced Grant 2021 da Associação Europeia de Hematologia, pelo Global Research Award 2021 da Sociedade Americana de Hematologia e pelo Fundo de Apoio à Estratégia Interna ISSF3 financiado pelo Welcome Trust e pela Universidade de Edimburgo. Agradecemos a Fiona Rossi, do Centro de Citometria de Fluxo, pelo apoio na análise por citometria de fluxo. Para fins de acesso aberto, o autor aplicou uma licença Creative Commons Attribution (CC BY) a qualquer versão do Manuscrito Aceito pelo Autor decorrente desta submissão.
Materiais
| Name | Company | Catalog Number | Comments |
| 0.6 Luer uncoated slide | ibidi | IB-80186 | |
| 25% BSA | Life Technologies | A10008-01 | |
| 6-well plates | Greiner Bio-one | 657160 | |
| Accutase | Life Technologies | A1110501 | Cited as Dissociation reagent |
| Ascorbic acid | Merck | A4544-100G | |
| Aspiration pipette | Sardtedt | 86.1252.011 | |
| B27 supplement | Life Technologies | 17504044 | Cited as Neuronal cell culture supplement (50x) |
| BD FACS DIVA | BD Biosciences | Version 8.0.1 | Cited as flow cytometry software |
| BD LSR Fortessa 5 Laser | BD Biosciences | ||
| bFGF | Life Technologies | PHG0021 | |
| CD34 Microbead kit | Miltenyil Biotec | 30-046-702 | |
| CD34 PE clone 4H11 | Invitrogen | 12-0349-42 | |
| CD34 PerCP-eFluor 710 clone 4H11 | Invitrogen | 44-0349-42 | |
| Cellstar cell-repellent surface 6-well plates | Greiner Bio-one | 657970 | Cited as cell-repellent plate |
| CHIR99021 | Cayman Chemicals | 13122-1mg-CAY | |
| Cryostor CS10 cell cryopreservation | Merck | C2874-100ML | Cited as Cryopreservation solution |
| Dimethyl Sulfoxide | VWR | 200-664-3 | Cited as DMSO |
| DMEM/F-12 | Life Technologies | 10565-018 | |
| DPB Ca2+ Mg2+ | Life Technologies | 14080055 | |
| DPBS | Life Technologies | 14200075 | |
| EASY Strainer 40 μm | Greiner Bio-one | 542040 | |
| EDTA | Life technologies | 15575020 | |
| FcR Blocking Reagent | Miltenyil Biotec | 130-059-901 | |
| Fiji | Version 1.53c | ||
| Flow Jo | Version 10.7.1 | Cited as flow cytometry sanalysis oftware | |
| FLT3L | Peprotech | 300-19-10uG | |
| Fluidic unit | ibidi | 10903 | |
| GlutaMax | Life Technologies | 35050038 | Cited as L-glutamine supplement |
| Ham F-12 | Life Technologies | 11765054 | |
| Holo-transferrin | Merk | T0665-500MG | |
| Human Serum Albumin | Fujifilm UK LTD | 9988 | |
| Ibidi Pump system | ibidi | 10902 | Cited as Pump system |
| IMDM | Life Technologies | 12440053 | |
| Inverted microscope | ioLight/Thisle Scientific | IOL-IO-INVERT | Cited as inverted in-incubator microscope |
| Lyophilised BSA | Merck | A2153-100G | |
| MiniMACS Separator | Miltenyil Biotec | 130-042-102 | Cited as Magnetic separator |
| MS Columns | Miltenyil Biotec | 130-042-201 | Cited as Magnetic column |
| MTG | Merck | M6145-25ML | |
| N2 supplement | Life Technologies | 17502048 | |
| Notebook for pump system | ibidi | 10908 | |
| Paraformaldehyde 37-41% | Fisher Chemicals | F/1501/PB15 | |
| Pastette | Greiner Bio-one | 612398 | |
| Pen/Strep | Gibco | 15070063 | |
| Perfusion Set YELLOW/GREEN: 50 cm, ID 1.6 mm, 10 mL reservoirs | Ibidi | IB-10964 | Cited as Perfusion set |
| Polystyrene Round Bottom Tubes | Falcon | 352008 | Cited as Flow cytometry tubes |
| Prism 9 | Verison 9.4.0 | ||
| Pump control software | ibidi | version 1.6.1 | Cited as Pump software |
| ReLeSR | Stem cell tecchonologies | 5872 | Cited as Detaching solution |
| rhBMP4 | R&D | 314-BP-010 | |
| rhEPO | R&D | 287-TC-500 | |
| rhIGF1 | Peprotech | 100-11-100uG | |
| rhIL11 | Peprotech | 200-11-10uG | |
| rhIL3 | Peprotech | 200-03-10uG | |
| rhIL6 | R&D | 206-IL-010 | |
| rhLaminin-521 | Life technologies | A29248 | Cited as Laminin |
| rhSCF | Life Technologies | PHC2111 | |
| rhTPO | R&D | 288-TPN-025 | |
| rhVEGF | R&D | 293-VE-010 | |
| RLT Lysis Buffer | Qiagen | 79216 | |
| Serial Connector for µ-Slides: Sterile, Sterile | ibidi | IB-10830 | |
| StemPro-CD34 SFM media | Life Technologies | 10639011 | Cited as Serum-Free media for CD34+ cells (SFM-34) |
| StemPro-CD34 Nutrient Supplement | Life Technologies | 10641-025 | Cited as 34 nutrient supplement |
| StemPro hESC SFM | Life Technologies | A1000701 | Cited as Culture media |
| StemPro supplement | Life Technologies | A10006-01 | |
| Vitronectin (VTN-N) recombinant human protein, truncated | Invitrogen | A31804 | |
| Y-27632 dihydrochloride | Tocris | 1254 | Cited as iRock |
| β-Mercaptoethanol | Gibco | 21985023 |
Referências
- Copp, A. J. Death before birth: clues from gene knockouts and mutations. Trends in Genetics. 11 (3), 87-93 (1995).
- Ji, R. P., et al. Onset of cardiac function during early mouse embryogenesis coincides with entry of primitive erythroblasts into the embryo proper. Circulation Research. 92 (2), 133-135 (2003).
- Peacock, H. M., Daems, M., Jones, E. A. V. Hemodynamic control of endothelial cell fates in development. Cardiac and Vascular Biology. 8, 127-166 (2021).
- Chong, D. C., Koo, Y., Xu, K., Fu, S., Cleaver, O. Stepwise arteriovenous fate acquisition during mammalian vasculogenesis. Developmental Dynamics. 240 (9), 2153-2165 (2011).
- Jaffredo, T., Gautier, R., Eichmann, A., Dieterlen-Lièvre, F. Intraaortic hemopoietic cells are derived from endothelial cells during ontogeny. Development. 125 (22), 4575-4583 (1998).
- Zovein, A. C., et al. Fate Tracing reveals the endothelial origin of hematopoietic stem cells. Cell Stem Cell. 3 (6), 625-636 (2008).
- Bertrand, J. Y., et al. Haematopoietic stem cells derive directly from aortic endothelium during development. Nature. 464 (7285), 108-111 (2010).
- Boisset, J. C., et al. In vivo imaging of haematopoietic cells emerging from the mouse aortic endothelium. Nature. 464 (7285), 116-120 (2010).
- Adamo, L., et al. Biomechanical forces promote embryonic haematopoiesis. Nature. 459 (7250), 1131-1135 (2009).
- Diaz, M. F., et al. Biomechanical forces promote blood development through prostaglandin E2 and the cAMP-PKA signaling axis. Journal of Experimental Medicine. 212 (5), 665-680 (2015).
- North, T. E., et al. Hematopoietic stem cell development is dependent on blood flow. Cell. 137 (4), 736-748 (2009).
- Lundin, V., et al. YAP regulates hematopoietic stem cell formation in response to the biomechanical forces of blood flow. Developmental Cell. 52 (4), 446.e5-460.e5 (2020).
- Li, J., et al. Mimicry of embryonic circulation enhances the hoxa hemogenic niche and human blood development. Cell Reports. 40 (11), 111339 (2022).
- Azzoni, E., et al. The onset of circulation triggers a metabolic switch required for endothelial to hematopoietic transition. Cell Reports. 37 (11), 110103 (2021).
- Li, Y. S. J., Haga, J. H., Chien, S. Molecular basis of the effects of shear stress on vascular endothelial cells. Journal of Biomechanics. 38 (10), 1949-1971 (2005).
- Batsivari, A., et al. Understanding hematopoietic stem cell development through functional correlation of their proliferative status with the intra-aortic cluster architecture. Stem Cell Reports. 8 (6), 1549-1562 (2017).
- Canu, G., et al. Analysis of endothelial-to-haematopoietic transition at the single cell level identifies cell cycle regulation as a driver of differentiation. Genome Biology. 21 (1), 157 (2020).
- Luo, W., et al. Arterialization requires the timely suppression of cell growth. Nature. 589 (7842), 437-441 (2020).
- Yang, C. -. T., et al. Activation of KLF1 enhances the differentiation and maturation of red blood cells from human pluripotent stem cells. Stem Cells. 35 (4), 886-897 (2017).
- Lopez-Yrigoyen, M., et al. A human iPSC line capable of differentiating into functional macrophages expressing ZsGreen: A tool for the study and in vivo tracking of therapeutic cells. Philosophical Transactions of the Royal Society B: Biological Sciences. 373 (1750), 20170219 (2018).
- Lopez-Yrigoyen, M., et al. Production and characterization of human macrophages from pluripotent stem cells. Journal of Visualized Experiments. 2020 (158), (2020).
- Fidanza, A., et al. Single cell analyses and machine learning define hematopoietic progenitor and HSC-like cells derived from human PSCs. Blood. 136 (25), 2893-2904 (2020).
- Schindelin, J., et al. Fiji: an open-source platform for biological-image analysis. Nature Methods. 9 (7), 676-682 (2012).
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- North, T. E., et al. Hematopoietic stem cell development is dependent on blood flow. Cell. 137 (4), 736-748 (2009).
- Nguyen, J., Lin, Y. Y., Gerecht, S. The next generation of endothelial differentiation: Tissue-specific ECs. Cell Stem Cell. 28 (7), 1188-1204 (2021).
- Petazzi, P., et al. Arterial cells support the development of human hematopoietic progenitors in vitro via secretion of IGFBP2. bioRxiv. , (2022).
- Crosse, E. I., et al. Multi-layered spatial transcriptomics identify secretory factors promoting human hematopoietic stem cell development. Cell Stem Cell. 27 (5), 822 (2020).
- Calvanese, V., et al. Mapping human haematopoietic stem cells from haemogenic endothelium to birth. Nature. 604 (7906), 534-540 (2022).
- Zeng, Y., et al. Tracing the first hematopoietic stem cell generation in human embryo by single-cell RNA sequencing. Cell Research. 29 (11), 881-894 (2019).
- Hwa, J. J., et al. Abnormal arterial-venous fusions and fate specification in mouse embryos lacking blood flow. Scientific Reports. 7 (1), 11965 (2017).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados