Cultivando organoides de glioma derivados de pacientes ex vivo usando um picador de tecido
Neste Artigo
Resumo
Este estudo introduz um método automatizado para gerar organoides 3-dimensionais de glioblastoma derivados do paciente utilizando um picador de tecido. O método fornece uma abordagem adequada e eficaz para a obtenção de tais organoides para testes terapêuticos.
Resumo
O glioblastoma, tipo IDH-selvagem, grau 4 (GBM) da OMS do SNC é um tumor cerebral primário associado à baixa sobrevida do paciente, apesar do tratamento agressivo. O desenvolvimento de modelos ex vivo realistas continua a ser um desafio. Modelos organoides 3-dimensionais derivados de pacientes (DOP) oferecem plataformas inovadoras que capturam a heterogeneidade fenotípica e molecular do GBM, preservando as principais características dos tumores originais. No entanto, a dissecção manual para geração de DOP é demorada, cara e pode resultar em uma série de DOPs irregulares e de tamanho desigual. Este estudo apresenta um método inovador para a produção de DOP utilizando um picador de tecido automatizado. Amostras tumorais de quatro pacientes com GBM e um astrocitoma, mutante IDH, grau 2 da OMS foram processadas manualmente, bem como usando o picador de tecido. Na abordagem manual, o material tumoral foi dissecado com bisturi sob controle microscópico, enquanto o picador de tecido foi empregado em três ângulos diferentes. Após cultura em agitador orbitário a 37 °C, as alterações morfológicas foram avaliadas por microscopia de campo claro, enquanto proliferação (Ki67) e apoptose (CC3) foram avaliadas por imunofluorescência após 6 semanas. O método do picador de tecido reduziu quase 70% do tempo de fabricação e resultou em uma contagem média de DOPs significativamente maior em comparação com o tecido processado manualmente a partir da segunda semana (semana 2: 801 vs. 601, P = 0,018; semana 3: 1105 vs. 771, P = 0,032; e semana 4:1195 vs. 784, P < 0,01). A avaliação da qualidade revelou taxas semelhantes de apoptose e proliferação de células tumorais para ambos os métodos de fabricação. Portanto, o método automatizado de corte de tecido oferece uma abordagem mais eficiente em termos de tempo e rendimento de DOP. Esse método é promissor para a triagem de pacientes com GBM ou imunoterapia.
Introdução
Os gliomas de baixo grau (LGGs) são um grupo de tumores cerebrais relativamente raros que tipicamente se apresentam como de crescimento lento e menos agressivos em comparação com gliomas de alto grau como o glioblastoma. Podem ocorrer tanto em adultos quanto em crianças, com prevalência um pouco maior em adultos. A prevalência exata varia de acordo com a região e a população, mas os LGGs são responsáveis por aproximadamente 15%-20% de todos os tumores cerebrais primários1. As estratégias de tratamento para LGGs geralmente envolvem uma combinação de cirurgia, radioterapia e quimioterapia, com o objetivo de maximizar a ressecção tumoral enquanto preserva a função neurológica. O manejo dos LGGs pode ser complexo, e a escolha da terapia pode depender de fatores como localização do tumor e característicasmoleculares2. Os avanços na compreensão dos fundamentos genéticos e moleculares dos LGGs levaram a terapias mais direcionadas, e a pesquisa em andamento continua a refinar as abordagens de tratamento.
Já o glioblastoma do tipo IDH-selvagem, grau 4 (GBM) da OMS no SNC é o tumor cerebral primário mais prevalente encontrado em adultos, com taxa de incidência entre 3,19-4,17 casos por 100.000pessoas-ano3. O GBM causa sintomas como dores de cabeça, convulsões, déficits neurológicos focais, alterações na personalidade e aumento da pressão intracraniana. O tratamento padrão para GBM envolve remoção de volume do tumor, se possível, seguido de radioterapia combinada com Temozolomida4. Além disso, a combinação de Temozolomida e Lomustina pode aumentar a taxa de sobrevida global mediana em pacientes com metilação do promotor da O6-metilguanina-metiltransferase (MGMT) 5. No entanto, apesar dessas abordagens terapêuticas recentes, o GBM permanece uma doença incurável e de mau prognóstico, caracterizada por uma taxa de sobrevida global mediana dos pacientes de 16 meses até 20,9 meses quando Campos de Tratamento de Tumor (TTFields) é adicionado 3,6. Várias abordagens imunoterápicas foram investigadas no GBM, mas demonstraram eficácia limitada in vivo. Além disso, limitações clínicas e pré-clínicas dificultam o avanço terapêutico7. O estabelecimento de um modelo ex vivo adequado e realista tem sido um desafio devido à heterogeneidade inter-8 e intratumoral9 do GBM.
Linhagens celulares convencionais de pacientes em 2 dimensões (2D) representam populações celulares homogêneas e são adequadas para triagem de drogas de alto rendimento. No entanto, linhagens celulares derivadas do paciente e imortalizadas não conseguem mimetizar adequadamente o GBM devido a diferenças nas condições de crescimento e desvios nas características genotípicas e fenotípicas após múltiplas passagens 10,11,12.
Por outro lado, modelos organoides 3D têm emergido recentemente como sistemas promissores que replicam a heterogeneidade fenotípica e molecular de órgãos e vários tipos de câncer13,14,15,16,17,18. No contexto do GBM, organoides cerebrais têm sido geneticamente modificados para simular característicastumorais16,17 ou co-cultivados com GSCs ou esferoides para induzir infiltração de células tumorais 18,19. Embora organoides GBM derivados de pacientes cultivados com Matrigel e EGF/bFGF exibam características do GBM, como heterogeneidade e hipóxia de células-tronco20, permanece incerto até que ponto esse modelo pode representar as principais propriedades moleculares das neoplasias dos pacientes.
Os organoides GBM derivados de pacientes (PDOs) são modelos promissores que podem manter as características predominantes de seus tumores parentais análogos, incluindo características histológicas, diversidade celular, expressão gênica e perfis mutacionais. Além disso, são rapidamente infiltrados após a implantação em cérebros de roedores adultos, fornecendo um modelo realista para testes de drogas e terapia personalizada21. No entanto, a dissecção manual do tecido tumoral para gerar DOPs é demorada e dispendiosa. Portanto, existe uma necessidade urgente de um método rápido que possa produzir um grande número de DOPs, permitindo uma avaliação abrangente de diferentes abordagens terapêuticas promissoras para testes individualizados de drogas. Este estudo descreve um novo método para a fabricação de DOPs diretamente a partir de tecido tumoral recém-dissecado usando um picador automático de tecido. Além disso, as DOPs geradas por esse método foram comparadas com as DOPs dissecadas manualmente dos mesmos pacientes em termos de contagem de DOP, características morfológicas, apoptose e proliferação de células tumorais.
Protocolo
Todos os pacientes foram tratados no Departamento de Neurocirurgia do Hospital Universitário de Würzburg, Alemanha, após assinatura do termo de consentimento livre e esclarecido, de acordo com a declaração de Helsinque e aprovado pelo Comitê de Ética em Pesquisa da Universidade de Würzburg (#22/20-me). Material de tecido tumoral de quatro pacientes com GBM e um astrocitoma, mutante IDH, grau 2 da OMS no SNC (glioma de baixo grau, LGG) (Tabela 1) foi obtido da cirurgia e processado usando o seguinte protocolo. O processo automatizado de geração de DOPs utilizando um picador de tecido é referido como chopper (C) e o processo de corte manual do tecido com dois bisturis sob controle microscópico como manual (M). Seis cortes de tamanhos iguais (1-2 cm3) foram dissecados da amostra tumoral, em seguida, cada um foi cortado ao meio e processado homogeneamente usando os dois métodos. Devido à heterogeneidade intratumoral mencionada, uma placa de 6 poços para cada abordagem foi gerada de cada paciente, com cada poço representando DOPs de um local diferente dentro do tumor original. Ambos os procedimentos foram realizados sob uma cabine de fluxo de ar laminar e todos os instrumentos utilizados foram esterilizados antes do uso. A visão geral da abordagem é ilustrada na Figura 1.
1. Preparação de blocos de agarose (apenas para a abordagem C, opcional)
- Encha 50 ml de solução salina tamponada com fosfato (PBS) num copo, adicione um comprimido de agarose (ver Tabela de Materiais) e misture bem até ser suspenso.
- Aqueça a mistura no micro-ondas por 30-40 s, evitando ferver. Em seguida, resfriar a mistura até atingir 47 °C.
- Despeje a mistura de agarose em um molde de fundição selado em forma de cilindro e evite qualquer formação de bolhas. Arrefecer imediatamente o molde utilizando uma braçadeira congelada (-20 °C) ou colocando-o em gelo seco durante 30 minutos.
2. Processamento do material tumoral
- Prepare uma caixa de gelo para manter o material tumoral resfriado no caminho da sala de cirurgia para o laboratório.
- Transfira o tecido tumoral (4-5 cm³) para um tubo estéril de 50 mL contendo 25 mL de Hibernato A (ver Tabela de Materiais) cobrindo o tumor e coloque o tubo na caixa de gelo.
- Sob um gabinete de fluxo de ar laminar, transfira o material tumoral juntamente com o Hibernate A para uma placa de Petri de vidro esterilizada.
- Elimine o tecido necrótico e disseque os vasos sanguíneos cuidadosamente usando um bisturi e pinças de tecido sob controle microscópico. Identificar tecido necrótico por áreas hemorrágicas exibindo uma tonalidade acastanhada resultante de sangramento, ou tecido exibindo uma aparência mais pálida ou branca em relação ao tecido viável adjacente. Preste atenção para não apertar ou romper o tecido.
- Cortar o material tumoral em seis pedaços com um tamanho aproximado de 1-2 cm3. Distribuir as peças em placas plásticas de Petri (n = 6) pré-preenchidas com 3 mL de meio H-GPSA (Tabela 2), cada22. Coloque as placas de Petri no gelo.
3. Configuração do cortador de tecido
- Posicione a lâmina conforme descrito no manual do fabricante23.
- Ajuste a espessura do corte para 0,45-0,50 mm. Ajuste a força da lâmina para média. Corrija o botão de liberação da tabela para o modo "iniciar".
4. Processamento das peças de tecido tumoral
- Processamento de tecido tumoral com o chopper (método C)
- Corte os blocos de agarose em cilindros de 2 cm de comprimento e cole um desses cilindros no prato de plástico circular do picador usando a cola histoacryl (ver Tabela de Materiais).
- Crie um aprofundamento no cilindro de agarose usando um bisturi e, em seguida, encaixe o tecido tumoral do primeiro poço (passo 2.5) dentro deste poço.
NOTA: O material tumoral deve ser manuseado com cuidado e não deve ser espremido ou empurrado para dentro da lacuna. A lacuna deve ser grande o suficiente para se encaixar facilmente no tumor, mas pequena o suficiente para manter o material tumoral estável durante o processo de corte. Passos 4.1.1. e 4.1.2. são opcionais. - Posicione o disco de plástico no disco de montagem da mesa de corte (consulte Tabela de Materiais).
- Ligue o helicóptero e pressione o botão de reset . O helicóptero agora começa a cortar (primeiro round). A máquina pára automaticamente depois que a mesa atinge o final e tanto a agarose quanto o tecido tumoral são cortados no diâmetro desejado.
- Gire o disco de montagem em 90° e, em seguida, ajuste o botão da mesa de liberação para o modo de partida.
- Pressione o botão de reset e deixe a máquina cortar o tecido novamente criando tecido de forma retangular (segunda rodada).
- Remova o disco plástico com o material processado e gire cuidadosamente apenas o tecido tumoral em 90° usando espátula de tecido.
- Coloque o disco de plástico sobre a mesa de corte, em seguida, ajuste o botão da mesa de liberação para o modo de partida e pressione o botão de reset para uma rodada de corte final (terceira rodada).
- Desligue o picador e retire o disco de plástico. Limpe o picador e as lâminas.
- Usando uma pipeta de canal único de 5 mL, aspirar o material processado juntamente com o meio para dentro da pipeta e lavar a suspensão de volta para o prato.
- Repita o passo anterior 2-3 vezes para separar o tecido corretamente.
- Coloque a placa de Petri de volta no gelo e repita os passos (4.1.1-4.1.12.) com os outros 5 pratos de cada tumor.
- Processamento manual do tecido tumoral (método M)
- Transferir o tecido tumoral da primeira placa de Petri plástica (passo 2.5) juntamente com 3 mL de meio H-GPSA (Tabela 2) para uma placa de Petri de vidro. Dissecar o segmento manualmente ao microscópio em cortes de 0,5 mm com dois bisturis.
- Transfira o tecido dissecado de volta para sua placa de Petri plástica usando uma pipeta de 2 mL.
- Repetir os passos (4.2.1.-4.2.3.) para os cortes tumorais nas outras cinco placas de Petri (passo 2.5).
5. Lavagem do tecido tumoral
- Incline cada placa de Petri para cima até 45° e aguarde 30 s até que os pedaços do tumor afundem no fundo da placa.
- Aspirar cuidadosamente 2,5 mL do meio H-GPSA (Tabela 2) utilizando pipeta de 1 mL e estar atento para não absorver nenhum tecido tumoral.
- Adicionar 2 ml de tampão de lise de hemácias (ver Tabela de Materiais) a cada amostra. Os pedaços tumorais processados devem ser completamente cobertos por tampão de lise.
- Coloque as 6 placas em uma máquina de agitação orbital de laboratório em velocidade lenta por 10 min.
- Aspirar cuidadosamente 2 mL do tampão de lise para não absorver nenhum tecido tumoral.
- Repetir as etapas de lavagem anteriores (passo 5.1-5.5) duas vezes usando 2 mL de meio H-GPSA (Tabela 2) em vez de tampão de lise de cada vez.
6. Cultura do tecido tumoral
- Aspirar o meio H-GPSA (Tabela 2) de cada placa e substituí-lo por 4 mL de meio DOP (Tabela 2).
- Transfira os pedaços de tecido de cada prato para um poço respectivo de uma placa de 6 poços de fixação ultrabaixa (consulte a Tabela de Materiais).
- Coloque a placa num agitador orbital dentro de uma incubadora e incube a 37 °C, 5% CO2 e 150 rpm durante 2-4 semanas.
- Realizar meia troca de meio meio a cada dois dias, aspirando 2 mL de meio de cada poço e substituindo-o por 2 mL de meio DOP fresco (Tabela 2) pré-aquecido a 37 °C.
- Observar o tecido ao microscópio (morfologia, crescimento, cor média) e cortar DOPs em crescimento (>0,7 mm) ou tecido adesivo para prevenir hipóxia tecidual.
- Para isso, transfira as DOPs do poço de fixação ultrabaixa para uma placa de Petri de vidro esterilizada e use um bisturi para o corte. Alternativamente, as DOPs adesivas podem ser resolvidas aspirando-as com uma pipeta de 1 mL. Tenha cuidado para não apertar as DOPs e manuseá-las suavemente.
- Avaliar a formação de DOP contando a DOP a cada dois dias e verificar minuciosamente a morfologia redonda desejada (Figura 2).
7. Fixação e incorporação das DOP
- Fixar duas DOP de cada poço de cada paciente com formalina a 4% por 24 h após 6 semanas de cultura.
- Imergir as DOPs fixas em formalina tamponada neutramente (fosfato de sódio) até a incorporação.
- Coloque cada DOP numa (ver Tabela de Materiais) para processamento posterior.
- Inicie um processo de desidratação mergulhando o nas seguintes soluções, conforme mencionado na NOTA abaixo:
NOTA: Etanol 50% por 20 min, etanol 70% por 20 min, etanol 80% por 20 min, etanol 96% por 20 min, etanol 100% por 20 min, etanol 100% por 30 min, etanol 100% + clorofórmio (relação 1:1) por 30 min, etanol 100% + clorofórmio (relação 1:1) por 30 minutos, clorofórmio absoluto por 30 min, clorofórmio absoluto por 30 min, Parafina por 30 min, Parafina por 30 min usando o STP 120. - Incorporar as DOP desidratadas em cera de parafina a 58-60 °C.
- Corte as DOPs incorporadas com 2,5 μm de espessura e monte-as em lâminas para coloração.
8. Coloração por imunofluorescência
- Monte as DOPs após 6 semanas de cultura.
- Posteriormente, realizar dupla coloração contra a proteína glial fibrilar ácida (GFAP, diluição: 1:100) e o marcador de proliferação Ki67 (diluição: 1:1000) (ver Tabela de Materiais), conforme relatado anteriormente22.
- Da mesma forma, avaliar a apoptose por dupla coloração de DOPs contra GFAP e anticaspase-3 (CC3, diluição: 1:400) (ver Tabela de Materiais).
- Capturar imagens das DOPs usando um microscópio de fluorescência em aumento de 40x.
- Analise as imagens para células positivas para GFAP, Ki67 e CC3, bem como células duplamente positivas para GFAP/Ki67 e GFAP/CC3.
- Utilize o programa de código aberto Fiji (ImageJ-win 32) para análise de imagens.
9. Avaliação e análise dos dados
- Capture imagens microscópicas diárias de campo brilhante durante a primeira semana de cultura em configurações padrão e aumento de 5x.
- Observe as mudanças morfológicas e acompanhe o processo de maturação em ambas as abordagens de processamento manual e automatizado.
- Realizar análises morfológicas usando o microscópio em configurações padrão de modo de campo claro.
- Avaliar o número e a morfologia da DOP durante as primeiras 4 semanas de cultura em DOP dos cinco pacientes.
- Obter três leituras de cada contagem de DOP de cada paciente para calcular a média e o erro padrão da média (EPM).
- Investigar proliferação e apoptose em DOPs de três pacientes.
- Analise os dados usando um pacote de software estatístico disponível comercialmente (consulte a Tabela de Materiais).
- Aplicar os testes Student-T e Mann-Whitney U para determinar diferenças entre a geração manual e automatizada de DOP em termos de contagem de DOP, proliferação e apoptose.
Resultados Representativos
Quatro pacientes com GBM e um com LGG foram incluídos após confirmação patológica por um neuropatologista experiente (CMM). A maioria dos pacientes tinha um promotor de MGMT não metilado, e todos os pacientes com GBM eram do tipo selvagem IDH1 e IDH2 (Tabela 1). Em média, o processo de fabricação durou 88,8 min (+/- 6,3 min) na abordagem C e 322 min (+/- 17,2 min) na abordagem M. A taxa de sucesso global foi de 87% na abordagem manual e de 93% na abordagem chopper após 4 semanas de cultura (n = 5). Além disso, as DOPs derivadas do grupo C atingiram a forma arredondada desejada em 1 semana e estavam maduras o suficiente para serem usadas em experimentos in vitro , enquanto as DOPs do grupo M permaneceram em sua maioria com bordas acentuadas e indefinidas (Figura 2). O tecido tumoral processado com a abordagem C resultou em 281 DOP (Média por paciente = 56 +/- 43) após a primeira semana de cultura, enquanto 250 DOP (Média por paciente = 50 +/- 41) se desenvolveram com a abordagem M. Durante a segunda semana de cultura, o tecido de todos os cinco pacientes apresentou maiores números de DOP quando eles foram gerados com a abordagem C (801; Média por paciente= 130 +/- 38) em relação à abordagem M (601; Média por paciente= 76 +/- 44; P = 0,018). Durante a terceira semana de cultura, a abordagem C acumulou 1105 DOP de todos os pacientes (Média por paciente = 221 +/- 32) em comparação com 771 DOP (Média por paciente = 155 +/- 34) na abordagem M (P = 0,032). Além disso, um total de 1195 DOPs (média por paciente= 239 +/- 50) formadas após quatro semanas de cultura quando geradas com a abordagem C em comparação com 784 (Média por paciente= 157 +/- 36) utilizando a abordagem M (P < 0,01). Portanto, o método C mostrou uma contagem de DOPs significativamente maior a partir da segunda semana (Figura 3). Além disso, as flutuações relativas nas contagens de DOP foram avaliadas para explorar as tendências dinâmicas entre semanas sucessivas. A análise revelou um aumento impressionante nas contagens de DOP durante a transição inicial da primeira para a segunda semana na abordagem C (265%), o que foi indicativo de um rápido progresso. Posteriormente, houve um aumento menor nas contagens durante a terceira semana (75%), refletindo um ajuste temporário. Em contraste, a abordagem M demonstrou um aumento consistente e constante nas contagens de DOP (92% na segunda semana, respectivamente 67% na terceira semana), o que contribuiu para uma notável estabilidade nas contagens durante a quarta semana. Esta tendência ascendente consistente nas contagens de DOP sublinha a fiabilidade e a resiliência da abordagem C ao longo do período de observação.
Dois pacientes com GBM e um com LGG foram incluídos para a análise do número de astrócitos (GFAP) dentro de DOPs, proliferação de células DOP (Ki67) e apoptose (CC3). A contagem de astrócitos determinada não revelou diferenças significativas entre os dois métodos de processamento, com uma média de 43% na abordagem C e 45% na abordagem M (Figura 4 e Figura 5, Figura Suplementar 1 e Figura Suplementar 2). Da mesma forma, as taxas de proliferação dentro das DOPs foram comparáveis entre as abordagens C (3%) e M (1%). Apenas as DOPs geradas com a abordagem C do paciente 5 apresentaram uma taxa de proliferação de 26% em comparação com 1% com a abordagem M (P = 0,001; Figura 4C). Em geral, baixas taxas de apoptose foram detectadas em DOPs processadas com a abordagem C (3%) em comparação com 2% da abordagem M para todos os pacientes, que não foram significativamente diferentes (Figura 5C). Além disso, não houve diferença significativa entre os dois métodos quanto ao número de astrócitos submetidos à apoptose (Figura 5D).
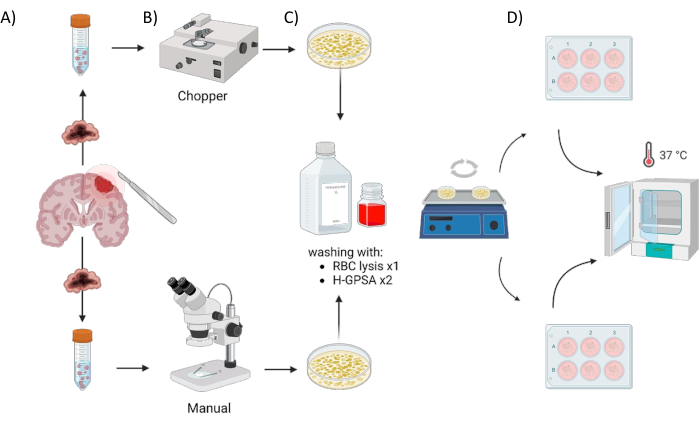
Figura 1: Visão gráfica do processo de fabricação de organoides derivados do paciente (DOP) usando um helicóptero automatizado versus uma abordagem manual. A ilustração descreve as várias etapas envolvidas, incluindo (A) coleta de amostras, (B) dissecção do material tumoral, (C) lavagem e (D) incubação. Clique aqui para ver uma versão maior desta figura.
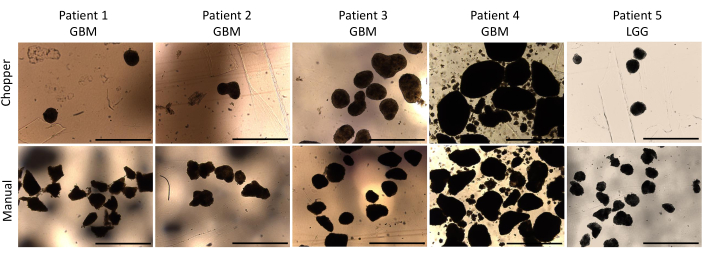
Figura 2: Morfologia da DOP durante a primeira semana de cultivo. Comparação da formação de DOPs pós-dissecção utilizando o método de picador automático e manual. Barras de escala = 1000 μm. Clique aqui para ver uma versão maior desta figura.
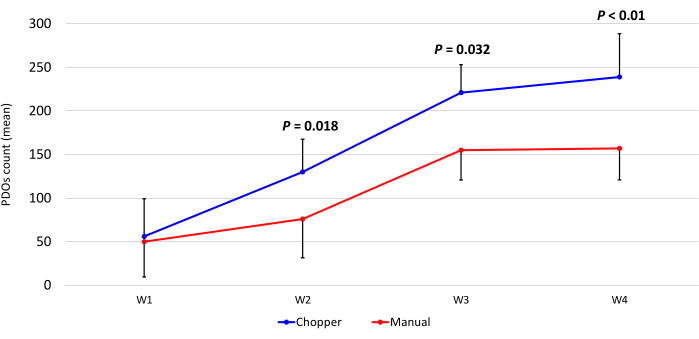
Figura 3: Contagem de DOP durante as primeiras quatro semanas de cultura. O eixo x exibe o tempo em semanas (W) e o eixo y o número de DOPs das abordagens C (azul) e M (vermelho) (n = 5). Cada ponto de dados representa a contagem média, com barras de erro indicando o erro padrão da média. Clique aqui para ver uma versão maior desta figura.
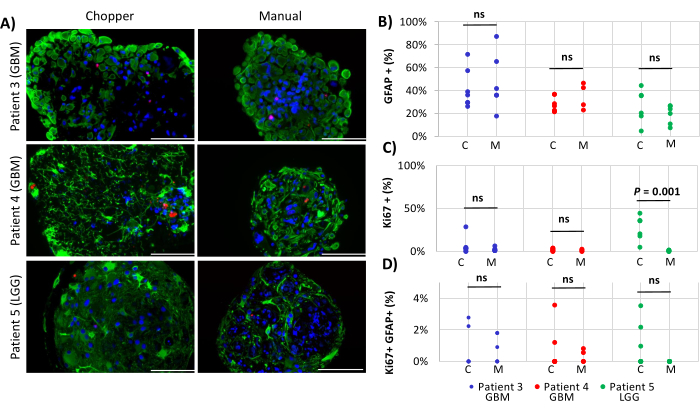
Figura 4: Taxas de proliferação celular dentro das DOP. (A) Imagens representativas de imunofluorescência (n = 3) de células positivas para GFAP (verde), células positivas para Ki67 (vermelho) e DAPI (azul) em DOPs dos pacientes 3, 4 e 5 (Tabela 1). Todas as DOPs foram processadas pelos métodos chopper (C) e manual (M). Barras de escala = 100 μm. (B) Comparação dos dois métodos quanto ao número relativo de células positivas para GFAP, (C) células Ki67-positivas e (D) células Ki67/GFAP-duplamente positivas. Resultados não significativos são indicados por "ns". Clique aqui para ver uma versão maior desta figura.
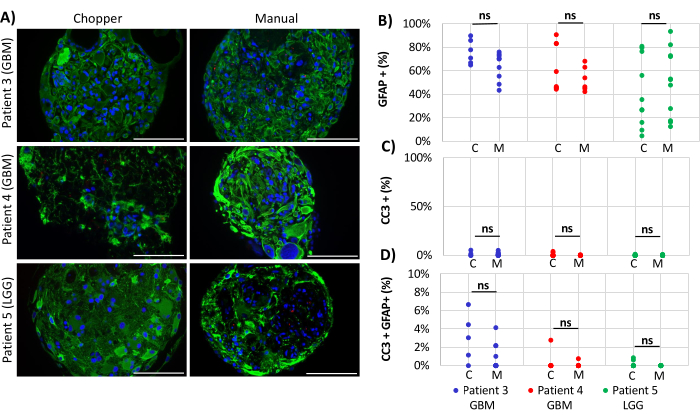
Figura 5: Taxas de apoptose dentro das DOPs. (A) Imagens representativas de imunofluorescência (n = 3) de células positivas para GFAP (verde), células positivas para CC3 (vermelho) e DAPI (azul) em DOPs dos pacientes 3, 4 e 5 (Tabela 1). Todas as DOPs foram processadas pelos métodos chopper (C) e manual (M). Barras de escala = 100 μm. (B) Comparação dos dois métodos em relação ao número relativo de células positivas para GFAP, (C) células CC3-positivas e (D) células CC3/GFAP-duplamente positivas. Resultados não significativos são indicados por "ns". Clique aqui para ver uma versão maior desta figura.
Tabela 1: Características dos pacientes e parâmetros clínicos. GBM = glioblastoma, tipo IDH-selvagem, CNS WHO grau 4; LGG = glioma de baixo grau; KPS = escore de desempenho de Karnofsky; MGMT = O 6-metilguanina-DNA metiltransferase; IDH1 = isocitrato desidrogenase 1, IDH2 = isocitrato desidrogenase 2, ATRX = α-talassemia/retardo mental, gene ligado ao X; M = morfologia; CC = contagem celular; p = proliferação; A = apoptose. Clique aqui para baixar esta tabela.
Tabela 2: Composições médias. H-GPSA = Hibernato A-Glutamax, pencilina, estreptomicina, anfotericina B. DOP = Organoides derivados do paciente DMEM: Meio de águia modificado de Dulbecco. NEAA: aminoácidos não essenciais. Pen Strep: Penicilina / Streptomicina Clique aqui para baixar esta tabela.
Tabela 3: Visão geral das técnicas utilizadas para gerar modelos de cultura celular. Clique aqui para baixar esta tabela.
Figura suplementar 1: Canais individuais de coloração de proliferação de DOP. (A) DAPI (azul), (B) células positivas para GFAP (verde), (C) células positivas para Ki67 (vermelho) e (D) canal de sobreposição em DOPs dos pacientes 3, 4 e 5. Barras de escala = 100 μm. Clique aqui para baixar este arquivo.
Figura suplementar 2: Canais individuais de coloração de apoptose das DOPs. (A) DAPI (azul), (B) células positivas para GFAP (verde), (C) células CC3-positivas (vermelho) e (D) canal de sobreposição em DOPs dos pacientes 3, 4 e 5. Barras de escala = 100 μm. Clique aqui para baixar este arquivo.
Discussão
Este estudo apresenta um método rápido e eficiente para a geração de DOPs. O GBM continua sendo um tumor desafiador de tratar, muitas vezes caracterizado por recidiva e alta carga dedoença3,6. Abordagens terapêuticas inovadoras são urgentemente necessárias, pois resultados promissores observados in vitro muitas vezes não conseguem demonstrar eficácia in vivo durante os ensaios de fase I. Uma das razões para essa discrepância pode ser a capacidade limitada de linhagens celulares imortalizadas derivadas do paciente, cultivadas em culturas de monocamadas, de refletir as complexas interações célula-célula e as propriedades genéticas do tumor parental. Dada a alta heterogeneidade inter e intratumoral do GBM 8,9, terapias-alvo personalizadas são preferidas e podem ser promissoras para aplicações futuras. Em contraste com as linhagens celulares aderentes 2D, os organoides têm a capacidade de reter as propriedades do tecido parental21, mas interações celulares complexas entre o tumor e o cérebro normal são de suma importância e poderiam ser potencialmente negligenciadas por esse modelo. No entanto, a geração manual de DOPs é um processo demorado, e o dano tecidual causado pela compressão com bisturi durante o corte pode dificultar o crescimento bem-sucedido da DOP. Portanto, um método automatizado foi otimizado usando um picador de tecido para gerar maior número de DOPs com tempo e esforço reduzidos. Além disso, demonstramos que as taxas globais de proliferação e apoptose não diferiram entre as duas abordagens.
A abordagem C é direta, fácil de implementar e permite a geração de um número maior de DOPs (Figura 3). A rotação do tecido entre a segunda e a terceira rodadas de corte foi identificada como etapa crítica do protocolo. Nesta fase, o tecido já perdeu sua integridade e pode facilmente se desfazer, resultando em pedaços maiores que requerem corte adicional ou dissecção manual sob o microscópio. Enquanto a abordagem automatizada do helicóptero permite um tamanho de corte predefinido com maior precisão, a abordagem manual carece de precisão na determinação do tamanho das DOP, levando a DOPs de formato e tamanho desiguais, o que é uma desvantagem para a triagem comparativa de drogas (Figura 2). No entanto, com o método proposto, a padronização do número de células por DOP não é alcançada, potencialmente representando uma desvantagem para protocolos padronizados de triagem de drogas. As vantagens e desvantagens das diferentes técnicas de geração de organoides 18,19,20,24,25,26,27,28,29,30,31,32,33,34,35,36,
37,38,39,40,41,42 e suas aplicações estão resumidas na Tabela 3.
O tecido GBM pode variar em consistência, variando de resistente (zona de infiltração) a mole (núcleo necrótico), o que pode representar desafios para a abordagem automatizada do helicóptero. Se o tecido for muito resistente, o picador pode apertá-lo e danificá-lo, enquanto o tecido muito mole pode ser esmagado. O tecido escolhido apresentou atributos distintivos, incluindo um nível intermediário de firmeza, esporadicamente caracterizando uma coloração róseo-acinzentada em vez de manifestar descoloração marrom ou amarela. Tecidos de textura esponjosa e prontamente esfarelada demonstraram preservação superior dentro dos blocos de agarose, enquanto tecido tumoral extremamente delicado e liquefeito foi omitido do procedimento de amostragem. No entanto, a abordagem do chopper possibilitou a geração bem-sucedida de um número maior de DOPs em comparação com a abordagem manual, mesmo com tecido de consistência subótima. A solução chave é manter uma interação estreita com o cirurgião que realiza a ressecção do tumor para processar o tecido de diferentes áreas do tumor. Em casos de consistência tecidual subótima, o retrabalho manual do tecido ao microscópio foi uma adição útil após o corte. Para explicar a heterogeneidade, o tecido tumoral foi inicialmente dividido em seis segmentos, cada um posteriormente reduzido pela metade para a abordagem C ou M. Dentro dessas seis seções distintas, um grau substancial de heterogeneidade é antecipado. Além disso, mesmo dentro das DOPs da mesma seção ou poço, a presença de subpopulações distintas é plausível.
Como prova de conceito, os dados de proliferação e apoptose foram relatados de dois pacientes com GBM e um paciente com LGG, que não mostram diferenças significativas entre os dois métodos. A geração de DOPs não se limita a tumores cerebrais altamente malignos, mas também pode ser aplicada a LGGs. Este estudo destaca que o LGG raramente exibe crescimento em cultura 2D, tornando o desenvolvimento de um modelo preciso para seu estudo altamente valioso. Este protocolo visa demonstrar a versatilidade desta abordagem na geração de DOPs a partir do GBM, bem como LGG de forma rápida e eficaz.
Em geral, as DOPs poderiam ser utilizadas no futuro para testes pré-terapêuticos orientados ao paciente de terapias-alvo em tumores cerebrais malignos. Fornecer um método rápido e eficiente para triagem individualizada de drogas é crucial, pois a progressão do tumor ocorre rapidamente e opções de tratamento de resgate são desesperadamente necessárias. Como próximo passo, o modelo de DOP poderia ser avaliado com várias abordagens imunoterápicas para melhor mimetizar respostas reais ao tratamento. No futuro, as DOPs poderão ser utilizadas para tirar conclusões sofisticadas sobre a necessidade de maior exploração e avaliação de terapias em um ambiente clínico.
Divulgações
Os autores não têm nada a revelar.
Agradecimentos
Esta pesquisa foi financiada pelo Centro Interdisciplinar de Pesquisa Clínica (IZKF, B-450) Würzburg, Bavarian Center of Cancer Research (BZKF) e pela publicação apoiada pelo Open Access Publishing Fund da Universidade de Würzburg. Agradecemos a Dagmar Hemmerich e Siglinde Kühnel, ambas da Seção de Neurocirurgia Experimental do Departamento de Neurocirurgia do Hospital Universitário de Würzburg, pelo suporte técnico. A Figura 1 foi criada usando www.biorender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| 2-mercaptoethanol (1000x) | Gibco | 21985023 | |
| 30% formaldehyde methanol-free | Carl Roth | 4235.1 | Used in 4% concentration |
| 70% ethanol solution | For sterilisation | ||
| Agarose tablets 0.5 g | Carl Roth | HP67.7 | |
| Amphotericin B 250 µg/mL | Gibco | 15290018 | |
| Anatomical forceps | Hartstein | N/A | |
| Anatomical spatula | Hartstein | N/A | |
| B-27 Supplement without vitamin A (50x) | Gibco | 12587010 | |
| Biopsy cassette with cover | Resolab | 37001-b | |
| Blades for McIlwain Tissue Chopper | Campden instruments | Model TC752-1 | |
| CC3 antibody (Asp 175) | Cells signaling technology | 9661 | |
| Disposable scalpel | Feather | 0200130015 | |
| Distilled water | Gibco | 15230089 | To dilute the formaldehyd |
| Dulbecco's Modified Eagle Serum Nutrient Mixture (DMEM) F-12 (1:1) (1x) | Gibco | 11330032 | Includes L-Glutamine and 15 mM HEPES |
| Dulbecco's Phosphate Buffered Saline (PBS) | Sigma Life Sciences | D8537-500ML | Modified, without calcium, chloride and magnesium chloride, liquid, sterile-filtered, suitable for cell culture |
| eBioscience 1x RBC Lysis Buffer | Invitrogen | 433357 | |
| Falcon tube 50 ml Cellstar | Greiner Bio-One | 227261 | |
| GFAP antibody | Santa Cruz Biotechnology | sc33673 | |
| Glass beaker | N/A | N/A | |
| Glass petri dish | N/A | N/A | |
| GlutaMAX (100x) | Gibco | 35050061 | |
| Heracell 240i CO2 Incubator | Thermo scientific | 51032875 | |
| Herasafe 2025 Biological Safety Cabinet | Thermo scientific | 5016643 | |
| Hibernate-A | Gibco | A1247501 | |
| Histoacryl glue | B. Braun surgical | 1050052 | |
| Human Insulin, Solution | Santa Cruz Biotechnology | sc-360248 | |
| Ice box | N/A | N/A | |
| Ki67 antibody | Abcam | ab16667 | |
| McIlwain Tissue Chopper | Cavey Laboratory Engineering | 51350V | |
| Microscope Leica DMI 3000B, DMI 4000B, DMI 6000B | Leica | DMI6000B | For brightfield and immunofluorescence pictures |
| Microscope stereozoom S9D | Leica | W841832 | For manual cutting and to organoids monitoring |
| Microwave | Bosch | N/A | To heat the agarose solution |
| Mounting plastic discs | Cavey Laboratory Engineering | 51354 | |
| N-2 Supplement (100x) | Gibco | 17502048 | |
| NEM Non-Essential Amino Acids (NEAA) (100x) | Gibco | 11140050 | |
| Neurobasal (1x) | Gibco | 21103049 | |
| Orbital shaking machine Rotamax120 | Heidolph | 10304491 | |
| Penicilin Streptomycin | Gibco | 15140122 | |
| Plastic petri dishes Cellstar | greiner bio-one | 628160 | n = 12 |
| Single channel pipette 1000 µm | Eppendorf | 4924000010 | |
| Single channel pipette 5000 µm | Eppendorf | EP3123000276 | |
| Statistical Package for the Social Sciences (SPSS) version 23.0 | IBM | ||
| Surgipath Paraplast | Leica | 39601006 | Embedding medium |
| Ultra-low attachment Nucleon Sphera 6-well plate | Thermo Scientific | 174932 |
Referências
- Gatto, L., et al. IDH inhibitors and beyond: the cornerstone targeted glioma treatment. Mol Diagn Ther. 25 (4), 457-473 (2021).
- Buckner, J. C., et al. Radiation plus Procarbazine, CCNU, and Vincristine in low-grade glioma. N Engl J Med. 374 (14), 1344-1355 (2016).
- Grochans, S., et al. Epidemiology of glioblastoma multiforme-literature review. Cancers (Basel). 14 (10), 2412 (2022).
- Stupp, R., et al. Radiotherapy plus concomitant and adjuvant temozolomide for glioblastoma). N Engl J Med. 352 (10), 987-996 (2005).
- Herrlinger, U., et al. Lomustine-temozolomide combination therapy versus standard temozolomide therapy in patients with newly diagnosed glioblastoma with methylated MGMT promoter (CeTeG/NOA-09): a randomised, open-label, phase 3 trial. Lancet. 393 (10172), 678-688 (2019).
- Stupp, R., et al. Effect of tumor-treating fields plus maintenance temozolomide vs maintenance temozolomide alone on survival in patients with glioblastoma: a randomized clinical trial. Jama. 318 (23), 2306-2316 (2017).
- Desbaillets, N., Hottinger, A. F. Immunotherapy in glioblastoma: a clinical perspective. Cancers (Basel). 13 (15), 3721 (2021).
- Gularyan, S. K., et al. Investigation of inter- and intratumoral heterogeneity of glioblastoma using TOF-SIMS). Mol Cell Proteomics. 19 (6), 960-970 (2020).
- Brennan, C. W., et al. The somatic genomic landscape of glioblastoma. Cell. 155 (2), 462-477 (2013).
- Lathia, J. D., Mack, S. C., Mulkearns-Hubert, E. E., Valentim, C. L., Rich, J. N. Cancer stem cells in glioblastoma. Genes Dev. 29 (12), 1203-1217 (2015).
- Pollard, S. M., et al. Glioma stem cell lines expanded in adherent culture have tumor-specific phenotypes and are suitable for chemical and genetic screens. Cell Stem Cell. 4 (6), 568-580 (2009).
- Timerman, D., Yeung, C. M. Identity confusion of glioma cell lines. Gene. 536 (1), 221-222 (2014).
- Boj, S. F., et al. Organoid models of human and mouse ductal pancreatic cancer. Cell. 160 (1-2), 324-338 (2015).
- Kopper, O., et al. An organoid platform for ovarian cancer captures intra- and interpatient heterogeneity. Nat Med. 25 (5), 838-849 (2019).
- Lee, S. H., et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer. Cell. 173 (2), 515-528 (2018).
- Bian, S., et al. Genetically engineered cerebral organoids model brain tumor formation. Nat Methods. 15 (8), 631-639 (2018).
- Ogawa, J., Pao, G. M., Shokhirev, M. N., Verma, I. M. Glioblastoma model using human cerebral organoids. Cell Rep. 23 (4), 1220-1229 (2018).
- Linkous, A., et al. Modeling patient-derived glioblastoma with cerebral organoids. Cell Rep. 26 (12), 3203-3211 (2019).
- da Silva, B., Mathew, R. K., Polson, E. S., Williams, J., Wurdak, H. Spontaneous glioblastoma spheroid infiltration of early-stage cerebral organoids models brain tumor invasion. SLAS Discov. 23 (8), 862-868 (2018).
- Hubert, C. G., et al. A three-dimensional organoid culture system derived from human glioblastomas recapitulates the hypoxic gradients and cancer stem cell heterogeneity of tumors found in vivo. Cancer Res. 76 (8), 2465-2477 (2016).
- Jacob, F., et al. A patient-derived glioblastoma organoid model and biobank recapitulates inter- and intra-tumoral heterogeneity. Cell. 180 (1), 188-204 (2020).
- Nickl, V., et al. Glioblastoma-derived three-dimensional ex vivo models to evaluate effects and efficacy of tumor treating fields (TTFields). Cancers (Basel). 14 (21), 5177 (2022).
- Klein, E., Hau, A. C., Oudin, A., Golebiewska, A., Niclou, S. P. Glioblastoma organoids: pre-clinical applications and challenges in the context of immunotherapy. Front Oncol. 10, 604121 (2020).
- Golebiewska, A., et al. Patient-derived organoids and orthotopic xenografts of primary and recurrent gliomas represent relevant patient avatars for precision oncology. Acta Neuropathol. 140 (6), 919-949 (2020).
- Bougnaud, S., et al. Molecular crosstalk between tumour and brain parenchyma instructs histopathological features in glioblastoma. Oncotarget. 7 (22), 31955-31971 (2016).
- Chua, C. W., et al. Single luminal epithelial progenitors can generate prostate organoids in culture. Nat Cell Biol. 16 (10), 951-954 (2014).
- Collingridge, G. L. The brain slice preparation: a tribute to the pioneer Henry McIlwain. J Neurosci Methods. 59 (1), 5-9 (1995).
- Kato, H., Ogawa, T. A technique for preparing in vitro slices of cat's visual cortex for electrophysiological experiments. J Neurosci Methods. 4 (1), 33-38 (1981).
- Teyler, T. J. Brain slice preparation: hippocampus. Brain Res Bull. 5 (4), 391-403 (1980).
- Schulz, E., et al. Preparation and culture of organotypic hippocampal slices for the analysis of brain metastasis and primary brain tumor growth. Methods Mol Biol. 2294, 59-77 (2021).
- Driehuis, E., Gracanin, A., Vries, R. G. J., Clevers, H., Boj, S. F. Establishment of pancreatic organoids from normal tissue and tumors. STAR Protoc. 1 (3), 100192 (2020).
- Driehuis, E., et al. Pancreatic cancer organoids recapitulate disease and allow personalized drug screening. Proc Natl Acad Sci U S A. 116 (52), 26580-26590 (2019).
- Neal, J. T., et al. Organoid modeling of the tumor immune microenvironment. Cell. 175 (7), 1972-1988 (2018).
- Li, X., et al. Oncogenic transformation of diverse gastrointestinal tissues in primary organoid culture. Nat Med. 20 (7), 769-777 (2014).
- Ootani, A., et al. Sustained in vitro intestinal epithelial culture within a Wnt-dependent stem cell niche. Nat Med. 15 (6), 701-706 (2009).
- Zhao, Z., et al. Organoids. Nat Rev Methods Primers. 2, 94 (2022).
- Toh, Y. C., et al. A novel 3D mammalian cell perfusion-culture system in microfluidic channels. Lab Chip. 7 (3), 302-309 (2007).
- Zhang, C., Zhao, Z., Abdul Rahim, N. A., van Noort, D., Yu, H. Towards a human-on-chip: culturing multiple cell types on a chip with compartmentalized microenvironments. Lab Chip. 9 (22), 3185-3192 (2009).
- Homan, K. A., et al. Flow-enhanced vascularization and maturation of kidney organoids in vitro. Nat Methods. 16 (3), 255-262 (2019).
- Huh, D., et al. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
- Kengla, C., Atala, A., Sang Jin, L. Bioprinting of organoids. Essentials of 3D Biofabrication and Translation. , 271-282 (2015).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados