Avaliação em tempo real de Ca2+ absoluto, citosólico, livre e contratilidade correspondente em vasos linfáticos isolados e pressurizados
Neste Artigo
Resumo
Este protocolo descreve um método para medir simultaneamente o diâmetro citosólico, de cálcio livre [Ca2+]i e do vaso em vasos linfáticos em contração em tempo real e, em seguida, calcular as concentrações absolutas de Ca2+ , bem como os parâmetros de contratilidade/ritmidade. Este protocolo pode ser usado para estudar Ca2+ e dinâmica contrátil em uma variedade de condições experimentais.
Resumo
A vasculatura linfática, agora muitas vezes referida como "a terceira circulação", está localizada em muitos sistemas de órgãos vitais. A principal função mecânica da vasculatura linfática é devolver o fluido dos espaços extracelulares de volta aos ductos venosos centrais. O transporte linfático é mediado por contrações rítmicas espontâneas dos vasos linfáticos (VEs). As contrações do VE são amplamente reguladas pelo aumento e queda cíclicos do cálcio livre citosólico ([Ca2+]i).
Este trabalho apresenta um método para calcular simultaneamente as mudanças nas concentrações absolutas de [Ca2+]i e contratilidade/ritmicidade do vaso em tempo real em LVs isolados e pressurizados. Usando LVs mesentéricos isolados de ratos, estudamos mudanças em [Ca2+]i e contratilidade/ritmicidade em resposta à adição de drogas. Os LVs isolados foram carregados com o indicador raciométrico sensor de Ca2+ Fura-2AM, e a microscopia de vídeo acoplada ao software de detecção de bordas foi usada para capturar [Ca2+]i e medições de diâmetro continuamente em tempo real.
O sinal Fura-2AM de cada VE foi calibrado para o sinal mínimo e máximo para cada vaso e usado para calcular o [Ca] 2+]i absoluto. As medidas de diâmetro foram usadas para calcular os parâmetros contráteis (amplitude, diâmetro diastólico final, diâmetro sistólico final, fluxo calculado) e ritmicidade (frequência, tempo de contração, tempo de relaxamento) e correlacionadas com medidas absolutas [Ca2+]i .
Introdução
A vasculatura linfática é encontrada em muitos sistemas de órgãos, incluindo cérebro, coração, pulmões, rins e mesentério 1,2,3,4,5,6, e opera impulsionando fluido (linfa) dos espaços intersticiais para os ductos venosos centrais para manter a homeostase do fluido 7,8,9,10. Começa com capilares linfáticos cegos dentro dos leitos capilares vasculares que drenam para os vasos linfáticos coletores (VEs). Os VEs coletores são constituídos por duas camadas de células: uma camada de células endoteliais englobada por uma camada de células musculares linfáticas (LMCs)10,11. O transporte de fluido linfático é obtido por meio de forças extrínsecas (por exemplo, formação de nova linfa, pulsações arteriais, flutuações da pressão venosa central) e forças intrínsecas12.
A força intrínseca para o transporte linfático é a contração rítmica espontânea dos VE coletores, que é o foco da maioria dos estudos que investigam a função linfática. Esta bomba linfática intrínseca é regulada principalmente pelo aumento e queda cíclico de Ca2+ livre citosólico ([Ca2+]i). A despolarização espontânea da membrana plasmática em LMCs ativa os canais de Ca2+ (Cav1.x) "tipo L" dependentes de voltagem, desencadeando o influxo de Ca2+ e subsequente contração rítmica do VE 8,9,10. Esse papel foi demonstrado pelo bloqueio de Cav1.x com agentes específicos, como a nifedipina, que inibiu as contrações do VE e causou dilatação dos vasos13,14. O aumento transitório de [Ca2+]i ou "pico de Ca2+" nos LMCs mediado pelos canais de Cav1.x também pode mobilizar estoques intracelulares de Ca2+ ativando receptores de trifosfato de inositol (IP3) e receptores de rianodina (RyRs) no retículo sarcoplasmático (SR)15,16,17,18. As evidências atuais sugerem que os receptores IP3 contribuem com mais Ca2+ necessário para contrações normais do VE em comparação com RyRs 15,16,19,20,21; no entanto, os RyRs podem desempenhar um papel durante a patologia ou em resposta à intervenção farmacêutica 17,18. Além disso, a ativação dos canais de K+ ativados por Ca2+ 22 e dos canais de potássio sensível ao ATP (KATP)23,24 pode hiperpolarizar a membrana do LMC e inibir a atividade contrátil espontânea.
Existem muitos outros canais iônicos e proteínas que podem regular a dinâmica do Ca2+ na coleta de LVs. A utilização de métodos para estudar as alterações no Ca2+ e na contratilidade dos vasos em resposta a agentes farmacológicos em tempo real é importante para entender esses potenciais reguladores. Um método anterior usando Fura-2 para medir mudanças relativas no VE [Ca2+]i foi descrito25. Como a constante de dissociação para Fura-2 e Ca2+ é conhecida26, é possível calcular as concentrações reais de Ca2+, o que amplia a aplicação desse método e fornece informações adicionais sobre a sinalização de Ca2+ , excitabilidade da membrana e mecanismos de contratilidade27, além de permitir comparações de linha de base entre grupos experimentais. Esta última abordagem tem sido utilizada em cardiomiócitos28 e, portanto, pode ser adaptada aos VEs. Este artigo apresenta um método aprimorado que combina essas duas abordagens para medir e calcular mudanças no [Ca2+]i absoluto, bem como na contratilidade/ritmicidade do vaso continuamente em tempo real em LVs isolados e pressurizados. Também fornecemos resultados representativos para LVs tratados com nifedipina.
Protocolo
Ratos Sprague-Dawley machos de nove a 13 semanas de idade foram comprados de um fornecedor comercial. Após a chegada, todos os ratos foram alojados e mantidos nas instalações da Divisão de Medicina de Animais de Laboratório (DLAM) da Universidade de Arkansas para Ciências Médicas (UAMS) em uma dieta de laboratório padrão e expostos a 12 h de ciclo claro: escuro a 25 oC. Todos os procedimentos foram realizados de acordo com o protocolo de uso de animais aprovado #4127 pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) da UAMS.
1. Dissecção e canulação de VE mesentérico
NOTA: É importante configurar a câmara de perfusão antes do isolamento dos VE mesentéricos para garantir que não haja interrupção do fluxo ou vazamento que interrompa o experimento.
- Preparação do banho de perfusão
- Compre micropipetas de vidro borossilicato (1,2 mm de diâmetro externo, 0,68 mm de diâmetro interno e puxadas para um diâmetro de ponta externa de 75-100 μm) de um fornecedor comercial. Corte e polir micropipetas (também conhecidas como cânulas) com aproximadamente 1-2 cm de comprimento para montagem na câmara de perfusão do vaso isolado.
- Conecte cada cânula de vidro montada na câmara de perfusão do vaso a transdutores de pressão independentes situados em linha com reguladores de pressão independentes alimentados por gravidade usando tubos de polietileno.
NOTA: Isso permite a manipulação independente das pressões de entrada e saída, dependendo do projeto do estudo. A Figura 1 mostra essa configuração em detalhes. - Preencha a câmara de perfusão (5 mL), micropipetas de vidro e regulador de pressão independente alimentado por gravidade, juntamente com tubos de polietileno com solução salina fisiológica (PSS; 119 mM NaCl; 24 mM NaHCO3; 1,17 mM NaH2PO4; 4,7 mM KCl; 1,17 mM MgSO4; 5,5 mM C6H12O6 (glicose); 0,026 mM C10H16N2O8 (EDTA); e 1,6 mM CaCl2) desprovido de bolhas de ar. Em seguida, aperte a pressão para que as cânulas não sejam pressurizadas.
NOTA: O pH desta solução é ~ 7,5. Um pH de 7,4 é mantido no banho de perfusão utilizando o borbulhamento de CO2 para atuar no sistema tampão de bicarbonato dentro do PSS, conforme descrito na etapa 1.3.7. O EDTA é usado aqui para quelar o excesso de íons Ca2+ .
- Preparação de nós
- Amarre nós duplos sob o microscópio usando fio de sutura de seda trançada (tamanho 8-0). As principais etapas são ilustradas na Figura 2.
- Separe um único filamento.
- Use duas pinças Dumont # 5 com pontas microembotadas e, usando uma pinça, faça um laço duplo ao redor da ponta da outra pinça.
- Com a pinça em laço, pegue a ponta solta da sutura e puxe-a pelas duas alças, certificando-se de não fechar o nó completamente e deixando uma pequena abertura.
- Use uma tesoura de mola Vanna para cortar o excesso de sutura de ambos os lados. Use esses nós posteriormente para prender o VE nas cânulas.
NOTA: Não use a mesma pinça com a qual você irá dissecar ou canular, pois há mais perigo de danificar as pontas das pinças durante a amarração do nó.
- Amarre nós duplos sob o microscópio usando fio de sutura de seda trançada (tamanho 8-0). As principais etapas são ilustradas na Figura 2.
- Isolamento e canulação de VE mesentérico
- Anestesiar profundamente os animais administrando isoflurano a 5% com overdose de 1,5 L/min O2 e exsanguinar por decapitação.
- Isole mesentérios inteiros para dissecção de VEs mesentéricos, primeiro fazendo um corte longitudinal ao longo da linha média da parede abdominal, exteriorizando o mesentério e, em seguida, cortando a conexão logo abaixo do esfíncter pilórico e ~ 2-3 cm acima do ceco, bem como a conexão com o reto.
- Lave os mesentérios inteiros dissecados em 200 mL de PSS gelado e, em seguida, transfira e prenda em uma placa de Petri revestida de silicone (8-10 mm) (100 mm) contendo PSS gelado.
- Disseque os LVs mesentéricos de segunda ordem da gordura circundante e do tecido conjuntivo usando um estereomicroscópio, uma pinça fina Dumont #5 Inox de dissecção e uma tesoura de mola Vanna. Para ajudar a identificar as extremidades dos VEs, uma vez removidos do tecido, deixe um pequeno pedaço de gordura na extremidade proximal do VE.
- Transfira os VEs dissecados para a câmara de perfusão do vaso para canulação em cânulas de vidro.
- Use duas pinças finas Dumont # 5 Inox pré-afiadas, ponta reta (0,05 x 0,01 mm) para canular os VE com a extremidade distal do VE na cânula P1 (entrada) e a extremidade proximal do vaso na cânula P2 (saída) para imitar a direção do fluxo linfático.
NOTA: As cânulas P1 e P2 são idênticas e diferem apenas pela extremidade do VE conectada. É importante usar uma pinça que se encaixe perfeitamente na ponta e sem danos para facilitar a preensão da parede fina do vaso.- Deslize um único nó amarrado em cada cânula de vidro para depois prender o vaso nas cânulas.
- Usando o pequeno pedaço de gordura para ajudar a orientar a direção do VE, primeiro canule a extremidade distal em P1.
- Deslize o nó pela cânula e aperte para prender o LV. Certifique-se de não apertar demais e quebrar a ponta da cânula.
- Pressurize o VE a 4-5 mm Hg na câmara de perfusão.
NOTA: Para nossos propósitos, definimos a pressão P1 e P2 como iguais; no entanto, dependendo das condições experimentais, a pressão pode ser ajustada em cada cânula para induzir tensão de cisalhamento ou refluxo. - Repita as etapas 1.3.6.1-1.3.6.4 para caninar a extremidade proximal do VE em P2.
- Coloque a pedra borbulhante com 7% de dióxido de carbono (CO2)/93% de oxigênio (O2) na câmara de banho para manter o pH fisiológico.
- Conecte a câmara ao regulador de temperatura e ajuste-a a 37 oC para que os LVs se equilibrem e desenvolvam contrações estáveis e espontâneas (aproximadamente 30 min).
NOTA: A Figura 1 mostra essa configuração em detalhes.
2. Medição das concentrações absolutas de [Ca2+]i em LV
- Coloração Fura-2AM de VE canulado
- Após o desenvolvimento de contrações espontâneas (a partir da etapa 1.3.8), incube os LVs com éster Fura-2-acetoximetílico (Fura-2AM; 2 μM ou 10 μL / 5 mL) e ácido plurônico (PA; 0,02% P / V ou 5 μL / 5 mL de 20% PA) por 30 min no escuro.
NOTA: Após a adição do Fura-2AM, todas as etapas restantes devem ser executadas no escuro. - Após 30 min, troque a solução na câmara de perfusão 3x, esvaziando todo o volume do banho com vácuo de pressão negativa, substituindo-o por PSS sem reagente de temperatura correspondente (37 oC).
NOTA: Isso deve ser feito rapidamente para minimizar o tempo em que o LV fica suspenso no ar. Use as duas mãos, por exemplo, a mão direita para vácuo e a mão esquerda para substituir o novo PSS sem reagentes. - Após a lavagem, incube LVs por 15 minutos no escuro para remover o excesso de indicador e permitir a desesterificação.
- Após o desenvolvimento de contrações espontâneas (a partir da etapa 1.3.8), incube os LVs com éster Fura-2-acetoximetílico (Fura-2AM; 2 μM ou 10 μL / 5 mL) e ácido plurônico (PA; 0,02% P / V ou 5 μL / 5 mL de 20% PA) por 30 min no escuro.
- Capturando Ca2+ fluorescência e diâmetro do vaso
- Transfira a câmara para a platina de microscópio fluorescente invertida equipada com uma fonte de luz LED, uma objetiva S Fluor 20x, um adaptador de enquadramento de célula e um sistema de câmera de vídeo CMOS rápido, que permite a captura de fluorescência quadro a quadro a 15 Hz.
NOTA: Um esquema dessa configuração de fluxo de trabalho é apresentado na Figura 3. O sinal de Ca2+ pode ser capturado usando uma câmera CCD com pelo menos 15 fps. - Conecte o microscópio ao computador equipado com software de imagem para registrar a fluorescência e a detecção de bordas.
NOTA: O software referenciado também permite o registro simultâneo da pressão; no entanto, isso não está incluído aqui. - Ligue a fonte de luz LED e a interface do sistema fluorescente.
NOTA: As instruções de software descritas aqui são para o software referenciado, mas outro software pode ser usado para obter esses dados. - Abra o software (IonWizard).
- Na guia Arquivo , selecione Novo.
- Na guia Coletar , selecione Experimento.
- Carregue o modelo experimental desejado e clique em OK.
NOTA: Você precisará configurar um modelo experimental com os parâmetros a serem medidos. As instruções para a configuração do modelo podem ser encontradas no manual do software29. - Ajuste os traços na tela para ver o diâmetro do vaso, o numerador (sinal 340), o denominador (sinal 380) e a proporção em ordem decrescente.
- Ajuste a escala do eixo y conforme necessário para ajudar a visualizar os traços.
- Em Rastreamentos, selecione Editar Limites de Usuário. Certifique-se de que a opção Limites automáticos esteja desmarcada.
- Selecione o parâmetro que deseja ajustar, insira os valores mínimo e máximo para o eixo e, em seguida, selecione OK.
- Para iniciar o experimento, clique em INICIAR (na parte inferior da tela).
- Para medir o diâmetro do VE simultaneamente, use o software de detecção de borda incorporado ao sistema de imagem, que gera traços contráteis de VEs a 3 Hz. Use essas medidas para analisar os parâmetros contráteis e de ritmicidade descritos na seção 3 e mostrados na Figura 4.
- Certifique-se de ajustar a iluminação para que a parede de BT apareça como linhas escuras.
- Selecione uma região de interesse (ROI) desprovida de gordura e detritos. Depois que o experimento for iniciado, não mova esse ROI.
- Certifique-se de que o limite esteja definido para que a borda da parede do vaso seja detectada durante todo o ciclo de contração.
- Para medições de fluorescência, ligue o Tubo Fotomultiplicador (PMT).
- Excite o Fura-2, um indicador raciométrico, alternando comprimentos de onda de 340 e 380 nm em exposições de 50 ms usando iluminadores LED e capture os espectros de emissão a 510 nm a 15 Hz em todo o campo de imagem.
NOTA: É importante manter todos os parâmetros ópticos (configurações de excitação, filtros de emissão, lente objetiva e espelhos dicróicos) iguais por toda uma série de experimentos para obter medições reprodutíveis de Ca2+ . - Meça a relação sinal-fundo obtendo primeiro a fluorescência 340 e 380 com o LV no meio do campo de visão (sinal) e, em seguida, usando os manipuladores de platina para mover o campo de visão para a borda do banho sem vaso (tomando cuidado para evitar a borda revestida de silicone e / ou removendo quaisquer detritos do banho) para capturar o fundo.
NOTA: É importante navegar de volta à seção original do vaso todas as vezes para medições de Ca2+ . - Troque a solução do banho por PSS sem reagentes de temperatura compatível para remover o indicador de excesso no banho. Pode levar várias trocas de banho para remover o excesso de Fura-2, portanto, repita essa troca até que a proporção sinal/fundo seja de aproximadamente 10:1.
- Registre o sinal de fluorescência Fura-2 basal e as contrações espontâneas por aproximadamente 30 minutos, seguido por uma resposta de concentração cumulativa de nifedipina (NIF; 0,1-100 nM), um antagonista Cav1.x dependente de voltagem. Obtenha medições de fundo para cada concentração de medicamento.
- No final de cada experimento, lave os LVs com PSS livre de Ca2+ compatível com a temperatura para obter o sinal de fluorescência mínimo de Fura-2 (Rmin) e o diâmetro máximo dos LVs na ausência de Ca2+. Certifique-se de medir o plano de fundo.
NOTA: O PSS livre de Ca2+ tem a mesma composição que o PSS, mas sem CaCl2, e o EDTA é substituído por 1 mM EGTA (C14H24N2O10) (pH ~ 7,5). - Troque a solução do banho por PSS de temperatura correspondente contendo 10 mM de Ca2+ e ionomicina (10 μM de IONO), um ionóforo de Ca2+ , para obter o sinal de fluorescência máximo de Fura-2 (Rmax) e o diâmetro mínimo dos LVs em condições de saturação de Ca2+. Certifique-se de medir o plano de fundo.
- Transfira a câmara para a platina de microscópio fluorescente invertida equipada com uma fonte de luz LED, uma objetiva S Fluor 20x, um adaptador de enquadramento de célula e um sistema de câmera de vídeo CMOS rápido, que permite a captura de fluorescência quadro a quadro a 15 Hz.
- A fórmula para medir o absoluto [Ca2+]i
- Utilizar Rmin e Rmax para calibrar a relação entre os comprimentos de onda de 340 e 380 nm e calcular a concentração citosólica absoluta de Ca2+ livre ([Ca2+]i).
- Calcular a concentração absoluta de Ca 2+ livre citosólico ([Ca2+]i) utilizando a equação (1)26:
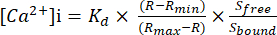 Características (1)
Características (1)
Onde Kd = 225 nM (constante de dissociação para Fura-2)26, R = razão 340/380, razão Rmin = 340/380 na ausência de Ca2+, Rmax = razão 340/380 com condições de saturação de Ca2+, Slivre = sinal 380 na ausência de Ca2+,limite S = sinal 380 com condições de saturação de Ca2+
NOTA: Todos os sinais fluorescentes foram corrigidos para fluorescência de fundo. - A Figura 5 é um exemplo de traço de Ca2+ detalhando quais parâmetros são registrados. Defina a linha de base Ca2+ como o Ca2+ em repouso mais baixo antes do pico de Ca2+ e o pico de Ca2+ como o Ca2+ mais alto alcançado durante o pico de Ca2+ . A amplitude é a diferença entre o pico e a linha de base Ca2+. Exporte todos os parâmetros diretamente do software de imagem, exceto a frequência do pico de Ca2+ , que deve ser calculada offline como o número de picos/s de Ca2+ . Abaixo estão as principais etapas do software referenciado para obter esses parâmetros.
NOTA: Traços inteiros podem ser exportados para um arquivo .txt e todos os parâmetros podem ser analisados ou calculados no software de sua escolha. - Para Rmin, realce a seção do traço do numerador que corresponde ao plano de fundo durante o PSS livre de Ca2+. Uma caixa de diálogo será aberta e fornecerá os valores para essa parte do rastreamento.
- Em Operações, selecione Constantes.
- Selecione o plano de fundo numérico de cálcio e insira os números de plano de fundo para o numerador e o denominador da etapa anterior. Clique em OK.
- Realce a seção do traço de razão que corresponde à proporção mais baixa durante o PSS livre de Ca2+. Isso é Rmin. Anote também o valor do Denominador para esta seção; isso éS livre.
- Repita as etapas 2.3.4 a 2.3.7 para Rmax e Sligados à seção do traço que corresponde a PSS livre de Ca2+ alto e proporção mais alta.
- Em Operações, selecione Constantes.
- Selecione Calibração de cálcio-cálcio e insira os valores listados na Equação 1. Clique em OK.
- Ajuste um dos traços na tela conforme descrito na Etapa 2.2.8 para que você possa ver Cálcio-Numérico subtraído Cálcio.
- Execute uma análise transitória monotônica para adquirir os parâmetros restantes. As instruções para isso podem ser encontradas no manual do software30.
- Como alternativa, em Exportar, selecione Rastreamento atual.
- Selecione o local para o qual deseja exportar o arquivo .txt e clique em OK.
NOTA: Certifique-se de clicar no rastreamento individual que deseja exportar. Você pode exportar o rastreamento inteiro ou as seções selecionadas do rastreamento.
3. Medição da contratilidade e ritmicidade do VE
- O software de detecção de bordas incorporado ao sistema de imagem gera traços contráteis para medições do diâmetro do VE, conforme descrito acima. Use essas medições para analisar parâmetros contráteis e de ritmitidade. A Figura 4 é um exemplo de traço contrátil detalhando quais parâmetros contráteis devem ser registrados. Exporte todos os parâmetros diretamente do software de imagem usando a função Análise de transientes monotônicos no traço de diâmetro30, exceto frequência de contrações, fluxo calculado e intervalo, que devem ser calculados offline.
NOTA: Traços inteiros podem ser exportados para um arquivo .txt e todos os parâmetros podem ser analisados ou calculados no software de sua escolha usando as equações abaixo. - EDD, ESD, amplitude, frequência e medições de vazão calculadas
- Meça os diâmetros máximo e mínimo (diâmetro diastólico final [EDD] e diâmetro sistólico final [ESD], respectivamente) que os VE podem atingir durante suas contrações rítmicas e espontâneas.
- Calcule a amplitude das contrações (AMP) como a diferença entre EDD e ESD.
- Calcule a frequência como o número de contrações por período de medição (em s).
- Calcular o caudal calculado por μm utilizando a equação (2):
Fluxo calculado = π/4(EDD2- ESD2)F (2)
Onde EDD2 = área da seção transversa do vaso durante o estado relaxado, ESD2 = medida da área da seção transversa do vaso durante a constrição, F = frequência de contrações/s
- Ritmica: tempo de contração e relaxamento:
- Outras medidas de ritmicidade do VE são o tempo de contração e o tempo de relaxamento.
- Defina o tempo de contração como o tempo que o VE leva para atingir a DEP a cada contração.
- Defina o tempo de relaxamento como o tempo que o VE leva para atingir o EDD para cada relaxamento, o que dará uma indicação geral de ritmicidade correlacionada com [Ca2+]i absoluto dentro de um período de tempo específico.
- Calcule o tempo de intervalo (ΔT) a partir da equação (3).
Δt = t2 (ESD2)-t1 (ESD1) (3)
Resultados Representativos
A contratilidade dos VEs e as alterações correspondentes no Ca 2+ livre citosólico ([Ca2+]i) foram avaliadas em VEs mesentéricos isolados de ratos após exposição a concentrações variáveis de nifedipina (NIF; 0,1-100 nM) (Figura 6). Os parâmetros, incluindo amplitude de pico de Ca2+, Cabasal 2+ e pico de Ca2+, exibiram uma redução dependente da concentração com a adição incremental de NIF à câmara de perfusão (Figura 7A). Concomitantemente, parâmetros contráteis, como amplitude de contração e fluxo calculado, também demonstraram uma diminuição gradual (Figura 7B). Houve um pequeno aumento no diâmetro do EDD com NIF (Figura 7B). A frequência de pico e a frequência de contração de Ca2+ parecem ser uma resposta de tudo ou nada. No entanto, esse efeito ocorreu a 10 nM para um VE, enquanto todos os VE cessaram as contrações em 100 nM. Assim, os dados combinados geram gráficos que se assemelham a uma resposta de concentração graduada. Esse efeito é consistente com publicações anteriores que usaram NIF em VEs em outras preparações (miografia de fio e pressão13,14). Os gráficos de Manhattan mostram as respostas individuais do VE para medidas de ritmicicidade, incluindo intervalo, tempo de contração e tempo de relaxamento (Figura 7C). Esse tipo de representação de dados permite que o pesquisador identifique essas respostas de tudo ou nada ou variabilidade nos ritmos de contração para fornecer informações adicionais sobre os mecanismos subjacentes. Em última análise, as diminuições na amplitude e frequência de contração resultaram em uma redução no fluxo calculado através desses LVs isolados, que serve como um indicador substituto para a função in vivo. No geral, o declínio na contratilidade do VE correlacionou-se com a redução de [Ca2+]i. Nossos achados fornecem evidências diretas de que, dentro da faixa de 100 nM, o NIF efetivamente interrompeu as contrações e as oscilações de [Ca2+]i nos LVs, antagonizando os canais de Cav1.x presentes nas células musculares linfáticas (LMCs).
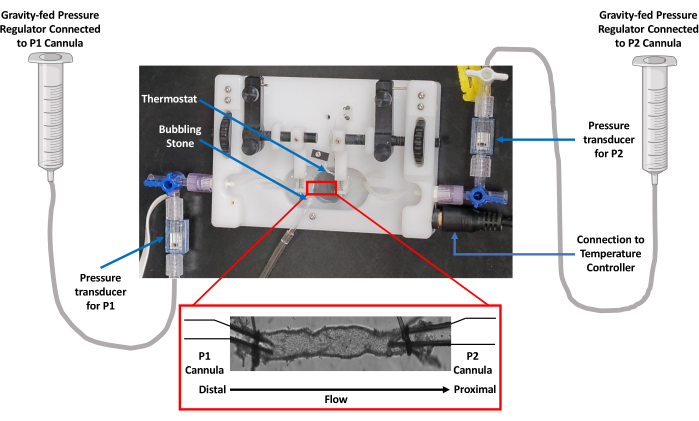
Figura 1: Imagem da configuração da câmara isolada do vaso. Os estudos de perfusão dos vasos utilizaram uma câmara isolada equipada com um termorregulador. A gravidade foi usada para controlar a pressão por meio de um reservatório PSS. A pressão foi monitorada por transdutores conectados às cânulas de entrada (P1) e saída (P2). Abreviatura: PSS = solução salina fisiológica. Clique aqui para ver uma versão maior desta figura.

Figura 2: Preparação do nó em resumo. (A) Preparação de alça dupla sob o microscópio de dissecção usando um único filamento de fio de sutura de seda de 3 camadas, (B) agarrando a ponta solta e puxando-a através de ambas as alças, (C) puxando o nó de ambas as extremidades para manter uma pequena abertura, e (D) cortando o excesso de filamento de ambos os lados e a caixa azul mostrando um nó duplo completo pronto para usar. Barra de escala = 1,5 mm. Clique aqui para ver uma versão maior desta figura.
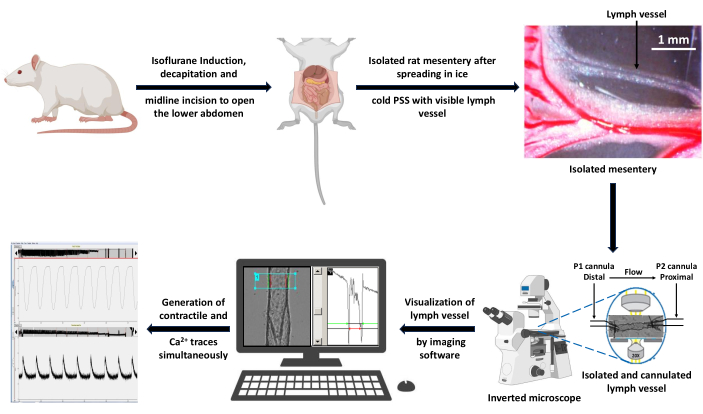
Figura 3: Esquema do fluxo de trabalho experimental para aquisição de dados. Um rato saudável foi anestesiado com indução de isoflurano a 5% e a decapitação foi realizada para remover o sangue do tronco. Uma incisão na linha média foi realizada para expor e isolar o mesentério. O mesentério isolado foi espalhado em solução de PSS gelada e um VE foi dissecado livre de gordura para canulação em uma câmara de perfusão de vasos isolados. O banho foi colocado no palco do microscópio invertido usando uma lente objetiva de 20x. O vaso foi excitado alternadamente com luz de comprimento de onda de 340 e 380 nm e os espectros fluorescentes de emissão foram coletados usando uma câmera CCD a 510 nm. O computador conectado ao microscópio gerou os traços contráteis e de Ca2+ usando um software de captura de fluorescência e detecção de bordas. Barra de escala = 1 mm. Abreviaturas: PSS = solução salina fisiológica; VE = vaso linfático; CCD = dispositivo de carga acoplada. Clique aqui para ver uma versão maior desta figura.
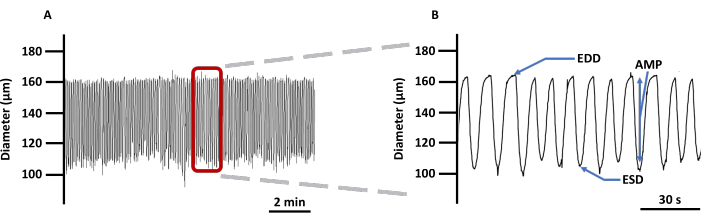
Figura 4: Traço contrátil representativo do VE. (A) Exemplo de registro de alterações no diâmetro de VEs canulados carregados com indicador de imagem Ca2 + Fura 2 AM em PSS e (B) um traço ampliado para mostrar todos os parâmetros relacionados à contratilidade do vaso: EDD, ESD, AMP e frequência. Esses valores foram usados para calcular a ritmicidade e o fluxo. Abreviaturas: PSS = solução salina fisiológica; VE = vaso linfático; EDD = diâmetro diastólico final; DEP = diâmetro sistólico final; AMP = amplitude. Clique aqui para ver uma versão maior desta figura.
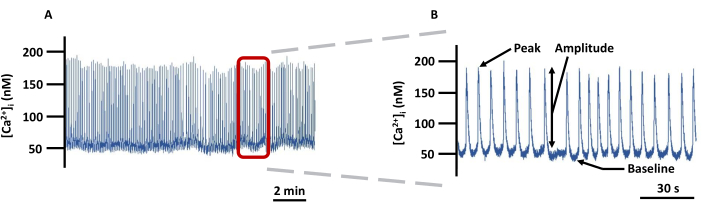
Figura 5: Traçado de imagem representativo do VE Ca2+ . (A) Exemplo de registro de alterações no [Ca2+]i absoluto em LVs canulados carregados com Fura-2 em PSS e (B) um traço ampliado para mostrar todos os parâmetros (Pico, Amplitude e Linha de Base) relacionados a [Ca2+]i (não corrigido pelo fundo). Abreviatura: PSS = solução salina fisiológica. Clique aqui para ver uma versão maior desta figura.
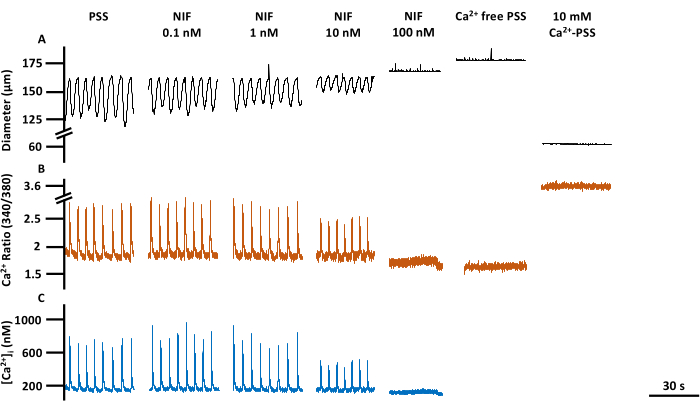
Figura 6: Contratilidade do VE e imagem de Ca2+ em resumo. Traços representativos correspondentes ao diâmetro (A), (B) relação 340/380 e (C) absoluto [Ca2+]i da linha de base PSS, nifedipina, um antagonista do canal Cav1.x (Ca2+), resposta de concentração, incluindo Rmin e Rmax. Abreviaturas: PSS = solução salina fisiológica; VE = vaso linfático; NIF = nifedipina; Rmin = sinal mínimo de fluorescência Fura-2; Rmax = sinal máximo de fluorescência Fura-2. Clique aqui para ver uma versão maior desta figura.
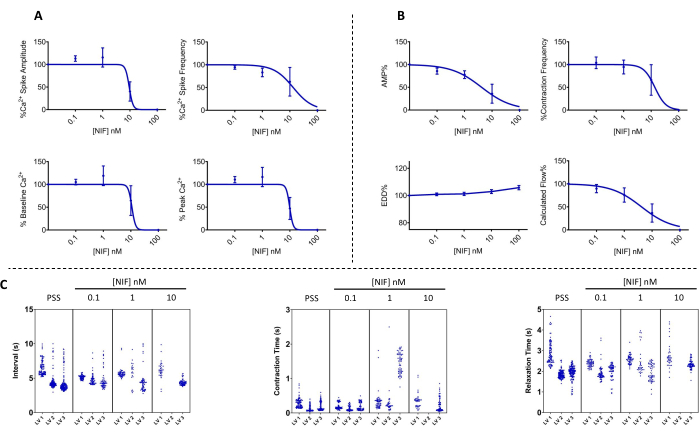
Figura 7: Oscilação de Ca2+ e contratilidade correspondente bloqueada pela nifedipina em LVs. Os parâmetros contráteis (A) de Ca2+ (n = 3) e (B) diminuíram de maneira dependente da concentração com a adição de nifedipina, um antagonista do canal Cav1.x (Ca2+) dependente de voltagem. (C) Os gráficos representativos de Manhattan mostram o intervalo de tempo médio (Δt) entre as contrações e os tempos de contração e relaxamento. Dados apresentados como média ± EPM. Abreviaturas: PSS = solução salina fisiológica; VE = vaso linfático; NIF = nifedipina; EDD = diâmetro diastólico final; AMP = amplitude. Clique aqui para ver uma versão maior desta figura.
Discussão
Devido à natureza frágil e diminuta dos LVs, é imperativo ter o máximo cuidado durante os processos de dissecção e canulação. Mesmo pequenos danos ao vaso podem levar ao desenvolvimento de um VE inviável ou dar origem a anormalidades nos transientes de [Ca2+]i . A consistência nas configurações de excitação é igualmente crucial ao longo de toda a série experimental para garantir a comparabilidade nas medições de [Ca2+]i entre os grupos controle e tratado. A falha em manter configurações uniformes representa um risco substancial de superestimar ou subestimar [Ca2+]i em todos os navios dentro de uma série experimental. Da mesma forma, é igualmente importante identificar e monitorar com precisão a mesma região do vaso em cada experimento.
O uso do indicador raciométrico Fura-2AM normaliza as variações de fluorescência causadas por espessura irregular do tecido, distribuição/vazamento de fluoróforo ou fotobranqueamento, problemas comuns com corantes de comprimento de onda único. 31 Isso permite o monitoramento contínuo descrito neste protocolo. No entanto, como o Fura-2 funciona quelatando Ca2+, é possível sobrecarregar os LVs e reduzir o [Ca2+]i disponível para contração ou resposta a medicamentos. Nesses casos, picos de Ca2+ ainda podem ser observados enquanto as contrações rítmicas estão ausentes. A variação do comprimento do VE também pode contribuir para esse fenômeno. Embora essas medições de Ca2+ provavelmente ainda possam ser válidas, pode ser necessário reduzir a concentração de Fura-2AM em configurações replicadas para obter com sucesso as medições de Ca2+ e diâmetro. Nossos resultados incluem apenas LVs para os quais os picos de Ca2+ e as contrações rítmicas estavam presentes no início do estudo.
A medição de Rmin e Rmax são etapas críticas no cálculo do [Ca2+]i absoluto. Como Rmin deve ser a razão Fura-2 na ausência de Ca2+, uma alta concentração de EGTA foi adicionada ao PSS livre de Ca2+ para garantir a quelação de qualquer Ca2+ residual. Estudos iniciais foram conduzidos com EDTA no PSS livre de Ca2+, e isso resultou em contrações esporádicas dos vasos com picos de Ca2+ correspondentes. Para Rmax, uma alta concentração de Ca2+ foi adicionada ao PSS junto com um ionóforo, ionomicina, para maximizar o sinal [Ca2+]i . A solução com alto teor de Ca2+ pode precipitar, o que pode exigir a remoção do EDTA do PSS. É importante ressaltar que essas medições adicionais de Rmin e Rmax fornecem a oportunidade de avaliar mudanças fisiologicamente relevantes em [Ca2+]i, o que pode fornecer informações sobre a excitabilidade da membrana e mecanismos de contratilidade27 , bem como permitir comparações de linha de base entre grupos experimentais em comparação com protocolos que relatam apenas a proporção 340/380 para Fura-2. A falha em atingir valores adequados de Rmin e Rmax impede a capacidade de calcular [Ca2+]i absoluto.
Devido à natureza contrátil dos VEs, esse método só pode fornecer uma medida dos níveis globais de Ca2+, em vez de eventos locais de liberação de Ca2+ que podem ser medidos em vasos paralisados32. No entanto, este método é vantajoso para correlacionar mudanças na dinâmica absoluta [Ca2+]i com a contratilidade em comparação com métodos que usam vasos paralisados ou células individuais28,32. Para esta abordagem, assume-se que a maior parte do Ca2+ medido se origina das células do músculo linfático. No entanto, as células endoteliais, que também estão presentes nesses VE isolados, podem contribuir para o sinal total de Ca2+ observado33. Essa contribuição pode ser estimada usando VE despojados de endotélio34. As contrações do VE também podem resultar no deslocamento da parede do vaso ligeiramente para dentro e para fora de foco durante o ciclo de contração. Portanto, é importante usar segmentos de vasos curtos que possam ser esticados, mas sem esticar o vaso.
Além de sua aplicação em LVs, esse método pode ser usado para estudar vasos isolados de outros leitos vasculares, incluindo arteríolas e veias, e é promissor para utilização potencial em neurobiologia e outros ramos da biologia vascular. Explorar os efeitos de vários agonistas ou antagonistas direcionados a diferentes vias de transdução de sinal é outro caminho para investigar a dinâmica subjacente do Ca2+ . Além disso, essa técnica também pode ser utilizada para pesquisas comparativas envolvendo amostras de controle e tratadas dos respectivos animais. Além disso, essa abordagem é adaptável para implementação em nível celular, como em células musculares linfáticas isoladas, exigindo ajustes mínimos na câmara de perfusão e nas objetivas do microscópio. Em resumo, este método fornece informações fisiologicamente relevantes sobre a dinâmica global de Ca2+ , pois se correlaciona com a contratilidade e ritmicidade em LVs e fornece uma avaliação robusta de potenciais reguladores da dinâmica de Ca2+ na coleta de LVs.
Divulgações
Os autores não têm conflitos de interesse a divulgar.
Agradecimentos
Este trabalho foi apoiado pelos Institutos Nacionais de Saúde, incluindo o Instituto Nacional de Ciências Médicas Gerais, os Centros de Excelência em Pesquisa Biomédica (COBRE), o Centro de Estudos da Resposta do Hospedeiro à Terapia do Câncer [P20-GM109005], o Instituto Nacional do Câncer [1R37CA282349-01] e a Bolsa de Pré-Doutorado da American Heart Association [Número do Prêmio: 23PRE1020738; https://doi.org/10.58275/AHA.23PRE1020738.pc.gr.161089]. O conteúdo é de responsabilidade exclusiva dos autores e não representa necessariamente as opiniões oficiais do NIH ou da AHA. A Figura 1 e a Figura 3 foram criadas com BioRender.com.
Materiais
| Name | Company | Catalog Number | Comments |
| 20x S Fluor objective | Olympus Corporation of the Americas (Center Valley, PA, United States) | UPlanSApo | |
| Borosilicate glass micropipettes | Living Systems Instrumentation (Burlington, VT, United States) | GCP-75-100 | |
| Calcium chloride (CaCl2) | Fisher Bioreagents (Waltham, MA, United States) | BP510-500 | |
| Carbon dioxide (CO2) | nexAir (Memphis, TN, United States) | UN3156 | |
| Dissection forceps | Fine Science Tools (Foster City, CA, United States) | 11254-20 | |
| EDTA (C10H16N2O8) | Fisher Bioreagents (Waltham, MA, United States) | BP118-500 | |
| EGTA (C14H24N2O10) | Fisher Bioreagents (Waltham, MA, United States) | O2783-100 | |
| Fura-2AM | Invitrogen (Waltham, MA, United States) | F1221 | |
| Glucose (C6H12O6) | Fisher Bioreagents (Waltham, MA, United States) | D16-500 | |
| Gravity-Fed Pressure regulator | custom-made in the lab | ||
| Heating unit | Living Systems Instrumentation (Burlington, VT, United States) | TC-09S | |
| Imaging software | IonOptix (Westwood, MA, United States) | ||
| Inverted fluorescent microscope | Olympus Corporation of the Americas (Center Valley, PA, United States) | IX73 | |
| Ionomycin | Invitrogen (Waltham, MA, United States) | I24222 | |
| IonOptix Cell Framing Adaptor | IonOptix (Westwood, MA, United States) | 665 DXR | |
| Isoflurane | Piramal Critical Care (Telangana, India) | NDC 66794-017-10 | |
| Isolated vessel perfusion chamber | Living Systems Instrumentation (Burlington, VT, United States) | CH-1 | |
| Knot preparation forceps | Fine Science Tools (Foster City, CA, United States) | 11253-20 | |
| LED light source | Olympus Corporation of the Americas (Center Valley, PA, United States) | TL4 | |
| Magnesium sulfate (MgSO4) | Acros Organics (New Jersey, NJ, Unites States) | 213115000 | |
| MyoCam-S3 Fast CMOS video system | IonOptix (Westwood, MA, United States) | MCS300 | |
| Nifedipine | Sigma (St. Louis, MO, United States) | N7634 | |
| Ophthalmic sutures | |||
| Oxygen (O2) | nexAir (Memphis, TN, United States) | UN1072 | |
| Pluronic acid | Sigma (St. Louis, MO, United States) | P2443 | |
| Potassium chloride (KCl) | Fisher Bioreagents (Waltham, MA, United States | BP366-500 | |
| Pressure monitor system | Living Systems Instrumentation (Burlington, VT, United States) | PM-4 | |
| Pressure Transducer | Living Systems Instrumentation (Burlington, VT, United States) | PT-F | |
| Silicone-lined petri-dish | custom-made in the lab | ||
| Sodium bicarbonate (NaHCO3) | Fisher Bioreagents (Waltham, MA, United States | BP328-500 | |
| Sodium chloride (NaCl) | Fisher Bioreagents (Waltham, MA, United States | BP358-212 | |
| Sodium phosphate (NaH2PO4) | Fisher Bioreagents (Waltham, MA, United States | BP329-500 | |
| Sprague-Dawley rats | Envigo RMS (Indianapolis, IN, USA) | Male | 9-13 weeks old |
| Stereomicroscope | Leica Microsystems (Wetzlar, Germany) | S9D | |
| Vannas spring scissors | Fine Science Tools (Foster City, CA, United States) | 15000-03 |
Referências
- Takahashi, T., Shibata, M., Kamiya, A. Mechanism of macromolecule concentration in collecting lymphatics in rat mesentery. Microvasc Res. 54 (3), 193-205 (1997).
- Ishikawa, Y., et al. The human renal lymphatics under normal and pathological conditions. Histopathology. 49 (3), 265-273 (2006).
- Fanous, M. Y. Z., Phillips, A. J., Windsor, J. A. Mesenteric lymph: the bridge to future management of critical illness. JOP. 8 (4), 374-399 (2007).
- El-Chemaly, S., Levine, S. J., Moss, J. Lymphatics in lung disease. Ann N Y Acad Sci. 1131 (1), 195-202 (2008).
- Klotz, L., et al. Cardiac lymphatics are heterogeneous in origin and respond to injury. Nature. 522 (7554), 62-67 (2015).
- Louveau, A., et al. Structural and functional features of central nervous system lymphatic vessels. Nature. 523 (7560), 337-341 (2015).
- Aukland, K., Reed, R. K. Interstitial-lymphatic mechanisms in the control of extracellular fluid volume. Physiol Rev. 73 (1), 1-78 (1993).
- Zawieja, D. C. Contractile physiology of lymphatics. Lymphat Res Biol. 7 (2), 87-96 (2009).
- Nipper, M. E., Dixon, J. B. Engineering the Lymphatic System. Cardiovasc Eng Technol. 2 (4), 296-308 (2011).
- Choi, I., Lee, S., Hong, Y. K. The new era of the lymphatic system: No longer secondary to the blood vascular system. Cold Spring Harb Perspect Med. 2 (4), 006445 (2012).
- Ji, R. C. Lymphatic endothelial cells, lymphedematous lymphangiogenesis, and molecular control of edema formation. Lymphat Res Biol. 6 (3-4), 123-137 (2008).
- Scallan, J. P., Zawieja, S. D., Castorena-Gonzalez, J. A., Davis, M. J. Lymphatic pumping: mechanics, mechanisms and malfunction. J Physiol. 594 (20), 5749-5768 (2016).
- Lee, S., Roizes, S., vonder Weid, P. Y. Distinct roles of L- and T-type voltage-dependent Ca2+ channels in regulation of lymphatic vessel contractile activity. J Physiol. 592 (24), 5409-5427 (2014).
- Telinius, N., et al. Human lymphatic vessel contractile activity is inhibited in vitro but not in vivo by the calcium channel blocker nifedipine. J Physiol. 592 (21), 4697-4714 (2014).
- Imtiaz, M. S., Zhao, J., Hosaka, K., vonder Weid, P. Y., Crowe, M., van Helden, D. F. Pacemaking through Ca2+ stores interacting as coupled oscillators via membrane depolarization. Biophys J. 92 (11), 3843-3861 (2007).
- Jo, M., Trujillo, A. N., Yang, Y., Breslin, J. W. Evidence of functional ryanodine receptors in rat mesenteric collecting lymphatic vessels. Am J Physiol Heart Circ Physiol. 317 (3), H561-H574 (2019).
- Stolarz, A. J., et al. Doxorubicin Activates Ryanodine Receptors in Rat Lymphatic Muscle Cells to Attenuate Rhythmic Contractions and Lymph Flow. J Pharmacol Exp Ther. 371 (2), 278-289 (2019).
- Van, S., et al. Dantrolene Prevents the Lymphostasis Caused by Doxorubicin in the Rat Mesenteric Circulation. Front Pharmacol. 12, 727526 (2021).
- Atchison, D. J., Johnston, M. G. Role of extra- and intracellular Ca2+ in the lymphatic myogenic response. Am J Physiol Regul Integr Comp Physiol. 272 (1), R326-R333 (1997).
- Atchison, D. J., Rodela, H., Johnston, M. G. Intracellular calcium stores modulation in lymph vessels depends on wall stretch. Can J Physiol Pharmacol. 76 (4), 367-372 (1998).
- Zhao, J., van Helden, D. F. ET-1-associated vasomotion and vasospasm in lymphatic vessels of the guinea-pig mesentery. Br J Pharmacol. 140 (8), 1399-1413 (2003).
- Cotton, K. D., Hollywood, M. A., McHale, N. G., Thornbury, K. D. Outward currents in smooth muscle cells isolated from sheep mesenteric lymphatics. J Physiol. 503 (1), 1-11 (1997).
- Mathias, R., vonder Weid, P. Y. Involvement of the NO-cGMP-KATP channel pathway in the mesenteric lymphatic pump dysfunction observed in the guinea pig model of TNBS-induced ileitis. Am J Physiol Gastrointest Liver Physiol. 304 (6), G623-G634 (2013).
- Garner, B. R., et al. KATP channel openers inhibit lymphatic contractions and lymph flow as a possible mechanism of peripheral edema. J Pharmacol Exp Ther. 376 (1), 40-50 (2021).
- Souza-Smith, F. M., Kurtz, K. M., Breslin, J. W. Measurement of cytosolic Ca2+ in isolated contractile lymphatics. J Vis Exp. (58), e3438 (2011).
- Grynkiewicz, G., Poenie, M., Tsien, R. Y. A new generation of Ca2+ indicators with greatly improved fluorescence properties. J Biol Chem. 260 (6), 3440-3450 (1985).
- Hill-Eubanks, D. C., Werner, M. E., Heppner, T. J., Nelson, M. T. Calcium signaling in smooth muscle. Cold Spring Harb Perspect Biol. 3 (9), 1-20 (2011).
- Harmer, A. R., Abi-Gerges, N., Morton, M. J., Pullen, G. F., Valentin, J. P., Pollard, C. E. Validation of an in vitro contractility assay using canine ventricular myocytes. Toxicol Appl Pharmacol. 260 (2), 162-172 (2012).
- IonOptix LLC. . IonWizard 7.2 Acquisition. , (2017).
- IonOptix LLC. IonWizard 7.2 Core & Analysis Functions. IonOptix LLC. , (2017).
- Roe, M. W., Lemasters, J. J., Herman, B. Assessment of Fura-2 for measurements of cytosolic free calcium. Cell Calcium. 11 (2-3), 63-73 (1990).
- Zawieja, S. D., et al. Ano1 mediates pressure-sensitive contraction frequency changes in mouse lymphatic collecting vessels. J Gen Physiol. 151 (4), 532-554 (2019).
- Behringer, E. J., et al. Calcium and electrical dynamics in lymphatic endothelium. J Physiol. 595 (24), 7347-7368 (2017).
- Ferrusi, I., Zhao, J., van Helden, D., vonder Weid, P. Y. Cyclopiazonic acid decreases spontaneous transient depolarizations in guinea pig mesenteric lymphatic vessels in endothelium-dependent and -independent manners. Am J Physiol Heart Circ Physiol. 286 (6), H2287-H2295 (2004).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados