Isquemia Arterial Visceral Reversível Controlada, Congestão Venosa e Malperfusão Combinada via Laparotomia da Linha Média em Ratos
Neste Artigo
Resumo
Este artigo apresenta um procedimento padronizado para má perfusão controlada e reversível de órgãos viscerais em modelos de ratos. O objetivo é induzir esses estados de má perfusão com um alto grau de certeza e controle metodológico, mantendo a simplicidade técnica e a resiliência a erros.
Resumo
Além da sepse e malignidade, a má perfusão é a terceira principal causa de degradação tecidual e um importante mecanismo patológico para várias condições médicas e cirúrgicas. Apesar de desenvolvimentos significativos, como cirurgia de ponte de safena, procedimentos endovasculares, oxigenação por membrana extracorpórea e substitutos artificiais do sangue, a má perfusão tecidual, especialmente de órgãos viscerais, continua sendo uma questão premente no atendimento ao paciente. A demanda por mais pesquisas sobre processos biomédicos e possíveis intervenções é alta. Modelos biológicos válidos são de extrema importância para permitir esse tipo de pesquisa. Devido aos aspectos multifatoriais da pesquisa de perfusão tecidual, que incluem não apenas biologia celular, mas também microanatomia vascular e reologia, um modelo apropriado requer um grau de complexidade biológica que apenas um modelo animal pode fornecer, tornando os roedores o modelo óbvio de escolha. A má perfusão tecidual pode ser diferenciada em três condições distintas: (1) isquemia arterial isolada, (2) congestão venosa isolada e (3) má perfusão combinada. Este artigo apresenta um protocolo passo a passo detalhado para a indução controlada e reversível desses três tipos de má perfusão visceral via laparotomia mediana e pinçamento da aorta abdominal e veia cava em ratos, ressaltando a importância de uma metodologia cirúrgica precisa para garantir resultados uniformes e confiáveis. Os principais exemplos de possíveis aplicações deste modelo incluem o desenvolvimento e validação de modalidades inovadoras de imagem intraoperatória, como a Imagem Hiperespectral (HSI), para visualizar e diferenciar objetivamente a má perfusão de órgãos gastrointestinais, ginecológicos e urológicos.
Introdução
Embora as implicações da privação de perfusão tecidual na forma de condições de má perfusão tecidual local ou sistêmica tenham sido reconhecidas há muito tempo, elas persistem como uma das principais causas de morbidade e mortalidade nos Estados Unidos e na Europa1. Essas condições de má perfusão são a terceira principal causa de degradação tecidual, após malignidade e inflamação séptica, mas têm um espectro de origens muito mais amplo em comparação com as duas últimas2.
Esse espectro varia de mecanismos locais, como fibrilação atrial com oclusão tromboembólica, vasoconstrição e dissecção iatrogênica ou traumática, a mecanismos sistêmicos, como insuficiência ou choque cardíaco, sepse, hipovolemia e fenômenos de roubo. Esses diversos mecanismos estão subjacentes a uma variedade de condições médicas e cirúrgicas. A significativa morbidade e mortalidade associadas a essas condições direcionaram a atenção médica para procedimentos para restabelecer o fluxo sanguíneo para tecidos mal perfundidos, a fim de prevenir a necrose e restaurar a função do órgão ao longo das décadas3.
Esse esforço de pesquisa resultou em uma variedade de soluções farmacêuticas, médicas e cirúrgicas para restaurar a perfusão fisiológica de órgãos, incluindo avanços na cirurgia de revascularização4, procedimentos endovasculares5, oxigenação por membrana extracorpórea6,7, perfusão de máquina de órgãos durante o transplante8e substitutos artificiaisdo sangue9.
No entanto, apesar desses desenvolvimentos significativos, a má perfusão, especialmente de órgãos viscerais, continua sendo uma questão premente no atendimento ao paciente, e a demanda por mais pesquisas sobre processos biomédicos e estratégias de resgate é alta. Modelos biológicos válidos são de extrema importância para permitir esse tipo de pesquisa. Devido aos aspectos multifatoriais da pesquisa de perfusão tecidual, que incluem não apenas biologia celular, mas também microanatomia vascular e reologia, um modelo apropriado requer um grau de complexidade biológica que apenas um organismo modelo completo pode fornecer, tornando os roedores o modelo óbvio de escolha.
A má perfusão tecidual pode ser diferenciada em três condições distintas: isquemia arterial isolada, congestão venosa isolada e má perfusão combinada10. Cenários clinicamente relevantes para essas condições incluem (1) Isquemia arterial: fibrilação atrial com oclusão tromboembólica, êmbolos sépticos, vasoconstrição, dissecção ou pinçamento vascular iatrogênico ou traumático, insuficiência ou choque cardíaco, dissecção aórtica, sepse e hipovolemia, obstrução arterial extrema devido a constrição externa, embolia da artéria pulmonar, doenças oclusivas vasculares arteriais crônicas ou fenômenos de roubo; (2) Congestão venosa: dissecção ou pinçamento vascular iatrogênico ou traumático, insuficiência cardíaca, fibrose hepática ou cirrose, obstrução venosa por constrição externa, trombose venosa, insuficiência venosa e síndrome de Budd-Chiari; (3) Má perfusão combinada: Combinações das condições acima e estágios avançados das condições acima mencionadas, como congestão venosa secundária devido à fibrose induzida por isquemia ou isquemia arterial secundária devido à retenção induzida por congestão, bem como condições específicas de órgãos, como inflamação isquêmica (por exemplo, colite isquêmica)11,12.
Este artigo, portanto, tem como objetivo fornecer um modelo passo a passo para induzir isquemia arterial visceral controlada e reversível, congestão venosa e má perfusão combinada via laparotomia da linha média em ratos para aplicações de sobrevivência e não sobrevivência, conforme ilustrado na Figura 1. O modelo experimental oferece um ambiente controlado para estudar a dinâmica multifacetada da isquemia arterial, congestão venosa e suas sequelas combinadas, emulando cenários clinicamente relevantes encontrados em várias condições.
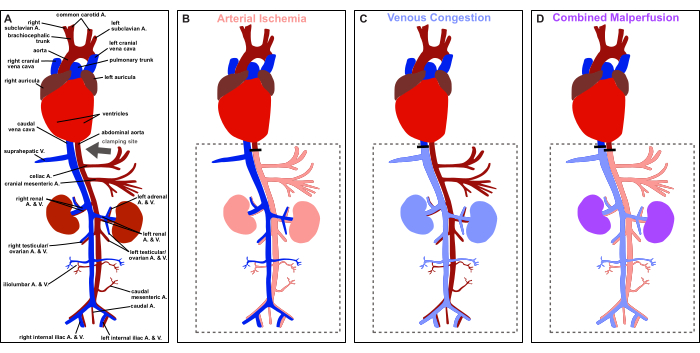
Figura 1: Visão geral do protocolo. Representação esquemática da anatomia vascular do rato e representação do local de pinçamento (seta cinza). (A) Perfusão fisiológica. (B) Isquemia arterial. (C) congestão venosa. (D) Má perfusão combinada. Clique aqui para ver uma versão maior desta figura.
Protocolo
Todas as atividades com animais descritas aqui foram conduzidas em instalações credenciadas e aprovadas pelo Comitê Institucional de Cuidados e Uso de Animais (IACUC) do Conselho Regional de Baden-Württemberg em Karlsruhe, Alemanha (35-9185.81/G-62/23). Os animais experimentais foram manejados de acordo com os padrões institucionais, as leis alemãs para uso e cuidados com os animais, as diretrizes do Conselho da Comunidade Europeia (2010/63/UE) e as diretrizes ARRIVE. Ratos machos da raça Sprague Dawley com peso de ordem de 400 gramas foram utilizados após uma semana de aclimatação. Os detalhes dos reagentes e dos equipamentos utilizados neste estudo estão listados na Tabela de Materiais.
1. Anestesia e analgesia
- Anestesiar o rato com a medicação seguindo os protocolos institucionais. O isoflurano é recomendado para indução de sedação seguida por uma injeção intravenosa de 100 mg / kg de cetamina em peso corporal e 4 mg / kg de xilazina em peso corporal. Analgesia adicional pode ser alcançada com uma injeção s.c. de 5 mg / kg de carprofeno em peso corporal. Para detalhes, consulte Studier-Fischer et al.13.
- Aplique pomada oftálmica nos olhos para evitar o ressecamento.
- Garanta a profundidade analgésica adequada usando o teste de pinça do dedo do pé com pinça cirúrgica.
- Reavalie e ajuste regularmente a profundidade da anestesia durante a cirurgia.
2. Preparação do procedimento
- Prepare a mesa de esfregar com todos os materiais e instrumentos necessários, incluindo pinças microvasculares liberáveis e o aplicador (Figura 2A-C), pinça de overholt romba, tesoura de preparação fina e pinça.
- Prepare os ganchos de preparação cirúrgica dobrando cânulas em um ângulo de 135° a 1 cm em relação à ponta e conecte-as a tubos de perfusão de plástico via Luer-lock prontos para aplicar tensão usando uma pinça cirúrgica de mosquito (Figura 2D, E).
- Prepare um aparelho de exposição cirúrgica para roedores, incluindo hastes de fixação em forma de Y e uma almofada de aquecimento, conforme especificado em Studier-Fischer et al.13.
- Certifique-se de que a oxigenação adequada seja alcançada por meio da inalação de oxigênio a 100% usando uma máscara facial neonatal (Figura 2F).
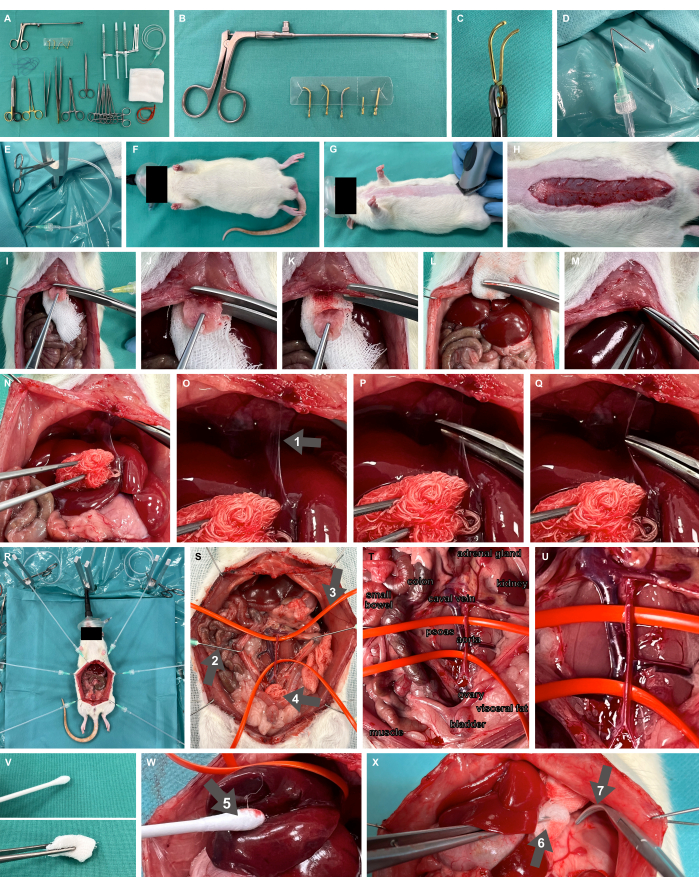
Figura 2: Configuração experimental e animal. (A) Instrumentos e materiais cirúrgicos necessários. (B, C) Pinça microvascular removível e aplicador. (D, E) Uma cânula dobrada conectada a um tubo de perfusão é usada como gancho de preparação cirúrgica. (F, G) Modelo de rato oxigenado com máscara facial e barbeado. (H) Incisão cutânea em todo o comprimento abdominal. (I-M) ressecção do xifóide e hemostasia. (N-Q) Mobilização hepática e dissecção do ligamento falciforme (seta 1). (R) Aplicação de ganchos de preparação e suportes de metal para exposição de órgãos após laparotomia. (S) Exposição visceral total dos grandes vasos abdominais com ganchos rombos (seta 2), alças de silicone (seta 3) e compressa cirúrgica (seta 4). (T, U) Aorta abdominal e veia cava. (V) Instrumentos de preparação atraumática. (W) Troca de algodão umidificado (seta 5). (X) Compressa umidificada em pinça (seta 6) e pinças de overholt rombas (seta 7). Clique aqui para ver uma versão maior desta figura.
3. Preparação cirúrgica
- Faça a barba do local de acesso cirúrgico para uma laparotomia de linha média (Figura 2G). Realizar uma incisão cutânea sobre o comprimento abdominal desejado, ou seja, cerca de 7 cm (Figura 2H), avançar com a laparotomia dissecando a fáscia e costurar os ganchos de preparação cirúrgica com tubos plásticos acoplados e pinças cirúrgicas contra mosquitos através da pele. Exponha o sítio cirúrgico usando os ganchos de preparação cirúrgica, aplicando tensão no tecido.
- Certifique-se de que o peritônio seja dissecado cranialmente apenas até alguns milímetros abaixo do início do esterno, deixando parte do peritônio intacto. Colocar uma parte de uma compressa cirúrgica abaixo do esterno (Figura 2I) e ressecar o xifóide com uma tesoura de material resistente. Aplique pressão na área de ressecção usando a compressa cirúrgica para obter hemostasia suficiente dessa região bem perfundida (Figura 2I-M).
- Mobilize o fígado dorso-caudalmente para expor o ligamento falciforme (Figura 2N) e disseque o ligamento (Figura 2O-Q).
- Para o controle hemostático, dependendo de onde o pinçamento dos vasos maiores deve ser realizado, realizar uma exposição visceral completa dos vasos maiores abdominais (Figura 2R) e dos vasos pendurados com alças de silicone (Figura 2S-U). Apenas instrumentos de preparação atraumática devem ser usados (Figura 2V), como trocas de algodão umidificado (Figura 2W), compressa umidificada em fórceps e grampos overholt rombos (Figura 2X).
4. Preparo e pinçamento da aorta abdominal para isquemia arterial
- Realize uma medialização esquerda dos órgãos abdominais superiores usando instrumentos de preparação atraumática para obter acesso à artéria adrenal esquerda (Figura 3A-D).
- Identificar o local pulsátil tipicamente medial à extensão cranial da artéria adrenal esquerda, indicando o trajeto da aorta (Figura 3E). Avance através do tecido mole usando pinças de overholt para dissecção romba para acessar a aorta abdominal (Figura 3F,G).
- Tunelamente a aorta abdominal na extremidade mais cranial usando pinças de overholt rombas (Figura 3H-L) e estilingue a aorta usando uma alça de vaso de silicone (Figura 3M-T).
- Aplique uma pinça microvascular de aneurisma adequada usando a alça de silicone para luxar levemente a aorta ventralmente e guie a pinça microvascular do aneurisma ao longo da alça de silicone para garantir o pinçamento aórtico isolado (Figura 3U). Dependendo da questão da pesquisa, o grampo microvascular pode ser liberado novamente.
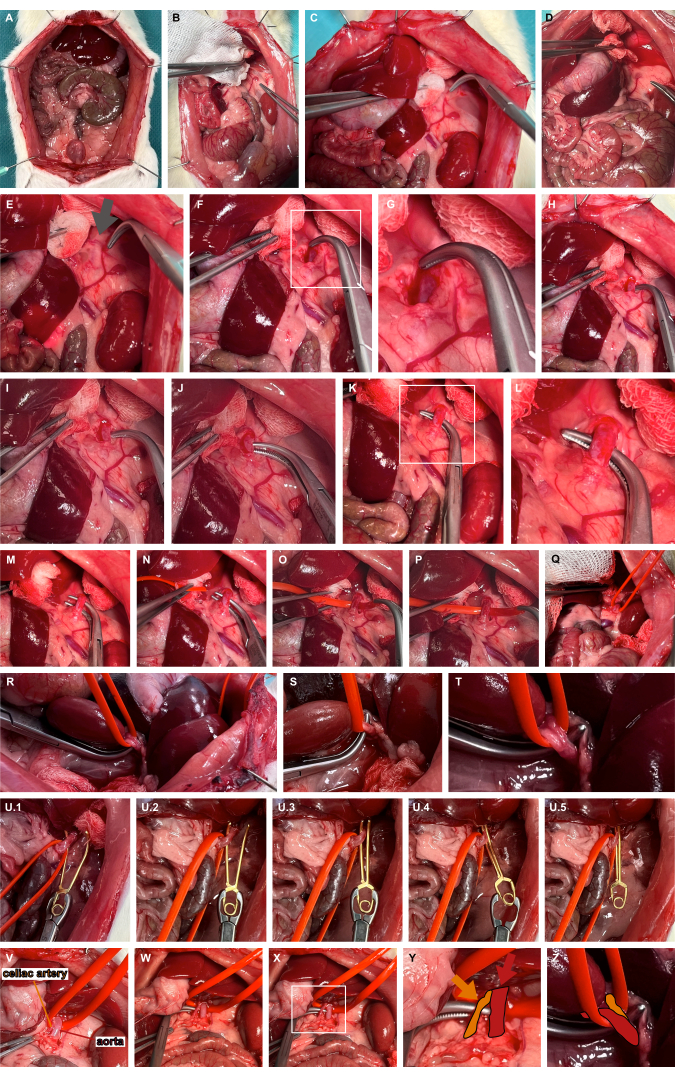
Figura 3: Preparo e pinçamento da aorta abdominal. (A) Exposição de órgãos viscerais. (BE) Medialização esquerda dos órgãos abdominais superiores usando instrumentos de preparação atraumática para obter acesso à artéria adrenal esquerda. (F, G) Dissecção romba medial da artéria adrenal esquerda no local pulsátil (seta cinza) para acesso à aorta abdominal. (H-L) Tunelização da aorta abdominal com pinças de overholt rombas. (MT) Lançar a aorta usando uma alça de vaso de silicone. (U) Aplicação de uma pinça microvascular de aneurisma liberável usando a alça de silicone como orientação. (V-Z) Visualização da artéria celíaca (laranja) em referência à aorta (vermelho) e à alça do vaso de silicone. Clique aqui para ver uma versão maior desta figura.
5. Preparo e pinçamento da veia cava abdominal supra-hepática para congestão venosa
- Mobilize o fígado para a direita usando instrumentos de preparação atraumática, disseque bruscamente os ligamentos hepáticos e lateralize ainda mais o fígado (Figura 4A-C).
- Abra o espaço retro-hepático na cruz esquerda do diafragma usando grampos de overholt rombos (Figura 4D-G).
- Tunelamente a veia caval usando grampos overholt rombos ( Figura 4H-K ) e estilingue a veia caval usando alças de vaso de silicone ( Figura 4L-O ).
- Aplique uma pinça microvascular de aneurisma adequada usando a alça de silicone para luxar levemente a veia cava ventralmente e guie a pinça microvascular do aneurisma ao longo da alça de silicone para garantir o pinçamento isolado da veia cava (Figura 4R).
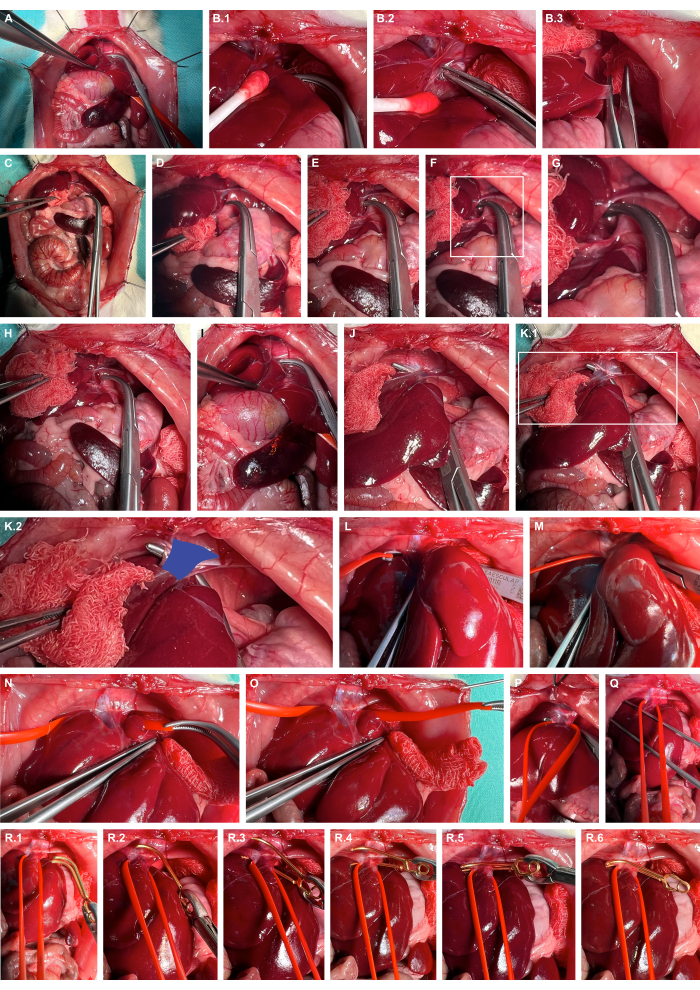
Figura 4: Preparo e pinçamento da veia cava abdominal supra-hepática. (A) Exposição de órgãos viscerais cranianos. (B) Mobilização tecidual-protetora do fígado e dissecção aguda dos ligamentos hepáticos usando instrumentos de preparação atraumática. (C) Lateralização do fígado. (DG) A abertura do espaço retro-hepático e preparação na cruz esquerda do diafragma. (H-K) Tunelização da veia caval (azul) usando pinças de overholt rombas. (L-O) Lançar a veia caval usando alças de vaso de silicone. (P, Q) Esforço de tensão para restringir provisoriamente o fluxo sanguíneo caval. (R) Aplicação de uma pinça microvascular de aneurisma liberável usando a alça de silicone como orientação. Clique aqui para ver uma versão maior desta figura.
6. Pinçamento da aorta abdominal e veia cava abdominal supra-hepática para má perfusão combinada
- Execute as etapas acima até que a aorta e a veia cava estejam presas com alças de vaso de silicone. Avance com a aplicação da pinça microvascular do aneurisma para ambos os vasos novamente usando a alça de silicone para orientação. Recomenda-se pinçar a aorta primeiro e minimizar o tempo necessário até o pinçamento caval subsequente para apenas alguns segundos.
NOTA: Dependendo do cenário desejado e do objetivo da pesquisa, a má perfusão pode ser continuada ou liberada após um período de tempo definido, e os animais podem ser sacrificados por cardiectomia afiada (seguindo protocolos aprovados institucionalmente) para aplicações de não sobrevivência ou receber fechamento abdominal gradual usando suturas cirúrgicas em caso de acompanhamentos planejados e experimentos de sobrevivência. Para o presente estudo, os animais foram eutanasiados.
Resultados
Este protocolo foi realizado em 10 ratos machos (peso médio de 403 g ± 26 g) em um cenário de não sobrevivência. A taxa de sucesso foi definida pela sobrevida ao longo de 20 min após pinçamento arterial, pinçamento venoso e pinçamento combinado por 5 min com 10 min de reperfusão, cada um dos quais foi de 100%. A duração média do preparo desde a incisão na pele até que ambos os vasos fossem pendurados com alças de silicone foi de 11 min 45 s ± 3 min 23 s.
Para validação dos 4 diferentes estados de má perfusão, os parâmetros de índice para oxigenação (StO2) e perfusão (NIR) foram medidos usando imagens hiperespectrais (HSI) em 5 órgãos viscerais (Figura 5).
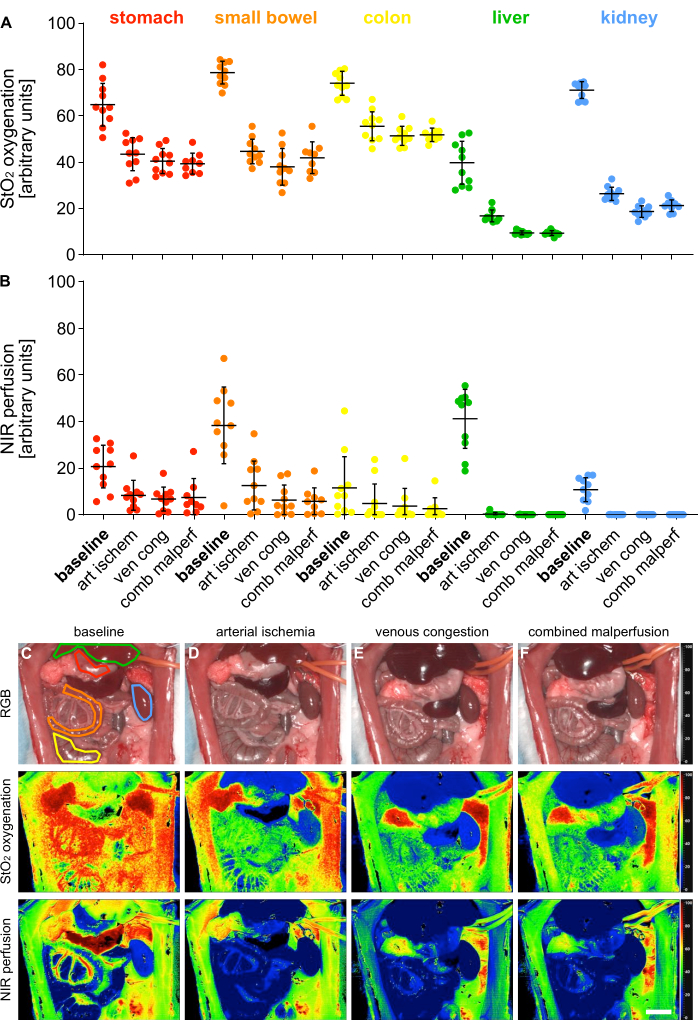
Figura 5: Validação do modelo de má perfusão. (A,B) Quantificação dos valores de oxigenação e perfusão do HSI em quatro estados de perfusão diferentes e cinco órgãos viscerais diferentes com n = 10 animais. (C-F) Imagens de índice RGB e codificadas por cores de gravações HSI contendo órgãos viscerais em 4 estados de perfusão diferentes. As barras de erro indicam o desvio padrão. A barra de escala representa 5 cm. Clique aqui para ver uma versão maior desta figura.
Os valores foram fornecidos em unidades arbitrárias e mostraram uma diminuição significativa nos estados de má perfusão em comparação com o estado fisiológico do órgão (Tabela 1). Os resultados hiperespectrais estão de acordo com publicações recentes indicando que a viabilidade e a perfusão do tecido podem ser avaliadas usando valores de corte HSI StO2 específicos do órgão que correspondem aos valores observados neste estudo14,15. Exemplarmente para o estômago, foram 64,1% (±9,4%) para perfusão fisiológica, 43,1% (±7,4%) para isquemia arterial, 40,5% (±5,4%) para congestão venosa e 39,3% (±4,5%) para má perfusão combinada.
Como esses foram experimentos de não sobrevivência, não há dados experimentais sobre os resultados de longo prazo dos animais. No entanto, outros estudos relatam sobrevida de 100% e 57% em 24 h para ratos submetidos a 30 min e 60 min de pinçamento da artéria mesentérica superior16,17 e correlacionam com sucesso com os níveis séricos da proteína de choque térmico 70. Consequentemente, este pode ser um método possível para avaliar os resultados em futuros estudos de sobrevida de acordo com diferentes tempos de pinçamento.
| parâmetro | órgão | referência | isquemia arterial | congestão venosa | Má perfusão combinada |
| StO2 | estômago | 64,1% (±9,4%) | 43,1% (±7,4%) | 40,5% (±5,4%) | 39,3% (±4,5%) |
| intestino delgado | 78,4% (±5,1%) | 44,8% (±5,5%) | 38,0% (±7,9%) | 41,9% (±6,9%) | |
| cólon | 74,6% (±5,0%) | 56,0% (±6,3%) | 51,3% (±4,1%) | 51,8% (±2,9%) | |
| fígado | 39,5% (±9,7%) | 16,9% (±2,6%) | 9,5% (±0,8%) | 9,3% (±1,1%) | |
| rim | 71,0% (±3,8%) | 26,3% (±3,0%) | 18,6% (±2,5%) | 21,2% (±2,6%) | |
| NIR | estômago | 20,0% (±9,3%) | 8,3% (±6,7%) | 6,8% (±5,1%) | 7,5% (±8,1%) |
| intestino delgado | 38,6% (±17,4%) | 12,9% (±11,0%) | 6,3% (±6,5%) | 5,7% (±5,9%) | |
| cólon | 12,6% (±13,7%) | 5,3% (±8,7%) | 3,8% (±7,5%) | 2,6% (±4,7%) | |
| fígado | 40,4% (±13,1%) | 0,3% (±0,7%) | 0,0% (±0,1%) | 0,0% (±0,0%) | |
| rim | 10,4% (±5,2%) | 0,0% (±0,0%) | 0,0% (±0,1%) | 0,0% (±0,0%) |
Tabela 1: Parâmetros teciduais. Valores de oxigenação HIS StO2 e perfusão NIR em unidades arbitrárias em 5 órgãos viscerais e 4 estados de perfusão diferentes.
Discussão
Embora a doença arterial oclusiva periférica (DAOP) isoladamente, como o representante mais proeminente das condições de má perfusão tecidual, já tenha uma prevalência de cerca de 7%, afetando cerca de 8,5 milhões de adultos apenas nos Estados Unidos18, a má perfusão tecidual em geral é um mecanismo patológico relevante na maioria das condições cirúrgicas e médicas. Consequentemente, modelos animais apropriados e reprodutíveis são absolutamente necessários para abordar novas questões de pesquisa neste campo.
As três situações dinâmicas vasculares que requerem investigação distinta são isquemia arterial, congestão venosa e má perfusão combinada. Ao induzir isquemia arterial isolada, os cientistas podem delinear com precisão a progressão temporal e espacial da hipóxia tecidual, investigando as cascatas moleculares implicadas na lesão de isquemia-reperfusão, apoptose celular e respostas inflamatórias. Ao comprometer a drenagem venosa, uma faceta muitas vezes negligenciada da patologia vascular, os cientistas podem investigar a interação entre as discrepâncias de entrada e saída venosa das artérias, esclarecendo a fisiopatologia da trombose venosa, edema tecidual relacionado à congestão e disfunção microcirculatória. Ao combinar essas duas situações patológicas, pode-se investigar o meio dissinérgico da má perfusão combinada, espelhando a complexa fisiopatologia encontrada em síndromes clínicas como isquemia mesentérica aguda e colite isquêmica.
Além de elucidar mecanismos fisiopatológicos fundamentais, a capacidade de induzir isquemia arterial visceral, congestão venosa e má perfusão combinada em ratos serve como uma plataforma indispensável para avaliar a eficácia de intervenções farmacológicas, técnicas cirúrgicas, novas estratégias terapêuticas e modalidades inovadoras de imagem, especialmente como o HSI 14,19,20,21,22. Este modelo é, portanto, um componente-chave para fornecer a verdade biológica necessária para aproveitar todo o potencial da HSI na avaliação de tecidos e identificação de estados de perfusão. Ao alavancar essa configuração experimental, os pesquisadores podem agilizar a tradução de achados pré-clínicos em estratégias clinicamente viáveis, reduzindo a morbidade e a mortalidade associadas a diversos distúrbios vasculares e de perfusão.
Ilustrativamente, os pesquisadores podem empregar esse modelo para investigar a eficácia de agentes farmacológicos direcionados às vias de lesão de isquemia-reperfusão, como antioxidantes, anti-inflamatórios e vasodilatadores, delineando assim sua potencial utilidade na prática clínica 23,24. Além disso, esse modelo facilita a avaliação de novas abordagens cirúrgicas, como técnicas de revascularização mesentérica e procedimentos descompressivos venosos, fornecendo informações valiosas sobre sua viabilidade, segurança e eficácia a longo prazo 25,26.
Além disso, essa estrutura experimental permite que os pesquisadores explorem a intrincada interação entre disfunção vascular e comorbidades sistêmicas, como diabetes, hipertensão e aterosclerose, ilustrando assim a intrincada teia de vias fisiopatológicas interconectadas que orquestram a progressão da doença vascular27,28.
Embora existam várias publicações sobre má perfusão seletiva de órgãos únicos, como fígado 29,30,31 ou rim, em ratos 32,33, há uma falta de literatura científica abordando a má perfusão das vísceras completas em ratos, e não há explicitamente um protocolo metódico. Esta é, portanto, a afirmação deste manuscrito. As limitações da técnica apresentada incluem principalmente a invasividade do procedimento e, dependendo da duração da má perfusão, trombose de órgãos consecutiva e disfunção, podendo levar ao sofrimento pós-operatório por falência de múltiplos órgãos ou síndrome compartimental abdominal 34,35,36. O planejamento e o projeto cuidadosos, dependendo da questão da pesquisa, podem ajudar a equilibrar a duração necessária da má perfusão e suas consequências fisiopatológicas.
Ao solucionar desafios comuns encontrados durante o procedimento, deve-se atentar para os seguintes pontos e recomendações: (1) Garantir a preparação completa de equipamentos e medicamentos com antecedência para minimizar interrupções durante o procedimento; (2) Realize o controle hemostático meticulosamente, preparando e dissecando cuidadosamente os planos avasculares. Considere o uso de pinças hemostáticas bipolares para hemostasia elétrica, se disponível; (3) Minimizar o trauma nos tecidos usando instrumentos não traumáticos, como cotonetes umidificados ou compressa cirúrgica umidificada com fórceps ao fazer contato com o parênquima hepático; (4) Aproximadamente 20% dos animais apresentaram sangramento difuso do parênquima hepático superficial devido a condições delicadas dos tecidos. No entanto, o sangramento parou em todos os casos com leve compressão e paciência. Essas recomendações visam aumentar a eficiência do procedimento e minimizar as complicações durante a indução de má perfusão em modelos de ratos.
Ao ressecar o xifóide para melhorar o acesso à veia caval, certifique-se de que o peritônio dorsal à transição entre o xifóide e o esterno seja deixado intacto por alguns milímetros. O local de ressecção do xifóide será duro e agudo, podendo causar trauma no parênquima hepático superficial. Portanto, recomenda-se que o peritônio retroesternal seja mobilizado caudalmente com fórceps e enrolado ao redor do coto ósseo de forma eficaz, cobrindo-o e suportando a hemostasia. Os ganchos de preparação cirúrgica devem ser suturados através da parede abdominal ventral cranial com tensão cranial para que a cobertura peritoneal do coto xifóide permaneça no lugar.
Ao dissecar o ligamento falciforme, deve-se tomar cuidado para evitar causar acidentalmente lesão iatrogênica na veia hepática, pois isso pode ser fatal para o animal. Devido ao alto risco de sangramento durante o preparo vascular, recomenda-se que a maior parte do preparo cirúrgico seja feita espalhando com pinças de overholt rombas, em vez de usar instrumentos de dissecção pontiagudos. Além disso, as alças dos vasos de silicone devem ser umedecidas antes do uso para reduzir o atrito da superfície e minimizar o risco de trauma tecidual.
Ao aplicar a pinça microvascular do aneurisma, é crucial visualizar a anatomia vascular exata. Por exemplo, a artéria celíaca se origina muito cranialmente da aorta abdominal. Se a oclusão celíaca for desejada, como para investigar a má perfusão hepática, a artéria celíaca deve ser visualizada em referência à aorta e à alça do vaso de silicone. Isso garante que a artéria celíaca seja incluída no tecido vascular pinçado (Figura 2V-Z). Houve um caso em que a pinça foi inicialmente colocada caudal à artéria celíaca por acidente. No entanto, isso foi prontamente reconhecido devido à falta de queda nos valores hepáticos de StO2, e o repinçamento adequado foi realizado com sucesso.
A etapa de preparação mais perigosa é o tunelamento da veia caval. Esta etapa requer movimentos suaves e paciência, e os grampos overholt só devem ser espalhados quando houver certeza de que não há contato com a veia caval. Pode ser um desafio julgar isso, pois a veia cava aparecerá como tecido conjuntivo avascular fino quando uma leve compressão é aplicada, fazendo com que o sangue contido desapareça em ambas as direções. Também existe o risco de abertura pleural acidental e criação de um pneumotórax ao tunelar a veia caval muito cranialmente. Isso pode ser uma complicação séria e com risco de vida, especialmente porque o animal está respirando espontaneamente e nenhuma medida respiratória invasiva pode ser tomada. Considerou-se útil retrair ligeiramente os instrumentos de preparação e continuar mais caudalmente para evitar essa complicação. Nos casos de pneumotórax hemodinamicamente relevante e visível com abaulamento do diafragma hepático, uma punção única transdiafragmática e aspiração do ar aprisionado usando uma agulha 30 G e uma seringa pequena podem ser recomendadas como estratégia de resgate. Esta técnica foi empregada com sucesso em um animal para salvá-lo no intraoperatório.
Finalmente, cuidados especiais devem ser tomados ao aplicar as pinças microvasculares para evitar a inclusão de tecido conjuntivo circundante, o que pode levar à oclusão insuficiente do vaso desejado.
Embora este protocolo seja um guia passo a passo para a má perfusão visceral global, o local do pinçamento pode ser ajustado de acordo com a questão de pesquisa específica devido à extensa preparação vascular e mobilização representada na Figura 1T-V. Portanto, a má perfusão selecionada de grupos de órgãos ou órgãos isolados também é uma opção na escolha do local de pinçamento mais distalmente ao longo da árvore vascular, como o pinçamento seletivo do tronco celíaco para isquemia hepática. Ao oferecer uma metodologia detalhada e reprodutível, este protocolo facilita uma abordagem padronizada para isquemia arterial reversível controlada, congestão venosa e má perfusão combinada em modelos de ratos, levando a uma maior confiabilidade dos dados, robustez, independência do pesquisador e comparabilidade em futuros estudos com animais. Consequentemente, representa uma ferramenta indispensável dentro do arsenal de pesquisa biomédica, oferecendo insights sobre a complexa interação entre comprometimento vascular, lesão tecidual e intervenções terapêuticas. Ao aproveitar a versatilidade dessa configuração experimental, os pesquisadores podem investigar os mistérios em torno da fisiopatologia vascular, forjando novas fronteiras na medicina translacional e, finalmente, melhorando os resultados dos pacientes no campo da saúde vascular.
Divulgações
Nenhum.
Agradecimentos
Os autores agradecem que o serviço de armazenamento de dados SDS@hd apoiado pelo Ministério da Ciência, Pesquisa e Artes Baden-Württemberg (MWK) e pela Fundação Alemã de Pesquisa (DFG) por meio da concessão INST 35/1314-1 FUGG e INST 35/1503-1 FUGG. Além disso, os autores agradecem o apoio do NCT (Centro Nacional de Doenças Tumoral em Heidelberg, Alemanha) por meio de seu programa estruturado de pós-doutorado e do programa de Oncologia Cirúrgica. Também reconhecemos o apoio por meio de fundos estaduais aprovados pelo Parlamento Estadual de Baden-Württemberg para a Innovation Campus Health + Life Science Alliance Heidelberg Mannheim do programa de pós-doutorado estruturado para Alexander Studier-Fischer: Inteligência Artificial em Saúde (AIH) - Uma colaboração de DKFZ, EMBL, Universidade de Heidelberg, Hospital Universitário de Heidelberg, Hospital Universitário de Mannheim, Instituto Central de Saúde Mental, e o Instituto Max Planck de Pesquisa Médica. Além disso, reconhecemos o apoio do DKFZ Hector Cancer Institute no University Medical Center Mannheim. Pela taxa de publicação, agradecemos o apoio financeiro da Deutsche Forschungsgemeinschaft dentro do programa de financiamento "Open Access Publikationskosten", bem como da Universidade de Heidelberg.
Materiais
| Name | Company | Catalog Number | Comments |
| Atraumatic preparation forceps | Aesculap | FB395R | DE BAKEY ATRAUMATA atraumatic forceps, straight |
| Blunt overholt clamp | Aesculap | BJ012R | BABY-MIXTER preparation and ligature clamp, bent, 180 mm |
| Cannula | BD (Beckton, Dickinson) | 301300 | BD Microlance 3 cannula 20 G |
| Fixation rods | legefirm | 500343896 | tuning forks used as y-shaped metal fixation rods |
| Heating pad | Royal Gardineer | IP67 | Royal Gardineer Heating Pad Size S, 20 Watt |
| Plastic perfusor tube | M. Schilling GmbH | S702NC150 | connecting tube COEX 150 cm |
| Preparation scissors | Aesculap | BC177R | JAMESON preparation scissors, bent, fine model, blunt/blunt, 150 mm (6") |
| Silicone vessel loop tie | SERAG WIESSNER | SL26 | silicone vessel loop tie 2,5 mm red |
| Spraque Dawley rat | Janvier Labs | RN-SD-M | Spraque Dawley rat |
| Steel plate | Maschinenbau Feld GmbH | C010206 | Galvanized sheet plate, 40 x 50 cm, thickness 4.0 mm |
| Yasargil clip | Aesculap | FE795K | YASARGIL Aneurysm Clip System Phynox Temporary (Standard) Clip |
| Yasargil clip applicator | Aesculap | FE558K | YASARGIL Aneurysm Clip Applicator Phynox (Standard) |
Referências
- Carden, D. L., Granger, D. N. Pathophysiology of ischemia-reperfusion injury. J Pathol. 190 (3), 255-266 (2000).
- Balkwill, F., Mantovani, A. Inflammation and cancer: Back to Virchow. Lancet. 357 (9255), 539-545 (2001).
- Cruz, R. J., Garrido, A. G., Ribeiro, C. M., Harada, T., Rocha-E-Silva, M. Regional blood flow distribution and oxygen metabolism during mesenteric ischemia and congestion. J Surg Res. 161 (1), 54-61 (2010).
- Leng, G. C., Davis, M., Baker, D. Bypass surgery for chronic lower limb ischemia. Cochrane Database Syst Rev. 3, Cd002000 (2000).
- Droc, I., Calinescu, F. B., Droc, G., Blaj, C., Dammrau, R. Aortic stenting. Minim Invasive Ther Allied Technol. 24 (5), 296-304 (2015).
- Le Gall, A., et al. Veno-arterial-ecmo in the intensive care unit: From technical aspects to clinical practice. Anaesth Crit Care Pain Med. 37 (3), 259-268 (2018).
- Napp, L. C., Kühn, C., Bauersachs, J. ECMO in cardiac arrest and cardiogenic. Herz. 42 (1), 27-44 (2017).
- Sousa Da Silva, R. X., Weber, A., Dutkowski, P., Clavien, P. A. Machine perfusion in liver transplantation. Hepatology. 76 (5), 1531-1549 (2022).
- Sen Gupta, A. Bio-inspired nanomedicine strategies for artificial blood components. Wiley Interdiscip Rev Nanomed Nanobiotechnol. 9 (6), 1464 (2017).
- Lu, D., et al. Intramuscular microvascular flow sensing for flap monitoring in a porcine model of arterial and venous occlusion. J Reconstr Microsurg. 39 (3), 231-237 (2023).
- Nguyen, G. K., et al. Novel biomarkers of arterial and venous ischemia in microvascular flaps. PLoS One. 8 (8), e71628 (2013).
- Redlin, M., et al. How near-infrared spectroscopy differentiates between lower body ischemia due to arterial occlusion versus venous outflow obstruction. Ann Thorac Surg. 91 (4), 1274-1276 (2011).
- Studier-Fischer, A., et al. Endotracheal intubation via tracheotomy and subsequent thoracotomy in rats for non-survival applications. J Vis Exp. (205), e66684 (2024).
- Nickel, F., et al. Optimization of anastomotic technique and gastric conduit perfusion with hyperspectral imaging and machine learning in an experimental model for minimally invasive esophagectomy. Eur J Surg Oncol. , 106908 (2023).
- Barberio, M., et al. Quantitative fluorescence angiography versus hyperspectral imaging to assess bowel ischemia: A comparative study in enhanced reality. Surgery. 168 (1), 178-184 (2020).
- Doukas, P., et al. Onset of adverse abdominal events due to intestinal ischemia-reperfusion injury after aortic cross-clamping is associated with elevated hsp70 serum levels in the early postoperative phase. Int J Mol Sci. 23 (23), 15063 (2022).
- Mine, Y., et al. Heat shock protein 70 messenger RNA in rat leukocytes elevates after severe intestinal ischemia-reperfusion. J Surg Res. 242, 342-348 (2019).
- Criqui, M. H., et al. Lower extremity peripheral artery disease: Contemporary epidemiology, management gaps, and future directions: A scientific statement from the American Heart Association. Circulation. 144 (9), e171-e191 (2021).
- Seidlitz, S., et al. Robust deep learning-based semantic organ segmentation in hyperspectral images. Med Image Anal. 80, 102488 (2022).
- Studier-Fischer, A., et al. Icg-augmented hyperspectral imaging for visualization of intestinal perfusion compared to conventional icg fluorescence imaging: An experimental study. Int J Surg. 109 (12), 3883-3895 (2023).
- Studier-Fischer, A., et al. Heiporspectral - the heidelberg porcine hyperspectral imaging dataset of 20 physiological organs. Scientific Data. 10 (1), 414 (2023).
- Studier-Fischer, A., et al. Spectral organ fingerprints for machine learning-based intraoperative tissue classification with hyperspectral imaging in a porcine model. Sci Rep. 12 (1), 11028 (2022).
- Mallick, I. H., Yang, W., Winslet, M. C., Seifalian, A. M. Ischemia-reperfusion injury of the intestine and protective strategies against injury. Dig Dis Sci. 49 (9), 1359-1377 (2004).
- Malekinejad, Z., et al. Prazosin treatment protects brain and heart by diminishing oxidative stress and apoptotic pathways after renal ischemia-reperfusion. Drug Res (Stuttg). 72 (6), 336-342 (2022).
- Feldman, Z. M., et al. Inferior mesenteric artery revascularization can supplement salvage of mesenteric ischemia. J Vasc Surg Cases Innov Tech. 9 (3), 101041 (2023).
- Munley, J. A., et al. Chronic mesenteric ischemia-induced intestinal dysbiosis resolved after revascularization. J Vasc Surg Cases Innov Tech. 9 (2), 101084 (2023).
- Lejay, A., et al. Ischemia reperfusion injury, ischemic conditioning and diabetes mellitus. J Mol Cell Cardiol. 91, 11-22 (2016).
- Huang, D., et al. Macrovascular complications in patients with diabetes and prediabetes. Biomed Res Int. 2017, 7839101 (2017).
- Liu, A., et al. Hmgb1 in the ischemic and non-ischemic liver after selective warm ischemia/reperfusion in rats. Histochem Cell Biol. 135 (5), 443-452 (2011).
- Koc, S., Dogan, H. O., Karatas, O., Erdogan, M. M., Polat, V. Mitochondrial homeostasis and mast cells in experimental hepatic ischemia-reperfusion injury of rats. Turk J Gastroenterol. 33 (9), 777-784 (2022).
- Chu, M. J., Vather, R., Hickey, A. J., Phillips, A. R., Bartlett, A. S. Impact of ischaemic preconditioning on experimental steatotic livers following hepatic ischemia-reperfusion injury: A systematic review. HPB (Oxford). 17 (1), 1-10 (2015).
- Chang, M. W., et al. Sitagliptin protects rat kidneys from acute ischemia-reperfusion injury via upregulation of GLP-1 and GLP-1 receptors. Acta Pharmacol Sin. 36 (1), 119-130 (2015).
- Boys, J. A., Toledo, A. H., Anaya-Prado, R., Lopez-Neblina, F., Toledo-Pereyra, L. H. Effects of dantrolene on ischemia-reperfusion injury in animal models: A review of outcomes in heart, brain, liver, and kidney. J. Investig Med. 58 (7), 875-882 (2010).
- Orihashi, K. Mesenteric ischemia in acute aortic dissection. Surg Today. 46 (5), 509-516 (2016).
- Byard, R. W. Acute mesenteric ischemia and unexpected death. J Forensic Leg Med. 19 (4), 185-190 (2012).
- Łagosz, P., Sokolski, M., Biegus, J., Tycinska, A., Zymlinski, R. Elevated intra-abdominal pressure: A review of current knowledge. World J Clin Cases. 10 (10), 3005-3013 (2022).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados