Galleria mellonella como modelo de triagem antimicrobiana
Neste Artigo
Resumo
Este estudo apresenta uma estrutura padronizada para otimizar os modelos de infecção por G. mellonella para uso na avaliação antimicrobiana pré-clínica. A aplicação de um modelo de G. mellonella como parte de um pipeline de desenvolvimento antimicrobiano pré-clínico pode diminuir o número de compostos ineficazes que progridem para ensaios clínicos.
Resumo
Para combater o crescente problema global de resistência aos antibióticos, o desenvolvimento acelerado de novos antibióticos é essencial. O desenvolvimento atual de antimicrobianos pré-clínicos produz um número significativo de pistas que se mostram inadequadas antes ou durante os ensaios clínicos. Para aumentar a eficiência do desenvolvimento pré-clínico, modelos relevantes, padronizados, acessíveis e econômicos devem ser desenvolvidos. As larvas de Galleria mellonella (mariposa-da-cera) são amplamente utilizadas como modelo de infecção para avaliar a virulência microbiana, realizar testes de toxicidade de medicamentos e servir como meio preliminar de avaliar a eficácia in vivo de novos compostos antimicrobianos. Esses modelos de infecção têm maior relevância biológica do que muitos exames in vitro de rendimento comparável e diminuem a dependência de modelos de mamíferos quando usados como pré-triagem para testes antimicrobianos. Este protocolo descreve uma metodologia padronizada para a otimização de modelos de infecção por G. mellonella , que pode ser aplicada a espécies bacterianas e terapêuticas antimicrobianas de escolha. Usando o patógeno prioritário da OMS Pseudomonas aeruginosa como exemplo, descrevemos as etapas que podem ser realizadas para desenvolver um modelo reprodutível de infecção e testes terapêuticos. Isso inclui recomendações sobre configuração experimental, preparação de amostras e protocolos de infecção e tratamento. A integração desse modelo nos pipelines de desenvolvimento de antimicrobianos pré-clínicos diminuiria a dependência de modelos de mamíferos, reduziria o número de compostos ineficazes que chegam aos ensaios clínicos e, em última análise, aumentaria a eficiência do desenvolvimento antimicrobiano pré-clínico.
Introdução
As larvas de Galleria mellonella (a mariposa da cera maior) são amplamente utilizadas nas ciências biológicas como modelos de infecção para espécies microbianas e para testes de toxicidade de novos compostos de drogas 1,2. Eles têm o potencial de utilidade considerável em um pipeline de testes antimicrobianos pré-clínicos, pois são de alto rendimento, replicam características integrais in vivo da infecção humana e reduzem a dependência de modelos de mamíferos, de acordo com os princípios de redução, refinamento e substituição que regem o uso ético de espécies de mamíferos em pesquisa.
O desenvolvimento de novos antibióticos requer extensos testes pré-clínicos em modelos in vitro e in vivo antes da validação clínica3. Apenas alguns novos agentes com pacotes de dados pré-clínicos promissores são traduzidos para a clínica, e um dos contribuintes para essa alta taxa de atrito é a falha das telas pré-clínicas em capturar as complexidades dos ambientes de infecção4. Essas questões contribuem não apenas para uma baixa taxa de tradução de agentes antimicrobianos para a clínica, mas também para um aumento do uso de animais vertebrados experimentais durante a triagem pré-clínica em estágio avançado. Para melhorar a avaliação pré-clínica de novos antimicrobianos e reduzir o uso de modelos in vivo murinos caros, demorados, complexos e eticamente problemáticos, são necessárias melhores ferramentas de triagem de medicamentos em estágio inicial que reduzam o número de compostos não promissores que progridem para testes em sistemas de vertebrados.
G. mellonella tem um ciclo de vida curto de 8 semanas, composto por quatro estágios de vida: ovo, larva, pupa e adultos, dos quais a forma larval é utilizada neste protocolo1. G. mellonella é fácil de manter durante todo o experimento sem a necessidade de equipamento especializado ou uma instalação dedicada à pesquisa animal. Não há necessidade de buscar aprovação ética para seu uso, e os pesquisadores podem criar o organismo internamente para melhorar a qualidade experimental 2,5,6,7. O sistema imunológico de G. mellonella se assemelha muito ao do sistema imunológico inato de mamíferos, com a capacidade de responder a estímulos "próprios" e "não próprios"8. Os hemócitos são responsáveis pelo reconhecimento do padrão molecular associado ao patógeno e subsequente fagocitose, desempenhando um papel funcionalmente análogo ao dos neutrófilos em humanos9. G. mellonella codifica três tipos de receptores toll-like que foram identificados por homologia de sequência com humanos e produzem proteínas semelhantes a complementos, que reconhecem material não próprio e formam complexos de melanização localizados após a ativação e polimerização da fenoloxidase em melanina10. Isso pode servir como uma leitura visual da saúde das larvas durante os experimentos de infecção, pois a cutícula é escurecida pela melanização. Deve-se notar, no entanto, que o eixo de melanização em insetos, que envolve a fenoloxidase, difere substancialmente do eixo tirosinase-melanina em mamíferos11,12. Além disso, G. mellonella produz 18 peptídeos antimicrobianos induzíveis, incluindo homólogos de lisozima e defensina13. Essa semelhança, bem como os procedimentos simples de manutenção larval e a natureza de alto rendimento do modelo, tornaram G. mellonella um organismo amplamente utilizado na avaliação de novos medicamentos. No desenvolvimento pré-clínico de antibióticos, G. mellonella tem maior utilidade em comparação com modelos in vitro, pois podem modelar com mais precisão as interações hospedeiro-patógeno-droga em um ambiente complexo com imunidade ativa.
Atualmente, não existe um fornecedor padronizado de G. mellonella para pesquisa na Europa. Em vez disso, os pesquisadores devem comprar larvas de G. mellonella em lojas de iscas ou manter sua própria colônia. Embora métodos para manter uma colônia interna de G. mellonella tenham sido descritos e possam aumentar a consistência experimental 5,6,7, essa opção provavelmente será atraente apenas para aqueles que usam as larvas com frequência. Como tal, este protocolo se concentra na configuração experimental após a compra de larvas de um fornecedor de iscas vivas. Embora mais acessível, esse método aumenta a complexidade experimental e pode introduzir variabilidade adicional nos ensaios devido a inconsistências na saúde das larvas no ponto em que são recebidas dos fornecedores. Para que acadêmicos, indústria e reguladores aceitem e adotem o teste de G. mellonella como parte de um pipeline de desenvolvimento antimicrobiano pré-clínico, é necessário um sistema padronizado para otimização e avaliação da eficácia antimicrobiana.
Este estudo otimiza o desenho experimental de um modelo de infecção por G. mellonella para o desenvolvimento de antibióticos. Embora os modelos de infecção por G. mellonella tenham sido descritos14,15, a presente metodologia documenta etapas adicionais para mitigar a complexidade adicional introduzida pela inconsistência do fornecimento e fornece uma estrutura para a avaliação de novos antimicrobianos. Como caso de teste, G. mellonella foi infectada com o patógeno prioritário da OMS, Pseudomonas aeruginosa, e o tratamento com um agente aminoglicosídeo (tobramicina) foi otimizado. Essa estrutura, ilustrada na Figura 1, fornece uma base para futuros estudos pré-clínicos de triagem antimicrobiana com novos agentes.
Protocolo
Neste estudo, as larvas de Galleria mellonella (mariposa-da-cera) foram selecionadas como modelo para testes de suscetibilidade a antibióticos e ensaios de toxicidade aguda. Não é necessária aprovação ética para o uso experimental de Galleria mellonella. Os detalhes dos reagentes e equipamentos usados estão listados na Tabela de Materiais.
1. Desenho experimental
- Determine os tamanhos apropriados dos grupos de larvas de Galleria mellonella com base na mudança proporcional na sobrevivência larval que o estudo pretende capturar. A Tabela 1 detalha os tamanhos de grupo necessários para detectar alterações percentuais específicas na sobrevida usando um modelo de infecção por PAO1 da cepa Pseudomonas aeruginosa .
NOTA: Ao usar um novo patógeno, primeiro determine a variabilidade entre ensaios na sobrevivência proporcional de larvas infectadas, mas não tratadas, pois isso influenciará a determinação do tamanho da amostra.- Inclua dois grupos de controles PBS: um injetado antes do resto das infecções para garantir que a seringa esteja afiada e adequada para uso, e outro injetado durante ou após infecções bacterianas para garantir a esterilização adequada entre os grupos de infecção. Se estiver otimizando com um novo patógeno, inclua um controle tratado termicamente para garantir que a morte não seja resultado de uma resposta imune a partículas estranhas.
NOTA: Seringas de insulina podem ser usadas para injeções, reduzindo os riscos de embotamento e contaminação. No entanto, experimentos podem usar rotineiramente centenas de G. mellonella, tornando o uso de seringas de insulina caro e um desperdício. - Para estudos que otimizam o tratamento antibacteriano, inclua dois controles adicionais: um grupo infectado com bactérias e depois injetado com um tratamento 'simulado' de veículo e um grupo injetado duas vezes com o veículo, uma vez no momento da infecção para as outras condições e uma vez no momento do tratamento.
NOTA: O primeiro é um controle não tratado, enquanto o último controla qualquer trauma causado pelas injeções. Esse trauma é mais provável quando agulhas rombas são usadas.
- Inclua dois grupos de controles PBS: um injetado antes do resto das infecções para garantir que a seringa esteja afiada e adequada para uso, e outro injetado durante ou após infecções bacterianas para garantir a esterilização adequada entre os grupos de infecção. Se estiver otimizando com um novo patógeno, inclua um controle tratado termicamente para garantir que a morte não seja resultado de uma resposta imune a partículas estranhas.
- Encomende G. mellonella de um fornecedor de iscas vivas ou mantenha uma colônia de G. mellonella conforme descrito anteriormente 5,6,7. Para o fornecedor listado na Tabela de Materiais, peça 1,8 vezes o número planejado de larvas, pois aproximadamente 33% serão excluídos com base no tamanho e outros 10% podem morrer após a esterilização da cutícula.
- Determine a variabilidade de peso de G. mellonella antes do uso experimental e certifique-se de que a faixa de peso não exceda um desvio padrão da média.
NOTA: Para fornecedores não listados na Tabela de Materiais, providencie para que o fornecedor forneça novo estoque.
- Determine a variabilidade de peso de G. mellonella antes do uso experimental e certifique-se de que a faixa de peso não exceda um desvio padrão da média.
- Após o recebimento, armazene G. mellonella em temperatura ambiente para limitar a chance de casulo, que ocorre após a incubação a 37 °C.
NOTA: Nem todas as larvas de fornecedores comerciais formam casulos, que já foram usados como indicador da saúde larval16. - Use larvas dentro de 1 semana após o recebimento, caso em que não precisam ser alimentadas.
NOTA: Embora o estágio de vida das larvas varie entre os lotes, a maioria das larvas é entregue durante o último ínstar antes da pupa. Nesse estágio, a alimentação diminui naturalmente em comparação com os estágios anteriores17.
2. Esterilização e seleção de larvas de G. mellonella
- Pese as larvas de Galleria mellonella e descarte as que estiverem fora da faixa de 224 mg ± 49,2 mg, que é o peso médio das larvas mais ou menos um desvio padrão. Isso resultará na exclusão de aproximadamente 33% das larvas.
NOTA: A variação de peso pode diferir entre os fornecedores. Para fornecedores não listados neste protocolo, calcule uma faixa de peso apropriada. - Execute as etapas a seguir em condições assépticas.
- Pulverize etanol 70% em uma placa de Petri, garantindo o suficiente para cobrir o fundo da placa.
- Esterilize a superfície de G. mellonella em lotes de 10-20 larvas.
- Coloque cada lote individualmente no prato e borrife as larvas duas vezes com etanol 70%.
- Use uma pinça para rolar as larvas, garantindo cobertura total.
- Retire as larvas do etanol e coloque-as em uma placa de Petri estéril. Deixe o prato descoberto para permitir que as larvas sequem.
CUIDADO: Deixar G. mellonella em etanol por mais de 15 s resultará em alta mortalidade.
- Uma vez que aproximadamente 90% das larvas tenham recuperado a atividade após 2 h, separe as larvas recuperadas em grupos de tamanho que permita detectar alterações de sobrevivência suficientes de acordo com os cálculos de poder detalhados na Tabela 1.
- Use G. mellonella dentro de 6 h após a esterilização.
3. Otimizando a densidade do inóculo bacteriano
- Prepare um estoque de infecção bacteriana de uma UFC/mL conhecida antes da infecção. Os métodos de geração de estoques variam de acordo com o organismo. Aqui, Pseudomonas aeruginosa foi cultivada até a fase intermediária em caldo nutritivo, alíquota e congelada a uma densidade de 6 x 107 UFC / mL.
- Pulverize o estoque de infecção centrifugando a 10.000 x g em temperatura ambiente por 5 min e ressuspenda em PBS. Diluir em série o estoque bacteriano dez vezes para gerar uma faixa de doses de inóculo de 10 1-107 UFC por larva, considerando que cada larva é injetada com 10 μL de inóculo.
NOTA: A faixa de dose específica do inóculo será diferente dependendo da virulência bacteriana, mas a faixa proposta aqui deve ser adequada para a maioria das espécies patogênicas. A determinação da taxa de crescimento in vitro pode ajudar a informar a seleção de uma faixa de dose apropriada, pois a taxa de crescimento específica da cepa em cultura líquida está correlacionada com a mortalidade larval. - Antes de iniciar as infecções, enumere o inóculo com uma diluição seriada de Miles e Misra para determinar com precisão a densidade do inóculo18.
- Prepare três tubos de microcentrífugas de 1 mL contendo dH2O estéril, etanol a 70% ou PBS estéril. Estes serão usados continuamente para esterilizar a seringa usada para injetar as larvas.
- Inspecione uma seringa Hamilton estéril de 100 μL, certificando-se de que a ponta da agulha esteja afiada e não tenha desenvolvido um gancho, o que causará trauma significativo no local da infecção.
CUIDADO: A ponta da agulha da seringa Hamilton começará a deformar após aproximadamente 300 infecções. Se a ponta da agulha estiver deformada, ela deve ser substituída. - Lave a seringa sequencialmente com dH2O, etanol e PBS antes das infecções, retirando e descartando a capacidade máxima da seringa.
- Agitar o inóculo de infecção ressuspenso e aspirar um máximo de 100 μL para a seringa de Hamilton, suficiente para injetar 10 μL por larva.
- Injetar 10 μL de inóculo em cada larva na properna traseira direita. Certifique-se de que a agulha penetra aproximadamente 2 mm no corpo.
NOTA: Vários métodos de infecção podem ser usados. Isso inclui segurar a larva sobre a ponta de uma pipeta para expor as propernas, prender a seringa estaticamente e posicionar o G. mellonella com a mão ou injetar à mão livre. - Entre cada conjunto de infecções, esterilize a seringa conforme detalhado na etapa 2.5 para evitar a contaminação por comensais residuais da pele.
- Incubar as larvas infectadas a uma temperatura suficiente para o crescimento microbiano, entre 20 °C e 42 °C, que é uma faixa apropriada para a sobrevivência de G. mellonella 5.
- Monitore a sobrevivência de G. mellonella em intervalos regulares a partir do momento em que a mortalidade é geralmente observada pela primeira vez para medir com precisão o momento da morte. Isso deve ser avaliado em uma primeira triagem. Remova todas as larvas mortas e registre a hora da morte.
- Selecione a dose ideal de infecção para um estudo de teste terapêutico com base na dose que produz 50% de mortalidade em 18 h e mais de 80% em 72 h. Isso permite o desenvolvimento de uma triagem rápida de um dia, garantindo virulência suficiente e uma janela terapêutica apropriada.
4. Ensaios de toxicidade de novos agentes antimicrobianos em larvas não infetadas
- Avaliar a toxicidade de novos antimicrobianos e veículos escolhidos em Galleria mellonella antes de seu uso com larvas infectadas experimentalmente. Preparar uma ampla gama de doses que excedam a faixa terapêutica esperada do antimicrobiano, guiadas por dados de toxicidade in vitro (por exemplo, linhagem celular), se disponíveis.
- Considere que as larvas serão injetadas com 10 μL da terapêutica. Preparar controlos apenas para veículos em concentrações correspondentes àquelas em que a terapêutica é administrada.
- Injetar G. mellonella saudável e estéril em grupos apropriados com as diferentes concentrações de agentes antimicrobianos e PBS, conforme detalhado nas etapas 3.2 a 3.10. No presente estudo, o antimicrobiano utilizado foi a tobramicina.
NOTA: Para agentes que requerem DMSO como solvente, injete com uma agulha de calibre 26s, em vez da agulha padrão de calibre 22, pois o trauma de agulhas maiores aumenta a mortalidade ao usar DMSO. - Defina uma dose segura como aquela que não produz diferença significativa na mortalidade em comparação com as larvas injetadas apenas com PBS.
5. Otimizando o tratamento da infecção bacteriana por G. mellonella com um agente antimicrobiano
- Preparar uma gama de doses do antimicrobiano, considerando que as larvas infectadas são tratadas com uma dose de 10 μL. Use uma variedade de doses com toxicidade mínima, conforme avaliado na etapa 4.
- Siga as etapas 1 e 2 deste protocolo para preparar e infectar Galleria mellonella em grupos apropriados na dose de infecção previamente otimizada.
- 2 h após a infecção, trate as larvas com o agente antimicrobiano preparado ou solução de controle do veículo. Siga os passos 3.2-3.8, injetando na perna oposta à injetada durante a infecção. Esterilize a agulha entre os grupos.
NOTA: O tratamento em 2 h foi selecionado para essa otimização para adquirir dados fortes de dose-resposta, a partir dos quais foi determinada a otimização subsequente do tempo de tratamento19. - Monitore a sobrevivência de G. mellonella em intervalos de 30 minutos ou com mais frequência a partir do momento em que a mortalidade é geralmente observada pela primeira vez. Remova todas as larvas mortas e registre a hora da morte.
- Calcule a mudança nas proporções de sobrevida entre os grupos de tratamento. Use a análise de sobrevivência de Kaplan-Meier para determinar se o tratamento leva a uma mortalidade larval significativamente alterada. Inclua a correção post-hoc apropriada para multiplicidade em pares em análises de vários grupos.
6. Otimizando o tempo de tratamento de G. mellonella infectada
- Siga as etapas 1 e 2 para preparar Galleria mellonella em grupos apropriados na dose de infecção previamente otimizada.
- Prepare o agente antimicrobiano na dose previamente otimizada na etapa 4.
- Em 2 h, 4 h, 6 h, 9 h ou 12 h após a infecção, trate as larvas infectadas seguindo as etapas 3.2-3.8 para comparar como o momento do tratamento afeta a mortalidade.
- Monitore a sobrevivência de G. mellonella em intervalos de 30 minutos ou com mais frequência a partir do momento em que a mortalidade é geralmente observada pela primeira vez. Remova todas as larvas mortas e registre a hora da morte. O momento ideal é aquele que mantém a sobrevida observada após a otimização inicial da dose de tratamento.
NOTA: Ao testar a eficácia antimicrobiana em G. mellonella, otimize a dose e o tempo de tratamento separadamente, usando o primeiro para informar a dose de tratamento no segundo.
Resultados Representativos
Avaliação da variação do lote no peso de G. mellonella
Uma fonte potencial de variação indesejada em experimentos de infecção vem de diferenças de tamanho entre unidades experimentais individuais (ou seja, larvas) e entre lotes. Os efeitos dessa variação podem ser mitigados ajustando as doses de tratamento ou infecção com base no peso ou selecionando apenas as larvas dentro de uma faixa de peso definida para uso em experimentos. Este último ajuste é mais pragmático e não está sujeito a erros humanos que possam surgir durante a preparação da dose. Uma vantagem adicional da pesagem das larvas é que ela permite a conversão das doses de tratamento daquelas administradas às larvas para seus equivalentes em mg / kg humanos. Para quantificar a variação dentro e entre lotes, três lotes de 50 larvas, encomendados em momentos diferentes, foram pesados. O peso médio em cada grupo foi de 225,5 mg, 230,54 mg e 215,86 mg, com desvios-padrão de 49,1 mg, 53,7 mg e 44,3 mg, respectivamente (Figura 2A). Entre os lotes, não houve diferença significativa no peso. Entre os lotes, o peso variou de 107,5 mg a 341,0 mg, com média de 224,0 mg ± 49,2 mg.
Para obter resultados reprodutíveis, as larvas foram pesadas antes da experimentação e selecionadas se seu peso fosse de 224 mg ± 49,2 mg, reduzindo a faixa de peso de 233,5 mg para 98,4 mg e removendo 33% das larvas. Isso está de acordo com trabalhos anteriores que identificaram variação significativa na sobrevivência de larvas infectadas com MRSA com faixas de peso superiores a 100 mg14,20. Também comparamos o peso de G. mellonella no ponto de entrega com o de uma semana após o parto, pois qualquer mudança significativa de peso pode influenciar os resultados experimentais quando as larvas não são usadas imediatamente após a chegada. O peso médio de G. mellonella foi de 230,54 mg ± 53,7 mg. Uma semana após o parto, o peso médio foi de 221,8 mg ± desvio padrão de 45,7 mg (Figura 2B). Não houve diferença significativa entre o peso na chegada e o peso após uma semana, a partir do qual concluímos que as larvas podem ser usadas para fins experimentais a qualquer momento na primeira semana após o parto. É importante observar que esses resultados são representativos apenas de G. mellonella comprado de um fornecedor, e o peso pode diferir significativamente entre fornecedores ou quando as larvas são encomendadas em momentos diferentes.
Otimizando a densidade de inóculo de P. aeruginosa PAO1
A virulência de cinco isolados de P. aeruginosa em quatro densidades de inóculo foi avaliada, incluindo três cepas de laboratório comumente usadas, PAO1, PA14 e PAK, e dois isolados clínicos de infecção respiratória crônica, LESB58 e IST27-M. Estes foram usados como parte de um painel de cepas relevante para FC desenvolvido por Mahenthiralingam et al.21 e são representativos da filogenia global da espécie. Dados preliminares de crescimento em caldo nutriente mostraram uma menor taxa de crescimento para os isolados de infecção crônica (Figura 3). Considerando isso, G. mellonella foi infectada em grupos de 10 larvas com doses de 101, 102, 103 ou 104 UFC/larva em 10μl de PBS para PAO1, PA14 e PAK, e doses de 102, 103, 104 ou 105 UFC/larva para LESB58 e IST27-M. Dois grupos de 10 larvas também foram injetados apenas com PBS, um grupo antes e um grupo após as infecções. As injeções de PBS antes das infecções controlam o PBS contaminado ou a contaminação de agulhas com espécies microbianas da cutícula da Galleria, enquanto as injeções de PBS após o controle da infecção para qualquer contaminação das agulhas com bactérias usadas no processo de infecção. As doses ideais para PAO1, PA14 e PAK foram de 10 UFC/larva, pois densidades maiores resultaram em > 50% de morte em 18 h (Figura 4). 10 UFC foi a dose mais baixa que poderia ser preparada de forma confiável e reprodutível para infecção. Doses mais altas de LESB58 e IST27-M foram necessárias para atingir a cinética de sobrevivência desejada, refletindo o crescimento mais lento e a menor capacidade de suporte desses isolados em condições in vitro (Figura 4). A dose ótima para ambos foi de 104 UFC/larva. LESB58 e IST27-M são isolados clínicos de indivíduos com infecções crônicas, e LESB58 já demonstrou menor virulência em modelos de roedores do que PAO122.
Teste de toxicidade de tobramicina e colistina em Galleria mellonella
Antes de avaliar a eficácia de novos compostos antimicrobianos, sua toxicidade deve ser avaliada por meio da injeção de uma ampla gama de doses clinicamente relevantes. Isso permite que compostos com alta toxicidade sejam removidos dos testes no início do pipeline pré-clínico. A tobramicina e a colistina foram avaliadas contra larvas de G. mellonella não infectadas, pois são comumente administradas para o tratamento da infecção por P. aeruginosa em pessoas com fibrose cística (pwFC)23. O uso clínico da tobramicina varia de 3 mg/kg por dia para indivíduos gravemente enfermos sem fibrose cística a 11 mg/kg a cada 24 h para aqueles com fibrose cística24,25. Estes valores foram utilizados como guia para a dosagem em Galleria mellonella, com 1 mg/kg, 2,5 mg/kg, 5 mg/kg, 10 mg/kg, 25 mg/kg, 50 mg/kg, 100 mg/kg, 250 mg/kg de tobramicina selecionada para testes de toxicidade. Nenhuma morte foi observada em qualquer concentração. Considerando a ausência de toxicidade da tobramicina em altas concentrações, a toxicidade da colistina foi avaliada, pois já havia sido previamente associada à nefrotoxicidade ou neurotoxicidade em 29,8% das pcFC, com uma dose de ataque de 2,9 (±1,5) mg/kg e a dose diária total de 4,1 (±1,1) mg/kg26. Isso o tornou um candidato valioso para testes de toxicidade, embora os efeitos específicos de órgãos em humanos sugiram que a toxicidade pode não se traduzir em G. mellonella. De fato, quando doses de 1 mg / kg, 2,5 mg / kg, 5 mg / kg, 10 mg / kg, 25 mg / kg, 50 mg / kg, 100 mg / kg e 250 mg / kg de colistina foram administradas, nenhuma morte de larvas foi observada em 72 h. Como tal, a colistina foi finalmente administrada em sua maior solubilidade em H2O, a 2000 mg / kg. A morte de todas as larvas foi observada em 12 h, confirmando que a toxicidade do medicamento pode ser avaliada em G. mellonella, mas que deve-se ter cuidado ao tentar prever a toxicidade humana.
Otimizando a dosagem de tratamento de tobramicina contra a infecção por P. aeruginosa PAO1
Uma variedade de doses clinicamente relevantes de tobramicina foi administrada a larvas infectadas por P. aeruginosa para otimizar a dosagem do tratamento. Para novos antimicrobianos, a dosagem pode ser inicialmente selecionada com base no uso clínico de antibióticos semelhantes existentes ou em dados pré-clínicos para o novo agente, como concentrações inibitórias mínimas em caldo. Para avaliar a eficácia da tobramicina contra P. aeruginosa PAO1, as larvas de G. mellonella foram infectadas com 10 UFC de P. aeruginosa PAO1, conforme otimizado anteriormente, e injetadas com 1 mg/kg, 2,5 mg/kg ou 5 mg/kg de tobramicina 2 h após a infecção. Essas doses foram escolhidas com base em trabalhos anteriores de G. mellonella com tobramicina e estão de acordo com as doses clínicas atuais de tobramicina em indivíduos sem fibrose cística 24,27,28.
O limiar para o sucesso inicial foi um aumento de 50% na sobrevida de G. mellonella em comparação com os controles não tratados. O tratamento com PAO1 com 1 mg/kg de tobramicina teve pouco impacto na mortalidade por G. mellonella , com 90% de morte em 28 h pós-infecção (Figura 5). O tratamento com 2,5 mg/kg de tobramicina atrasou a mortalidade, mas produziu 80% de mortalidade geral com 5 mg/kg de tobramicina, resultando em uma sobrevida ideal de 90%. A dose efetiva para PA14 foi de 5 mg/kg, mas para PAK foi de 2,5 mg/kg. A dose efetiva para IST27-M foi maior em 10 mg / kg, enquanto nenhuma concentração de tobramicina testada foi suficiente para resgatar as larvas da infecção por LESB58. Essa tendência se correlacionou com os valores de concentração inibitória mínima (CIM) para tobramicina em caldo Mueller Hinton ajustado para cátions, no qual 1 μg/mL foi suficiente para inibir 90% do crescimento em todas as cepas, exceto LESB58, que teve uma CIM de 8 μg/mL. Como tal, o teste inicial de CIM pode ser usado para indicar resistência relativa entre cepas, embora não deva ser usado para determinar os intervalos de dose em G. mellonella, que devem ser otimizados separadamente.
Otimização do tempo de tratamento com tobramicina contra a infecção por P. aeruginosa PAO1
A aplicação clínica de antibióticos normalmente não ocorre horas após a infecção, mas dias ou semanas depois. O teste de novos antimicrobianos dessa maneira é inatingível em G. mellonella, pois alta mortalidade é observada dentro de 24 h após a infecção por P. aeruginosa PAO1. Para aumentar a relevância do modelo de infecção, novos antimicrobianos devem ser administrados o mais tarde possível durante a infecção. Para otimizar os tempos de tratamento, 5 mg/kg de tobramicina foram administrados a larvas de G. mellonella infectadas com PAO1 em 2 h, 4 h, 6 h, 9 h e 12 h após a infecção. O sucesso experimental foi definido como o tratamento com antibióticos que produziu um aumento de >50% na sobrevida em comparação com a infecção por PAO1. O tratamento em 9 h e 12 h retardou a mortalidade, embora não tenha sido capaz de resolver a infecção (Figura 6). O tratamento em 2 h, 4 h e 6 h proporcionou sobrevida superior a 50%.
Otimização do tamanho do grupo de G. mellonella
O tamanho do grupo experimental foi calculado com base na variação observada na sobrevida de G. mellonella após a infecção com 10 UFC/larvas de P. aeruginosa PAO1. O tamanho do grupo pode diferir com base na mudança percentual esperada entre o grupo de controle e o grupo de tratamento não tratado em qualquer estudo (Tabela 1). Os cálculos seguiram o descrito por Charan et al.29. A equação utilizada é descrita a seguir.
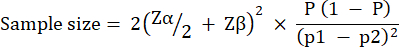
Onde:
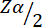 = 1,96 no erro tipo 1 de 5%.
= 1,96 no erro tipo 1 de 5%.
Zβ = 0,842 é o valor que fornece 80% de poder estatístico.
p1 = A proporção de eventos no grupo de teste, calculada como p2 + a variação percentual esperada
p2 = A proporção de eventos no grupo controle (infecção não tratada), calculada com base na variabilidade de sobrevivência de P. aeruginosa PAO1 em 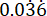 .
.
P = Prevalência combinada, definida como (p1 + p2)/2.
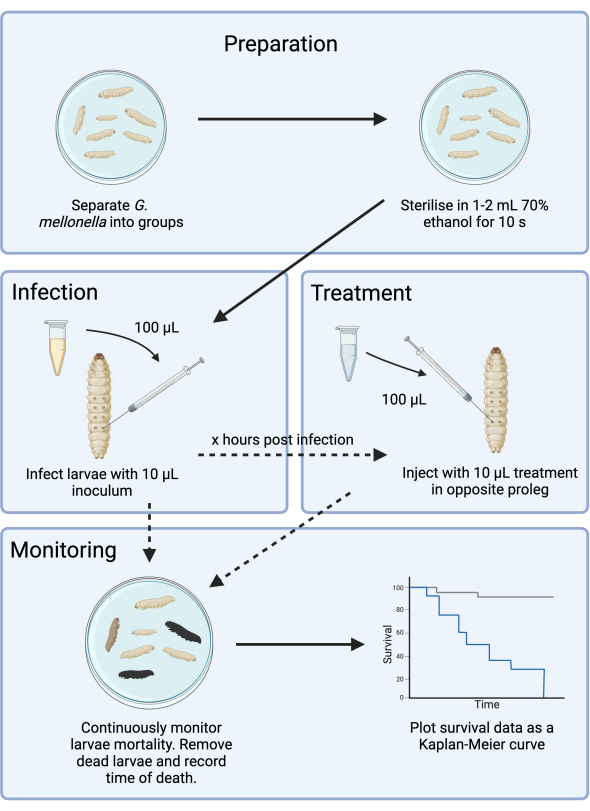
Figura 1: Esquema de um estudo de infecção por G. mellonella . O protocolo geral envolve a preparação de larvas de G. mellonella antes da infecção, infecção com inóculo de 10 μL, o tratamento opcional em algumas horas após a infecção e monitoramento contínuo. Clique aqui para ver uma versão maior desta figura.
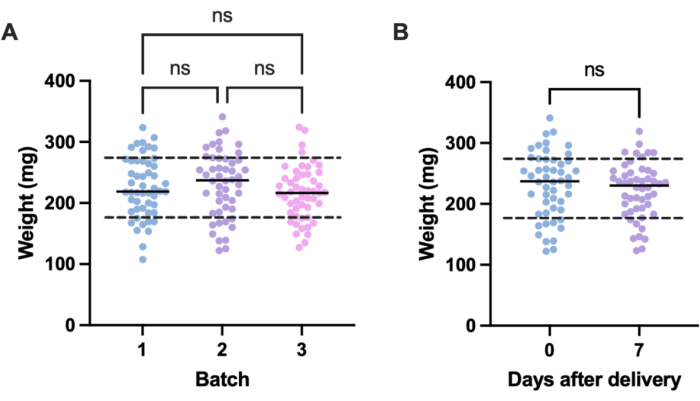
Figura 2: Variação dependente do lote e do tempo no peso das larvas de Galleria mellonella . (A) Peso de três lotes de 50 larvas de Galleria mellonella pesadas imediatamente após a entrega. Cada lote foi encomendado em momentos diferentes. Não houve diferença significativa no peso entre os lotes, conforme calculado por uma ANOVA de uma via (P > 0,05). (B) Peso de 50 larvas pesadas no recebimento em comparação com o mesmo lote pesado uma semana depois. Não houve diferença significativa no peso calculado pelo teste t de Student (P > 0,05). ns: Não é significativo. Clique aqui para ver uma versão maior desta figura.
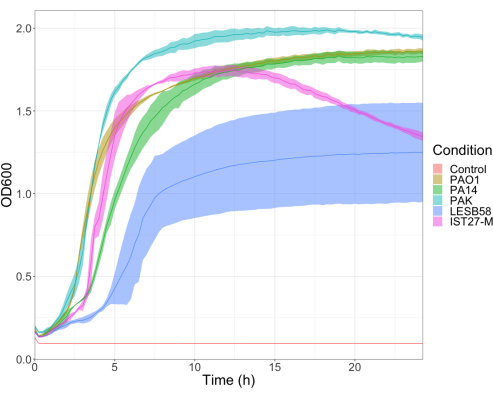
Figura 3: Curvas de crescimento das cepas de P. aeruginosa PAO1, PA14, PAK, LESB58 e IST27-M. Cada cepa foi cultivada em LB a partir de um OD600 inicial de 0,08-0,13, e OD600 foi posteriormente medido a cada 15 min durante 24 h de crescimento estático a 37 ° C. Clique aqui para ver uma versão maior desta figura.
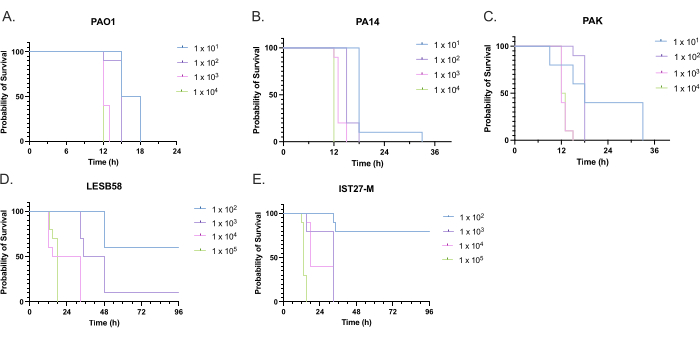
Figura 4: Otimização da densidade de inóculo de cepas de Pseudomonas aeruginosa para infecção de larvas de Galleria mellonella . Sobrevivência de larvas de Galleria mellonella após injeção com diferentes densidades de unidades formadoras de colônias (UFC) por larva. As densidades de inóculo testadas foram 10, 10², 10³ ou 104 UFC por larva para (A) PAO1, (B) PA14 ou (C) PAK e 10², 10³, 104 ou 105 UFC por larva para (D) LESB58 e (E) IST27-M. Foram utilizadas dez larvas por grupo, cada uma injetada com 10 μL de inóculo na properna traseira direita. A sobrevida foi monitorada a cada 30 minutos a partir de 16 h após a infecção, e o momento do óbito foi registrado. Todas as cepas apresentaram virulência dose-dependente, conforme determinado pelo teste Log-rank (Mantel-Cox) para significância. P < 0,05 para todas as comparações de dose dentro da cepa, exceto para PAK 101 vs. PAK 102, PAK 103 vs. PAK 104, LESB58 104 vs. LESB58 105 e IST27-M 103 vs. IST27-M 104, que não foram significativos. Esta figura é representativa de três réplicas biológicas. Clique aqui para ver uma versão maior desta figura.
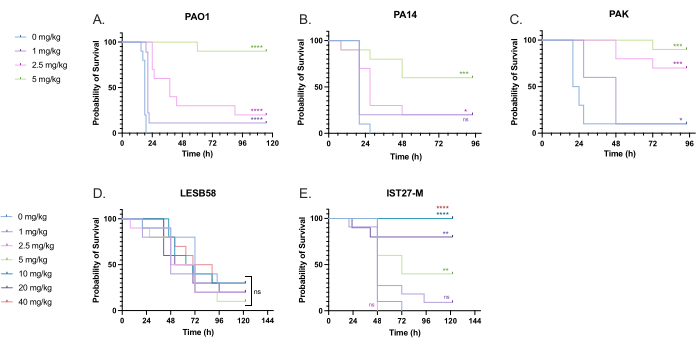
Figura 5: Sobrevivência de larvas de Galleria mellonella após injeção com cepas de painel de P. aeruginosa e tratamento com sulfato de tobramicina 2 h após a infecção. 10 larvas de G. mellonella por grupo experimental foram infectadas com 10 UFC de (A) PAO1, (B) PA14 ou (C) PAK ou 103 UFC de (D) LESB58 ou (E) IST27-M por larva em 10 μL de PBS. As infecções foram administradas na proleg traseira esquerda. 2 h após a infecção, PAO1, PA14 e PAK foram injetados com 10 μL de PBS como controle sem tratamento, 1 mg/kg, 2,5 mg/kg ou 5 mg/kg de tobramicina, com LESB58 e IST27-M tratados com 10 μL de PBS, 1 mg/kg, 2,5 mg/kg, 5 mg/kg, 10 mg/kg, 20 mg/kg ou 40 mg/kg de tobramicina, conforme indicado na figura. A tobramicina foi diluída em água destilada e administrada na properna traseira direita. A sobrevida foi monitorada continuamente e o momento do óbito foi registrado. Teste de log-rank (Mantel-Cox) para significância vs. o controle PBS para cada cepa. ns: Não significativo, *P < 0,05, **P < 0,005, ***P < 0,0005 ****P < 0,0001. Esta figura é representativa de três réplicas biológicas. Clique aqui para ver uma versão maior desta figura.
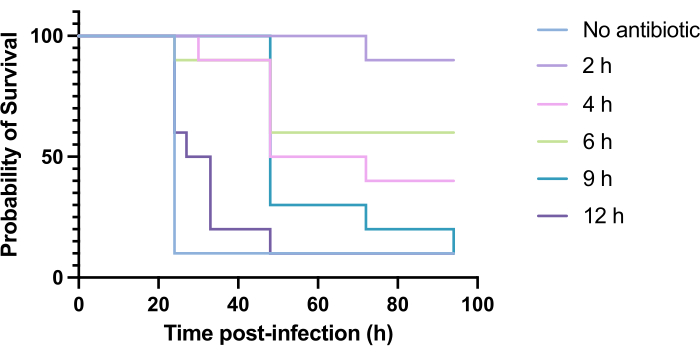
Figura 6: Sobrevivência de larvas de Galleria mellonella após infecção por Pseudomonas aeruginosa PAO1 e subsequente tratamento com tobramicina em vários momentos pós-infecção. 10 larvas de G. mellonella por grupo experimental foram infectadas com 10 UFC de PAO1 em 10 μL de PBS, injetadas na properna traseira direita. As larvas foram posteriormente injetadas 2 h, 4 h, 6 h, 9 h ou 12 h pós-infecção com 5 mg/kg de sulfato de tobramicina em 10 μL de água destilada na properna traseira esquerda. A sobrevida foi monitorada continuamente e o momento do óbito foi registrado. Teste de log-rank (Mantel-Cox) para significância vs. controle não tratado. P < 0,0005, **** P < 0,0001. Esta figura é representativa de três réplicas biológicas. Clique aqui para ver uma versão maior desta figura.
| Mudança esperada na sobrevida (%) | Tamanho do grupo |
| 30 | 26 |
| 40 | 18 |
| 50 | 13 |
| 60 | 10 |
| 70 | 8 |
| 80 | 6 |
| 90 | 5 |
| 100 | 4 |
Tabela 1: Tamanho do grupo para experimentos de sobrevivência de G. mellonella em que larvas de G. mellonella são infectadas com 10 UFC/larvas com P. aeruginosa PAO1 e subsequentemente administradas a um agente.
Discussão
A carga da resistência antimicrobiana (RAM) está aumentando continuamente. Em 2019, estima-se que 4,95 milhões de mortes foram associadas à RAM em todo o mundo30. Até 2050, estima-se que a mortalidade causada pela RAM chegue a 10 milhões31. Para lidar com esse risco, novos antimicrobianos devem ser desenvolvidos e testados de forma eficiente e econômica, exigindo o uso de modelos pré-clínicos que prevejam com precisão a eficácia antimicrobiana. A alta taxa de atrito observada durante a tradução para ensaios clínicos é um importante fator limitante. Um estudo descreveu 13 candidatos a antibióticos que falharam em ensaios clínicos, com 11 não progredindo para a fase II32.
O presente estudo fornece uma estrutura para a otimização dos estudos de triagem antimicrobiana pré-clínica de G. mellonella e um método para avaliação da eficácia antimicrobiana. As larvas de G. mellonella têm utilidade considerável na avaliação da toxicidade de drogas, determinação de CIM e testes de virulência, ao mesmo tempo em que contribuem para a redução de mamíferos usados no desenvolvimento pré-clínico. As larvas de Galleria mellonella têm rendimento relativamente alto, são biologicamente relevantes e se traduzem bem em modelos de mamíferos mais complexos. Enquanto isso, enquanto os camundongos de laboratório do tipo selvagem custam entre £ 8 e £ 30 cada, com manutenção semanal de ~ £ 7 por camundongo, G. mellonella custa ~ £ 2 por 50 larvas. Testar 10 compostos em um modelo de G. mellonella custaria, portanto, ~ £ 60, em comparação com mais de £ 4000 para o mesmo estudo em camundongos. Além disso, estudos anteriores compararam a toxicidade e a eficácia de novos compostos e identificaram uma correlação entre toxicidade aguda em G. mellonella e camundongos 8,19,33. Portanto, recomenda-se a implementação de uma tela de G. mellonella para priorizar compostos a serem testados em modelos de camundongos.
Apesar da clara utilidade do modelo, há várias considerações para garantir uma aplicação bem-sucedida. A falta de larvas estéreis de grau de pesquisa complica sua preparação para uso experimental, pois a esterilização por etanol é necessária ou os pesquisadores são obrigados a manter sua própria colônia de G. mellonella, o que mitigaria o risco de contaminação e melhoraria a qualidade experimental geral 5,6. A esterilização inadequada pode resultar em mortalidade considerável, e é um desafio esterilizar totalmente o organismo, pois um tempo mais longo de exposição ao etanol leva à morte. Métodos alternativos de esterilização incluem esfregar a proleg de cada larva com etanol a 70% antes da infecção, o que diminuiria a mortalidade durante a esterilização, mas é um método mais trabalhoso. Outros antissépticos também poderiam ser usados, embora nenhuma alternativa tenha sido avaliada neste estudo, pois a esterilização com etanol rendeu <10% de morte, uma vez otimizada. Além disso, muitas vezes não está claro se os fornecedores tratam sua G. mellonella com antibióticos, pois os fornecedores podem obter suas larvas de outros fornecedores em vez de manter colônias.
A biologia de G. mellonella difere consideravelmente dos mamíferos, o que impõe limitações à sua utilidade. Seu sistema imunológico carece de imunidade adaptativa, embora os principais aspectos solúveis e celulares da imunidade inata estejam presentes. Os hemócitos são a principal defesa imune inata de G. mellonella e exibem propriedades semelhantes a fagócitos. Vários subconjuntos dessas células foram descritos, incluindo granulócitos e plasmatócitos, entre outros34. G. mellonella também não pode recapitular locais de infecção relevantes, como os de infecções respiratórias ou da bexiga. No entanto, em um pipeline pré-clínico, G. mellonella serviria como uma pré-triagem para modelos murinos, garantindo que apenas os compostos mais promissores progredissem para o complexo sistema de mamíferos que mais se assemelha aos ambientes de infecção humana. Finalmente, o modelo se beneficiaria de uma caracterização genômica adicional de G. mellonella para determinar sua adequação para avaliar mudanças em biomarcadores clinicamente relevantes. Em particular, isso requer melhorar nossa compreensão da imunidade a G. mellonella.
No geral, o modelo de infecção por Galleria mellonella é uma ferramenta valiosa para a avaliação pré-clínica de novos compostos antimicrobianos antes de sua avaliação em modelos de mamíferos. Embora seu uso seja complicado pela falta de padronização de fornecimento, sua aplicação é de alto rendimento, simples e pode ser aplicada amplamente em todo o cenário de desenvolvimento antimicrobiano. No futuro, a integração desse modelo em um pipeline pré-clínico padronizado pode acelerar o desenvolvimento de novos compostos antimicrobianos para aumentar a proporção de candidatos que progridem da avaliação pré-clínica para os ensaios clínicos.
Divulgações
Os autores não têm nada a divulgar.
Agradecimentos
TB, AK, JF e DN receberam apoio financeiro para o Centro de Pesquisa Estratégica (SRC) "Uma estrutura pré-clínica baseada em evidências para o desenvolvimento de terapêuticas antimicrobianas na fibrose cística" (PIPE-CF; Projeto nº. SRC 022) do UK Cystic Fibrosis Trust e da US Cystic Fibrosis Foundation. LD e JF reconhecem o financiamento da Kidney Research North West (Projeto nº 49/19).
Materiais
| Name | Company | Catalog Number | Comments |
| 22s gauge, Small Hub RN Needle, 2 in, point style 2 | Hamilton | 7758-03 | Replacement for the Hamilton syringe. |
| Bacterial infection stocks | Bacterial stocks of a known density (CFU/mL) frozen during mid-exponential phase of growth. | ||
| Ethanol | Fisher Scientific | 10610813 | Other manufacturers may be used. |
| G. mellonella larvae | Livefoods | 5.06045E+12 | For this supplier, orders are marked as “New stock for lab use”. As of April 2024, new stock is delivered to the supplier on Mondays. Orders should be placed then, for delivery on Wednesdays. |
| Microliter syringe | Hamilton | 80630 | The 80630 syringe has a 100 µL capacity. Other volumes exist, such as the 80430, 80530 or 80730. |
| Petri dish | Fisher Scientific | 12674785 | Other manufacturers may be used. |
Referências
- Menard, G., Rouillon, A., Cattoir, V., Donnio, P. Y. Galleria mellonella as a suitable model of bacterial infection: Past, present and future. Front Cell Infect Microbiol. 11, 782733 (2021).
- Piatek, M., Sheehan, G., Kavanagh, K. Galleria mellonella: The versatile host for drug discovery, in vivo toxicity testing and characterizing host-pathogen interactions. Antibiotics. 10 (12), 1545 (2021).
- Miethke, M., et al. Towards the sustainable discovery and development of new antibiotics. Nat Rev Chem. 5 (10), 726-749 (2021).
- Seyhan, A. A. Lost in translation: The valley of death across preclinical and clinical divide - identification of problems and overcoming obstacles. Transl Med Commun. 4 (1), (2019).
- Firacative, C., et al. Rearing and maintenance of Galleria mellonella and its application to study fungal virulence. J Fungus. 6 (3), 130 (2020).
- Pereira, M. F., Rossi, C. C. Overview of rearing and testing conditions and a guide for optimizing Galleria mellonella breeding and use in the laboratory for scientific purposes. APMIS. 128 (12), 607-620 (2020).
- Jorjão, A. L., et al. From moths to caterpillars: Ideal conditions for Galleria mellonella rearing for in vivo microbiological studies. Virulence. 9 (1), 383-389 (2018).
- Tsai, C. J. -. Y., Loh, J. M. S., Proft, T. Galleria mellonella infection models for the study of bacterial diseases and for antimicrobial drug testing. Virulence. 7 (3), 214-229 (2016).
- Gallorini, M., et al. Immunophenotyping of hemocytes from infected Galleria mellonella larvae as an innovative tool for immune profiling, infection studies and drug screening. Sci Rep. 14, 759 (2024).
- Smith, F. Q., Casadevall, A. Fungal immunity and pathogenesis in mammals versus the invertebrate model organism Galleria mellonella. Pathog Dis. 79 (3), ftab013 (2021).
- Sugumaran, M. Comparative biochemistry of eumelanogenesis and the protective roles of phenoloxidase and melanin in insects. Pigment Cell Res. 15 (1), 2-9 (2002).
- Sheehan, G., Garvey, A., Croke, M., Kavanagh, K. Innate humoral immune defences in mammals and insects: The same, with differences. Virulence. 9, 1625-1639 (2018).
- Wright, C. L., Kavanagh, O. Galleria mellonella as a novel in vivo model to screen natural product-derived modulators of innate immunity. Appl Sci. 12 (13), 6587 (2022).
- Newton, S. M., et al. Use of the invertebrate Galleria mellonella as an infection model to study the Mycobacterium tuberculosis complex. J Vis Exp. (148), e59703 (2019).
- Frankel, G., Collins, J. W., Schroeder, G. N., Harding, C. R. Use of Galleria mellonella as a model organism to study Legionella pneumophila infection. J Vis Exp. (81), e50964 (2013).
- Romera, D., et al. The Galleria mellonella infection model as a system to investigate the virulence of Candida auris strains. Pathog Dis. 78 (9), ftaa067 (2020).
- Kwadha, C. A., Ong'amo, G. O., Ndegwa, P. N., Raina, S. K., Fombong, A. T. The biology and control of the greater wax moth, Galleria mellonella. Insects. 8 (2), 61 (2017).
- Miles, A. A., Misra, S. S., Irwin, J. O. The estimation of the bactericidal power of the blood. J Hyg. 38, 732-749 (1938).
- Ignasiak, K., Maxwell, A. Galleria mellonella (greater wax moth) larvae as a model for antibiotic susceptibility testing and acute toxicity trials. BMC Res Notes. 10 (1), 428 (2017).
- Hesketh-Best, P. J., Mouritzen, M. V., Shandley-Edwards, K., Billington, R. A., Upton, M. Galleria mellonella larvae exhibit a weight-dependent lethal median dose when infected with methicillin-resistant Staphylococcus aureus. Pathog Dis. 79 (2), ftab003 (2021).
- Mahenthiralingam, E., Weiser, R., Floto, R. A., Davies, J. C., Fothergill, J. L. Selection of relevant bacterial strains for novel therapeutic testing: a Guidance document for priority cystic fibrosis lung pathogens. Curr Clin MicrobiolRep. 9 (4), 33-45 (2022).
- Carter, M. E. K., et al. A subtype of a Pseudomonas aeruginosa cystic fibrosis epidemic strain exhibits enhanced virulence in a murine model of acute respiratory infection. J Infect Dis. 202 (6), 935-942 (2010).
- Herrmann, G., et al. Colistin-tobramycin combinations are superior to monotherapy concerning the killing of biofilm Pseudomonas aeruginosa. J Infect Dis. 202 (10), 1585-1592 (2010).
- Hennig, S., Standing, J. F., Staatz, C. E., Thomson, A. H. Population pharmacokinetics of tobramycin in patients with and without cystic fibrosis. Clin Pharmacokinet. 52 (4), 289-301 (2013).
- Reyhanoglu, G., Reddivari, A. K. R. . Tobramycin. , (2023).
- Crass, R. L., Rutter, W. C., Burgess, D. R., Martin, C. A., Burgess, D. S. Nephrotoxicity in patients with or without cystic fibrosis treated with polymyxin b compared to colistin. Antimicrob Agents Chemother. 61 (4), e02329-e02416 (2017).
- Deacon, J., et al. Antimicrobial efficacy of tobramycin polymeric nanoparticles for Pseudomonas aeruginosa infections in cystic fibrosis: Formulation, characterization and functionalization with dornase alfa (DNase). J Control Release. 198, 55-61 (2015).
- Tamma, P. D., et al. Infectious Diseases Society of America 2022 guidance on the treatment of extended-spectrum β-lactamase producing enterobacterales (ESBL-E), carbapenem-resistant enterobacterales (CRE), and Pseudomonas aeruginosa with difficult-to-treat resistance (DTR-P. aeruginosa). Clin Infect Dis. 75 (2), 187-212 (2022).
- Charan, J., Kantharia, N. D. How to calculate sample size in animal studies. J PharmacolPharmacother. 4 (4), 303-306 (2022).
- Murray, C. J. L., et al. Global burden of bacterial antimicrobial resistance in 2019: A systematic analysis. Lancet. 399 (10325), 629-655 (2022).
- de Kraker, M. E. A., Stewardson, A. J., Harbarth, S. Will 10 million people die a year due to antimicrobial resistance by 2050. PLoS Med. 13 (11), e1002184 (2016).
- Prasad, N. K., Seiple, I. B., Cirz, R. T., Rosenberg, O. S. Leaks in the pipeline: A failure analysis of gram-negative antibiotic development from 2010 to 2020. Antimicrob Agents Chemother. 66 (5), e0005422 (2022).
- Wang, S., et al. A novel Galleria mellonella experimental model for zoonotic pathogen Brucella. Virulence. 14 (1), 2268496 (2023).
- Senior, N. J., Titball, R. W. Isolation and primary culture of Galleria mellonella hemocytes for infection studies. F1000Res. 9, 1932 (2021).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados