Method Article
Гистологическая характеристика интактного мозга имплантированных Microdevices и окружающих тканей
В этой статье
Резюме
Здесь мы представляем гистологических методов для сбора, маркировки, оптически очистки и изображения нетронутый интерфейс мозговой ткани вокруг хронически имплантированными микроустройств в ткани головного мозга грызунов. Результаты от методов, включающий в себя этот метод полезны для понимания влияния различных проникающих мозг имплантанты на их окружающие ткани.
Аннотация
Исследования в области разработки и использования мозг имплантировали микроустройств, таких как массивы микроэлектродов, направлена на производство клинически значимых устройств, которые взаимодействуют с хроническими окружающие ткани. Ткани, окружающие эти имплантаты, как полагают, реагируют на присутствие устройства в течение долгого времени, которая включает в себя формирование изоляционного "глиальных рубцов" вокруг устройства. Тем не менее, гистологический анализ этих изменений тканей, как правило, производится после культивирующий в искусственной среде устройства, в процессе, который может привести к нарушению морфологии ткани интерес.
Здесь мы показываем протокол, в котором корково-имплантированных устройств собираются нетронутыми в окружающие ткани грызунов мозга. Мы опишем, как, когда перфузия фиксатором, мозг удаляют и нарезанные таким образом, чтобы избежать культивирующий в искусственной среде устройства. Мы выделяем флуоресцентные маркировки антител и оптические методы очистки полезен для создания информативной, но толстые тканираздел. Наконец, мы демонстрируем монтажа и обработки изображений этих срезов тканей для исследования биологических интерфейсов мозг вокруг имплантированных устройств.
Введение
Поле neuroprosthetic исследований направлена на оказание помощи лицам, страдающим от различных ограниченными возможностями и нарушениями в обход больных или поврежденных структур в организм через ЦНС взаимодействия устройств 1,2. Brain-имплантированных микроустройств, таких как массивы микроэлектродов (МПС), может быть использован для записи или стимулировать мозговые структуры, и таким образом позволяют установить долгосрочные интерфейсов между электроникой и ЦНС ткани 3-5. Проникающие МПС, устройства, которые приводятся в ткани головного мозга, занимать определенные надежды как двунаправленный интерфейс связи с непосредственной близостью, в которой они представят электродов относительно небольшой набор близлежащих нейронов 6.
Тем не менее, сложная ткань ответов результатом долгосрочной имплантации проникающего МПС, что часто приводит к переменным и постепенно унижающие электрофизиологических сигнал-шум в течение нескольких дней до нескольких месяцев, и увеличение электрического импедансаANCE между электродом сайтов и наземные 7,8. Предполагаемый происхождение этих изменений включают активацию микроглии, реактивные астроцитоз по микроустройств, и потеря или миграции нейронов из ткани, окружающие в имплантированных устройств 9-11. Одна из основных задач для понимания этих изменений тканей вокруг хронический, МПС проникновения трудности в захвате гистологические данные нетронутыми интерфейс тканей, окружающих хронически имплантированными устройствами 12. Гистологический анализ тканей с устройством / ткань интерфейс все еще присутствует бы улучшить текущее устройство удаления гистологического протоколов. С спокойно устройства, оставшиеся в тканях, биологическое воздействие сравнительно тонкие взаимодействия, такие, как использование биосовместимых покрытий 13,14 или электрической очистки поверхности электрода 15,16, могли бы быть отображены и проанализированы в связи с имплантатом.
Hпрежде чем мы демонстрируем метод для сбора, обработки, и изображение нетронутым интерфейс микроустройство для подробного микроскопии на основе анализа окружающие ткани головного мозга. В этом методе, устройство и окружающие ткани собираются в толстых (> 250 мкм) тканей секции, используя vibratome. Для улучшения гистологической проникновения метки в эти толстые ломтики, люминесцентные гистохимических и иммуногистохимических этикетки применяется при высокой концентрации в растворах, содержащих блокирование сыворотке крови и моющих средств за несколько дней. Оптическое решение очистки используется для улучшения глубины микроскопии изображений, и ткань устанавливается в 2-сторонней камеры для последующей лазерной сканирующей конфокальной микроскопии 17. Для получения полного гистологического интерфейс, управляемый компьютером поступательного этапе используется во время съемки для сбора Z-Stack панорамы по длине имплантата. В дополнение к визуализации применяются ткани этикетки, сбор лазерного отражения назад от имплантатови пропускание света через ткань, как помочь локализовать интерфейс устройства по отношению к окружающим тканям. Ткань подготовлены с использованием этой «Device-Capture Гистология" (DCHist) протокол обеспечивает изображение доступ к морфологически сохранившихся тканей / устройства взаимодействия, и таким образом улучшает предыдущее устройство удаления гистологического протоколов 18.
протокол
Решения
Фосфатным буферным раствором (PBS) - в г / л; 9 г NaCl, 0,144 г KH 2 PO 4, 0,795 г Na 2 HPO 4, при рН 7,4
4% формальдегида - в мл / л, 202 мл натрия фосфат двузамещенный решение (0,4 М Na 2 HPO 4), 48 мл натрия фосфат однозамещенный решение (0,4 М NaH 2 PO 4), 500 мл 8% раствора формальдегида, 250 мл Milli- Q DDI воде, при рН 7,4
HEPES буферном растворе Хэнка с азид натрия (HBHS) - в г / л, 7,5 г NaCl, 0,3 г KCl, 0,06 г KH 2 PO 4, 0,13 г Na 2 HPO 4, 2 г глюкозы, 2,4 г HEPES, 0,05 г MgCl 2 6 частей H 2 O, 0,05 г MgSO 4 7 частей H 2 O, 0,165 г CaCl 2, 0,09 г NaN 3 при рН 7,4
Промывочного раствора (WS) - 1% Vol / Vol, Нормал козьей сыворотки, 0,3% Triton X-100, в HBHS с азид натрия (NaN 3). Охладите WS при 4 ° С до использования в последующих шагах.
U2 Sca L E Solution - 4 М мочевины, 30% глицерина и 0,1% Triton X-100 17
ПОРЯДОК
Все эксперименты были проведены под руководством Уход Purdue животных и Комитетом по эксплуатации и программа лабораторных животных в Университете Пердью.
1. Хирургия
- Различные асептические хирургические методы совместимы с представленными гистологического метода. Использование стереотаксической рамы и автоматизированные для введения рекомендуется для улучшения воспроизводимости и контроля микроэлектрода массивов (MEA) имплантация углом по отношению к стереотаксической самолетов.
Примечание: В этой демонстрации наших хирургического метода заключается в следующем: удерживать грызунов тему в стереотаксической earbars Whilе при изофлуран анестетика (в пределах 1-3%), перевозимого медицинского назначения кислорода. Тест на отсутствие ног щепотку отразить в крысу или отсутствие рефлексов хвост щепотку в мышь, чтобы убедиться, что животное полностью под наркозом. Применение глазной мази и очистить место операции с тремя переменного моет из Бетадин и этанола. Мыть руки, рассвет хирургические перчатки, сетку для волос, маски и мантии. Вводят болюсно лидокаин, чтобы ошеломить хирургической области, создать разрез с помощью ножниц или скальпеля, ясно надкостницы со скребком кости и хлопка аппликаторы, и создать трепанация черепа помощью зубной наконечник сверла и сверла. Поездка одного хвостовиком MEA в кору с помощью микроманипулятора. У хирургической помощи помощником в поддержании асептических условиях хирургии и документировать ход операции.
- После имплантации MEA в мозг, собирать изображения с помощью операционного микроскопа для информирования возможного удаления части черепа из разных стран бдождь. Имплантированные части устройства будут сохранены на месте.
Примечание: возможные коллекции тканей в местах устройства опирается на близкие по плоскости устройства вставки с плоскостью ткани срезов. Подробные заметки о самолете устройство вставки по отношению к мозгу, таким образом, очень важно.
- После имплантации устройства, применяются силиконового эластомера Kwik-Sil (WPI), вокруг любой открытой MEA черенками или кабелей, и позволяют вылечить. Стерилизованные пластиковые части, такие, как наконечник пипетки разреза, могут быть использованы, чтобы помочь содержать силиконового эластомера в небольшом а вокруг трепанации черепа при лечении.
- Нанесите слой из двух частей стоматологического акрила ("Jet Liquid" и "Jet Powder" от Lang Dental) за Kwik-Sil и любой открытой череп.
Примечание: В более позднем этапе, headcap будет расплавлен путем для обеспечения имплантата должны быть разделеныиз черепа. УФ-отверждения акриловых следует избегать за Kwik-Sil и трепанация черепа, так как это очень трудно акриловые трудно удалить позже. Визуально непрозрачных материалов вокруг имплантата также следует избегать; ясно Kwik-Sil обеспечивает просмотр имплантата во время последующих этапов этого протокола.
- Выполните послеоперационные процедуры по уходу в соответствии с местным протоколом правила животных, и вернуть амбулаторной субъектов в одной клетке расположены ящики.
2. Перфузии и ткани коллекции
Примечание: См. Gage и соавт. Подробное пошаговое руководство процедурой перфузии в модели крысы животных 19.
- Используйте анестезии и перфузии протокола утвержденной животных учреждение по уходу и использованию комитета. После глубоко анестезии грызунов (подтверждено отсутствие ног щепотку рефлекса у крысы или хвост-пинча рефлексов у мышей) и подвергая сердце, сделать мелкий ножницами сокращениядля левого желудочка и правого предсердия. Вставьте тупой иглой в левом желудочке и доставить комнатной температуре PBS. Доставка всего ~ 10 мл PBS при ~ 5 мл / мин у мышей и ~ 200 мл PBS при ~ 100 мл / мин у крыс. Ищите очищения крови от печени во время.
- Inject гистологически соответствующие этикетки химического transcardially, при желании, с помощью шприца с доставкой тщательностью, чтобы избежать введения пузырьков.
Примечание: Сосудистые метки (например, DiI) и нуклеиновые кислоты контрастирующая красители (например, Hoechst 33342) являются примерами химических этикетки результата во время перфузии. При введении должным образом, эти гистологические маркеры должны маркировать весь животный 20.
- Доставка буфером, комнатной температуры, 4% формальдегида transcardially, чтобы исправить животных. Избегайте перегородки перфорации через сердце, которое может быть подтверждено легких нос дренаж во время перфузии. Посмотрите для фиксации подземных толчков в большие мышцыуказать полное перфузии. Доставка всего ~ 10 мл фиксатора на ~ 5 мл / мин у мышей и ~ 200 мл фиксатора при ~ 100 мл / мин у крыс.
- После перфузии, обезглавил животное, подвергать части ствола головного мозга или мозжечка использованием rongeurs или ножницами, и место главы в 4% раствором формальдегида в течение ночи при 4 ° C.
- Вымойте голову в трех сменах PBS от одного до четырех часовых интервалов между промывками.
- Хранить фиксированной головой в HBHS содержащие азид натрия при температуре 4 ° C в течение нескольких дней до нескольких месяцев.
3. Мозг удаления с устройства на месте
Примечание: Выполните этот раздел в вытяжном шкафу, а носить соответствующие средства индивидуальной защиты. Избегайте тканей высыхания, возвращаясь фиксированной головой HBHS решение периодически.
- Осторожно рассекают от кожи и других тканей со всего акриловая крышка черепа с помощью пинцета и маленькие ножницы.
- Во время ношения тепло-иnsensitive перчатках, пользоваться паяльником, чтобы удалить зубной акриловые и подвергать области, лежащие в основе ясно Kwik-Sil (рис. 2а).
Примечание: цель этого шага является предоставление микро-ножницы соответствующий угол доступ к позиции, где имплантированные устройства поступают в мозг, чтобы мозг имплантировали компоненты могут быть отделены от компоненты крепятся к черепу.
- Под операционным микроскопом, нарезать силиконового эластомера с изогнутыми микро-ножницами, снимая небольшие кусочки Kwik-Sil с помощью пинцета до положения, в котором устройств проникать в мозг.
- Продолжить резки вдоль поверхности трепанация черепа с изогнутыми микро-ножницы для отдельных компонентов устройства, подключенного к поликремния и череп из компонентов, имплантированных в мозг. Снова используйте увеличении микроскопа и большую осторожность при резке через открытые компоненты устройства, заботясь, чтобы избежать случайного нажатия или перетаскивания импЛанц в основной ткани.
- Удалить кости вокруг headcap с осторожностью использованием rongeurs. Используйте лопаточку, чтобы отделить мозга с имплантированных устройств от черепа. Хранить мозга в HBHS решение до готовности нарезать.
- Поместите мозга в чашке Петри стеклянные заполнены HBHS, и использовать лезвие, чтобы удалить посторонние ткани, такие как спинной мозг, мозжечок, или обонятельной луковице, в зависимости от того, что они имеют отношение к месту имплантации устройства. Используйте мозги блока (Ted Пелла) и лезвия к разделу мозга и создать плоскость близкие по углу имплантированных устройств; это достигается путем размещения мозга в соответствующего размера мозга блока, ориентируясь мозга, что любое видимая часть имплантата параллельно с гидом лезвие бритвы, а также размещение лезвие в лезвие руководство по крайней мере, 2 мм от имплантата. Нажмите на лезвие бритвы через ткань. Установите эту поверхность vibratome платформы. Alternaственно, лезвие крепится к микроманипулятора может быть использован в такой же моде, как управляется мозгом блоку создать самолет близкие по направлению имплантата.
- Место льда под vibratome платформе, и после позволяющие поверхности ткани кратко высушить на бумажном полотенце, придерживаться мозга vibratome использованием супер клей. Клей плоская ткань создали в предыдущем шаге к сцене. С асимметричным размеры ткани, ориентироваться образца таким образом, что широкое измерение клееного вниз параллельно с движением направлении vibratome лезвие, чтобы помочь избежать потенциально лезвие стучится ткани более. После того, как клей, наборы (~ 1-2 мин), добавить охлажденное (~ 4 ° C) PBS в vibratome блюдо вокруг ткани.
- Сбор ломтики толщиной ткани между 200-400 мкм, в том числе контроль ткань, используя максимальную скорость вибрации (~ 100 Гц) и низкой скорости прогрессии лезвия (<0,2 мм в секунду), с лезвием под углом 10 ° от хоrizontal. Соберите кусочки тщательно с помощью кисти или шпателя совок и хранить в HBHS в 24-луночный планшет при 4 ° C.
- Как только на месте устройства видна невооруженным глазом или операционным микроскопом, собираем тоньше разделах подойти к устройству в подразделе шагом 100 мкм или менее.
Примечание: Типичные кремния микро-имплантаты видны невооруженным глазом в формальдегид фиксированной грызунов мозговой ткани коры между 300 и 500 мкм от поверхности устройства.
- При устройстве на месте сейчас близко к поверхности ткани, собирают> 250 мкм кусочек ткани содержащие устройства внутри. Оценка необходимой толщины может быть оказана помощь, ссылаясь на ранее собранные кусочки.
Примечание: Увеличенное устройств, multishank устройств, а также угловые устройств могут потребоваться толстые срезы тканей (> 500 мкм), чтобы захватить устройство в одной ткани кусок, повторночлена, что и проникновение применяются этикетки и глубиной микроскопии изображений будут ограничены в возможных сбор данных от этих очень толстыми ломтиками. Если возможно, избегайте удара устройство с vibratome лезвия, так как это может привести увлечение устройства через деформацию тканей и морфологического.
4. Обработка тканей и посредничества
- Промойте ломтики 3x на 5 минут за стирку в HBHS
- Инкубируйте в натрийборгидрида (5 мг NaBH 4/1 мл HBHS) в течение 30 мин общая (15 мин с каждой стороны среза). Переверните кусочки использованием нержавеющей стали или с тефлоновым покрытием микро-ложки и маленькую кисть (Ted Pella). Медленно и вдумчивый движений улучшить успех каждый ломтик флип. Не прикасайтесь к области вокруг имплантированных устройств с кистью. Когда это возможно, добавив, значительно больше, чем требуется решение (> 2 мл) позволяет управлять и переворачивать кусочки ткани легче.
Примечание: Этот шаг уменьшает эндогенный автофлуоресценции, пропустите этот шаг, если флуоресцентные метки были применены во время перфузии или XFP трансгенных маркеры присутствуют.
- Промойте ломтики 3x на 5 минут за стирку в промывочного раствора при комнатной температуре.
Примечание: Агитация во время стирки и инкубации не является обязательным. Авторы считают, что тонкие сотрясение из жесткой имплантата по отношению к окружающей ткани мозга может произойти с агитация. Тем не менее, орбитальный миксер, движущийся со скоростью нежный (<60 мин), могут избежать этого при увеличении движения решений.
- Блок в течение 2 часов в промывочного раствора при комнатной температуре (флип ломтиками через один час).
- Инкубируйте в первичных антител (разводится в промывочного раствора) в течение примерно 48 часов (24 ч на каждой стороне среза) при 4 ° C.
- Выполнить 6 быстрых 3 мин промывок промывочного раствора.
- Выполнить 6, 1 час моет (3 стиркиES на каждой стороне ткани срез) в промывочный раствор (хранить при 4 ° C, если стиральная ночь).
- Инкубируйте в вторичными антителами (разбавляют промывочного раствора) в течение примерно 48 часов (24 часов с каждой стороны) в 4 ° C.
- Выполнить 6 быстрых 3 мин промывок промывочного раствора.
- Выполнить 6, 1 час моет (3 моет с каждой стороны) в промывочного раствора; хранить при 4 ° C, если стиральная ночь.
- Удалить Промывочный раствор и добавьте на основе глицерина "U2 - Sca л е" очистка раствора. Позвольте, чтобы очистить около 1 недели для толстых ломтиков (250-500 мкм) или 2-3 недели для очень толстых срезах тканей (> 500 мкм) при 4 ° C.
- Крышка с фольгой и хранить при 4 ° C.
- Установите в слайдах размещения толстым слоем ткани (рис. 2б, 2в) с помощью посредничества решения, как средства массовой информации и монтаж уплотнения с прозрачного лака для ногтей. Хранить при температуре 4 ° C вдали от света.
5. Панорама Съемка Полный TiСГУП и Device Interface
- Использование более рабочее расстояние объективов микроскопов (> 2 мм), начинают изображений с лазерной сканирующей конфокальной микроскопии или 2-фотонного микроскопа. Мы продемонстрируем с Zeiss LSM 710, Carl Zeiss "Zen" Программное обеспечение (2010), и управляемый компьютером XY переводе этапе изображение 3D панорамы вокруг имплантата.
Примечание: для правильного преломления очистке решение либо в программное обеспечение, с помощью корректирующих ошейник на цель, или в обработку данных после сбора. В этой демонстрации мы входим показателю преломления для "U2" очистка раствору 1,4 в Leica Zen программного обеспечения микроскопа; этот параметр тонко регулирует г-шаг интервалов для учета преломления несоответствия индексов.
- В тканях рядом с устройством, грубо оценить соответствующие оси окна и сбора данных настроек в Z-измерение для каждого канала с помощью флуоресцентного малой мощности лазера (~ 00,5 до 5%) и большой шаг г-размеров (> 25 мкм).
Примечание: Включая дополнительное пространство выше и ниже при установке оси при настройке для панорамной сбора данных, а ткань не может целиком лежать плашмя на предметное стекло (~ 20 мкм каждом направлении).
- Установите цель на ху центре вашего возможного панораму помощью Zen программного обеспечения панорамы, определить количество коллекцию позиций для каждой оси (х, у) для покрытия вашего региона интереса.
- Пересмотреть и доработать оси коллекция окна.
- Ручная настройка чувствительности детектора и мощность лазера, чтобы нарастить соответственно с увеличенной глубиной, цель, как правило, поддерживать примерно такой же интенсивности изображения, независимо от глубины визуализации в ткань кусочек, но также избежать высоких фоновых шумов.
- Сбор каждой флуоресцентное изображение рядов данных. Если необходимо, чтобы избежать дублирования сигналов, запустить лазерную линиюс последовательно.
Примечание: Если есть возможность, установите программное обеспечение для автоматического сохранения данных на жестком диске во время сбора.
- Изменить настройки программного обеспечения для сбора «отражения» и «прозрачности» данных, а также использовать дольше, более проникающий длины волны лазера (например, 633 нм), чтобы захватить эти каналы. Определить соответствующие мощности лазера и чувствительности детектора для "отражения" и "прозрачности" Сбор и повторите ту же серию коллекции около имплантированного устройства.
- Экспорт данных для последующей обработки, количественное определение и анализ.
Результаты
Brain-имплантированных МЭС могут быть собраны в срезах тканей, сначала отделение любого черепа монтажа компонентов из мозга встроенных компонентов. Рисунке 2а приведены результаты удаления одной стороне зубного headcap цемента и часть Kwik-Sil окружающих MEA кабеля на крысах черепа. Паяльник был использован, чтобы удалить зубной цемент и Kwik-Sil в вытяжном шкафу. Кабели и любого не-имплантированных структур МПС следующий вырезать микро-ножницы медленно раскопки через Kwik-Sil вниз к поверхности неподвижной мозга.
После нарезки, маркировки и очистки ткани, простые заказные слайды полезны для монтажа ломтики толщиной ткани (рис. 2б). Установлены среза мозга содержащие имплантированные микроустройство показано на рисунке 2в. Изображениями через обе стороны от слайд может позволить вам оценить интерфейс вокруг устройства, как показано на рисунке 3 , где микроглии вдоль кремния поддержке МЭС видны с одной стороны (рис. 3а) и микроглии вдоль электродов сайтов и следы видны на другой стороне (рис. 3б).
После монтажа, ткань может быть отображена использовании этапе XY перевода. Обзоры флуоресцентных меток по всей кусочки ткани может быть сгенерировано нужного разрешения (рис. 4). Подробное рассмотрение морфологически сохранившихся тканей вокруг имплантированных интерфейс микроустройств могут быть собраны при большом увеличении для анализа местной реакции ткани (рис. 5).
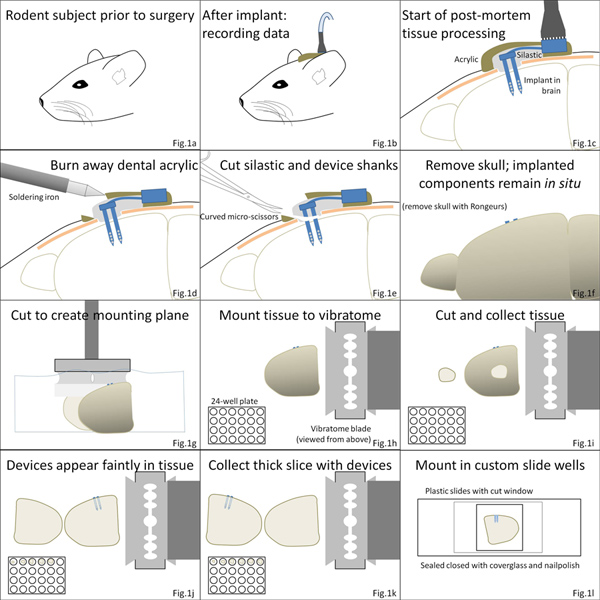
Рисунок 1. Обзор процедуры. (Переменного тока) Мозг микро-имплантаты являются операции по водным видам спортаказывают слоем Kwik-Sil полимер непосредственно вокруг устройства, после чего акриловые покрытия цемента. (D, E) После эвтаназии, акриловый слой сгорел, и череп монтажа компонентов устройства отделяются от имплантированных компонентов, проходящем через силиконового эластомера. (F, G) мозга удаляется из черепа и режется и монтируется на vibratome этапе. (HK) срезы тканей собраны, в том числе содержащие кусочек ткани устройства. (Л) ткани могут быть обработаны и смонтированы в пользовательских камер для подробного микроскопии. Нажмите, чтобы увеличить показатель .
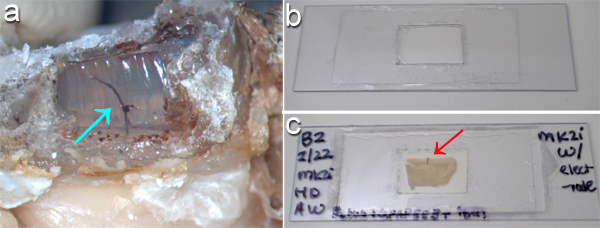
Рисунок 2. (А) Очистить Kwik-Sil силиконового эластомера суrrounding электрод-массив кабеля (стрелка) был выставлен на сжигать окно в стоматологических крышки цемента на перфузируемой голова грызуна с помощью паяльника. (Б) Для размещения изображений в обе стороны толстый ломоть ткани, просто "слайд-камеры" может быть сделано путем разрезания пластиковых слайдов и соблюдения покровного стекла в обе стороны вокруг ткани и монтажные решения. (С) ткани мозга крыс срез с неповрежденными имплантата (красная стрелка) показан после монтажа. По обе стороны от ткани быстро доступной для микроскопии изображений с этой установкой. Для масштаба, панель (а) в 25 мм в поперечнике внизу, в то время как панели (В, С) на 80 мм в поперечнике внизу.
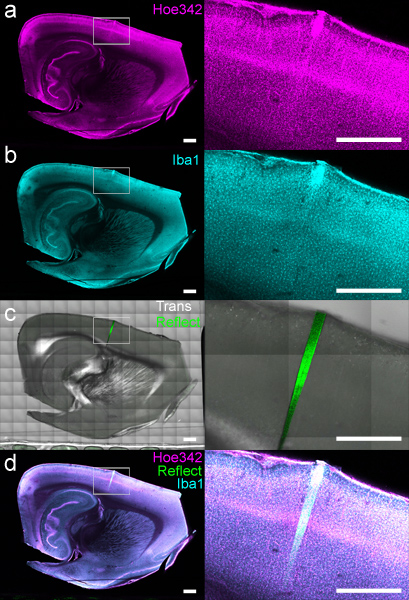
Рисунок 3. Максимальная Intensity Z-проекции толщиной 40 мкм стеки изображений, собранных по всему спинках (а) и спереди (б) имплантирован микроэлектрод массива. Микроглии (меченные анти-Iba1 и Alexa Fluor 633, белый) и лазерного отражения (красный), собранные с поверхности устройства, были последовательно изображение получено с обеих сторон 400 мкм толстый кусок ткани. Так как мозг имплантанты часто непрозрачны, монтаж оптического доступа с обеих сторон обеспечивает четкое представление о меченых тканевых структур "за" имплантата по отношению к объектива микроскопа. Шкала бар 50 мкм.
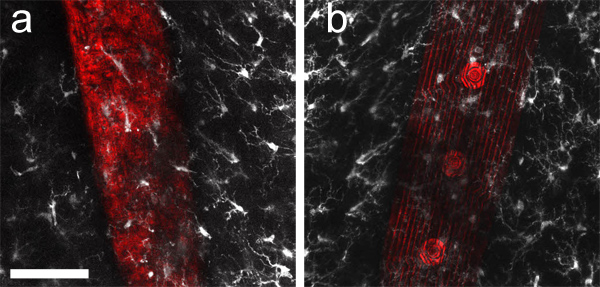
Рисунок 4. Меченых DCHist кусочек отображаемого использованием управляемых компьютером этап на лазерной сканирующей конфокальной микроскопии. (А) клеточных ядер (окрашивают Hoechst 33342) и (б) моноциты / микроглии(Меченные анти-Iba1) были одновременно отображается на отдельных каналах. (С) пропускание света и отражения были собраны, показывающие расположение 4-недельного имплантата по отношению к Hoechst и Iba1 данных. (D) Наложение всех каналов, но передача также показаны. Белый прямоугольник, площадь расширяется в изображениях появляется справа. Шкала бар 1 мм.
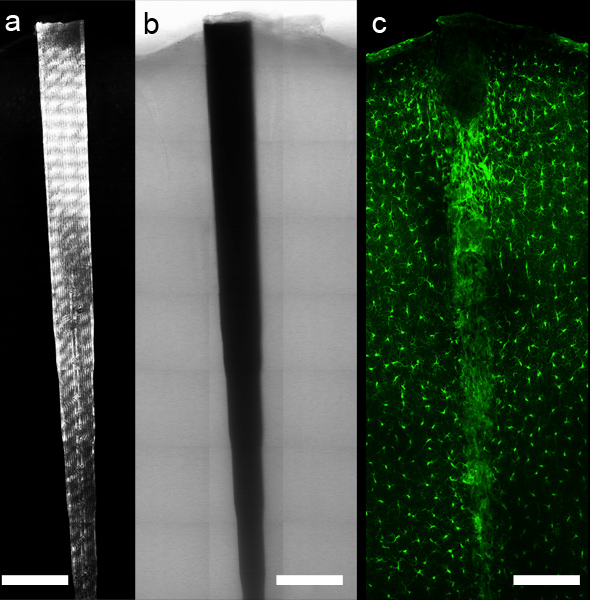
Рисунок 5. Использование управляемых компьютером столик микроскопа и соответствующего программного обеспечения, панорамный данные изображения могут быть собраны вокруг имплантата. Коэффициент отражения (а) и пропускания (б) разрешить локализацию устройств, в то время как флуоресцентные метки антител или химической (с, анти-Iba1 маркировки микроглии и Macrophages) позволяют подробное изображение тканевых компонентов по нетронутым интерфейс ткани. Шкала бар 200 мкм.
Обсуждение
"Устройство-захват Гистология" (DCHist) метод позволяет продемонстрировали здесь близко гистологические оценки морфологически сохранившихся взаимодействия между мозговой ткани и ткани имплантаты. Коллекция тканей DCHist требует тщательного разделения черепа монтажа компонентов устройства от компонентов, имплантированных в мозг. DCHist также требует коллекция толстых гистологического среза ткани (> 250 мкм). Эти срезы ткани, когда-то помечены, очищено, установлены и отображаемого, может дать новые идеи в травме имплантации или последующего хронического ответ на пребывающего устройств. Используя передовые инструменты микроскопии, интерфейс между тканью и устройства могут быть выявлены и проанализированы в высокой детализации, как показано на рисунках 3-5.
Представленные методы в их нынешнем виде полагаться на способность медленно раскопки далеко headcap из двух частей стоматологического цемента и Kwik-Sil до точки имплантации устройства.Использование зубной цемент, который может быть сгорел или иным образом удалена и ясно эластомера кремния, через которую маленькие ножницы можно руководствоваться визуально значительно помочь в успешной отделения имплантированного устройства из его черепа монтажа компонентов. Попытка сократить устройство под черепом и выше мозга для того, чтобы собрать его на месте не рекомендуется, так как череп монтажа имплантатов будут выведены из мозга значительную сумму.
Несмотря на то, тоньше, меньше имплантатов, таких как одного МЭС хвостовик от NeuroNexus Technologies, наиболее пригодны для DCHist, принципы не ограничиваются одной черенки устройства или микроэлектрода массивов. Сбор и визуализация стратегии широко применимо к мульти-хвостовик устройств и больших имплантатов, таких как канюли, с требованиями том, что они должны быть отделены от любых черепа крепления и собранные в толстые раздела тканей. Хотя авторы сосредоточены на анализе тканейокружающей корковой имплантатов, устройств приводится глубже в мозг также может быть собрана и образ. Глубина установки имплантата не должно влиять на захват имплантата в кусочек условии, что устройство не отклоняются дико от известных угол введения.
Ограничения существуют для полезного применения DCHist метод. Срезы головного мозга ткани сложно изображения через сотни микрометров, особенно в районах с белым веществом, хотя и оптических решений очистки может значительно улучшить изображение глубинах в различных тканях 21. Для дальнейшего улучшения визуализации глубины, двухфотонного возбуждения микроскопия может быть использована вместе с оптического просветления описано.
Другим потенциальным ограничением описанный метод может быть конкретным флуоресцентные методы иммуногистохимии и антител, используемых исследователями. Пассивная диффузия обычно управляет включением этих маркеров через фиксированные ткании на сайты связывания антигена. Конечные концентрации рабочей антител должны быть определены исследователями на индивидуальной основе максимального проникновения этикетки, избегая при этом высокий уровень фона маркировки. Антитела маркировка не должна быть переменной между слоями, которые обрабатываются одинаково, но разные антитела могут значительно различаться по своей способности проникать и отметить их антигенов, антител с некоторыми антигенами легко маркировке многих сотен микрометров глубокие и другие маркировки антигенов всего несколько десятков микрометров глубины. Мы описываем улучшения этой диффузии с применением антител этикетки при более высоких концентрациях, чем обычные, за несколько дней применения, и в растворе, содержащем разбавленной моющим средством и блокирование сыворотки. Периодически листать ломтиками также способствует даже маркировки. Антиген поиска шаги и альтернативные процессы фиксации (например, глутаральдегида, микроволновая печь и т.д.) могут быть неподходящими для специфических антигенов. Вторичные антитела fluorochРим конъюгаты также могут варьироваться в их исполнении маркировки толстым слоем, хотя это не наблюдался авторами использовании Alexa Fluor этикетки от Invitrogen. Кроме того, трансгенные животные субъектов выразив флуоресцентных белков в клетке типов проценты могут быть использованы, чтобы избежать проблем с проникновением антитела этикетки, так как многие флуоресцентные белки, такие как EGFP, сохраняют свою флуоресценции после обработки формальдегидом, и может быть сразу же визуализируются в срезах тканей.
DCHist представляет собой мощный набор методов для захвата и анализа воздействия имплантированных микроустройств на ткани головного мозга. Соединение этой гистологической протокол с оценкой в естественных условиях электрофизиологии качества и сопротивление электрода данных 22 может значительно улучшить наше понимание биологических источников изменчивости физиологии и деградации. Области имплантированного нейронных протезов, в частности, могут извлечь выгоду из подробного DCHist IMAненности ВИЧ варьируется от неповрежденного устройства / ткань интерфейса сообщить дальнейшее развитие биологически нейтральными устройств МПС.
Раскрытие информации
Авторы не имеют соответствующих раскрытий заявить, финансовых или иным образом.
Благодарности
Все эксперименты были проведены под руководством Уход Purdue животных и Комитетом по эксплуатации и программа лабораторных животных в Университете Пердью.
Эта работа была организована Defense Advanced Research Projects Agency (DARPA) Microsystems Technology Office (МТО), под эгидой доктора Jack W. Джуди (jack.judy @ darpa.mil) в рамках Программы Расписание нейронных технологий, через Космический центр и Naval Warfare Systems Command (SPAWAR) Системы (SSC) Тихоокеанского грант № N66001-11-1-4013.
Авторы хотели бы поблагодарить Михаила Слипченко, Don Ready, Грег Рихтера, Aaron Taylor, и Кевин Eliceiri для обмена опытом микроскопии.
Материалы
| Name | Company | Catalog Number | Comments |
| Реагенты | |||
| Hoechst 33342 | Invitrogen | 14533 | ДНК-маркеров |
| Кролик против Iba1 | Вако (Япония) | 019-19741 | Моноциты антител |
| Стоматологическая акриловая | Стоматологическая Lang (различных дистрибьюторов) | Jet протезов порошок Ремонт и жидких | Headcap строительства |
| Kwik-Sil | Инструменты Всемирной Precision | Kwik-SIL | Покрытие подвергается черепных имплантатов |
| Нормальной козьей сывороткой | Джексон ImmunoResearch | 005-000-121 | Ткань обработки |
| Triton X-100 | Sigma-Aldrich | X100-500мл | Ткань обработки |
| Мочевина | Sigma-Aldrich | U4883 | Очистка решения |
| Глицерин | Sigma-Aldrich | G20225 | Очистка решения |
| Оборудование | |||
| Изогнутые микро-ножниц | Инструменты Всемирной Precision | 14208 | Резка имплантатов перед удалением мозга |
| Лезвия для бритвы | Ted Pella | (Разных размеров) | Для использования с блока мозга |
| Акриловые мозга Matrice | Ted Pella | 15054 | Мозг блока для создания начальной плоскости в ткани |
| Пластиковые горки | Ted Pella | 260225 | Монтаж ткани |
| Крышка стекла | Ted Pella | (Разных размеров) | Монтаж ткани |
| Электрод массивов | NeuroNexus технологий | (Различных конструкций) | Пример МПС |
| Vibratome | Leica | VT1000 S | Конкретные системы, используемые в предложенном методе |
| Vibratome лезвия | (Различных поставщиков) | Сбор ломтики | |
| 24-луночные планшеты | (Различных поставщиков) | Хранение и обработка срезы тканей | |
| Конфокальной микроскопии с моторизованной XY сканирования этапе | Carl Zeiss микроскопии | Zeiss LSM 710 и «дзен-2010» программное обеспечение | Конкретные системы, используемые в предложенном методе |
| Паяльник | (Различных поставщиков) | Экскаваторы headcap |
Ссылки
- Schwartz, A. B. Cortical Neural Prosthetics. Annual Review of Neuroscience. 27, 487-507 (2004).
- Normann, R. A. Technology Insight: future neuroprosthetic therapies for disorders of the nervous system. Nature Clinical Practice Neurology. 3, 444-452 (2007).
- Rousche, P., Normann, R. A. Chronic recording capability of the Utah Intracortical Electrode Array in cat sensory cortex. Journal of Neuroscience Methods. 82, 1-15 (1998).
- Koivuniemi, A., Wilks, S. J., Woolley, A. J., Otto, K. J. Multimodal, longitudinal assessment of intracortical microstimulation. Prog. Brain Res. 194, 131-144 (2011).
- Otto, K. J., Rousche, P. J., Kipke, D. R. Microstimulation in auditory cortex provides a substrate for detailed behaviors. Hearing Research. 210, 112-117 (2005).
- Drake, K., Wise, K., Farraye, J., Anderson, D., BeMent, S. Performance of planar multisite microprobes in recordingextracellular single-unit intracortical activity. IEEE Transactions on Biomedical Engineering. 35, 719-732 (1988).
- Liu, X., et al. Stability of the interface between neural tissue and chronically implanted intracortical microelectrodes. IEEE Trans. Rehab. Eng. 7, 315-326 (1999).
- Williams, J. C., Hippensteel, J. A., Dilgen, J., Shain, W., Kipke, D. R. Complex impedance spectroscopy for monitoring tissue responses to inserted neural implants. J. Neural Eng. 4, 410-423 (2007).
- Polikov, V., Tresco, P., Reichert, W. Response of brain tissue to chronically implanted neural electrodes. Journal of Neuroscience Methods. 148, 1-18 (2005).
- Szarowski, D. H., et al. Brain responses to micro-machined silicon devices. Brain Research. 983, 23-35 (2003).
- McConnell, G. C., et al. Implanted neural electrodes cause chronic, local inflammation that is correlated with local neurodegeneration. J. Neural Eng. 6, 056003 (2009).
- Holecko, M. M., Williams, J. C., Massia, S. P. Visualization of the intact interface between neural tissue and implanted microelectrode arrays. J. Neural Eng. 2, 97-102 (2005).
- Pierce, A. L., Sommakia, S., Rickus, J. L., Otto, K. J. Thin-film silica sol-gel coatings for neural microelectrodes. J. Neurosci. Methods. 180, 106-110 (2009).
- Wilks, S. Poly(3,4-ethylene dioxythiophene) (PEDOT) as a micro-neural interface material for electrostimulation. Frontiers in Neuroengineering. 2, (2009).
- Johnson, M. D., Otto, K. J., Kipke, D. R. Repeated voltage biasing improves unit recordings by reducing resistive tissue impedances. IEEE Trans Neural Syst. Rehabil. Eng. 13, 160-165 (2005).
- Otto, K. J., Johnson, M. D., Kipke, D. R. Voltage pulses change neural interface properties and improve unit recordings with chronically implanted microelectrodes. IEEE Trans. Biomed. Eng. 53, 333-340 (2006).
- Hama, H., et al. Scale: a chemical approach for fluorescence imaging and reconstruction of transparent mouse brain. Nature Neuroscience. 14, 1481-1488 (2011).
- Woolley, A. J., Desai, H. A., Steckbeck, M. A., Patel, N. K., Otto, K. J. In situ characterization of the brain-microdevice interface using Device Capture Histology. Journal of Neuroscience Methods. 201, 67-77 (2011).
- Gage, G. J., Kipke, D. R., Shain, W. Whole Animal Perfusion Fixation for Rodents. J. Vis. Exp. (65), e3564 (2012).
- Li, Y., et al. Direct labeling and visualization of blood vessels with lipophilic carbocyanine dye DiI. Nature Protocols. 3, 1703-1708 (2008).
- Clendenon, S. G., Young, P. A., Ferkowicz, M., Phillips, C., Dunn, K. W. Deep Tissue Fluorescent Imaging in Scattering Specimens Using Confocal Microscopy. Microscopy and Microanalysis. 17, 614-617 (2011).
- Wilks, S. J., Richner, T. J., Brodnick, S. K., Kipke, D. R., Williams, J. C., Otto, K. J. Voltage Biasing, Cyclic Voltammetry, & Electrical Impedance Spectroscopy for Neural Interfaces. J. Vis. Exp. (60), e3566 (2012).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены