Method Article
Электрофизиологический анализ кардиомиоцитов, полученных из плюрипотентных стволовых клеток человека (hPSC-CMs) с использованием многоэлектродных массивов (MEAs)
В этой статье
Резюме
Электрофизиологическая характеристика кардиомиоцитов, полученных из человеческих Pluripotent стволовых клеток (hPSC-CMs), имеет решающее значение для моделирования сердечных заболеваний и для определения лекарственной реакции. Этот протокол обеспечивает необходимую информацию для диссоциации и пластин hPSC-CM на многоэлектродных массивах, измерения их полевого потенциала и метода анализа интервалов QT и RR.
Аннотация
Теперь кардиомиоциты могут быть получены с высокой эффективностью как из человеческих эмбриональных, так и индуцированных человеком Pluripotent Stem Cells (hPSC). Кардиомиоциты, полученные из hPSC (hPSC-CMs), все больше признаются как имеющие большое значение для моделирования сердечно-сосудистых заболеваний у людей, особенно синдромов аритмии. Они также продемонстрировали свою актуальность как системы in vitro для прогнозирования ответов лекарственных средств, что делает их потенциально полезными для скрининга и обнаружения лекарственных препаратов, фармакологии безопасности и, возможно, в конечном итоге для персонализированной медицины. Этому будет способствовать получение hPSC-CM от пациентов или восприимчивых лиц в виде hiPSC. Однако для всех применений точное измерение и анализ электрических свойств hPSC-CM необходимы для идентификации изменений, вызванных мутациями ионного канала сердца и / или лекарствами, которые нацелены на ионные каналы и могут вызвать внезапную сердечную смерть. По сравнению с ручным патч-зажимом, устройства с несколькими электродами (MEA) имеют преимуществоЧто позволяет записывать данные со средней и высокой пропускной способности. Этот протокол описывает, как отделить двумерные клеточные культуры hPSC-CMs до небольших агрегатов и отдельных клеток и нанести их на MEA для регистрации их спонтанной электрической активности в качестве потенциала поля. Здесь также описаны методы анализа записанных данных для извлечения конкретных параметров, таких как QT и RR интервалы. Изменения в этих параметрах ожидаются в hPSC-CM, несущих мутации, ответственные за сердечные аритмии, и последующее добавление определенных лекарств, позволяющих выявлять те, которые несут кардиотоксический риск.
Введение
Человеческие плюрипотентные стволовые клетки (hPSC) обладают способностью к самообновлению и генерированию практически любого клеточного типа человеческого тела посредством дифференциации 1 , 2 . Подробные протоколы о том, как направлять дифференцировку hPSCs на несколько сердечных линий (желудочковые, предсердные, кардиостимулярные кардиомиоциты), описаны 3 , 4 , 5 , 6 , 7 . Кардиомиоциты являются электрически активными клетками, и детальное знание их электрофизиологической активности может быть чрезвычайно информативным для понимания развития сердца и заболевания 8 . Кардиомиоциты, полученные из hiPSC (hiPSC-CMs), специфичные для пациента, были успешно использованы для моделирования и изучения клеточных, молекулярных и электрических особенностей некоторых сердечных аритмий, включая синдром Long QT(LQTS) 9 , 10 , 11 , 12 , 13 , синдром Бругады 14 и катехоламинергическая полиморфная желудочковая тахикардия 15 , 16 . Кроме того, несколько препаратов были добавлены к больным hiPSC-CMs, чтобы повторить терапевтическое вмешательство и спасти клеточные патологические фенотипы 10 , 15 , 20 , 21 , 22 . Позднее были разработаны скрининговые платформы на основе Wi hiPSC-CM, в ответ на потребность в человеческих системах на ранних стадиях открытия лекарств 23 , 24 , 25 , поскольку кардиомиоциты грызунов существенно отличаются от huЧеловека в экспрессии ионного канала и биофизике 26 .
С этой целью разрабатываются и внедряются технологии, пригодные для применения с высокой и средней пропускной способностью. К ним относятся оптические записи мембранного потенциала, переходные процессы Ca 2+ и деформация, измерения импеданса (в качестве косвенного показателя сократимости клеток) и измерения потенциала внеклеточного поля (FP) (обзор см. В ссылке 24 ). Устройства с многоэлектродными матрицами (MEA) позволяют регистрировать сигналы (или FP) электрических сигналов, генерируемые и формируемые монослоями или небольшими кластерами кардиомиоцитов. Контур FP коррелирует с потенциалом сердечного действия и, в некоторой степени, с записями 27 электрокардиограммы (ЭКГ); Они обычно показывают начальный быстрый подъем вверх, соответствующий притоку Na + и деполяризации мембраны (пик R / Q), фаза медленной волны / плато, вероятно, соответствующая Са2+ и фазе реполяризации, соответствующей преобладающему K + efflux (T-пик). Возмущение формы FP-волны может быть соотнесено с изменениями в фазах удельного потенциала действия 28 .
Хотя записи патч-струбцины о потенциалах действия могут быть более информативными, особенно для параметров, таких как скорость апстрима и потенциал покоящейся мембраны, ручные измерения невозможны для экспериментов на средних и высоких уровнях производительности, в то время как автоматический патч-зажим применяется только к hPSC -CMs 29 . Однако, поскольку длительные записи в МПС позволяют изучать как острый, так и хронический контакт с соединениями, теперь можно использовать платформы hPSC-CM для скрининга лекарственных средств, открытия 24 , 30 и для фармакологии безопасности 31 , 32 . Это обещает будущую точность или персоНационализированное лекарство 33 .
Цель этого протокола состоит в том, чтобы предоставить необходимую информацию для отделения и размещения hPSC-CM на микросхемах MEA и измерения их FP. В этой процедуре каждый этап был оптимизирован, обеспечивая оптимальную выживаемость и восстановление клеток после диссоциации, оптимальное прикрепление клеток к пластине MEA и стандартизованный анализ и количественную оценку параметров. В частности, объясняется и проиллюстрирован пример процедуры регистрации внеклеточного FP, анализа интервалов QT и RR и оценки эффектов лекарственного средства.
протокол
1. Приготовление растворов и реагентов
- Подготовьте культуральную среду hPSC-CM с использованием среды 34 , 35 , 36 с низким уровнем инсулина, бычьего сывороточного альбумина, поливинилового спирта, основных липидов (LI-BPEL) путем объединения реагентов, описанных в таблице 1 . Фильтруют среду через фильтр с размером пор 0,22 мкм и хранят при 4 ° С в течение 2 недель.
- Подготовьте рекомбинантный маточный раствор фибронектина человека, восстановив 1 мг человеческого рекомбинантного фибронектина в 5 мл стерильной дистиллированной воды, чтобы достичь концентрации 200 мкг / мл, аликвоту и хранить при -80 ° С.
- Приготовьте 1% (мас. / Об.) Раствор детергента для ферментов (см . Таблицу ), чтобы помочь удалить остаточные клетки из микрочипов, растворяя 1 г порошка детергента в 100 мл теплого (~ 40-45 ° C) деионизированная вода. Дайте раствору остыть и храните при 4 ° C fИли до одного года.
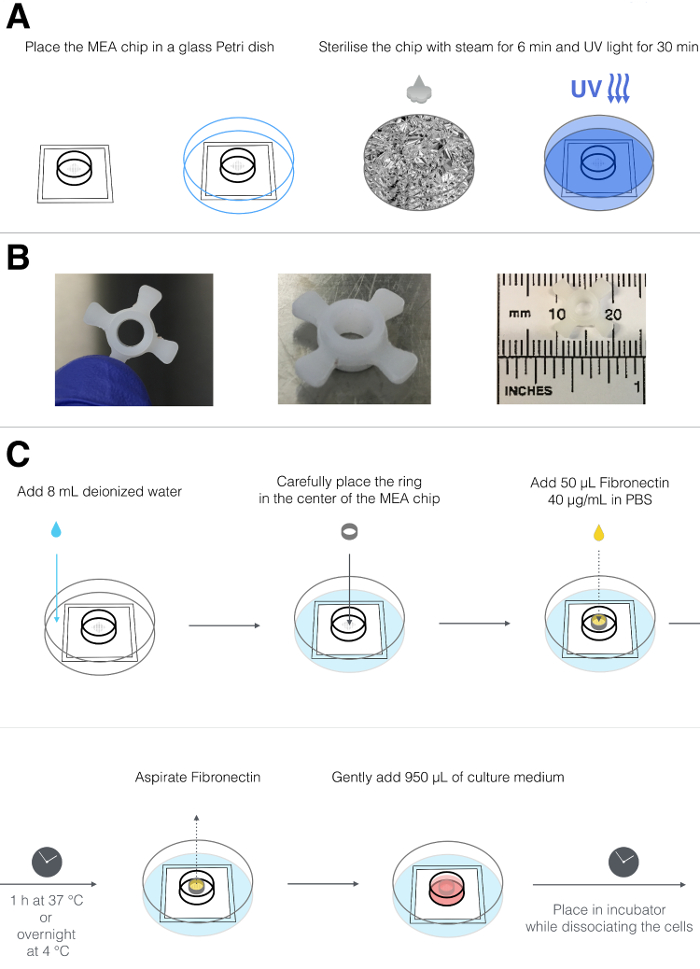
2. Стерилизация микроэлементов (рисунок 1А)
ПРИМЕЧАНИЕ. Доступны несколько различных конфигураций MEA с одно- или многолуночными форматами. В описанном здесь протоколе используется однокамерный МЭА, содержащий 60 регистрирующих электродов в сетке 8 х 8 (см. Таблицу материалов ). Диаметр электрода составляет 30 мкм, а расстояние между электродами - 200 мкм. Также имеется один электрод сравнения.
- Промыть чип тщательно деионизированной водой.
- Поместите чипы MEA в стеклянную чашку Петри, которую можно автоклавировать. Оберните блюдо алюминиевой фольгой.
- Стерилизовать чипсы в лабораторной скороварке в течение 6 мин. Перед открытием посуды дайте ей остыть.
ПРИМЕЧАНИЕ. В качестве альтернативы, стружки можно стерилизовать путем погружения их в 1 мл 80% (об. / Об.) Этанола при комнатной температуре в течение 15-30 мин. - Поместите чипы в вытяжку для клеток и обнажитеОт поверхности до УФ-излучения в течение примерно 30 мин.
3. Покрытие микросхем MEA (рис. 1B и 1C)
- Поместите чистые чипсы в стандартную пластиковую чашку Петри диаметром 10 см.
- Добавить 8 мл стерильной дистиллированной воды в чашку Петри, чтобы сформировать увлажненную камеру, которая предотвратит высыхание небольшого объема культуральной среды на чипе при помещении в инкубатор.
- Используйте специально изготовленные кольца из политетрафторэтилена (PTFE) ( рис. 1B ), чтобы обеспечить размещение кардиомиоцитов в центре чипа, где расположена электродная решетка. (Кольца из ПТФЭ предварительно хранят в 80% этаноле.) В культуральном вытяжном шкафу удалите кольца из этанола, поместите их в стерильную чашку Петри без крышки и позвольте кольцам высохнуть в капоте.
- Поместите сухое кольцо внутри микросхемы MEA с помощью пистолета-распылителя ( рис. 1C ).
ПРИМЕЧАНИЕ. В качестве альтернативы можно использовать 80% этанола, чтобы вымыть пинцет и дать высохнуть iВ тканевой культуре капюшон перед их использованием. - Оттереть одну аликвоту человеческого рекомбинантного фибронектина (200 мкг / мл в дистиллированной воде) и развести в PBS с помощью Ca 2+ и Mg 2+ для получения рабочего раствора 40 мкг / мл. Покройте электроды добавлением 50 мкл 40 мкг / мл фибронектина внутри кольца.
ПРИМЕЧАНИЕ. Покрытие с использованием рекомбинантного фибронектина человека обеспечивает оптимальное прикрепление hPSC-CM. Однако могут быть использованы другие типы белков покрытия, такие как смеси бычьего фибронектина или белков внеклеточного матрикса. - Закройте крышку пластиковой чашки Петри диаметром 10 см и аккуратно переносите в инкубатор блюдо, содержащее чип МЭА. Инкубируйте при 37 ° С в течение не менее 1 ч или при 4 ° С / N.
- Перенесите блюдо, содержащее чип MEA, в капюшон для выращивания клеток. Перед использованием чипа MEA отсасывают 50 мкл фибронектина с использованием пипетки Р200 или вакуумной системы в вытяжном шкафу, не вытесняя кольцо из PTFE. Использовать плаДля этого шага. Убедитесь, что твердые предметы ( например, наконечники пипеток) не касаются внутренней поверхности посуды, так как это может повредить электроды.
ПРИМЕЧАНИЕ. Это продлит срок службы чипов MEA. - Аккуратно добавьте 950 мкл среды LI-BPEL (см. Таблицу 1 и таблицу материалов ), гарантируя , что она равномерно распределена и что кольцо не плавает. Верните блюдо в инкубатор.
4. Диссоциация и покрытие hPSC-CMs (рисунок 2)
ПРИМЕЧАНИЕ. В описанном здесь протоколе используются hPSC-CM, которые были дифференцированы в монослойной культуре с использованием цитокинов 34 через ~ 18 дней после начала дифференцировки. Тем не менее, было доказано, что он подходит для любой 2D и 3D культуры hPSC-CM. При использовании дифференцированных культур в более ранние или более поздние моменты времени регулирование времени инкубации фермента диссоциации (см. Таблицу материалов ) может быть necessary. Следующие объемы предназначены для одной лунки формата 12-луночных планшетов (3,8 см 2 ).
- Аспирируйте среду из культуры hPSC-CMs хорошо.
- Во время работы в вытяжном шкафу для тканей добавьте 1-2 мл / лунку PBS без Ca 2+ / Mg 2+ для промывки культуры. Аспирируйте PBS.
- Добавить 500 мкл / лунку фермента диссоциации. Инкубируйте в течение 5 мин при 37 ° С.
- Добавить 1 мл LI-BPEL / лунку для разбавления фермента. Аккуратно отсоедините монослой hPSC-CM, слегка поцарапав с помощью пипетки P1000. Соберите суспензию клеток в 15 мл пробирке.
- Промойте лунку 1 мл LI-BPEL, чтобы собрать все оставшиеся клетки и клеточные комки.
- Добавьте еще 2-3 мл LI-BPEL, чтобы достичь конечного объема 5-6 мл и осторожно встряхните 3-5 раз по 5 мл пипеткой, чтобы отделить клеточные комки.
ПРИМЕЧАНИЕ. Диссоциация в отдельные клетки в этот момент не является необходимой, так как она влияет на выживание клеток. Наличие малых кластеровОбеспечивают более высокую жизнеспособность клеток. - Центрифуга клеток при комнатной температуре в течение 3 мин при 300 х g.
- Удалите супернатант, пытаясь удалить большую часть избыточной жидкости, но не удаляя клеточный осадок.
- Ресуспендируют осадок клеток в 250 мкл LI-BPEL (с использованием P1000 и пипетирования очень осторожно).
- Распределить ~ 50 мкл клеточной суспензии на МЭА (до 5 МЕА можно приготовить из одной лунки 12-луночного планшета) путем пипетирования клеточной суспензии непосредственно в центре кольца ПТФЭ поверх электродов.
ПРИМЕЧАНИЕ. На этой стадии клетки трудно подсчитать из-за присутствия кластеров клеток, и общее количество ячеек на МЭА может существенно меняться в зависимости от используемого источника hPSC-CM. Во время нанесения покрытия убедитесь, что облако диссоциированных клеток покрывает площадь электродов. - Тщательно переносите МЭС в инкубатор при 37 ° C и позволяйте клеткам присоединять O / N
5. Удаление кольца и средний Re(Рисунок 3)
- Через 1 день после нанесения осторожно удалите кольцо в стерильной среде с помощью стерильного пинцета ( рис. 3A-3B ).
- Промойте кольцо в 80% (об. / Об.) Этаноле и сохраните его в пробирке объемом 50 мл, содержащей свежее 80% (об. / Об.) Этанола.
- Аккуратно удалите 500 мкл среды из чипа MEA и добавьте 500 мкл свежего LI-BPEL.
- Переведите МЭС в инкубатор при 37 ° C.
ПРИМЕЧАНИЕ. Ячейки должны начать избивать через 1-7 дней после удаления кольца и изменения среды ( рисунок 3C ). - Измерьте электрическую активность hPSC-CMs на МЭС через 1-7 дней после удаления кольца.
6. Проверьте качество сигнала (рисунок 4)
- Включите компьютер и запустите программный пакет, связанный с настройкой MEA: TCX-Control, MC_MEA Select и MC_Rack. Установите температуру в 37 ° C в TCX-Control для записи измерений при физиологической температуре.
- Удалите блюдо, содержащее чип MEA fВ инкубаторе. Откройте крышку, выньте чип MEA и поместите его на ткань, чтобы поглотить остаточную воду.
- Тщательно протрите внешние контакты пластины тканью и очистите их с помощью ватного тампона, смоченного 100% (об. / Об.) Этанола, чтобы удалить остатки воды или мусора, которые могут вызвать шум сигнала.
- Перенесите плату MEA в нагретую (37 ° C) записывающую головку, чтобы обнаружить спонтанную активность ( например, аппаратное обеспечение : см. Таблицу материалов , программное обеспечение MC_Rack).
- Откройте MC_Rack: нажмите «Изменить» → «Добавить MC_Card», чтобы создать новый протокол. Используйте раскрывающееся меню «Редактировать», чтобы добавить в протокол разные окна Recorder и Display.
ПРИМЕЧАНИЕ. Рекомендуется частота дискретизации не менее 10 кГц. Протокол, который мы используем, содержит один инструмент Longterm Display Tool с полным расположением всей микросхемы MEA и один сортировщик спайков, необходимый для захвата эффекта лекарственного средства iN реальном времени. Вырез Спайка настраивается с помощью «Предварительного триггера» 20 мс, «Спускового механизма» 800 мс и «Мертвого времени» 2 мс. Протокол можно сохранить как файл «.rck» и перезагрузить перед началом экспериментов.
- Откройте MC_Rack: нажмите «Изменить» → «Добавить MC_Card», чтобы создать новый протокол. Используйте раскрывающееся меню «Редактировать», чтобы добавить в протокол разные окна Recorder и Display.
- Запустите протокол в режиме воспроизведения, нажав кнопку «play».
ПРИМЕЧАНИЕ. На этом этапе можно перезагрузить протокол, сохраненный в шаге 6.5. В MC_Rack загрузите протокол (расширение файла .rck), нажав «Файл» → «Открыть». - Если сигналы показывают четко видимые пики R и пики Т, подождите 10-15 минут, чтобы завершить этап адаптации. Примеры трассировки хорошего и плохого качества показаны на рисунке 4 .
ПРИМЕЧАНИЕ. Если на любом из электродов не обнаружен Т-пик, не проводите эксперимент. Обычно это результат плохой электрической активности hPSC-CM или плохое прикрепление клеток к электродам.
7. Начать ExПеримен и запись
- Нажмите «записать», а затем «играть» и получить данные в течение 10 минут в базовых условиях, чтобы определить устойчивое состояние. Обозначьте электроды, у которых есть лучший сигнал, чтобы их можно было легко идентифицировать и впоследствии экспортировать для анализа.
- Для оценки ответа на наркотики добавьте увеличивающиеся концентрации препарата через каждые 10 мин. В качестве примера добавьте блокатор hERG E4031 в конечной концентрации 1 мкМ. Для этого удалите 100 мкл среды и добавьте тот же объем 10 мкМ E4031, растворенный в среде.
ПРИМЕЧАНИЕ. Как ранее продемонстрировал Cavero и соавт. 31 , разумный выбор объема, в котором растворяются лекарства, важен, поскольку он может существенно изменить кривую ответа препарата. - Повторите шаг 7.2 для всех других концентраций препарата, представляющих интерес.
- Нажмите «остановить», чтобы завершить запись в конце протокола.
8.Очистка MEA для повторного использования
- Как только запись эксперимента закончена, аккуратно удалите среду пипеткой P1000. Не прикасайтесь к внутренней поверхности посуды, так как это может повредить электроды. Утилизировать в соответствии с местными правилами безопасности.
- Промойте чипы МЭА деионизированной водой, используя промывочный флакон, и повторите этап промывки 3-4 раза.
ПРИМЕЧАНИЕ. На этом этапе нет необходимости полностью отсоединять ячейки от чипа. - Добавить 1 мл раствора детергента 1% (об. / Об.) В каждую лунку и инкубировать O / N при 4 ° C, чтобы позволить открепление клеток и удаление клеток.
- Через день тщательно промыть чипсы MEA деионизированной водой для удаления раствора ферментного моющего средства и остаточных клеток и добавить 1 мл деионизированной воды. Чистые чипы MEA можно хранить в погруженной в деионизированную воду при 4 ° C.
9. Экспорт данных
- Откройте программу MC_Data Tool, связанную с настройкой MEA.
- Нажмите «Файл» → «Открыть MC».D».
- Нажмите «Инструменты» → «Преобразовать MCD в ABF» .
- Выберите электроды с лучшими записываемыми сигналами, которые будут экспортированы для анализа. Выберите каталог для сохранения экспортированных файлов и нажмите «Сохранить». Процедура экспорта может занять несколько минут в зависимости от количества экспортированных электродов и общего размера файлов записи.
10. Анализ данных
- Загрузите и установите программу сбора и анализа электрофизиологических данных ( например, pClamp). После завершения запустите программное обеспечение для анализа ( например, Clampfit).
- Расчет интервала RR (рисунок 5).
- Поместите два вертикальных курсора, чтобы определить интересующую область на трассе. Выберите «Обнаружение событий» → «Пороговый поиск». Горизонтальный курсор должен пересекать все события, которые должны быть определены количественно, как показано на рисунке 5A .
- Нажмите &ОК, а затем «Принять всю категорию». Затем программное обеспечение будет искать трассировку для всех подходящих событий. Над событиями будут помечены синие метки.
- Отрегулируйте чувствительность автоматического выбора, настроив параметры в главном окне обнаружения событий.
- После того, как все события были автоматически идентифицированы, перейдите в окно результатов (Window → Results) и скопируйте столбец «Intervent Interval», который содержит частотные данные ( рисунок 5B ).
- Расчет интервала QT (рисунки 6-9):
- Поместите один курсор прямо перед и один после одного FP в состоянии устойчивого состояния. Выберите «Event Detection» → «Создать шаблон» ( рисунок 6 ) .
- Проверьте правильность идентификации FP и нажмите «Добавить». Шаблон будет перемещен в нижнюю панель.
- Сохраните шаблон как '.atf'файл. Таким образом, была создана шаблонная трассировка, которую будет искать программное обеспечение на протяжении всей записи ( рисунок 7 ). Создайте по одному шаблону для каждого условия, так как эффект препарата может изменить форму FP. При необходимости слегка отфильтруйте трассировку, чтобы включить максимум 10 000 точек в пределах двух курсоров.
- После того, как шаблон был сохранен с расширением '.atf', выберите «Обнаружение событий» → «Поиск шаблона» и загрузите шаблон.
- Отрегулируйте «Порог соответствия шаблона», чтобы правильно идентифицировать все FP в выбранном интервале.
- После того как все события были правильно идентифицированы, сохраните их в новом файле .abf.
- Откройте файл с помощью программного обеспечения для анализа и автоматически вычислите «Время пика» как для Q / R, так и для T пиков ( рис. 8, 9 ). Если следы очень шумят, примените фильтр. Вычислите интервал QT, вычитаяQ / R значение из значения T в редакторе электронных таблиц по выбору.
Результаты
Через один день после диссоциации и нанесения покрытия слой hPSC-CM будет видимым как плотная белая пленка, покрывающая центр камеры MEA ( рис. 3A ). После снятия кольца ( фиг. 3B ) Слой должен оставаться на месте, и осмотр на световом микроскопе покажет электроды МЭА, покрытые (сжимающимся) слоем hPSC-CM ( рис. 3C ). Из-за физической и электрической связи ячеек для анализа будет использоваться только один электрод (золотой электрод).
Альтернативно, при работе с трехмерными структурами, такими как эмбриоидные тела или микротитумы, их можно высевать так, чтобы они были физически и электрически разомкнуты. Визуальный осмотр на микроскопе может подтвердить, что физическое соединение между кластерами и несинхронизированные R-волны на МЭС не подтверждают электрического сцепления. В этом cМожно проанализировать множество независимых электродов.
Типичные записи трасс FP показаны на рисунке 4 . В частности, след хорошего качества может определяться наличием четкого пика, соответствующего притоку Na + и деполяризации мембраны (пик R / Q), четкой фазы реполяризации, соответствующей K + efflux (T-пик), и высокой Отношение сигнал / шум ( рис. 4A , слева: обратите внимание на шкалу оси y и рисунок 4B ). Плохое качество следов ( рис. 4A , середина) может быть результатом отказа hPSC-CMs присоединяться к пластине MEA или слабой электрической активности hPSC-CM. Ожидание 1-3 дней для лучшего вложения может улучшить сигнал; Однако, если улучшение сигнала не видно, рекомендуется исключить это МЭА из экспериментов. Шумные следы ( рис. 4A , справа) могут быть проанализированы после фильтрации.
Успешный анализ интервала RR можно определить путем визуального осмотра экрана, показывающего обнаружение пика ( рис. 5A, 5B ). В пределах интервала времени, определенного вертикальными курсорами, должны присутствовать синие метки, соответствующие каждому пику. Если программа не идентифицирует один или несколько пиков, попробуйте переместить горизонтальный курсор и снова запустить анализ или настроить параметры обнаружения. Аналогичным образом, успешный анализ интервала QT может быть идентифицирован визуальной проверкой экрана, показывающего обнаружение FP ( рисунок 7 ). В пределах интервала времени, определенного вертикальными курсорами, должны присутствовать синие метки, соответствующие каждому обнаружению FP. Если программа не идентифицирует один или несколько FP, попробуйте переопределить шаблон FP ( рисунок 6 ) или настроить параметры обнаружения и выполнить анализ еще раз.
Извлеченные индивидуальные следы FP или их среднее значение ( FigurE 8) можно использовать для получения значений интервала QT со специфическими настройками, как на рисунке 9 . Анализ отношения QT-RR является целесообразным и имеет смысл в линиях больных и WT hPSC ( рисунок 10A ) и для оценки необходимости и / или влияния коррекций интервала QT ( рисунок 10B-10D ). HPSC-CMs, несущие вызывающие LQTS мутации, удлинили интервалы QT по сравнению с контрольными WT ( рисунок 11A ). Обработка hPSC-CM с блокатором hERG приводит к удлинению интервала QT ( рисунок 11B ); Наоборот, обработка активатором hERG приводит к сокращению интервала QT ( рисунок 11C ). Наконец, лечение лекарственными средствами, влияющими на частоту избиения hPSC-CMs, должно быть видимым как изменение интервала RR ( рисунок 11D , сокращение RR-интервала).
 />
/>
Рисунок 1: Стерилизация и покрытие микроэлементов. ( A ) Схема, представляющая процесс стерилизации, включая размещение чипа MEA в автоклавируемой стеклянной чашке Петри, обертывание в алюминиевой фольге, пропаривание в течение 6 мин и воздействие на УФ в течение 30 мин. ( B ) верхняя (левая панель) и боковая (средняя панель) виды пользовательского кольца из PTFE; Кольцо имеет наружный диаметр 1,2 см, в том числе 4 откидных створки, которые позволяют разместить его в центре чипа МЭА, а внутренний диаметр составляет 0,4 см (правая панель). ( C ) Схема подготовки микросхемы MEA, включая установку чипа в стандартную пластиковую чашку Петри, добавление 8 мл деионизированной воды вне камеры MEA, размещение кольца PTFE в середине камеры и нанесение покрытия на электродную решетку фибронектином , После инкубации фибронектин удаляют и заменяют культуральной средой.T = "_ blank"> Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
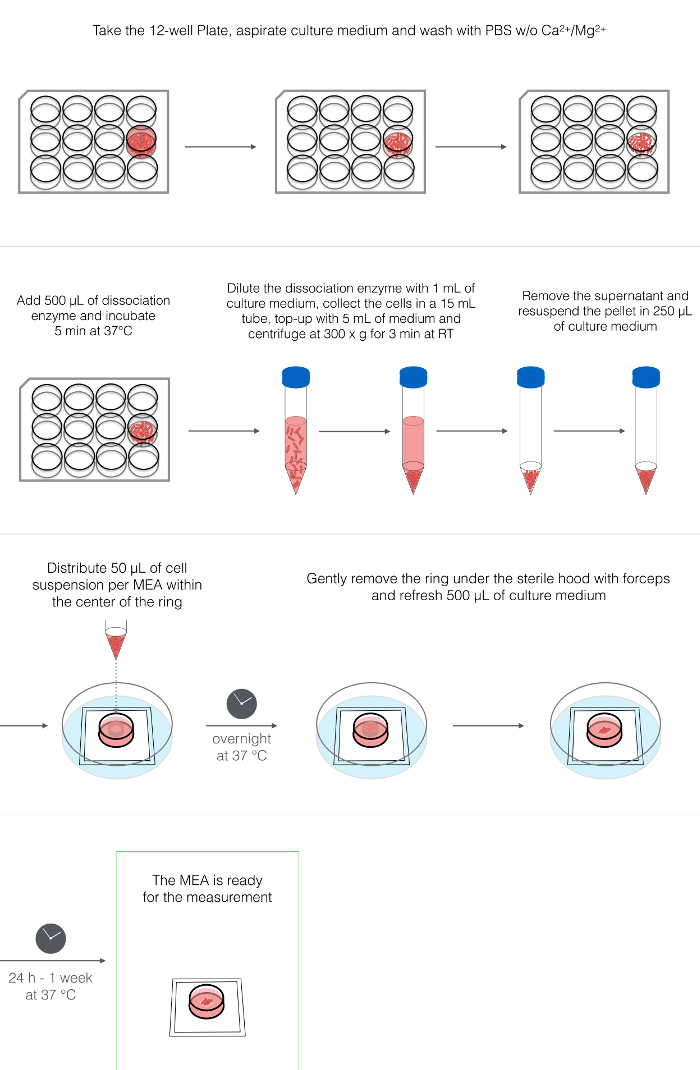
Рисунок 2: Диссоциация и нанесение покрытий hPSC-CM. Схема, представляющая процессы ферментативной диссоциации hpSC-CMs, центрифугирования, ресуспендирования и осаждения на центре камеры MEA. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 3: Микросхемы MEA с hPSC-CM слоем. ( A ) Вид сверху микросхемы MEA, содержащей кольцо и слой hPSC-CM. ( B ) вид сбоку микросхемы MEA после снятия кольца. ( C ) Яркое полевое изображение слоя hPSC-CMs, нанесенного на микро-Электродная решетка; 4Х увеличение. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
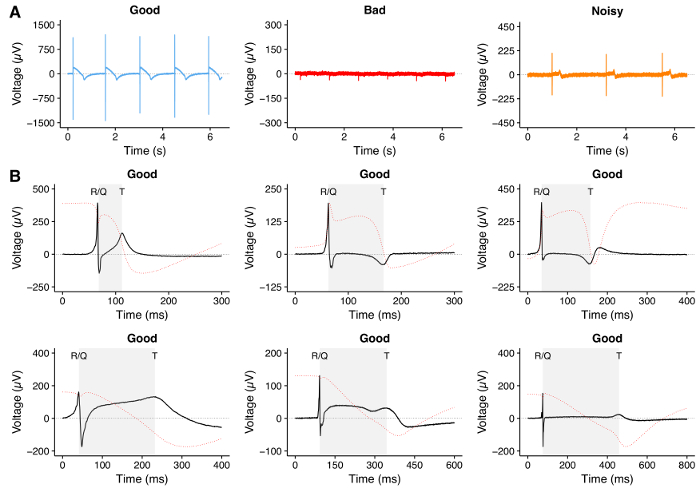
Рисунок 4: MEA Запись hPSC-CM. ( A ) репрезентативные следы, записанные с MEA, показывающие трассу хорошего качества с четко видимыми пиками R / Q и T с высоким отношением сигнал / шум (слева), след плохого качества без четко видимых пиков R / Q и Т (средний) И шумная трасса с ярко выраженными R / Q и Т пиками, но с низким отношением сигнал / шум (справа). ( B ) Репрезентативные примеры трасс FP хорошего качества с различными морфологиями, которые могут быть записаны во время экспериментов MEA с использованием hPSC-CM. Заштрихованная область представляет интервал QT, измеренный во время анализа. Так как FP в MEA напоминает первый деривативE потенциала действия 28 мы вычислили интеграл трассы FP, показанный как красная пунктирная линия, как теоретическая демонстрация выбора T волны, близкой к полной реполяризации потенциала действия. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
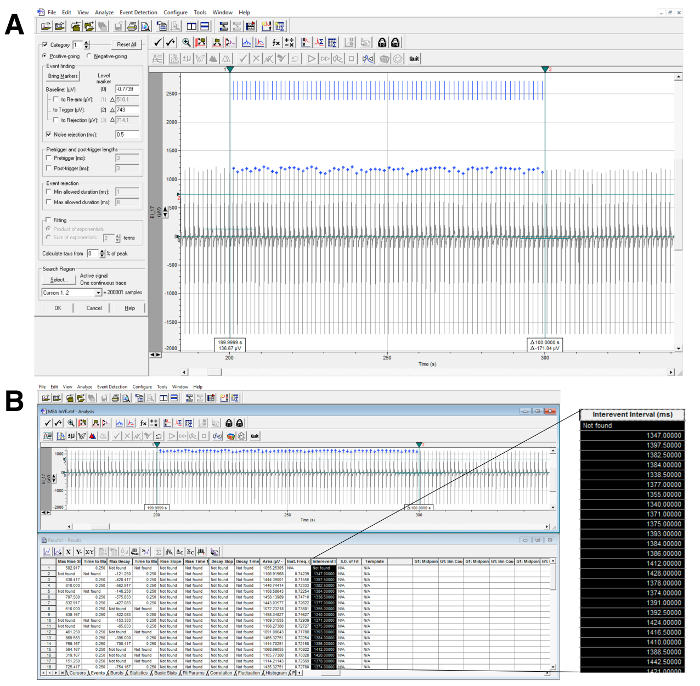
Рисунок 5: Расчет интервала RR. ( A ) Пример анализа интервалов RR с автоматическим определением пика (сверху) и извлечением данных (внизу) с использованием программного обеспечения для анализа (см. Таблицу). Вертикальные курсоры определяют интересующий временной интервал, а горизонтальный курсор пересекает все события, которые были обнаружены и идентифицированы синими метками. ( B ) Увеличенный столбец показывает извлеченные данные, используемые для расчета интервала RR, Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.

Рисунок 6: Создание шаблона FP. Пример выбора шаблона с использованием вертикальных курсоров, расположенных до и после одного FP. Этот шаблон используется для автоматической идентификации FP. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
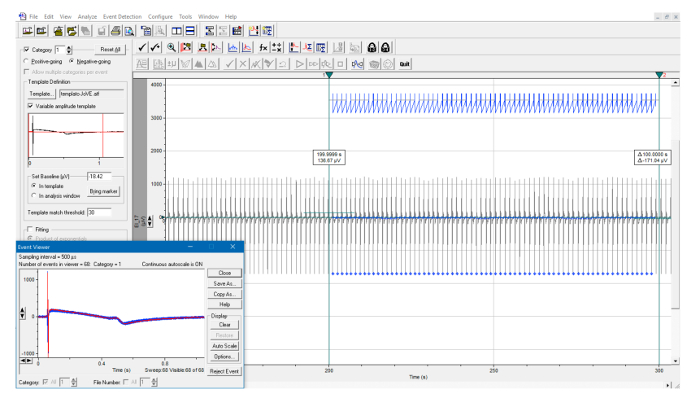
Рисунок 7: Автоматическая идентификация шаблона FP. Пример поиска шаблона на протяжении интервала, определенного двумя вертикальными курсорами. Все обнаруженные события идентифицируются синими метками и являются автоматическимиY, наложенных на вставку. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
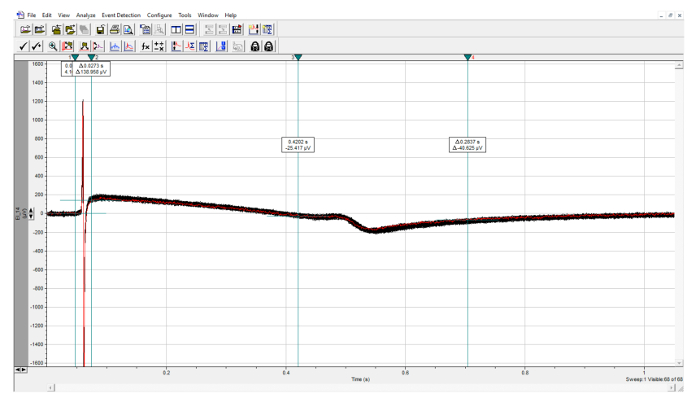
Рисунок 8: Количественная оценка параметров FP. Анализ сохраненных событий с R-пиком, вручную идентифицированным в первых двух курсорах, и пиком T, вручную идентифицированным в двух последних курсорах. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
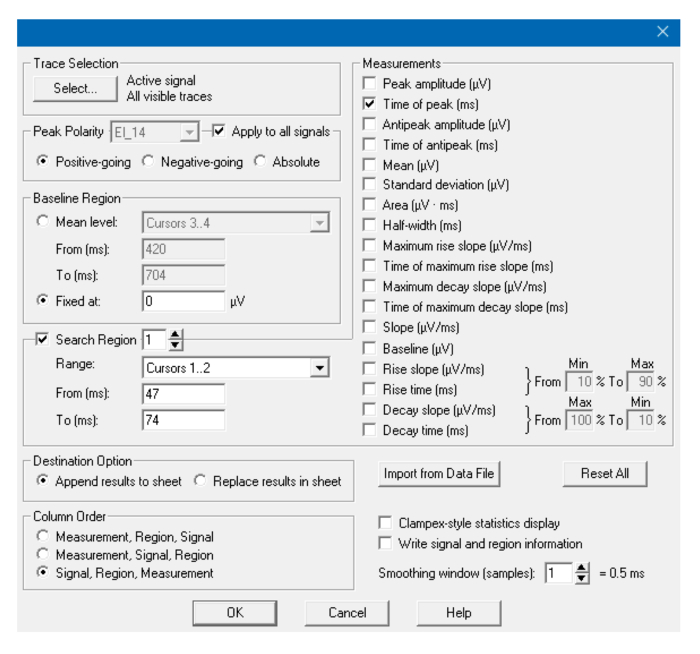
Рисунок 9: Окно анализа. Параметры, используемые в окне статистики для определения пика R. Для обнаружения Т-пика, изменения курсоров и (при необходимости) polarity. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
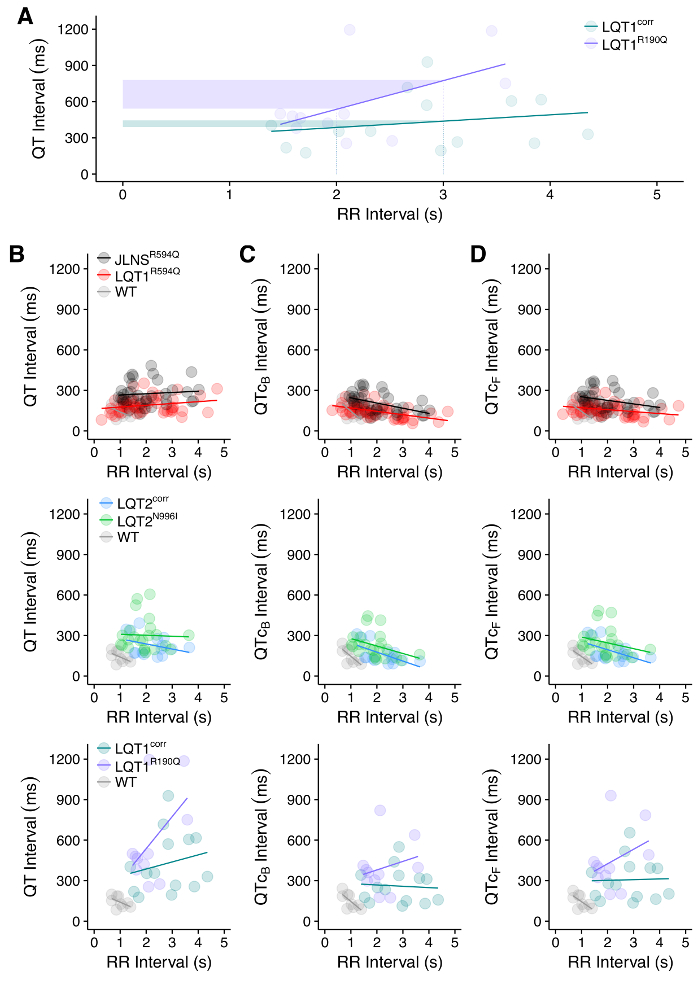
Рисунок 10: Связь QT-RR. ( A ) Пример различной взаимосвязи между QT и RR интервалами между WT (LQT1 корр. ) И синдромом длинного QT типа 1 (LQT1 R190Q ) hPSC -CM. Заштрихованные области показывают, что один и тот же сдвиг в интервале RR вызывает больший сдвиг в интервале QT больной линии LQT1, что, вероятно, увеличивает восприимчивость к аритмии. ( B ) Связь между нескорректированными QT и RR интервалами, измеренными в MEA в CMs из 7 различных линий hPSC. Эффект коррекции QT для формул Bazett ( C ) или Fridericia ( D ) показан и виден как изменение наклона QT-RR в Термальные отношения. Цифры, приведенные в ссылке 30 . Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
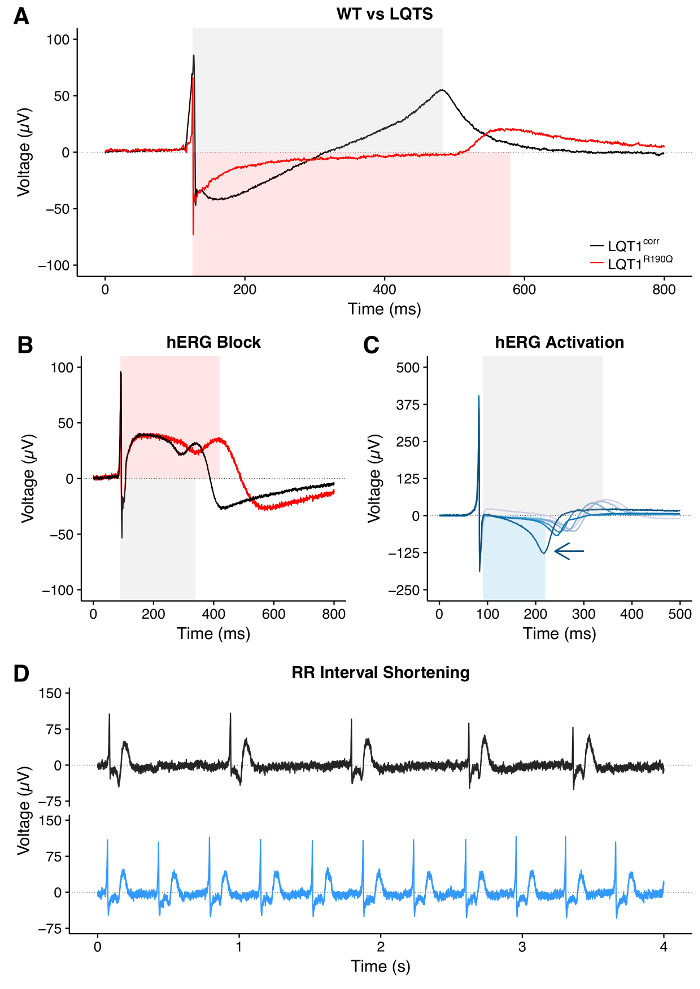
Рисунок 11: Изменения интервала QT и RR, вызванные заболеванием или лекарством. ( A ) Пример удлинения интервала QT в hPSC-CM, полученного от пациента, несущего мутацию с длинным QT синдромом (LQTS), по сравнению с его изогенным контролем WT. ( B ) Пример удлинения интервала QT в hPSC-CM при фармакологическом блоке hERG. ( C ) Сокращение интервала QT при лечении возрастающими дозами активатора hERG. Стрелка указывает направление сокращения. ( D ) Пример сокращения интервала RR, вызванного лекарственным средством. Панель (C) была адаптирована из справочной> 30. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
| Низкий уровень инсулина, BSA, поливиниловый спирт, основные липиды (LI-BPEL) Средняя | |||
| Компонент | Количество на 100 мл | ||
| IMDM | 43 мл | ||
| F12 | 43 мл | ||
| Аскорбиновая кислота 2-фосфат (5 мг / мл в дистиллированной воде) | 1 мл | ||
| Дополнение к культуре клеток (прямой заменитель L-глутамина) | 1 мл | ||
| Пенициллин / стрептомицин | 0,5мл | ||
| Феноловый красный | 1 мг | ||
| Гибридома со средним белком (II) (PFHMII) | 5 мл | ||
| BSA (10% мас. / Об. В IMDM) | 2,5 мл | ||
| ПВА (5% мас. / Об. В дистиллированной воде) | 2,5 мл | ||
| Химически определенный липидный концентрат (CDLC) | 1 мл | ||
| Инсулин-трансферрин-селен-этаноламин (ITS-X) 100X | 0,1 мл | ||
| Α-Монотиоглицерин (13 мкл в 1 мл IMDM) | 0,3 мл | ||
| Объединяют реагенты, фильтруют с помощью фильтра с порами 0,22 мкм и хранят среду при 4 ° С в течение до 2 недель. | |||
Таблица 1: Средняя концентрация Li-BPEL.
Обсуждение
Этот протокол показывает, как отделить и подготовить hPSC-CM для измерения их FP с использованием MEA. HPSC-CMs обычно отображают спонтанную электрическую активность, которая может быть измерена как FP и может предоставлять значимые данные в отношении частоты избиения, продолжительности интервала QT и аритмических событий.
Диссоциация двумерных кардиальных дифференцированных культур необходима для воссоздания слоя биения на МЭС, и это представляет собой критический шаг. Механическое напряжение путем повторного пипетирования и / или агрессивного лечения диссоциации ферментами может приводить к высокой гибели клеток, невозможности прикрепления к пластине MEA и отсутствию спонтанной электрической активности. Этот протокол был оптимизирован для однослойных культур. Однако подобный подход может быть использован для трехмерных (3D) культур ( например, эмбриоидных тел или ЭБ) с незначительными изменениями, такими как сбор ЭБ с последующей промывкой PBS и более длительным временем инкубации с диссоциирующим ферментом. ИмпортироватьКак в 2D, так и в 3D дифференцированных культурах, чем старше дифференцированные клетки, тем большее время инкубации может потребоваться для отделения клеток из-за увеличения осаждения внеклеточного матрикса.
Протокол, описанный здесь для количественной оценки параметров FP, может быть использован для генерирования кривых доза-ответ для кардиоактивных лекарственных средств. Как недавно описано Cavero et al. 31 , начальная концентрация лекарственного средства может существенно повлиять на результат измерения МЭА. Поэтому для повышения точности и достоверности результатов мы предлагаем следующее: 1) при необратимых активаторах / блокаторах применяют относительно большие объемы среды, содержащей исследуемый препарат. Более подробно удалите 10-50% среднего объема из чипа MEA и добавьте равный объем среды, в которой препарат предварительно растворялся в соответствующей концентрации. В этом случае для вычисления конечной концентрации лекарственного средства важно учитыватьИзменение концентрации после удаления среды. 2) В случае обратимых активаторов / блокаторов добавьте 10 мкл каждой дозы лекарственного средства из исходного раствора 100X.
Большинство протоколов дифференцировки сердца приводит к переменной смешанной популяции узлоподобных, предсердных и желудочковых кардиомиоцитов, причем наиболее представительным является желудочковый тип. Это может быть ограничением при моделировании сердечных заболеваний, затрагивающих определенный подтип кардиомиоцитов или препаратов, действующих на ионные каналы, специфичные для сердечного подтипа. Хотя в нескольких исследованиях были оптимизированы условия для направления более контролируемой спецификации во время дифференцировки сердца 3 , 5 , 37 , 38 , их широкое применение все еще находится в стадии изучения.
Кроме того, переменная эффективность дифференциации (в разных экспериментах и в диFferent hPSC), могут наблюдаться 39 , 40 , 41 , 42 , 43 , 44 . Стратегии обогащения кардиомиоцитов, основанные на экспрессии поверхностного белка 35 , 45 (путем сортировки клеток с помощью флуоресценции или путем выбора магнитной шарики 46 , 47 ), и метаболический отбор 44 , 48 могут представлять достоверные стратегии, которые могут быть применены к любым (генетически модифицированным или Немодифицированный) hPSC-line предварительное покрытие hPSC-CM, для улучшения электрического сигнала.
Хотя hPSC-CMs, как известно, незрелые по сравнению со взрослыми кардиомиоцитами 4 , 49 , они оказались ценными в r( Например , в каналопатиях) 19 , 20 , 50 и вызванные лекарствами реакции ( например, блокаторы сердечных ионных каналов) 4 , 51 . Кроме того, незрелые клетки легче диссоциируют и лучше восстанавливаются, чем взрослые кардиомиоциты после диссоциации и гальванизации 44, поэтому незрелость hPSC-CM может быть вознаграждена как преимущество в этом отношении. Однако, чтобы быть в состоянии повторить, например . Поздних сердечных заболеваний и добросовестно воспроизводить лекарственные реакции взрослых кардиомиоцитов, необходимо получить более зрелое механическое, метаболическое и электрическое состояние hPSC-CM. Способы созревания этих клеток включают в себя длительное время в культуре 52 , механическую деформацию 53 , электрическую стимуляцию 54 , добавление небольшихМолекулы 55 , 3D-культура 56 , совместная культура с другими типами клеток 57 и даже комбинация этих подходов 58 ; На сегодняшний день ни один из этих подходов не привел к фенотипу, сходному с взрослым.
Как часть характеристик незрелости, hPSC-CMs показывают электрическую автоматичность. Здесь приведены подробные сведения о том, как точно количественно определить интервалы QT и RR. Одним из ограничений измерения спонтанной электрической активности является то, что сравнение интервалов QT может быть затруднено, когда hPSC-CMs отображают различные частоты избиения. В этом случае формулы Bazett или Fridericia могут быть использованы для коррекции интервала QT для частоты. Однако, как ранее сообщалось 30 , мы настоятельно рекомендуем провести регрессионный анализ по основным осям, построив график интервала QT по отношению к интервалу RR как для необработанных, так и для исправленных данных, чтобы исключить любые возможные отклонения из-за самого метода коррекции.
Представленный здесь протокол вместе с ранее описанными методами 59 , 60 помогает стандартизировать процедуры и анализ FP hPSC-CM, улучшая воспроизводимость данных и позволяя лучше сравнивать результаты между лабораториями.
Раскрытие информации
CLM является соучредителем и консультантом Pluriomics bv. Часть расходов на публикацию была покрыта многоканальными системами.
Благодарности
Эта работа была поддержана следующими грантами: CVON (HUSTCARE): Нидерландская кардиологическая исследовательская инициатива (голландский фонд сердца, Нидерландская федерация университетских медицинских центров, Нидерландская организация исследований и разработок в области здравоохранения и Королевская академия наук Нидерландов); Европейский исследовательский совет (ERCAdG 323182 STEMCARDIOVASC). Мы благодарим Э. Джакомелли (LUMC) за помощь в дифференцировке сердца hPSC.
Материалы
| Name | Company | Catalog Number | Comments |
| Biological safety cabinet/laminar flow-hood | Cleanair | ||
| MEA2100 in vitro recording system | Multi Channel Systems | ||
| CO2 cell-culture incubator | Sanyo | MCO-15A | |
| Centrifuge | Hitachi | himac-CT6EL | |
| Leica stereomicroscope | Leica Microsystems | MS5 | |
| Handheld pipetman (P-10 (10 μL), P-200 (200 μL), P-1000 (1,000 μL)) | Gilson International | ||
| Filter tips (10 μL, 200μL, 1,000μL) | Corning | 4807 (10 μL), 4810 (200μL), 4809 (1000μL) | |
| Disposable bottle top filter (0.22 μm pore size) | Millipore | SCGVU02RE | |
| Sterile plastic pipette | Greiner Bio-One | 606180 (5 mL), 607180 (10 mL), 760180 (25 mL) | |
| Tweezers | Dumont | ||
| Autoclavable Petri dishes | VWR/ Duran Group | 391-0860 | |
| MEA chip | Multi Channel Systems | MEA200/30iR-Ti-gr | |
| Phosphate-buffered Saline (PBS) calcium, magnesium | Thermo Fisher Scientific | 14040-091 | |
| Phosphate-Buffered Saline (PBS) no calcium, no magnesium | Thermo Fisher Scientific | 14190-169 | |
| Human recombinant fibronectin | Tebu-Bio | J64560 | |
| Custom-made polytetrafluoroethylene (PTFE) MEA rings | LUMC: department of Instrument Development | ||
| Dissociation enzyme - TrypLE Select 1x | Thermo Fisher Scientific | 12563-029 | |
| Tergazyme enzyme detergent | Sigma-Aldrich | Z273287-1EA | |
| Distilled Water | Thermo Fisher Scientific | 15230-089 | |
| Name | Company | Catalog Number | Comments |
| Reagents for LI-BPEL medium | |||
| Iscove's Modified Dulbecco's Medium (IMDM) | Thermo Fisher Scientific | 21056-023 | |
| F12 nutrient mixture (Ham) | Thermo Fisher Scientific | 31765-027 | |
| Ascorbic Acid 2-phosphate | Sigma-Aldrich | A8960 | |
| Glutamax | Thermo Fisher Scientific | 35050-038 | |
| Penicillin/Streptomycin | Thermo Fisher Scientific | 15070-063 | |
| Phenol Red | Sigma-Aldrich | P3532 | |
| Protein-free Hybridoma Medium-II (PFHMII) | Thermo Fisher Scientific | 12040-077 | |
| Bovine Serum Albumin (BSA) | Bovogen Biologicals Australia | BSAS05 | |
| Poly(Vinyl Alcohol) (PVA) | Sigma-Aldrich | P8136 | |
| Chemically-defined Lipid Concentrate (CDLC) | Thermo Fisher Scientific | 11905-031 | |
| Insulin-Transferrin-Selenium-Ethanolamine (ITS-X) 100x | Thermo Fisher Scientific | 51599-056 | |
| α-Monothioglycerol | Sigma-Aldrich | M6145 | |
| Name | Company | Software version | Comments |
| MC_Rack | Multi Channel Systems | 4.6.2 | Alternatively, data can be recorded using Cardio2D or MC_Experimenter (MultiChannel Systems) |
| TCX Control | Multi Channel Systems | 1.3.4 | |
| MEA Select | Multi Channel Systems | 1.3.0 | |
| MC_Data Tool | Multi Channel Systems | 2.6.15 | Alternatively, Multi Channel Data Manager (MultiChannel Systems) can be used when custom data export is required (HDF5, EDF, etc.) |
| Clampfit | Molecular Devices | 7.0.0 | Used in step 10.1 for analyzing, graphing, and formatting of all of data. To use Clampfit, download and install the electrophysiology data acquisition and pClam (latest version, 10.7.0), available on the Molecular Devices Website. Once complete, launch the software Clampfit. Alternatively, data can be analysed using Cardio2D (MultiChannel Systems) or MatLab custom code. |
Ссылки
- Takahashi, K., et al. Induction of pluripotent stem cells from adult human fibroblasts by defined factors. Cell. 131 (5), 861-872 (2007).
- Thomson, J. A., et al. Embryonic stem cell lines derived from human blastocysts. Science. 282 (5391), 1145-1147 (1998).
- Birket, M. J., et al. Expansion and patterning of cardiovascular progenitors derived from human pluripotent stem cells. Nat Biotechnol. 33 (9), 970-979 (2015).
- Denning, C., et al. Cardiomyocytes from human pluripotent stem cells: From laboratory curiosity to industrial biomedical platform. Biochim Biophys Acta. 1863 (7 Pt B), 1728-1748 (2016).
- Devalla, H. D., et al. Atrial-like cardiomyocytes from human pluripotent stem cells are a robust preclinical model for assessing atrial-selective pharmacology. EMBO Mol Med. 7 (4), 394-410 (2015).
- Lewandowski, J., Kolanowski, T. J., Kurpisz, M. Techniques for the induction of human pluripotent stem cell differentiation towards cardiomyocytes. J Tissue Eng Regen Med. , (2016).
- Mummery, C. L., Zhang, J., Ng, E. S., Elliott, D. A., Elefanty, A. G., Kamp, T. J. Differentiation of human embryonic stem cells and induced pluripotent stem cells to cardiomyocytes: a methods overview. Circ Res. 111 (3), 344-358 (2012).
- Davies, M. P., An, R. H., Doevendans, P., Kubalak, S., Chien, K. R., Kass, R. S. Developmental changes in ionic channel activity in the embryonic murine heart. Circ Res. 78 (1), 15-25 (1996).
- Bellin, M., et al. Isogenic human pluripotent stem cell pairs reveal the role of a KCNH2 mutation in long-QT syndrome. EMBO J. 32 (24), 3161-3175 (2013).
- Moretti, A., et al. Patient-specific induced pluripotent stem-cell models for long-QT syndrome. N Engl J Med. 363 (15), 1397-1409 (2010).
- Ma, D., et al. Modeling type 3 long QT syndrome with cardiomyocytes derived from patient-specific induced pluripotent stem cells. Int J Cardiol. 168 (6), 5277-5286 (2013).
- Yazawa, M., et al. Using induced pluripotent stem cells to investigate cardiac phenotypes in Timothy syndrome. Nature. 471 (7337), 230-U120 (2011).
- Limpitikul, W. B., et al. A Precision Medicine Approach to the Rescue of Function on Malignant Calmodulinopathic Long QT Syndrome. Circ Res. , (2016).
- Liang, P., et al. Patient-Specific and Genome-Edited Induced Pluripotent Stem Cell-Derived Cardiomyocytes Elucidate Single-Cell Phenotype of Brugada Syndrome. J Am Coll Cardiol. 68 (19), 2086-2096 (2016).
- Jung, C. B., et al. Dantrolene rescues arrhythmogenic RYR2 defect in a patient-specific stem cell model of catecholaminergic polymorphic ventricular tachycardia. EMBO Mol Med. 4 (3), 180-191 (2012).
- Novak, A., et al. Cardiomyocytes generated from CPVTD307H patients are arrhythmogenic in response to beta-adrenergic stimulation. J Cell Mol Med. 16 (3), 468-482 (2012).
- Bellin, M., Mummery, C. L. Inherited heart disease - what can we expect from the second decade of human iPS cell research. FEBS Lett. 590 (15), 2482-2493 (2016).
- Sallam, K., Li, Y., Sager, P. T., Houser, S. R., Wu, J. C. Finding the rhythm of sudden cardiac death: new opportunities using induced pluripotent stem cell-derived cardiomyocytes. Circ Res. 116 (12), 1989-2004 (2015).
- Sinnecker, D., Goedel, A., Laugwitz, K. L., Moretti, A. Induced pluripotent stem cell-derived cardiomyocytes: a versatile tool for arrhythmia research. Circ Res. 112 (6), 961-968 (2013).
- Bellin, M., Marchetto, M. C., Gage, F. H., Mummery, C. L. Induced pluripotent stem cells: the new patient?. Nat Rev Mol Cell Biol. 13 (11), 713-726 (2012).
- Sinnecker, D., Laugwitz, K. L., Moretti, A. Induced pluripotent stem cell-derived cardiomyocytes for drug development and toxicity testing. Pharmacol Ther. 143 (2), 246-252 (2014).
- Terrenoire, C., et al. Induced pluripotent stem cells used to reveal drug actions in a long QT syndrome family with complex genetics. J Gen Physiol. 141 (1), 61-72 (2013).
- Abi-Gerges, N., et al. Assessment of extracellular field potential and Ca2+ transient signals for early QT/pro-arrhythmia detection using human induced pluripotent stem cell-derived cardiomyocytes. J Pharmacol Toxicol Methods. 83, 1-15 (2016).
- Del Alamo, J. C., et al. High throughput physiological screening of iPSC-derived cardiomyocytes for drug development. Biochim Biophys Acta. 1863 (7 Pt B), 1717-1727 (2016).
- Blinova, K., et al. Comprehensive Translational Assessment of Human Induced Pluripotent Stem Cell Derived Cardiomyocytes for Evaluating Drug-Induced Arrhythmias. Toxicol Sci. , (2016).
- Nerbonne, J. M. Studying cardiac arrhythmias in the mouse--a reasonable model for probing mechanisms?. Trends Cardiovasc Med. 14 (3), 83-93 (2004).
- Halbach, M., Egert, U., Hescheler, J., Banach, K. Estimation of action potential changes from field potential recordings in multicellular mouse cardiac myocyte cultures. Cell Physiol Biochem. 13 (5), 271-284 (2003).
- Tertoolen, L. G., Braam, S. R., van Meer, B. J., Passier, R., Mummery, C. L. Interpretation of field potentials measured on a multi electrode array in pharmacological toxicity screening on primary and human pluripotent stem cell-derived cardiomyocytes. Biochem Biophys Res Commun. , (2017).
- Rajamohan, D., et al. Automated Electrophysiological and Pharmacological Evaluation of Human Pluripotent Stem Cell-Derived Cardiomyocytes. Stem Cells Dev. 25 (6), 439-452 (2016).
- Sala, L., et al. A new hERG allosteric modulator rescues genetic and drug-induced long-QT syndrome phenotypes in cardiomyocytes from isogenic pairs of patient induced pluripotent stem cells. EMBO Mol Med. 8 (9), 1065-1081 (2016).
- Cavero, I., Guillon, J. M., Ballet, V., Clements, M., Gerbeau, J. F., Holzgrefe, H. Comprehensive in vitro Proarrhythmia Assay (CiPA): Pending issues for successful validation and implementation. J Pharmacol Toxicol Methods. , (2016).
- Sala, L., Bellin, M., Mummery, C. L. Integrating cardiomyocytes from human pluripotent stem cells in safety pharmacology: has the time come?. Br J Pharmacol. , (2016).
- Chen, I. Y., Matsa, E., Wu, J. C. Induced pluripotent stem cells: at the heart of cardiovascular precision medicine. Nat Rev Cardiol. 13 (6), 333-349 (2016).
- Dambrot, C., et al. Strategies for rapidly mapping proviral integration sites and assessing cardiogenic potential of nascent human induced pluripotent stem cell clones. Exp Cell Res. 327 (2), 297-306 (2014).
- Elliott, D. A., et al. NKX2-5(eGFP/w) hESCs for isolation of human cardiac progenitors and cardiomyocytes. Nat Methods. 8 (12), 1037-1040 (2011).
- Ng, E. S., Davis, R., Stanley, E. G., Elefanty, A. G. A protocol describing the use of a recombinant protein-based, animal product-free medium (APEL) for human embryonic stem cell differentiation as spin embryoid bodies. Nat Protoc. 3 (5), 768-776 (2008).
- Karakikes, I., et al. Small molecule-mediated directed differentiation of human embryonic stem cells toward ventricular cardiomyocytes. Stem Cells Transl Med. 3 (1), 18-31 (2014).
- Zhang, Q., et al. Direct differentiation of atrial and ventricular myocytes from human embryonic stem cells by alternating retinoid signals. Cell Res. 21 (4), 579-587 (2011).
- Mummery, C., et al. Differentiation of human embryonic stem cells to cardiomyocytes: role of coculture with visceral endoderm-like cells. Circulation. 107 (21), 2733-2740 (2003).
- Kehat, I., et al. Human embryonic stem cells can differentiate into myocytes with structural and functional properties of cardiomyocytes. J Clin Invest. 108 (3), 407-414 (2001).
- Kattman, S. J., et al. Stage-specific optimization of activin/nodal and BMP signaling promotes cardiac differentiation of mouse and human pluripotent stem cell lines. Cell Stem Cell. 8 (2), 228-240 (2011).
- Zhang, J., et al. Extracellular matrix promotes highly efficient cardiac differentiation of human pluripotent stem cells: the matrix sandwich method. Circ Res. 111 (9), 1125-1136 (2012).
- Lian, X., et al. Directed cardiomyocyte differentiation from human pluripotent stem cells by modulating Wnt/beta-catenin signaling under fully defined conditions. Nat Protoc. 8 (1), 162-175 (2013).
- Burridge, P. W., et al. Chemically defined generation of human cardiomyocytes. Nat Methods. 11 (8), 855-860 (2014).
- Dubois, N. C., et al. SIRPA is a specific cell-surface marker for isolating cardiomyocytes derived from human pluripotent stem cells. Nat Biotechnol. 29 (11), 1011-1018 (2011).
- Fuerstenau-Sharp, M., et al. Generation of highly purified human cardiomyocytes from peripheral blood mononuclear cell-derived induced pluripotent stem cells. PLoS One. 10 (5), e0126596 (2015).
- Schwach, V., Passier, R. Generation and purification of human stem cell-derived cardiomyocytes. Differentiation. 91 (4-5), 126-138 (2016).
- Tohyama, S., et al. Distinct metabolic flow enables large-scale purification of mouse and human pluripotent stem cell-derived cardiomyocytes. Cell Stem Cell. 12 (1), 127-137 (2013).
- Veerman, C. C., Kosmidis, G., Mummery, C. L., Casini, S., Verkerk, A. O., Bellin, M. Immaturity of human stem-cell-derived cardiomyocytes in culture: fatal flaw or soluble problem?. Stem Cells Dev. 24 (9), 1035-1052 (2015).
- Karakikes, I., Ameen, M., Termglinchan, V., Wu, J. C. Human induced pluripotent stem cell-derived cardiomyocytes: insights into molecular, cellular, and functional phenotypes. Circ Res. 117 (1), 80-88 (2015).
- Avior, Y., Sagi, I., Benvenisty, N. Pluripotent stem cells in disease modelling and drug discovery. Nat Rev Mol Cell Biol. 17 (3), 170-182 (2016).
- Otsuji, T. G., Minami, I., Kurose, Y., Yamauchi, K., Tada, M., Nakatsuji, N. Progressive maturation in contracting cardiomyocytes derived from human embryonic stem cells: Qualitative effects on electrophysiological responses to drugs. Stem Cell Res. 4 (3), 201-213 (2010).
- Mihic, A., et al. The effect of cyclic stretch on maturation and 3D tissue formation of human embryonic stem cell-derived cardiomyocytes. Biomaterials. 35 (9), 2798-2808 (2014).
- Lieu, D. K., et al. Mechanism-based facilitated maturation of human pluripotent stem cell-derived cardiomyocytes. Circ Arrhythm Electrophysiol. 6 (1), 191-201 (2013).
- Yang, X., et al. Tri-iodo-l-thyronine promotes the maturation of human cardiomyocytes-derived from induced pluripotent stem cells. J Mol Cell Cardiol. 72, 296-304 (2014).
- Mannhardt, I., et al. Human Engineered Heart Tissue: Analysis of Contractile Force. Stem Cell Reports. , (2016).
- Kim, C., et al. Non-cardiomyocytes influence the electrophysiological maturation of human embryonic stem cell-derived cardiomyocytes during differentiation. Stem Cells Dev. 19 (6), 783-795 (2010).
- Nunes, S. S., et al. Biowire: a platform for maturation of human pluripotent stem cell-derived cardiomyocytes. Nat Methods. 10 (8), 781-787 (2013).
- Clements, M. Multielectrode Array (MEA) Assay for Profiling Electrophysiological Drug Effects in Human Stem Cell-Derived Cardiomyocytes. Curr Protoc Toxicol. 68 (22), 1-22 (2016).
- Harris, K. A Human Induced Pluripotent Stem Cell-Derived Cardiomyocyte (hiPSC-CM) Multielectrode Array Assay for Preclinical Cardiac Electrophysiology Safety Screening. Curr Protoc Pharmacol. 71, 1-15 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены