Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Живые клетки изображений сегрегации хромосом в процессе митоза
В этой статье
Резюме
Этот протокол описывает метод простой и удобный ярлык и визуализировать Живые хромосомы митотическая клеток Histone2B-GFP BacMam 2.0 label и система конфокальной микроскопии диск спиннинг.
Аннотация
Хромосомы должны быть надежно и равномерно делятся на клетки дочи процессе митотического деления клетки. Верность хромосомных сегрегации управляется несколько механизмов, которые включают шпиндель контрольно-пропускного пункта Ассамблея (SAC). SAC является частью сложной обратной связи системы, которая отвечает за предотвращение клетки прогресса путем митоза если все хромосомных kinetochores придают шпинделя микротрубочек. Хромосомная отстающих и аномальные хромосомы сегрегация является показателем неблагополучных клеточного цикла управления контрольно-пропускных пунктов и может использоваться для измерения геномная стабильность делящихся клеток. Дерегулирование мешка может привести к трансформации нормальной клетки в злокачественных клеток путем накопления ошибок при хромосомных сегрегации. Осуществление SAC и формирование комплекса Кинетохор жестко регулируются взаимодействия между киназы и фосфатазы например фосфатазы Протеин 2A (PP2A). Этот протокол описывает изображений живой клетки отстает хромосом в мыши эмбриональных фибробластов, изолированные от мышей, которые были нокаут Субблок регулирования PP2A-B56γ. Этот метод преодолевает недостатки других клеточного цикла управления методы визуализации как проточной цитометрии или immunocytochemistry только обеспечивают моментальный снимок статуса цитокинез клетки, вместо динамического пространственно-временных визуализации хромосом в процессе митоза.
Введение
В следующий протокол мы описываем удобный метод для визуализации хромосомных сегрегации и митотического прогрессии во время клеточного цикла в эмбриональных фибробластов мыши с помощью гистона 2B-GFP, BacMam 2.0 маркировки и живых клеток.
Клеточный цикл контрольно-пропускных пунктах контролировать хромосома сегрегации и играют важную роль в поддержании генетических целостность клеток в 1,2,3. Накопление неправильного сегрегированных хромосом может привести к анеуплоидии, который является отличительной чертой наиболее твердые туморы 4. Следовательно выявления отстающих хромосом может использоваться как метод для изучения хромосомной нестабильности.
Дневно помечены белки могут быть использованы для визуализации Живые хромосомы сегрегации и хромосомных отставание но поколение mCherry тегами или H2B-GFP с тегами белка требует существенных знаний для доставки и молекулярной биологии гена 5. Здесь мы описываем использование реагента CellLight Histone2B-GFP BacMam 2.0, называемой CL-HB регент, ради простоты. Этот реактив может быть использован сразу и таким образом, устраняет беспокойство вектор качества и целостности. Кроме того этот реагент не требует использования потенциально вредных лечения или липидов и химических красителей загрузки. В отличие от обычных флуоресцентные метки, регент CL-HB пятна независимо от функции (т.е., мембранного потенциала). CL-HB регент могут быть просто добавлены к клеткам и инкубированы всю ночь для выражения протеина. CL-HB регент не реплицировать в клетках млекопитающих и может использоваться в параметры 1 лаборатории биобезопасности уровня (BSL). Кроме того этот временной transfection может быть обнаружен после ночи инкубации до 5 дней, достаточно времени для выполнения самых динамичных клеточного анализа.
В качестве альтернативы хромосомные аномалии может быть изучен различные методы, такие как проточной цитометрии, иммуногистохимия или флуоресценции в situ гибридизация (рыба) 6. Проточной цитометрии могут быть использованы для изучения анеуплоидии, которая может быть измерена на основе содержания ДНК и этапа клеток в клеточный цикл. Хотя проточной цитометрии может быть использован для измерения анеуплоидии, он не представить информацию о хромосомных неправильного сегрегации. Рыба и иммуногистохимии методы использования флуоресцентных зондов связываться с ДНК или хромосомы. Хотя эти методы обеспечивают моментальный снимок состояния популяции клеток, они не позволяют живой клетки, изображений, тем самым отсутствие любой информации, полученной через пространственно-временных визуализации цитокинез в определенные ячейки в течение определенного периода времени.
Этот протокол был использован для изучения хромосом отстает или хромосомных неправильного сегрегации в Нокодазол лечение мыши эмбриональных фибробластов (MEFs) изолированы от PP2A-B56γ-мышей. В дополнение к выше приложения этот протокол обеспечивает простой инструмент для этикетки и визуализировать хромосомных сегрегации в различных типах клеток, которые могут быть использованы для изучения регуляции клеточного цикла или хромосомной нестабильности в опухолевых клетках. Кроме того он также может использоваться для изучения хромосомной нестабильности, вызванной различных лекарств или для изучения последствий Нокаут гена результате хромосомной неправильного сегрегации.
протокол
Все эксперименты, проведенные в этих исследованиях были выполнены в соответствии с протоколами, утвержденных институциональный уход животных и использования Комитетом на объекте исследований продовольственной и лекарствами (FDA).
1. изоляция и культура мыши эмбриональных фибробластов (MEFs)
- Изолируйте мыши эмбриональных фибробластов (MEFs) от PP2A-B56γ-мышь штамм и дикого типа однопометники, стандартный протокол 7,8,9.
- ExpandMEFs для 3 проходов, заморозить и хранить до тех пор, пока необходимые для экспериментов 8.
2. культивирования Mefs в 2-ну камерных покровным стеклом для жить изображений
- Подготовка 500 мл MEF питательных сред, содержащих среднего изменения Eagle Дульбекко (DMEM/F12) с 10% плода Bovine сыворотки (ФБС), 1 X пенициллина/стрептомицина антибиотики, L-глютамин (200 мм) и 1 X несущественные аминокислот (NEAA) в СМИ 500 мл бутылки.
- Оттепель флаконов замороженных MEFs от дикого типа и PP2A-B56γ-мышей при прохождении 3 подогретым водяной бане при температуре 37 ° C.
- Переноса размороженных MEFs для 15 мл пробирок и медленно добавить прикапывают 20 мл в среде DMEM/F12 СМИ для 15 мл пробирок, с помощью пипетки 10-мл.
- Передача MEFs наряду с 20 мл в среде DMEM/F12 роста средств массовой информации в T75 колбы и расширить их до тех пор, пока клетки являются 70% притока. Confluency оценивается с использованием инвертированный микроскоп на увеличение 10 x или 4 x.
- Аспирационная среднего роста, с использованием стекла пастбище Пипетка прилагается к вакуумной системы в капюшоне, добавить 3 мл 0,25% трипсина/ЭДТА и инкубировать при 37 ° C за 5 минут добавить 3 мл среднего роста DMEM/F12 для остановки реакции.
- Центрифуга клетки на низкой скорости (300 x g) за 5 мин при комнатной температуре. Тщательно удалить супернатант и вновь приостановить Пелле клеток в 1 мл DMEM/F12 роста средних предварительно нагревают при 37 ° C на водяной бане.
- Перечисления с помощью метода Трипановый синий исключения или другие соответствующие ячейки, подсчитывая метод 8клеток.
- Семя приблизительно 20 000 MEFs/хорошо в 2-ну камерных покровным стеклом. Добавить 200 мкл/хорошо среднего роста в среде DMEM/F12 и позволяют клеткам прикрепить по инкубации их на ночь на 37 ° C и 5% CO2.
3. Синхронизация
- Синхронизировать MEFs в G0/G1 фазе, инкубации клеток в среде DMEM/F12 питательных сред, содержащих 0,1% FBS за 24 часа, чтобы получить максимальное количество ячеек в G0/G1 фазе.
Примечание: Хотя сыворотки голод был использован как метод предпочтения, различные другие методы могут использоваться в зависимости от митотическая стадии, на которой клетки необходимы для арестованных 10.
4. Маркировка
- Приготовьте 1,5 мг/мл Стоковый раствор Нокодазол в ДМСО. Нокодазол аресты клетки на G2/М этапе путем ингибирования микротрубочек формирования 10.
- Трех дней после синхронизации, добавить 200 мкл среднего роста (с 10% FCS), 200 нг/мл Нокодазол и CL-HB Регент (гистона 2B-GFP BacMam 2.0).
- Вычислите CL-HB регент частиц за клеток (КПП) для добавления ячеек следующим образом:
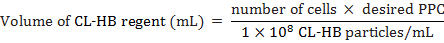
Предполагаемое общее количество клеток, где количество клеток во время маркировки, КПП — число частиц в ячейки, и 1 × 108 — количество частиц на мл реагента. Например чтобы метка 20 000 ячеек с КПП 30
Примечание: CL-HB регент хорошо работает с большинства типов клеток между 10 и 50 КПП. Однако 30 КПП работали лучше для этого исследования. - Инкубируйте MEFs 18 ч при 37 ° C и 5% CO2.
Примечание: Для текущего эксперимента, Визуализация хромосом в клетках митотическая побега контрольно-пропускном пункте Ассамблея шпинделя произошла 18 h после ареста клеточного цикла с Нокодазол.
5. Визуализация отставание хромосом
- Визуализируйте мыши эмбриональных фибробластов (MEFs) с использованием системы Конфокальный микроскоп диск спиннинг с экологической палаты и масло погружения, 63 x объектив.
- Использование возбуждения волны 488 нм и выбросов волны 450 Нм для захвата изображений канал GFP.
- Использовать систему Конфокальный микроскоп вращающийся диск с возможностью сканирования моторизованных этапов, Z-пьезо вставки, этап Топ инкубации и восстановления прямых флуоресценции после фото отбеливания для этой техники.
- Один день до изображений, включите питания экологической палаты и согреться всю камеру при 37 ° C на ночь.
- Включите питания для Микроскоп стенд, камеры, вращающийся диск группы, осветитель, Аргонового лазера, компьютера и моторизованного столика.
- Пусть система прогреться в течение 3 мин; Запустите Аргонового лазера, повернув ключ зажигания. Переключите тумблер для Аргонового лазера от «ожидания» до «лазерные запуск».
- Запуск программного обеспечения сбора и обработки данных.
- Инициировать CO2 контроллер для стадии Топ инкубатора и установить концентрации CO2 на 5%. Это должно быть сделано до начала обработки изображений.
- Удалите патрон покровным стеклом из инкубатора и место на сцене для визуализации. Визуализируйте клетки через масло погружения 63 x объектива (NA1.4).
- Просмотр через глазной линзы, резкость изображения и определить ячейки в стадии ядерная оболочка разбивка (NEBD).
- Инициируйте соответствующие лазер (488 нм Аргонового лазера для визуализации Histone2B-ГФП).
- Откройте окно управления приобретения и задайте время экспозиции для канала GFP. Определите ячейки, которая находится в NEBD.
- Определить целевую ячейку верхней и нижней фокальной плоскости и вручную введите xyz оптических секционирование параметры.
- Наблюдать за 20 мин; Если ячейка не проходит через деление клеток, остановить получение изображения после 20 мин и перейти к следующей ячейке, которая находится в NEBD.
- Примерно 1 час на ячейку необходимо изображение отставание хромосом в процессе митоза в PP2A-B56γ-клеток, которые бежали из мешка. Для получения данных для фильма, делать снимки каждые 3 мин.
Примечание: дикого типа клетки арест и не прогресс прошлое NEBD при лечении с Нокодазол. - Сохранение изображений в формате файла Цви для дальнейшего анализа.
6. обработка и анализ изображений
Примечание: Выполнение обработки трехмерных изображений и анализа с помощью любого программного обеспечения как Axiovision версия 4.8.2 или Imaris версии 8.2. Для этого исследования ImageJ программное обеспечение было использовано.
- Открытие последовательности изображений. Если изображения находятся уже в формате стек, переходите к следующему шагу. Если нет, объединить все соответствующие изображения в стек с помощью ' изображение > стеки > изображения стек ' в строке меню.
- Выполняйте любые коррективы по мере необходимости Яркость/контраст и уровней.
- Чтобы добавить отметку времени фильм:
- Перейти к ' изображение > стеки > Этикетка...' в строке меню.
- Выберите подходящий формат, начальное значение времени и интервал времени между каждого изображения.
- Установите флажок «Просмотр» и настроить расположение и формат. Нажмите «OK» чтобы применить штамп времени.
- Для добавления линейки шкалы к фильму:
- Задать масштабирование под ' анализ > Задать шкалу ' в строке меню.
- В поле «Расстояние в пикселах» введите число пикселей, где расстояние, как известно и в поле «Известный расстояние» введите расстояние. Установите правильную единицу длины для расстояния, например, в мкм. Нажмите «OK», чтобы применять шкалу в стек.
- Перейти к ' анализ > Инструменты > шкала бара... ' добавить линейку шкалы. Установите размер панели как «Ширина в мкм» и настроить остальные параметры при необходимости форматирования. Установите флажок «Пометить все срезы» добавить линейку шкалы на весь стек.
- Предварительный просмотр фильма, нажав на кнопку треугольной играть на нижней левой границы окна изображения. Отрегулируйте скорость кадров с помощью ' изображение > стеки > Анимация > Параметры анимации в строке меню.
- Экспортируйте файл фильма, выбрав «Файл > Сохранить как > AVI...' и выберите частота кадров и сжатие.
- Нажмите «OK», чтобы выбрать сохранить расположение и имя файла. Нажмите кнопку «Сохранить» для сохранения файла фильма.
Результаты
MEFs от дикого типа и PP2A-B56γ-мышей были посеяны в стакане крышки камеры 2-Ну и разрешено присоединить. На 2 день, MEFs были синхронизированы с помощью 0,1% FBS за 24 ч. День 3, MEFs в СМИ с 200 нг/мл Нокодазол и 30 КПП CL-HB regentwere инкубированы для 18 h 37° C и 5% CO2. День 4 клетки были обр?...
Обсуждение
Клеточный цикл управления контрольно-пропускные пункты, которые обеспечивают точные хромосома сегрегации предотвратить анеуплоидии и ячейки преобразования 1,2,3. В настоящем исследовании, мы обнаружили, что инактивирование PP2A-B56γ прив...
Раскрытие информации
Авторы заявляют, что они не имеют никаких финансовых интересов.
Благодарности
Мы хотели бы поблагодарить доктора Хунг го-Chiuan и д-р Bharatkumar Джоши за ценные замечания, которые улучшили рукопись.
Материалы
| Name | Company | Catalog Number | Comments |
| DMEM/F12 | Gibco | 11320082 | |
| L-Glutamine | Gibco | 25030081 | |
| MEM Non-Essential amino acids solution (100X) | Gibco | 11140050 | |
| Penicillin-Streptomycin (10,000 U/mL) | Gibco | 15140122 | |
| Dulbecco’s Phosphate Buffered saline | Gibco | 14190144 | |
| Trypsin-EDTA | Gibco | 25300054 | |
| Fetal bovine serum | Atlanta Biologicals | S11150 | |
| DMSO | EMD Millipore | MX 1458-6 | |
| Cryogenic vial storage boxes | Fisherbrand | 10-500-28 | |
| Cryogenic vials | Corning/costar | 431416 | |
| T75 flasks | Cellstar | 658175 | |
| 2 well chambered cover glass | Nunc | 155380PK | |
| Cellometer Vision Cell Profiler | Nexcelom Bioscience LLC | Cellometer Vision Trio | |
| Nocodazole | Sigma | M1404 | |
| CellLight Histone 2B-GFP, BacMam 2.0 | Thermo Fisher Scientific Inc. | C10594 | |
| Zeiss Cell Observer Spinning Disk Confocal Microscope system | Carl Zeiss Microscopy | Zeiss Cell Observer SD | |
| Water Bath | Thermoscientific | 280 series | |
| Incubator | Sanyo commercial solutions | MCO-18AIC (UV) | |
| Class II Biological safety cabinet | The Baker Company | SterilGard | |
| Axiovision software | Zeiss | Ver.4.8.2 | |
| ImageJ software | National Institute of Health | Ver. 1.51r |
Ссылки
- Funk, L. C., Zasadil, L. M., Weaver, B. A. Living in CIN: Mitotic Infidelity and Its Consequences for Tumor Promotion and Suppression. Dev Cell. 39, 638-652 (2016).
- Etemad, B., Kops, G. J. Attachment issues: kinetochore transformations and spindle checkpoint silencing. Curr Opin Cell Biol. 39, 101-108 (2016).
- Lara-Gonzalez, P., Westhorpe, F. G., Taylor, S. S. The spindle assembly checkpoint. Curr Biol. 22, 966-980 (2012).
- Jallepalli, P. V., Lengauer, C. Chromosome segregation and cancer: cutting through the mystery. Nat Rev Cancer. (2), 109-117 (2001).
- Zhu, L., et al. Mitotic protein CSPP1 interacts with CENP-H protein to coordinate accurate chromosome oscillation in mitosis. J Biol Chem. 290 (45), 27053-27066 (2015).
- Pikor, L., Thu, K., Vucic, E., Lam, W. The detection and implication of genome instability in cancer. Cancer Metastasis Rev. 32 (3-4), 341-352 (2013).
- Varadkar, P., Despres, D., Kraman, M., Lozier, J., Phadke, A., Nagaraju, K., McCright, B. The protein phosphatase 2A B56γ regulatory subunit is required for heart development. Dev Dyn. 243 (6), 778-790 (2014).
- Jozefczuk, J., Drews, K., Adjaye, J. Preparation of Mouse Embryonic Fibroblast Cells Suitable for Culturing Human Embryonic and Induced Pluripotent Stem Cells. J. Vis. Exp. (64), e3854 (2012).
- Varadkar, P., Abbasi, F., Takeda, K., Dyson, J. J., McCright, B. PP2A-B56γ is required for an efficient spindle assembly checkpoint. Cell Cycle. 18 (12), 1210-1219 (2017).
- Rosner, M., Schipany, K., Hengstschläger, M. Merging high-quality biochemical fractionation with a refined flow cytometry approach to monitor nucleocytoplasmic protein expression throughout the unperturbed mammalian cell cycle. Nat Protoc. 8 (3), 602-626 (2013).
- Jonkman, J., Brown, C. M. Any Way You Slice It-A Comparison of Confocal Microscopy Techniques. J Biomol Tech. 26 (2), 54-65 (2015).
- Versaevel, M., Braquenier, J. B., Riaz, M., Grevesse, T., Lantoine, J., Gabriele, S. Super-resolution microscopy reveals LINC complex recruitment at nuclear indentation sites. Sci Rep. 8 (4), 7362 (2014).
- Wild, T., Larsen, M. S., Narita, T., Schou, J., Nilsson, J., Choudhary, C. The Spindle Assembly Checkpoint Is Not Essential for Viability of Human Cells with Genetically Lowered APC/C Activity. Cell Rep. 1 (8), 1829-1840 (2016).
- Iuso, D., et al. Exogenous Expression of Human Protamine 1 (hPrm1) Remodels Fibroblast Nuclei into Spermatid-like Structures. Cell Rep. 1 (9), 1765-1771 (2015).
- Ratcliffe, E., Glen, K. E., Naing, M. W., Williams, D. J. Current status and perspectives on stem cell-based therapies undergoing clinical trials for regenerative medicine: case studies. Br Med Bull. 108, 73-94 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены