Method Article
Анализ аналогов иофеноковой кислоты в малых индийских mongoose (Herpestes Auropunctatus) Сера для использования в качестве устного бешенства Вакцинация Биологического маркера
In This Article
Summary
Мы предложили плен мангусты плацебо пероральной вакцины против бешенства вакцины с этил или метиловой иофеноковой кислоты в качестве биомаркера и проверенные поглощения приманки с помощью новой жидкой хроматографии с тандемной масс-спектрометрии (LC-MS /MS) метод.
Abstract
Небольшой индийский мангуст(Herpestes auropunctatus) является резервуаром вируса бешенства (RABV) в Пуэрто-Рико и составляет более 70% случаев бешенства животных, зарегистрированных ежегодно. Контроль циркуляции RABV в резервуарах дикой природы, как правило, осуществляется стратегией вакцинации против оральных бешенств (ORV). В настоящее время в Пуэрто-Рико не существует программы дикой природы ORV. Исследования пероральных вакцин против бешенства и различных типов приманки для мангустов были проведены с многообещающими результатами. Мониторинг успеха ORV опирается на оценку поглощения приманки целевыми видами, которая обычно включает в себя оценку изменения в RABV нейтрализующих антител (RVNA) после вакцинации. Эту стратегию может быть трудно интерпретировать в районах с активной программой ORV дикой природы или в районах, где RABV является энзоотическим и фоновые уровни РВНА присутствуют в водохранилищах видов. В таких ситуациях может быть полезным биомаркер, включенный в вакцину или матрицу приманки. Мы предложили 16 плен мангусты плацебо ORV приманки, содержащие этил-иофеноксовую кислоту (et-IPA) в концентрациях 0,4% и 1% внутри приманки и 0,14% во внешней матрице приманки. Мы также предложили 12 пленных мангуст ORV приманки, содержащие метил-iophenoxic кислоты (ме-IPA) в концентрациях 0,035%, 0,07% и 0,14% во внешней матрице приманки. Мы собрали образец сыворотки до приманки предлагая, а затем еженедельно на срок до восьми недель после предложения. Мы извлекли иофенковедные кислоты из сыкты в ацетонитрил и количественно с помощью жидкой хроматографии / масс-спектрометрии. Мы проанализировали серу для et-IPA или me-IPA с помощью жидкой хроматографии-масс-спектрометрии. Мы нашли адекватную способность маркировки, по крайней мере восемь и четыре недели для и так овечий и i-IPA, соответственно. Оба производных IPA могут быть пригодны для оценки ORV приманки поглощения в мангустах. Из-за долговечности маркера в мангуста сера, следует проявлять осторожность, чтобы не смущовать результаты с помощью той же производной IPA во время последовательных оценок.
Introduction
Вирус бешенства (RABV) является отрицательным чувством одного мель лиссавирус, и циркулирует среди различных видов диких животных водохранилища в рамках заказов Carnivora и Chiroptera. Несколько видов мангуста являются резервуарами RABV, и небольшой индийский мангуст (Herpestes auropunctatus) является единственным резервуаром в Пуэрто-Рико и других Карибских островов в Западном полушарии1,2,3 . Контроль циркуляции RABV в резервуарах дикой природы, как правило, осуществляется в рамках стратегии вакцинации против оральных бешенства (ORV). В Соединенных Штатах (США), эта деятельность по управлению координируется USDA / APHIS / Дикой службы Национальной программы по борьбе с бешенством (NRMP)4. В настоящее время в Пуэрто-Рико не существует программы дикой природы ORV. Исследования в вакцинах против бешенства и различных типов приманки для мангустов было проведенос многообещающими результатами предлагая ORV программа для мангустов возможно 5,6,7,8.
Мониторинг воздействия ORV опирается на оценку поглощения приманки целевыми видами, которая обычно включает в себя оценку изменения серораспространенности противотел R. Тем не менее, эта стратегия может быть сложной задачей в районах с активной дикой природы ORV программ или в районах, где Р. является энзоотическим и фоновые уровни RABV нейтрализующих антител (RVNA) присутствуют в водохранилище видов. В таких ситуациях может быть полезным биомаркер, включенный в приманку или внешнюю матрицу приманки.
Различные биологические маркеры были использованы для мониторинга поглощения приманки в многочисленных видов, в том числе енотов (Procyon лотор)9,10, stoats (Mustela горностай)11,12, Европейские барсуки ( Мелес Мелес) 13, дикие кабаны (Sus scrofa)14, небольшие индийские мангусты15 и прерии собак (Cynomysludovicianus)16,17, среди других. В США, операционные приманки ORV часто включают 1% тетрациклина биомаркер в матрице приманки для мониторинга поглощения приманки18,19. Тем не менее, недостатки использования тетрациклина включают растущую озабоченность по поводу распределения антибиотиков в окружающую среду и что обнаружение тетрациклина, как правило, инвазивные, требующие удаления зубов или уничтожения животного для получения кости образцы20. Родамин B был оценен в качестве маркера в различных тканях и может быть обнаружен с помощью ультрафиолетового (УФ) света и флуоресценции в волосах и усы10,21.
Иофеноковая кислота (IPA) является белый, кристаллический порошок, который был использован для оценки потребления приманки в койотов (Canis latrans)22, арктическая лиса (Vulpes lagopus)23, красная лиса (Vulpes vulpes)24, еноты 9 До 9 , 25, дикий кабан14, красный олень (Cervus elaphus scoticus)26, Европейские барсуки12 и хорьки (M. furo)27, среди нескольких других видов млекопитающих. Время удержания IPA варьируется в зависимости от вида от менее чем двух недель в некоторых сумчатых28,29, по крайней мере 26 недель в книжающих26 и более 52 недель в домашних собак (Canis lupus familiaris)30. Время удержания также может быть зависимым от дозы31. Иофеноковая кислота сильно связывается с альбумином в сыворотке крови и исторически была обнаружена путем измерения уровня йода в крови32. Этот косвенный подход был вытеснен высокопроизводительными методами жидкой хроматографии (HPLC) для непосредственного измерения концентраций иофеноковой кислоты с УФ-детектором33,и в конечном итоге с жидкой хроматографией и масс-спектрометрией (LCMS) 34,35. Для этого исследования была разработана высокочувствительная и селективная жидкая хроматография с тандемной масс-спектрометрией (LC-MS/MS), которая использует многократный мониторинг реакции (MRM) для количественной оценки двух аналогов иофеноксиновой кислоты. Наша цель состояла в том, чтобы использовать этот метод LC-MS/MS для оценки способности маркировки 2-(3-гидрокси-2,4,6-триоодобензил) пропаниной кислоты (метил-IPA или me-IPA) и 2-(3-гидрокси-2,4,6-triiodobenzyl) бутаноиновой кислоты (ethyl-IPA или et-IPA) при доставке в приманка для пленных мангустов.
Мангусты были живы ею, захваченными в ловушках в клетках, заманиваемых коммерчески доступными копчеными сосисками и рыбьим жиром. Мангусты размещались в отдельных клетках из 60 см х 60 см х 40 см из нержавеющей стали и кормили ежедневным рационом в размере 50 г коммерческого сухого кошачьего корма, дополняемого два раза в неделю коммерчески доступным куриным бедренным... Вода была доступна объявление libitum. Мы поставили два производных IPA, этил-IPA и метил-IPA, в плен мангусты в плацебо ORV приманки. Все приманки состояли из 28 мм х 20 мм х 9 мм фольги волдырь пакет с внешним покрытием (в дальнейшем "приманка матрицы"), содержащий порошкообразное куриное яйцо и желатин (Таблица материалов). Приманки содержали 0,7 мл воды или производной IPA и весили около 3 г, из которых 2 г были внешней матрицей приманки.
Мы предложили 16 пленных мангустов и МПА в трех концентрациях: 0,14% (2,8 мг и МПА в матрице приманки 2 г; 3 самца, 3 самки, 0,4% (2,8 мг и МГ АПИ в объеме упаковки 0,7 мл волдыря; 3 м, 3f) и 1,0% (7,0 мг этил-IPA в 0,7 мл блистерного пакета; 2 м , 2f). Общая доза 2,8 мг соответствует дозе 5 мг/кг27,36 и основана на среднем весе мангуста 560 г в Пуэрто-Рико. Мы выбрали 1% в качестве самой высокой концентрации, как исследования показывают, отвращение вкуса кнекоторым биомаркеров может произойти в концентрациях Мы только предложили 1% дозы в волдырь пакет, как флоккуляция предотвратить растворение от растворения в растворителе достаточно, чтобы быть равномерно включены в матрицу приманки. Одна контрольная группа (2м, 1f) получила приманки, наполненные стерильной водой и без АПИ. Мы предлагали приманки мангустам утром (8 утра) во время или до кормления их ежедневного рациона обслуживания. Остатки приманки были удалены примерно через 24 часа. Мы собрали образцы крови до лечения, один день после лечения, а затем еженедельно до 8 недель после лечения. Мы обезопасили мангусты путем вдыхания изофлурана газа и собрали до 1,0 мл цельной крови путем венипанктуры черепной полы вены, как описано для хорьков38. Мы центрифугированные образцы цельной крови, перенесли серту в криовиалы и хранили их при -80 градусах Цельсия до анализа. Не все животные были отобраны в течение всех периодов времени, чтобы свести к минимуму воздействие повторных черпает крови на здоровье животных. Контроль животных были отобраны на день 0, а затем еженедельно в течение 8 недель после лечения.
Мы доставили мне-IPA в трех концентрациях: 0,035% (0,7 мг), 0,07% (1,4 мг) и 0,14% (2,8 мг), все включены в матрицу приманки, с 2 мужчин и 2 женщин на группу лечения. Два самца и две самки получили приманки, наполненные стерильной водой, и не АПИ. Приманка предлагая раз и мангуста анестезии описаны выше. Мы собрали образцы крови до начала лечения на 1-й день, а затем еженедельно до 4 недель после лечения.
Мы проверили данные о концентрации сыворотки на нормальность и предполагаемые средства для концентрации iPA в сыворотке сыворотки различных групп лечения. Мы использовали линейную смешанную модель для сравнения средних концентраций сыворотки и IPA, объединенных между отдельными лицами. Тип приманки (матрица/волдырь пакет) был фиксированный эффект в дополнение к экспериментальной день, в то время как животное ID был случайный эффект. Все процедуры были запущены с использованием общего статистического программного обеспечения(Таблицаматериалов), и значение было оценено на уровне 0,05 евро.
Access restricted. Please log in or start a trial to view this content.
Protocol
Все процедуры были одобрены институциональным Комитетом по уходу и использованию животных Национального исследовательского центра дикой природы Министерства сельского хозяйства США в соответствии с утвержденным протоколом исследований «A-2597».
ПРИМЕЧАНИЕ: Следующий протокол описывает процедуру анализа для обнаружения метил-иофеноксиевой кислоты в сыворотке мангуста. Этот метод является окончательной версией итеративного процесса, который начался с анализа этил-иофеноковой кислоты в сыворотке мангуста. В ходе первоначальной оценки этил-иофеноковой кислоты были внесены незначительные изменения в методы, в результате чего окончательный протокол представлен ниже. Представитель результаты включают те, полученные во время обеих итераций.
1. Подготовка решений и стандартов
- Купить me-IPA и et-IPA.
- Для мобильной фазы А подготовьте 1 л из 0,1% (v/v) форм-кислоты в воде, объединив 1 мл формической кислоты с 1 л ультрачистой воды (18 МЗ). Для мобильной фазы B, подготовить 1 л 0,1% (v/v) формическая кислота в ацетонитриле (ACN) путем объединения 1 мл formic кислоты с 1 L ACN.
- Для разбавителя, подготовить 200 мл 0,5% (v/v) трифтороацетической кислоты (TFA) в ACN путем объединения 1 мл TFA с 200 мл ACN.
- Подготовьте концентрированные пассовные растворы IPA me-IPA и IPA в ACN в концентрациях около 1000 мкг/мл.
- Взвешивание примерно 10 мг меня-IPA на микробаланс е и записывать массу до 0,0001 мг. Количественно передать me-IPA в 10 мл класса А объемная колба с использованием 45 мл ACN. Sonicate 1 мин, чтобы растворить все твердые вещества, а затем довести до объема с ACN.
- Передача 8 мл каждого бульона в стеклянные флаконы янтаря 8 мл с поли-тетрафторэтиленом (PTFE) подкладками колпачков. Хранить при комнатной температуре (RT). Передача оставшегося запаса в опасные отходы.
- Для 25x-7 me-IPA акции (Таблица 1), подготовить запас me-IPA в ACN примерно на 200 мкг /мл. Пример: Передача 1 мл концентрированного запаса me-IPA от шага 1.4.2 до 5 мл класса А объемной колбы с использованием стеклянного шприца объемом 1000 л. Разбавить до объема с ACN. Перенесите бульон на стеклянный флакон янтаря 8 мл с крышкой, облицованной PTFE. Хранить в RT.
- Подготовьте шесть дополнительных 25x me-IPA Акции описаны в таблице 1. Для каждого запаса, объединить объемы, указанные с помощью повторного пипетка в янтаре 8 мл янтарного стекла флакон с PTFE подкладкой крышкой. Храните каждый запас на RT.
- Для 25x суррогатного фонда, подготовить суррогатный запас me-IPA в ACN примерно на 10 мкг /мл из концентрированного запаса подготовлены в шаге 1.4.2. Передача 0,100 мл концентрированного запаса me-IPA в объемную колбу класса А 100 мл с использованием стеклянного шприца объемом 100 л, а затем разбавить объемом с помощью ACN.
- Передача 8 мл на янтарный 8-мл стеклянный флакон с PTFE подкладкой крышкой. Хранить на RT. Перенесите оставшийся запас на опасные отходы.
- Подготовка 4x запасов, содержащих оба анализирует в 2 мл винт-топ стеклянные аутоссий, как описано в таблице 2.
- Например, чтобы подготовить запас 4x-7, к флакону 2 мл, добавьте 0,20 мл запаса 25x-7 me-IPA со ступени 1.5 с помощью повторного пипетки с наконечником емкости 0,5 мл. Добавьте 0,20 мл 25-х суррогатного и IPA с ступени 1.7 с помощью повторного пипетатора с наконечником емкости 0,5 мл.
- Добавьте 0,85 мл ACN с помощью повторного пипетки с наконечником емкости 1 мл. Cap флакон надежно и инвертировать 5x для смешивания.
- Подготовьте стандартную кривую в 2 мл винт-топ автосимер флаконы, как описано в таблице 3.
- Например, чтобы подготовить стандартный 7 (Std 7), к флакону объемом 2 мл, добавьте 0,20 мл запаса 4x-7 с ступени 1.8.2 с помощью повторного пипетатора с наконечником емкости 0,5 мл. Добавьте 0,60 мл ультрачистой воды DI с помощью повторного пипетатора с наконечником емкости 1 мл. Cap флакон надежно и инвертировать 5x для смешивания.
2. Подготовка образцов
ВНИМАНИЕ: Персонал, выполняющий эту процедуру, должен был получить полную серию предэкспозиционной профилактики бешенства и иметь документированный титр антител бешенства выше 0,5 МЕ из Федерального медицинского учреждения по охране здоровья. Персонал должен носить лабораторные пальто и защиту глаз в любое время при выполнении извлечения. ВНИМАНИЕ: Выполните шаги 2.3'2.6 в шкафе биобезопасности класса II.
- Для каждого образца подготовьте микроцентрифугную трубку размером 1,5 мл, содержащую 200–300 мг NaCl.Arrange трубки в пластиковой стойке на 80 позиций. Отложите для использования в шаге 2.6.
ПРИМЕЧАНИЕ: микро совок (или другое небольшое измерительное устройство) рекомендуется для большого количества образцов. - Для каждого образца пометьте две микроцентрифуги мощностью 1,5 мл: одну как "А", а другую - "B". Расположите трубки в 80-позиционной пластиковой стойке.
- Поместите следующие материалы и оборудование, необходимые для извлечения сыворотки в шкаф у биобезопасности класса II: микроцентрифугные трубки (в стеллажах), подготовленные в шагах 2.1 и 2.2, вихревой смеситель, повторный пипеттор с 0,5 мл и 5 мл наконечников емкости, 100-1000 л водоизмещения пипетка с 1000 наконечниками, контейнеры примерно 100 мл каждая из разбавительной и ультрачистой воды DI, а также контейнер для биоопасных отходов.
- Удалите образцы сыворотки из замороженного хранения и подогрейте до RT в шкафу для биобезопасности. Vortex смешивают каждый образец сыворотки перед отбором проб.
- Используя повторный пипетктор с наконечником емкости 0,5 мл, разделите 0,050 мл сыворотки мангуста в трубку "А" и добавьте 0,050 мл 25-х суррогатного запаса. Затем добавьте 0,950 мл разбавителя в трубку "А" с помощью повторного пипетки с наконечником емкости 5 мл. Крышка надежно и вихревой смеси для 10'15 s.
- Распределите предварительно взвешенный NaCl со ступени 2.1 в трубку "A" и вихревую смесь 3x для 8'12 с. Протрите внешние поверхности флакона, содержащего трубку "А", используя 70% (v/v) изопропанол.
ПРИМЕЧАНИЕ: Стойка образцов теперь может быть удалена из шкафа биобезопасности класса II. - Центрифуга трубки "А" на 12000 х г в течение 1 мин, чтобы отделить вацовых и ACN фаз. Пипетка 0,80 мл верхней фазы ACN к трубке "B" с помощью пипетки водоизмещением воздуха объемом 100-1000 л. Перенесите оставшийся раствор в трубку "А" в опасные отходы и выбросите пустую трубку в контейнер для биоопасных отходов.
- Удалите ACN и TFA из трубки "B" с нежным потоком газа N2 в водяной бане 45 градусов по Цельсию.
- Добавьте 0,250 мл ACN в трубку "B" с помощью повторного пипетки, вихревой смеси для 4'5 s, а затем центрифуги кратко (2'4 s) на 12000 х г, чтобы собрать жидкость в нижней части трубки.
- Добавьте 0,750 мл ультрачистой воды DI в трубку "B", используя повторный пипетктор с наконечником емкости 5 мл, вихревой смесью на 4х5 с, а затем центрифугу в течение 1 мин при 12 000 х г, чтобы прояснить образец.
- Передача 0,75 мл супернатанта на флакон автосэмпера с помощью пипетки для водоизмещения воздуха в 1000 л. Отбросьте пипетки советы в контейнере биоопасных отходов.
- Cap autosampler флаконы надежно и анализировать по LC-MS/MS (раздел 4). Перенесите оставшийся раствор в трубку "В" на опасные отходы и выбросите пустую трубку в контейнер для биоопасных отходов. Утилизировать все биоопасные отходы путем автоматического сжигания или сжигания.
3. Образцы контроля качества
ВНИМАНИЕ: Следуйте предостережениям, описанным в разделе 2.
ПРИМЕЧАНИЕ: Следующая процедура описывает минимальное количество образцов контроля качества (КК), необходимых для анализа. Реплики на каждом уровне рекомендуется, если достаточно контроля мангуста сыворотки.
- Приготовьте четыре микроцентрифуговых трубки мощностью 1,5 мл, содержащих 200-300 мг NaCl. Расположите трубки в 80-позиционной пластиковой стойке.
- Для каждого образца КК пометьте две микроцентрифуги мощностью 1,5 мл: одну как "А", а другую - "B". Расположите трубки в 80-позиционной пластиковой стойке.
- Повторите шаг 2.3.
- Удалить контроль мурашки мангуста из замороженных хранения и тепло й RT в шкафу биобезопасности. Vortex смешивают контрольную сыворотку перед отбором проб.
- Распределите 0,050 мл контрольной сыворотки мангуста в четыре 1,5-мл "А" трубки с помощью повторного пипетки с наконечником емкости 0,5 мл.
- Убежьте каждый из четырех образцов КК, указанных в таблице 4, используя повторный пипетктор с наконечником емкости 0,5 мл. Cap каждый образец КК надежно и вихревой смеси для 10'15 s.
- Выполните процедуру извлечения, описанную в шагах 2.6–2.12.
4. Анализ LC-MS/MS
- Налажить LC-MS/MS со всеми параметрами, описанными в таблице 5. Питание на LC-MS/MS и позволяет столбцу достичь 70 градусов по Цельсию, прежде чем установить скорость потока до 0,800 мл/мин.
- Настройка последовательности в программном обеспечении для сбора данных(Таблицаматериалов), чтобы ввести стандартную кривую до и после каждой партии, состоящей из образцов контроля качества и неизвестных образцов.
- Впрысните все стандарты и образцы и приобретите хроматограммы MRM иона, используя параметры, перечисленные в таблице5.
- После завершения последовательности выключите LC-MS/MS и утилизируйте все флаконы автосэмпера в качестве опасных отходов.
5. Количественная оценка
- Используйте программное обеспечение для анализа данных для создания кривой калибровки относительных ответов по сравнению с относительными концентрациями для меня-IPA, используя et-IPA в качестве внутреннего стандарта. Рассчитайте относительные ответы от перехода quantifier MRM для me-IPA (556.6 и 428.7), разделенных переходом MRM для et-IPA (570.7 и 442.7). Постройте 7-уровневую кривую калибровки, используя квадратную функцию второго порядка, которая взвешивается 1/x и игнорирует происхождение.
- Рассчитайте концентрацию сыворотки (Cсыворотки)me-IPA с помощью следующего уравнения:
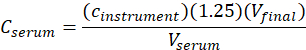
где cинструмент омованием будет концентрация обусловленная аппаратурой от кривой калибровки в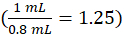 блоках мкг/мл, 1.25 фактор разбавления, Vвыпускной будет окончательным томом образца (1.0 ml), и сывороткой V будет том сыворотки в mL ( 0,050 мл номинальная).
блоках мкг/мл, 1.25 фактор разбавления, Vвыпускной будет окончательным томом образца (1.0 ml), и сывороткой V будет том сыворотки в mL ( 0,050 мл номинальная).
Access restricted. Please log in or start a trial to view this content.
Results
Представитель ионных хроматограмм из анализа me-IPA представлены на рисунке 1. Контроль мурашки мангуста(рисунок 1A) иллюстрирует время удержания et-IPA (суррогатный аналитик) и отсутствие меня-IPA в указанное время удержания. Образец контроля...
Access restricted. Please log in or start a trial to view this content.
Discussion
Метод LC-MS/MS, разработанный для исследований, использовал селективность мониторинга нескольких реакций для точной количественной оценки me-IPA и et-IPA в сыворотке мангуста. Избирательность обнаружения MS/MS также позволила провести простой протокол очистки, опирающийся исключительно на аце?...
Access restricted. Please log in or start a trial to view this content.
Disclosures
Авторы AV и SO являются штатными сотрудниками производителя пероральной вакцины против бешенства.
Acknowledgements
Это исследование было частично поддержано программой интрамуральных исследований Министерства сельского хозяйства США, Службы инспекций здоровья животных и растений, Службы охраны дикой природы, Национальной программы по борьбе с бешенством и IDT Biologika (Дессау-Росслау, Германия).
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
|---|---|---|---|
| Acetonitrile, Optima grade | Fisher | A996 | |
| Analytical balance | Mettler Toledo | XS204 | |
| C18 column, 2.1 x 50 mm, 2.5-µm particle size | Waters Corp. | 186003085 | |
| ESI Source | Agilent | G1958-65138 | |
| Ethyl-iophenoxic acid, 97 % | Sigma Aldrich | N/A | Lot MKBP5399V |
| Formic acid, LC/MS grade | Fisher | A117 | |
| LCMS software | Agilent | MassHunter Data Acquisition and Quantitative Analysis | |
| Methyl-iophenoxic acid, 97 % (w/w) | PR EuroChem Ltd. | N/A | Lot PR0709514717 |
| Microanalytical balance | Mettler Toledo | XP6U | |
| Microcentrifuge | Eppendorf | 5415C | |
| MS/MS | Agilent | G6470A | |
| N-Evap | Organomation | 115 | |
| Oral Rabies Vaccine Baits | IDT Biologika, Dessau Rossleau, Germany | N/A | |
| Propyl-iophenoxic acid, 99 % (w/w) | PR EuroChem Ltd. | N/A | Lot PR100612108RR |
| Repeat pipettor | Eppendorf | M4 | |
| Screw-top autosampler vial caps, PTFE-lined | Agilent | 5190-7024 | |
| Sodium chloride, Certified ACS grade | Fisher | S271 | |
| Statistical Software Package | SAS Institute, Cary, North Carolina, USA | N/A | |
| Trifluoroacetic acid, 99 % | Alfa Aesar | L06374 | |
| UPLC | Agilent | 1290 Series | |
| Vortex Mixer | Glas-Col | 099A PV6 | |
| 0.2-mL pipettor tips | Eppendorf | 30089.413 | |
| 0.5-mL pipettor tips | Eppendorf | 30089.421 | |
| 1.5-mL microcentrifuge tubes | Fisher | 14-666-325 | |
| 1250-µL capacity pipette tips | GeneMate | P-1233-1250 | |
| 1-mL pipettor tips | Eppendorf | 30089.43 | |
| 2-mL amber screw-top autosampler vials | Agilent | 5182-0716 | |
| 5-mL pipettor tips | Eppendorf | 30089.456 | |
| 80-position microcentrifuge tube rack | Fisher | 05-541-2 | |
| 8-mL amber vials with PTFE-lined caps | Wheaton | 224754 | |
| 70 % (v/v) isopropanol | Fisher | A459 | |
| 100-1000 µL air displacement pipette | Eppendorf | ES-100 |
References
- Nel, L. H., et al. Mongoose rabies in southern Africa: a re-evaluation based on molecular epidemiology. Virus Research. 109 (2), 165-173 (2005).
- Zieger, Z., et al. The phylogeography of rabies in Grenada, West Indies, and implications for control. PLOS Neglected Tropical Diseases. 8 (10), e3251(2004).
- Monroe, B. P., et al. Rabies surveillance in the United States during 2014. Journal of the American Veterinary Medical Association. 248 (7), 777-788 (2015).
- Slate, D., et al. Status of oral rabies vaccination in wild carnivores in the United States. Virus Research. 111, 68-76 (2005).
- Blanton, J. D., et al. Vaccination of small Asian mongoose (Herpestes javanicus) against rabies. Journal of Wildlife Diseases. 42 (3), 663-666 (2006).
- Vos, A., et al. Oral vaccination of captive small Indian mongoose (Herpestes auropunctatus) against rabies. Journal of Wildlife Diseases. 49 (4), 1033-1036 (2013).
- Berentsen, A. R., Johnson, S. R., VerCauteren, K. C. Evaluation of ONRAB® bait matrix flavor preference by mongoose (Herpestes auropunctatus) in Puerto Rico: Implications for Oral Rabies Vaccination. Caribbean Journal of Science. 48 (1), 52-58 (2014).
- Ortmann, S., et al. Safety studies with the oral rabies virus vaccine strain SPBN GASGAS in the small Indian mongoose (Herpestes auropunctatus). BMC Veterinary Research. 14 (1), 90(2018).
- Linhart, S. B., et al. A field evaluation of baits for delivering oral rabies vaccines to raccoons (Procyon lotor). Journal of Wildlife Diseases. 30 (2), 185-194 (1994).
- Fry, T. L., Atwood, T., Dunbar, M. R. Evaluation of rhodamine B as a biomarker for raccoons. Human Wildlife Interactions. 4 (2), 275-280 (2010).
- Jones, C., Moller, H., Hamilton, W. A review of potential techniques for identifying individual stoats (Mustela erminea) visiting control or monitoring stations. New Zealand Journal of Zoology. 31 (3), 193-203 (2004).
- de Leeuw, A. N. S., Smith, G. C., Woods, J. A. Use of iophenoxic acid to assess bait uptake by European badgers. Advances in Vertebrate Pest Management. 4, 243-254 (2006).
- Southey, A. K., Sleeman, D. P., Gormley, E. Sulfadimethoxine and rhodamine B as oral biomarkers for European badgers (Meles meles). Journal of Wildlife Diseases. 38 (2), 378-384 (2002).
- Massei, G., Jones, A., Platt, T., Cowan, D. P. Iophenoxic Acid as a Long-Term Marker for Wild Boar. Journal of Wildlife Management. 73 (3), 458-461 (2009).
- Creekmore, T. E., et al. Field evaluation of baits and baiting strategies for delivering oral vaccine to mongooses in Antigua, West Indies. Journal of Wildlife Diseases. 30 (4), 497-505 (1994).
- Creekmore, T. E., Rock, R. E., Hurley, J. A baiting system for delivery of an oral plague vaccine to black-tailed prairie dogs. Journal of Wildlife Diseases. 38 (1), 32-39 (2002).
- Fernandez, J. R. R., Rocke, R. E. Use of Rhodamine B as a biomarker for oral plague vaccination of prairie dogs. Journal of Wildlife Diseases. 47 (3), 765-768 (2011).
- Johnston, J. J., et al. Evaluation and significance of tetracycline stability in rabies vaccine baits. Journal of Wildlife Diseases. 41 (3), 549-558 (2005).
- Algeo, T. P., et al. Oral rabies vaccination variation in tetracycline biomarking among Ohio Raccoons. Journal of Wildlife Diseases. 49 (2), 332-337 (2013).
- Crier, J. K. Tetracyclines as a fluorescent marker in bones and teeth of rodents. Journal of Wildlife Management. 34 (4), 829-834 (1970).
- Fisher, P. Review of using Rhodamine B as a marker for wildlife studies. Wildlife Society Bulletin. 27 (2), 318-329 (1999).
- Knowlton, F. K., Savarie, P. J., Wahlgren, C. E., Hayes, D. J. Physiological marks by coyotes ingesting baits containing iophenoxic acid, Mirex and Rhodamine B. Vertebrate Pest Control and Management Materials. Shumake, S. A., Bullard, R. W. , American Society for Testing and Materials. Philadelphia. 5th Volume. STP 974 141-147 (1987).
- Follmann, E. H., Savarie, P. J., Ritter, D. G., Baer, G. M. Plasma marking of arctic foxes with iophenoxic acid. Journal of Wildlife Diseases. 23 (4), 709-712 (1987).
- Saunders, G., Harris, S., Eason, C. T. Iophenoxic acid as a quantitative bait marker for foxes. Wildlife Research. 20, 297-302 (1993).
- Hadidian, J., et al. Acceptance of simulated oral rabies vaccine baits by urban raccoons. Journal of Wildlife Diseases. 25 (1), 1-9 (1989).
- Sweetapple, P. J., Nugent, G. Iophenoxic acid as a serum marker for red deer (Cervus elaphus scoticus). Wildlife Research. 25, 649-654 (1998).
- Ogilvie, S. C., Eason, C. T. Evaluation of iophenoxic acid and rhodamine B for marking feral ferrets (Mustela furo). New Zealand Journal of Zoology. 25 (2), 105-108 (1998).
- Eason, C. T., Batcheler, D., Frampton, C. M. Comparative pharmacokinetics of iophenoxic acid in cats and brushtail possums. Wildlife Research. 21, 377-380 (1994).
- Fisher, P. M., Marks, C. A. Evaluation of iophenoxic acid as a biomarker for swamp wallabies (Wallabia bicolor). Wildlife Research. 24, 97-103 (1997).
- Baer, G. M., Shaddock, J. H., Hayes, D. J., Savarie, P. Iophenoxic acid as a serum marker in carnivores. Journal of Wildlife Management. 49 (1), 49-51 (1985).
- Spurr, E. B. Iophenoxic acid as a systemic blood marker for assessment of bait acceptance by stoats (Mustela ermine) and weasels (Mustela nivalis). New Zealand Journal of Zoology. 29 (2), 135-142 (2002).
- Mudge, G. H., Strewler, G. J., Desbiens, N., Berndt, W. O., Wade, D. N. Excretion and distribution of iophenoxic acid. Journal of Pharmacology and Experimental Therapeutics. 178 (1), 159-172 (1971).
- Jones, A. High-performance liquid chromatographic determination of iophenoxic acid in serum. Journal of Chromatography B: Biomedical Sciences and Applications. 654 (2), 293-296 (1994).
- Wiles, M. C., Campbell, T. A. Liquid chromatography-electrospray ionization mass spectrometry for direct identification and quantification of iophenoxic acid in serum. Journal of Chromatography B. 832 (1), 144-157 (2006).
- Ballesteros, C., et al. Analysis by LC/ESI-MS of iophenoxic acid derivatives and evaluation as markers of oral baits to deliver pharmaceuticals to wildlife. Journal of Chromatography B. 878 (22), 1997-2002 (2010).
- Purdey, D. C., Petcu, M., King, C. M. A simplified protocol for detecting two systemic bait markers (Rhodamine B and iophenoxic acid) in small mammals. New Zealand Journal of Zoology. 30 (3), 175-184 (2003).
- Tobin, M. E., Koehler, A. E., Sugihara, R. Tetracyclines as a fluorescent marker in bones and teeth of rodents. Journal of Wildlife Management. 60 (1), 202-207 (1996).
- Briscoe, J. A., Syring, R. Techniques for emergency airway and vascular access in special species. Seminars in Avian and Exotic Pet Medicine. 13 (3), 118-131 (2004).
- Eason, C. T., Frampton, C. M. The plasma pharmacokinetics of iophenoxic and iopanoic acids in goat. Xenobiotica. 2 (2), 185-189 (1992).
- Hilton, H. E., Dunn, A. M. S. Mongooses: their natural history. , Oliver and Boyd. Edinburgh and London. (1967).
- Stevens, C. E., Hume, I. D. Comparative physiology of the vertebrate digestive system. Second edition. , Cambridge University Press. Cambridge. (1995).
- National Rabies Management Program (NRMP). Oral rabies vaccination draft operations manual. , USDA APHIS Wildlife Services. (2009).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request Permission