Method Article
Инженерные ассамблоиды сухожилий для исследования перекрестных клеточных помех при заболевании и восстановлении
В этой статье
Резюме
В данной работе мы представляем ассамблоидную модельную систему, имитирующую перекрестные помехи между несущей тканью сухожильного ядра и внешним компартментом, содержащим клеточные популяции, активированные болезнью и травмой. В качестве важного примера использования мы демонстрируем, как система может быть развернута для исследования активации внешних эндотелиальных клеток, связанных с заболеванием.
Аннотация
Сухожилия обеспечивают передвижение, передавая мышечные силы на кости. Они опираются на прочное сухожильное ядро, состоящее из коллагеновых волокон и популяций стромальных клеток. Это несущее ядро охватывается, питается и восстанавливается синовиальным слоем ткани, содержащим наружный отдел сухожилия. Несмотря на эту сложную конструкцию, травмы сухожилий являются распространенным явлением, и клиническое лечение по-прежнему опирается на физиотерапию и хирургическое вмешательство. Ограниченность имеющихся экспериментальных модельных систем замедлила разработку новых методов лечения, модифицирующих болезнь, и клинических режимов, предотвращающих рецидивы.
Исследования in vivo на людях ограничиваются сравнением здоровых сухожилий с терминальной стадией пораженных или разорванных тканей, взятых во время операции по восстановлению, и не позволяют провести лонгитюдное исследование основного заболевания сухожилий. Модели на животных in vivo также имеют важные ограничения, касающиеся непрозрачной физиологической сложности, этического бремени для животных и больших экономических затрат, связанных с их использованием. Кроме того, животные модели in vivo плохо приспособлены для систематического зондирования лекарств и путей многоклеточного, многотканевого взаимодействия. Более простые модельные системы in vitro также не оправдали ожиданий. Одной из основных причин является неспособность адекватно воспроизвести трехмерную механическую нагрузку, необходимую для осмысленного изучения клеток сухожилий и их функций.
Новая система 3D-моделирования, представленная здесь, решает некоторые из этих проблем, используя экспланты сухожилий хвоста мыши. Важно отметить, что эти экспланты легко доступны в больших количествах с одной мыши, сохраняют 3D-паттерны загрузки in situ на клеточном уровне и имеют внеклеточный матрикс, подобный in vivo. В этом протоколе даны пошаговые инструкции о том, как дополнить экспланты ядра сухожилий коллагеновыми гидрогелями, нагруженными эндотелиальными клетками мышечного происхождения, фибробластами сухожильного происхождения и макрофагами костного мозга для замещения популяций клеток, активируемых болезнью и травмой, во внешнем сухожильном компартменте. Показано, как полученные сухожильные ассамблоиды могут быть подвергнуты механическому воздействию или с помощью определенных стимулов микроокружающей среды для исследования возникающих многоклеточных перекрестных помех во время болезни и травмы.
Введение
Выполняя свою функцию передачи мышечных сил на кости для обеспечения подвижности, сухожилия подвергаются некоторым из самых экстремальных механических нагрузок, возникающих в человеческом теле 1,2,3. В связи со старением общества, растущей распространенностью ожирения и растущей популярностью занятий спортом, требующих механических усилий, распространенность заболеваний и травм сухожилий, по прогнозам, будет расти в развитых странах 4,5,6. Разработка новых, научно обоснованных и модифицирующих болезнь схем лечения для борьбы с этим ростом была затруднена ограничениями имеющихся в настоящее время модельных систем 1,7,8.
В идеале, модели восстановления заболеваний и травм должны позволять изучать, как орган-мишень обрабатывает определенный набор входных параметров (имитируя триггеры заболевания, Таблица 1) в измеримые выходные параметры (представляющие признаки заболевания, Таблица 2), контролируя при этом искажающие факторы. Исследования с использованием таких модельных систем позволят идентифицировать (пато-) физиологические процессы, лежащие в основе заболевания и восстановления травм, и получить знания, которые могут быть использованы для предотвращения или уменьшения признаков заболеваний и травм в клиниках. Применяя этот принцип к сухожилиям, полезная модельная система должна повторять центральные части реакции сухожилий in vivo на заболевание и травму, которые охватывают следующие признаки: микроповреждение, воспаление, неоваскуляризация, гиперцеллюлярность, ускоренный оборот матрикса и декомпартментализация 9,10,11,12,13,14,15 . Используя эти признаки в качестве основы, можно сделать следующие выводы для успешной системы моделирования заболеваний сухожилий и травм.
Предполагается, что механическая перегрузка является центральным фактором в повреждении сухожилий и патогенезе заболевания и, таким образом, является широко используемым экспериментальным подходом для создания микроповреждений16. Таким образом, контролируемая механическая нагрузка является основным условием для моделей восстановления заболеваний и травм сухожилий. В идеале модельная система допускает три основных режима: одинарное нагружение растяжением до повреждения, усталостное нагружениеи разгрузка 8,17,18. При механической деформации тканевые резидентные клетки испытывают сложное сочетание сил растяжения, сил сдвига (из-за скольжения коллагеновых волокон, окружающих клетки) и сил сжатия, возникающих во время разгрузки или вблизи энтезиса19,20. Модельные системы должны воспроизводить эти сложные схемы нагружения как можно точнее.
Альтернативным способом введения матриксного микроповреждения является использование биохимических стрессоров, которые имитируют системную предрасположенность к заболеваниям и травмам сухожилий, такие как (про)воспалительные цитокины, окислительный стресс или высокие концентрации глюкозы 21,22,23. Следовательно, контролируемое нишевое микроокружение является выгодным для модельной системы восстановления заболеваний и травм сухожилий.
Общей предпосылкой для того, чтобы модельные системы могли повторять воспаление, неоваскуляризацию и гиперцеллюлярность, является селективное присутствие клеточных популяций, которые управляютэтими процессами. Для воспалительных процессов эти популяции включают нейтрофилы, Т-клетки и макрофаги, в то время как эндотелиальные клетки и перициты необходимы для изучения неоваскуляризации 25,26,27,28,29. Фибробласты сухожилий не только жизненно важны для восстановления сухожилий, но и, как пролиферативные и мигрирующие клетки, также частично ответственны за локальную гиперцеллюлярность, наблюдаемую при заболеваниях сухожилий 30,31,32,33,34,35,36.
Помимо изменений в популяциях резидентных клеток, состав матрикса сухожилий также изменяется при заболеваниях и травмах сухожилий 7,37,38,39,40. Для представления правильных сигналов микросреды, связанных с заболеванием, модельные системы должны быть способны интегрировать состав внеклеточного матрикса, соответствующий целевой стадии заболевания или травмы, например, путем включения соответствующих пропорциональных комбинаций коллагена-1, коллагена-3 и клеточного фибронектина41.
Компартментализация здоровых сухожилий в сухожильный сердечник и внешние отделы (т.е. эндотенон, эпитенон и паратенон) занимает центральное место в их функции и часто нарушается в больных или поврежденных сухожилиях 1,42,43,44,45,46,47 . Таким образом, включение 3D-компартментализации сухожилий в системы моделей сухожилий необходимо не только для более точного моделирования процессов, лежащих в основе де- и рекомпартментализации, но и для установления правильных пространственно-временных градиентов цитокинов и питательных веществ48,49.
Наконец, модульность является еще одним центральным преимуществом модельных систем, позволяющим исследователям комбинировать правильный относительный вклад и взаимодействие между ранее описанными стрессорами во время исследуемых процессов 8,17.
Помимо выбора оптимальных модальностей ввода, важным этапом является возможность измерения, наблюдения и отслеживания изменений в результирующем результате. Механические свойства модельной системы (т.е. длина области носка, линейный модуль упругости, максимальная растягивающая деформация, максимальное растягивающее напряжение, усталостная прочность и релаксация напряжений) являются здесь центральными, поскольку они характеризуют основную функцию сухожилия 50,51,52. Чтобы связать эти функциональные изменения с изменениями на тканевом уровне, важно использовать методы, обнаруживающие повреждение структурного матрикса (коллагена) и отслеживающие пролиферацию и рекрутирование соответствующих заболеванию и репарации клеточных популяций 30,53,54,55,56,57,58,59,60.
Для изучения возникающих перекрестных помех между клетками и клетками-матриксами необходимо уметь выделять или маркировать белки в адекватных количествах для количественного определения (т.е. ИФА, протеомика, иммуногистохимия, проточная цитометрия)14,21,61,62. Также должен быть возможен популяционный или, по крайней мере, компарт-специфический анализ экспрессии генов (т.е. флуоресцентно-активируемая сортировка клеток [FACS], секвенирование одноклеточных/объемных РНК и количественная полимеразная цепная реакция в реальном времени (ОТ-кПЦР))21,24,27,63. Модельная система должна позволять измерять как можно больше вышеупомянутых выходных параметров на одном и том же образце и на нескольких образцах достаточно быстро, чтобы обеспечить высокую производительность исследований.
Среди модельных систем, доступных в настоящее время для изучения заболеваний сухожилий и восстановления травм человека, само человеческое тело, безусловно, является наиболее репрезентативным. Он также наименее совместим с экспериментальным вмешательством. В то время как пациенты с острыми повреждениями сухожилий в изобилии доступны для клинических исследований, пациенты с ранней тендинопатией (наиболее распространенным заболеванием сухожилий) в значительной степени бессимптомны и часто остаются клинически незамеченными до тех пор, пока не проявятся более серьезные изменения 14,64,65. Это затрудняет определение критического момента, когда гомеостаз сухожилий нарушает норму, и механизмы, стоящие за этим срывом 16,66,67,68,69. Кроме того, извлечение биопсии из здоровых сухожилий является этически сложной задачей, так как это может привести к стойкому повреждению. Остатки сухожилий подколенного сухожилия после операции по реконструкции передней крестообразной связки часто используются в качестве здоровых контрольных групп, но, возможно, отличаются по функциям, механическим свойствам, клеточным популяциям и составу матрикса по сравнению с вращательной манжетой плеча, ахилловыми сухожилиями и сухожилиями надколенника, обычно поражаемыми заболеваниями и травмами сухожилий 70,71,72,73.
Модели на животных in vivo более доступны и понятны, но их использование налагает значительное этическое бремя на животных и экономические издержки на исследователей. Кроме того, у большинства популярных модельных животных тендинопатические поражения либо не развиваются спонтанно (например, у крыс, мышей, кроликов), либо отсутствуют праймеры и генетически модифицированные штаммы, необходимые для отслеживания вовлеченных в него путей многоклеточной коммуникации (например, у лошадей, кроликов).
Простые 2D-модельные системы in vitro находятся на другой стороне спектра сложности/податливости и лучше позволяют контролируемо, эффективно по времени изучать специфические пути межклеточной коммуникации в ответ на более контролируемый набор триггеров 8,74. Тем не менее, эти упрощенные системы, как правило, не в состоянии повторить многомерную механическую нагрузку (т.е. растяжение, сжатие и сдвиг), которая является центральной для функциональности сухожилий. Кроме того, (слишком) высокая жесткость пластика для культуры тканей имеет тенденцию перекрывать любые матричные сигналы, предоставляемые покрытиями, предназначенными для имитации интересующего болезненного состояния75,76.
Чтобы преодолеть этот недостаток, были разработаны все более сложные системы тканеинженерных 3D-моделей, обеспечивающие нагружаемую матрицу, состав которой, по крайней мере, частично соответствует желаемому состоянию заболевания 77,78,79. Тем не менее, эти системы не только испытывают трудности с точным воспроизведением сложных составов внеклеточного матрикса in vivo и моделей клеточной нагрузки, но, как правило, не имеют долгосрочной нагружаемости и компартментных интерфейсов, необходимых для изучения путей межкомпонентной коммуникации, которые координируют заболевание сухожилий и восстановление травмы 48,49,80.
Модельные системы эксплантов сухожилий ex vivo имеют явное преимущество в виде встроенной матричной композиции, подобной in vivo, которая включает перицеллюлярные ниши, перекрестные компартментные барьеры, а также пространственно-временные градиенты цитокинов/питательных веществ и повторяет сложные паттерны нагрузки при растяжении8. В результате зависящих от размера пределов диффузии питательных веществ эксплантаты от более крупных животных моделей (например, лошадей) трудно сохранить живыми для долгосрочного изучения заболеваний сухожилий и восстановления травм 81,82,83. Между тем, более мелкие экспланты от видов мышей (например, ахиллово сухожилие, сухожилие надколенника) трудно воспроизводимо зажимать и механически нагружать. Их размер также ограничивает количество материала, который может быть собран для считывания на клеточном, белковом и генном уровнях без объединения образцов и снижения производительности. В этом смысле пучки сухожилий хвоста мышей предлагают потенциал для высокопроизводительного изучения заболеваний сухожилий и восстановления травм, поскольку они легко доступны в больших количествах у одной мыши, сохраняют сложный состав перицеллюлярного матрикса in vivo и повторяют паттерны клеточной нагрузки. Однако в процессе экстракции они теряют большую часть своего внешнего компартмента и содержащиеся в нем популяции сосудистых, иммунных и фибробластов, которые, как теперь считается, приводят к заболеванию и восстановлению сухожилий.
Чтобы восполнить этот пробел, была разработана модельная система, сочетающая в себе преимущества эксплантатов стержней, полученных из сухожилий хвоста мыши, с преимуществами модельных систем на основе 3D-гидрогеля. Эта модельная система состоит из нагруженного клетками (коллаген-1) гидрогеля, отлитого вокруг эксплантов сухожилий хвоста84,85. В этой статье подробно описаны необходимые этапы производства, а также полезные данные, которые могут быть получены путем совместного культивирования стержневых эксплантов (внутренний компартмент) внутри эндотелиального коллагенового гидрогеля типа 1 (внешний компартмент).
протокол
Все описанные здесь методы были одобрены ответственными органами (номера лицензий кантона Цюрих ZH104-18 и ZH058-21). Обзор представлен на рисунке 1.
1. Выделение компонентов сухожильной сборки у мышей в возрасте 12-15 недель (т.е. B6/J-Rj)
- Усыпляйте мышей с помощью асфиксии, вызванной газомCO2 . Чтобы получить максимальный урожай, не обрабатывайте более 3 мышей за один раз и приступайте к изоляции клеток сразу после эвтаназии.
- Обеспечивают смерть при двусторонней индукции пневмоторакса.
- Простерилизуйте кожу мыши 80% этанолом и переместите мышь в стерильный колпак для биобезопасности.
- Изолируют эксплантаты ядра сухожилия хвоста.
- С помощью скальпеля (No 21) отделите хвост от мыши, разрезав его у основания.
- Начиная с кончика хвоста, захватите его пинцетом и пошевелите, чтобы повредить кожу. Затем осторожно оттяните пинцет от хвоста, чтобы обнажить экспланты сухожилийного ядра.
- Поместите экспланты сухожильного стержня в стандартную питательную среду (DMEM/F12 + 10% FBS + 1% пенициллин/стрептомицин + 1% амфотерицин + 1% заменимые аминокислоты) и отделите их от оттянутой хвостовой части с помощью свежего лезвия скальпеля (No 21).
- Повторите шаги 1.4.2. и 1.4.3. до тех пор, пока не будет обработан весь хвост и сухожилия не станут короче 25 мм.
- Разрежьте изолированные стержневые экспланты на куски длиной 25 мм с помощью свежего лезвия скальпеля (No 21).
- Измерьте средний диаметр эксплантатов керна с помощью светового микроскопа, подключенного к программному обеспечению для анализа изображений через съемную цифровую камеру с креплением C-mount.
- Используйте указатель и щелчок, чтобы выбрать инструмент измерения линий с правой стороны.
- Измерьте диаметр экспланта в трех разных местах и вычислите их средний диаметр.
- Для облегчения зажима и механических испытаний в дальнейшем приступайте только к эксплантациям стержней со средним диаметром более 100 мкм.
- Выгрузка в сочетании с экспозицией в стандартных условиях культивирования (37 °C, 20%O2, сывороточное добавко) изменяет экспрессию генов в течение 6 ч после выделения и приводит к деградации в течение 7 дней21. Для начала в квазигомеостатическом состоянии получают ассамблоиды сухожилий и начинают эксперименты сразу после изоляции сухожильного ядра.
- В зависимости от экспериментальной установки, в качестве контрольной группы требуются девитализированные экспланты сухожильного стержня. Чтобы девитализировать эксплантаты сухожильного ядра, заморозьте их в небольшой емкости, наполненной жидким азотом, в течение 5 с помощью пинцета, а затем разморозьте в течение 5 секунд при комнатной температуре (RT). Повторите этот цикл замораживания-оттаивания 3 раза и перейдите к шагу 4 («Зажим стержневых эксплантатов»).
ВНИМАНИЕ: Жидкий азот может вызвать холодные ожоги, удушье и охрупчивать многие обычные материалы. Используйте только емкости, предназначенные для низкотемпературных жидкостей, и надевайте защитную одежду (например, защитную маску для лица, соответствующие перчатки, обувь с закрытым верхом).
- Изолируют фибробласты сухожилий.
- С помощью скальпеля (No 21) сделайте поперечный надрез посередине лапки мыши. Сделайте два надреза перпендикулярно стопе по бокам задних конечностей и вверх до бедер с каждого конца этого разреза.
- С помощью пинцета зафиксируйте вырезанный кожный лоскут на стопе и снимите кожу, покрывающую икроножные мышцы. При выделении эндотелиальных клеток у той же мыши удалите всю кожу.
- Отделите ахиллово сухожилие от пяточной кости свежим лезвием скальпеля (No 21). Свободный конец ахиллова сухожилия зафиксируйте пинцетом и отделите другой конец от икроножной мышцы.
- Промойте ахиллово сухожилие один раз в PBS и с помощью скальпеля (No 21) удалите всю оставшуюся мышечную ткань, пока не останется только белая ткань сухожилия. Если эндотелиальные клетки были выделены из той же мыши, оставьте ахиллово сухожилие в PBS и перейдите к шагу 1.6. первый.
- Соберите ахилловы сухожилия одного животного в пластиковую пробирку объемом 15 мл, содержащую 10 мл питательной среды сухожилий (DMEM/F12 + 1% пенициллина/стрептомицина + 1% амфотерицина + 2 мг/мл коллагеназы 1) и расщепляйте в течение 6-8 ч при 37 °C при медленном, постоянном перемешивании с помощью низкоскоростного орбитального шейкера при 15 об/мин.
- Центрифугируют сброженный сухожильный раствор при 500 х г в течение 5 мин при RT, аспирируют надосадочную жидкость и ресуспендируют в 8 мл стандартной питательной среды (DMEM/F12 + 10% FBS + 1% пенициллин/стрептомицин + 1% амфотерицин + 1% заменимые аминокислоты) и культивируют в колбе для культивирования Т25 в стандартных условиях культивирования (37 °C, 20 % O2) в течение 7 дней без смены среды. После этого меняйте носитель раз в неделю.
- Разделите клетки при 80% слиянии в колбу для культуры Т150 (1:6). Замораживают клетки при прохождении 2 в 2 мл стерильной фильтрованной морозильной среды (70% DMEM/F12 + 20% FBS + 10% DMSO), распределенной по двум криопробиркам по 1,5 мл, и хранят их при -80 °C до дальнейшего использования. Используйте трипсин для удаления клеток из тканевой культуры пластика.
- Изолируют эндотелиальные клетки мышечного происхождения.
- Если фибробласты сухожилий не выделены у одной и той же мыши, начните с шагов 1.5.1 и 1.5.2.
- Ножницами отделите задние лапы от туловища, разрезав тазобедренный сустав.
- Вымойте задние конечности один раз в холодном PBS (~ 4 °C), удалите мышцы (четырехглавую мышцу бедра, длинный разгибатель пальца, камбаловидную мышцу и икроножную мышцу) скальпелем (No 21) и поместите мышцы в чашку Петри на льду.
- Свежим лезвием скальпеля (No 21) измельчите мышечную ткань на кусочки размером менее 1мм3, держа чашку Петри на льду.
- Смешайте измельченную мышечную ткань с обеих задних конечностей в пластиковую пробирку объемом 50 мл, содержащую 12,5 мл мышечной среды для пищеварения (PBS + 2 мг/мл коллагеназа IV + 2 мг/мл dispase II + 2 мМ CaCl2).
- Поместите пластиковую трубку на водяную баню с температурой 37 °C на 10 минут. Энергично встряхните раствор и поставьте его обратно еще на 10 минут. Повторяйте до тех пор, пока раствор не станет однородным и не останутся только (белые) кусочки сухожилий и фасций (примерно 4 x 10 мин). Между тем, продолжайте изоляцию фибробластов сухожилия или изоляцию макрофагов.
- Добавьте в пластиковую пробирку 12,5 мл холодного PBS + 10% FBS, чтобы остановить пищеварение.
- Используйте держатель дозатора с питанием от батареи, оснащенный пипеткой объемом 50 мл, для аспирации суспензии из пластиковой пробирки. Оснастите пластиковую трубку сетчатым фильтром на 400 мкм и отфильтруйте суспензию для удаления мусора. Повторите процесс с сетчатым фильтром на 100 мкм.
- Центрифугу отфильтрованной суспензии при 400 х г в течение 5 мин при RT. Ресуспендировать в 10 мл холодного PBS + 10% FBS и снова центрифугировать.
- Ресуспендировать в 8 мл питательной среды эндотелия (смесь 1:1 DMEM/F12 и набора Endopan 3 + 10 ЕД/мл гепарина + 20% FBS + 1% пенициллина/стрептомицина + 1% амфотерицина + 30 мг/мл добавки для роста эндотелия) с добавлением пуромицина (4 мг/мл) для популяционного отбора.
- Высевают клетки одной мыши в одну колбу для культуры Т25, которая предварительно была покрыта 2 мл стерильного 0,2% раствора желатина в течение 2 ч при 37 °C, а затем высушена в течение ночи при RT после удаления излишков раствора. Подготовьте колбы за день до изоляции.
- Через 24 ч в стандартных условиях культивирования (37 °C, 20%O2) удаляют питательную среду с пуромицином, промывают прикрепленные клетки один раз PBS и культивируют их в 8 мл эндотелиальной питательной среды.
- Пропускают ячейки 1:5 при 80%-ном слиянии в колбы, покрытые желатином, и используют их в опытах до Р2. Используйте раствор для отслоения клеток, отличный от трипсина (Таблица материалов), чтобы удалить клетки из пластика культуры тканей и не замораживать их.
- Выделите макрофаги, полученные из костного мозга.
- Если фибробласты сухожилий или эндотелиальные клетки не выделены из одной и той же мыши, сначала выполните шаги 1.5.1, 1.5.2, 1.6.2 и 1.6.3.
- После удаления кожи, сухожилий и мышечных тканей промойте оставшиеся кости (бедренную и большеберцовую кости) один раз в холодной ПБС (~4 °C).
- Поместите кости в свежий холодный PBS (~4 °C) и с помощью скальпеля (No 21) постепенно срежьте эпифизы до тех пор, пока костный мозг не обнажится. Он выглядит как красная точка с обеих сторон кости.
- Снабдите шприц инъекционной иглой 0,4 мм x 25 мм (G27) и наполните его 10 мл питательной среды макрофагов (DMEM/F12 + 10% FBS + 1% пенициллин/стрептомицин + 1% амфотерицин + 1% заменимые аминокислоты).
- Держите одну кость за другой над пластиковой пробиркой объемом 50 мл, введите инъекционную иглу на глубину около 1 мм в открытый костный мозг сверху и промойте костный мозг, опорожнив шприц. Вымытый костный мозг выглядит как красноватая трубчатая структура, когда находится во взвешенном состоянии в среде.
- Растворите костный мозг, осторожно пипетируя его вверх и вниз с помощью наконечника пипетки объемом 1 мл. Используйте держатель дозатора с батарейным питанием, оснащенный пипеткой на 50 мл, чтобы отфильтровать клеточную суспензию через сетчатый фильтр для клеток 100 мкм обратно в пластиковую пробирку объемом 50 мл и центрифугировать ее при 350 x g в течение 5 минут при RT.
- Удалите надосадочную жидкость, повторно суспендируйте гранулу в 10-миллилитровом буфере лизиса эритроцитов (эритроцитов) и снова центрифугируйте при 350 x g в течение 10 минут при комнатной температуре.
- Ресуспендированную гранулу в 5 мл питательной среды макрофагов (DMEM/F12 + 10% FBS + 1% пенициллин/стрептомицин + 1% амфотерицин + 1% заменимые аминокислоты) и высевают в необработанные чашки Петри диаметром 100 мм (5-8 x 10,6 клеток в чашке).
- Через 4 ч добавляют 5 мл питательной среды макрофагов с добавлением 40 нг/мл колониестимулирующего фактора макрофагов (м-КСФ) к питательной среде клеток без м-КСФ (смесь 1:1) до получения конечной концентрации 20 нг/мл м-КСФ.
- Через 6 дней используйте клетки в экспериментах или заморозьте их до дальнейшего использования. Используйте раствор для отслоения клеток, отличный от трипсина (таблица материалов), чтобы удалить клетки из пластика культуры тканей.
ПРИМЕЧАНИЕ: После изоляции клетки больше не расширяются. Описанные здесь методы выделения клеток также работают с мышами и крысами, находящимися вне указанного возрастного диапазона.
- Чтобы проверить фенотип изолированных клеточных популяций с помощью проточной цитометрии, перейдите к шагу 6.3.4.
2. Выделение коллагена у крыс Wistar или Sprague-Dawley
- Следуйте протоколу изоляции, подробно описанному в другом месте86. Он также работает с мышами, хотя и с гораздо меньшим выходом.
- Концентрацию полученного раствора определяют гидроксипролиновым анализом, оценивают чистоту с помощью SDS-страницы и хранят раствор при 4 °С до использования в экспериментах.
3. Производство компонентов системы культуры
- Напечатайте на 3D-принтере держатели зажимов, монтажную станцию и пресс-формы для камер.
- Загрузите прилагаемый файл .stl (дополнительный файл 1) для держателей зажимов, монтажной станции и пресс-форм камеры в программное обеспечение для нарезки. Чтобы изменить номера объектов в соответствии с требованиями, используйте указатель и щелчок для выбора объектов и копирование и вставку для их умножения.
- Нажмите кнопку Экспорт G-кода (Ctrl-R), чтобы сгенерировать G-код, а затем экспортировать его (Ctrl-G).
- Загрузите G-код в 3D-принтер.
- Используйте для процесса печати неокрашенные, биосовместимые нити (например, полимолочную кислоту).
- Нарежьте резьбу 3 мм в отверстиях держателя зажима, который будет удерживать винты, с помощью резьбонарезного резака (Дополнительный файл 2 и Дополнительный файл 3, отверстия 1 и 3).
- Вставьте установочные штифты из нержавеющей стали в отверстие в задней части держателя зажима (Дополнительный файл 2 и Дополнительный файл 3, отверстие 4).
- Перед использованием стерилизуйте держатели зажимов и монтажную станцию ультрафиолетовым светом в течение не менее 1 часа. Не используйте повторно напечатанные на 3D-принтере держатели зажимов.
- В качестве альтернативы можно изготовить держатели зажимов и монтажную станцию из полиэфиримида, используя прилагаемые планы (Дополнительный файл 2, Дополнительный файл 3 и Дополнительный файл 4), что является более дорогим, но позволяет использовать более эффективные методы стерилизации (например, автоклавирование) и повторное использование.
- Отлите камеры с помощью пресс-форм, напечатанных на 3D-принтере.
- Заполните камеры форм силиконом.
- Дегазируйте силикон в вакуумной камере (90 мбар) в течение 30 мин.
- Дайте раствору полимеризоваться при RT в течение ночи или на конфорке при 70 °C в течение 1 ч, в зависимости от термостойкости нитей, используемых для форм.
- Аккуратно выньте полимеризованные камеры из форм и скальпелем (No21) срежьте лишний силикон.
- ОПЦИОНАЛЬНО: Если сборки и, следовательно, окружающие камеры должны быть механически нагружены, укрепите отверстия в силиконовых камерах полыми трубками из нержавеющей стали.
- Обработайте металлические хомуты из нержавеющей стали, используя прилагаемый план (Дополнительный файл 5).
- Перед каждым использованием промывайте зажимы из нержавеющей стали, держатели зажимов из полиэфиримида, винты и силиконовую камеру.
- В течение 10 минут обрабатывайте ультразвуком в 80% этаноле (EtOH) и 20% воде обратного осмоса (ROW).
- Ультразвуковое воздействие в течение 10 мин в 50% EtOH и 50% изопропанола.
- Смойте 3 раза с помощью ROW.
- Ультразвуковое воздействие в течение 10 мин в 0,5% щелочном чистящем концентрате (т.е. 3 мл в 600 мл ROW).
- Ультразвуковое воздействие в течение 10 минут в 0,5% щелочном чистящем концентрате.
- Оставить в 0,5% щелочном чистящем концентрате при встряхивании на 1 ч 50 мин.
- Смойте 3 раза с помощью ROW.
- Ультразвуковая терапия в течение 10 минут подряд.
- Компоненты высушиваются на воздухе и автоклавируются.
4. Зажим стержневых эксплантатов
- Поместите соответствующие держатели зажимов вместе с одним металлическим зажимом в монтажную станцию.
- Положите влажные кусочки автоклавной бумаги (4 мм x 25 мм) поверх металлических зажимов, а затем разрежьте бумагу по внутренним границам зажимов скальпелем (No 21). Отрежьте 2 дополнительных кусочка бумаги меньшего размера (4 мм x 1,5 мм) от другого листа бумаги и держите их влажными.
- С помощью заостренного пинцета поместите 8 стержневых эксплантов на бумагу между металлическими зажимами концевыми точками на металлические зажимы.
- Накройте конечные точки стержневых эксплантов подготовленными кусочками бумаги меньшего размера (4 мм x 1,5 мм), а затем наденьте на них металлические зажимы. Используйте отвертку и маленькие винты (M3 x 6 мм), чтобы зафиксировать стержневые эксплантаты между металлическими зажимами и держателем зажима.
- Осторожно перенесите зажатые стержневые экспланты в силиконовые культуральные камеры и заполните эти камеры 2 мл стандартной клеточной питательной среды (DMEM/F12 + 10% FBS + 1% пенициллин/стрептомицин + 1% амфотерицин + 1% заменимые аминокислоты).
- НЕОБЯЗАТЕЛЬНО: Если сборные элементы/окружающие камеры должны быть механически нагружены, закрепите их дополнительными винтами (M3 x 16 мм) в отверстии 3 (Дополнительный файл 2 и Дополнительный файл 3, отверстие 3).
5. Подготовка и отливка коллагенового гидрогеля
- Извлеките клетки-мишени из пластика для культуры тканей с помощью раствора для отслоения клеток, центрифугируйте их при 400 x g в течение 5 мин при RT и ресуспендируйте их в 1 мл стандартной питательной среды.
- Для одного ассамблоида требуется 10 мкл PBS (20x), 1,28 мкл 1 M NaOH (125x), 8,72 мкл воды двойной дистилляции (ddH2O, 23x), 80 мкл коллагена-1 (2,5x или 1,6 мг/мл конечного) и 100 мкл (2x) стандартной питательной среды (для ядра // бесклеточных ассамблоидов) или клеточной суспензии. Готовят эти компоненты в двух отдельных растворах и смешивают их только непосредственно перед отливкой.
- Решение для сшивания: Объедините PBS, NaOH, ddH20 и клеточную суспензию до 12 ассамблоидов (+10% запас безопасности) в раствор для сшивания и храните его в пластиковой пробирке объемом 15 мл на льду. Отрегулируйте концентрацию клеточной суспензии для достижения следующих конечных концентраций после смешивания двух растворов: 250 000 клеток/мл фибробластов сухожилий, 500 000 клеток/мл эндотелиальных клеток мышечного происхождения или 370 000 клеток/мл макрофагов костного мозга.
- Раствор коллагена-1: Смешайте раствор коллагена-1, необходимый для 12 ассамблоидов (+10% запас прочности), в еще одну пластиковую пробирку объемом 15 мл и держите ее на льду.
- После того, как раствор для сшивания и раствор коллагена-1 будут готовы на льду, отсасывайте питательную среду из культуральных камер, содержащих зажатые эксплантаты ядра.
- Добавьте раствор коллагена-1 в раствор для сшивания с помощью пипетки на 1000 мкл и смешайте два раствора, быстро пипетируя вверх и вниз без образования пузырьков. Покройте отдельные эксплантаты сухожильного стержня 200 мкл смешанного раствора, пипетируя его в канавки, предусмотренные силиконовыми камерами.
- Дайте гидрогелям полимеризоваться в течение 50 минут при 37 °C.
- Осторожно заполните силиконовые камеры для культивирования 1,5 мл соответствующей питательной среды, пипетируя ее в углах камер.
- Для кокультивирования фибробластов заполните DMEM/F12, 10% FBS, 1% заменимых аминокислот, 1% пенициллина/стрептомицина, 1% амфотерицина, 200 мкМ L-аскорбиновой кислоты, 20 нг/мл макрофагального колониестимулирующего фактора.
- Для кокультивирования ядра // макрофагов заполняют DMEM/F12, 10% FBS, 1% заменимых аминокислот, 1% пенициллина/стрептомицина, 1% амфотерицина, 200 мкМ L-аскорбиновой кислоты, 20 нг/мл макрофагального колониестимулирующего фактора.
- Для кокультивирования ядра // эндотелиальных клеток заполните смесь 1:1 DMEM/F12 и набора Endopan 3 + 10 ЕД/мл гепарина + 20% FBS + 1% пенициллина/стрептомицина + 1% амфотерицина + 30 мг/мл добавки для роста эндотелия.
- Культивирование ассамблоидов в условиях, соответствующих гипотезе. Например, чтобы имитировать пораженную нишевую среду, культивируйте их при 37 °C и 20%O2. Меняйте питательную среду два раза в 1 неделю. Чтобы предотвратить заражение, поместите камеры в большую чашку Петри или стерильную коробку, прежде чем помещать их в инкубатор.
ПРИМЕЧАНИЕ: Время культивирования зависит от гипотезы и конфигурации кокультуры. Например, основные // фибробластные ассамблоиды в пораженной нишевой среде становятся механически нестабильными примерно через 3 недели.
6. Доступные методы считывания
- Проведение флуоресцентной микроскопии, включая анализ жизнеспособности и морфологии.
- В целом, сборки можно изобразить как полноценные маунты. Для этого извлеките ассамблоиды из зажимов, разрезав их ножницами близко к зажимам и перенеся на 12-луночную пластину.
- Промойте сборки один раз с помощью ПБС.
- Если проведен анализ жизнеспособности, окрасьте каждый ассамблоид 100 мкл 4 x 10−6 М гомодимера этидия в PBS (EthD-1) в течение 20 мин при 37 °C в темноте.
- Промыть ассамблоиды 3 раза PBS, затем зафиксировать их 500 мкл 4% формальдегида каждый на 20 мин при RT.
ВНИМАНИЕ: 4% формальдегид обладает аллергенным, канцерогенным и мутагенным действием, токсичен для репродуктивной функции и может вызвать токсичность для развития (репротоксическое) или повреждение органов. Надевайте защитную одежду и перчатки, средства защиты глаз, маску или другие средства защиты органов дыхания. - Промойте ассамблоиды 3 раза PBS и продолжайте использовать выбранный протокол окрашивания. Выборка окрашивания была описана ранее84,85.
ПРИМЕЧАНИЕ: Избегайте окрашивания, в котором используются флуорофоры с длиной волны излучения, близкой к длине волны автофлуоресценции коллагена (около 480 нм).
- В соответствии с инструкциями производителя выполняйте компарт-специфическую изоляцию РНК для ОТ-кПЦР или полногеномного секвенирования РНК.
- Извлеките сборки из хомутов ножницами.
- НЕОБЯЗАТЕЛЬНО: Используйте пинцет, чтобы отделить стержневые эксплантаты от внешнего отсека гидрогеля.
- Пул 20-24 20 мм стержневых эксплантов или 2 клеточных коллагеновых гидрогеля для выделения достаточного количества РНК.
- Используйте 1 мл холодного тризола и механическое разрушение (например, металлические шарики или криогенное измельчение) для разрушения внеклеточного матрикса объединенных эксплантов ядра или объединенных гидрогелей коллагена.
ВНИМАНИЕ: Пероральная, кожная и ингаляционная токсичность. Вызывает раздражение кожи и глаз. Работайте только в перчатках и в химическом защитном шкафу. - Продолжайте выделение РНК из клеточного лизата с помощью стандартных наборов для экстракции РНК, как описано ранее или как описано в инструкциях производителя84,85.
- Компартмент-специфическая проточная цитометрия.
- Извлеките сборки из хомутов ножницами.
- ДОПОЛНИТЕЛЬНО: Используйте пинцет, чтобы отделить стержневые эксплантаты от внешнего отсека гидрогеля.
- Дигестивные компартменты в 1 мл PBS с коллагеназой I (3 мг/мл) и диспазой II (4 мг/мл) в течение 4 ч при 37 °C при постоянном перемешивании.
- Центрифугируют сброженный раствор при 500 х г в течение 5 мин при РТ и аспирируют надосадочную жидкость.
- Ресуспендировать гранулу в 100 мкл буфера FACS (1% FBS в PBS), содержащего флуорофор-конъюгированные антитела выбора. Выборка рабочих флуорофор-конъюгированных антител была описана ранее84,85.
- Инкубируйте красящий раствор в течение 30 мин при РТ.
- Разбавьте раствор для окрашивания 1,4 мл буфера FACS и центрифугируйте его в течение 5 мин при 500 x g при RT.
- Ресуспендируйте гранулу в 350 мкл буфера FACS и отфильтруйте раствор через крышку сетчатого сетчатого фильтра 100 мкм перед анализом с помощью проточного цитометра по выбору в соответствии с инструкциями производителя.
- Проанализируйте надосадочную жидкость.
- Замените питательную среду на питательную среду, не содержащую сыворотки, за 3 дня до забора надосадочной жидкости.
- Выполняйте немедленный и отсроченный анализ обогащенного, неразбавленного надосадочной жидкости с помощью иммуноферментного анализа (ИФА) и наборов для определения мезомасштаба (MSD). Для отсроченного анализа храните надосадочную жидкость в пластиковых пробирках объемом 1,5 мл при температуре -80 °C.
- Оценка механических свойств сборки.
- Используйте изготовленное по индивидуальному заказу растягивающее устройство для приложения механических сил и измерения механических свойств22. Установочные штифты из нержавеющей стали и винты из нержавеющей стали позволяют прикреплять зажимы и к другим растяжным устройствам.
- Поскольку механические свойства ассамблоида в значительной степени определяются свойствами экспланта 18 с закладным стержнем, измерьте механические свойства стержневого эксплантата перед его внедрением в гидрогель, чтобы снизить риск разрушения свежеотлитого гидрогеля в процессе измерения.
Результаты
Изоляция компонентов (рис. 1 и рис. 2)
Перед использованием стержневых эксплантов и клеточных популяций в ассамблоидной кокультуре эти компоненты должны быть проверены под микроскопом (рис. 1). Стержневые эксплантаты должны иметь одинаковый диаметр (100-200 мкм) и не иметь видимых изломов или морщин. Эндотелиальные клетки должны иметь удлиненную форму при контакте с другими клетками, чего они не имеют при посеве при слишком низкой плотности из-за низкого начального выхода из изоляции. В этом случае эндотелиальные клетки приобретают более округлую форму с цитоскелетными расширениями и пролиферируют заметно медленнее. Разделите их 1:5 через 7-10 дней. Фибробласты сухожилий, выделенные из ахилловых сухожилий, имеют более округлую морфологию по сравнению с их человеческими аналогами в течение 1-2 пассажей (10-14 дней каждый), когда они были разделены 1:6. Макрофаги намного меньше, чем фибробласты или эндотелиальные клетки, и не размножаются после выделения. В зависимости от партии их форма может варьироваться от пирамидальной до круглой.
Фенотипы клеточных компонентов верифицировали с помощью проточной цитометрии. В качестве маркера эндотелиальных клеток использовали конъюгированное антитело к CD31 (рис. 2А). При установлении порога флуоресценции на основе неокрашенного контрольного образца (серый) 90,1% эндотелиальных клеток пассажа 1 (P1) и 48,7% эндотелиальных клеток пассажа 2 (P2) были идентифицированы как CD31-положительные. Для характеристики фибробластов сухожилий использовалась генетически модифицированная мышиная линия, совместно экспрессирующая маркер фибробластов сухожилий Scleraxis вместе с зеленым флуоресцентным белком (ScxGFP) и конъюгированным антителом к CD146 (рис. 2B)35,60. После одного пассажа (P1) 37,3% фибробластов составляли ScxGFP+CD146-, 0,2% — ScxGFP+CD146+, 4,3% — ScxGFP-CD146+ и 58% — ScxGFP-CD146-. После двух пассажей (P2) процент клеток ScxGFP+CD146- снизился до 27,6%, процент клеток ScxGFP+CD146+ увеличился до 6,9%, процент клеток ScxGFP-CD146+ увеличился до 10,6%, а процент клеток ScxGFP-CD146- снизился до 54,9%. Для идентификации и характеристики макрофагов использовали антитело F4/80 в комбинации с антителами к CD86 и CD206 (рис. 2C). После выделения и культивирования 96,4% клеток, полученных из костного мозга, были F4/80-положительными. Среди этих F4/80-положительных клеток 8,6% составляли CD206+CD86-, 23,6% — CD206+CD86+, 28,3% — CD206-CD86+ и 39,4% — CD206-CD86-. Скорость сшивания коллагена может варьироваться от партии к партии и должна быть проверена перед началом экспериментов.
Внешний вид ассамблоида (рис. 3)
В условиях пораженной культуры (36 °C, 20%O2) эксплант ядра оставался механически растяжимым, не менялся по внешнему виду и продолжал быть визуально различимым и физически отделимым от окружающего гидрогеля в течение, по крайней мере, 21 дня (рис. 3A, B). Окружающий гидрогель уплотнялся с течением времени, при этом скорость уплотнения зависела от популяции клеток, засеянных в него. Фибробласты, полученные из ахиллова сухожилия, сокращали окружающий их гидрогель быстрее всего, и делали это радиально, когда находился в гидрогеле, отлитом вокруг стержневого эксплантата, и во всех направлениях, когда это не было (рис. 3B, C). Первоначально бесклеточные гидрогели, размещенные вокруг стержневого экспланта, также уплотнялись. Это сокращение, вероятно, было вызвано миграцией клеток из основного экспланта, что указывает на динамический кросс-компартментальный интерфейс. Поскольку бесклеточные гидрогели без встроенного стержневого экспланта не уплотняются заметно, вклад усадки, вызванной потерей воды, представляется незначительным (рис. 3B и дополнительный файл 6).
Таким образом, недостаток уплотнения гидрогеля может быть использован для обнаружения ошибок в сборке ассамблоида (т.е. низких концентраций клеток) и должен быть проверен перед переходом к более дорогостоящим методам считывания. При разработке этого метода распространенными ошибками снижения концентрации клеток были умирающие клетки во внешнем гидрогеле, потому что они были оставлены слишком долго в относительно жестком растворе сшивания (высокий pH, низкая температура) и сушка стержневых эксплантатов, потому что время между аспирацией среды и впрыском гидрогеля было слишком большим, или потому, что стержневой эксплант был зажат слишком высоко, чтобы быть встроенным в коллаген.
Конфокальная флуоресцентная микроскопия: анализ жизнеспособности и морфологии (рис. 3)
После извлечения из зажимов ножницами (рис. 3B) ассамблоиды могут быть зафиксированы, окрашены и визуализированы с помощью конфокального микроскопа в целом без секционирования. Здесь ядро // эндотелиальная клетка, ядро // макрофаг и ядро // ассамблоиды фибробластов были окрашены DAPI (NucBlue) и Ethidium Homodimer (EthD-1) для анализа жизнеспособности, а DAPI и F-актин для анализа морфологии и распространения клеток в 3D-гидрогеле коллагена (рис. 3D). Жизнеспособность ядра // эндотелиальных клеточных ассамблоидов (рис. 3E) была количественно оценена и обнаружила, что после сборки ассамблоидов она в целом ниже, чем сообщалось ранее для ядра // макрофага и ядра // ассамблоидов фибробластов84. Тем не менее, жизнеспособность оставалась стабильной во время ассамблоидной культуры, по крайней мере, до 7-го дня.
Механически индуцированные микроповреждения и измерение механических свойств (рис. 4)
Винты и штифты, прикрепленные к зажимным держателям, позволяют фиксировать зажимные сборки к одноосным растяжным устройствам. Используемое здесь устройство растяжения, изготовленное по индивидуальному заказу, оснащено тензодатчиком 10 Н и было описано в предыдущих публикациях (рис. 4A)22. Все образцы были предварительно подготовлены с помощью пяти циклов растяжения до 1% деформации перед измерениями.
Регистрация полной кривой зависимости напряжения от деформации стержневых эксплантов или ассамблоидов (рис. 4B) позволит количественно оценить линейный модуль упругости (α), максимальное напряжение (β) и максимальную деформацию (у). Однако он также необратимо повреждает стержневой эксплант или ассамблоид, что делает невозможным оценку продольного развития максимального напряжения (β) и максимальной деформации (у) для одних и тех же образцов (рис. 4Б). В данном случае линейный модуль упругости использовался в качестве меры способности образца выдерживать нагрузки, поскольку это измерение требует растяжения образца всего на 2% деформации, что, как было показано ранее, не приводит к постоянному уменьшению линейного модуля упругости18. В частности, ядро // эндотелиальные клеточные ассамблоиды подвергались процедуре зажима 2% деформации (примерно конец линейной эластической области) или 6% деформации (примерно максимальная деформация). Полученное микроповреждение оценивали путем измерения линейного модуля упругости до и после процедуры (рис. 4C).
В соответствии с ранее проведенными экспериментами с использованием монокультурных стержневых эксплантов, ассамблоиды ядра // эндотелиальных клеток сохраняли свой линейный модуль упругости не менее 14 дней при культивировании в квазигомеостатических нишевых условиях (29 °C, 3% O2) и воздействии штаммов не выше 2%18,21. Что касается механической базовой стимуляции, то статическое растяжение, приложенное через зажимы, по-видимому, в достаточной степени имитирует уровни нативной деформации, испытываемые ядром сухожилия in vivo, чтобы предотвратить катаболические процессы, обычно связанные с разгрузкой матрицы87. Действительно, прогрессирующее и статистически значимое снижение линейного модуля упругости, наблюдаемое в ядро // эндотелиальных клеточных ассамблоидах, подвергшихся 6%-ной деформации, может быть связано с разгрузкой матрикса, вызванной механически индуцированным микроповреждением матрикса.
При выполнении этих экспериментов важно не допустить пересыхания ассамблоида. Здесь они были заключены в автоклавную и смачиваемую бумагу, но другие методы также могли быть жизнеспособными в зависимости от их совместимости с используемым устройством для растяжения. Поскольку трение между металлическими зажимами и стержневым эксплантом ограничено, добавьте небольшие кусочки бумаги между металлом и стержневым эксплантом во время зажима, чтобы предотвратить проскальзывание и внимательно следить за процессом растяжения, чтобы обнаружить и исключить соскальзывающие стержневые эксплантаты и сборки.
Компартмент-специфический транскриптомный и ассамблоидно-специфический анализ секретома (рис. 5 и рис. 6)
В первой серии экспериментов с монокультурой керна, представленных здесь, была проведена оценка стабильности экспрессии генов ядра после выделения экспланта, чтобы отделить изоляцию от экспериментальных эффектов (рис. 5А). Несмотря на то, что для получения точных выводов необходимо более высокое число репликаций, экспрессия Vegfa и Mmps сильно увеличилась в свежеизолированных стержневых эксплантах в течение нескольких часов после выделения эксплантов при культивировании в условиях пораженной ниши (37 °C, 20%O2).
Неоваскуляризация является центральным признаком заболевания и восстановления сухожилий, который может быть частично обусловлен эндотелиальными клетками, активированными проангиогенными факторами (например, фактором роста эндотелия сосудов, Vegfa), секретируемыми ядром сухожилия при гипоксии88. При изучении первого этапа этого потенциального перекрестного взаимодействия (рис. 5B) было обнаружено, что экспрессия как Vegfa, так и маркера гипоксии карбоангидразы 9 (Ca9) была статистически значимой у эксплантов, монокультивируемых при низком кислородном напряжении (3%O2), в отличие от эксплантов, культивируемых при высоком кислородном напряжении (20% O2). Между тем, более низкое напряжение кислорода, по-видимому, не вызывало изменений в экспрессии маркеров фибробластов сухожилий, таких как склеракс (Scx) и коллаген-1 (Col1a1). Вместе эти результаты идентифицируют центральные резидентные клетки как вероятных участников проангиогенной передачи сигналов в гипоксической нише.
Далее оценивали активацию эндотелиальных клеток проангиогенной сигнализацией ядра в кокультуре ядра // эндотелиальных клеток при высоком (20%О2) и низком (3%О2) напряжении кислорода. К счастью, модульный состав ассамблоидов позволяет проводить компарт-специфический анализ транскриптома после культивирования, физически отделяя основной эксплант от внешнего гидрогеля коллагена (рис. 6A). В экспланте керна (рис. 6D) экспрессия Vegfa снова увеличилась при низком напряжении кислорода, хотя влияние на другие гипоксические маркеры, такие как Fgf2 , было менее ясным и требует более высоких показателей репликации для точных выводов. Кроме того, экспрессия провоспалительных маркеров, таких как Tnf-α , и маркеров деградации внеклеточного матрикса, таких как Mmp3 , была снижена в ядре при низком напряжении кислорода. Во внешнем гидрогеле, первоначально засеянном эндотелиальными клетками (рис. 6E), присутствие живого стержневого экспланта (aC) снижало экспрессию Vegfa при низком напряжении кислорода, но не при высоком напряжении кислорода. Кроме того, наличие девитализированного (dC) экспланта ядра при низком напряжении кислорода также не снижало экспрессию Vegfa . При низком напряжении кислорода экспрессия Tnf-α во внешнем гидрогеле была сопоставима в районе aC/dC, но увеличивалась при высоком напряжении кислорода вокруг живых эксплантов ядра. Экспрессия Fgf2 была снижена во всех условиях по сравнению с внешним эндотелиальным гидрогелем, культивируемым вокруг девитализированного стержневого экспланта при высоком напряжении кислорода, но в большинстве случаев при низком напряжении кислорода. Экспрессия Mmp3 была самой высокой вокруг живых эксплантов ядра при высоком напряжении кислорода и самой низкой вокруг девитализированных эксплантов ядра при низком напряжении кислорода. В целом, совместно культивируемые эндотелиальные клетки, по-видимому, реагируют как на активный эксплант ядра, который способен инициировать перекрестные помехи, так и на вариации уровня кислорода. Более всесторонний анализ транскриптома облегчил бы выяснение их соответствующего вклада.
Модульность ассамблоидной системы позволяет интегрировать генетически модифицированные клетки, содержащие флуоресцентные репортерные гены. Здесь эндотелиальные клетки, выделенные от мышей Pdgfb-iCreER mG89 , были высеяны в компартмент гидрогеля. Эти клетки совместно экспрессируют эндотелиальный клеточный маркер, субъединицу тромбоцитарного фактора роста b (Pdgfb) вместе с усиленным зеленым флуоресцентным белком (EGFP), благодаря которому эндотелиальные клетки, экспрессирующие Pdgfb, выглядят зелеными под микроскопом (рис. 6C). С помощью этого метода было подтверждено, что присутствие эндотелиальных клеток, экспрессирующих Pdgfb, сохраняется в культуре в течение 7 дней (37 °C) и, по-видимому, не зависит от напряжения кислорода (20% O2 по сравнению с 3% O2).
Для анализа секретома ассамблоидов питательную среду, используемую соответственно для ядра // бесклеточного и стержневого // фибробластов, ядра // макрофага или ядра // эндотелиальных клеток, заменяли его безсывороточным аналогом за три дня до аспирации и замораживания надосадочной жидкости, теперь обогащенной секретомом (рис. 6А). Это время обогащения было достаточным для обнаружения цитокинов, таких как фактор роста эндотелия сосудов (VEGF), с помощью анализа MSD, как показано здесь для эксплантов ядра и ассамблоидов керна // фибробластов, культивируемых в условиях пораженной ниши (рис. 6B).
Важные соображения при анализе секретомов и транскриптомов стержневых эксплантов и ассамблоидов касаются использования надлежащих средств контроля. Свежеизолированные стержневые экспланты имеют ограниченную ценность, так как их экспрессия Vegfa и Mmps сильно возрастает в течение нескольких часов после выделения (рис. 5A). Подобранные по времени экспланты, окруженные изначально бесклеточным гидрогелем, больше подходят в качестве контроля экспрессии гена основного компартмента. Что касается внешнего гидрогеля, то нагруженные клетками гидрогели, культивируемые без стержневого экспланта, являются худшими контрольными группами по сравнению с нагруженными клетками гидрогелями, культивируемыми вокруг девитализированных эксплантов ядра (Дополнительный файл 7), главным образом потому, что они уплотняются в округлые формы вместо удлиненных гидрогелей, что значительно изменяет морфологию клеток (Рисунок 3А).
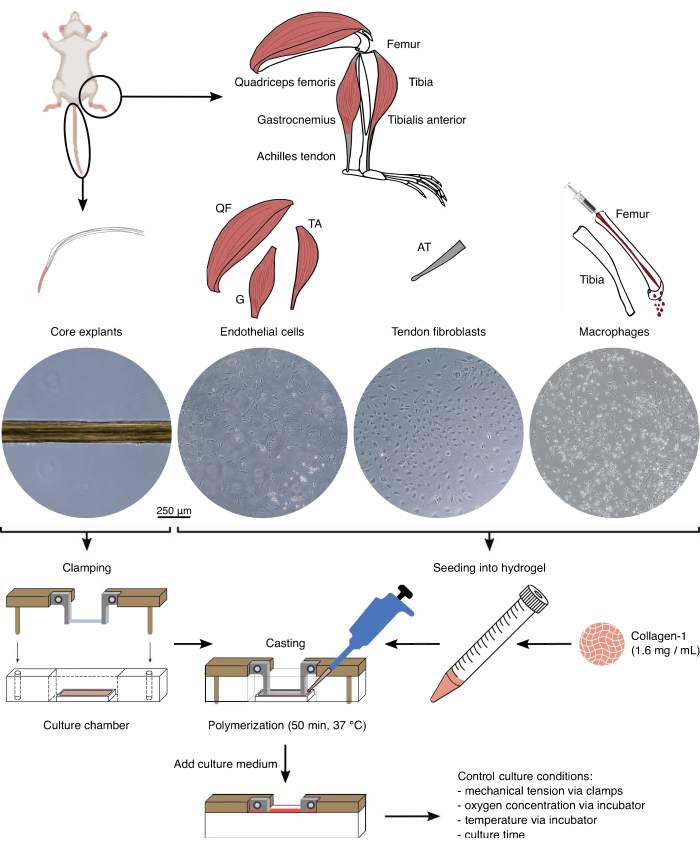
Рисунок 1: Изоляция и сборка компонентов сборки для моделирования перекрестных помех in vivo . Экспланты сухожильного ядра извлекали из мышиных хвостов, разрезали и зажимали. Мышцы ног мышей (т.е. четырехглавая мышца бедра (QF), икроножная мышца (G) и передняя большеберцовая мышца (TA)) были переварены для выделения эндотелиальных клеток, которые затем культивировались на пластике культуры тканей. Ахилловы сухожилия (АТ) также были расщеплены для выделения фибробластов сухожилий, которые затем культивировались на тканевой культуре пластика. Костный мозг из большеберцовой и бедренной костей был вымыт из костей. Затем выделенные моноциты культивировали на культуре тканей и дифференцировали в наивные макрофаги. Изображения световой микроскопии (10x) показывают появление стержневых эксплантов, эндотелиальных клеток, фибробластов сухожилий и макрофагов непосредственно перед их интеграцией в ассамблоиды. Во время сборки клетки, культивируемые на пластике, помещали в суспензию, а затем помещали в раствор коллагена-1 (1,6 мг/мл). Затем клеточно-гидрогелевую смесь отливали вокруг зажатого стержневого экспланта и полимеризовали в течение 50 мин при 37 °С перед добавлением питательной среды. Условия культивирования контролировались с помощью зажимов (механическое натяжение) и настроек инкубатора (концентрация кислорода, температура). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
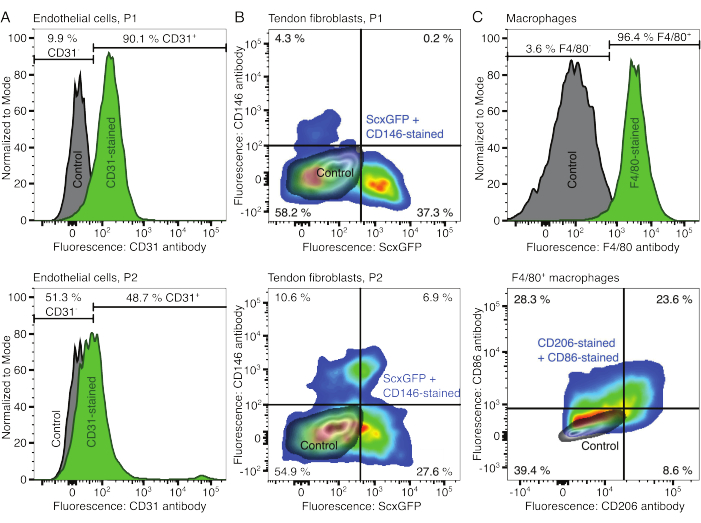
Рисунок 2: Характеристика компонентов клеточного ассамблоида. (A) Репрезентативный проточный цитометрический анализ эндотелиальных клеток мышечного происхождения после одного пассажа (P1, верхний ряд) и двух пассажей (P2, нижний ряд). Количество неокрашенных (серый) и CD31-окрашенных (зеленый) клеток было нормализовано до модальных. Процентное соотношение приведено для CD31-окрашенной группы. (B) Репрезентативный проточный цитометрический анализ фибробластов, полученных из ахиллова сухожилия, после одного пассажа (P1, верхний ряд) и двух пассажей (P2, нижний ряд). Оси сообщают об интенсивности флуоресценции неокрашенных клеток (серый цвет) и клеток, экспрессирующих ScxGFP и окрашенных антителами CD146 (цвета радуги). (C) Репрезентативный проточный цитометрический анализ макрофагов костного мозга после культивирования. В верхнем ряду подсчеты для неокрашенных (серый) и окрашенных F4/80 (зеленый) клеток были нормализованы к модальным. Процентное соотношение приведено для группы, окрашенной F4/80. На графике в нижней строке показана интенсивность флуоресценции неокрашенных клеток (серый цвет) и подмножества F4/80+ клеток, окрашенных антителами к CD206 и CD86 (цвета радуги). Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
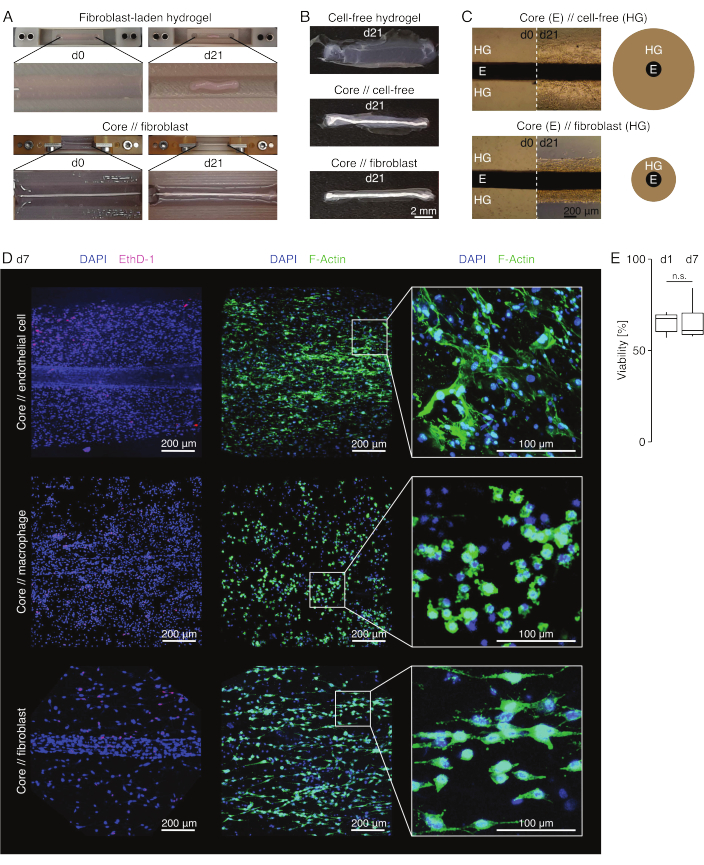
Рисунок 3: Ассамблоидная визуализация и внешний вид. (A) Репрезентативные фотографии, сделанные на 0-й день (d0) и 21-й день (d21) культивирования (37 °C, 20%O2), показывают многомерное сжатие гидрогеля, содержащего внешние фибробласты, без встроенного стержневого экспланта и сильное радиальное уплотнение гидрогеля, содержащего внешние фибробласты, вокруг стержневого эксплантата. (B) На репрезентативных фотографиях, сделанных на 21-й день (d21) культивирования (37 °C, 20%O2), видны различия в скорости уплотнения между бесклеточными гидрогелями, отлитыми вокруг стержневого эксплантата, и гидрогелями, нагруженными фибробластами сухожилий, отлитыми вокруг стержневого эксплантата. (C) Репрезентативные изображения световой микроскопии (10x), сделанные на 0-й день (d0) и 21-й день (d21) культивирования (37 °C, 20%O2), указывают на продольные изменения в присутствии клеточных популяций и скорости уплотнения гидрогеля коллагена (HG) вокруг экспланта ядра (E) в кокультуре ядра // бесклеточной и стержневой // ассамблоидной культуры фибробластов. На схематическом изображении показаны различия в уплотнении гидрогеля между керном // бесклеточным ассамблоидом и стержнем // кокультурой фибробластов. (D) Репрезентативные конфокальные микроскопические изображения, полученные на 7-й день (d7) ядра // эндотелиальной клетки, ядра // макрофага и ядра // кокультуры фибробластов (37 °C, 20 % O2). На изображениях в левом ряду изображены ассамблоиды с клеточными ядрами, окрашенными в синий цвет (DAPI), и мертвыми клетками, окрашенными в розовый цвет (Ethidium homodimer-1). В двух других рядах изображены ассамблоиды с клеточными ядрами, окрашенными в синий цвет (DAPI), и актиновыми филаментами, окрашенными в зеленый цвет (F-актин). (E) Блочные диаграммы, показывающие количественную жизнеспособность основных // эндотелиальных клеточных ассамблоидов на 1-й день (d1) и 7-й день (d7) совместной культуры. N = 5. Верхний и нижний шарниры соответствуют первому и третьему квартилям (25-му и75-му процентилям), а средний — медиане. Усы простираются от верхнего/нижнего шарнира до наибольшего/наименьшего значения не далее чем в 1,5 раза больше межквартильного диапазона. P-значения: n.s.p > 0,05. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
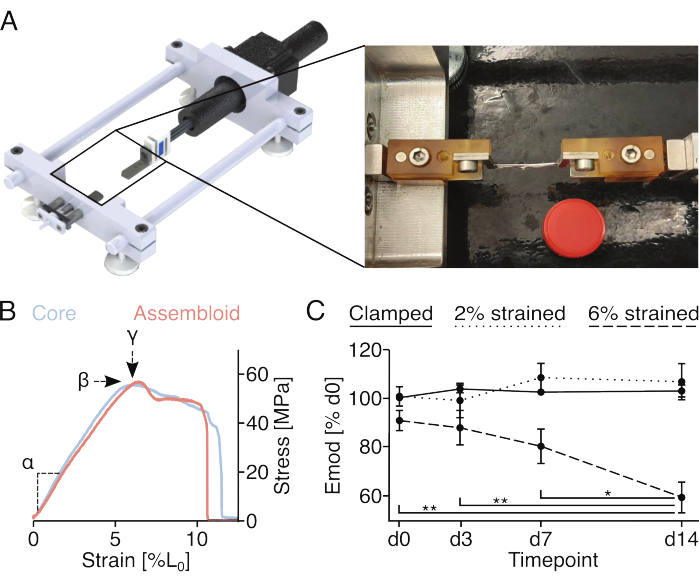
Рисунок 4: Механическая стимуляция ассамблоидов и измерение механических свойств ассамблоидов. (A) Графическое изображение изготовленного по индивидуальному заказу растягивающего устройства, состоящего из платформ зажимных держателей, датчика усилия и шагового двигателя. На фотографическом изображении показан ассамблоид, прикрепленный к растягивающему устройству с помощью зажимов. Крышка пластиковой пробирки объемом 15 мл (Ø: 17 мм) используется для накипи. (B) График, показывающий репрезентативные кривые напряжения/деформации для стержневых эксплантов (светло-синий) и ассамблоидов (светло-красный). Линейный модуль упругости (α), максимальное напряжение (β) и максимальная деформация (у) могут быть извлечены из данных для механической характеристики стержневого экспланта или сборки. (C) График, показывающий линейный модуль упругости (Emod) ядра // эндотелиальных клеточных ассамблоидов, культивируемых совместно (29 °C, 3%O2) в течение 14 дней после того, как их зажали (сплошная линия), зажали и растянули до деформации 2%L0 (пунктирная линия) или зажали и растянули до деформации 6%L0 (пунктирная линия) в начале эксперимента. N = 5. Точки данных были нормализованы к начальному модулю линейной упругости до растяжения и отображаются в виде среднего значения (±sem). P-значения: *p < 0,05, **p < 0,01. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
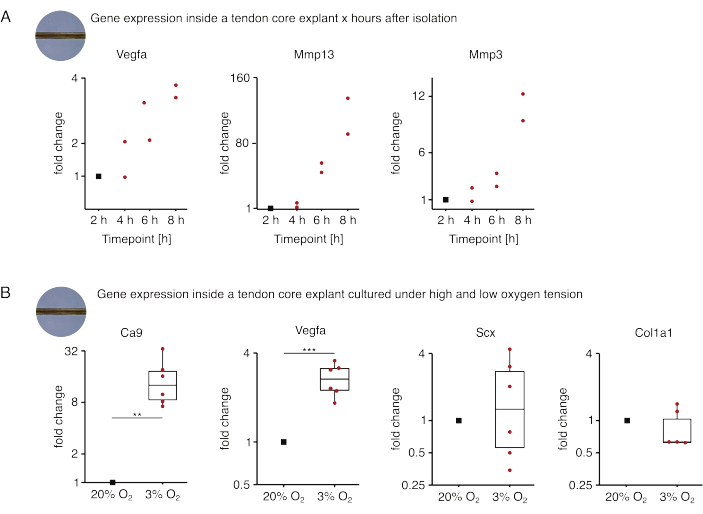
Рисунок 5: Изменения транскриптома ядра после выделения и культивирования в различных нишевых условиях. (A) Диаграмма рассеяния, показывающая складчатые изменения экспрессии генов Vegfa, Mmp13 и Mmp3 в монокультивируемых (37 °C, 20% O2) мышиных стержнях через 2 ч, 4 ч, 6 ч и 8 ч после их выделения из хвоста. Изменения складок в соответствующие моменты времени нормализовали к экспрессии гена через 2 часа после выделения. N = 2. (B) Коробчатые диаграммы, показывающие изменения в экспрессии генов Ca9, Vegfa, Scx и Col1a1 в основных эксплантах, нормализованных монокультивируемых при низком кислородном напряжении (3% O2), нормализованы и сравнены с эксплантами, культивируемыми при высоком кислородном напряжении (20% O2). N = 5-6. Верхний и нижний шарниры ящичковых диаграмм соответствуют первому и третьему квартилям (25-му и75-му процентилям), а средний — медиане. Усы простираются от верхнего/нижнего шарнира до наибольшего/наименьшего значения не далее чем в 1,5 раза больше межквартильного диапазона. Точки данных, используемые для нормализации, отображаются черными точками, а отдельные точки данных — красными. P-значения: **p < 0,01, ***p < 0,001. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
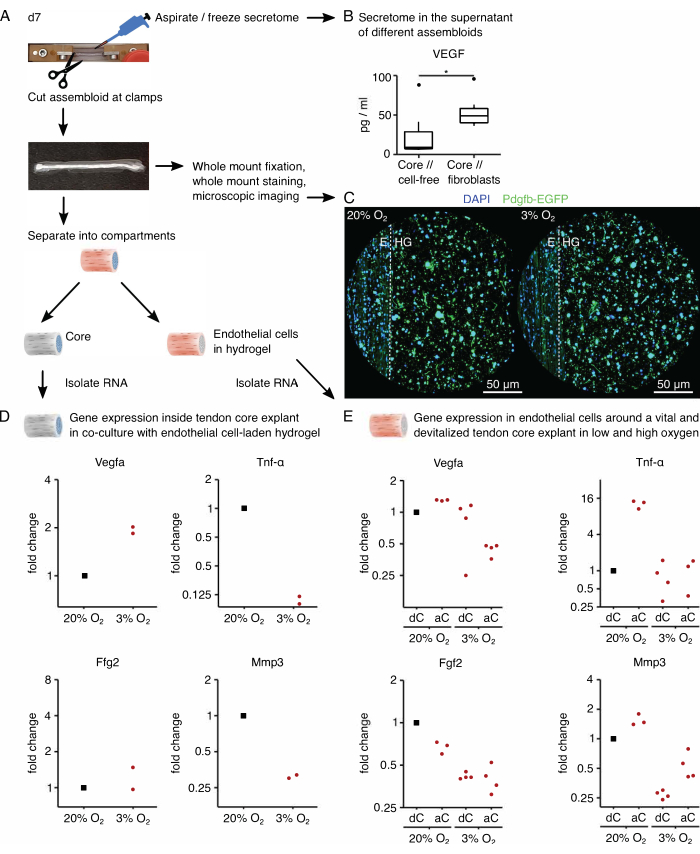
Рисунок 6: Ассамблоид-специфичный секретом и компарт-специфический транскриптомный анализ. (A) Репрезентативная фотография, показывающая ассамблоид на 7-й день (d7), когда были взяты образцы секретома и транскриптома, и изображение лежащего в основе рабочего процесса. (B) Концентрация VEGF (пг/мл) в надосадочной жидкости ядра // бесклеточных и стержневых // ассамблоидов фибробластов после 7 дней совместного культивирования (37 °C, 20% O2), изображенных в виде коробчатых диаграмм. N = 6. (C) Репрезентативные изображения конфокальной микроскопии ядра // эндотелиальных клеточных ассамблоидов после 7 дней совместного культивирования (37 °C) при высоком кислородном напряжении (20%O2) и низком кислородном напряжении (3%O2). Клеточные ядра окрашиваются в синий цвет (DAPI), а встроенные эндотелиальные клетки совместно экспрессируют усиленный зеленый флуоресцентный белок (EGFP) вместе с субъединицей b тромбоцитарного фактора роста эндотелиальных клеток (Pdgfb). Пунктирной линией показана компартментарная граница между стержневым эксплантом (E) и эндотелиальным гидрогелем (HG). (D) Диаграмма рассеяния, показывающая изменения экспрессии генов Vegfa, Tnf-α, Fgf2 и Mmp3 в основном компартменте из ядра // ассамблоиды эндотелиальных клеток, совместно культивируемые при низком напряжении кислорода (3% O2), нормализованы и сравнены с теми, которые культивируются при высоком напряжении кислорода (20% O2). N = 2. (E) Диаграмма рассеяния, показывающая изменения в экспрессии генов Vegfa, Tnf-α, Fgf2 и Mmp3 во внешнем компартменте ядра // эндотелиальных клеточных ассамблоидов с живым ядром (aC) или девитализированным ядром (dC), совместно культивируемых при высоком кислородном напряжении (20%O2) и низком напряжении кислорода (3%O2). Изменения складок в соответствующих условиях нормализованы к внешнему компартменту ядра // эндотелиального клеточного ассамблоида с девитализированным ядром (dC), совместно культивируемым под высоким кислородным давлением (20%O2). N = 3-4. В В верхний и нижний шарниры ящичковых диаграмм соответствуют первому и третьему квартилям (25-му и75-му процентилям), а средний — медиане. Усы простираются от верхнего/нижнего шарнира до наибольшего/наименьшего значения не далее 1,5-кратного межквартильного диапазона. Выбросы изображаются в виде черных точек. P-значения: *p < 0,05. В формах D и E точки данных, используемые для нормализации, отображаются черными точками, а отдельные точки данных — красными точками. Пожалуйста, нажмите здесь, чтобы увидеть увеличенную версию этого рисунка.
Таблица 1: Требования к входным данным для систем моделирования заболеваний и травм сухожилий. Список первичных триггеров заболевания сухожилий и вторичных драйверов, сопоставленных с выбором входных параметров, трактовка которых является центральной для моделирования заболеваний и травм сухожилий. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Таблица 2: Требования к выходным данным для систем моделирования заболеваний и травм сухожилий. Выборка признаков заболевания сухожилий сопоставлена с выбором выходных параметров, количественная оценка которых является центральной для интерпретации поведения модели заболевания сухожилий и травмы. Пожалуйста, нажмите здесь, чтобы скачать эту таблицу.
Дополнительный файл 1: файл .stl для держателей зажимов, монтажной станции и камерных пресс-форм. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 2: План правого зажимного держателя. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 3: План держателя левого зажима. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 4: План монтажной платформы Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 5: План металлических хомутов. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 6: Изображение, показывающее бесклеточную усадку гидрогеля. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Дополнительный файл 7: Изображение, показывающее девитализированную эксплантацию керна. Пожалуйста, нажмите здесь, чтобы скачать этот файл.
Обсуждение
В целом, представленная здесь система ассамблоидных моделей имеет несколько важных этапов, которые следует выделить. Во-первых, модельная система хороша настолько, насколько хороши ее компоненты. Очень важно проверить под микроскопом стержневую эксплантацию и клеточные популяции, которые будут засеяны, прежде чем начинать процесс сборки. Не менее важно хотя бы один раз верифицировать фенотип изолированных клеточных популяций с помощью проточной цитометрии. Особенно при первом использовании новой партии коллагена-1 полезно проверить скорость сшивания в пробном запуске, прежде чем встраивать в него клетки. Сборка сборки требует большого количества ручных манипуляций, что повышает риск инфекций. Чтобы свести к минимуму риск заражения, работайте в стерильном биозащитном колпаке с ламинарным потоком воздуха, часто меняйте перчатки и дезинфицируйте перчатки, а также рабочее пространство 80% этиловым спиртом. По тем же причинам не используйте держатели зажимов, напечатанные на 3D-принтере, более одного раза. Перед самим процессом встраивания важно держать все компоненты гидрогеля (раствор сшивания, раствор коллагена-1) на льду, чтобы предотвратить преждевременное сшивание. Следовательно, после добавления клеток в сшивающий раствор необходимо работать быстро, чтобы ограничить гибель клеток из-за высокого pH и низкой температуры сшивающего раствора. Чтобы предотвратить гибель клеток в стержневом эксплантате, связанную с высыханием, аспирируйте среду, покрывающую зажатые стержневые эксплантаты, непосредственно перед смешиванием сшивающего раствора с раствором коллагена-1. Чтобы гарантировать центральное размещение стержневого экспланта в гидрогеле, идеально отливать гидрогель вокруг слегка натянутого стержневого эксплантата. Для этого используйте установочный штифт и винт-болт M3 x 16 мм, чтобы зафиксировать держатели зажимов на (напечатанном на 3D-принтере) наборе пластин с отверстиями соответствующей длины. По истечении 50-минутного времени полимеризации эксплант встроенного стержня может быть снова натянут в зависимости от желаемых условий культивирования. Степень напряжения, испытываемого ассамблоидом во время культивирования, оказывает глубокое влияние на результаты экспериментов и должна быть одинаковой для всех образцов и условий21.
Тем не менее, большое влияние механического (не)нагружения на результаты эксперимента является основным преимуществом ассамблоидной модели перед большинством тканеинженерных альтернатив, особенно с учетом того, что поддерживаемый матричный состав стержневого экспланта должен также воссоздавать сложные паттерны нагрузки in vivo на клеточном уровне90. В то время как на практике до сих пор было продемонстрировано только измерение линейного модуля упругости, максимальной растягивающей деформации и максимального растягивающего напряжения ассамблоидов, протоколы для измерений усталостной прочности и релаксации напряжений были описаны для эксплантов сердечника сухожилия в других местах и должны быть применимы к ассамблоидам91,92. В дополнение к схемам нагружения, подобным in vivo, многоуровневая модульность ассамблоида, вероятно, является его самым большим преимуществом. Благодаря индивидуальным культуральным камерам для каждого образца можно установить контролируемый набор нишевых условий (например, температура, напряжение кислорода, концентрация глюкозы, добавки, стимуляторы, ингибиторы и статическое растяжение планшетом). Во-вторых, жесткость матрицы и матричный состав внешнего компартмента настраиваются с помощью гидрогелевого состава и позволяют, например, изучать влияние все более больного тканевого микроокружения путем включения большего количества коллагена-3 и клеточного фибронектина 93,94,95. Оцененные клеточные популяции во внешнем компартменте легко адаптируются путем выбора клеток для посева, но также могут быть модифицированы в экспланте сухожильного ядра путем использования установленных генетически модифицированных клеточных линий и мышиных линий (т.е. истощение клеток ScxLin)96. Различия в матриксе и клеточном составе двух компартментов дополнительно обеспечивают уникальную компартментализированную 3D-структуру, которая является еще одним центральным признаком сухожилия 1,30,46.
При использовании этой системы важно учитывать последствия модульности системы для детализации параметров результата. В то время как пролиферация и рекрутирование клеток могут быть оценены для каждого компартмента отдельно, механические свойства, компоненты секретома и продукты деградации в настоящее время могут быть измерены только для всей совокупности. Что касается производительности, то один специально обученный человек может подготовить до 50 сборок за обычный рабочий день, при этом основным узким местом является процедура зажима. Несмотря на то, что некоторые из методов считывания являются взаимоисключающими, можно многократно оценивать механические свойства и компоненты секретома на одном и том же образце, а также состав клеточной популяции (проточная цитометрия), клеточный транскриптом (ОТ-кПЦР, РНК-секвенирование) или матрикс и распределение клеток (иммуноцитохимия/флуоресцентная микроскопия) в конечных точках. В предыдущих публикациях эти методы были использованы для обширной характеристики межклеточных, кросс-компартментных взаимодействий в ядре // фибробластах и ядро // ассамблоидах макрофагов, подверженных воздействию пораженной ниши 84,85. В данной работе была исследована способность ассамблоидной модельной системы исследовать кросс-компартментарное взаимодействие между ядром и внешними эндотелиальными клетками при различных стимулах микросреды.
Модульность модельной системы позволяет в будущем совершенствовать метод, что необходимо для преодоления следующих ограничений текущей итерации проекта. Анализ проточной цитометрии, представленный в этой работе, и данные секвенирования РНК отдельных клеток, опубликованные недавно, показали, что популяции теноцитов, происходящих из сухожилий, и популяции, полученные из ахиллова сухожилия, более неоднородны, чем предполагалось ранее 24,34,59,84,97. Кроме того, миграционное поведение первоначально резидентных популяций клеток ядра или гидрогеля размывает ассамблоидную компартментализацию во время культивирования. Оба фактора вместе затрудняют отнесение транскриптомных различий к конкретным типам клеток и отделение процессов пролиферации от процессов, основанных на миграции. Это ограничение может быть преодолено путем уточнения входной популяции с помощью флуоресцентно-активируемой сортировки клеток (FACS) на основе клеточного состава здоровых или больных сухожилий, охарактеризованного в недавних исследованиях in vivo, улучшения считывания за счет внедрения секвенирования одноклеточной РНК и интеграции маркеров пролиферации, таких как окрашивание EdU (5-этинил-2'-дезоксиуридин) во время микроскопии.
Ассамблоиды, представленные здесь, также имеют общий недостаток с большинством доступных в настоящее время систем in vitro, которые имитируют больные органы, отделенные отостальной части тела. Тем не менее, используемая здесь платформа на основе культуральной камеры хорошо позиционирует модельную систему для интеграции в мультиорганную платформу, где соединяются ассамблоиды, имитирующие различные органы, и могут быть изучены межорганные взаимодействия.
По своей сути модельная система основана на позиционных сухожилиях грызунов, что приводит к собственному уникальному набору недостатков. Во-первых, переводимость результатов затруднена тем, что мыши дикого типа не развиваются или страдают от заболеваний сухожилий 8,100,101. Интеграция тканей и клеток человека или недавно разработанных линий мышей, которые демонстрируют аспекты заболевания сухожилий, может облегчитьэту проблему. Переход к ассамблоиду, основанному на человеке, особенно интересен, поскольку он позволит проводить исследования с тканями, полученными от пациентов из различных заболеваний сухожилий (например, тендинита, тендиноза или перитендинита) и даже с устойчивыми к лечению донорами, что может открыть более персонализированные программы лечения. Во-вторых, эксплантаты сухожилий хвоста мышей не особенно хорошо справляются с микроповреждениями, вызванными перегрузкой, что ограничивает применимость модельной системы для изучения острого повреждения сухожилий.
По всем этим причинам ассамблоиды эксплантов // гидрогеля находятся в отличном положении для изучения биологии сухожилий, структурно-функциональных взаимодействий матрицы и кросс-компартментальных взаимодействий между конкретными клеточными популяциями в ответ на микроповреждения, индуцированные нишей. Информация, полученная в результате этих довольно высокопроизводительных исследований, может дать направление исследованиям и разработке методов лечения in vivo .
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была профинансирована грантом ETH 1-005733
Материалы
| Name | Company | Catalog Number | Comments |
| 0.4 mm x 25 mm injection needle (G27) | Sterican | 9186174 | |
| 3D printing filament: Clear polylactic acid prusament | Prusa | NA | |
| 4% formaldehyde | Roti-Histofix | P087.4 | |
| Accutase cell detachment solution | Sigma-Aldrich | A6964-100ML | |
| Amphotericin | VWR | L0009-100 | |
| Attachable digital C-mount camera: Moticam 2 | Motic | NA | |
| Bolt screw M3 x 16 mm, stainless steel | RS PRO | 1871235 | |
| Bolt screw M3 x 6 mm, stainless steel | RS PRO | 1871207 | |
| CaCl2 | Sigma-Aldrich | C5670 | |
| CD146 antibody: PE anti-mouse | BioLegend | 134703 | |
| CD206 antibody: Alexa Fluor 488 anti-mouse | BioLegend | 141709 | |
| CD31 antibody: Alexa Fluor 488 anti-mouse | BioLegend | 102413 | |
| CD86 antibody: PE anti-mouse | BioLegend | 105007 | |
| Collagenase I | Thermo Fisher Scientific | 17100017 | |
| Collagenase IV | Gibco | 17104-019 | |
| Dialyzed Fetal Bovine Serum (FBS) | Sigma-Aldrich | F0392-100ML | |
| Dimethyl sulfoxide (DMSO) | Sigma-Aldrich | 7000183 | |
| Dispase II | Sigma-Aldrich | D4693-1G | |
| DMEM/F12 | Sigma | 7002211 | |
| Dowel Pin, 3 mm x 16 mm, stainless steel | Accu | HDP-3-16-A1 | |
| Dragon Skin 10 Slow/1 silicone | KauPO | 09301-004-000001 | |
| Endopan 3 Kit | Pan-Biotech | P04-0010K | |
| Endothelial cell growth supplement | Lonza | CC-3162 | |
| Eppendorf safe-lock plastic tubes (1.5 mL) | Eppendorf | 30121023 | |
| Ethidium homodimer, EthD-1, 2 mM stock in DMSO | Sigma-Aldrich | 46043-1MG-F | |
| F4/80 antibody: Apc/fire 750 anti-mouse | BioLegend | 123151 | |
| Falcon plastic tube (15 mL) | Corning | 352096 | |
| Falcon plastic tube (50 mL) | Corning | 352070 | |
| Flow cytometer: LSR II Fortessa | BD Bioscience | 23-11617-02 | |
| Gelatin | Invitrogen | D12054 | |
| Hellmanex III alkaline cleaning concentrate | Sigma | Z805939-1EA | |
| Heparin | Sigma-Aldrich | H3149-10KU | |
| Hydroxyproline assay | Sigma-Aldrich | MAK008 | |
| Image analysis software: Motic Images Plus 3.0 ML | Motic | NA | |
| L-Ascorbic Acid Phosphate Magnesium Salt n-Hydrate | Wako Chemicals | 013-19641 | |
| LSE Low Speed Orbital Shaker | Corning | 6780-FP | |
| MEM non-essential amino acids | Sigma | 7002231 | |
| Mouse macrophage-stimulating factor (m-CSF) | PeproTech | 315-02-50ug | |
| MSD assay | Mesoscale Discovery | various | |
| NucBlue | Thermo Fisher Scientific | R37605 | |
| Nylon mesh strainer cap, 100 µm | Corning | 734-2761 | |
| Original Prusa i3 MK3S 3D printer | Prusa | i3 MK3S | |
| Penicillin-Streptomycin | Sigma-Aldrich | P4333 | |
| Phosphate-buffered saline (PBS), ph 7.4, sterile, 10 L | Gibco | 10010001 | |
| Puromycin | Gibco | A1113803 | |
| RBC lysis buffer | VWR | 786-650 | |
| recombinant m-CSF | PeproTech | 315-02 | |
| RNA extraction kit: Rneasy plus Micro | Qiagen | 74034 | |
| Slicing software: PrusaSlicer | Prusa | NA | Version 2.6.0 or higher |
| Sterile Cell Strainer 100 µm | Fisherbrand | 22363549 | |
| Surgical scalpel blade No. 21 | Swann-Morton | 307 | |
| Trizol reagent | Thermo Fisher Scientific | 15596018 | |
| Trypsin-EDTA (0.5 %) | Gibco | 15400054 |
Ссылки
- Snedeker, J. G., Foolen, J. Tendon injury and repair - A perspective on the basic mechanisms of tendon disease and future clinical therapy. Acta Biomaterialia. 63, 18-36 (2017).
- Wang, J. H. C. Mechanobiology of tendon. Journal of Biomechanics. 39 (9), 1563-1582 (2006).
- Kirkendall, D. T., Garrett, W. E. Function and biomechanics of tendons. Scandinavian Journal of Medicine and Science in Sports. 7 (2), 62-66 (1997).
- Götmark, F., Cafaro, P., O'Sullivan, J. Aging human populations: Good for us, good for the earth. Trends in Ecology and Evolution. 33 (11), 851-862 (2018).
- Maffulli, N., Wong, J., Almekinders, L. C. Types and epidemiology of tendinopathy. Clinics in Sports Medicine. 22 (4), 675-692 (2003).
- Renström, P. A. F. H., Woo, S. L. -. Y. Tendinopathy: A major medical problem in sport. Tendinopathy in Athletes. , (2007).
- Screen, H. R. C., Birk, D. E., Kadler, K. E., Ramirez, F., Young, M. Tendon functional extracellular matrix. Journal of Orthopaedic Research. 33 (6), 793-799 (2016).
- Wunderli, S. L., Blache, U., Snedeker, J. G., Wunderli, S. L., Blache, U., Tendon, J. G. S. Tendon explant models for physiologically relevant in vitro study of tissue biology - a perspective. Connective Tissue Research. 61 (3-4), 262-277 (2020).
- Magnusson, S. P., Langberg, H., Kjaer, M. The pathogenesis of tendinopathy: balancing the response to loading. Nature Reviews Rheumatology. 6 (5), 262-268 (2010).
- Heinemeier, K. M., Schjerling, P., Øhlenschlæger, T. F., Eismark, C., Olsen, J., Kjær, M. Carbon-14 bomb pulse dating shows that tendinopathy is preceded by years of abnormally high collagen turnover. FASEB Journal. 32 (9), 4763-4775 (2018).
- Andersson, G., Backman, L. J., Scott, A., Lorentzon, R., Forsgren, S., Danielson, P. Substance P accelerates hypercellularity and angiogenesis in tendon tissue and enhances paratendinitis in response to Achilles tendon overuse in a tendinopathy model. British Journal of Sports Medicine. 45 (13), 1017-1022 (2011).
- Rolf, C. G., Fu, B. S. C., Pau, A., Wang, W., Chan, B. Increased cell proliferation and associated expression of PDGFRβ causing hypercellularity in patellar tendinosis. Rheumatology. 40 (3), 256-261 (2001).
- Riley, G. The pathogenesis of tendinopathy. A molecular perspective. Rheumatology. 43 (2), 131-142 (2004).
- Jarvinen, M., Jozsa, L., Kannus, P., Järvinen, T. L., Kvist, M., Leadbetter, W. Histopathological findings in chronic tendon disorders. Scandinavian Journal of Medicine & Science in Sports. 7 (2), 86-95 (1997).
- Soslowsky, L. J., et al. Overuse activity injures the supraspinatus tendon in an animal model: A histologic and biomechanical study. Journal of Shoulder and Elbow Surgery. 9 (2), 79-84 (2000).
- Tran, P. H. T., et al. Early development of tendinopathy in humans: Sequence of pathological changes in structure and tissue turnover signaling. FASEB Journal. 34 (1), 776-788 (2020).
- Theodossiou, S. K., Schiele, N. R. Models of tendon development and injury. BMC Biomedical Engineering. 1 (1), 1-24 (2019).
- Stauber, T., Blache, U., Snedeker, J. G. Tendon tissue microdamage and the limits of intrinsic repair. Matrix Biology. 85-86, 68-79 (2020).
- Wang, T., et al. In vitro loading models for tendon mechanobiology. Journal of Orthopaedic Research. 36 (2), 566-575 (2018).
- Fang, F., Sawhney, A. S., Lake, S. P. Different regions of bovine deep digital flexor tendon exhibit distinct elastic, but not viscous, mechanical properties under both compression and shear loading. Journal of Biomechanics. 47 (12), 2869-2877 (2014).
- Wunderli, S. L., et al. Tendon response to matrix unloading is determined by the patho-physiological niche. Matrix Biology. 89, 11-26 (2020).
- Wunderli, S. L., et al. Minimal mechanical load and tissue culture conditions preserve native cell phenotype and morphology in tendon - A novel ex vivo mouse explant model. Journal of Orthopaedic Research. 36 (5), 1383-1390 (2017).
- Arnoczky, S. P., Lavagnino, M., Egerbacher, M., Caballero, O., Gardner, K. Matrix metalloproteinase inhibitors prevent a decrease in the mechanical properties of stress-deprived tendons. The American Journal of Sports Medicine. 35 (5), 763-769 (2007).
- de Micheli, A. J., et al. Single-cell transcriptomic analysis identifies extensive heterogeneity in the cellular composition of mouse Achilles tendons. American Journal of Physiology - Cell Physiology. 319 (5), C885-C894 (2020).
- Arvind, V., Huang, A. H. Reparative and maladaptive inflammation in tendon healing. Frontiers in Bioengineering and Biotechnology. 9 (July), 1-16 (2021).
- Marsolais, D., Côté, C. H., Frenette, J. Neutrophils and macrophages accumulate sequentially following Achilles tendon injury. Journal of Orthopaedic Research. 19 (6), 1203-1209 (2001).
- Garcia-Melchor, E., et al. Novel self-amplificatory loop between T cells and tenocytes as a driver of chronicity in tendon disease. Annals of the Rheumatic Diseases. 80 (8), 1075-1085 (2021).
- Stolk, M., Klatte-Schulz, F., Schmock, A., Minkwitz, S., Wildemann, B., Seifert, M. New insights into tenocyte-immune cell interplay in an in vitro model of inflammation. Scientific Reports. 7 (1), 9801 (2017).
- Tempfer, H., Traweger, A. Tendon vasculature in health and disease. Frontiers in Physiology. 6, 330 (2015).
- Mienaltowski, M. J., Adams, S. M., Birk, D. E. Regional differences in stem cell/progenitor cell populations from the mouse achilles tendon. Tissue Engineering - Part A. 19 (1-2), 199-210 (2013).
- Sakabe, T., et al. Transcription factor scleraxis vitally contributes to progenitor lineage direction in wound healing of adult tendon in mice. Journal of Biological Chemistry. 293, (2018).
- Dyment, N. A., Hagiwara, Y., Matthews, B. G., Li, Y., Kalajzic, I., Rowe, D. W. Lineage tracing of resident tendon progenitor cells during growth and natural healing. PLoS One. 9 (4), e96113 (2014).
- Harvey, T., Flamenco, S., Fan, C. M. A Tppp3 + Pdgfra + tendon stem cell population contributes to regeneration and reveals a shared role for PDGF signalling in regeneration and fibrosis. Nature Cell Biology. 21 (12), 1490-1503 (2019).
- Zhang, J., et al. Characterization of the structure, vascularity, and stem/progenitor cell populations in porcine Achilles tendon (PAT). Cell and Tissue Research. 384 (2), 367-387 (2021).
- Tarafder, S., et al. Tendon stem/progenitor cells regulate inflammation in tendon healing via JNK and STAT3 signaling. FASEB Journal. 31 (9), 3991-3998 (2017).
- Lee, C. H., et al. Harnessing endogenous stem/progenitor cells for tendon regeneration Find the latest version Harnessing endogenous stem/progenitor cells for tendon regeneration. J Clin Invest. 125 (7), 2690-2701 (2015).
- Lui, P. P. Y., Chan, L. S., Cheuk, Y. C., Lee, Y. W., Chan, K. M. Expression of bone morphogenetic protein-2 in the chondrogenic and ossifying sites of calcific tendinopathy and traumatic tendon injury rat models. Journal of Orthopaedic Surgery and Research. 4, 27 (2009).
- Takeuchi, E., et al. Localization and expression of osteopontin in the rotator cuff tendons in patients with calcifying tendinitis. Virchows Archiv. 438 (6), 612-617 (2001).
- Kadler, K. E., Hill, A., Canty-Laird, E. G. Collagen fibrillogenesis: fibronectin, integrins, and minor collagens as organizers and nucleators. Current Opinion in Cell Biology. 20 (5), 495-501 (2008).
- Millar, N. L., et al. MicroRNA29a regulates IL-33-mediated tissue remodelling in tendon disease. Nature Communications. 6, 6774 (2015).
- Riley, G. P., Harrall, R. L., Constant, C. R., Chard, M. D., Cawston, T. E., Hazleman, B. L. Tendon degeneration and chronic shoulder pain: changes in the collagen composition of the human rotator cuff tendons in rotator cuff tendinitis. Annals of the Rheumatic Diseases. 53 (6), 359-366 (1994).
- Thorpe, C. T., Peffers, M. J., Simpson, D., Halliwell, E., Screen, H. R. C., Clegg, P. D. Anatomical heterogeneity of tendon: Fascicular and interfascicular tendon compartments have distinct proteomic composition. Scientific Reports. 6, 20455 (2016).
- Thorpe, C. T., et al. Distribution of proteins within different compartments of tendon varies according to tendon type. Journal of Anatomy. 229 (3), 450-458 (2016).
- Choi, H., et al. Heterogeneity of proteome dynamics between connective tissue phases of adult Tendon. eLife. 9, e55262 (2020).
- Spiesz, E. M., et al. Tendon extracellular matrix damage, degradation and inflammation in response to in vitro overload exercise. Journal of Orthopaedic Research. 33 (6), 889-897 (2015).
- Dyment, N. A., et al. The paratenon contributes to scleraxis-expressing cells during patellar tendon healing. PLoS One. 8 (3), e59944 (2013).
- Cadby, J. A., Buehler, E., Godbout, C., Van Weeren, P. R., Snedeker, J. G. Differences between the cell populations from the peritenon and the tendon core with regard to their potential implication in tendon repair. PLoS One. 9 (3), e92474 (2014).
- Huh, D., Hamilton, G. A., Ingber, D. E. From three-dimensional cell culture to organs-on-chips. Trends in Cell Biology. 21 (12), 745-754 (2011).
- Duval, K., et al. Modeling physiological events in 2D vs. 3D cell culture. Physiology. 32 (4), 266 (2017).
- Wang, J. H. C. Mechanobiology of tendon. Journal of Biomechanics. 39 (9), 1563-1582 (2006).
- Derwin, K. A., Soslowsky, L. J. A quantitative investigation of structure-function relationships in a tendon fascicle model. Journal of Biomechanical Engineering. 121 (6), 598-604 (1999).
- Herod, T. W., Veres, S. P. Development of overuse tendinopathy: A new descriptive model for the initiation of tendon damage during cyclic loading. Journal of Orthopaedic Research. 36 (1), 467-476 (2017).
- Andersen, M. B., Pingel, J., Kjær, M., Langberg, H. Interleukin-6: A growth factor stimulating collagen synthesis in human tendon. Journal of Applied Physiology. 110 (6), 1549-1554 (2011).
- Langberg, H., Rosendal, L., Kjær, M. Training-induced changes in peritendinous type I collagen turnover determined by microdialysis in humans. Journal of Physiology. 534 (1), 297-302 (2001).
- Zitnay, J. L., et al. Molecular level detection and localization of mechanical damage in collagen enabled by collagen hybridizing peptides. Nature Communications. 8, 14913 (2017).
- Hwang, J., et al. Molecular assessment of collagen denaturation in decellularized tissues using a collagen hybridizing peptide. Acta Biomaterialia. 53, 268-278 (2016).
- Lin, A. H., Zitnay, J. L., Li, Y., Yu, S. M., Weiss, J. A. Microplate assay for denatured collagen using collagen hybridizing peptides. Journal of Orthopaedic Research. 37 (2), 431-438 (2019).
- Blomgran, P., Blomgran, R., Ernerudh, J., Aspenberg, P. A possible link between loading, inflammation and healing: Immune cell populations during tendon healing in the rat. Scientific Reports. 6, 29824 (2016).
- Harvey, T., Flamenco, S., Fan, C. -. M. A Tppp3+Pdgfra+ tendon stem cell population contributes to regeneration and reveals a shared role for PDGF signalling in regeneration and fibrosis. Nature Cell Biology. 21 (12), 1490-1503 (2019).
- Pryce, B. A., Brent, A. E., Murchison, N. D., Tabin, C. J., Schweitzer, R. Generation of transgenic tendon reporters, ScxGFP and ScxAP, using regulatory elements of the scleraxis gene. Developmental Dynamics. 236 (6), 1677-1682 (2007).
- Godinho, M. S. C., Thorpe, C. T., Greenwald, S. E., Screen, H. R. C. Elastin is localised to the interfascicular matrix of energy storing tendons and becomes increasingly disorganised with ageing. Scientific Reports. 7 (1), 9713 (2017).
- Smith, M. M., et al. Modulation of aggrecan and ADAMTS expression in ovine tendinopathy induced by altered strain. Arthritis and Rheumatism. 58 (4), 1055-1066 (2008).
- Asundi, K. R., Rempel, D. M. MMP-1, IL-1β, and COX-2 mRNA expression is modulated by static load in rabbit flexor tendons. Annals of Biomedical Engineering. 36 (2), 237-243 (2008).
- Millar, N. L., et al. Inflammation is present in early human tendinopathy. American Journal of Sports Medicine. 38 (10), 2085-2091 (2010).
- Dakin, S. G., et al. Inflammation activation and resolution in human tendon disease. Science Translational Medicine. 7 (311), 311ra173 (2015).
- Jelinsky, S. A., Rodeo, S. A., Li, J., Gulotta, L. V., Archambault, J. M., Seeherman, H. J. Regulation of gene expression in human tendinopathy. BMC Musculoskeletal Disorders. 12, 86 (2011).
- Kannus, P., Józsa, L. Histopathological changes preceding spontaneous rupture of a tendon. A controlled study of 891 patients. The Journal of Bone and Joint Surgery. American. 73 (10), 1507-1525 (1991).
- Comin, J., et al. The prevalence and clinical significance of sonographic tendon abnormalities in asymptomatic ballet dancers: A 24-month longitudinal study. British Journal of Sports Medicine. 47 (2), 89-92 (2013).
- Schubert, T. E. O., Weidler, C., Lerch, K., Hofstädter, F., Straub, R. H. Achilles tendinosis is associated with sprouting of substance P positive nerve fibres. Annals of the Rheumatic Diseases. 64 (7), 1083-1086 (2005).
- Quigley, A. S., Bancelin, S., Deska-Gauthier, D., Légaré, F., Kreplak, L., Veres, S. P. In tendons, differing physiological requirements lead to functionally distinct nanostructures. Scientific Reports. 8 (1), 4409 (2018).
- Herod, T. W., Chambers, N. C., Veres, S. P. Collagen fibrils in functionally distinct tendons have differing structural responses to tendon rupture and fatigue loading. Acta Biomaterialia. 42, 296-307 (2016).
- Shepherd, J. H., Riley, G. P., Screen, H. R. C. Early stage fatigue damage occurs in bovine tendon fascicles in the absence of changes in mechanics at either the gross or micro-structural level. Journal of the Mechanical Behavior of Biomedical Materials. 38, 163-172 (2014).
- Birch, H. L. Tendon matrix composition and turnover in relation to functional requirements. International Journal of Experimental Pathology. 88 (4), 241-248 (2007).
- Kapałczyńska, M., et al. 2D and 3D cell cultures - a comparison of different types of cancer cell cultures. Archives of Medical Science. 14 (4), 910-919 (2018).
- Hussien, A. A., Niederoest, B., Bollhalder, M., Goedecke, N., Snedeker, J. G. The stiffness-sensitive transcriptome of human tendon stromal cells. Advanced Healthcare Materials. 12 (7), 2101216 (2023).
- Heo, S. J., et al. Aberrant chromatin reorganization in cells from diseased fibrous connective tissue in response to altered chemomechanical cues. Nature Biomedical Engineering. 7 (2), 177-191 (2023).
- Liu, C. -. F., Aschbacher-Smith, L., Barthelery, N. J., Dyment, N., Butler, D., Wylie, C. What we should know before using tissue engineering techniques to repair injured tendons: A developmental biology perspective. Tissue Engineering Part B: Reviews. 17 (3), 165-176 (2011).
- Ruiz-Alonso, S., Lafuente-Merchan, M., Ciriza, J., Saenz-del-Burgo, L., Pedraz, J. L. Tendon tissue engineering: Cells, growth factors, scaffolds and production techniques. Journal of Controlled Release. 333, 448-486 (2021).
- Rinoldi, C., et al. Tendon tissue engineering: Effects of mechanical and biochemical stimulation on stem cell alignment on cell-laden hydrogel yarns. Advanced Healthcare Materials. 8 (7), e1801218 (2019).
- Walia, B., Huang, A. H. Tendon stem progenitor cells: Understanding the biology to inform therapeutic strategies for tendon repair. Journal of Orthopaedic Research. 37 (6), 1270-1280 (2018).
- Thorpe, C. T., Riley, G. P., Birch, H. L., Clegg, P. D., Screen, H. R. C. Fascicles from energy-storing tendons show an age-specific response to cyclic fatigue loading. Journal of The Royal Society Interface. 11 (92), 20131058-20131058 (2014).
- Thorpe, C. T., Riley, G. P., Birch, H. L., Clegg, P. D., Screen, H. R. C. Fascicles and the interfascicular matrix show decreased fatigue life with ageing in energy storing tendons. Acta Biomaterialia. 56, 58-64 (2017).
- Youngstrom, D. W., Rajpar, I., Kaplan, D. L., Barrett, J. G. A bioreactor system for in vitro tendon differentiation and tendon tissue engineering. Journal of Orthopaedic Research. 33 (6), 911-918 (2015).
- Stauber, T., et al. Extrinsic macrophages protect while tendon progenitors degrade: Insights from a tissue engineered model of tendon compartmental crosstalk. Advanced Healthcare Materials. 10 (20), e2100741 (2021).
- Stauber, T., Moschini, G., Hussien, A. A., Jaeger, P. K., De Bock, K., Snedeker, J. G. IL-6 signaling exacerbates hallmarks of chronic tendon disease by stimulating progenitor proliferation & migration to damage. eLife. 12, RP87092 (2023).
- Doillon, C. J., Mantovani, D., Rajan, N., Habermehl, J., Cote, M. Preparation of ready-to-use storable and reconstituted type I collagen from rat tail tendon for tissue engineering applications. Nature Protocols. 1 (6), 2753-2758 (2007).
- Blache, U., et al. Inhibition of ERK 1/2 kinases prevents tendon matrix breakdown. Scientific Reports. 11 (1), 6838 (2021).
- Liu, X., et al. The role of vascular endothelial growth factor in tendon healing. Frontiers in Physiology. 12, 766080 (2021).
- Claxton, S., Kostourou, V., Jadeja, S., Chambon, P., Hodivala-dilke, K., Fruttiger, M. Efficient, inducible Cre-recombinase activation in vascular endothelium. Genesis. 46 (2), 74-80 (2008).
- Passini, F. S., et al. Shear-stress sensing by PIEZO1 regulates tendon stiffness in rodents and influences jumping performance in humans. Nature Biomedical Engineering. 5 (12), 1457-1471 (2021).
- Lee, A. H., Szczesny, S. E., Santare, M. H., Elliott, D. M. Investigating mechanisms of tendon damage by measuring multi-scale recovery following tensile loading. Acta Biomaterialia. 57, 363-372 (2017).
- Lee, A. H., Elliott, D. M. Multi-scale loading and damage mechanisms of plantaris and rat tail tendons. Journal of Orthopaedic Research. 37 (8), 1827-1837 (2019).
- Williams, I. F., Heaton, A., McCullagh, K. G. Cell morphology and collagen types in equine tendon scar. Research in Veterinary Science. 28 (3), 302-310 (1980).
- Maffulli, N., Ewen, S. W. B., Waterston, S. W., Reaper, J., Barrass, V. Tenocytes from ruptured and tendinopathic achilles tendons produce greater quantities of type III collagen than tenocytes from normal achilles tendons: An in vitro model of human tendon healing. American Journal of Sports Medicine. 28 (4), 499-505 (2000).
- Pajala, A., Melkko, J., Leppilahti, J., Ohtonen, P., Soini, Y., Risteli, J. Tenascin-C and type I and III collagen expression in total Achilles tendon rupture. An immunohistochemical study. Histology and Histopathology. 24 (10), 1207-1211 (2009).
- Best, K. T., et al. Scleraxis-lineage cell depletion improves tendon healing and disrupts adult tendon homeostasis. eLife. 10, e62203 (2021).
- Lehner, C., et al. Tenophages: A novel macrophage-like tendon cell population expressing CX3CL1 and CX3CR1. DMM Disease Models and Mechanisms. 12 (12), dmm041384 (2019).
- Ajalik, R. E., et al. Human organ-on-a-chip microphysiological systems to model musculoskeletal pathologies and accelerate therapeutic discovery. Frontiers in Bioengineering and Biotechnology. 10, 846230 (2022).
- Ingber, D. E. Human organs-on-chips for disease modelling, drug development and personalized medicine. Nature Reviews Genetics. 23 (8), 467-491 (2022).
- Brehm, M. A., Shultz, L. D., Luban, J., Greiner, D. L. Overcoming current limitations in humanized mouse research. The Journal of Infectious Diseases. 208 Suppl (Suppl 2), 125-130 (2013).
- Nunan, R., Harding, K. G., Martin, P. Clinical challenges of chronic wounds: searching for an optimal animal model to recapitulate their complexity. Disease Models & Mechanisms. 7 (11), 1205-1213 (2014).
- Costa-Almeida, R., Calejo, I., Reis, R. L., Gomes, M. E. Crosstalk between adipose stem cells and tendon cells reveals a temporal regulation of tenogenesis by matrix deposition and remodeling. Journal of Cellular Physiology. 233 (7), 5383-5395 (2018).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены