在细胞培养中缺氧诱导和测试
In This Article
Summary
在这里,我们提出简单的方法,诱导缺氧细胞培养和简单的测试,以评估文化的缺氧状态。
Abstract
缺氧是指器官,组织或细胞减少或缺乏氧气。这可能是由于在氧气的供应量减少(的原因包括没有足够的血管网络,有缺陷的血管,和贫血)或增加氧气供应(突然更高的细胞增殖率造成消费相对的氧张力下降) 。缺氧可,如在固体癌症 1-3,类风湿关节炎,动脉粥样硬化等病理生理或... ...每一个组织和细胞具有不同的能力,以适应这一新的条件。在缺氧,缺氧诱导因子(HIF)是稳定和调节不同的基因,如参与血管生成或运输氧气 4的。这种蛋白的稳定是一个缺氧的标志,因此,检测HIF是经常使用到屏幕缺氧5-7上。
在这篇文章中,我们提出两个简单的方法,缺氧诱导哺乳动物细胞培养和简单的测试,以评估这些细胞的缺氧状态。
Protocol
1。缺氧诱导CoCl 2溶液
钴(II)氯化(CoCl 2•6H 2 O,分子量= 237.9)是一种化学诱导缺氧诱导因子- 1.3 8。本产品易溶于水(100毫克/毫升),产生一个明确的,红色的解决方案。
- 准备一个25mm的库存解决方案,在无菌日水(准备使用前)
- 在常规的细胞培养介质使用CoCl 2诱导缺氧,在终浓度为100μm。
- 添加CoCl 2包含媒体对你的细胞,并在传统的孵化器孵化24小时的文化(37 ° C,5%C0 2) 。
以上浓度的细胞,我们有测试,但应该是每一个细胞系在不同浓度(建立以剂量依赖曲线)测试以及在不同的孵育时间,以限制药物相关的毒性和优化检测线工程。
2。缺氧诱导模块化孵化厅
- 准备至少有两个相同的(双胞胎文化)的细胞培养。可以在细胞培养瓶,板或培养皿。要打开总商会,首先打开位于室(用于注射吹扫缺氧气/管),轻轻地打开钢圈钳管上的两个白色塑料夹具。
- 松开夹紧。现在可将盖子和托盘。
- 将细胞培养在缺氧室。同时置于培养皿中,包含在会议厅内的无菌水,以提供足够的文化加湿。
- 放置在常氧的“双胞胎”细胞培养作为对照。
- 确保您的食品是安全的和不动,然后关闭盒盖室。正确定位钢圈夹,以确保密闭的腔封闭,并关闭它。
- 要创建缺氧,管“缺氧罐”,含有1%O 2的混合气体。如果你有一个连接到你的坦克流量计,你的商会将直接连接到它(煤气罐流量计室)。我们使用在我们的稳压器中的流量计。
- 重要的是去除大部分并非所有在您的媒体室和氧气目前,这样做,打开煤气罐在7-10分钟每分钟20公升的流量冲洗室;然后迅速关闭气体流量,并完全关闭,关闭两个白色夹子的室。
- 所需的时间内返回会议厅,一个传统的孵化器。如果使用大型的文化,允许在媒体文化DE气体1 - 2小时,然后重复冲洗。
上述步骤的基础上构造函数的建议“(比卢普斯罗森堡,INC)。确保你煤气罐在所有的时间获得正确。
注:
- 为了消除媒体中的O 2,建议将重瓦斯后1 -3小时室一次。
- 孵化时间较长比48小时它也应重新气体室。
- 氧传感器(电极/压力计),允许在细胞/室中的O 2的测量,将提供一个细胞内/室O 2的含)更精确的测量。
- 培养细胞在不同的时间长度,时间曲线,将有助于确定的最佳时间在您的特定细胞中HIF -1α表达。
3。缺氧的评价
- HIF - 1的免疫印迹检测α。
- 重新打开你的商会在第2.2节所述,立即置于冰上文化。
- 然后用5%SDS在解决板块裂解缺氧治疗组和非治疗细胞转移细胞lyzate管,超声,转速减速(spindown)的细胞碎片,收集上清。
- 测量蛋白质浓度用BCA试剂盒,准备样品加入样缓冲液,在95℃加热5分钟。
- Electrophorese 8%SDS聚丙烯酰胺凝胶转移到硝酸纤维素膜蛋白质。
- 膜在PBS中,含有5%非脱脂奶粉和0.1%吐温20座在室温下1小时或4℃摇床过夜。
- 免疫印迹法与反HIF -1α的主要单克隆抗体在同一个缓冲区(1 / 600)在4 ° C过夜
- 洗净,用含0.1%吐温20在室温下,5分钟,每次孵育HRP二级抗体(1 / 2000)的PBS + 0.1%吐温20为45分钟的3倍。
- 洗净,用含0.1%吐温20在室温下,5分钟/时间的3倍。
- 皮尔斯ECL试剂盒和X光片显示蛋白带
- 缺氧反应元件(HRE)。
HIF -1α调控许多基因(即血管内皮生长因子,促红细胞生成素),通过结合到一个序列称为缺氧调节元件(HRE)。使用人权教育相关的一个标记基因的我t是可以检测HIF活动9。若要使用此方法,首先你需要你的细胞转染与人权教育的荧光素酶质粒使用适合您的细胞转染方法的。例如,我们用脂质体2000。细胞需要转染至少4个小时之前,在低氧和常氧孵育。时间允许的DNA进入细胞,因此,这第一步不是缺氧的影响。使用荧光素酶检测试剂盒,荧光素酶检测到信号。- 孵育您的HRE转染的细胞在缺氧模块化室或使用的HRE转染的细胞孵育CoCl 2,包括常氧控制。
- 所需的潜伏期后,从细胞中移除的生长介质。
- 在PBS冲洗细胞,去除PBS。
- 免除到培养皿400μl1X裂解试剂,并刮去贴壁细胞,然后将它们传输到一个微型管。
- 短暂离心颗粒碎片。
- 混合20μL细胞裂解液上清与萤光素酶检测试剂100μL和使用光度计测量发光。
4。代表性的成果:
在K562细胞(人白血病细胞株)培养2天,含氧量低,相比常氧,缺氧诱导增加HIF -1α蛋白免疫印迹(图1)检测。
使用的HRE -荧光素酶改性293细胞(人胚肾细胞系)在缺氧培养,显着增加,在缺氧细胞HIF -1α活动检测(图2)。
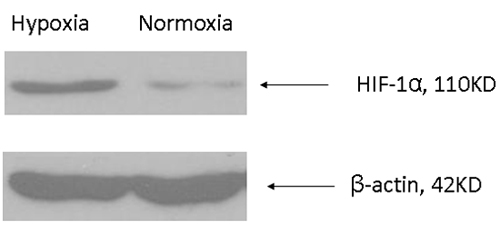
图1:增加缺氧细胞HIF -1α。 K562细胞在常氧和缺氧(缺氧室)培养48小时,并使用一种抗体具体为HIF -1α的西部印迹分析。为肌动蛋白抗体的具体用于装载控制。
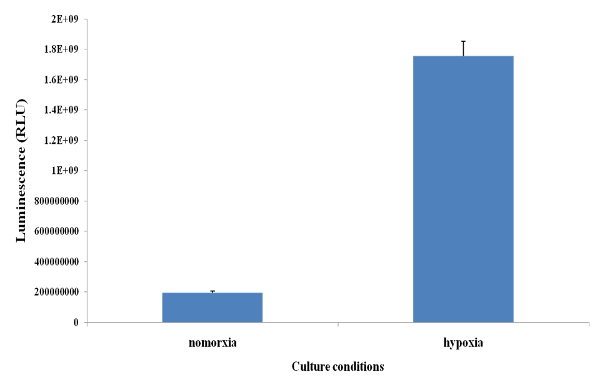
图2:HIF -1α的活动 。荧光素酶的HRE修改293细胞培养在低氧和常氧48小时,然后裂解使用荧光素酶检测试剂盒和光度计检测荧光素酶的信号。结果表示为相对发光单位(RLU)。
Discussion
细胞增殖和缺氧条件下的生存能力有很大的差异,根据细胞类型。因此,你应该调整细胞数或数量,以确保你将有足够的细胞/蛋白质为您的实验开始的文化板块。
氯化钴方法的优点是价格低廉和快速。本产品模仿缺氧诱导HIF-1/3α,但还可以调节其他基因,确保检查什么其他的影响,它可能对您的特定细胞的功能和表型的“模仿独立本产品适合您的项目缺氧“的效果。另一种药物也可以用来模仿缺氧是去铁胺甲磺酸(DFO,终浓度为100微米)。这些药物的使用,允许experimentator开放,而不影响“缺氧”的培养板/盘/瓶多次。
混合气体中的氧气水平可以有所不同,取决于您的实验和细胞类型,缺氧值的变化对组织和细胞类型的不同而不同。事实上,一些细胞缺氧5%O 2的其他需要不到1%O 2的缺氧。添加5%的CO 2混合气体,以稳定的文化的pH值,其余的气体通常是氮气。
缺氧商会有没有使用药物可以替代细胞行为的独立的氧张力的优势。然而,并非所有类型的实验可以做氧气重新进入在每个开放的腔,从而减轻缺氧。你应该考虑这个因素在您的实验;缺氧/复氧是一种特定条件下,可能会影响一些类型的细胞。另一种方法是使用缺氧工作站(预混合气体罐或气体混合系统连接到)或较大缺氧培养箱(缺氧处理室,手套箱),允许试验,以改变媒体和操纵连续缺氧环境中的细胞。各种缺氧商会在过去的十年,已经商业化的选择应根据您的实验室使用,项目的空间,大小,和预算。一定要确保用好你的房间和条件,以保证正确的文化条件。一般情况下,用一腔时,缺氧的水平可以通过选择不同的气体混合物(即1%,5%〜10%的氧气)的调制。
关于中HIF -1α的检测,重要的是要知道,某些肿瘤细胞系表达常氧HIF -1α。因此,使用常氧控制,以确定这些细胞系中HIF基础水平的关键。 HIF -1α也可以在非恶性细胞常氧细胞刺激或压力。这也可能发生,如果这些细胞被饿死,确保您的细胞培养正确的饲料和保持。
Disclosures
没有利益冲突的声明。
Materials
| Name | Company | Catalog Number | Comments |
| 试剂名称 | 公司 | 目录编号 | |
|---|---|---|---|
| 反HIF -1α | Invitrogen公司 | 458400 | |
| (二)氯化钴 | 西格玛 | C8661 - 25G | |
| 孵化商会 | 比卢普斯,罗滕伯格 | MIC - 101 | |
| 的HRE荧光素酶质粒 | Adgene | 质粒26731 |
References
- Swinson, D. E., O'Byrne, K. J. Interactions between hypoxia and epidermal growth factor receptor in non-small-cell lung cancer. Clin Lung Cancer. 7, 250-256 (2006).
- van Laarhoven, H. W. Hypoxia in relation to vasculature and proliferation in liver metastases in patients with colorectal cancer. Int J Radiat Oncol Biol Phys. 64, 473-482 (2006).
- Hockel, M. Intratumoral pO2 predicts survival in advanced cancer of the uterine cervix. Radiother Oncol. 26, 45-50 (1993).
- Semenza, G. L. HIF-1 and human disease: one highly involved factor. Genes Dev. 14, 1983-1991 (2000).
- Semenza, G. L. Hypoxia-inducible factor 1: master regulator of O2 homeostasis. Curr Opin Genet Dev. 8, 588-594 (1998).
- Tatum, J. L. Hypoxia: importance in tumor biology, noninvasive measurement by imaging, and value of its measurement in the management of cancer therapy. Int J Radiat Biol. 82, 699-757 (2006).
- Brahimi-Horn, M. C., Pouyssegur, J. HIF at a glance. J Cell Sci. 122, 1055-1057 (2009).
- Piret, J. P., Mottet, D., Raes, M., Michiels, C. CoCl2, a chemical inducer of hypoxia-inducible factor-1, and hypoxia reduce apoptotic cell death in hepatoma cell line HepG2. Ann N Y Acad Sci. 973, 443-447 (2002).
- Emerling, B. M., Weinberg, F., Liu, J. L., Mak, T. W., Chandel, N. S. PTEN regulates p300-dependent hypoxia-inducible factor 1 transcriptional activity through Forkhead transcription factor 3a (FOXO3a). Proc Natl Acad Sci U S A. 105, 2622-2627 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved