Visualisering og genetisk manipulering af dendritter og udløberne i mus cerebrale cortex og hippocampus under anvendelse
In This Article
Summary
Denne artikel beskriver i detaljer en protokol til at elektroporere in utero den cerebrale cortex og hippocampus ved E14.5 i mus. Vi viser også, at dette er en værdifuld metode til at studere dendritter og udløberne i disse to cerebrale områder.
Abstract
In utero elektroporering (IUE) er blevet en kraftig teknik til at undersøge udviklingen af forskellige regioner af den embryoniske nervesystem 1-5. Hidtil dette værktøj er blevet bredt anvendt til at undersøge reguleringen af celleproliferation, differentiering og neuronal migration specielt i udviklingslandene hjernebarken 6-8. Her detalje vores protokol til elektroporere in utero hjernebarken og hippocampus og dokumentere, at denne fremgangsmåde kan bruges til at studere dendritter og rygsøjle i disse to cerebrale regioner.
Visualisering og manipulation af neuroner i primære kulturer har bidraget til en bedre forståelse af de processer, der er involveret i dendritceller, rygsøjle og synapser udvikling. Men neuroner voksende in vitro er ikke udsat for alle de fysiologiske signaler, der kan påvirke dendritceller og / eller ryg dannelse og vedligeholdelse under normal udvikling. Vores viden om dendritceller og rygrad strukturer 9. Imidlertid Golgi farvning anses for at være uforudsigelig. Faktisk er grupper af nerveceller og fibre skrifter mærket tilfældigt, bestemte områder ofte optræder fuldstændig farvede, mens tilstødende områder er blottet for farvning. Nylige undersøgelser har vist, at IUE fluorescerende konstruktioner er et attraktivt alternativ metode til at studere dendritter udløberne samt synapser i mutant / vildtype-mus 10-11 (figur 1A). Desuden i forhold til generering af muse-knockouts repræsenterer IUE en hurtig fremgangsmåde til at udføre forstærkning og tab af funktion undersøgelser specifik population af celler i en bestemt tidsvindue. Desuden er IUE blevet anvendt med inducerbar genekspression eller inducerbar RNAi nærmer at raffinere den tidsmæssige kontrol af ekspressionen af et gen eller shRNA 12. Disse fordele IUE er således opened nye dimensioner for at studere virkningen af genekspression / suppression af dendritter og udløberne ikke kun i specifikke cerebrale strukturer (fig. 1B), men også ved et specifikt tidspunkt i udviklingen (figur 1C).
Endelig, IUE giver et nyttigt redskab til at identificere funktionelle interaktioner mellem gener involveret i dendritceller, ryg og / eller synapser udvikling. Faktisk, i modsætning til andre genoverføringsmetoder, såsom virus, er det ligetil at kombinere multiple RNAi eller transgener i den samme population af celler.
Sammenfattende er IUE en kraftfuld fremgangsmåde, der allerede har bidraget til karakterisering af molekylære mekanismer, der ligger hjernefunktion og sygdom, og det bør også være nyttige i studiet af dendritter og udløberne.
Protocol
I Det Forenede Kongerige, mus huses, avlet, og behandles i henhold til de retningslinjer, der er godkendt af Indenrigsministeriet under Animal (Scientific Procedures) Act 1986.
1. Forberedelse: DNA Solution og nåle
- Oprense plasmid-DNA med et endotoksin frit Maxi-prep kit. Fremstilling af plasmid-DNA-opløsning til injektion ønskede koncentrationer i vand, og der tilsættes Fast Green (slutkoncentration på 0,05%) til at visualisere injektioner. Effektiviteten af elektroporation er stærkt afhængig af DNA-koncentration. En koncentration på 1 ug / ul anvendes generelt. Denne koncentration er tilstrækkelig til at visualisere elektroporerede neuroner uden at påvirke deres udvikling. Men ifølge promotoren anvendt i plasmidvektoren (lavt ekspressionsniveau med cytomegalovirus promoter / enhancer, kraftig ekspression i niveau med cytomegalovirus immediate early enhanceren og kyllinge β-actin-promotoren fusion (CAG)-promotor), såvel som størrelse og Stabiliteten af det udtrykte protein, kan denne koncentration justeres (0,25 ug / ul til 5 ug / ul).
- Træk glas nåle ved hjælp af en mikropipette aftrækker.
2. Forberedelse af kirurgi
- Autoklaveres kirurgiske instrumenter og phosphatpuffersaltopløsning (PBS).
- Fremstille analgetisk opløsning i PBS (Buprenorphin, Vetergesic, endelig koncentration på 30 ug / ml). Vejes gravide mus og injicere subkutant 0,1 mg / kg Vetergesic mindst 30 minutter før kirurgi. I dette tidsrum forberede det kirurgiske område. Tænd for varmepuder og inddrivelse kammer. Sæt steril PBS i varmt vandbad og alle sterile instrumenter og materialer på sterile draperier. Læg platinelektroder i et PBS fyldt bæger og oprette forbindelse til elektroporator. Fyld sprøjte med DNA-opløsningen med en microloader spids, forbinde nålen til det kapillære holderen og afklemme spidsen af nålen med en tang.
- Bedøve en gravid mus (E14.5-E15.5) med isofluran i oxygen bæreren (oxygen 2 l / min) under anvendelse af et bedøvelsesmiddel induktion kammer. Vente, indtil dyret mister vridningsrefleksen.
- Overfører dyret til en "præ-kirurgi" maske. Placere en dråbe øjengel på hvert øje for at forhindre corneal ulceration af øjnene mens moderen under generel anæstesi. Brug en elektrisk barbermaskine til at barbere håret af maven. Rengør det barberede område gang med clorhexidine at indsamle flyvende hår.
- Overføre dyret til en anden maske for det kirurgiske område. Placer musen med sin ryg på varmepude. Start operationen, når pedalen refleksen er gået tabt.
- Tag maske og sterile handsker. Omfatte dyr med et sterilt afdækningsstykke (med et lille hul over underlivet) for at forhindre væv og instrumenter blive angrebet af de hudområder, som ikke er blevet barberet og desinficeret. Rengør det barberede område ent mindst 3 gange med clorhexidine. Brug en anden steril vatpind hver gang. Anvender en skalpel til at foretage en lodret snit langs midterlinien (~ 1 inch lange) gennem huden. Ved hjælp af saks, foretage en tilsvarende indsnit i en muskel i maven langs linea alba (hvid linje består hovedsageligt af kollagen bindevæv).
- Vælg de mest tilgængelige embryoner og sætte ringen tangen mellem to æg og træk forsigtigt den embryonale kæden ud af bughulen. Fra dette punkt, holde embryoner hydreret med sterilt forvarmet PBS.
Ingen mikroskop påkrævet til visualisering.
4. Injektion af DNA og elektroporation
- Start med en af de mest laterale embryoner, hvilket gør det nemmere at holde styr på hvilke embryoner blev elektroporeret. Træk ikke for meget på de embryoner, da dette vil øge risikoen for blødning. Manipulere positionen af embryonet ind i fosterhinden hjælp af ring forceps ogstabilisere hovedet af embryonerne mellem ringene. Blidt at presse sig embryonet tættere på uterusvæggen.
- Med den anden hånd, at den kapillære holderen og kanylen forsigtigt ind i midten af halvkuglens at målrette den laterale ventrikel. Tryk på pedalen at tilføre ca 1 pi DNA-opløsning blandet med Fast Green (mindre end 1 pi til at studere dendritter). Du skal observere den grønne farvestof fylde den laterale ventrikel. Kritiske trin: - skarpheden af nålen er kritisk at trænge ordentligt livmodervæggen. Det er vigtigt at minimere bevægelse af nålen på overfladen af livmodervæggen, og efter indsætning i ventriklen, fordi en udvidelse af hullet, vil resultere i lækage af fostervand og embryo død. Undgå piercing blodkar i livmodervæggen, da dette vil resultere i blødninger og fosterdød.
- Det er vigtigt ikke at injicere en for stor mængde DNA i den laterale ventrikel, fordi det vil inducerehydrocephalus (ikke overstiger 2 ul på E14.5). Volumenet af DNA justeres afhængigt af formålet af eksperimentet. Hvis 1 pi almindeligvis anvendes til de fleste eksperimenter, er et mindre volumen af DNA (ca. 0,5 pi), der kræves for dendritceller og rygsøjle analyse. Faktisk nogle få isolerede celler skal målrettes med henblik på at visualisere og måle dendritiske løvhytte af elektroporerede neuroner. - Placere elektroderne på siderne af embryo hoved med den positive (+) padle på samme side som den injicerede ventrikel til cortex elektroporation eller på den modsatte side af den injicerede ventrikel for hippocampus elektroporering (figur 2). Så gælder fem 30V elektriske impulser (50 msek varighed) med 1 sek mellemrum. Kritisk skridt: Undgå at bruge strøm på tværs af moderkagen, da dette vil resultere i fosterdød.
Alle embryoner i en gravid mus kan skal elektroporeres, som regel med den samme DNA-konstruktionen for at undgå enhver forveksling. En lang operation fald s overlevelsesraten af embryoner. Bughulen bør ikke åbnes mere end 30 min.
5. Kirurgi Post-elektroporering
- Efter elektroporere embryoner, tilføje PBS i bughulen og bruge ring pincet til at erstatte den livmoderhorn i sin oprindelige placering. Suturere maven væg og huden med Vicryl absorberbare suturer.
- Sende dyret i et opsving kammer, indtil det aktiveres (sædvanligvis 5-10 minutter) og derefter overføres i et bur anbragt på en varmepude.
6. Efter kirurgi
Kontroller musenes adfærd for at vurdere smerte, lidelse eller angst og vejer dyrene 24 timer og 48 timer efter operationen. Hvis det er nødvendigt, kan analgetika administreres at mindske smerter og ubehag.
7. Vævsbehandling
Saml de elektroporerede embryoner eller unger ved de embryonale eller postnatal etaper for eksperimentet.
ove_content "> - Til analyse ved embryonale stadier (for eksempel at undersøge celleproliferation eller migration):Afliv mor via cervikal dislokation og indsamle de embryoner. Efter halshugning, hjernen, der er blevet korrekt elektroporeret vælge, som angivet ved mængden og placeringen af det fluorescerende signal, visualiseret over kraniet ved hjælp af en fluorescerende binokulært. Dissekere hjernen ud af kraniet og fastsætte natten i 4% PFA og derefter i 20% saccharose / PBS natten. Integrere i OCT-forbindelse, fryse ved -80 ° C og afsnit ved hjælp af en kryostat.
- Til analyse ved postnatale trin (for eksempel at undersøge dendritter og udløberne):
Bedøve unger eller voksne mus med intraperitoneal injektion af pentobarbiton (40-60 mg / kg) og udføre transcardial perfusion med PBS efterfulgt af 4% PFA i PBS. Dissekere hjernen ud af kraniet og post-fix i 4% PFA natten. Efter vask i PBS, afsnit hjernen ved hjælp af en vibratome (100 um snit til dendrite analyse). Montér sektionerne i Aqua Poly / mount hjælp 0.16-0.19 mm tykke dækglas til billede dendritter og rygsøjle.
8. Repræsentative resultater
Figur 3 viser eksempler på elektroporerede celler i den cerebrale cortex (figur 3A, B), i CA1 (figur 3C, D) og i den tandede gyrus i hippocampus (figur 3E, F). Vildtype-mus blev elektroporeret ved E14.5 med en GFP-konstruktion (PCA-b-EGFPm5 lyddæmper 3), og hjernerne blev høstet ved postnatal dag (P) 14. Ved at indsprøjte et lille volumen af DNA-opløsning (0,5 ul eller mindre af en opløsning på 1 ug / ul), er nogle få celler mærket, hvilket muliggør visualisering af det dendritiske arborization af isolerede GFP +-celler (fig. 3) samt deres udløberne ved højere forstørrelse (figur 4).
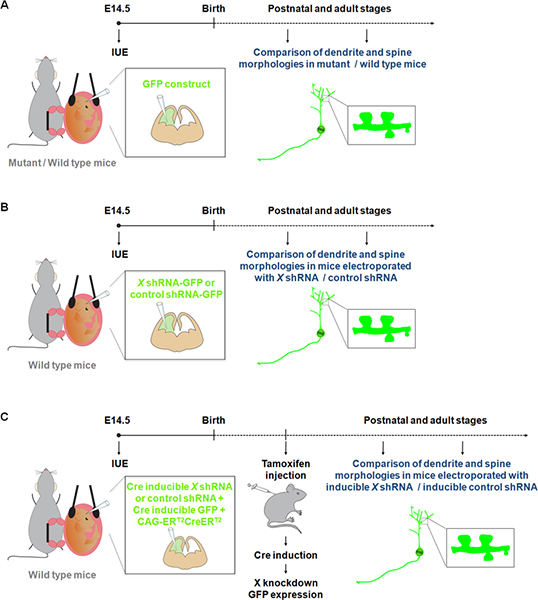
Figur 1. Skematisk repræsentation af elektroporation protokoller, der kan anvendes til at studere dendritter og udløberne. (A) Elektroporering af en GFP-konstruktion til at sammenligne dendritter og udløberne i vildtype-og mutant-mus. (B) Elektroporering af GFP-shRNA (GFP udtrykkes fra den samme konstruktion) at sammenligne dendritter og udløberne i mus elektroporeret med en shRNA konstruktion er specifikt for et gen af interesse (X) eller et kontrol shRNA. (C) IUE kan anvendes sammen med et Cre inducerbare system for at begrænse ekspression af shRNA til den ønskede periode. I dette eksperiment, der udtrykker en vektor en form af Cre-rekombinase, der kan aktiveres af 4-hydroxytamoxifen (CAG-ER T2 CreER T2; 1 ug / ul) 10, der er elektroporeret med en vektor der udtrykker et specifikt shRNA i et Cre afhængig måde (1 ug / ul, og med en rekombination indikator (CALNL-GFP-konstruktion, GFP-ekspression induceres af Cre. 1 ug / ul) 10 effekticy af knockdown kan forbedres ved at forøge koncentrationen af shRNA såvel som forøgelse CAG-ER T2 CreER T2 koncentration.
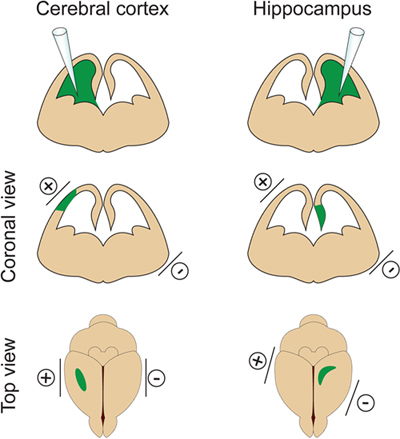
Figur 2. Rumlig styring af elektroporering. Denne figur viser, hvor at positionere skovlen elektroder ifølge DNA'et injektionsstedet for at målrette den cerebrale cortex eller hippocampus.
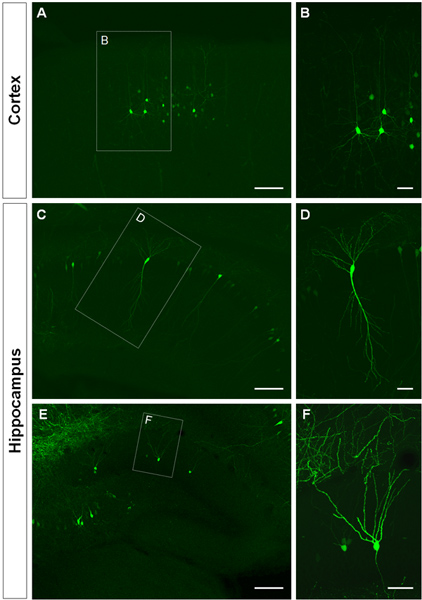
Figur 3. Visualisering af dendritiske akslen af in utero elektroporerede celler i den cerebrale cortex og hippocampus. (A, B) Koronale sektioner viser GFP +-pyramidale celler i den cerebrale cortex, (CD) pyramidale celler i CA1 i hippocampus og (E, F), granulceller i den tandede gyrus i P14. En GFP-konstruktion (PCA-b-EGFPm5 lyddæmper 3) blev elektroporeret ved E14.5. Højere forstørrelse billeder (B, D, F) viser, at IUE er en effektiv metode til at visualisere dendritter. Målestoksforhold udgør 50 pm (B, D og F) og 150 um (A, C, E).
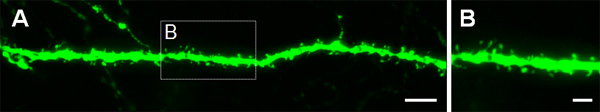
Figur 4. Visualisering af dendritiske spidser i P14 neuroner, blev elektroporeret i livmoderen ved E14.5 med en GFP-udtrykkende konstruktion. (A, B) høj forstørrelse billeder af pigge fra basale dendritter af hippocampale pyramideformede neuroner. Målestoksforhold udgør 5 um (A) og 2 um (B).
Discussion
IUE er et kraftfuldt værktøj til at manipulere genekspression ikke kun i rummet, men også i tid. Vi viser her, at denne teknik kan anvendes til at visualisere og genmanipulere dendritter og udløberne i den cerebrale cortex og hippocampus hos mus. Ud over de fordele som tidligere nævnt, er det værd at bemærke, at IUE, i modsætning til Golgi fremgangsmåde kan kombineres med immunohistokemi eller in situ hybridisering, som giver mulighed for eksempel fænotype de elektroporerede celler. Det er også vigtigt at nævne, at denne procedure ikke inducerer tydelige hjernen malformationer på trods af sin relative invasiv. Hertil kommer, på celleniveau ikke IUE ikke ændre de elektrofysiologiske egenskaber af den elektroporerede neuroner 13. Mens vores demonstration fokuserer på visualisering af dendritceller og rygrad morfologier, kunne IUE af kortikale eller hippocampus neuroner på E14.5 også bruges til at studere andre udviklingsmæssige begivenheder, såsom axon dannelse og vejledning. I tilføjeition, samme slags protokol kan gennemføres på andre stadier af fosterudviklingen at målrette forskellige befolkningsgrupper. For eksempel kan en udviklingsmæssigt meget sen cortical elektroporering paradigme ved E18.5 udføres for at drive ekspression i astrocytiske progenitorer 1. Tilsvarende, medens en elektroporering af hippocampus ved E14.5 tillader at målrette CA1-CA3 pyramideformede Neuron progenitorer og gyrus granula celle progenitorceller samtidig, ville en sen hippocampalt elektroporering (E18.5 eller tidligt efter fødslen) tillade at målrette forskellige tandede granule progenitorer 14. I dette tilfælde kan den indsprøjtede mængde af DNA øges såvel som intensiteten af strømmen.
Transgener indføres ved IUE synes at forblive episomalt og derfor tabt fra celler efter hinanden celledelinger. I postmitotiske celler som neuroner, men de episomale transgenerne forbliver aktive i flere måneder efter elektroporation så langtidsstudier 13, 15. I vores undersøgelse, har vi observeret lyse GFP + celler op til 7 uger efter fødslen (det seneste tidspunkt har vi analyseret) angiver, at embryonale målretning af kortikale eller hippocampus neuronale forstadier ved anvendelse IUE resulterer i vedvarende ekspression af transgenet fra tidlige udviklingsstadier tidspunkter op til voksenalderen.
En strømbegrænsning af teknikken er, at det er vanskeligt at udøve en god kontrol over det totale antal elektroporerede celler. Imidlertid, ved at nedsætte den indsprøjtede mængde af DNA-opløsning, har vi vist, at det er muligt at mærke et par celler og at visualisere dendritiske arborization af isolerede GFP +-celler såvel som deres pigge. Dimensionen af det transficerede område kan også justeres ved at ændre parametrene for elektroporering, såsom intensitet strøm og antallet af impulser eller diameteren af elektroporation skovlene.
Helt IUE er en metode, der er let at implementere, hurtig ogeffektiv til at studere dendritter og udløberne in vivo.
Acknowledgements
Forfatterne vil gerne takke Dr. Kathleen Mathers, Dr. Jean-Philippe Mocho og Dr. Yolanda Saavedra Torres for deres hjælp til at udføre in utero elektroporation under aseptiske procedurer, og Hayley Wood for hende hjælp til at forberede tegninger.
EP blev understøttet af en langsigtet Federation of European Biochemical Societies (FEBS) fællesskab og en Medical Research Council (MRC) karriereudvikling stipendium, indehaveren af markedsføringstilladelsen af en Wellcome Trust tilskud til Elizabeth Fisher og Victor Tybulewicz (080174/B/06/Z) , HW ved en EMBO langsigtet fællesskab og RA af en MRC studentship. Dette arbejde blev støttet af en projektbevilling fra Wellcome Trust (086947/Z/08/Z) og en Grant-in-Aid fra Medical Research Council (U117570528) til FG
Materials
| Name | Company | Catalog Number | Comments | |||
| Navn på reagenset | Firma | Katalog nummer | Kommentarer | |||
| Fremstillinq af nåle og DNA-opløsning til injektion | ||||||
| Endofree Plasmid Maxi Kit | Qiagen | 12362 | ||||
| Fast Green | Sigma | F-7258 | ||||
| Borosilikatglas kapillærer 1,0 mm OD x 0,58 mm ID | Harvard Apparatus | 30-0016 | ||||
| Microloader tips | Eppendorf | 5242956003 | For Eppendorf pipetterer 0,5 pi-10 ul / 2 til 20 ul | |||
| & Nbsp; | Materiale til kirurgi | |||||
| Ekstra tynde Iris saks | Gode Science Tools | 14088-10 | ||||
| Buede Tang | Gode Science Tools | 91197-00 | ||||
| Ring tang | Gode Science Tools | 11103-09 | ||||
| Nåleholder | Gode Science Tools | 12002-12 | ||||
| Graefe Tang | Gode Science Tools | 11050-10 | ||||
| Vicryl absorberbar sutur | Ethicon Inc (Johnson & Johnson) | W9074 | ||||
| Sterile gardiner 30cm x 45 cm | Buster | 141765 | ||||
| Sterile podninger | Shermond | Huby-340 | ||||
| Vatpinde | Clean Cross Co, Ltd | 1860 | ||||
| Buprenorphin (Vetergesic) | Alstoe Dyresundhed | |||||
| Clorhexidine | Vetasept | XHG007 | ||||
| Øjengel Viscotears | Novartis | |||||
| Isofluran | Abbott Laboratories | B506 | ||||
| Pentoject, pentobarbitonnatrium 20% | Animalcare | |||||
| Elektroporation | ||||||
| Elektroporator | BTX | ECM830 | ||||
| Platinum Tweezertrode 5mm | BTX, Harvard Apparatus | 45-0489 | ||||
| Femtojet microinjector | Eppendorf | 5247000030 | ||||
| Fodpedal for Femtojet Microinjector | Eppendorf | 5247623002 | ||||
| Kapillær holder | Eppendorf | 5176190002 | ||||
| Vævsbehandling | ||||||
| Paraformaldehyd | Sigma | P6148 | ||||
| Saccharose | VWR (Prolabo) | 27480.294 | ||||
| Mikroskopobjektglas | ThermoScientific (Menzel-Gläser) | J1800AMNZ | ||||
| Dækglas | Menzel-Gläser | 22 x 50 mm # 1,5 | ||||
| Aqua Poly / mount | Polysciences, Inc. | 18606 | ||||
References
- Kolk, S. M., de Mooij-Malsen, A. J., Martens, G. J. Spatiotemporal Molecular Approach of in utero Electroporation to Functionally Decipher Endophenotypes in Neurodevelopmental Disorders. Front Mol. Neurosci. 4, 37 (2011).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol. 240, 237-246 (2001).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Dev. Growth Differ. 50, 499-506 (2008).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Tabata, H., Nakajima, K. Labeling embryonic mouse central nervous system cells by in utero electroporation. Dev. Growth Differ. 50, 507-511 (2008).
- Castro, D. S. A novel function of the proneural factor Ascl1 in progenitor proliferation identified by genome-wide characterization of its targets. Genes Dev. 25, 930-945 (2011).
- Pacary, E. Proneural transcription factors regulate different steps of cortical neuron migration through Rnd-mediated inhibition of RhoA signaling. Neuron. 69, 1069-1084 (2011).
- Marteau, L. Angiopoietin-2 regulates cortical neurogenesis in the developing telencephalon. Cereb Cortex. 21, 1695-1702 (2011).
- Ramon Moliner, E. . Comparative Methods in Neuroanatomy. , (1970).
- Banks, G. T. Behavioral and other phenotypes in a cytoplasmic Dynein light intermediate chain 1 mutant mouse. J. Neurosci. 31, 5483-5494 (2011).
- Elias, G. M., Elias, L. A., Apostolides, P. F., Kriegstein, A. R., Nicoll, R. A. Differential trafficking of AMPA and NMDA receptors by SAP102 and PSD-95 underlies synapse development. Proc. Natl. Acad. Sci. U.S.A. 105, 20953-20958 (2008).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U.S.A. 104, 1027-1032 (2007).
- Navarro-Quiroga, I., Chittajallu, R., Gallo, V., Haydar, T. F. L. o. n. g. -. t. e. r. m. selective gene expression in developing and adult hippocampal pyramidal neurons using focal in utero electroporation. J. Neurosci. 27, 5007-5011 (2007).
- Nakahira, E., Yuasa, S. Neuronal generation, migration, and differentiation in the mouse hippocampal primoridium as revealed by enhanced green fluorescent protein gene transfer by means of in utero electroporation. J. Comp. Neurol. 483, 329-340 (2005).
- Ramos, R. L., Bai, J., LoTurco, J. J. Heterotopia formation in rat but not mouse neocortex after RNA interference knockdown of DCX. Cereb Cortex. 16, 1323-1331 (2006).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved