Visualisierung und genetische Manipulation von Dendriten und Dornen in der Maus Hirnrinde und im Hippocampus mit
In This Article
Summary
Dieser Artikel beschreibt im Detail, ein Protokoll zur in utero elektroporieren die Hirnrinde und im Hippocampus bei E14.5 bei Mäusen. Wir zeigen auch, dass dies eine wertvolle Methode, um Dendriten und Dornen in diesen beiden Hirnregionen zu untersuchen ist.
Abstract
In utero Elektroporation (IUE) hat sich eine mächtige Technik, die Entwicklung der verschiedenen Regionen des embryonalen Nervensystems 5.1 zu studieren. Bis heute wurde dieses Tool weit verbreitet, um die Regulation der zellulären Proliferation, Differenzierung und neuronalen Migration insbesondere in den Entwicklungsländern Großhirnrinde 6-8 studieren. Hier haben wir unsere Detail-Protokoll in utero elektroporieren der Großhirnrinde und den Hippocampus und den Nachweis erbringen, dass dieser Ansatz verwendet werden, um Dendriten und Dornen in diesen beiden Hirnregionen zu untersuchen.
Visualisierung und Manipulation von Neuronen im primären Kulturen haben zu einem besseren Verständnis der Vorgänge in Dendriten, der Wirbelsäule und Synapse beteiligt Entwicklung beigetragen. Allerdings Neuronen wachsen in vitro sind nicht an allen physiologischen Signale, die Dendriten und / oder Wirbelsäule Bildung und Aufrechterhaltung während der normalen Entwicklung beeinflussen kann ausgesetzt. Unser Wissen über Dendriten und Strukturen der Wirbelsäule 9. Jedoch ist Golgi-Färbung als unvorhersehbar sein. Tatsächlich sind Gruppen von Nervenzellen und Nervenbahnen nach dem Zufallsprinzip, mit bestimmten Bereichen häufig auftretende vollständig gefärbt, während benachbarte Bereiche frei von Verfärbungen sind beschriftet. Jüngste Studien haben gezeigt, dass IUE von fluoreszierenden Konstrukte eine attraktive Alternative zur Dendriten, Stacheln sowie Synapsen in der Mutante / Wildtyp-Mäusen 10 bis 11 (Abbildung 1A) Studie stellt. Außerdem im Vergleich zur Erzeugung von Maus-Knockouts, stellt IUE eine rasche Annäherung an Gewinn und Verlust der Funktions-Studien in speziellen Population von Zellen führen während eines bestimmten Zeitfensters. Darüber hinaus hat IUE erfolgreich mit induzierbaren Genexpression oder induzierbare RNAi nähert, um die zeitliche Steuerung der Expression eines Gens oder shRNA 12 zu präzisieren. Diese Vorteile von IUE haben damit openenterprd neue Dimensionen zur Untersuchung der Auswirkungen der Genexpression / Unterdrückung auf Dendriten und Dornen nicht nur in bestimmten zerebralen Strukturen (Abbildung 1B), sondern auch zu einem bestimmten Zeitpunkt der Entwicklung (Abbildung 1C).
Schließlich bietet IUE ein nützliches Instrument, um funktionelle Wechselwirkungen zwischen Genen in Dendriten, der Wirbelsäule und / oder Synapse Entwicklung beteiligt sind. In der Tat, im Gegensatz zu anderen Gentransferverfahren wie Viren, ist es einfach, mehrere RNAi oder Transgene in der gleichen Population von Zellen zu verbinden.
Zusammenfassend ist IUE eine leistungsfähige Methode, die bereits auf der Charakterisierung der molekularen Mechanismen der Hirnfunktion und Krankheit beigetragen hat, und es sollte auch in der Studie von Dendriten und Dornen nützlich.
Protocol
Im Vereinigten Königreich werden die Mäuse untergebracht, gezüchtet und behandelt nach den Richtlinien vom Innenministerium unter dem Tier (Scientific Procedures) Act 1986 genehmigt.
1. Zubereitung: DNA-Lösung und Nadeln
- Entschlacken Plasmid-DNA mit einem Endotoxin frei Maxi-Prep-Kit. Planen Plasmid-DNA-Lösung zur Injektion gewünschten Konzentrationen in Wasser gelöst und mit Fast Green (Endkonzentration von 0,05%), um Injektionen zu visualisieren. Die Effizienz der Elektroporation ist stark abhängig von der DNA-Konzentration. Eine Konzentration von 1 ug / ul wird im Allgemeinen verwendet. Diese Konzentration reicht aus, um elektroporierte Neuronen ohne Auswirkungen auf ihre Entwicklung zu visualisieren. Jedoch, gemäß der Promotor im Plasmid-Vektor (niedrige Expression mit Cytomegalovirus-Promotor / Enhancer, starke Expression mit dem Cytomegalovirus immediate early enhancer und Huhn β-Actin-Promotor-Fusion (CAG)-Promotor) sowie der Größe und der verwendeten Stabilität des Proteins exprimiert, kann diese Konzentration eingestellt (0,25 ug / ul bis 5 ug / ul) werden.
- Ziehen Sie mit einem Glas Nadeln Feinpipettenziehvorrichtung.
2. Vorbereitung der Chirurgie
- Autoklav chirurgische Instrumente und Phosphat-gepufferter Saline (PBS).
- Bereiten analgetische Lösung in PBS (Buprenorphin, Vetergesic, Endkonzentration von 30 ug / ml). Wiegen Sie die schwangere Maus subkutan injizieren und 0,1 mg / kg von Vetergesic mindestens 30 Minuten vor der Operation. Während dieser Zeit bereiten den OP-Bereich. Schalten Sie die Heiz-Pads und der Erholung Kammer. Platzieren Sie sterilem PBS in warmen Wasserbad und alle sterilen Instrumente und Materialien auf sterilen Tüchern. Legen Sie die Platin-Elektroden in eine PBS gefüllten Becher und eine Verbindung zum Elektroporator. Füllen Sie die Nadel mit der DNA-Lösung mit einem Microloader Spitze, verbinden Sie die Nadel auf die Kapillarhalter und kneifen Sie die Spitze der Nadel mit einer Pinzette.
- Betäuben eine schwangere Maus (E14.5-E15.5) mit Isofluran in Sauerstoff-Träger (Sauerstoff 2 l / min) unter Verwendung einer Narkoseeinleitung Kammer. Warten Sie, bis das Tier verliert Stellreflexes.
- Übertragen Sie das Tier zu einer "pre-Chirurgie" Maske. Geben Sie einen Tropfen Augengel auf jedem Auge zu Hornhautulzeration der Augen zu verhindern, während die Mutter ist unter Vollnarkose. Verwenden Sie einen elektrischen Rasierer, um die Haare des Bauches zu rasieren. Reinigen Sie den rasierten Bereich einmal mit Chlorhexidin, um fliegende Haare zu sammeln.
- Übertragen Sie das Tier auf eine zweite Maske im OP-Bereich. Platzieren Sie die Maus mit dem Rücken auf dem Heizkissen. Starten Sie die Operation, wenn das Pedal Reflex verloren gegangen ist.
- Setzen Sie auf Maske und sterile Handschuhe. Decken Sie das Tier mit einem sterilen Tuch (mit einem kleinen Loch in den Bauch) zu den Geweben und Instrumenten aus, die von den Hautpartien, die noch nicht rasiert und desinfiziert verschmutzt wird. Reinigen Sie den rasierten Bereich eint mindestens 3 mal mit Chlorhexidin. Verwenden Sie eine andere sterile Wattestäbchen jeder Zeit. Verwenden Sie ein Skalpell, um einen vertikalen Schnitt entlang der Mittellinie (~ 1 cm lang) durch die Haut zu machen. Mit Schere, einen ähnlichen Einschnitt des Muskels des Bauches entlang der Linea alba (weiße Linie hauptsächlich aus Kollagen Bindegewebe).
- Wählen Sie die am besten zugängliche Embryonen und legen Sie den Ring Zange zwischen zwei Embryonen und embryonalen ziehen Sie vorsichtig die Kette aus der Bauchhöhle. Von diesem Punkt an, halten die Embryonen hydratisiert mit steriler vorgewärmten PBS.
Kein Mikroskop zur Visualisierung erforderlich.
4. Die Injektion von DNA und Elektroporation
- Beginnen Sie mit einer der seitlichen Embryonen, wodurch es leichter zu verfolgen, welche Embryonen wurden elektroporiert zu halten. Sie nicht zu viel Zug auf der Embryonen, da dies das Risiko von Blutungen erhöhen. Manipulieren Sie die Position des Embryos innerhalb der Fruchtblase mit der Ring-Zange undStabilisierung der Kopf der Embryonen zwischen den Ringen. Leicht zusammendrücken, bis der Embryo nach oben treiben näher an der Gebärmutterwand.
- Mit der anderen Hand, nehmen Sie die Kapillarhalter und führen Sie die Nadel vorsichtig in der Mitte der Halbkugel, um die lateralen Ventrikel zielen. Drücken Sie das Pedal auf etwa 1 ul DNA-Lösung mit Fast Green (weniger als 1 ul zu studieren Dendriten) gemischt injizieren. Sie sollten beobachten den grünen Farbstoff Befüllen der lateralen Ventrikel. Kritische Schritte: - Die Schärfe der Nadel ist kritisch zu durchdringen richtig die Gebärmutterwand. Es ist wichtig, um die Bewegung der Nadel an der Oberfläche der Gebärmutterwand und nach dem Einsetzen in die Ventrikel zu minimieren, da eine Vergrößerung der Bohrung in das Austreten von Fruchtwasser und Embryo zum Tod führen. Vermeiden Sie Piercing Blutgefäße in der Gebärmutterwand, da dies zu Blutungen und Embryo zum Tod führen.
- Es ist wichtig, dass eine zu große Menge der DNA in den lateralen Ventrikel injiziert wird, weil es zu induzierenHydrocephalus (nicht mehr als 2 mu l bei E14.5). Das Volumen der DNA gemäß dem Zweck des Experiments eingestellt. Wenn 1μl wird im Allgemeinen für die meisten Experimente verwendet wird, wird ein kleineres Volumen von DNA (etwa 0,5 pl) für Dendriten und der Wirbelsäule Analyse. In der Tat ein paar isolierte Zellen benötigen, um gezielt, um zu visualisieren und messen Sie die dendritischen Dorn elektroporierte Neuronen werden. - Die Elektroden an den Seiten des Embryos Kopf mit dem positiven (+) Paddel auf der gleichen Seite wie die Ventrikel injiziert Cortex Elektroporation oder auf der gegenüberliegenden Seite des eingespritzten Ventrikel Hippocampus Elektroporation (2). Dann bewerben Sie sich fünf 30V elektrischen Impulsen (50 ms Dauer) bei 1 Sek. Intervallen. Kritischer Schritt: Vermeiden Sie die Anwendung über die Plazenta aktuell wie dies im Keim zum Tod führen wird.
All die Embryonen in einer schwangeren Maus kann elektroporiert, werden in der Regel mit dem gleichen DNA-Konstrukts, um Verwechslungen zu vermeiden. Jedoch eine lange Operation Abnahme on die Überlebensrate der Embryonen. Die Bauchhöhle sollte nicht länger als 30 min geöffnet werden.
5. Chirurgie nach der Elektroporation
- Nach Elektroporation der Embryonen, fügen PBS in die Bauchhöhle und verwenden Sie die Ring-Zange, um die Uterushorn in seinem ursprünglichen Standort zu ersetzen. Nähen Sie die Bauchdecke und die Haut mit Vicryl resorbierbare Fäden.
- Platzieren Sie das Tier in einer Erholung Kammer, bis er aufwacht (meist 5-10 min) und dann übertragen in einem Käfig auf einem Heizkissen platziert.
6. Post-Chirurgie
Überprüfen Sie das Verhalten der Mäuse zu Schmerzen, Leiden oder Ängste einzuschätzen und wiegen die Tiere 24 h und 48 h nach der Operation. Bei Bedarf können Schmerzmittel verabreicht, um Schmerzen und Beschwerden zu minimieren.
7. Gewebeeinbettsystem
Sammeln Sie die elektroporierte Embryonen oder Jungtieren bei den embryonalen oder postnatalen Stadien für das Experiment erforderlich.
ove_content "> - Für die Analyse der embryonalen Stufen (z. B. die Zellproliferation und Migration zu untersuchen):Einschläfern Mutter über Genickbruch und sammeln die Embryonen. Nach Enthauptung, wählen Sie die Gehirne, die korrekt elektroporiert, wie von der Menge und Ort der Fluoreszenz-Signal angezeigt, visualisiert über den Schädel mit einem fluoreszierenden Fernglas. Sezieren das Gehirn aus dem Schädel und fixieren über Nacht in 4% PFA und dann in 20% Saccharose / PBS über Nacht. Einbetten in OCT-Verbindung, Einfrieren bei -80 ° C und Abschnitt mit Hilfe eines Kryostaten.
- Zur Analyse an postnatalen Stadien (zum Beispiel an Dendriten und Dornen-Studie):
Anesthetize Welpen oder erwachsenen Mäusen mit einer intraperitonealen Injektion von Pentobarbital (40-60 mg / kg) und führen transcardial Perfusion mit PBS, gefolgt von 4% PFA in PBS. Sezieren die Gehirne aus dem Schädel und Post-fix in 4% PFA über Nacht. Nach Waschen in PBS, Abschnitt das Gehirn mit Hilfe eines Vibratom (100 um Abschnitte für dendrite Analyse). Montieren Sie die Abschnitte in Aqua Poly / Mount mit 0,16 bis 0,19 mm dicken Deckgläsern zu Bild Dendriten und Dornen.
8. Repräsentative Ergebnisse
3 zeigt Beispiele für elektroporierten Zellen in der Großhirnrinde (3A, B), in der CA1 (3C, D) und im Gyrus dentatus des Hippocampus (3E, F). Wildtyp-Mäuse wurden im E14.5 mit einem GFP-Konstrukt (PCA-b-EGFPm5 Schalldämpfer 3) und Gehirne wurden am postnatalen Tag (P) 14 geerntet elektroporiert. Durch Einspritzen einer kleinen Menge der DNA-Lösung (0,5 ul oder weniger einer Lösung bei 1 ug / ul), sind ein paar Zellen markiert, die ermöglicht die Visualisierung der dendritischen Verzweigungen von isolierten GFP +-Zellen (Abbildung 3) sowie deren Stacheln bei stärkerer Vergrößerung (Abbildung 4).
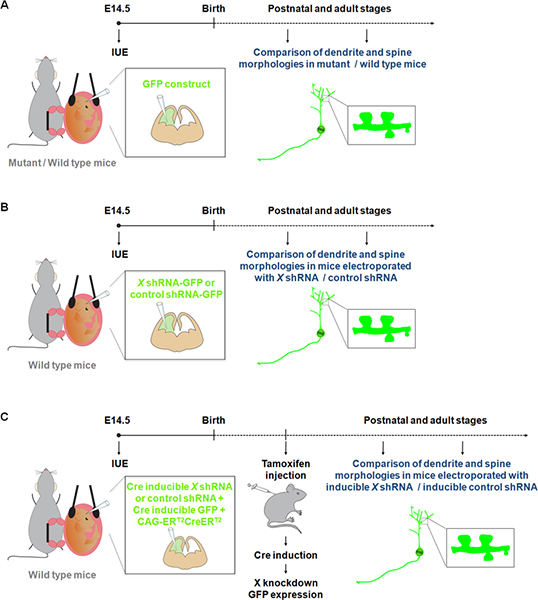
Abbildung 1. Schematische Darstellung der Elektroporation Protokolle, die verwendet werden, um Dendriten und Dornen studieren können. (A) Elektroporation von einem GFP-Konstrukt, um Dendriten und Dornen in Wildtyp-und mutierten Mäusen zu vergleichen. (B) Elektroporation von GFP-shRNA (GFP aus dem gleichen Konstrukt exprimiert) Zum Dendriten und Dornen in Mäusen mit einem shRNA elektroporiert konstruieren, die spezifisch für ein Gen von Interesse (X) oder einer Steuerung shRNA. (C) IUE kann zusammen mit einem Cre-induzierbare System verwendet werden, um die Expression der shRNA auf die gewünschte Zeitdauer zu beschränken. In diesem Experiment Expression eines Vektors eine Form der Cre-Rekombinase, die von 4-Hydroxytamoxifen aktiviert werden kann (CAG-ER T2 Creer T2; 1 ug / ul) 10, zusammen mit einem Vektor, der ein shRNA in einer Cre abhängigen elektroporiert Weise (1 ug / ul, und mit einer Rekombination Indikator (CALNL-GFP-Konstrukt, GFP-Expression induzierbar durch Cre;. 1 ug / ul) 10 Die Effizienzcy des Zuschlags kann durch Erhöhen der Konzentration des shRNA sowie eine Erhöhung CAG-ER T2 Creer T2 Konzentration verbessert werden.
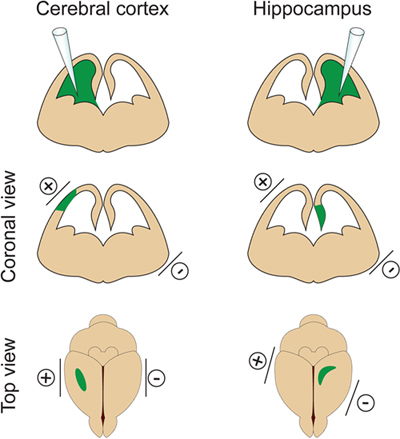
Abbildung 2. Räumliche Steuerung der Elektroporation. Diese Abbildung zeigt, wo die Paddle-Elektroden nach der DNA an der Injektionsstelle, um die Gehirnrinde oder den Hippocampus Zielposition.
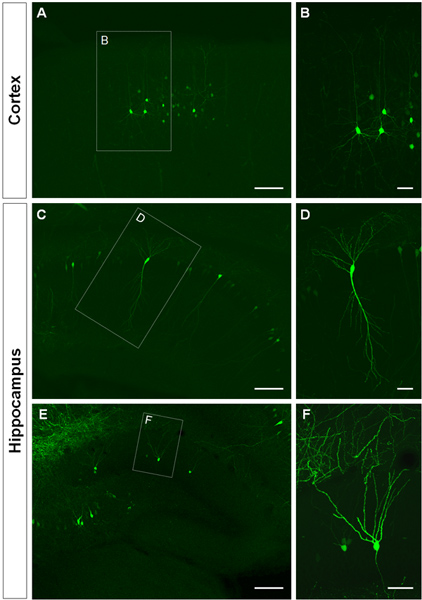
Abbildung 3. Visualisierung der dendritischen Dorn in utero Elektroporation Zellen in der Hirnrinde und im Hippocampus. (A, B) Im koronaren Schnitte zeigen GFP + Pyramidenzellen in der Hirnrinde, (CD) in CA1 Pyramidenzellen des Hippocampus und (E, F), Körnerzellen im Gyrus dentatus auf P14. Ein GFP-Konstrukt (PCA-b-EGFPm5 Schalldämpfer 3) wurde bei E14.5 elektroporiert. Höhere Vergrößerung Bilder (B, D, F) zeigen, dass IUE eine effiziente Methode zur Visualisierung von Dendriten ist. Maßstabsbalken repräsentieren 50 um (B, D und F), 150 um (A, C, E).
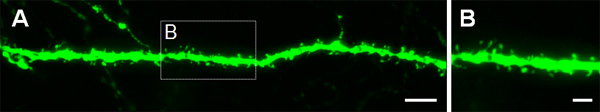
Abbildung 4. Visualisierung von dendritischen Dornen in P14 Neuronen, die in utero bei E14.5 mit einem GFP-exprimierenden Konstrukt wurden elektroporiert. (A, B) Hohe Vergrößerung Bilder von Stacheln aus basalen Dendriten von Pyramidenzellen des Hippocampus. Scale-Balken stellen 5 um (A) und 2 um (B).
Discussion
IUE ist ein leistungsfähiges Werkzeug, um die Genexpression nicht nur im Raum sondern auch in der Zeit zu manipulieren. Wir zeigen hier, dass diese Technik verwendet werden, um sichtbar zu machen und genetisch manipulieren, Dendriten und Dornen in der Hirnrinde und im Hippocampus von Mäusen werden. Neben den Vorteilen zuvor zitierten, ist es erwähnenswert, dass IUE, im Gegensatz zur Methode Golgi, können mit Immunhistochemie oder in situ Hybridisierung, die zum Beispiel auf den Phänotyp elektroporierten Zellen können kombiniert werden. Es ist auch wichtig zu erwähnen, dass dieses Verfahren nicht induziert offensichtlich Hirnfehlbildungen trotz seiner relativen Invasivität. Außerdem auf der zellulären Ebene, hat IUE nicht verändern die elektrophysiologischen Eigenschaften der Neuronen elektroporierte 13. Während unserer Demonstration konzentriert sich auf die Visualisierung von Dendriten und Wirbelsäule Morphologien, könnte IUE der kortikalen Neuronen im Hippocampus oder bei E14.5 auch verwendet, um andere Entwicklungsstörungen Veranstaltungen wie Axon Bildung und Anleitung zu studieren. In hinzufügenition, die gleiche Art von Protokoll könnte in anderen Stadien der embryonalen Entwicklung umgesetzt werden, um verschiedene Bevölkerungsgruppen anzusprechen. Zum Beispiel kann ein Entwicklungs sehr spät kortikalen Elektroporation Paradigma an E18.5 durchgeführt, um die Expression in Astrozyten Vorläuferzellen 1 gebracht werden. In ähnlicher Weise, während eine Elektroporation des Hippocampus bei E14.5 ermöglicht CA1-CA3 Pyramidenneuron Vorläufer und dentatus Körnerzellen Vorläuferzellen zur gleichen Zeit richten, wäre ein Ende des Hippocampus Elektroporation (E18.5 oder frühen postnatalen) erlaubt, verschiedene dentatus Granulat Ziel Vorläuferzellen 14. In diesem Fall kann die eingespritzte Menge von DNA als auch die Stromstärke erhöht werden.
Transgene durch IUE eingeführt scheinen episomal bleiben und werden daher von den Zellen nach wiederholten Zellteilungen verloren. In postmitotischen Zellen wie Neuronen, jedoch bleiben die episomale Transgene seit Monaten aktiv nach der Elektroporation ermöglicht Langzeitstudien 13, 15. In unserer Studie haben wir helle GFP +-Zellen beobachtet, die bis zu 7 Wochen nach der Geburt (die neueste Zeit Punkt, den wir analysiert) darauf hinweist, dass embryonale Ausrichtung der kortikalen oder neuronalen Vorläuferzellen des Hippocampus mit IUE zu bleibender Expression des Transgens aus frühen Entwicklungsstadien Zeitpunkten bis bis zum Erwachsenenalter.
Eine aktuelle Einschränkung der Technik ist, dass es schwierig ist, eine genaue Kontrolle über die Gesamtzahl der elektroporierten Zellen ausüben. Jedoch, durch Verringern der eingespritzte Menge der DNA-Lösung, haben wir gezeigt, dass es möglich ist, ein paar Zellen zu markieren und die dendritische Verzweigung von GFP +-Zellen isoliert und ihre Wirbelsäule zu visualisieren. Die Dimension der transfizierten Bereich könnte auch durch eine Änderung der Parameter der Elektroporation wie Stromstärke für die Anzahl der Impulse oder der Durchmesser der Elektroporation Schaufeln eingestellt werden.
Insgesamt IUE ist eine Methode, die einfach zu implementieren, ist eine schnelle undeffizienter zu Dendriten und Dornen in vivo zu untersuchen.
Acknowledgements
Die Autoren bedanken sich bei Dr. Kathleen Mathers, Dr. Jean-Philippe Mocho und Dr. Yolanda Saavedra Torres für ihre Hilfe danken, die in utero Elektroporation unter aseptischen Verfahren ausführen können, und Hayley Wood für ihre Hilfe, um die Zeichnungen vorbereiten.
EP wurde durch eine langfristige Federation of European Biochemical Societies (FEBS) und einem Stipendium Medical Research Council (MRC) berufliche Entwicklung der Gemeinschaft, MAH durch eine Wellcome Trust Zuschuss an Elizabeth Fisher und Victor Tybulewicz (080174/B/06/Z) unterstützt , HW durch ein EMBO-Langzeit-Stipendiums und RA durch ein Stipendium MRC. Diese Arbeit wurde von einem Projekt Beihilfe des Wellcome Trust (086947/Z/08/Z) und durch ein Grant-in-Aid aus dem Medical Research Council (U117570528) bis FG unterstützt
Materials
| Name | Company | Catalog Number | Comments | |||
| Name des Reagenzes | Firma | Katalog-Nummer | Kommentare | |||
| Vorbereitung von Nadeln und DNA-Lösung zur Injektion | ||||||
| Endofree Plasmid Maxi Kit | Qiagen | 12362 | ||||
| Fast Green | Sigma | F-7258 | ||||
| Borosilikatglas Kapillaren 1,0 mm AD x 0,58 mm ID | Harvard Apparatus | 30-0016 | ||||
| Microloader Tipps | Eppendorf | 5242956003 | Für Eppendorf-Pipetten 0,5 ul-10 ul / ul 2-20 | |||
| & Nbsp; | Material für die Chirurgie | |||||
| Extra dünne Iris Schere | Fine Science Tools | 14088-10 | ||||
| Gebogenen Pinzette | Fine Science Tools | 91197-00 | ||||
| Ring Zange | Fine Science Tools | 11103-09 | ||||
| Nadelhalter | Fine Science Tools | 12002-12 | ||||
| Graefe Pinzette | Fine Science Tools | 11050-10 | ||||
| Resorbierbares Nahtmaterial Vicryl | Ethicon Inc (Johnson & Johnson) | W9074 | ||||
| Sterilen Tüchern 30cm x 45 cm | Buster | 141765 | ||||
| Sterile Tupfer | Shermond | Huby-340 | ||||
| Wattestäbchen | Saubere Kreuz Co., Ltd | 1860 | ||||
| Buprenorphin (Vetergesic) | Alstoe Tiergesundheit | |||||
| Chlorhexidin | Vetasept | XHG007 | ||||
| Eye Gel Viscotears | Novartis | |||||
| Isofluran | Abbott Laboratories | B506 | ||||
| Pentoject, Pentobarbital Natrium 20% | Animalcare | |||||
| Die Elektroporation | ||||||
| Electroporator | BTX | ECM830 | ||||
| Platinum Tweezertrode 5mm | BTX, Harvard Apparatus | 45-0489 | ||||
| FemtoJet Mikroinjektor | Eppendorf | 5247000030 | ||||
| Fußschalter für FemtoJet Mikroinjektor | Eppendorf | 5247623002 | ||||
| Kapillarhalter | Eppendorf | 5176190002 | ||||
| Gewebeverarbeitung | ||||||
| Paraformaldehyd | Sigma | P6148 | ||||
| Saccharose | VWR (Prolabo) | 27480.294 | ||||
| Objektträger | ThermoScientific (Menzel-Gläser) | J1800AMNZ | ||||
| Deckgläser | Menzel-Gläser | 22 x 50 mm # 1,5 | ||||
| Aqua Poly / Mount | Polysciences, Inc | 18606 | ||||
References
- Kolk, S. M., de Mooij-Malsen, A. J., Martens, G. J. Spatiotemporal Molecular Approach of in utero Electroporation to Functionally Decipher Endophenotypes in Neurodevelopmental Disorders. Front Mol. Neurosci. 4, 37 (2011).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol. 240, 237-246 (2001).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Dev. Growth Differ. 50, 499-506 (2008).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Tabata, H., Nakajima, K. Labeling embryonic mouse central nervous system cells by in utero electroporation. Dev. Growth Differ. 50, 507-511 (2008).
- Castro, D. S. A novel function of the proneural factor Ascl1 in progenitor proliferation identified by genome-wide characterization of its targets. Genes Dev. 25, 930-945 (2011).
- Pacary, E. Proneural transcription factors regulate different steps of cortical neuron migration through Rnd-mediated inhibition of RhoA signaling. Neuron. 69, 1069-1084 (2011).
- Marteau, L. Angiopoietin-2 regulates cortical neurogenesis in the developing telencephalon. Cereb Cortex. 21, 1695-1702 (2011).
- Ramon Moliner, E. . Comparative Methods in Neuroanatomy. , (1970).
- Banks, G. T. Behavioral and other phenotypes in a cytoplasmic Dynein light intermediate chain 1 mutant mouse. J. Neurosci. 31, 5483-5494 (2011).
- Elias, G. M., Elias, L. A., Apostolides, P. F., Kriegstein, A. R., Nicoll, R. A. Differential trafficking of AMPA and NMDA receptors by SAP102 and PSD-95 underlies synapse development. Proc. Natl. Acad. Sci. U.S.A. 105, 20953-20958 (2008).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U.S.A. 104, 1027-1032 (2007).
- Navarro-Quiroga, I., Chittajallu, R., Gallo, V., Haydar, T. F. L. o. n. g. -. t. e. r. m. selective gene expression in developing and adult hippocampal pyramidal neurons using focal in utero electroporation. J. Neurosci. 27, 5007-5011 (2007).
- Nakahira, E., Yuasa, S. Neuronal generation, migration, and differentiation in the mouse hippocampal primoridium as revealed by enhanced green fluorescent protein gene transfer by means of in utero electroporation. J. Comp. Neurol. 483, 329-340 (2005).
- Ramos, R. L., Bai, J., LoTurco, J. J. Heterotopia formation in rat but not mouse neocortex after RNA interference knockdown of DCX. Cereb Cortex. 16, 1323-1331 (2006).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved