Visualizzazione e manipolazione genetica di dendriti e spine nella corteccia cerebrale e nell'ippocampo mouse utilizzando
In This Article
Summary
Questo articolo descrive in dettaglio un protocollo per elettroporare in utero della corteccia cerebrale e l'ippocampo a E14.5 nei topi. Abbiamo anche dimostrato che questo è un metodo valido per studiare dendriti e spine in queste due regioni cerebrali.
Abstract
In elettroporazione utero (IUE) è diventata una tecnica potente per studiare lo sviluppo delle varie regioni del sistema nervoso embrionale 1-5. Ad oggi questo strumento è stato ampiamente utilizzato per studiare la regolazione della proliferazione cellulare, la differenziazione neuronale e migrazione specialmente nei paesi corteccia cerebrale 6-8. Qui di seguito troverai il nostro protocollo di elettroporare in utero della corteccia cerebrale e l'ippocampo e fornire la prova che questo approccio può essere utilizzato per studiare dendriti e spine in queste due regioni cerebrali.
Visualizzazione e manipolazione di neuroni in colture primarie hanno contribuito ad una migliore comprensione dei processi coinvolti nella dendrite, colonna vertebrale e lo sviluppo delle sinapsi. Tuttavia neuroni in crescita in vitro non sono esposti a tutti i segnali fisiologici che possono influire dendrite e / o di formazione delle spine e manutenzione durante il normale sviluppo. La nostra conoscenza delle strutture dendritiche e della colonna vertebrale 9. Tuttavia, colorazione Golgi è considerato essere imprevedibile. Infatti, gruppi di cellule nervose e tratti di fibre sono etichettati in modo casuale, con aree particolari spesso apparire completamente tinto mentre le aree adiacenti sono privi di colorazione. Recenti studi hanno dimostrato che IUE di costrutti fluorescenti rappresenta un attraente metodo alternativo per studiare dendriti, spine e sinapsi in topi mutanti / wild-type 10-11 (Figura 1A). Inoltre rispetto alla generazione di knockouts topo, IUE rappresenta un approccio rapido per eseguire aumento e calo di studi in funzione specifica popolazione di cellule durante una finestra di tempo specifico. Inoltre, IUE è stato usato con successo con l'espressione genica inducibile o inducibile RNAi avvicina definire il controllo temporale sopra l'espressione di un gene o shRNA 12. Questi vantaggi di IUE hanno così opened nuove dimensioni per studiare l'effetto dell'espressione genica / soppressione sui dendriti e spine, non solo in particolari strutture cerebrali (Figura 1B), ma anche in un punto temporale specifico di sviluppo (figura 1C).
Infine, IUE fornisce uno strumento utile per identificare interazioni funzionali tra i geni coinvolti nella dendrite, colonna vertebrale e / o sviluppo delle sinapsi. Infatti, contrariamente ad altri metodi di trasferimento genico, quali virus, è semplice per combinare più RNAi o transgeni in stessa popolazione di cellule.
In sintesi, IUE è un metodo potente che ha già contribuito alla caratterizzazione dei meccanismi molecolari alla base della funzione del cervello e della malattia e dovrebbe anche essere utile nello studio dei dendriti e spine.
Protocol
Nel Regno Unito, i topi sono alloggiati, allevati e trattati secondo le linee guida approvate dal Ministero degli Interni sotto la Animal (Scientific Procedures) Act 1986.
1. Preparazione: Soluzione DNA e Needles
- Purificare il DNA con un plasmide libero Endotoxin Maxi-prep kit. Preparare la soluzione plasmide DNA iniettabile a concentrazioni desiderate in acqua e aggiungere Fast Green (concentrazione finale di 0,05%) per visualizzare iniezioni. L'efficienza di elettroporazione è altamente dipendente dalla concentrazione di DNA. Una concentrazione di 1 pg / pl viene generalmente utilizzato. Questa concentrazione è sufficiente per visualizzare i neuroni elettroporate senza compromettere il loro sviluppo. Tuttavia, secondo il promotore utilizzato nel vettore plasmidico (basso livello di espressione con promotore di citomegalovirus / enhancer, con forte livello di espressione del citomegalovirus enhancer precoce immediato e β-actina di pollo fusione promotore (CAG) promotore), nonché le dimensioni e la stabilità della proteina espressa, questa concentrazione può essere regolato (0,25 pg / pl a 5 pg / pl).
- Tirare aghi di vetro con un estrattore micropipetta.
2. Preparazione della Chirurgia
- Autoclavare strumenti chirurgici e saline tampone fosfato (PBS).
- Preparare la soluzione analgesico in PBS (buprenorfina, Vetergesic, concentrazione finale di 30 ug / ml). Pesare il mouse incinta iniettare per via sottocutanea e 0,1 mg / kg di Vetergesic almeno 30 minuti prima della chirurgia. Durante questo tempo, preparare la zona chirurgica. Accendere i rilievi di riscaldamento e la camera di recupero. Mettere PBS sterile in bagno di acqua calda e tutti gli strumenti sterili e materiali su teli sterili. Posizionare gli elettrodi di platino in un bicchiere pieno di PBS e connettersi al elettroporatore. Riempire l'ago con la soluzione di DNA con una punta microloader, collegare l'ago al titolare capillare e pizzicare la punta dell'ago con una pinza.
- Anestetizzare un topo in stato di gravidanza (E14.5, E15.5) con isoflurano in carrier di ossigeno (ossigeno 2 l / min) utilizzando una camera di anestetico di induzione. Attendere che l'animale perde il riflesso di raddrizzamento.
- Trasferire l'animale a una maschera di "pre-chirurgia". Mettere una goccia di gel occhio su ciascun occhio per evitare ulcerazioni della cornea degli occhi, mentre la madre è in anestesia generale. Utilizzare un rasoio elettrico a radersi i capelli dell'addome. Pulire la zona rasata una volta con clorhexidine per raccogliere i capelli volo.
- Trasferire l'animale a una seconda maschera nella zona di intervento. Posizionate il mouse con la schiena sul cuscino. Avviare la chirurgia quando il riflesso pedale è andato perduto.
- Indossare maschera e guanti sterili. Coprire l'animale con un telino sterile (con un piccolo foro sopra l'addome) per evitare che i tessuti e gli strumenti vengano contaminate dalle aree di pelle che non sono stati rasati e disinfettati. Pulire la zona rasata unot almeno 3 volte con clorhexidine. Usare un tampone di cotone sterile diverso ogni volta. Utilizzare un bisturi per fare una incisione verticale lungo la linea mediana (~ 1 pollice lungo) attraverso la pelle. Usando le forbici, praticare un'incisione simile del muscolo dell'addome lungo la linea alba (linea bianca composta principalmente di collagene del tessuto connettivo).
- Scegliere gli embrioni più accessibili e posizionare la pinza ad anelli tra due embrioni e tirare la catena embrionale dalla cavità addominale. Da questo punto in poi, tenere gli embrioni idratata con sterile preriscaldata PBS.
N microscopio è richiesto per la visualizzazione.
4. L'iniezione di DNA e di elettroporazione
- Inizia con uno dei laterali più embrioni, rendendo più facile tenere traccia di quali sono state elettroporate embrioni. Non tirare troppo sugli embrioni in quanto ciò aumenta il rischio di emorragia. Manipolare la posizione dell'embrione all'interno del sacco amniotico utilizzando i pinza ad anelli estabilizzare la testa degli embrioni tra gli anelli. Premere delicatamente per spingere verso l'alto l'embrione più vicino alla parete uterina.
- Con l'altra mano, prendere il titolare capillare e inserire l'ago attentamente in mezzo dell'emisfero per indirizzare il ventricolo laterale. Premere il pedale per iniettare circa 1 pl di soluzione di DNA miscelato con Fast Green (meno di 1 pl per studiare dendriti). Si dovrebbe osservare il colorante verde di riempimento del ventricolo laterale. Passaggi critici: - la nitidezza l'ago è fondamentale per forare correttamente la parete uterina. È importante ridurre al minimo il movimento dell'ago alla superficie della parete uterina e dopo l'inserimento nel ventricolo causa un allargamento del foro porterà alla fuoriuscita di liquido amniotico e morte embrionale. Evitare di vasi sanguigni penetranti nella parete uterina, come questo si tradurrà in emorragia e la morte dell'embrione.
- È importante non iniettare un volume troppo grande di DNA nel ventricolo laterale perché indurràidrocefalo (non superino il 2 ul a E14.5). Il volume di DNA viene regolato secondo lo scopo dell'esperimento. Se 1ml è generalmente utilizzato per la maggior parte degli esperimenti, un volume minore di DNA (circa 0,5 pl) è richiesto per dendrite e l'analisi della colonna vertebrale. Infatti poche cellule isolate devono essere mirate al fine di visualizzare e misurare il pergolato dendritica dei neuroni elettroporate. - Posizionare gli elettrodi sui lati della testa dell'embrione con il polo positivo (+) paddle sullo stesso lato come il ventricolo iniettato per elettroporazione corteccia o sul lato opposto del ventricolo iniettato per elettroporazione dell'ippocampo (Figura 2). Quindi applicare cinque impulsi elettrici 30V (50 msec durata) ad intervalli di 1 sec. Passaggio critico: Evitare l'applicazione di corrente attraverso la placenta in quanto ciò può provocare la morte dell'embrione.
Tutti gli embrioni di un topo in stato di gravidanza può essere elettroporate, di solito con lo stesso DNA costrutto per evitare qualsiasi confusione. Tuttavia, una diminuzione lungo intervento chirurgico è il tasso di sopravvivenza degli embrioni. La cavità addominale non deve essere aperta più di 30 min.
5. Chirurgia Post-elettroporazione
- Dopo electroporating gli embrioni, aggiungere PBS nella cavità addominale e utilizzare le pinza ad anelli per sostituire il corno uterino nella sua posizione originale. Suturare la parete addominale e pelle con Vicryl suture riassorbibili.
- Mettete l'animale in una camera di recupero fino a quando non si sveglia (min di solito 5-10) e poi trasferirli in una gabbia posta su un rilievo del heating.
6. Post-operatorio
Controllare il comportamento dei topi per valutare il dolore, sofferenza o angoscia e pesare gli animali 24 h e 48 h dopo l'intervento chirurgico. Se necessario, analgesici può essere somministrata per minimizzare il dolore e disagio.
7. Tissue Processing
Raccogliere gli embrioni elettroporate o cuccioli nelle fasi embrionali o post-natale necessari per l'esperimento.
ove_content "> - Per l'analisi in fasi embrionali (per esempio per studiare la proliferazione cellulare o la migrazione):Euthanize madre via dislocazione cervicale e raccogliere gli embrioni. Dopo decapitazione, selezionare i cervelli che sono state elettroporate correttamente, come indicato dalla quantità e la posizione del segnale fluorescente, visualizzato attraverso il cranio con un binoculare fluorescente. Sezionare il cervello fuori dal cranio e fissare una notte in 4% PFA e poi posto in 20% di saccarosio / PBS durante la notte. Incorpora in compound ottobre, il congelamento a -80 ° C e la sezione con un criostato.
- Per l'analisi in una fase post-natale (per esempio per studiare dendriti e spine):
Anestetizzare cuccioli o topi adulti con iniezione intraperitoneale di pentobarbitone (40-60 mg / kg) ed eseguire perfusione transcardial con PBS, seguito da 4% in PBS PFA. Sezionare il cervello fuori dal cranio e post-fix in 4% PFA durante la notte. Dopo lavaggi in PBS, la sezione cervello utilizzando un vibratomo (100 sezioni micron per dendrite analisi). Montare le sezioni in Poly Aqua / mount utilizzando coprioggetto 0.16-0.19 mm di spessore per dendriti delle immagini e spine.
8. Rappresentativi risultati
La figura 3 mostra esempi di cellule elettroporate nella corteccia cerebrale (Figure 3A, B), nella CA1 (figure 3C, D) e nel giro dentato dell'ippocampo (figure 3e, F). Topi wild-type sono state elettroporate a E14.5 con un costrutto GFP (PCA-b-EGFPm5 silenziatore 3) e il cervello sono state raccolte al giorno postnatale (P) 14. Iniettando un piccolo volume di soluzione di DNA (0,5 pl o meno di una soluzione a 1 pg / pl), alcune celle sono etichettati, che permette la visualizzazione del arborizzazione dendritica di isolate GFP + cellule (figura 3) così come le loro spine con un ingrandimento maggiore (Figura 4).
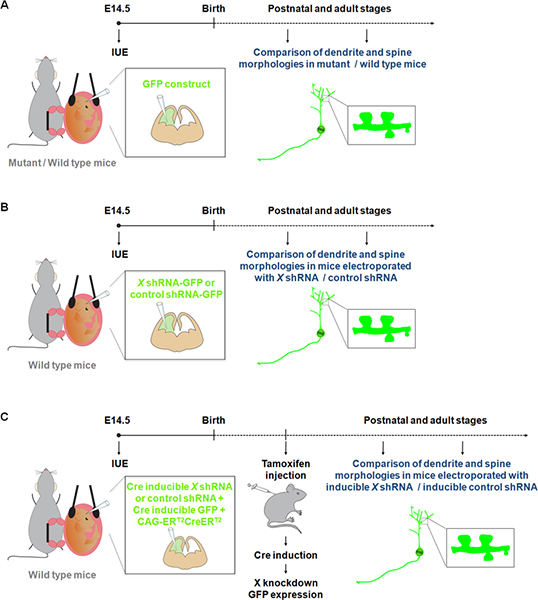
Figura 1. Rappresentazione schematica di elettroporazione protocolli che possono essere utilizzati per studiare dendriti e spine. (A) elettroporazione di un costrutto GFP per confrontare i dendriti e spine nei topi wild-type e mutanti. (B) Elettroporazione di GFP-shRNA (GFP è espressa dal costrutto stesso) per confrontare dendriti e spine in topi elettroporata con un costrutto shRNA specifico per un gene di interesse (X) o un shRNA controllo. (C) IUE possono essere utilizzati insieme con un sistema inducibile Cre per limitare l'espressione del shRNA al periodo di tempo auspicabile. In questo esperimento, un vettore che esprime una forma di ricombinasi Cre che può essere attivato da 4-hydroxytamoxifen (CAG-ER T2 CREER T2; 1 pg / pl) 10, viene elettroporata con un vettore che esprime una shRNA specifica in un Cre dipendente modo (1 pg / pl, e con un indicatore di ricombinazione (CALNL-GFP costrutto, espressione inducibile GFP da Cre;. 1 pg / pl) 10 Il efficienzecy del knockdown può essere migliorata aumentando la concentrazione del shRNA così come l'aumento CAG ER-T2 CREER concentrazione T2.
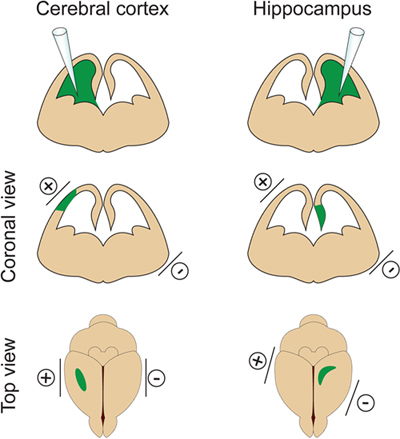
Figura 2. Controllo spaziale di elettroporazione. Questa figura mostra dove posizionare gli elettrodi paletta secondo la sito di iniezione del DNA per indirizzare la corteccia cerebrale e nell'ippocampo.
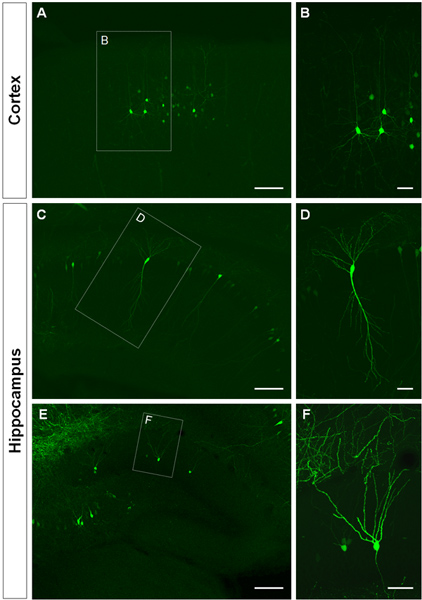
Figura 3. Visualizzazione del pergolato dendritiche in utero elettroporate di cellule nella corteccia cerebrale e nell'ippocampo. (A, B) sezioni coronali che mostrano GFP + cellule piramidali della corteccia cerebrale, (CD) cellule piramidali di CA1 dell'ippocampo e (E, F), cellule granulari del giro dentato a P14. Un costrutto GFP (PCA-b-EGFPm5 silenziatore 3) è stato elettroporate a E14.5. Immagini maggiore ingrandimento (B, D, F) mostrano che IUE è un metodo efficace per visualizzare dendriti. Barre di scala rappresentano 50 micron (B, D e F), 150 micron (A, C, E).
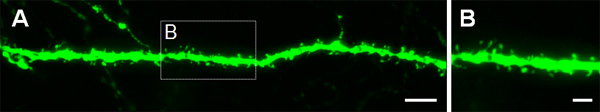
Figura 4. Visualizzazione di spine dendritiche in P14 neuroni che sono stati elettroporate in utero ad E14.5 con un costrutto che esprime GFP. (A, B) le immagini ad alto ingrandimento di spine da dendriti basali dei neuroni piramidali dell'ippocampo. Barre di scala rappresentano 5 micron (A) e 2 micron (B).
Discussion
IUE è un potente strumento per manipolare l'espressione genica non solo nello spazio ma anche nel tempo. Mostriamo qui che questa tecnica può essere usata per visualizzare e manipolare geneticamente dendriti e spine nella corteccia cerebrale e nell'ippocampo dei topi. Oltre ai vantaggi precedentemente citati, è opportuno notare che IUE, a differenza di Golgi metodo, può essere combinato con immunoistochimica o ibridazione in situ, che permette ad esempio di fenotipo delle cellule elettroporate. E 'inoltre importante ricordare che questa procedura non induce malformazioni cerebrali evidenti nonostante la sua relativa invasività. Inoltre, a livello cellulare, IUE non modificare le proprietà elettrofisiologiche del elettroporata neuroni 13. Mentre la nostra manifestazione si concentra sulla visualizzazione delle morfologie dendritiche e della colonna vertebrale, IUE dei neuroni corticali e dell'ippocampo a E14.5 potrebbe anche essere utilizzato per studiare altri eventi di sviluppo come la formazione degli assoni e di orientamento. In aggiuntaition, lo stesso tipo di protocollo, possono essere attuate in altre fasi dello sviluppo embrionale per indirizzare le diverse popolazioni. Ad esempio, un paradigma elettroporazione evolutivamente molto tardi corticale E18.5 può essere eseguita per guidare l'espressione in progenitori astrocitari 1. Analogamente, mentre un elettroporazione dell'ippocampo a E14.5 consente di indirizzare CA1-CA3 progenitori dei neuroni piramidali e cellule progenitrici dentato granuli al tempo stesso, uno elettroporazione ritardo ippocampo (E18.5 o precoce postnatale) consentirebbe di indirizzare differenti granulo dentata progenitori 14. In questo caso, il volume iniettato di DNA può essere aumentata come pure l'intensità della corrente.
Transgeni introdotti da IUE sembrano rimanere episomiale e sono quindi persi dalle cellule seguenti divisioni cellulari successive. In cellule postmitotico quali neuroni, tuttavia, i transgeni episomale rimangono attive per mesi dopo l'elettroporazione consentendo studi a lungo termine 13, 15. Nel nostro studio, abbiamo osservato luminoso GFP + cellule fino a 7 settimane dopo la nascita (il punto di ultima ora abbiamo analizzato) che indicano che embrionale di mira dei precursori neuronali corticali e dell'ippocampo che utilizzano i risultati IUE in persistente espressione del transgene dai primi momenti dello sviluppo fino fino all'età adulta.
Una limitazione di corrente della tecnica è che è difficile esercitare un controllo preciso del numero totale di cellule elettroporate. Tuttavia, diminuendo il volume iniettato di soluzione di DNA, abbiamo dimostrato che è possibile marcare poche cellule e per visualizzare la arborizzazione dendritica di GFP + cellule isolate, nonché le loro spine. La dimensione della zona trasfettata potrebbe anche essere regolato modificando i parametri di elettroporazione, come intensità di corrente e il numero di impulsi o il diametro delle pale elettroporazione.
Complessivamente IUE è un metodo che è facile da implementare, rapida eefficace per studiare dendriti e spine in vivo.
Acknowledgements
Gli autori desiderano ringraziare il Dott. Kathleen Mathers, il dottor Jean-Philippe Mocho e il dottor Yolanda Saavedra Torres per il loro aiuto ad esibirsi in elettroporazione utero nell'ambito delle procedure asettiche, e Wood Hayley per il suo aiuto per preparare i disegni.
EP è stato sostenuto da un lungo periodo Federazione delle società biochimiche europee (FEBS) e una borsa di studio del Medical Research Council (MRC) borsa di studio lo sviluppo della carriera, MAH da un Wellcome Trust sovvenzione Elizabeth Fisher e Victor Tybulewicz (080174/B/06/Z) , HW da un lungo periodo EMBO fellowship e RA da una borsa di studio MRC. Questo lavoro è stato sostenuto da una borsa di studio del progetto del Wellcome Trust (086947/Z/08/Z) e da un Grant-in-Aid dal Medical Research Council (U117570528) a FG
Materials
| Name | Company | Catalog Number | Comments | |||
| Nome del reattivo | Azienda | Numero di catalogo | Comments | |||
| Preparazione di aghi e soluzione di DNA per iniezione | ||||||
| Endofree kit Maxi plasmide | Qiagen | 12362 | ||||
| Fast Green | Sigma | F-7258 | ||||
| Vetro borosilicato capillari 1,0 millimetri OD x 0,58 mm ID | Harvard Apparatus | 30-0016 | ||||
| Microloader suggerimenti | Eppendorf | 5242956003 | Per Eppendorf pipette 0,5 pl-10 pl / 2-20 pl | |||
| & Nbsp; | Materiale per chirurgia | |||||
| Extra forbici Iris sottili | Strumenti di Scienze Belle | 14088-10 | ||||
| Pinze curve | Strumenti di Scienze Belle | 91197-00 | ||||
| Anello pinza | Strumenti di Scienze Belle | 11103-09 | ||||
| Porta aghi | Strumenti di Scienze Belle | 12002-12 | ||||
| Graefe Pinza | Strumenti di Scienze Belle | 11050-10 | ||||
| Vicryl sutura assorbibile | Ethicon Inc (Johnson & Johnson) | W9074 | ||||
| Teleria sterile 30cm x 45 cm | Buster | 141765 | ||||
| Tamponi sterili | Shermond | Huby-340 | ||||
| Cotton fioc | Clean Croce Co., Ltd | 1860 | ||||
| Buprenorfina (Vetergesic) | Alstoe Animal Health | |||||
| Clorhexidine | Vetasept | XHG007 | ||||
| Eye Gel Viscotears | Novartis | |||||
| Isoflurano | Abbott Laboratories | B506 | ||||
| Pentoject, Sodio Pentobarbitone 20% | Animalcare | |||||
| Elettroporazione | ||||||
| Elettroporatore | BTX | ECM830 | ||||
| Platinum Tweezertrode 5 millimetri | BTX, Harvard Apparatus | 45-0489 | ||||
| FemtoJet microiniettore | Eppendorf | 5247000030 | ||||
| Pedale di controllo per FemtoJet microiniettore | Eppendorf | 5247623002 | ||||
| Porta capillare | Eppendorf | 5176190002 | ||||
| Tissue di elaborazione | ||||||
| Paraformaldeide | Sigma | P6148 | ||||
| Saccarosio | VWR (Prolabo) | 27480.294 | ||||
| Vetrini | ThermoScientific (Menzel-Glaser) | J1800AMNZ | ||||
| Coprivetrini | Menzel-Glaser | 22 x 50 mm # 1,5 | ||||
| Aqua Poly / mount | Polysciences, Inc | 18606 | ||||
References
- Kolk, S. M., de Mooij-Malsen, A. J., Martens, G. J. Spatiotemporal Molecular Approach of in utero Electroporation to Functionally Decipher Endophenotypes in Neurodevelopmental Disorders. Front Mol. Neurosci. 4, 37 (2011).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol. 240, 237-246 (2001).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Dev. Growth Differ. 50, 499-506 (2008).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Tabata, H., Nakajima, K. Labeling embryonic mouse central nervous system cells by in utero electroporation. Dev. Growth Differ. 50, 507-511 (2008).
- Castro, D. S. A novel function of the proneural factor Ascl1 in progenitor proliferation identified by genome-wide characterization of its targets. Genes Dev. 25, 930-945 (2011).
- Pacary, E. Proneural transcription factors regulate different steps of cortical neuron migration through Rnd-mediated inhibition of RhoA signaling. Neuron. 69, 1069-1084 (2011).
- Marteau, L. Angiopoietin-2 regulates cortical neurogenesis in the developing telencephalon. Cereb Cortex. 21, 1695-1702 (2011).
- Ramon Moliner, E. . Comparative Methods in Neuroanatomy. , (1970).
- Banks, G. T. Behavioral and other phenotypes in a cytoplasmic Dynein light intermediate chain 1 mutant mouse. J. Neurosci. 31, 5483-5494 (2011).
- Elias, G. M., Elias, L. A., Apostolides, P. F., Kriegstein, A. R., Nicoll, R. A. Differential trafficking of AMPA and NMDA receptors by SAP102 and PSD-95 underlies synapse development. Proc. Natl. Acad. Sci. U.S.A. 105, 20953-20958 (2008).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U.S.A. 104, 1027-1032 (2007).
- Navarro-Quiroga, I., Chittajallu, R., Gallo, V., Haydar, T. F. L. o. n. g. -. t. e. r. m. selective gene expression in developing and adult hippocampal pyramidal neurons using focal in utero electroporation. J. Neurosci. 27, 5007-5011 (2007).
- Nakahira, E., Yuasa, S. Neuronal generation, migration, and differentiation in the mouse hippocampal primoridium as revealed by enhanced green fluorescent protein gene transfer by means of in utero electroporation. J. Comp. Neurol. 483, 329-340 (2005).
- Ramos, R. L., Bai, J., LoTurco, J. J. Heterotopia formation in rat but not mouse neocortex after RNA interference knockdown of DCX. Cereb Cortex. 16, 1323-1331 (2006).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved