Visualização e manipulação genética de dendritos e espinhas no córtex cerebral e hipocampo do rato usando
In This Article
Summary
Este artigo descreve em pormenor um protocolo para electroporate no útero do córtex cerebral eo hipocampo em E14.5 em ratinhos. Mostramos também que este é um método valioso para estudar dendritos e espinhas nessas duas regiões cerebrais.
Abstract
Na eletroporação útero (IUE) tornou-se uma poderosa técnica para estudar o desenvolvimento de diferentes regiões do sistema nervoso embrionário 1-5. Até à data, esta ferramenta tem sido amplamente utilizada para estudar a regulação da proliferação celular, diferenciação e migração neuronal principalmente no córtex cerebral em desenvolvimento 6-8. Aqui temos detalhe nosso protocolo para electroporate no útero do córtex cerebral eo hipocampo e fornecem evidências de que esta abordagem pode ser utilizada para estudar os dendritos e as espinhas nestas duas regiões cerebrais.
Visualização e manipulação de neurônios em culturas primárias têm contribuído para uma melhor compreensão dos processos envolvidos no dendrito, coluna vertebral e desenvolvimento da sinapse. No entanto neurónios crescentes in vitro não são expostos a todas as pistas fisiológicas que podem afectar dendrite e / ou formação de coluna e de manutenção durante o desenvolvimento normal. O nosso conhecimento das estruturas dendríticos e coluna 9. No entanto, a coloração de Golgi é considerado ser imprevisível. Na verdade, grupos de células nervosas e tratos de fibras são rotulados de forma aleatória, com áreas específicas, muitas vezes aparecendo completamente coradas enquanto as áreas adjacentes são desprovidas de coloração. Estudos recentes têm mostrado que IUE de construções de fluorescentes representa um método atraente alternativa para estudar dendritos, espinhas, bem como sinapses em ratinhos mutantes / de tipo selvagem 10-11 (Figura 1A). Além disso, em comparação com a geração de orifícios de rato, IUE representa uma abordagem para executar uma rápida perda de ganho e estudos funcionais na população específica de células durante uma janela de tempo específico. Além disso, IUE foi usado com sucesso com a expressão indutível gene ou induzível RNAi se aproxima para refinar o controlo temporal sobre a expressão de um gene ou shRNA 12. Estas vantagens da IUE têm, assim, opened novas dimensões para estudar o efeito da expressão do gene / supressão em dendrites e as espinhas não só em determinadas estruturas cerebrais (Figura 1B), mas também num ponto de tempo específico de desenvolvimento (Figura 1C).
Finalmente, IUE fornece uma ferramenta útil para identificar as interações funcionais entre os genes envolvidos no dendrito, coluna e / ou desenvolvimento da sinapse. Com efeito, em contraste com os métodos de outros genes de transferência, tais como vírus, é muito simples para combinar RNAi múltipla ou transgenes na mesma população de células.
Em resumo, IUE é um método poderoso que já contribuiu para a caracterização dos mecanismos moleculares subjacentes a função cerebral e doença e deve também ser úteis no estudo da dendritos e as espinhas.
Protocol
No Reino Unido, os ratos estão alojados, criados e tratados de acordo com as diretrizes aprovadas pelo Ministério do Interior sob o Animal (Scientific Procedures) Act 1986.
1. Preparação: Solução de DNA e Agulhas
- Purificar DNA plasmídico com um kit de endotoxinas Maxi preparação livre. Preparar solução de DNA do plasmídeo para injecção para as concentrações desejadas em água e adicionar Fast Green (concentração final de 0,05%) para visualizar injectáveis. A eficiência de electroporação é altamente dependente da concentração de DNA. Uma concentração de 1 ug / uL é geralmente utilizado. Esta concentração é suficiente para visualizar os neurónios eletroporados sem afectar o seu desenvolvimento. No entanto, de acordo com o promotor utilizado no vector de plasmídeo (nível de expressão baixo com o promotor do citomegalovírus / potenciador, o nível de expressão forte com o citomegalovírus imediata potenciador precoce e fusão promotor de galinha β-actina (CAG) promotor), bem como o tamanho ea estabilidade da proteína expressa, esta concentração pode ser ajustada (0,25 ug / uL de 5 ug / uL).
- Puxe agulhas de vidro usando um puxador de micropipeta.
2. Preparação da Cirurgia
- Autoclavar instrumentos cirúrgicos e tampão fosfato salino (PBS).
- Preparar solução analgésica em PBS (A buprenorfina, concentração, Vetergesic final de 30 ug / ml). Pesar o rato grávida e injectar por via subcutânea de 0,1 mg / kg de Vetergesic pelo menos 30 minutos antes da cirurgia. Durante este tempo, preparar a área cirúrgica. Girar sobre as almofadas de aquecimento ea câmara de recuperação. Coloque PBS estéril em banho de água quente e todos os instrumentos esterilizados e materiais sobre campos estéreis. Coloque os eletrodos de platina em um copo cheio de PBS e se conectar à electroporator. Encher a agulha com a solução de ADN, utilizando uma ponta de microloader, ligar a agulha para o titular capilar e comprimir fora da ponta da agulha com um fórceps.
- Anestesiar um rato grávida (E14.5-E15.5) com isoflurano em transportadora de oxigênio (oxigênio 2 l / min), utilizando uma câmara de indução anestésica. Aguarde até que o animal perde postura.
- Transfira o animal a um "pré-cirurgia" máscara. Coloque uma gota de gel olho em cada olho para prevenir ulceração da córnea dos olhos, enquanto a mãe está sob anestesia geral. Use um barbeador elétrico para depilar os pêlos do abdômen. Limpe a área raspada uma vez com clorexidina para cabelos voando.
- Transferir o animal a uma segunda máscara na área cirúrgica. Posicione o mouse com a sua volta na almofada de aquecimento. Inicie a cirurgia, quando o reflexo pedal foi perdida.
- Coloque a máscara e luvas estéreis. Cobrir o animal com uma cortina estéril (com um pequeno orifício sobre o abdómen) para impedir que os tecidos e os instrumentos de ser contaminado por as áreas da pele que não foram raspadas e desinfectados. Limpe a área raspada umpelo t 3 vezes com clorexidina. Use um cotonete estéril diferente a cada vez. Use um bisturi para fazer uma incisão vertical ao longo da linha média (~ 1 polegada de comprimento) através da pele. Com uma tesoura, faça uma incisão semelhante do músculo do abdômen ao longo da linha alba (linha branca, composta principalmente de colágeno do tecido conjuntivo).
- Escolha os embriões mais acessíveis e colocar a pinça de anel entre dois embriões e, cuidadosamente, puxar a corrente embrionário para fora da cavidade abdominal. Deste ponto em diante, manter os embriões hidratados com estéril pré-aquecido PBS.
N microscópio é necessário para visualização.
4. A injecção de ADN e electroporação
- Comece com um dos embriões mais laterais, tornando mais fácil manter o controle de que os embriões foram electroporadas. Não puxe muito sobre os embriões, pois isso vai aumentar o risco de hemorragia. Manipular a posição do embrião no interior do saco amniótico, utilizando a pinça de anel eestabilizar a cabeça dos embriões entre os anéis. Aperte delicadamente para empurrar o embrião mais perto da parede uterina.
- Com a outra mão, tomar o titular capilar e inserir a agulha cuidadosamente para o meio do hemisfério para alvejar o ventrículo lateral. Pressionar o pedal para injectar cerca de 1 uL de solução de ADN misturado com Fast Green (menos de 1 uL de estudar dendritos). Você deve observar o corante verde enchimento do ventrículo lateral. Etapas críticas: - A nitidez da agulha é fundamental para furar corretamente na parede uterina. É importante para minimizar o movimento da agulha na superfície da parede uterina e após a inserção no ventrículo, porque um alargamento do furo irá resultar na perda de fluido amniótico e morte do embrião. Evite vasos penetrantes de sangue na parede uterina, pois isso irá resultar em sangramento e morte embrionária.
- É importante que não se injectar um volume demasiado grande de DNA para o ventrículo lateral, pois irá induzirhidrocefalia (não ultrapassar 2 ul a E14.5). O volume de DNA é ajustada de acordo com a finalidade da experiência. Se 1μl é geralmente utilizado para a maioria das experiências, um volume menor de DNA (aproximadamente 0,5 uL) é necessária para dendrite e análise coluna vertebral. Na verdade algumas células isoladas precisa ser orientado a fim de visualizar e medir o caramanchão dendrítica de neurônios eletroporados. - Colocar os eléctrodos nos lados da cabeça de embriões com a pá (+) positivo sobre o mesmo lado que o ventrículo injectado para electroporação córtex ou no lado oposto do ventrículo injectado para electroporação hipocampo (Figura 2). Em seguida, aplique cinco 30V pulsos elétricos (50 ms de duração) em intervalos de 1 seg. Etapa crítica: Evite aplicar corrente através da placenta como isso vai resultar na morte do embrião.
Todos os embriões em um mouse de grávida pode ser electroporados, geralmente com o mesmo DNA construir para evitar qualquer confusão. No entanto, uma diminuição da cirurgia longo é a taxa de sobrevivência de embriões. A cavidade abdominal não deve ser aberto mais tempo do que 30 min.
5. Pós-cirurgia eletroporação-
- Depois electroporating os embriões, adicione PBS na cavidade abdominal e usar a pinça de anel para substituir o corno uterino na sua localização original. Suturar a parede abdominal e da pele com fio de Vicryl suturas absorvíveis.
- Colocar o animal em uma câmara de recuperação até que acorda (min geralmente 5-10) e depois transferir numa gaiola colocado sobre uma almofada de aquecimento.
6. Pós-operatório
Verificar o comportamento dos ratos para avaliar dor, sofrimento ou angústia e pesar os animais de 24 he 48 h após a cirurgia. Se necessário, analgésicos pode ser administrada para minimizar a dor e desconforto.
7. Processamento de tecidos
Colete os embriões eletroporados ou filhotes nas fases embrionárias ou pós-natal necessários para o experimento.
ove_content "> - Para a análise em fases embrionárias (por exemplo, para estudar a proliferação celular ou migração):Euthanize mãe através de deslocamento cervical e coletar os embriões. Após decapitação, seleccionar os cérebros que foram correctamente electroporado, como indicado pela quantidade e localização do sinal fluorescente, visualizado através do crânio utilizando um binóculo fluorescente. Dissecar o cérebro fora do crânio e corrigir durante a noite em PFA 4% e, em seguida, em lugar de sacarose a 20% / PBS durante a noite. Incorporar em outubro composto, congelamento a -80 ° C e secção usando um criostato.
- Para a análise em fases pós-natal (por exemplo, para estudar dendritos e as espinhas):
Anestesiar os filhotes ou ratinhos adultos com injecção intraperitoneal de pentobarbitona (40-60 mg / kg) e executar a perfusão transcardial com PBS, seguido de PFA a 4% em PBS. Dissecar o cérebro fora do crânio e pós-correção em 4% PFA durante a noite. Após lavagens em PBS, seção do cérebro usando um vibratome (100 seções M para dendrite análise). Montar as seções no Aqua Poli / montagem usando 0.16-0.19 lamínulas mm de espessura para dendritos de imagem e espinhas.
8. Os resultados representativos
A Figura 3 mostra exemplos de células eletroporados no córtex cerebral (Figuras 3A, B), na CA1 (Figuras 3C, D) e no giro dentado do hipocampo (Figuras 3E, F). Tipo selvagem ratinhos foram electroporadas em E14.5 com uma construção de GFP (APC-b-EGFPm5 silenciador 3) e os cérebros foram colhidas no dia pós-natal (P) 14. Por injecção de um pequeno volume de solução de ADN (0,5 uL ou menos de uma solução a 1 ug / uL), algumas células são rotulados, o que permite a visualização da arborização dendrítica de isolados GFP + de células (Figura 3), bem como as suas espinhas em maior ampliação (Figura 4).
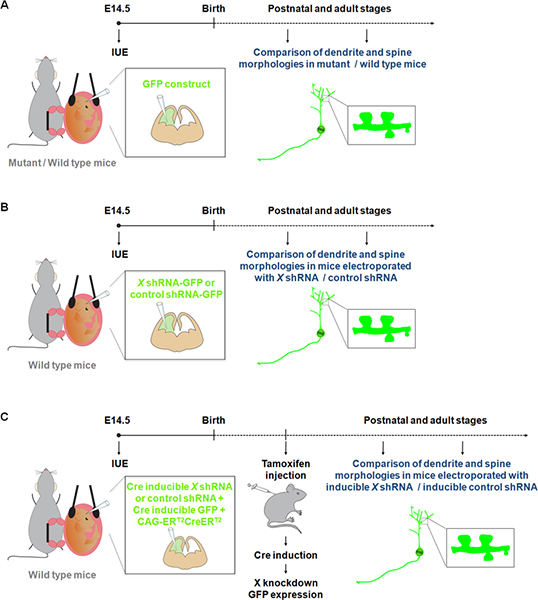
Figura 1. Representação esquemática de protocolos de electroporação que podem ser usados para estudar dendritos e as espinhas. (A) A electroporação de uma GFP construir para comparar os dendritos e as espinhas em ratinhos de tipo selvagem e mutante. (B) A electroporação de GFP-shRNA (GFP é expresso a partir do mesmo construto) para comparar os dendritos e as espinhas em ratinhos electroporado com um shRNA específico para construir um gene de interesse (X) ou um shRNA controlo. (C) IUE pode ser usado em conjunto com um sistema indutivel Cre, a fim de restringir a expressão do shRNA para o período de tempo desejáveis. Nesta experiência, um vector que expressa uma forma da recombinase Cre que pode ser activado por 4-hydroxytamoxifen (CAG-ER T2 CREER T2; 1 ug / uL) 10, é electroporado em conjunto com um vector de expressão de uma shRNA específica em um dependente Cre forma (1 ug / uL, e com um indicador de recombinação (CALNL-GFP construto, GFP induzível por expressão de Cre;. 1 ug / uL) 10 A eficiêncy do knockdown pode ser melhorada pelo aumento da concentração do shRNA, bem como aumentar CAG-ER T2 CREER concentração T2.
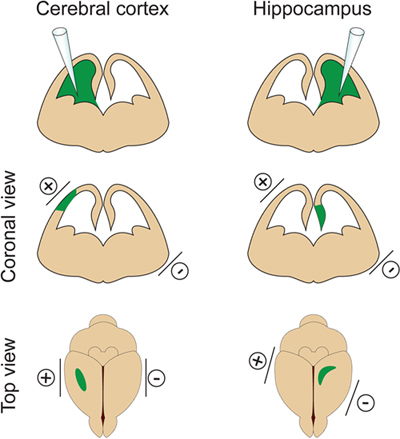
Figura 2. Controle espacial da eletroporação. Esta figura mostra onde posicionar os eléctrodos de pás de acordo com o local de injecção de DNA, a fim de atingir o córtex cerebral ou no hipocampo.
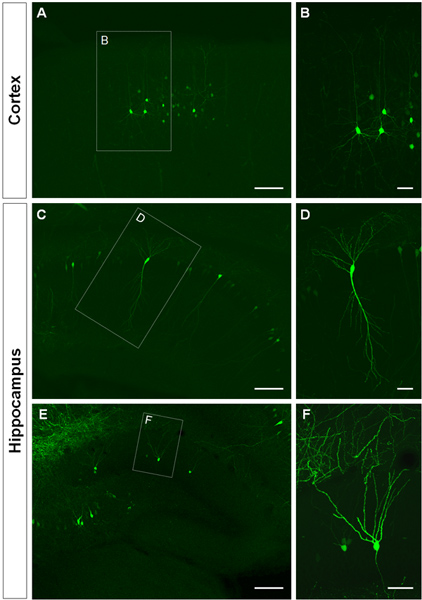
Figura 3. A visualização do mandril dendrítica de células electroporadas no útero, no córtex cerebral e hipocampo. (A, B) secções coronal mostrando GFP + células piramidais no córtex cerebral, (CD) em células piramidais CA1 do hipocampo e (E, F), células granulares no giro dentado em P14. Uma construção de GFP (APC-b-EGFPm5 silenciador 3) foi electroporado em E14.5. Maiores imagens ampliação (B, D, F) mostram que IUE é um método eficiente para visualizar dendrites. Barras de escala representam 50 um (B, D e F), 150 uM (A, C, E).
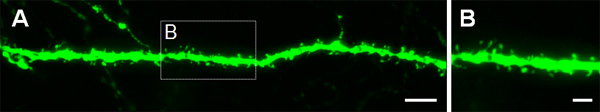
Figura 4. Visualização das espinhas dendríticas em neurônios P14 que foram eletroporados in utero em E14.5 com GFP expressar construir. (A, B) imagens de alta ampliação de espinhos de dendritos basais de neurônios piramidais do hipocampo. Barras de escala representam 5 mm (A) e 2 m (B).
Discussion
IUE é uma ferramenta poderosa para manipular a expressão do gene não só no espaço, mas também no tempo. Nós mostramos aqui que esta técnica pode ser utilizada para visualizar e manipular geneticamente dendritos e as espinhas no córtex cerebral e hipocampo de ratos. Além das vantagens citadas anteriormente, é de notar que IUE, em contraste com Golgi método, pode ser combinado com imuno-histoquímica ou hibridação in situ, o que permite por exemplo para o fenótipo das células eletroporados. Também é importante mencionar que este procedimento não induz malformações cerebrais evidentes, apesar da sua invasividade relativa. Além disso, ao nível celular, IUE não modifica as propriedades electrofisiológicas dos neurónios electroporado 13. Enquanto a nossa demonstração centra-se na visualização de morfologias dendríticos e da coluna, IUE de neurónios corticais ou do hipocampo em E14.5 também poderia ser usado para estudar outros eventos de desenvolvimento, tais como a formação de axónio e orientação. Em adicionarition, o mesmo tipo de protocolo pode ser implementado em outras etapas do desenvolvimento embrionário para atingir diferentes populações. Por exemplo, um paradigma electroporação developmentally muito tarde na cortical E18.5 pode ser realizada para dirigir a expressão em células progenitoras astrocíticos 1. De modo semelhante, enquanto que um electroporação do hipocampo em E14.5 permite orientar CA1-CA3 progenitores de neurónios piramidais e progenitoras denteado, ao mesmo tempo, uma electroporação tardia do hipocampo (E18.5 ou pós-natal) permitiria para alvejar grânulo denteado diferente progenitores 14. Neste caso, o volume injectado de DNA pode ser aumentada, bem como a intensidade de corrente.
Transgenes introduzidas pelo EIA parecem manter-se epissómico e são, portanto, perde a partir de células seguintes divisões celulares sucessivas. Em células pós-mitóticas tais como neurónios, no entanto, os transgenes epissomais permanecem activas durante meses após a electroporação permitindo estudos de longo prazo 13, 15. Em nosso estudo, observamos GFP brilhante + células até 7 semanas após o nascimento (o último ponto de tempo analisamos), indicando que embrionário direcionamento de corticais ou do hipocampo precursores neuronais utilizando resultados de IUE na expressão persistente do transgene de primeiros pontos no tempo de desenvolvimento até para a vida adulta.
Uma limitação de corrente da técnica é que é difícil de exercer um controlo fino sobre o número total de células eletroporados. No entanto, por diminuir o volume injectado de solução de ADN, que têm mostrado que é possível para rotular algumas células e para visualizar o arborização dendrítica de isolados GFP + de células, bem como as suas espinhas. A dimensão da área transfectado pode também ser ajustada através da modificação dos parâmetros da electroporação, tais como a intensidade da corrente e do número de impulsos ou o diâmetro das pás electroporação.
Ao todo IUE é um método que é fácil de implementar, rápida eeficiente para estudar dendritos e as espinhas in vivo.
Acknowledgements
Os autores gostariam de agradecer ao Dr. Kathleen Mathers, Dr. Jean-Philippe Mocho e Yolanda Saavedra Dr. Torres para a sua ajuda para a realização eletroporação no utero em procedimentos assépticos, e Wood Hayley por sua ajuda para preparar os desenhos.
EP foi apoiado por uma Federação de longo prazo de europeus Sociedades Bioquímicas (FEBS) comunhão e um Medical Research Council (MRC) comunhão de desenvolvimento de carreira, MAH por um Wellcome Trust concessão de Elizabeth Fisher e Victor Tybulewicz (080174/B/06/Z) , HW por um EMBO longo prazo companheirismo e RA por uma bolsa de estudo do MRC. Este trabalho foi suportado por uma concessão do projeto do Wellcome Trust (086947/Z/08/Z) e por um FG Grant-in-Aid do Medical Research Council (U117570528) para
Materials
| Name | Company | Catalog Number | Comments | |||
| Nome do reagente | Companhia | Número de catálogo | Comentários | |||
| Preparação das agulhas e solução de ADN para a injecção | ||||||
| Endofree Kit Maxi Plasmid | Qiagen | 12362 | ||||
| Verde rápido | Sigma | F-7258 | ||||
| Borosilicato capilares de vidro 1,0 milímetros OD x 0,58 mm ID | Harvard Apparatus | 30-0016 | ||||
| Microloader dicas | Eppendorf | 5242956003 | Para pipetas Eppendorf 0,5 ul ul-10/2-20 ul | |||
| & Nbsp; | Material para cirurgia | |||||
| Extra Fino tesoura de íris | Belas Ferramentas Ciência | 14088-10 | ||||
| Pinças curvas | Belas Ferramentas Ciência | 91197-00 | ||||
| Fórceps do anel | Belas Ferramentas Ciência | 11103-09 | ||||
| Suporte de agulha | Belas Ferramentas Ciência | 12002-12 | ||||
| Pinça Graefe | Belas Ferramentas Ciência | 11050-10 | ||||
| Sutura absorvível Vicryl | Ethicon Inc (Johnson & Johnson) | W9074 | ||||
| Campos estéreis 30cm x 45 cm | Buster | 141765 | ||||
| Swabs estéreis | Shermond | Huby-340 | ||||
| Cotonetes | Limpo Cruz Co., Ltd | 1860 | ||||
| Buprenorfina (Vetergesic) | Alstoe Saúde Animal | |||||
| Clorexidina | Vetasept | XHG007 | ||||
| Gel Viscotears Eye | Novartis | |||||
| Isoflurano | Abbott Laboratories | B506 | ||||
| Pentoject, pentobarbitona de sódio 20% | Animalcare | |||||
| Eletroporação | ||||||
| Electroporator | BTX | ECM830 | ||||
| Tweezertrod Platinume cinco milímetros | BTX, Harvard Apparatus | 45-0489 | ||||
| FemtoJet microinjector | Eppendorf | 5247000030 | ||||
| Pedal para FemtoJet microinjector | Eppendorf | 5247623002 | ||||
| Titular capilar | Eppendorf | 5176190002 | ||||
| Processamento de tecidos | ||||||
| Paraformaldeído | Sigma | P6148 | ||||
| Sacarose | VWR (Prolabo) | 27480.294 | ||||
| Lâminas de microscópio | ThermoScientific (Menzel-Glaser) | J1800AMNZ | ||||
| Lamelas | Menzel-Glaser | 22 x 50 mm # 1,5 | ||||
| Do Aqua Poly / mount | Polysciences, Inc. | 18606 | ||||
References
- Kolk, S. M., de Mooij-Malsen, A. J., Martens, G. J. Spatiotemporal Molecular Approach of in utero Electroporation to Functionally Decipher Endophenotypes in Neurodevelopmental Disorders. Front Mol. Neurosci. 4, 37 (2011).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol. 240, 237-246 (2001).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Dev. Growth Differ. 50, 499-506 (2008).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Tabata, H., Nakajima, K. Labeling embryonic mouse central nervous system cells by in utero electroporation. Dev. Growth Differ. 50, 507-511 (2008).
- Castro, D. S. A novel function of the proneural factor Ascl1 in progenitor proliferation identified by genome-wide characterization of its targets. Genes Dev. 25, 930-945 (2011).
- Pacary, E. Proneural transcription factors regulate different steps of cortical neuron migration through Rnd-mediated inhibition of RhoA signaling. Neuron. 69, 1069-1084 (2011).
- Marteau, L. Angiopoietin-2 regulates cortical neurogenesis in the developing telencephalon. Cereb Cortex. 21, 1695-1702 (2011).
- Ramon Moliner, E. . Comparative Methods in Neuroanatomy. , (1970).
- Banks, G. T. Behavioral and other phenotypes in a cytoplasmic Dynein light intermediate chain 1 mutant mouse. J. Neurosci. 31, 5483-5494 (2011).
- Elias, G. M., Elias, L. A., Apostolides, P. F., Kriegstein, A. R., Nicoll, R. A. Differential trafficking of AMPA and NMDA receptors by SAP102 and PSD-95 underlies synapse development. Proc. Natl. Acad. Sci. U.S.A. 105, 20953-20958 (2008).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U.S.A. 104, 1027-1032 (2007).
- Navarro-Quiroga, I., Chittajallu, R., Gallo, V., Haydar, T. F. L. o. n. g. -. t. e. r. m. selective gene expression in developing and adult hippocampal pyramidal neurons using focal in utero electroporation. J. Neurosci. 27, 5007-5011 (2007).
- Nakahira, E., Yuasa, S. Neuronal generation, migration, and differentiation in the mouse hippocampal primoridium as revealed by enhanced green fluorescent protein gene transfer by means of in utero electroporation. J. Comp. Neurol. 483, 329-340 (2005).
- Ramos, R. L., Bai, J., LoTurco, J. J. Heterotopia formation in rat but not mouse neocortex after RNA interference knockdown of DCX. Cereb Cortex. 16, 1323-1331 (2006).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved