Visualisation et la manipulation génétique des dendrites et des épines dans le cortex cérébral et l'hippocampe de souris à l'aide
Dans cet article
Résumé
Cet article décrit en détail un protocole d'électroporation in utero du cortex cérébral et l'hippocampe à E14.5 chez la souris. Nous montrons aussi que cette méthode est précieuse pour étudier les dendrites et les épines dans ces deux régions cérébrales.
Résumé
En électroporation in utero (IUE) est devenue une technique puissante pour étudier le développement de différentes régions du système nerveux embryonnaire 1-5. À ce jour, cet outil a été largement utilisée pour étudier la régulation de la prolifération cellulaire, la différenciation et la migration neuronale en particulier dans les pays en développement du cortex cérébral 6-8. Ici, nous détaillons notre protocole d'électroporation in utero du cortex cérébral et l'hippocampe et fournir la preuve que cette approche peut être utilisée pour étudier les dendrites et les épines dans ces deux régions cérébrales.
Visualisation et la manipulation des neurones en cultures primaires ont contribué à une meilleure compréhension des processus impliqués dans la dendrite, la colonne vertébrale et le développement des synapses. Cependant les neurones en développement in vitro ne sont pas exposés à tous les signaux physiologiques qui peuvent affecter dendrite et / ou la formation la colonne vertébrale et de l'entretien au cours du développement normal. Notre connaissance des structures dendritiques et la colonne vertébrale 9. Toutefois, la coloration de Golgi est considéré comme imprévisible. En effet, des groupes de cellules nerveuses et des faisceaux de fibres sont étiquetés de manière aléatoire, avec des zones particulières apparaissant souvent complètement taché alors que les zones adjacentes sont dépourvue de coloration. Des études récentes ont montré que l'IUE de constructions fluorescentes représente une méthode intéressante alternative à étudier dendrites, des épines, ainsi que des synapses chez les souris mutantes / type sauvage 10-11 (figure 1A). Ailleurs par rapport à la génération de souris knock-out, IUE représente une approche rapide pour effectuer le gain et la perte de fonction des études de la population spécifique de cellules pendant une fenêtre temporelle spécifique. En outre, l'IUE a été utilisé avec succès dans l'expression des gènes inductibles ou inductible ARNi se rapproche d'affiner le contrôle temporel sur l'expression d'un gène ou shRNA 12. Ces avantages de l'IUE ont ainsi opened de nouvelles dimensions à étudier l'effet de l'expression des gènes / suppression sur les dendrites et les épines non seulement dans certaines structures cérébrales (figure 1B), mais aussi à un moment spécifique du développement (figure 1C).
Enfin, IUE fournit un outil utile pour identifier les interactions fonctionnelles entre les gènes impliqués dans la dendrite, la colonne vertébrale et / ou le développement des synapses. En effet, contrairement à d'autres méthodes de transfert de gènes tels que le virus, il est facile de combiner plusieurs ARNi ou des transgènes dans la même population de cellules.
En résumé, l'IUE est une méthode puissante qui a déjà contribué à la caractérisation des mécanismes moléculaires qui sous-tendent le fonctionnement du cerveau et de la maladie et il devrait également être utile dans l'étude des dendrites et des épines.
Protocole
Au Royaume-Uni, les souris sont logés, élevés, et traité selon les lignes directrices approuvées par le Home Office en vertu de l'animal (Scientific Procedures) Act 1986.
1. Préparation: ADN Solution et Aiguilles
- Purifier l'ADN plasmidique avec une endotoxine libre Maxi-prep kit. Préparer la solution d'ADN plasmidique pour l'injection à des concentrations désirées dans l'eau et ajouter Fast Green (concentration finale de 0,05%) pour visualiser les injections. L'efficacité de l'électroporation est très dépendante de la concentration d'ADN. Une concentration de 1 ug / ul est généralement utilisé. Cette concentration est suffisante pour visualiser les neurones électroporées sans affecter leur développement. Toutefois, selon le promoteur utilisé dans le vecteur plasmidique (niveau d'expression faible promoteur du cytomégalovirus / enhancer, le niveau d'expression forte avec le cytomégalovirus immédiate activateur précoce et de la fusion de poulet promoteur β-actine (ACG) promoteur) ainsi que la taille et la la stabilité de la protéine exprimée, cette concentration peut être ajustée (0,25 pg / pl à 5 ug / ul).
- Tirez aiguilles de verre en utilisant un extracteur micropipette.
2. Préparation de la chirurgie
- Autoclave des instruments chirurgicaux et une solution saline de tampon phosphate (PBS).
- Préparer la solution analgésique dans du PBS (buprénorphine, Vetergesic, concentration finale de 30 pg / ml). Peser la souris enceintes et injecter sous-cutanée de 0,1 mg / kg de Vetergesic au moins 30 minutes avant la chirurgie. Pendant ce temps, préparer la zone chirurgicale. Tourner sur les coussins chauffants et la chambre de récupération. Placez PBS stérile dans un bain d'eau chaude et tous les instruments stériles et de matériaux sur des draps stériles. Placer les électrodes de platine dans un bécher rempli de PBS et de se connecter à l'électroporateur. Remplir l'aiguille avec la solution d'ADN en utilisant une pointe microloader, connectez l'aiguille au titulaire capillaire et pincez l'extrémité de l'aiguille avec une pince.
- Anesthésiez une souris enceinte (E14.5 E15.5-) avec de l'isoflurane en transporteur d'oxygène (l'oxygène 2 l / min) en utilisant une chambre d'induction de l'anesthésie. Attendez jusqu'à ce que l'animal perd réflexe de redressement.
- Transfert de l'animal à une "pré-opératoire" masque. Déposer une goutte de gel pour les yeux sur chaque œil afin de prévenir une ulcération cornéenne des yeux tandis que la mère est sous anesthésie générale. Utiliser un rasoir électrique pour se raser les cheveux de l'abdomen. Nettoyez la zone rasée une fois avec clorhexidine pour recueillir les cheveux volant.
- Transfert de l'animal à un second masque dans le domaine chirurgical. Placez la souris avec son dos sur le coussin chauffant. Début de la chirurgie lorsque le réflexe de pédale a été perdu.
- Mettez un masque et des gants stériles. Couvrir l'animal d'un drap stérile (avec un petit trou sur l'abdomen) pour empêcher les tissus et les instruments d'être contaminés par les zones de peau qui n'ont pas été rasés et désinfectés. Nettoyez la zone rasée uneau moins 3 fois avec t clorhexidine. Utilisez un coton-tige stérile à chaque fois différente. Utiliser un scalpel pour faire une incision verticale le long de la ligne médiane (~ 1 pouce de long) à travers la peau. L'aide de ciseaux, faire une incision similaire du muscle de l'abdomen le long de la ligne blanche (ligne blanche composée principalement de tissu conjonctif collagène).
- Choisissez les embryons les plus accessibles et placez la pince à anneaux entre deux embryons et tirez délicatement sur la chaîne embryonnaire hors de la cavité abdominale. A partir de ce moment-là, garder les embryons hydraté avec stérile préchauffée PBS.
Pas de microscope est nécessaire pour la visualisation.
4. L'injection de l'ADN et l'électroporation
- Commencez avec l'un des embryons les plus latérales, ce qui rend plus facile à garder une trace des embryons ont été soumis à une électroporation. Ne tirez pas trop sur les embryons, car cela augmente le risque d'hémorragie. Manipuler la position de l'embryon dans la cavité amniotique utilisant les pinces annulaires etstabiliser la tête des embryons entre les anneaux. Serrez doucement à pousser jusqu'à l'embryon plus proche de la paroi utérine.
- Avec l'autre main, prendre le support de tube capillaire et insérer l'aiguille avec précaution dans le milieu de l'hémisphère pour cibler le ventricule latéral. Appuyez sur la pédale d'injecter environ 1 ul de solution d'ADN mélangé avec Fast Green (moins de 1 pl pour étudier dendrites). Vous devez observer le colorant vert de remplissage du ventricule latéral. Les étapes critiques: - La netteté de l'aiguille est essentiel pour percer correctement la paroi utérine. Il est important pour réduire au minimum le mouvement de l'aiguille à la surface de la paroi utérine et après l'insertion dans le ventricule parce un élargissement du trou se traduira par la fuite de fluide amniotique, et la mort embryon. Évitez les vaisseaux sanguins perçants dans la paroi utérine, comme cela se traduira par des saignements et mort de l'embryon.
- Il est important de ne pas injecter un volume trop important de l'ADN dans le ventricule latéral, car il va induirehydrocéphalie (ne pas dépasser 2 pi à E14.5). Le volume de l'ADN est ajustée en fonction de l'objectif de l'expérience. Si 1 microlitre est généralement utilisé pour la plupart des expériences, un plus petit volume de l'ADN (environ 0,5 pi) est nécessaire pour dendrite et l'analyse du rachis. En effet quelques cellules isolées doivent être ciblées afin de visualiser et de mesurer la tonnelle dendritique des neurones électroporées. - Placer les électrodes sur les côtés de la tête d'embryon avec le pôle positif (+) à aubes sur le même côté que le ventricule injecté pour l'électroporation cortex ou sur le côté opposé du ventricule injecté pour l'électroporation hippocampe (figure 2). Ensuite, appliquez cinq 30V impulsions électriques (50 msec) à des intervalles de 1 sec. Une étape cruciale: Évitez d'appliquer de courant à travers le placenta, car cela entraînerait la mort des embryons.
Tous les embryons chez une souris enceinte peut être une électroporation, le plus souvent avec le même ADN de construire afin d'éviter toute confusion. Toutefois, une diminution de la chirurgie à long est le taux de survie des embryons. La cavité abdominale ne doit pas être ouvert plus longtemps que 30 minutes.
5. Chirurgie post-électroporation
- Après électroporation des embryons, ajouter du PBS dans la cavité abdominale et d'utiliser les pinces à anneaux et à remplacer la corne utérine dans son emplacement d'origine. Suturer la paroi abdominale et la peau avec des sutures résorbables Vicryl.
- Placez l'animal dans une chambre de récupération jusqu'à ce qu'il se réveille (min habituellement 5-10), puis transférer dans une cage placée sur un coussin chauffant.
6. Post-chirurgie
Vérifier le comportement des souris pour évaluer la douleur, la souffrance ou de détresse et de peser les animaux 24 h et 48 h après la chirurgie. Si nécessaire, des analgésiques peuvent être administrés afin de minimiser la douleur et l'inconfort.
7. Traitement des tissus
Recueillir les embryons électroporées ou chiots à des stades embryonnaires ou postnatale nécessaires pour l'expérience.
ove_content "> - Pour l'analyse à des stades embryonnaires (par exemple pour étudier la prolifération cellulaire ou la migration):Euthanasier mère via dislocation cervicale et de recueillir les embryons. Après la décapitation, sélectionnez les cerveaux qui ont été correctement électroporés, comme indiqué par la quantité et l'emplacement du signal fluorescent, visualisé à travers le crâne à l'aide de jumelles fluorescente. Disséquer le cerveau du crâne et de fixer une nuit dans 4% PFA et les placer dans du saccharose à 20% / PBS pendant une nuit. Intégrer dans le composé OCT, gel à -80 ° C et de l'article à l'aide d'un cryostat.
- Pour l'analyse à des stades post-natal (par exemple pour étudier les dendrites et les épines):
Anesthésier chiots ou des souris adultes avec une injection intrapéritonéale de pentobarbital (40-60 mg / kg) et d'effectuer la perfusion transcardial avec du PBS, puis de 4% dans du PBS PFA. Disséquer la cervelle du crâne et de post-fix dans 4% PFA nuit. Après lavages en PBS, la section des cerveaux en utilisant un vibratome (100 sections um pour dendrite analyse). Montez les sections dans Aqua Poly / montage en utilisant des lamelles 0,16-0,19 mm d'épaisseur pour les dendrites et les épines d'image.
8. Les résultats représentatifs
La figure 3 montre des exemples de cellules électroporées dans le cortex cérébral (figures 3a, b), dans le CA1 (figures 3C, D) et dans le gyrus denté de l'hippocampe (figures 3E, F). Souris de type sauvage ont été électroporation à E14.5 avec une construction GFP (PCA-b-EGFPm5 silencieux 3) et les cerveaux ont été récoltés à jour postnatal (P) 14. En injectant un petit volume de solution d'ADN (0,5 pi ou moins d'une solution à 1 ug / ul), quelques cellules sont étiquetés, ce qui permet la visualisation de l'arborisation dendritique des isolés cellules GFP + (figure 3) ainsi que leurs épines au plus fort grossissement (figure 4).
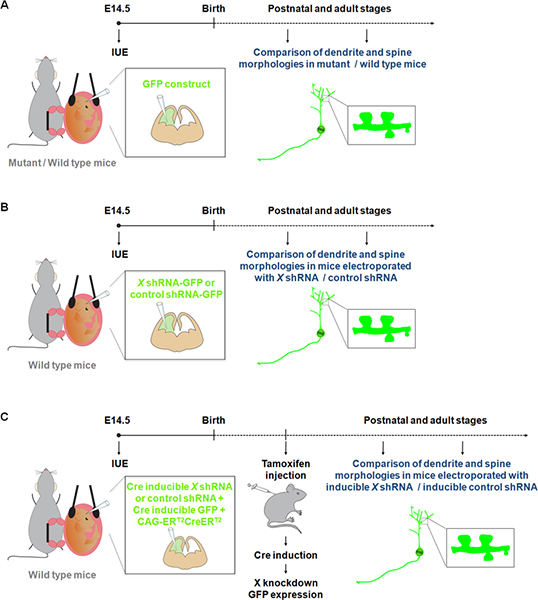
Figure 1. Représentation schématique des protocoles d'électroporation qui peuvent être utilisées pour étudier les dendrites et les épines. (A) électroporation d'une GFP de comparer les dendrites et les épines chez les souris de type sauvage et mutant. (B) électroporation de la GFP-shRNA (GFP est exprimée à partir de la même construction) pour comparer les dendrites et des épines chez la souris avec un électroporés shRNA spécifique pour construire un gène d'intérêt (X) ou un shRNA commande. (C) IUE peut être utilisé conjointement avec un système Cre inductible afin de limiter l'expression de l'shRNA à la période de temps souhaitable. Dans cette expérience, un vecteur exprimant une forme de la recombinase Cre, qui peut être activé par le 4-hydroxytamoxifène (CAG-ER T2 CREER T2; 1 pg / pi) 10, une électroporation est ensemble avec un vecteur exprimant une shRNA spécifique dans une charge Cre de manière (1 pg / pi, et avec un indicateur de recombinaison (CALNL-GFP construction, inductible par expression de la GFP Cre;. 1 pg / pi) 10 Le efficy de l'effet de choc peut être améliorée en augmentant la concentration de l'shRNA ainsi que l'augmentation CAG-ER T2 CREER T2 concentration.
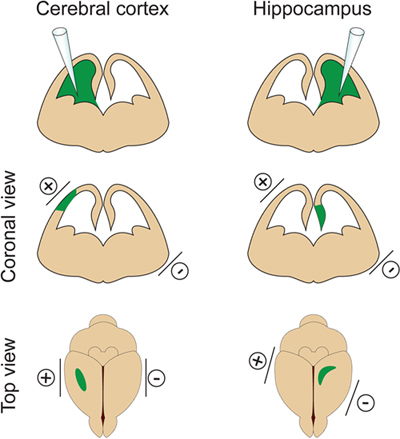
Figure 2. Le contrôle du territoire de l'électroporation. Cette figure montre l'endroit où positionner les électrodes à aubes selon le site d'injection d'ADN afin de cibler le cortex cérébral ou l'hippocampe.
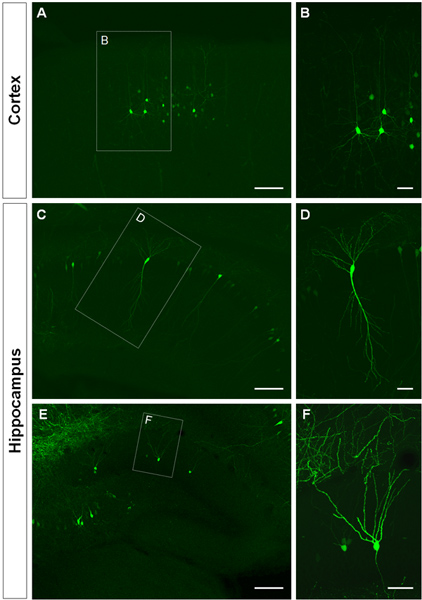
Figure 3. Visualisation de l'arbre dendritique des cellules par électroporation in utero dans le cortex cérébral et l'hippocampe. (A, B) coupes coronales montrant GFP + cellules pyramidales dans le cortex cérébral, (CD) dans les cellules pyramidales CA1 de l'hippocampe et (E, F), les cellules granulaires du gyrus denté à P14. Une construction GFP (PCA-b-EGFPm5 silencieux 3) a été une électroporation à E14.5. Images de grossissement supérieur (B, D, F) montrent que l'IUE est une méthode efficace pour visualiser les dendrites. Barres d'échelle représentent 50 um (B, D et F), 150 um (A, C, E).
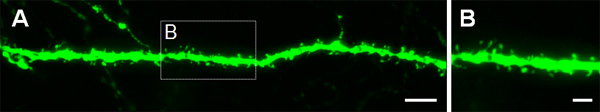
Figure 4. Visualisation des épines dendritiques dans les neurones P14 qui ont été électroporés in utero à E14.5 avec une GFP exprimant la construction. (A, B) des images à fort grossissement d'épines de dendrites basales de l'hippocampe neurones pyramidaux. Barres d'échelle représentent 5 um (A) et 2 uM (B).
Discussion
IUE est un outil puissant pour manipuler l'expression des gènes, non seulement dans l'espace mais aussi dans le temps. Nous montrons ici que cette technique peut être utilisée pour visualiser et manipuler génétiquement des dendrites et des épines dans le cortex cérébral et l'hippocampe de souris. Outre les avantages précédemment cités, il est intéressant de noter que l'IUE, contrairement à la méthode de Golgi, peut être combiné avec l'immunohistochimie ou hybridation in situ, qui permet par exemple de phénotype des cellules électroporées. Il est également important de mentionner que cette procédure ne provoque pas de malformations cérébrales évidentes en dépit de son caractère invasif relative. En outre, au niveau cellulaire, IUE ne modifie pas les propriétés électrophysiologiques de l'électroporation neurones 13. Alors que notre démonstration se concentre sur la visualisation des morphologies dendritiques et la colonne vertébrale, IUE de neurones corticaux ou l'hippocampe à E14.5 pourrait également être utilisée pour étudier d'autres événements de développement tels que la formation et l'orientation des axones. En ajouterition, le même genre de protocole pourrait être mis en œuvre à d'autres stades du développement embryonnaire de cibler des populations différentes. Par exemple, un paradigme développemental électroporation très tard corticale à E18.5 peut être effectuée pour diriger l'expression dans les progéniteurs astrocytaires 1. De même, alors une électroporation de l'hippocampe à E14.5 permet de cibler CA1-CA3 progéniteurs neuronaux pyramidales et denté progénitrices de cellules granulaires dans le même temps, une électroporation fin hippocampique (E18.5 ou postnatale précoce) permettrait de cibler les différents granules denté progéniteurs 14. Dans ce cas, le volume injecté de l'ADN peut être augmenté, ainsi que l'intensité du courant.
Transgènes introduits par IUE semblent rester épisomique et sont donc perdus à partir de cellules suivantes des divisions cellulaires successives. Dans les cellules post-mitotiques comme les neurones, cependant, les transgènes épisomiques restent actifs pendant des mois après l'électroporation permettant études à long terme 13, 15. Dans notre étude, nous avons observé la GFP lumineux + cellules jusqu'à 7 semaines après la naissance (le dernier point de temps, nous avons analysé) indiquant que l'embryon ciblage des corticales ou hippocampiques précurseurs neuronaux en utilisant les résultats IUE dans l'expression persistante du transgène à partir du début points dans le temps de développement en place à l'âge adulte.
Une limitation du courant de la technique, c'est qu'il est difficile d'exercer un contrôle précis sur le nombre total de cellules électroporées. Toutefois, en diminuant le volume injecté de la solution d'ADN, nous avons montré qu'il est possible d'étiqueter quelques cellules et de visualiser l'arborisation dendritique des cellules GFP + isolés ainsi que leurs épines. La dimension de la zone transfectée peut également être réglée en modifiant les paramètres de l'électroporation tels que l'intensité du courant et le nombre d'impulsions ou le diamètre des pales d'électroporation.
Au total IUE est une méthode qui est facile à mettre en œuvre, rapide etefficace pour étudier les dendrites et les épines in vivo.
Déclarations de divulgation
Pas de conflits d'intérêt déclarés.
Remerciements
Les auteurs tiennent à remercier le Dr Kathleen Mathers, le Dr Jean-Philippe Mocho et le Dr Yolanda Torres Saavedra pour leur aide pour effectuer électroporation in utero dans les procédures aseptiques, et Wood Hayley pour son aide pour préparer les plans.
EP a été soutenue par une fédération à long terme des sociétés européennes de biochimie (FEBS) et une bourse du Medical Research Council (MRC) de bourses de développement de carrière, titulaire de l'AMM par une subvention du Wellcome Trust à Elizabeth Fisher et Victor Tybulewicz (080174/B/06/Z) , HW par un EMBO long terme de bourses et RA par une bourse d'études de la MRC. Ce travail a été soutenu par une subvention de projet de la Wellcome Trust (086947/Z/08/Z) et par un FG Grant-in-Aid de la Medical Research Council (U117570528) à
matériels
| Name | Company | Catalog Number | Comments | |||
| Nom du réactif | Entreprise | Numéro de catalogue | Commentaires | |||
| Préparation d'aiguilles et de solution d'ADN pour l'injection | ||||||
| Kit Endofree Plasmid Maxi | Qiagen | 12362 | ||||
| Fast Green | Sigma | F-7258 | ||||
| Le verre borosilicate capillaires 1,0 mm de diamètre extérieur x 0,58 mm de diamètre | Harvard Apparatus | 30-0016 | ||||
| Microloader conseils | Eppendorf | 5242956003 | Pour Eppendorf pipettes 0,5 pi-10 pi / 2-20 ul | |||
| & Nbsp; | Matériau pour la chirurgie | |||||
| Extra plats Ciseaux Iris | Outils belle science | 14088-10 | ||||
| Pince courbes | Outils belle science | 91197-00 | ||||
| Pince à anneaux | Outils belle science | 11103-09 | ||||
| Porte-aiguille | Outils belle science | 12002-12 | ||||
| Graefe Forceps | Outils belle science | 11050-10 | ||||
| Fil résorbable Vicryl | Ethicon Inc (Johnson & Johnson) | W9074 | ||||
| Draps stériles 30cm x 45 cm | Buster | 141765 | ||||
| Écouvillons stériles | Shermond | HUBY-340 | ||||
| Cotons-tiges | Clean Croix Co., Ltd | 1860 | ||||
| La buprénorphine (Vetergesic) | De la santé animale Alstoe | |||||
| Clorhexidine | Vetasept | XHG007 | ||||
| Viscotears gel pour les yeux | Novartis | |||||
| L'isoflurane | Abbott Laboratories | B506 | ||||
| Pentoject, de pentobarbital sodique 20% | Animalcare | |||||
| L'électroporation | ||||||
| Electroporateur | BTX | ECM830 | ||||
| Tweezertrod Platinume 5mm | BTX, Harvard Apparatus | 45-0489 | ||||
| FemtoJet microinjecteur | Eppendorf | 5247000030 | ||||
| Pédale de commande pour FemtoJet microinjecteur | Eppendorf | 5247623002 | ||||
| Support de capillaire | Eppendorf | 5176190002 | ||||
| Le traitement des tissus | ||||||
| Paraformaldéhyde | Sigma | P6148 | ||||
| Saccharose | VWR (Prolabo) | 27480.294 | ||||
| Lames de microscope | ThermoScientific (Menzel-Gläser) | J1800AMNZ | ||||
| Lamelles | Menzel-Gläser | 22 x 50 mm # 1,5 | ||||
| Aqua Poly / montage | Polysciences, Inc | 18606 | ||||
Références
- Kolk, S. M., de Mooij-Malsen, A. J., Martens, G. J. Spatiotemporal Molecular Approach of in utero Electroporation to Functionally Decipher Endophenotypes in Neurodevelopmental Disorders. Front Mol. Neurosci. 4, 37 (2011).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol. 240, 237-246 (2001).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Dev. Growth Differ. 50, 499-506 (2008).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Tabata, H., Nakajima, K. Labeling embryonic mouse central nervous system cells by in utero electroporation. Dev. Growth Differ. 50, 507-511 (2008).
- Castro, D. S. A novel function of the proneural factor Ascl1 in progenitor proliferation identified by genome-wide characterization of its targets. Genes Dev. 25, 930-945 (2011).
- Pacary, E. Proneural transcription factors regulate different steps of cortical neuron migration through Rnd-mediated inhibition of RhoA signaling. Neuron. 69, 1069-1084 (2011).
- Marteau, L. Angiopoietin-2 regulates cortical neurogenesis in the developing telencephalon. Cereb Cortex. 21, 1695-1702 (2011).
- Ramon Moliner, E. . Comparative Methods in Neuroanatomy. , (1970).
- Banks, G. T. Behavioral and other phenotypes in a cytoplasmic Dynein light intermediate chain 1 mutant mouse. J. Neurosci. 31, 5483-5494 (2011).
- Elias, G. M., Elias, L. A., Apostolides, P. F., Kriegstein, A. R., Nicoll, R. A. Differential trafficking of AMPA and NMDA receptors by SAP102 and PSD-95 underlies synapse development. Proc. Natl. Acad. Sci. U.S.A. 105, 20953-20958 (2008).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U.S.A. 104, 1027-1032 (2007).
- Navarro-Quiroga, I., Chittajallu, R., Gallo, V., Haydar, T. F. L. o. n. g. -. t. e. r. m. selective gene expression in developing and adult hippocampal pyramidal neurons using focal in utero electroporation. J. Neurosci. 27, 5007-5011 (2007).
- Nakahira, E., Yuasa, S. Neuronal generation, migration, and differentiation in the mouse hippocampal primoridium as revealed by enhanced green fluorescent protein gene transfer by means of in utero electroporation. J. Comp. Neurol. 483, 329-340 (2005).
- Ramos, R. L., Bai, J., LoTurco, J. J. Heterotopia formation in rat but not mouse neocortex after RNA interference knockdown of DCX. Cereb Cortex. 16, 1323-1331 (2006).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon