使用して、マウス大脳皮質および海馬における可視化と樹状突起と棘の遺伝子操作
要約
この資料では詳細に子宮内で大脳皮質およびマウスのE14.5における海馬をエレクトロポためのプロトコルについて説明します。また、このこれらの2つの脳領域で樹状突起と棘を研究する貴重な方法であることを示している。
要約
子宮内エレクトロポレーション(IUE)胚の神経系1-5の異なった地域の発展を研究するための強力な手法となっています。このツールは広く細胞増殖、分化、特に大脳皮質6-8の神経細胞移動の調節を研究するために使用された日付ます。ここでは詳細私たちのプロトコルを子宮内で大脳皮質および海馬をエレクトロポ、このアプローチは、これら二つの脳領域における樹状突起と棘を研究するために使用することができる証拠を提供する。
初代培養の神経細胞の可視化と操作は、樹状突起、スパインとシナプスの開発に関与するプロセスの理解に貢献しています。しかし、in vitroで成長してニューロンが正常な発達中の樹状突起および/または脊椎の形成と維持に影響を与える可能性がすべての生理的な手がかりには公開されません。樹状突起と脊椎の構造の知識9を使用しての観測から来ている。しかし、ゴルジ染色は予測できないと見なされます。確かに、神経細胞と繊維管のグループは、隣接する領域は染色を欠いている間の特定の領域は、しばしば完全に染色された表示されると、ランダムにラベルが付けられています。最近の研究では、蛍光灯の構造のIUE変異体/野生型マウス10-11( 図1A)に樹状突起、棘などのシナプスを研究するための魅力的な代替方法を表していることが示されている。また、マウスのノックアウトの世代と比較して、IUEは、特定の時間帯に細胞の特定の集団における機能の研究の利得と損失を実行するための迅速なアプローチを表しています。さらに、IUEは、正常遺伝子またはshRNA 12の過剰発現時間制御を改良する誘導性遺伝子の発現または誘導性RNAiアプローチで使用されています。 IUEのこれらの利点は、このようにopene持っているD新しい寸法だけではなく、特定の脳構造( 図1B)でなく、開発の特定の時点( 図1C)における樹状突起と棘上の遺伝子の発現/抑制の効果を検討します。
最後に、IUEは、樹状突起、背骨、そして/または、シナプスの開発に関与する遺伝子間の機能的相互作用を識別するための便利なツールを提供しています。確かに、ウイルスなど他の遺伝子導入法とは対照的に、それが細胞の同じ集団内で複数のRNAiまたは導入遺伝子を組み合わせることは簡単です。
要約すると、IUEは、すでに脳機能や病気の根底にある分子機構の特性に貢献してきました、それはまた、樹状突起と棘の研究に有用なはずである強力な方法です。
プロトコル
イギリスでは、マウスは、飼育繁殖、動物(科学的手続)法1986の下に内務省によって承認されたガイドラインに従って扱われます。
1。準備:DNA溶液と針
- エンドトキシンフリーマキシプレップキットでプラスミドDNAを精製する。水の中で所望の濃度まで注射用プラスミドDNA溶液を調製し、注射を可視化する(0.05%の最終濃度)ファストグリーンを追加します。エレクトロポレーションの効率はDNA濃度に大きく依存しています。は1μg/μlの濃度は、一般的に使用されています。この濃度は、その開発に影響を与えずに、エレクトロポレーションのニューロンを可視化するのに十分である。しかし、プラスミドベクターと同様のサイズと(サイトメガロウイルスプロモーター/エンハンサー、サイトメガロウイルス即時型初期エンハンサーおよびニワトリβ-アクチンプロモーターの融合(CAG)のプロモーターとの強力な発現レベルの低い発現レベル)で使用されるプロモーターによると発現タンパク質の安定性は、この濃度は(0.25μg/μLのにを5μg/μl)を調整することができます。
- マイクロピペットプラーを用いて、ガラス針を引き抜きます。
2。手術の準備
- 手術器具をオートクレーブとリン酸緩衝生理食塩水(PBS)。
- PBS(ブプレノルフィン、30μg/ mlのVetergesic、最終濃度)に鎮痛剤溶液を調製します。妊娠マウスの重量を量ると、少なくとも30分手術前Vetergesicの皮下に0.1 mg / kgを注入します。この時間の間に、外科領域を準備します。加熱パッドおよび回復室の電源をオンにします。温水浴および滅菌ドレープ上のすべての滅菌器具および材料の滅菌したPBSを配置します。 PBSを入れたビーカーに白金電極を配置して、エレクトロに接続します。 microloaderチップを用いてDNA溶液を用いて針を入れ、キャピラリーホルダーに針を接続し、鉗子で針の先端をつまむ。
- 麻酔誘導チャンバーを用いて酸素キャリア(酸素2リットル/分)でイソフルランを妊娠マウス(E14.5-E15.5)をAnaesthetize。動物は正向反射失うまで待ちます。
- "手術前"マスクに動物を転送します。母親は全身麻酔下にありながら、目の角膜潰瘍を防ぐために、それぞれの目に目ゲルのドロップを配置します。腹部の毛を剃るように電気かみそりを使用しています。飛行の髪を収集するためにclorhexidineで一度剃っエリアを清掃します。
- 外科領域における第二のマスクに動物を転送します。加熱パッド上で、その背にマウスを置きます。ペダル反射が失われた外科手術を開始します。
- マスクと滅菌手袋を着用してください。剃毛され、駆除されていない皮膚の領域によって汚染される組織や楽器を防ぐために滅菌ドレープ(腹部の上に小さな穴を持つ)で動物をカバーしています。剃毛面積をきれいに少なくともトンclorhexidineで3回。別の滅菌綿棒を毎回使用しています。皮膚を通して正中線(約1インチの長さ)に沿って垂直に切開を作るためにメスを使用しています。はさみを使用して、白線(ホワイトラインは、コラーゲン結合組織の大部分で構成)に沿って腹部の筋肉と同様の切開を行います。
- 最もアクセスしやすい胚を選択し、2胚の間にリング鉗子を配置し、慎重に腹腔内の胚チェーンを引き出します。この点からは、滅菌予め温めておいたPBSで胚が水和保つ。
ない顕微鏡は可視化は必要ありません。
4。 DNAとエレクトロの注入
- それは容易に胚をエレクトロポレーションしたかを追跡するために行う、最も外側の胚のいずれかを使用して起動します。これは出血のリスクを増加させるとして、胚にあまり引っ張らないでください。リング鉗子を用いて羊膜嚢内の胚の位置を操作し、リング間の胚の頭部を安定させます。子宮壁に近い胚を押し上げるように優しく絞る。
- もう一方の手で、キャピラリーホルダーを取り、側脳室を対象とする半球の中央に慎重に針を挿入します。ファストグリーン(樹状突起を研究するために以下を1μl)と混合したDNA溶液の約1μlを注入するためにペダルを押してください。あなたが側脳室を埋める緑の色素を観察する必要があります。重要なステップ: - 針の鋭さが適切に子宮壁を貫くことが重要です。穴の拡大は、羊水や胎児死亡の漏れになりますので、それは子宮壁の表面と心室に挿入した後、針の動きを最小限に抑えることが重要です。これは出血と胎児死亡になりますように、子宮壁に刺す血管を避けてください。
- それが誘発されるので、側脳室へのDNAの大きすぎる音量を注入しないことが重要です水頭症(E14.5で2μlを超えない)。 DNAの量は実験の目的に応じて調整されます。 1μlのは一般的にほとんどの実験に使用されている場合は、DNA(約0.5μL)の小さいボリュームが樹状突起と脊椎分析のために必要となります。確かにいくつかの単離された細胞は、エレクトロポレーション、ニューロンの樹状東屋を視覚化し、測定するために対象とする必要があります。 - 皮質のエレクトロポレーションのために注入された心室、または海馬のエレクトロポレーションのために注入された心室( 図2)の反対側の同じ側にあるプラス(+)パドルで胚の頭部の両側に電極を配置します。その後1秒間隔で5〜30V電気パルス(50ミリ秒の期間)を適用します。重要なステップ:これは胚の死になりますように胎盤を通過電流を印加することは避けてください。
妊娠マウスのすべての胚は、任意の混乱を避けるために構築する通常は同じDNAを用いて、エレクトロポレーションすることができます。しかし、長い手術の減少胚の生存率はS。腹腔内は30分以上開かないでください。
5。手術後、エレクトロポレーション
- 胚をelectroporatingした後、腹腔内にPBSを追加し、元の場所に子宮角を置き換えるためにリングピンセットを使用しています。 Vicryl吸収性縫合糸と腹壁と皮膚を縫合。
- それは加熱パッド上に置かケージで転送してウェイクアップ(通常は5〜10分)となるまで回復室に動物を配置します。
6。術後
痛み、苦しみまたは苦痛を評価し、手術後の動物の24時間および48時間の重量を量るためにマウスの動作を確認してください。必要に応じて、鎮痛剤は痛みや不快感を最小限に抑えるために投与することができる。
7。組織の処理
実験に必要な胚又は出生後の段階でエレクトロポレーション胚または子犬を収集します。
ove_content "> - 分析のための胚の段階で(細胞増殖または移行を検討するなど):頸椎脱臼を介して母親を安楽死させると胚を収集します。断頭した後、蛍光双眼鏡を使って頭蓋骨を越えて視覚化し、蛍光シグナルの量と位置によって示されるように適切に、エレクトロポレーションされた頭脳を選択します。頭蓋骨の脳を解剖し、20%スクロース/ PBSで一晩4%PFAで一晩固定し、その後場所。 OCTコンパウンド、-80°Cとクライオスタットを用いてセクションを凍結に埋め込むことができます。
- 生後段階(例えば、樹状突起と棘を勉強するため)での解析の場合:
ペントバルビタールの腹腔内注射(40-60 mg / kg体重)で仔や成体マウスを麻酔し、PBS中4%PFAに続いてPBSでtranscardial灌流を行います。一晩4%PFAで頭蓋骨とポストフィックスの脳を解剖する。ビブラトーム(dは100μm以下のセクションを使用して、PBS、セクション脳内洗浄した後endrite分析)。画像の樹状突起と棘に0.16〜0.19ミリメートル厚いカバーガラスを使用して、アクアポリ/マウントのセクションをマウントします。
8。代表的な結果
図3は、CA1(図3C、D)および海馬の歯状回( 図3E、F)で、大脳皮質( 図3A、B)にエレクトロポレーションした細胞の例を示します。野生型マウスにGFPコンストラクト(PCA-B-EGFPm5サイレンサー3)脳の生後日(P)14で収穫されたとE14.5に電気穿孔した。 DNA溶液の少量(1μg/μLので溶液0.5μl以下)を注入することによって、いくつかの細胞は、単離されたGFP +細胞( 図3)だけでなく、その棘の樹状突起分枝の可視化を可能にする、ラベルが付いています高倍率( 図4)。
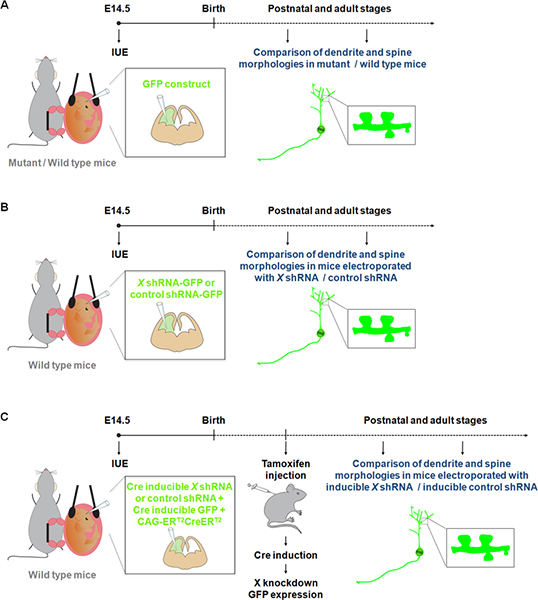
<強い>図1樹状突起と棘を研究するために使用することができるエレクトロポレーション·プロトコルの模式図。 (A)GFPのエレクトロポレーションは、野生型と変異型マウスでは樹状突起と棘を比較するために構築します。 (B)GFP-shRNAのエレクトロポレーション(GFPは、同じコンストラクトから発現されています)shRNAは、関心のある遺伝子(X)またはコントロールshRNAのための特定のコンストラクトでエレクトロマウスでは樹状突起と棘を比較することができます。 (C)IUEは、望ましい期間にshRNAの発現を制限するためにCreリコンビナーゼを誘導系と一緒に使用することができます。この実験では、4 -ヒドロキシ(CAG-ER T2 CreER T2;は1μg/μl)をしてアクティブにすることができますCreリコンビナーゼのフォーム発現ベクター10は 、依存性のCreリコンビナーゼに特異的なshRNAを発現するベクターと一緒にエレクトロポレーションされてい方法(1μg/μLの、および組換えインジケータ付き(CALNL-GFPコンストラクト、CreリコンビナーゼによりGFPの発現誘導;は1μg/μl)を10 efficienノックダウンのCYはshRNAの濃度を増加させると同様にCAG-ER T2 CreER T2濃度を増加させることによって改善することができます。
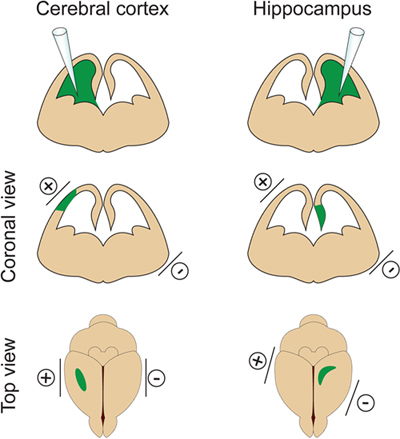
図2エレクトロポレーションの空間を制御します。この図は、大脳皮質や海馬をターゲットにするためにDNAの注射部位に応じてパドル電極を配置する場所を示します。
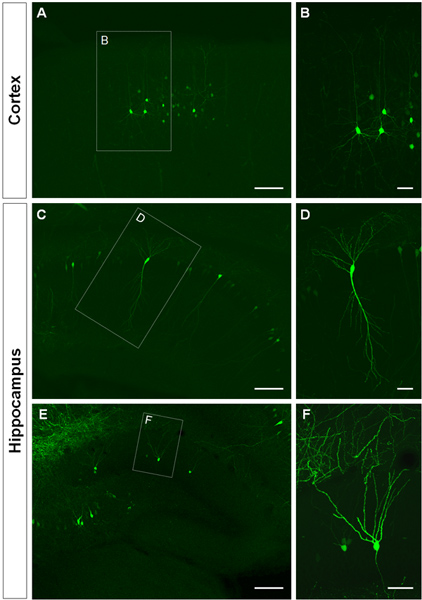
図3 子宮内での樹状東屋の可視化は、大脳皮質や海馬で細胞をエレクトロポレーション。 (A、B)GFP +大脳皮質の錐体細胞(CD)錐体、海馬のCA1の細胞と(E、F)、P14における海馬歯状回の顆粒細胞を示す冠状断面。 GFPコンストラクト(PCA-B-EGFPm5サイレンサー3)は14.5日でエレクトロポレートした。高倍率の画像(B、D、F)はIUEは、樹状突起を可視化する効率的な方法であることを示している。スケールバーは50μm(B、DおよびF)、150μmの(A、C、E)を表します。
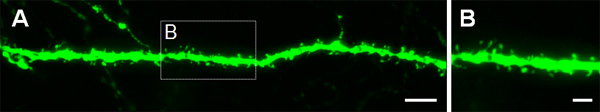
図4構築物を発現しているGFPでE14.5で子宮内エレクトロポレーションしたP14神経細胞における樹状突起棘の可視化。 (A、B)海馬錐体ニューロンの基底樹状突起から棘の高倍率画像。スケールバーは5μm()と2μmの(B)を表します。
ディスカッション
IUEは、スペースでなく、時間だけでなく、遺伝子発現を操作するための強力なツールです。我々は、この技術は、マウスの大脳皮質と海馬の樹状突起と棘を視覚化し、遺伝的に操作するために使用することができますここで表示されます。以前に引用した利点に加え、それはIUEは、メソッドがゴルジ体へとは対照的に、免疫組織化学、あるいは表現型エレクトロポレーションした細胞を例にすることができsituハイブリダイゼーションにおいて結合することができますことは注目に値する。このプロシージャは、その相対的侵襲性にもかかわらず、明らかな脳の奇形を誘発しないことについて言及することも重要です。さらに、細胞レベルでは、IUEは、エレクトロポレーションのニューロン13の電気生理学的特性を変更しません。私たちのデモでは、樹状突起とスパイン形態の可視化に焦点を当てているが、E14.5における皮質または海馬ニューロンのIUEはまた、軸索形成およびガイダンスのような他の発達イベントを研究するために使用される可能性があります。追加でition、プロトコルの同じ種類の異なる集団を対象とする胚発生の他の段階で実装することができます。たとえば、E18.5で発達が非常に遅く皮質のエレクトロポレーションのパラダイムは、アストロサイト前駆細胞が1で発現を駆動するために実行することができます。同様に、E14.5における海馬のエレクトロポレーションが同時にCA1-CA3錐体細胞の前駆細胞および歯状回顆粒細胞の前駆細胞を標的とすることができますが、後半に海馬のエレクトロポレーション(E18.5または出生後早期)が別の歯状回顆粒をターゲットにできるようになる前駆細胞14。このケースでは、DNAの注入量は、電流の強さと同様に増加することができます。
IUEによって導入された導入遺伝子はエピソームのままのように見えるため、連続する細胞分裂後の細胞から失われています。このようなニューロンとして分裂細胞では、しかし、エピソームの導入遺伝子は、エレクトロポレーションは、長期試験13を許した後、月間アクティブのまま、15。私たちの研究では、胚の初期の発達時点アップから導入遺伝子の持続的な式でIUE結果を用いて皮質または海馬の神経前駆細胞を標的とすることを示す(ここでは分析した最新の時点)、出生後7週間に明るいGFP +細胞を観察した成人期へ。
技術の電流制限は、エレクトロポレーションした細胞の総数を細かく制御を行使することは困難であるということです。しかし、DNA溶液の注入量を減少させることによって、我々は、少数の細胞を標識するために、孤立したGFP +細胞だけでなく、その棘の樹状突起分枝を可視化することが可能であることが示されている。トランスフェクトされた領域の寸法は、また、電流とパルス数またはエレクトロポレーションパドル径の強度としてエレクトロポレーションのパラメータを変更して調整することができます。
完全にIUEは、迅速、簡単に実装できる方式であるとin vivoでの樹状突起と棘を学ぶことが効率的です。
開示事項
利害の衝突が宣言されません。
謝辞
著者は彼らの助け無菌手続きの下で子宮内エレクトロポレーションで実行するために、図面を準備する彼女の助けのためにヘイリー·ウッド博士のキャスリーン·マザーズ博士ジャン·フィリップ·Mocho博士ヨランダサアベドラ·トーレスに感謝します。
EPは、エリザベス·フィッシャーとビクターTybulewiczにウェルカムトラスト助成により、欧州の生化学的社会の長期的な連合(FEBS)の交わりと医学研究評議会(MRC)キャリア開発のフェローシップ、MAH(080174/B/06/Z)によってサポートされていました、HW EMBO長期的な親睦とRAによるMRCの学生の身分で。この作品は、ウェルカム·トラスト(086947/Z/08/Z)からプロジェクトの助成金によってとFGの医学研究評議会(U117570528)からの補助金によってサポートされていました
資料
| Name | Company | Catalog Number | Comments | |||
| 試薬の名前 | 会社 | カタログ番号 | コメント | |||
| 注射用の針とDNA溶液の調製 | ||||||
| Endofreeプラスミドマキシキット | キアゲン | 12362 | ||||
| 速いグリーン | シグマ | F-7258 | ||||
| ホウケイ酸ガラス毛細管 1.0ミリメートルOD×0.58 mm内径 | ハーバード装置 | 30から0016 | ||||
| Microloaderヒント | エッペンドルフ | 5242956003 | エッペンドルフピペットで0.5μL、10μL/ 2から20μL | |||
| &n個のBSPは、 | 手術のための材料 | |||||
| 余分な薄いアイリスはさみ | ファイン科学ツール | 14088から10 | ||||
| 湾曲した鉗子 | ファイン科学ツール | 91197から00 | ||||
| リング鉗子 | ファイン科学ツール | 11103から09 | ||||
| ニードルホルダー | ファイン科学ツール | 12002から12 | ||||
| グレーフェ鉗子 | ファイン科学ツール | 11050から10 | ||||
| Vicryl吸収性縫合糸 | エチコン社(ジョンソン·エンド·ジョンソン) | W9074 | ||||
| 滅菌ドレープ30センチメートルX 45センチメートル | バスター | 141765 | ||||
| 滅菌綿棒 | Shermond | HUBY-340 | ||||
| 綿の芽 | クリーンクロス(株) | 1860 | ||||
| ブプレノルフィン(Vetergesic) | Alstoeアニマルヘルス | |||||
| Clorhexidine | Vetasept | XHG007 | ||||
| アイゲルViscotears | ノバルティス | |||||
| イソフルレン | アボット·ラボラトリーズ | B506 | ||||
| Pentoject、ペントバルビタールナトリウム20パーセント | Animalcare | |||||
| エレクトロポレーション | ||||||
| エレクトロ | BTX | ECM830 | ||||
| プラチナTweezertrod5ミリメートルの電子 | BTX、ハーバード装置 | 45から0489 | ||||
| Femtojetインジェクター | エッペンドルフ | 5247000030 | ||||
| Femtojetマイクロインジェクター用フットコントロール | エッペンドルフ | 5247623002 | ||||
| キャピラリーホルダー | エッペンドルフ | 5176190002 | ||||
| 組織の処理 | ||||||
| パラホルムアルデヒド | シグマ | P6148 | ||||
| スクロース | VWR(Prolabo) | 27480.294 | ||||
| 顕微鏡スライド | ThermoScientific(メンツェル·グレイザー) | J1800AMNZ | ||||
| カバースリップ | メンツェル·グレイザー | 22×50ミリメートル#1,5 | ||||
| アクアポリ/マウント | ポリサイエン株式会社 | 18606 | ||||
参考文献
- Kolk, S. M., de Mooij-Malsen, A. J., Martens, G. J. Spatiotemporal Molecular Approach of in utero Electroporation to Functionally Decipher Endophenotypes in Neurodevelopmental Disorders. Front Mol. Neurosci. 4, 37 (2011).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol. 240, 237-246 (2001).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Dev. Growth Differ. 50, 499-506 (2008).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Tabata, H., Nakajima, K. Labeling embryonic mouse central nervous system cells by in utero electroporation. Dev. Growth Differ. 50, 507-511 (2008).
- Castro, D. S. A novel function of the proneural factor Ascl1 in progenitor proliferation identified by genome-wide characterization of its targets. Genes Dev. 25, 930-945 (2011).
- Pacary, E. Proneural transcription factors regulate different steps of cortical neuron migration through Rnd-mediated inhibition of RhoA signaling. Neuron. 69, 1069-1084 (2011).
- Marteau, L. Angiopoietin-2 regulates cortical neurogenesis in the developing telencephalon. Cereb Cortex. 21, 1695-1702 (2011).
- Ramon Moliner, E. . Comparative Methods in Neuroanatomy. , (1970).
- Banks, G. T. Behavioral and other phenotypes in a cytoplasmic Dynein light intermediate chain 1 mutant mouse. J. Neurosci. 31, 5483-5494 (2011).
- Elias, G. M., Elias, L. A., Apostolides, P. F., Kriegstein, A. R., Nicoll, R. A. Differential trafficking of AMPA and NMDA receptors by SAP102 and PSD-95 underlies synapse development. Proc. Natl. Acad. Sci. U.S.A. 105, 20953-20958 (2008).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U.S.A. 104, 1027-1032 (2007).
- Navarro-Quiroga, I., Chittajallu, R., Gallo, V., Haydar, T. F. L. o. n. g. -. t. e. r. m. selective gene expression in developing and adult hippocampal pyramidal neurons using focal in utero electroporation. J. Neurosci. 27, 5007-5011 (2007).
- Nakahira, E., Yuasa, S. Neuronal generation, migration, and differentiation in the mouse hippocampal primoridium as revealed by enhanced green fluorescent protein gene transfer by means of in utero electroporation. J. Comp. Neurol. 483, 329-340 (2005).
- Ramos, R. L., Bai, J., LoTurco, J. J. Heterotopia formation in rat but not mouse neocortex after RNA interference knockdown of DCX. Cereb Cortex. 16, 1323-1331 (2006).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved