Visualisering og genetisk manipulering av dendritter og pigger i Mus hjernebarken og hippocampus hjelp
In This Article
Summary
Denne artikkelen beskriver i detalj en protokoll til electroporate i utero hjernebarken og hippocampus hos E14.5 i mus. Vi viser også at dette er en verdifull metode for å studere dendritter og pigger i disse to cerebrale regioner.
Abstract
I fosterlivet electroporation (IUE) har blitt en effektiv teknikk for å studere utviklingen av ulike regioner av embryonale nervesystemet 1-5. Hittil dette verktøyet har vært mye brukt til å studere reguleringen av cellulær proliferasjon, differensiering og neuronal migrasjon spesielt i utviklingsland hjernebarken 6-8. Her har vi detalj vår protokoll til electroporate i utero hjernebarken og hippocampus og gi bevis for at denne tilnærmingen kan brukes til å studere dendritter og pigger i disse to cerebrale regioner.
Visualisering og manipulering av nerveceller i primære kulturer har bidratt til en bedre forståelse av prosessene som er involvert i dendrite, ryggraden og synapse utvikling. Men nevroner voksende in vitro ikke utsettes for alle de fysiologiske signaler som kan påvirke dendrite og / eller ryggrad dannelse og vedlikehold under normal utvikling. Vår kunnskap om dendrite og ryggrad strukturer 9. Men Golgi flekker anses å være uforutsigbar. Faktisk er grupper av nerveceller og fiber traktater merket tilfeldig, med spesielle områder ofte vises helt beiset mens tilstøtende områder er blottet for farging. Nyere studier har vist at IUE av fluorescerende konstruksjoner representerer et attraktivt alternativ metode for å studere dendritter og pigger samt synapser i mutant / villtype mus 10-11 (figur 1A). Videre i forhold til produksjon av mus knockouts, representerer IUE en rask tilnærming til å utføre gevinst og tap av funksjon studier i spesifikke populasjon av celler i løpet av en bestemt tid vindu. I tillegg har IUE blitt brukt med induserbar genekspresjon eller induserbar RNAi tilnærmingsmåter for å avgrense tidsmessige kontroll over uttrykket av et gen eller shRNA 12. Disse fordeler IUE har dermed opened nye dimensjoner for å studere effekten av genuttrykk / undertrykking på dendritter og ryggrader ikke bare i spesifikke cerebrale strukturer (Figur 1B), men også på et bestemt tidspunkt i utviklingen (figur 1C).
Til slutt gir IUE et nyttig verktøy for å identifisere funksjonelle samspillet mellom gener involvert i dendrite, ryggrad og / eller synapse utvikling. Faktisk, i motsetning til andre genoverføring metoder som virus, er det enkelt å kombinere flere RNAi eller transgener i samme populasjon av celler.
Oppsummert er IUE en kraftig metode som allerede har bidratt til karakterisering av molekylære mekanismene bak hjernens funksjon og sykdom, og det bør også være nyttig i studiet av dendritter og pigger.
Protocol
I Storbritannia, er mus plassert, oppdrettet, og behandles i henhold til retningslinjer godkjent av Home Office under Animal (Scientific Procedures) Act 1986.
1. Forberedelse: DNA Solution og Needles
- Rense plasmid DNA med en Endotoksin gratis Maxi-prep kit. Forbered plasmid DNA injeksjonsvæske til ønskede konsentrasjoner i vann og tilsett Fast Green (endelig konsentrasjon på 0,05%) for å visualisere injeksjoner. Effektiviteten av electroporation er svært avhengig av DNA konsentrasjon. En konsentrasjon av en mikrogram / mL er vanligvis brukt. Denne konsentrasjonen er tilstrekkelig til å visualisere electroporated nevroner uten at det påvirker deres utvikling. Men ifølge arrangøren brukt i plasmidet vektor (lavt uttrykk nivå med cytomegalovirus promoter / enhancer, sterkt uttrykk nivå med cytomegalovirus umiddelbar tidlig enhancer og kylling β-actin promoter fusion (CAG) promoter) samt størrelse og stabilitet av proteinet uttrykt, kan denne konsentrasjonen justeres (0,25 mikrogram / mL til 5 mikrogram / mL).
- Trekk glass nåler ved hjelp av en mikropipette avtrekker.
2. Klargjøring av kirurgi
- Autoklaver kirurgiske instrumenter og fosfatbuffer saltvann (PBS).
- Forbered smertestillende løsning i PBS (Buprenorfin, Vetergesic, endelig konsentrasjon på 30 mikrogram / ml). Vei den gravide mus og injisere subkutant 0,1 mg / kg av Vetergesic minst 30 minutter før operasjonen. I løpet av denne tiden, forberede kirurgisk område. Slå på Varmeplatene og utvinning kammermusikk. Plasser sterile PBS i varmt vannbad og alle sterile instrumenter og materialer på sterile forheng. Plasser platina elektroder i en PBS fylt begerglass og koble til electroporator. Fyll nålen med DNA løsningen ved hjelp av en microloader spissen, kobler du nålen til kapillær holderen og klemme av nålespissen med en tang.
- Anaesthetize en gravid mus (E14.5-E15.5) med isofluran i oksygen carrier (oksygen 2 l / min) med en bedøvelse induksjon kammer. Vent til dyret mister kjøl refleks.
- Overfør dyret til en "pre-kirurgi" maske. Plasser en dråpe øye gel på hvert øye for å hindre hornhinnesår av øynene mens moren er under narkose. Bruk en elektrisk barbermaskin for å barbere håret på magen. Rengjør det barberte området én gang med clorhexidine å samle flyvende hår.
- Overfør dyret til en andre maske i det kirurgiske området. Plasser musen med ryggen til varmeputen. Start kirurgi når pedalen refleks har gått tapt.
- Ta på masken og sterile hansker. Dekk dyret med en steril drapere (med et lite hull over magen) for å hindre at vev og instrumenter blir forurenset av de områdene av huden som ikke har blitt barbert og desinfisert. Rengjør det barberte området ent minst 3 ganger med clorhexidine. Bruk en annen steril bomullspinne hver gang. Bruk en skalpell til å lage en vertikal snitt langs midtlinjen (~ 1 cm lang) gjennom huden. Ved hjelp av saks, gjør en tilsvarende innsnitt av muskelen i magen langs linea alba (hvit linje består hovedsakelig av kollagen bindevev).
- Velg de mest tilgjengelige embryoer og plassere ring tang mellom to embryoer og dra forsiktig embryonale kjeden ut av bukhulen. Fra dette punktet, holde embryoene hydrert med steril forvarmes PBS.
Ingen mikroskop er nødvendig for visualisering.
4. Injeksjon av DNA og electroporation
- Start med en av de mest laterale embryoene, noe som gjør det lettere å holde styr på hvilke embryoer ble electroporated. Ikke trekk for mye på de embryoene som dette vil øke risikoen for blødning. Manipulere plasseringen av embryo inne i amniotic sac bruke ring tang ogstabilisere hodet av embryoene mellom ringene. Klem forsiktig å presse opp embryoet nærmere livmorveggen.
- Med den andre hånden, ta kapillær holderen og sett nålen forsiktig inn i midten av halvkulen å målrette den laterale ventrikkelen. Trykk på pedalen for å injisere ca 1 mL av DNA løsning blandet med Fast Green (mindre enn 1 mL å studere dendritter). Du bør observere den grønne fargestoffet fylle den laterale ventrikkelen. Kritiske trinn: - gjengivelsen av nålen er kritisk til pierce ordentlig livmorveggen. Det er viktig å minimere bevegelse av nålen på overflaten av livmor veggen og etter innsetting i ventrikkelen fordi en utvidelse av hullet vil resultere i lekkasje av fostervann og embryo død. Unngå piercing blodårer i livmorveggen, da dette vil resultere i blødninger og embryo død.
- Det er viktig ikke å injisere for stort volum av DNA inn i laterale ventrikkelen fordi det vil forårsakehydrocephalus (ikke overstige 2 mL ved E14.5). Volumet av DNA er justert i henhold til formålet med forsøket. Hvis 1μl brukes vanligvis for de fleste eksperimenter, er et mindre volum av DNA (ca. 0,5 mL) som kreves for dendrite og ryggrad analyse. Faktisk noen isolerte cellene trenger for å være målrettet for å visualisere og måle dendrittiske arbor av electroporated nerveceller. - Plasser elektrodene på sidene av embryoet hodet med den positive (+) padle på samme side som injiseres ventrikkelen for cortex electroporation eller på motsatt side av den injiserte ventrikkel for hippocampus electroporation (figur 2). Påfør deretter fem 30V elektriske pulser (50 msek varighet) på 1 sek mellomrom. Kritisk trinn: Unngå å bruke strøm på tvers av morkaken som dette vil resultere i embryodød.
Alle embryoene i en gravid mus kan electroporated, vanligvis med samme DNA konstruere for å unngå eventuelle misforståelser. Men en lang operasjon nedgang er den overlevelse av embryo. Bukhulen bør ikke åpnes lenger enn 30 min.
5. Kirurgi Post-electroporation
- Etter electroporating embryoene, legger PBS i bukhulen og bruke ring tang for å erstatte livmor horn i sin opprinnelige plassering. Suture magen veggen og hud med Vicryl absorberbare suturer.
- Plasser dyret i et recovery kammer før det våkner opp (vanligvis 5-10 min) og deretter overføre i et bur plassert på en varmepute.
6. Post-kirurgi
Sjekk oppførsel av mus for å vurdere smerte, lidelse eller nød og veie dyrene 24 h og 48 timer etter operasjonen. Om nødvendig kan smertestillende gis for å redusere smerte og ubehag.
7. Tissue Processing
Samle electroporated embryoene eller unger ved embryonale eller postnatal stadier kreves for forsøket.
ove_content "> - For analyse på embryonale stadier (for eksempel for å studere cellevekst eller migrasjon):Avlive moren via cervical forvridning og samle embryoer. Etter halshogging, velger hjernen som er riktig electroporated, som indikert av mengden og plasseringen av fluorescerende signal, visualisert gjennom skallen med en fluorescerende kikkert. Dissekere hjernen ut av skallen og fikse overnatting i 4% PFA og deretter plass i 20% sukrose / PBS over natten. Legge i oktober sammensatte, frys ved -80 ° C og avsnitt ved hjelp av en cryostat.
- For analyse på postnatale stadier (for eksempel for å studere dendritter og pigger):
Anesthetize valper eller voksne mus med intraperitoneal injeksjon av pentobarbitone (40-60 mg / kg) og utføre transcardial perfusjon med PBS, etterfulgt av 4% PFA i PBS. Dissekere hjernen ut av skallen og post-fix i 4% PFA natten. Etter vask i PBS, seksjon hjernen ved hjelp av en vibratome (100 mikrometer seksjoner for dendrite analyse). Monter delene i Aqua Poly / mount bruker 0.16-0.19 mm tykke Dekkglass til image dendritter og pigger.
8. Representative resultater
Figur 3 viser eksempler på electroporated celler i hjernebarken (Tall 3A, B), i CA1 (Tall 3C, D) og i dentate gyrus av hippocampus (Tall 3E, F). Villtype mus ble electroporated på E14.5 med en GFP konstruksjon (PCA-b-EGFPm5 lyddemper 3) og hjerner ble høstet ved postnatal dag (P) 14. Ved å injisere et lite volum av DNA løsning (0,5 mL eller mindre av en løsning på en mikrogram / mL), er noen få celler merket, noe som tillater visualisering av dendrittiske arborization av isolerte GFP + celler (figur 3), samt deres spines ved høyere forstørrelse (figur 4).
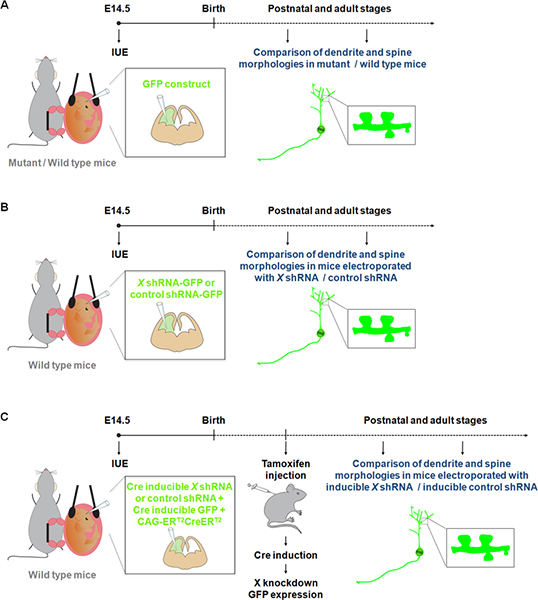
Figur 1. Skjematisk fremstilling av electroporation protokoller som kan brukes til å studere dendritter og pigger. (A) electroporation av en GFP konstruere å sammenligne dendritter og pigger i villtype og mutant mus. (B) electroporation av GFP-shRNA (GFP er uttrykt fra samme konstruksjon) for å sammenligne dendritter og pigger i mus electroporated med en shRNA konstruere spesifikk for et gen av interesse (X) eller en kontroll shRNA. (C) IUE kan brukes sammen med en Cre induserbar system for å begrense uttrykk for shRNA til ønskelig tidsperioden. I dette eksperimentet, en vektor som uttrykker en form for Cre recombinase som kan aktiveres ved 4-hydroxytamoxifen (CAG-ER T2 CreER T2; 1 mikrogram / mL) 10, er electroporated sammen med en vektor som uttrykker en bestemt shRNA i en Cre avhengige måte (1 mikrogram / mL, og med en rekombinasjon indikator (CALNL-GFP konstruere, GFP uttrykk induserbar ved Cre;. 1 mikrogram / mL) 10 efficiency av knockdown kan forbedres ved å øke konsentrasjonen av shRNA samt øke CAG-ER T2 CreER T2 konsentrasjon.
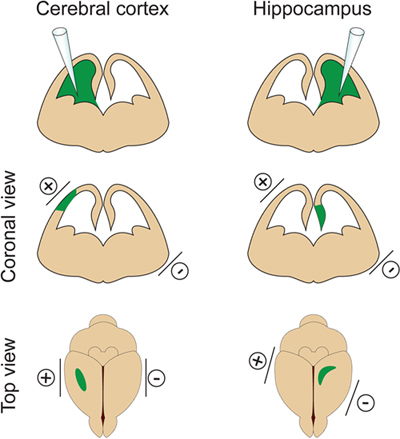
Figur 2. Romlig kontroll av electroporation. Denne figuren viser hvor du skal plassere padle elektrodene i henhold til DNA injeksjonsstedet for å målrette hjernebarken eller hippocampus.
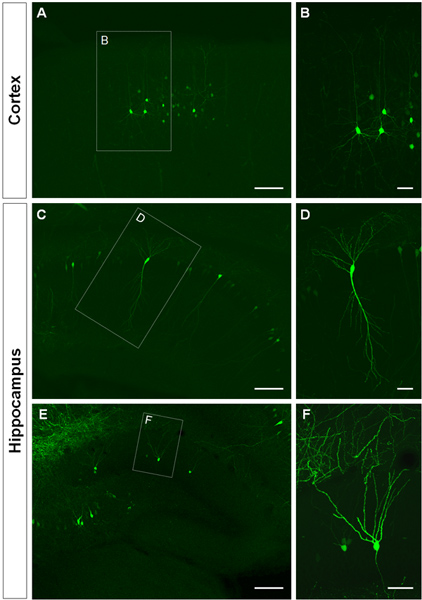
Figur 3. Visualisering av dendrittiske arbor in utero electroporated cellene i hjernebarken og hippocampus. (A, B) koronale seksjoner viser GFP + pyramidale celler i cerebral cortex, (CD) pyramidale celler i CA1 av hippocampus og (E, F), granule celler i dentate gyrus på P14. En GFP konstruksjon (PCA-b-EGFPm5 lyddemper 3) ble electroporated på E14.5. Høyere forstørrelse bilder (B, D, F) viser at IUE er en effektiv metode for å visualisere dendritter. Skala søylene representerer 50 mikrometer (B, D og F), 150 mikrometer (A, C, E).
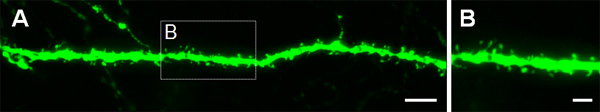
Figur 4. Visualisering av dendrittiske spines i P14 nevroner som ble electroporated i utero på E14.5 med en GFP uttrykker konstruere. (A, B) stor forstørrelse bilder av pigger fra basal dendritter av hippocampus pyramidale nevroner. Skala søylene representerer 5 mikrometer (A) og 2 mikrometer (B).
Discussion
IUE er et kraftig verktøy for å manipulere genuttrykket ikke bare i verdensrommet, men også i tid. Vi viser her at denne teknikken kan brukes til å visualisere og genetisk manipulere dendritter og pigger i hjernebarken og hippocampus hos mus. Foruten de fordelene som tidligere sitert, er det verdt å merke seg at IUE, i motsetning til Golgi-metoden, kan kombineres med immunhistokjemi eller in situ hybridisering, som tillater for eksempel å fenotype de electroporated cellene. Det er også viktig å nevne at denne fremgangsmåten ikke induserer åpenbare hjernen misdannelser tross for sin relative invasivitet. I tillegg, på cellenivå, ikke IUE ikke endre elektrofysiologiske egenskaper electroporated nevroner 13. Mens vår demonstrasjon fokuserer på visualisering av dendrite og ryggrad morfologi, kunne IUE av kortikale eller hippocampus nevroner ved E14.5 også brukes til å studere andre utviklingsforstyrrelser hendelser som axon formasjon og veiledning. I leggeition, samme type protokoll kan gjennomføres ved andre stadier av embryoutvikling å målrette ulike populasjoner. For eksempel kan en utviklingshemmede veldig sent kortikal electroporation paradigmet på E18.5 utføres for å kjøre uttrykk i astrocytic stamfedre 1. Tilsvarende mens en electroporation av hippocampus ved E14.5 gjør det mulig å målrette CA1-CA3 pyramidale nevroner stamfedre og dentate granule celle progenitor samtidig, ville en sen hippocampus electroporation (E18.5 eller tidlig postnatal) tillate å målrette ulike dentate granule stamfedre 14. I dette tilfellet kan det injiserte volumet av DNA økes, samt intensiteten i strømmen.
Transgener introdusert av IUE synes å forbli episomal og er derfor tapt fra celler etter rad celledelinger. I postmitotic celler som nerveceller, men de episomal transgener forblir aktive i flere måneder etter electroporation slik langtidsstudier 13, 15. I vår studie har vi sett lyse GFP + celler opp til 7 uker etter fødselen (den nyeste tidspunktet vi analyserte) indikerer at embryonale målretting av kortikale eller hippocampus nevrale forløpere bruker IUE resultater i vedvarende uttrykk for transgene fra tidlige utviklingsforstyrrelser tidspunkter opp til voksenlivet.
En gjeldende begrensning av teknikken er at det er vanskelig å utøve en god kontroll over det totale antall electroporated celler. Men ved å redusere det injiserte volumet av DNA-løsning, har vi vist at det er mulig å merke noen få celler og til å visualisere dendrittiske arborization av isolerte GFP + celler samt deres pigger. Dimensjonen på transfekterte området kan også bli justert ved å endre parametrene av electroporation som intensitet av nåværende og antall pulser eller diameteren på electroporation padleårer.
Tilsammen IUE er en metode som er enkel å implementere, rask ogeffektivt å studere dendritter og ryggrader in vivo.
Acknowledgements
Forfatterne ønsker å takke Dr. Kathleen Mathers, Dr. Jean-Philippe Mocho og Dr. Yolanda Saavedra Torres for deres hjelp til å utføre i utero electroporation under aseptiske prosedyrer, og Hayley Wood for hennes hjelp til å forberede tegningene.
EP ble støttet av en langsiktig Federation of European Biokjemiske Societies (FEBS) fellesskap og en Medical Research Council (MRC) karriereutvikling fellesskap, Mah ved en Wellcome Trust stipend til Elizabeth Fisher og Victor Tybulewicz (080174/B/06/Z) , HW av en embo langsiktig fellesskap og RA ved en MRC studentship. Dette arbeidet ble støttet av et prosjekt stipend fra Wellcome Trust (086947/Z/08/Z) og av en Grant-i-Aid fra Medical Research Council (U117570528) til FG
Materials
| Name | Company | Catalog Number | Comments | |||
| Navn på reagensen | Firma | Katalognummer | Kommentarer | |||
| Utarbeidelse av nåler og DNA injeksjonsvæske | ||||||
| Endofree Plasmid Maxi Kit | Qiagen | 12362 | ||||
| Rask Grønn | Sigma | F-7258 | ||||
| Borsilikatglass kapillærer 1,0 mm OD x 0,58 mm ID | Harvard Apparatus | 30-0016 | ||||
| Microloader tips | Eppendorf | 5242956003 | For Eppendorf pipetter 0,5 mL-10 mL / 2-20 mL | |||
| & Nbsp; | Materiale for kirurgi | |||||
| Ekstra tynne Iris saks | Fin Science Verktøy | 14088-10 | ||||
| Buede tang | Fin Science Verktøy | 91197-00 | ||||
| Ring tang | Fin Science Verktøy | 11103-09 | ||||
| Needle holder | Fin Science Verktøy | 12002-12 | ||||
| Graefe tang | Fin Science Verktøy | 11050-10 | ||||
| Vicryl absorberbare suturer | Ethicon Inc (Johnson & Johnson) | W9074 | ||||
| Sterile gardiner 30cm x 45 cm | Buster | 141765 | ||||
| Sterile kompresser | Shermond | Huby-340 | ||||
| Bomullspinner | Clean Cross Co, Ltd | 1860 | ||||
| Buprenorfin (Vetergesic) | Alstoe Animal Health | |||||
| Clorhexidine | Vetasept | XHG007 | ||||
| Eye Gel Viscotears | Novartis | |||||
| Isofluran | Abbott Laboratories | B506 | ||||
| Pentoject, Pentobarbitone Sodium 20% | Animalcare | |||||
| Electroporation | ||||||
| Electroporator | BTX | ECM830 | ||||
| Platinum Tweezertrode 5mm | BTX, Harvard Apparatus | 45-0489 | ||||
| Femtojet microinjector | Eppendorf | 5247000030 | ||||
| Foot Control for Femtojet Microinjector | Eppendorf | 5247623002 | ||||
| Kapillær holder | Eppendorf | 5176190002 | ||||
| Tissue behandling | ||||||
| Paraformaldehyde | Sigma | P6148 | ||||
| Sukrose | VWR (Prolabo) | 27480.294 | ||||
| Objektglass | ThermoScientific (Menzel-Glaser) | J1800AMNZ | ||||
| Dekkglass | Menzel-Glaser | 22 x 50 mm # 1,5 | ||||
| Aqua Poly / mount | Polysciences, Inc | 18606 | ||||
References
- Kolk, S. M., de Mooij-Malsen, A. J., Martens, G. J. Spatiotemporal Molecular Approach of in utero Electroporation to Functionally Decipher Endophenotypes in Neurodevelopmental Disorders. Front Mol. Neurosci. 4, 37 (2011).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol. 240, 237-246 (2001).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Dev. Growth Differ. 50, 499-506 (2008).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Tabata, H., Nakajima, K. Labeling embryonic mouse central nervous system cells by in utero electroporation. Dev. Growth Differ. 50, 507-511 (2008).
- Castro, D. S. A novel function of the proneural factor Ascl1 in progenitor proliferation identified by genome-wide characterization of its targets. Genes Dev. 25, 930-945 (2011).
- Pacary, E. Proneural transcription factors regulate different steps of cortical neuron migration through Rnd-mediated inhibition of RhoA signaling. Neuron. 69, 1069-1084 (2011).
- Marteau, L. Angiopoietin-2 regulates cortical neurogenesis in the developing telencephalon. Cereb Cortex. 21, 1695-1702 (2011).
- Ramon Moliner, E. . Comparative Methods in Neuroanatomy. , (1970).
- Banks, G. T. Behavioral and other phenotypes in a cytoplasmic Dynein light intermediate chain 1 mutant mouse. J. Neurosci. 31, 5483-5494 (2011).
- Elias, G. M., Elias, L. A., Apostolides, P. F., Kriegstein, A. R., Nicoll, R. A. Differential trafficking of AMPA and NMDA receptors by SAP102 and PSD-95 underlies synapse development. Proc. Natl. Acad. Sci. U.S.A. 105, 20953-20958 (2008).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U.S.A. 104, 1027-1032 (2007).
- Navarro-Quiroga, I., Chittajallu, R., Gallo, V., Haydar, T. F. L. o. n. g. -. t. e. r. m. selective gene expression in developing and adult hippocampal pyramidal neurons using focal in utero electroporation. J. Neurosci. 27, 5007-5011 (2007).
- Nakahira, E., Yuasa, S. Neuronal generation, migration, and differentiation in the mouse hippocampal primoridium as revealed by enhanced green fluorescent protein gene transfer by means of in utero electroporation. J. Comp. Neurol. 483, 329-340 (2005).
- Ramos, R. L., Bai, J., LoTurco, J. J. Heterotopia formation in rat but not mouse neocortex after RNA interference knockdown of DCX. Cereb Cortex. 16, 1323-1331 (2006).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved