La visualización y la manipulación genética de las dendritas y espinas en la corteza cerebral y el hipocampo del ratón usando
En este artículo
Resumen
Este artículo describe en detalle un protocolo para electroporar en el útero de la corteza cerebral y el hipocampo en E14.5 en ratones. También se muestra que este es un método valioso para estudiar las dendritas y espinas en estas dos regiones cerebrales.
Resumen
En la electroporación in utero (IUE) se ha convertido en una poderosa técnica para estudiar el desarrollo de las diferentes regiones del sistema nervioso embrionario 1-5. Hasta la fecha esta herramienta ha sido ampliamente utilizado para estudiar la regulación de la proliferación celular, la diferenciación y la migración neuronal especialmente en el desarrollo de corteza cerebral 6-8. A continuación le detallamos el protocolo para electroporar en el útero de la corteza cerebral y el hipocampo, y aportar pruebas de que este enfoque puede ser usado para estudiar las dendritas y espinas en estas dos regiones cerebrales.
La visualización y la manipulación de las neuronas en cultivos primarios han contribuido a una mejor comprensión de los procesos involucrados en las dendritas, la columna vertebral y el desarrollo de la sinapsis. Sin embargo neuronas de cultivo in vitro no están expuestos a todas las señales fisiológicas que pueden afectar dendrita y / o la formación de la columna vertebral y el mantenimiento durante el desarrollo normal. Nuestro conocimiento de las estructuras dendríticas y la columna vertebral 9. Sin embargo, la tinción de Golgi se considera que es impredecible. De hecho, los grupos de células nerviosas y tractos de fibras están etiquetados al azar, con áreas específicas que suele aparecer manchada por completo mientras que las áreas adyacentes están desprovistos de manchas. Estudios recientes han demostrado que el IUE de las construcciones fluorescentes representa un atractivo método alternativo para estudiar las dendritas, las espinas, así como las sinapsis en los ratones mutantes / de tipo salvaje 10-11 (fig. 1A). Además, en comparación con la generación de agujeros ciegos de ratón, IUE representa una aproximación rápida para realizar la ganancia y la pérdida de estudios de la función de la población específica de las células durante una ventana de tiempo específico. Además, el IUE ha sido utilizado con éxito con la expresión inducible del gen o inducible ARNi se aproxima a refinar el control temporal sobre la expresión de un gen o ARNhc 12. Estas ventajas de la IUE se lo opened nuevas dimensiones para estudiar el efecto de la expresión génica / supresión de las dendritas y espinas, no sólo en estructuras cerebrales específicas (Figura 1B), sino también en un punto de tiempo específico del desarrollo (fig. 1C).
Por último, el IUE es una herramienta útil para identificar las interacciones funcionales entre los genes implicados en las dendritas, la columna vertebral y / o desarrollo de la sinapsis. En efecto, a diferencia de otros métodos de transferencia de genes, como el virus, es fácil de combinar múltiples RNAi o transgenes en la misma población de células.
En resumen, la IUE es un poderoso método que ya ha contribuido a la caracterización de los mecanismos moleculares que subyacen a la función cerebral y la enfermedad y también debería ser útil en el estudio de las dendritas y espinas.
Protocolo
En el Reino Unido, los ratones se encuentran, criados y tratados de acuerdo con las directrices aprobadas por el Ministerio del Interior en el marco del Animal (Procedimientos Científicos) de 1986.
1. Preparación: El ADN de soluciones y Agujas
- Purificar el ADN plásmido con una endotoxina libre de Maxi-prep kit. Preparar una solución de ADN del plásmido para la inyección a las concentraciones deseadas en agua y añadir Fast Green (concentración final de 0,05%) para visualizar las inyecciones. La eficacia de la electroporación es altamente dependiente de la concentración de ADN. Una concentración de 1 mg / l se utiliza generalmente. Esta concentración es suficiente para visualizar las neuronas electroporadas sin afectar su desarrollo. Sin embargo, de acuerdo con el promotor utilizado en el vector de plásmido (bajo nivel de expresión con el promotor de citomegalovirus / potenciador, el nivel de expresión fuerte con el citomegalovirus temprano inmediato potenciador y pollo β-actina de fusión promotor (CAG) promotor), así como el tamaño y el estabilidad de la proteína expresada, esta concentración se puede ajustar (0,25 g / l de 5 g / l).
- Tire las agujas de vidrio utilizando un extractor de micropipeta.
2. Preparación de la cirugía
- Autoclave instrumentos quirúrgicos y solución salina de tampón fosfato (PBS).
- Preparar la solución de analgésico en PBS (buprenorfina, la concentración Vetergesic, final de 30 mg / ml). Pesar el ratón embarazada e inyectar por vía subcutánea 0,1 mg / kg de Vetergesic al menos 30 minutos antes de la cirugía. Durante este tiempo, preparar la zona quirúrgica. Encienda los cojines de la calefacción y la cámara de recuperación. Coloque PBS estéril en un baño de agua caliente y todos los instrumentos y materiales estériles sobre paños estériles. Colocar los electrodos de platino en un vaso lleno de PBS y conectarse a la electroporador. Completa la aguja con la solución de ADN utilizando una punta microloader, conectar la aguja a la titular capilar y pellizcar la punta de la aguja con un fórceps.
- Anestesiar a un ratón embarazada (E14.5-E15.5) con isoflurano en transportador de oxígeno (oxígeno de 2 l / min) con una cámara de inducción de la anestesia. Espere hasta que el animal pierde reflejo de enderezamiento.
- Traslado del animal a un "pre-cirugía" máscara. Ponga una gota de gel para los ojos en cada ojo para evitar ulceración de la córnea de los ojos mientras la madre está bajo anestesia general. Use una rasuradora eléctrica para afeitarse el vello del abdomen. Limpie el área afeitada, una vez con clorhexidina para recoger pelo al viento.
- Transferir el animal a una segunda máscara en la zona quirúrgica. Coloque el ratón con la espalda sobre el cojín eléctrico. Inicio de la cirugía cuando el reflejo de pedal se ha perdido.
- Ponte la máscara y guantes estériles. Cubrir el animal con un campo estéril (con un pequeño agujero en el abdomen) para evitar que los tejidos y los instrumentos de ser contaminado por las áreas de la piel que no han sido afeitadas y desinfectadas. Limpie el área afeitada unal menos 3 veces con clorhexidina. Use un hisopo de algodón estéril diferente cada vez. Utilice un bisturí para realizar una incisión vertical a lo largo de la línea media (aproximadamente 1 pulgada de largo) a través de la piel. Con unas tijeras, hacer una incisión similar del músculo del abdomen a lo largo de la línea alba (línea blanca compuesta principalmente de tejido conectivo de colágeno).
- Elija los embriones más accesibles y colocar las pinzas de anillo entre dos embriones y tire con cuidado la cadena de embriones fuera de la cavidad abdominal. Desde este punto en adelante, mantener los embriones hidratado con estéril pre-calentado PBS.
N microscopio se requiere para la visualización.
4. La inyección de ADN y electroporación
- Comience con uno de los embriones más laterales, por lo que es más fácil seguir la pista de que los embriones fueron electroporated. No tire demasiado de los embriones, ya que esto aumenta el riesgo de hemorragia. Manipular la posición del embrión dentro del saco amniótico mediante las pinzas de anillo yestabilizar la cabeza de los embriones entre los anillos. Apriete suavemente para empujar hacia arriba el embrión más cercano a la pared uterina.
- Con la otra mano, tome el titular capilar e insertar la aguja con cuidado en el centro de la semiesfera para orientar el ventrículo lateral. Presione el pedal para inyectar aproximadamente 1 l de solución de ADN se mezcla con Fast Green (menos de 1 l para estudiar las dendritas). Usted debe observar que el colorante verde de llenado del ventrículo lateral. Los pasos críticos: - La nitidez de la aguja es fundamental para penetrar adecuadamente la pared uterina. Es importante para minimizar el movimiento de la aguja en la superficie de la pared uterina y después de la inserción en el ventrículo porque una ampliación del agujero dará lugar a la fuga de líquido amniótico y la muerte del embrión. Evite los vasos sanguíneos perforantes en la pared uterina, ya que esto dará lugar a la hemorragia y la muerte del embrión.
- Es importante no inyectar un volumen demasiado grande de ADN en el ventrículo lateral porque inducehidrocefalia (no superan el 2 l en E14.5). El volumen de ADN se ajusta de acuerdo con la finalidad del experimento. Si 1μl se utiliza generalmente para la mayoría de los experimentos, un volumen más pequeño de ADN (aproximadamente 0,5 l) se requiere para la dendrita y análisis columna vertebral. De hecho algunas células aisladas tienen que ser dirigidos con el fin de visualizar y medir el árbol dendrítico de las neuronas electroporated. - Colocar los electrodos en los lados de la cabeza embrión con el positivo (+) paleta en el mismo lado que el ventrículo inyectado por electroporación corteza o en el lado opuesto del ventrículo inyectado por electroporación hipocampo (Figura 2). A continuación, aplique cinco pulsos eléctricos 30V (50 ms de duración) a intervalos de 1 seg. Paso fundamental: Evitar la aplicación de corriente a través de la placenta ya que esto puede provocar la muerte del embrión.
Todos los embriones de un ratón embarazada puede ser electroporación, por lo general con el mismo ADN que la construcción para evitar cualquier confusión. Sin embargo, una disminución de la cirugía a largo Cuál es la tasa de supervivencia de los embriones. La cavidad abdominal no se debe abrir más de 30 min.
5. Cirugía Post-electroporación
- Después de electroporación de embriones, añadir PBS en la cavidad abdominal y el uso de las pinzas de anillo para reemplazar el cuerno uterino en su ubicación original. Suturar la pared del abdomen y la piel con suturas absorbibles Vicryl.
- Colocar el animal en una cámara de recuperación hasta que se despierta (min generalmente 5-10) y luego se transfieren en una jaula colocada en una almohadilla térmica.
6. Después de la cirugía
Comprobar el comportamiento de los ratones para evaluar el dolor, sufrimiento o angustia y pesar a los animales 24 horas y 48 horas después de la cirugía. Si es necesario, se pueden administrar analgésicos para minimizar el dolor y las molestias.
7. Procesamiento de tejidos
Recoge los embriones electroporated o crías en las fases embrionarias o postnatal requeridos para el experimento.
ove_content "> - Para el análisis en las etapas embrionarias (por ejemplo, para estudiar la proliferación celular o la migración):La eutanasia de la madre a través de la dislocación cervical y recoger los embriones. Después de la decapitación, seleccionar los cerebros que han sido debidamente electroporadas, como se indica por la cantidad y localización de la señal fluorescente, visualizado a través del cráneo usando un binocular fluorescente. Diseccionar el cerebro fuera del cráneo y corregir durante la noche en PFA al 4% y luego el lugar en el 20% de sacarosa / PBS durante la noche. Insertar en el complejo de octubre, la congelación a -80 ° C y la sección de uso de un criostato.
- Para el análisis en las etapas postnatales (por ejemplo, para estudiar las dendritas y espinas):
Anestesie crías o ratones adultos con inyección intraperitoneal de pentobarbital (40-60 mg / kg) y realizar la perfusión transcardial con PBS, seguido por 4% PFA en PBS. Diseccionar el cerebro fuera del cráneo y después de fijar en PFA 4% durante la noche. Después de lavados en PBS, la sección de los cerebros de un vibrátomo (100 micras para las secciones dendrite análisis). Montar las secciones en Aqua Poli / montaje utilizando cubreobjetos de 0.16-0.19 mm de espesor a las dendritas de imagen y las espinas.
8. Los resultados representativos
La Figura 3 muestra ejemplos de las células electroporated en la corteza cerebral (Figuras 3A, B), en la CA1 (Figuras 3C, D) y en el giro dentado del hipocampo (Figuras 3e, f). Ratones de tipo salvaje se electroporated en E14.5 con una construcción de las buenas prácticas agrarias (PCA-b-EGFPm5 silenciador 3) y los cerebros fueron cosechadas en el día postnatal (P) 14. Mediante la inyección de un pequeño volumen de solución de ADN (0,5 l o menos de una solución al 1 g / l), unas pocas células están etiquetados, que permite la visualización de la arborización dendrítica de aislados GFP + células (Figura 3), así como sus espinas a mayor aumento (Figura 4).
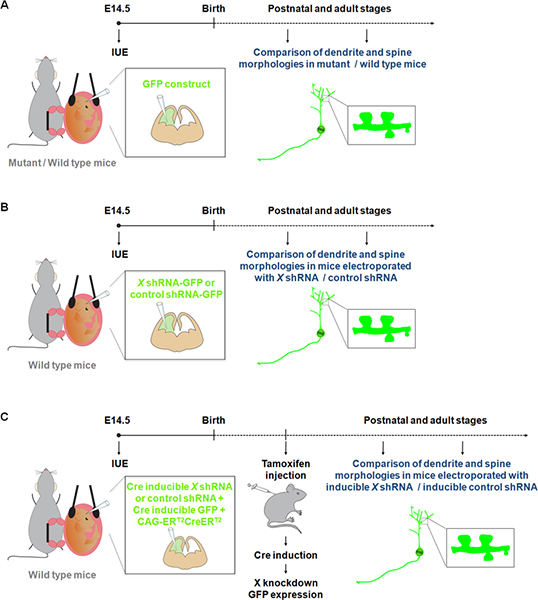
Figura 1. Representación esquemática de los protocolos de electroporación que se pueden utilizar para estudiar las dendritas y espinas. (A) La electroporación de una construcción de las buenas prácticas agrarias para comparar las dendritas y espinas en los ratones de tipo salvaje y mutante. (B) La electroporación de GFP-shRNA (GFP se expresa de la misma construcción) para comparar las dendritas y espinas en los ratones a electroporación con un shRNA construcción específica de un gen de interés (X) o un shRNA control. (C) IUE se puede utilizar junto con un sistema inducible Cre con el fin de restringir la expresión de la ARNhc al período de tiempo conveniente. En este experimento, un vector que expresa una forma de la recombinasa Cre que puede ser activado por 4-hidroxitamoxifeno (CAG-ER T2 CREER T2; 1 g / l) 10, se electroporó junto con un vector que expresa un ARNhc específico en una dependiente Cre manera (1 g / l, y con un indicador de recombinación (CALNL-GFP construir, inducible GFP expresión por Cre;. 1 g / l) 10 El eficienciasCY de la caída puede ser mejorada mediante el aumento de la concentración de la ARNhc así como el aumento CAG-ER T2 CREER concentración T2.
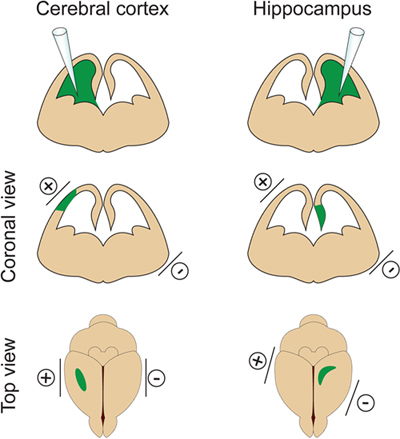
Figura 2. De control espacial de la electroporación. Esta figura muestra dónde colocar los electrodos de paletas de acuerdo con el sitio de la inyección de ADN a fin de orientar la corteza cerebral o el hipocampo.
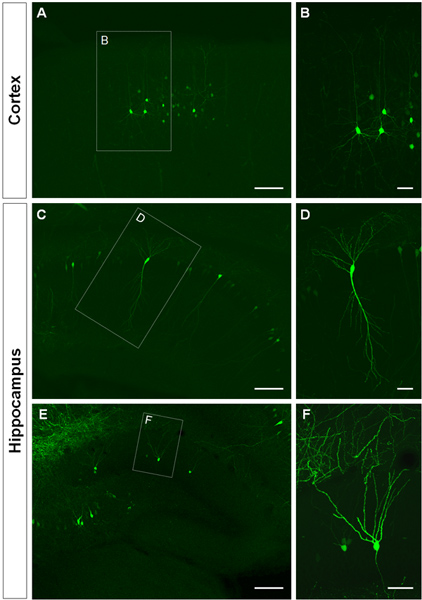
Figura 3. Visualización de la glorieta dendrítica de las células en el útero por electroporación en la corteza cerebral y el hipocampo. (A, B) secciones coronales que muestran las buenas prácticas agrarias + en las células piramidales de la corteza cerebral, (CD) en las células piramidales CA1 del hipocampo y (E, F), las células granulares del giro dentado en P14. Una construcción de las buenas prácticas agrarias (PCA-b-EGFPm5 silenciador 3) se electroporated en E14.5. Las fotos de alta magnificaciónB, D, F) muestran que la IUE es un método eficaz para visualizar las dendritas. Las barras de escala representan 50 micras (B, D y F), 150 micras (A, C, E).
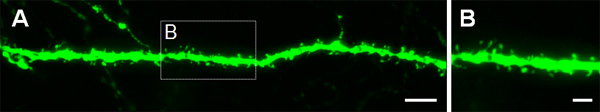
Figura 4. Visualización de las espinas dendríticas en las neuronas que se P14 electroporadas en el útero en E14.5 con las buenas prácticas agrarias que expresa la construcción. (A, B) Las imágenes de alta magnificación de las espinas de las dendritas basales de las neuronas piramidales del hipocampo. Las barras de escala representan 5 micras (A) y 2 micras (B).
Discusión
El IUE es una poderosa herramienta para manipular la expresión génica no sólo en el espacio sino también en el tiempo. Mostramos aquí que esta técnica se puede utilizar para visualizar y manipular genéticamente las dendritas y espinas en la corteza cerebral y el hipocampo de los ratones. Además de las ventajas anteriormente citadas, cabe señalar que el IUE, en contraste con Golgi método, se puede combinar con inmunohistoquímica o hibridación in situ, que permite, por ejemplo al fenotipo de las células electroporadas. También es importante mencionar que este procedimiento no induce malformaciones cerebrales evidentes a pesar de su relativa invasividad. Además, a nivel celular, el IUE no modifica las propiedades electrofisiológicas de las neuronas de la electroporated 13. Mientras que nuestra demostración se centra en la visualización de las morfologías dendríticas y la columna vertebral, el IUE de las neuronas corticales o del hipocampo en E14.5 también podría utilizarse para estudiar otros eventos de desarrollo tales como la formación del axón y la orientación. En añadeition, el mismo tipo de protocolo podría ser implementado en otras etapas del desarrollo embrionario que se dirigen a poblaciones diferentes. Por ejemplo, un paradigma electroporación desarrollo muy tarde cortical en E18.5 se puede realizar para impulsar la expresión en células progenitoras astrocíticos 1. De manera similar, mientras que una electroporación del hipocampo en E14.5 permite orientar CA1-CA3 progenitores neuronas piramidales y progenitoras dentado gránulo celular al mismo tiempo, una electroporación finales del hipocampo (E18.5 o postnatal temprana) permitiría orientar gránulo dentado diferente progenitores 14. En este caso, el volumen inyectado de ADN puede ser aumentado, así como la intensidad de la corriente.
Los transgenes introducidos por el IUE parecen seguir siendo episomal y por lo tanto perdió a partir de células después de sucesivas divisiones celulares. En las células postmitóticas tales como neuronas, sin embargo, los transgenes episomales permanecer activo durante meses después de la electroporación permitiendo estudios a largo plazo 13, 15. En nuestro estudio, hemos observado brillante GFP + células hasta 7 semanas después del nacimiento (el último tiempo hemos analizado) que indican que la orientación de embriones de los precursores neuronales corticales o del hipocampo utilizando los resultados de IUE en la expresión persistente de los transgenes de los primeros puntos en el tiempo de desarrollo hasta a la edad adulta.
Una limitación actual de la técnica es que es difícil de ejercer un control preciso sobre el número total de células electroporadas. Sin embargo, al disminuir el volumen inyectado de solución de ADN, hemos demostrado que es posible marcar unas pocas células y para visualizar la arborización dendrítica de aislados GFP + células, así como sus espinas. La dimensión de la zona transfectadas también podría ser ajustado mediante la modificación de los parámetros de la electroporación, tales como la intensidad de corriente y el número de impulsos o el diámetro de las palas de electroporación.
En total IUE es un método que es fácil de aplicar, rápida yeficiente para el estudio dendritas y espinas en vivo.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Los autores desean agradecer a la Dra. Kathleen Mathers, el Dr. Jean-Philippe Mocho y la Dra. Yolanda Torres Saavedra por su ayuda para llevar a cabo en el útero de la electroporación en los procedimientos de asepsia, y Hayley Wood por su ayuda para preparar los dibujos.
EP fue apoyado por una Federación a largo plazo Europea de Sociedades Bioquímicas (FEBS) y una beca del Medical Research Council (MRC) de becas de desarrollo profesional, TAC por una subvención del Wellcome Trust de Elizabeth Fisher y Tybulewicz Víctor (080174/B/06/Z) , HW por un EMBO becas a largo plazo y RA por una beca de MRC. Este trabajo fue apoyado por una subvención para el proyecto de la Wellcome Trust (086947/Z/08/Z) y por un FG Grant-in-Aid, de la Medical Research Council (U117570528) para
Materiales
| Name | Company | Catalog Number | Comments | |||
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios | |||
| Preparación de las agujas y la solución de ADN para la inyección | ||||||
| Endofree Maxi Kit plásmido | Qiagen | 12362 | ||||
| Fast Green | Sigma | F-7258 | ||||
| Vidrio borosilicato capilares 1,0 mm de diámetro exterior x 0,58 mm ID | Aparato de Harvard | 30-0016 | ||||
| Microloader consejos | Eppendorf | 5242956003 | Para pipetas Eppendorf 0,5 l-10 l / l 2-20 | |||
| & Nbsp; | El material para la cirugía | |||||
| Extra finas tijeras iris | Herramientas de Bellas Ciencia | 14088-10 | ||||
| Pinzas curvas | Herramientas de Bellas Ciencia | 91197-00 | ||||
| Pinzas de anillo | Herramientas de Bellas Ciencia | 11103-09 | ||||
| Portaagujas | Herramientas de Bellas Ciencia | 12002-12 | ||||
| Pinza Graefe | Herramientas de Bellas Ciencia | 11050-10 | ||||
| Sutura absorbible Vicryl | Ethicon Inc (Johnson & Johnson) | W9074 | ||||
| Paños estériles de 30 cm x 45 cm | Buster | 141765 | ||||
| Hisopos estériles | Shermond | Huby-340 | ||||
| Bastoncillos de algodón | Limpieza de la Cruz Co., Ltd | 1860 | ||||
| La buprenorfina (Vetergesic) | Alstoe Sanidad Animal | |||||
| Clorhexidina | Vetasept | XHG007 | ||||
| Viscotears los ojos de gel | Novartis | |||||
| El isoflurano | Abbott Laboratories | B506 | ||||
| Pentoject, Sodio Pentobarbitona 20% | Animalcare | |||||
| La electroporación | ||||||
| Electroporador | BTX | ECM830 | ||||
| Platinum Tweezertrode 5 mm | BTX, Harvard Apparatus | 45-0489 | ||||
| FemtoJet microinyector | Eppendorf | 5247000030 | ||||
| Control de pie durante FemtoJet microinyector | Eppendorf | 5247623002 | ||||
| Titular del capilar | Eppendorf | 5176190002 | ||||
| Procesamiento de tejidos | ||||||
| Paraformaldehído | Sigma | P6148 | ||||
| Sacarosa | VWR (Prolabo) | 27480.294 | ||||
| Portaobjetos | ThermoScientific (Menzel-Glaser) | J1800AMNZ | ||||
| Cubreobjetos | Menzel-Gläser | 22 x 50 mm # 1,5 | ||||
| Agua Poly / montaje | Polysciences, Inc | 18606 | ||||
Referencias
- Kolk, S. M., de Mooij-Malsen, A. J., Martens, G. J. Spatiotemporal Molecular Approach of in utero Electroporation to Functionally Decipher Endophenotypes in Neurodevelopmental Disorders. Front Mol. Neurosci. 4, 37 (2011).
- Saito, T., Nakatsuji, N. Efficient gene transfer into the embryonic mouse brain using in vivo electroporation. Dev. Biol. 240, 237-246 (2001).
- Shimogori, T., Ogawa, M. Gene application with in utero electroporation in mouse embryonic brain. Dev. Growth Differ. 50, 499-506 (2008).
- Tabata, H., Nakajima, K. Efficient in utero gene transfer system to the developing mouse brain using electroporation: visualization of neuronal migration in the developing cortex. Neuroscience. 103, 865-872 (2001).
- Tabata, H., Nakajima, K. Labeling embryonic mouse central nervous system cells by in utero electroporation. Dev. Growth Differ. 50, 507-511 (2008).
- Castro, D. S. A novel function of the proneural factor Ascl1 in progenitor proliferation identified by genome-wide characterization of its targets. Genes Dev. 25, 930-945 (2011).
- Pacary, E. Proneural transcription factors regulate different steps of cortical neuron migration through Rnd-mediated inhibition of RhoA signaling. Neuron. 69, 1069-1084 (2011).
- Marteau, L. Angiopoietin-2 regulates cortical neurogenesis in the developing telencephalon. Cereb Cortex. 21, 1695-1702 (2011).
- Ramon Moliner, E. . Comparative Methods in Neuroanatomy. , (1970).
- Banks, G. T. Behavioral and other phenotypes in a cytoplasmic Dynein light intermediate chain 1 mutant mouse. J. Neurosci. 31, 5483-5494 (2011).
- Elias, G. M., Elias, L. A., Apostolides, P. F., Kriegstein, A. R., Nicoll, R. A. Differential trafficking of AMPA and NMDA receptors by SAP102 and PSD-95 underlies synapse development. Proc. Natl. Acad. Sci. U.S.A. 105, 20953-20958 (2008).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc. Natl. Acad. Sci. U.S.A. 104, 1027-1032 (2007).
- Navarro-Quiroga, I., Chittajallu, R., Gallo, V., Haydar, T. F. L. o. n. g. -. t. e. r. m. selective gene expression in developing and adult hippocampal pyramidal neurons using focal in utero electroporation. J. Neurosci. 27, 5007-5011 (2007).
- Nakahira, E., Yuasa, S. Neuronal generation, migration, and differentiation in the mouse hippocampal primoridium as revealed by enhanced green fluorescent protein gene transfer by means of in utero electroporation. J. Comp. Neurol. 483, 329-340 (2005).
- Ramos, R. L., Bai, J., LoTurco, J. J. Heterotopia formation in rat but not mouse neocortex after RNA interference knockdown of DCX. Cereb Cortex. 16, 1323-1331 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados