Umano camera di flusso neutrofili saggio
In questo articolo
Riepilogo
È riportato un metodo di quantificazione neutrofili. Questo metodo crea un ambiente di flusso dinamico simile a quello riscontrato in un vaso sanguigno. Permette la ricerca di neutrofili adesione a entrambi le molecole purificate di adesione (ligando) o substrato di cellule endoteliali (HUVEC) in un contesto simile all'ambiente in vivo con lo stress puro.
Abstract
Ferma neutrofili alle cellule endoteliali svolge un ruolo critico nel processo infiammatorio sia in salute e malattia. Il processo di adesione dei neutrofili dell'impresa coinvolge molte molecole di adesione tra cui membri della famiglia delle integrine β 2 e le loro contro-recettori della famiglia ICAM. Recentemente, naturalmente varianti genetiche sia β 2 integrine e ICAM sono segnalati per essere associati con la malattia autoimmune. Così, la capacità adesiva quantitativa dei neutrofili da individui con diverse forme alleliche di queste molecole di adesione è importante studiare rispetto a meccanismi alla base dello sviluppo di autoimmunità. Studi adesione a sistemi camera di flusso possono creare un ambiente con sollecitazione di taglio fluido simile a quello osservato nell'ambiente vaso sanguigno in vivo. Qui, presentiamo un metodo che utilizza un sistema di dosaggio camera di flusso per studiare le proprietà adesive quantitativi di neutrofili nel sangue periferico umanos di cellule endoteliali della vena ombelicale umana (HUVEC) e di substrati ligando purificati. Con questo metodo, le capacità adesive neutrofili da donatori con diverse varianti alleliche in recettori di adesione possono essere valutati e confrontati. Questo metodo può anche essere modificato per valutare l'adesione di altri tipi di cellule primarie o linee cellulari.
Introduzione
Varianti genetiche in entrambi i β 2 integrine e ligandi in ICAM ora sono riconosciuti per essere associato con lo sviluppo della malattia autoimmune 1,2. La determinazione delle conseguenze funzionali di queste varianti in cellule derivate da individui con queste varianti è necessario per la nostra comprensione di come queste varianti contribuiscono alla patogenesi della malattia autoimmune. Tali studi funzionali consentono la determinazione dei meccanismi attraverso i quali naturalmente varianti genetiche modellano la risposta immunitaria nella salute e nella malattia. Nell'esempio specifico del LES, ora sappiamo che le varianti in ITGAM (CD11b) e il suo ligando, ICAM-1, fortemente associamo con lo sviluppo della malattia di 1,2. Perché neutrofili sono fondamentali nelle risposte infiammatorie, lo studio quantitativo dei neutrofili può fornire approfondimenti meccanicistici sul modo in cui le varianti genetiche in ITGAM / ICAM alterano l'infiammazione.
NeutropHIL ferma adesione alle cellule endoteliali (EC) è un processo altamente regolato e svolge un ruolo fondamentale nella risposta infiammatoria 3,4. La ferma adesione di neutrofili segue rotolamento dei neutrofili iniziale e la cattura alla CE e, infine, può portare a trasmigrazione in vivo. Questi processi coinvolgono diversi tipi di molecole di adesione, incluse ICAM-1, ICAM-2, P-selectina, E-selectina sulle cellule endoteliali e β 2 integrine sulla neutrofili 5-9. Così, attenta quantificazione dei neutrofili da donatori con diverse varianti alleliche delle molecole di adesione sarà importante per capire le conseguenze funzionali e patologiche di queste varianti genetiche.
Sperimentazione di una camera di flusso in grado di creare un ambiente in vitro con sollecitazione di taglio fluido simile a quello osservato nell'ambiente vaso sanguigno in vivo 10-12. Infatti, un saggio camera di flusso accoppiato con umbili umanacal cellule endoteliali della vena (HUVEC) può simulare l'ambiente in vivo di un vaso sanguigno. Usando questo metodo, si possono studiare le proprietà adesive cellulari complessive verso cellule endoteliali. Inoltre, l'ambiente altamente controllato della camera di flusso consente anche la valutazione della cella legame ai ligandi adesione purificate come ICAM-1 per facilitare lo studio di interazioni recettore-ligando specifico.
Vi presentiamo qui un metodo che utilizza un sistema di test di adesione camera di flusso per studiare le proprietà adesive dei neutrofili nel sangue periferico umano di HUVEC e ai substrati ligando purificati. Utilizzando questo metodo con cellule di donatori che esprimono diverse varianti alleliche molecola di adesione ci permette di valutare come queste varianti genetiche possono alterare impresa neutrofili umana adesione.
Protocollo
Tutti i donatori reclutati per questo studio hanno dato il consenso informato scritto e lo studio è stato approvato dalla University of Alabama a Birmingham Institutional Review Board.
1. HUVEC Cultura iniziale e Subculture
- La cultura umana vena ombelicale cellule endoteliali (HUVEC) in vitro in terreno di crescita completo che si compone di cellule endoteliali medio basale (vedere elenco dei materiali) supplementato con fattori di crescita delle cellule endoteliali.
Nota: I fattori di crescita utilizzati in questo studio sono: 5 ng / ml ricombinante umano Epidermal Growth Factor (hEGF), 1,0 mg / ml di idrocortisone, 50 mg / ml di gentamicina e 50 ng / ml di amfotericina B-(GA-1000), 2 % siero fetale bovino (FBS), 0,5 ng / ml Vascular Endothelial Growth Factor (VEGF), crescita dei fibroblasti fattore-base con eparina (hFGF-B), Fattore 10 ng / ml umano 20 ng / ml ricombinante umano Insulin-like Growth ( R 3-IGF-1), 1 mg / ml di acido ascorbico, e 22,5 mg / ml di eparina. Il terreno completoviene preparato inizialmente a 37 ° C e poi può essere conservato a 4 ° C per l'uso entro 1 mese di preparazione. - Per preparare un pallone di cellule, terreno di coltura completo viene aggiunto a un pallone di coltura tissutale 75 centimetri 2 (1 ml / 5 cm 2) e quindi il pallone viene lasciato equilibrare a 37 ° C / 5% di CO 2 in un incubatore umidificato per almeno 30 min. HUVEC umana saranno seminate direttamente nella stessa beuta cultura equilibrata ad una densità di 2.500-5.000 cellule / cm 2.
- Mentre i media si equilibrante, scongelare rapidamente il esageratamente magazzino HUVEC in un bagno d'acqua a 37 ° C. Disperdere le cellule nel flaconcino archiviazione originale vortex e poi aggiungere direttamente nel pallone di coltura contenente il terreno di coltura completo pre-equilibrata HUVEC a raggiungere una densità di 2.500-5.000 cellule / cm 2. Agitare delicatamente il pallone per distribuire uniformemente le cellule e quindi restituire il pallone al incubatrice. Queste cellule rappresentano oggi il passaggio 1 °.
- Piano dovrebbe essere cambiato ogni due giorni fino a quando le cellule sono 70-80% confluenti.
- Il HUVECs ora può essere raccolto dal pallone di coltura con tripsina / EDTA. Il mezzo di coltura viene aspirato dai palloni di coltura seguita da un risciacquo PBS per rimuovere eventuali residui di proteine e calcio dalle cellule. Un 0,25% soluzione di tripsina-EDTA viene aggiunto ed entro 2-6 minuti il distacco delle cellule dovrebbe essere evidente come valutato mediante microscopia ottica.
- Quando il 90% delle cellule sono arrotondati dal piatto, fermare la tripsinizzazione aggiungendo un volume uguale di inibitore della tripsina 2x. Per facilitare la raccolta di cellule, aggiungere un'altra uguale quantità di terreno di coltura completo. Trasferire le cellule staccate a una sterile provetta da centrifuga da 15 ml.
- Centrifugare le cellule staccate a 225 xg per 5 min a temperatura ambiente. Aspirare il surnatante e quindi risospendere le cellule in 2-3 ml di terreno di coltura completo. Determinare la concentrazione e la vitalità cellulare utilizzando un emocitometro e Trypan Blue.
- Per utilizzare the raccolte le cellule di studio, ri-seme di ulteriori 75 centimetri 2 palloni con cellule ad una densità di 10.000 cellule / cm 2 e passare al punto 2.2. In alternativa, le cellule possono essere congelate a questo punto per studi futuri. Per il congelamento delle cellule, agglomerare le cellule per centrifugazione a 225 xg per 5 min a temperatura ambiente. Aspirare il sopranatante e risospendere il pellet di cellule in FBS contenente 10% DMSO ad una concentrazione di 1 x 10 6 cellule / ml. La sospensione cellulare viene quindi trasferito cryovials e conservato a -80 ° C dopo il congelamento delle cellule in un contenitore cella di congelamento.
2. Preparazione HUVEC Strato
- L'uso di surgelati HUVECs passaggio 2 °: rinascita e della cultura. Se si utilizza cellule in attiva crescita, passare al punto 2.2.
- Scongelare il esageratamente contenente 2 HUVECs passaggio ° dal punto 1.8 rapidamente in un bagno d'acqua a 37 ° C. Trasferire le cellule dal esageratamente a 15 ml tubo da centrifuga sterile e aggiungere 10 ml di crescita medium.
- Centrifugare le cellule a 200 xg per 5 min a temperatura ambiente e aspirare il surnatante per rimuovere il DMSO residuo.
- Risospendere il pellet di cellule con mezzo di crescita completo e trasferire le cellule in un pallone da 75 centimetri 2. Aggiungere mezzo di crescita per un volume totale di circa 20-25 ml ed incubare a 37 ° C / 5% di CO 2.
- Esaminare visivamente la coltura cellulare per confluenza ogni giorno con materiale varia ogni due giorni. Di solito entro 2-4 giorni, le cellule raggiungeranno 80-90% di confluenza momento in cui saranno pronti per l'uso nel saggio camera di flusso.
- Per preparare il piatto di coltura che verrà utilizzato nella camera di flusso (vedere Sezione 5), aggiungere 1 ml di 10 mg / ml di fibronectina e 0,05% (w / v) di gelatina in una piastra di coltura tissutale a 35 mm e pipetta diverse volte per assicurarsi che l'intera superficie della piastra è rivestita. Rimuovere la fibronectina e gelatina soluzione eccessivo e asciugare la piastra per almeno 30 min per ottimizzare la formazione della matrice proteica. Il fibronectin e la gelatina soluzione può essere riutilizzato fino a 10x.
- Raccogliere le cellule HUVEC dal punto 2.2 utilizzando tripsina-EDTA come descritto nei passaggi 1,5-1,7. Seed 500.000 celle in ogni piatto di coltura di tessuti spalmati. Aggiungere 2 ml di mezzo di crescita in ogni piatto e incubare a 37 ° C / 5% di CO 2.
- Consentono alle cellule di crescere a confluenza come al punto 2.2. Le cellule devono essere ispezionati visivamente tutti i giorni con i cambiamenti di media ogni due giorni. Prima del saggio camera di flusso, il primo HUVEC con 20 ng / ml di TNF-α umano per 4-6 ore a upregulate e stimolare adesione espressione molecola.
3. Purificata Ligand Coating
- Disegnare un cerchio di 0,5 cm di diametro con un pennarello o penna al centro di un piatto di coltura tissutale da 35 mm.
- Piastre 20 ml di 20 mg / ml di proteina A nella zona segnata. Utilizzare la punta della pipetta per diffondere la proteina Una soluzione per coprire l'intera area all'interno del cerchio di diametro 0,5 centimetri. È importante non toccare o graffiare la superficie del dish. Incubare a 37 ° C per 1 ora.
- Lavare le proteine-A 3x piastra ricoperta con 1 ml di PBS (pH 8.0).
- Tavola 50 microlitri 1% BSA nella zona indicata per bloccare un legame non specifico sulla piastra. Incubare per 2 ore a 4 ° C.
- Lavare le piastre 3x bloccati con 1 ml di PBS come nella fase 3.3.
- Preparare i Fc-adesione recettore ligando soluzioni di proteine chimeriche per il rivestimento. In questo esperimento, una soluzione ICAM-1/Fc chimera a 25 ug / ml e un P-Selectin/Fc chimera a 0.5 mg / ml in PBS (pH 8,0) è stato utilizzato.
- Cappotto l'area contrassegnata con 50 ml di substrato. Incubare una notte a 4 ° C. Il piatto deve essere utilizzato entro due giorni e la zona rivestita non dovrebbe essere permesso di asciugare. Aggiungere PBS se necessario, per mantenere la soluzione 50 microlitri sulla piastra.
4. Separazione dei neutrofili (Tutti i passi eseguiti a temperatura ambiente)
- Dopo aver ottenuto il consenso informato, raccogliere il sangue partecipante da salasso in unn anticoagulante tubo di raccolta sangue o vacutainer (EDTA o eparina). Dopo la raccolta del sangue, diluire il sangue 1:1 con PBS prima della separazione.
- Preparare uno strato di due Ficoll per separare PBMC e neutrofili in 50 ml provette da centrifuga. Primo aggiungere 15 ml di Ficoll pesante (vedere elenco dei materiali, ρ = 1,118-1,120), e poi strato cura 10 ml luce Ficoll (vedere elenco dei materiali, ρ = 1,077-1,080) sulla parte superiore del pesante Ficoll. Ci dovrebbe essere un netto confine tra Ficoll luce e strati Ficoll pesanti. Infine, sovrapporre accuratamente 25 ml del campione di sangue diluito in cima al Ficoll luce senza disturbare lo strato di Ficoll.
- Centrifugare la provetta a 250 xg per 30 min a temperatura ambiente. Nota: Il freno rotore della centrifuga deve essere spento per questi giri per minimizzare potenziali perturbazioni della separazione cellulare durante rotore decelerazione al termine della centrifugazione. Dopo la centrifugazione, i seguenti strati (dall'alto al basso) sono presenti: lo strato superiore è il Follo plasmawed dallo strato PBMC sulla parte superiore dello strato Ficoll luce, lo strato neutrofili con pochi globuli rossi (RBC) è tra la luce e pesante Ficoll seguita dal livello Ficoll pesante e globuli rossi nella parte inferiore del tubo.
- Raccolto e trasferire lo strato neutrofili in un nuovo tubo 50 ml con una pipetta di trasferimento, aggiungere PBS ad un volume finale di 50 ml e centrifugare a 225 xg per 10 min a temperatura ambiente.
- Dopo la centrifugazione, ci possono essere ancora globuli rossi mescolati con i neutrofili. Aspirare il surnatante verso il basso fino alla tacca 10 ml. Risospendere il pellet neutrofilo-RBC da lieve agitazione del tubo (o una breve vortex a bassa velocità) e poi lavare nuovamente con 50 ml di PBS.
- Dopo il secondo lavaggio, aspirare il supernatante. Per rimuovere i globuli rossi contaminanti, risospendere le cellule pellet nel residuo PBS mediante agitazione (o corto vortex), aggiungere 25 ml di H 2 O e vortex delicatamente per 10 secondi per la lisi RBC.
- Aggiungere 25 ml di 1.8% NaCl e mescolare subitomediante centrifugazione a 225 xg per 10 min a temperatura ambiente. La RBC contaminanti dovrebbe essere lisato lasciando un bianco pellet di cellule neutrofili.
- Lavare il pellet di cellule neutrofili con PBS.
- Risospendere le neutrofili isolate in mezzo RPMI con 10% FBS e determinare la concentrazione cellulare al microscopio luce con un emocitometro.
- Regolare la densità cellulare a 500.000 cellule / ml con completo RPMI-10% FBS medie.
5. Flusso Camera Adesione saggio
- Montare la camera di flusso. Posizionare il piatto 35 millimetri contenente le HUVEC confluenti o ligandi del recettore adesione purificate sul tavolo microscopio. Collegare la camera di flusso piastra parallelo con pompa a siringa, sistema di aspirazione e lasciare una linea aperta per l'ingresso dei neutrofili. Inserire la camera di flusso sulla parte superiore della piastra e fissare il gruppo di camera di flusso 13. (Vedi figura 1)
- Avviare il programma di registrazione video sul computer collegato to il microscopio. Regolare il campo e messa a fuoco del microscopio fino a quando un campo libero con le cellule HUVEC completamente sviluppati o in un campo all'interno della regione di rivestimento ligando è visibile.
- Utilizzando la pompa a siringa, sciacquare la camera di flusso con RPMI. Assicurarsi che non vi siano bolle d'aria all'interno della camera o la linea di ingresso dei neutrofili.
- Se lo si desidera, i neutrofili possono essere trattate con basse dosi (10 -8 M) fMLP per 10 min. Questo consentirà una corrispondenza del livello basale di attivazione dei neutrofili tra diversi donatori 14.
- Utilizzare la pompa a siringa per iniettare i neutrofili nella camera di flusso a velocità definite (una velocità di 350 ml / min, il che equivale a una sollecitazione di taglio di 1,5 dyne / cm 2 è usato in questo studio). Registrare il video. Poiché neutrofili può avvenire rapidamente, un video con una lunghezza di 4-5 min è generalmente sufficiente per quantificare gli eventi di adesione per l'analisi.
- Una cella aderente è definita come una cellula che si muove meno del diametro di cellaentro 5 secondi sul HUVEC o ligando superficie rivestita 15,16. Contare il numero totale di cellule aderenti nel campo presente nel video registrato utilizzando questa regola. Con la registrazione di video di lunghezza simili con neutrofili diversi donatori, si può calcolare l'aderente cellule / min per confrontare le proprietà di adesione tra i diversi donatori.
Risultati
Esempi di neutrofili legame di un ligando purificato (ICAM-1/P-Selectin) camera di flusso rivestito (Figura 2) o di legarsi ad un HUVEC rivestite saggio camera di flusso (figura 3) neutrofili sono mostrati. Come mostrato nelle figure, neutrofili continuano ad accumularsi / aderire alla superficie rivestita o HUVEC in condizioni di flusso continuo. Nelle nostre condizioni sperimentali tipiche, possiamo osservare 50-70 neutrofili umani saldamente aderenti alla superficie rivestita o HUVEC durante un periodo di registrazione di quattro minuti. Tuttavia, le varianti alleliche delle molecole di adesione dei neutrofili, o le varianti alleliche del substrato (ligando purificato o HUVEC), potrebbero alterare sostanzialmente quantitativa neutrofili 14.
Abbiamo anche valutato la dipendenza temporale degli eventi di adesione dei neutrofili osservati nei nostri studi. Mentre stiamo mantenendo condizioni di flusso costante, è possibile che le proprietà adesive delle cellule cambiano nel tempo. Huttavia, negli relativamente brevi corsi di tempo nei nostri studi, non osserviamo differenze consistenti nel tasso di adesione nel corso del tempo. Ad esempio, valutare l'adesione ai 1-2 punti temporali minuti rispetto alla adesione osservata tra i 3-4 numero minimo di punti di tempo non sono sempre diversi. Naturalmente, se le cellule vengono stimolate durante l'esperimento adesione, poi cambiamenti nelle proprietà adesive nel tempo si poteva aspettare.
Nei nostri studi, abbiamo controllato per isolare l'attivazione dei neutrofili indotta intenzionalmente priming delle cellule con una bassa dose di fMLP (10 -8 M) per 10 minuti prima dell'inizio dello studio. Le cellule endoteliali (HUVEC nei nostri studi) richiedono l'attivazione prima di aumentare l'espressione delle molecole di adesione per una ottimale ferma adesione dei leucociti. In assenza di pre-trattamento, le cellule endoteliali (HUVEC) sosterranno pochissimo adesione dei neutrofili. Nei nostri studi, abbiamo usato 10 ng / ml trattamento TNFa per 4-6 ore prima dell'uso. IL-1β (10 ng / ml) e LPS (0,5-1 mg / ml) può essere usato per pre-attivare le cellule endoteliali. Importante, greggia HUVEC può essere utilizzato come controllo negativo per garantire che l'adesione delle cellule è causata da specifiche interazioni cellulari neutrofili-endoteliale (recettore-mediata). In alternativa, anticorpi anti-recettore possono essere usati per bloccare i recettori specifici per valutare la specificità di aderenza.
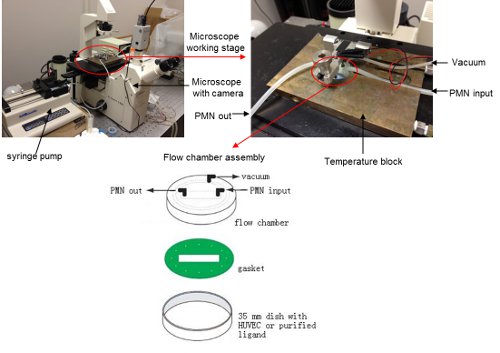
Figura 1. Configurazione della camera di flusso sul palco microscopio. Cliccare qui per vedere una versione più grande di questa figura.
oad/51410/51410fig2.jpg "/>
Scatti Figura 2 schermo da un video di esempio di neutrofili che aderiscono alla ICAM-1/P-Selectin superficie rivestita in diversi momenti (A:. 0 punto di tempo, B: 1 punto min Tempo, C: 2 punti min di tempo, e D: 4 min punto di tempo). La concentrazione di ICAM-1 è 25 mg / ml e P-selectina è di 0,5 mg / ml. Velocità del flusso dei neutrofili è di 350 ml / min, con densità di neutrofili a 500.000 cellule / ml.
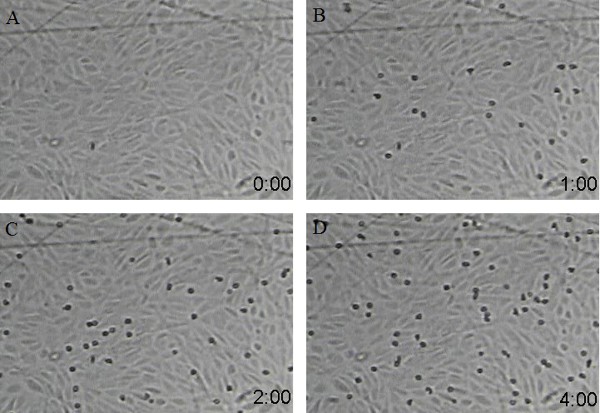
Figura 3 colpi di schermo da un video di esempio di neutrofili che aderiscono alla superficie HUVEC rivestita in diversi momenti (A: 0 punti di tempo, B: 1 min punto di tempo, C: 2 punti di min di tempo, e D: 4 min punto di tempo)..Velocità del flusso dei neutrofili è di 350 ml / ml con densità neutrofili 500.000 cellule / ml.
| Specie | Posizione | Shear stress (dyne / cm 2) |
| Umano | Arteria caroid Comune | 11.6 |
| Umano | Dell'arteria branchiale | 6.5 |
| Umano | Arteria femorale comune | 4.3 |
| Umano | Aorta surrenale | 7.3 |
| Umano | Aorta Supraceliac | 4.2 |
| Umano | Superficiale arteria fermoral | 4.4 |
| Umano | Venule | 0,5-5,0 |
| Umano | Retina prima arteriole | 40.2 |
| Umano | Secondo arteriole della retina | 0.001 |
| Umano | Retina prima venule | 23.2 |
| Umano | Secondo venule retiniche | 0.43 |
| Cane | Arteria caroid Comune | 15.8 |
| Coniglio | Arteria caroid Comune | 23.3 |
| Ratto | Arteria caroid Comune | 46.6 |
| Mouse | Arteria caroid Comune | 64.8 |
| Cane | Arteria femorale comune | 9.8 |
| Coniglio | Arteria femorale comune | 156.8 |
| Ratto | Arteria femorale comune | 65.9 |
Tabella 1. Esempio di shear stress nei diversi organi e specie diverse.
* Riassunte dai riferimenti 13, 16, 19, e 20.
Discussione
Questo protocollo guida la separazione e l'isolamento dei neutrofili minimamente attivati per l'accurata quantificazione di neutrofili in condizioni di stress puro. Neutrofili è un processo critico nell'infiammazione. Poiché varianti genetiche in molecole multiple di questo processo hanno dimostrato di predisporre allo sviluppo della malattia autoimmune 1,2, è necessario un sistema di test in grado di valutare quantitativamente ditta neutrofili umani adesione. Il metodo descritto in questo protocollo consente la determinazione accurata e quantitativa del potenziale adesivo compatto di neutrofili in un ambiente controllato in vitro sotto stress pura. Questo metodo consente quindi il confronto diretto di adesione dei neutrofili quantitativa tra individui genotipizzati per determinare l'importanza della variazione genetica in molecole di adesione 14.
Diversi passaggi di questo metodo meritano attenta considerazione per ragRisultati e altamente quantitativi e riproducibili. Nella preparazione HUVEC, è fondamentale per raggiungere il 100% di confluenza cella prima di utilizzarle nella camera di flusso. Per l'utilizzo di superfici rivestite con ligando purificato, l'area di rivestimento substrato deve mai essere lasciata asciugare per evitare la denaturazione del legante. Inoltre, la preparazione dei neutrofili umani è fondamentale per il successo dell'esperimento. Questioni chiave isolare neutrofili dal sangue includere manipolazione delicatamente minimizzando vortex per evitare l'attivazione, mantenendo le cellule a temperatura ambiente (cioè il sangue non dovrebbe essere memorizzato su ghiaccio e centrifugazione procedura deve essere eseguita a temperatura ambiente) e completando l'isolamento e l'esperimento nel minor tempo possibile. Ci sono altri metodi di isolamento dei neutrofili che possono anche essere utilizzati per preparare le cellule per questi saggi 17,18.
Da un punto di vista pratico saggi, di adesione con appena isolate neutrofili umani deve essere iniziato entro 3-6 ore dopo partecipante salasso. Come neutrofili sono estremamente sensibili alla manipolazione, tempi prolungati tra il prelievo di sangue e il loro utilizzo potrebbe influenzare i risultati del test. Determinazione accurata di concentrazione cellulare neutrofili prima del test camera di flusso è anche necessario per ottenere risultati accurati e riproducibili.
Durante il test camera di flusso, è importante monitorare attentamente la registrazione video per garantire che la velocità di flusso è costante e non c'è turbolenza per tutta la durata dell'esperimento. Le variazioni di velocità di flusso o la presenza di turbolenze richiedano che l'esperimento ripetuto. Dopo l'esperimento, è anche importante valutare le rimanenti neutrofili microscopicamente per garantire che i neutrofili non sono grumi. Aggregazione a questo punto indicherebbe che i neutrofili sono diventati attivato che potrebbero alterare significativamente la densità neutrofili durante l'esperimento.
contenuto "> La camera di flusso crea una tensione in prossimità omogenea pura all'interno della camera (τ = 6Qμ / (wh 2), dove Q = portata, μ = viscosità dinamica, e w = larghezza della camera di flusso, h = altezza del flusso camera 15). Nei nostri studi, abbiamo utilizzato una portata di 350 ml / min per neutrofili, che crea uno stress pura di 1,5 dyne / cm 2 (w = 0.25 cm, h = 0,01 pollici, la viscosità dell'acqua a 37 ° C (0,007 poise) è stato utilizzato come approssimazione della viscosità RMPI media). Per una camera di flusso specifico, si può modificare la portata per ottenere diversi livelli di stress pura per simulare diverse condizioni fisiologiche. Tipica shear stress fisiologico in vasi sanguigni umani possono intervalli tra 0.5-5.0 dyne / cm 13,16. sollecitazioni di taglio in altri vasi sanguigni e altri animali sono stati elencati nella Tabella 1 113,16,19 20.Mentre il nostro metodo si è concentrato sullo studio dell'adesione delle neutrophi umanals, questo metodo non è limitato a neutrofili e può essere facilmente applicato ad adesione o studi rotolamento di altri tipi di cellule con semplici modifiche. Inoltre, i substrati di questo metodo possono essere modificati per scopi diversi.
Sebbene questo protocollo è facilmente adattabile a diversi studi, ci sono alcune limitazioni. Il protocollo attuato qui richiede grande numero di cellule primarie per l'analisi. Questo può precludere l'analisi di pile di piccoli animali. Inoltre, la necessità di immobilizzare ligandi adesione purificati in una conformazione attiva / disponibili possono limitare la gamma di ligandi. L'uso delle proteine di fusione Fc-migliora notevolmente le possibilità di ottenere una corretta conformazione ligando sulla superficie della lastra. Tuttavia, il metodo ha una notevole flessibilità per consentire l'analisi quantitativa di eventi di adesione. Questi studi permettono di migliorare notevolmente la nostra comprensione di coppie recettore-ligando adesione, e l'importanza potenziale funzione di varianti genetichein queste proteine, nella patogenesi di malattie umane.
Divulgazioni
Gli autori non hanno nulla da rivelare.
Riconoscimenti
Questo lavoro è sponsorizzato dal Lupus Research Institute (NY, NY), NIH P01-AR49084, NIH R21-DA026956 e NIH UL1-TR00165. Ringraziamo il Dott. Robert P. Kimberly per il suo continuo sostegno.
Materiali
| Name | Company | Catalog Number | Comments |
| Table of Reagents Materials | |||
| Name of reagent | Company | Catalogue number | Comments |
| 0.25% Trypsin/EDTA | Life technologies | 25200-056 | with Phenol Red |
| 2X Trypsin inhibitor | Life technologies | R-002-100 | |
| 35mm tissue culture dish | Corning Inc. | 430165 | Standard Tissue Culture Treated Surface |
| 75cm2 tissue culture flask | Corning Inc. | 430641 | Standard Tissue Culture Treated Surface |
| CCD camera | Dage-MTI | Model 300T-RC | |
| Cell freezing container | Biocision | BCS-045 | |
| EBM-2 | Lonza Inc. | CC-3156 | HUVEC growth basal medium |
| EGM-2 Bulletkit | Lonza Inc | CC-4176 | HUVEC growth factors for basal medium |
| FBS | Life technologies | 10082-147 | Certified, Heat Inactivated |
| Gelatin | Sigma | G9391 | from bovine skin |
| Hemacytometer | Fisher scientific | 02-671-51B | |
| Fibronectin | Sigma | F2006 | from human plasma |
| Flow chamber | Glyco Tech | 31-001 | Circular flow chamber for 35mm dishes |
| fMLP | Sigma | 47729 | |
| Histopaque-11191 | Sigma | 11191 | Heavy ficoll |
| HUVEC | Lonza Inc. | CC-2517A | |
| ICAM-1 | R&D systems | 720-IC | Fc chimera |
| Lymphocyte separation medium | Mediatech Inc. | 25072CV | Light ficoll |
| Microscope | Zeiss | Axiovert 100 | |
| RPMI 1640 medium | Life technologies | 11875 | with L-Glutamine and Phenol Red |
| Protein A | Sigma | P6031 | resuspend in PBS |
| P-Selectin | R&D systems | 137-PS | Fc chimera |
| Syringe pump | KD Scientific | KDS270 | |
| TNF-a | Life technologies | PHC3015 | Recombinant Human Protein |
| Trypan Blue Solution, 0.4% | Life technologies | 15250-061 | |
Riferimenti
- Harley, J. B., et al. Genome-wide association scan in women with systemic lupus erythematosus identifies susceptibility variants. in ITGAM, PXK, KIAA1542 and other. 40, 204-210 (2008).
- Kim, K., et al. Variation in the ICAM1-ICAM4-ICAM5 Locus Is Associated with Systemic Lupus Erythematosus Susceptibility in Multiple Ancestry Populations. Ann. Rheum. Diseases. 71 (11), 1809-1814 (2012).
- Ley, K. Molecular mechanism of leukocyte recruitment in the inflammatory process. Cardiovasc. Res. 32 (4), 733-742 (1996).
- Korthuls, R. J., Anderson, D. C., Granger, D. N. Role of neutrophil-endothelial cell adhesion in inflammatory disorders. J. Crit. Care. 9 (1), 47-71 (1994).
- Albelda, S. M., Smith, C. W., Ward, P. A. Adhesion molecules and inflammatory injury. FASEB J. 8 (8), 504-512 (1994).
- Smith, C. W., Marlin, S. D., Rothlein, R., Toman, C., Anderson, D. C. Cooperative interactions of LFA-1 and Mac-1 with intercellular adhesion molecule-1 in facilitating adherence and transendothelial migration of human neutrophils in vitro. J. Clin. Invest. 83 (6), 2008-2017 (1989).
- Marlin, S. D., Springer, T. A. Purified intercellular adhesion molecule-1 (ICAM-1) is a ligand for lymphocyte function-associated antigen. Cell. 51 (5), 813-819 (1987).
- Lawrence, M. B., Springer, T. A. Leukocytes roll on a selectin at physiologic flow rates: Distinction from and prerequisite for adhesion through integrins. Cell. 65 (5), 859-873 (1991).
- Smith, C. W. Possible steps involved in the transition to stationary adhesion of rolling neutrophils: A brief review. Microcirculation. 7, 385-394 (2000).
- Usami, S., Chen, H. H., Zhao, Y., Chien, S., Skalak, R. Design and construction of a linear shear stress flow chamber. Ann. Biomed. Eng. 21 (1), 77-83 (1993).
- van Kooten, T. G., Schakenraad, J. M., Vander Mei, H. C., Busscher, H. J. Development and use of a parallel-plate flow chamber for studying cellular adhesion to solid surfaces. J. Biomed. Mater. Res. 26 (6), 725-738 (1992).
- Munn, L. L., Melder, R. J., Jain, R. K. Analysis of cell flow in the parallel plate flow chamber: Implications for cell capture studies. Biophys. J. 67, 889-895 (1994).
- Kucik, D. F. Measurement of Adhesion Under Flow Conditions. Current Protocols in Cell Biology. , 9.6.1-9.6.10 (2003).
- Zhou, Y., et al. Multiple Lupus Associated ITGAM Variants Alter Mac-1 Function on Neutrophils. Arthritis. Rheum. , (2013).
- Bacabac, R. G., et al. Dynamic shear stress in parallel-plate flow chambers. J. Biomech. 38 (1), 159-167 (2005).
- Kucik, D. F., Wu, C. . Cell-Adhesion Assay. Methods in Molecular Biology. 294, 43-54 (2005).
- Brinkmann, V., Laube, B., Abu Abed, ., Goosmann, U., C, A., Zychlinsky, Neutrophil extracellular traps: how to generate and visualize them. J Vis Exp. 36 (36), (2010).
- Oh, H., Siano, B., Diamond, S. Neutrophil isolation protocol. J Vis Exp. (17), 745 (2008).
- Cheng, C., et al. Large variations in absolute wall shear stress levels within one species and between species. Atherosclerosis. 195 (2), 225-235 (2007).
- Nagaoka, T., Yoshida, A. Noninvasive evaluation of wall shear stress on retinal microcirculation in humans. Invest Ophthalmol Vis Sci. 47 (3), 1113-1119 (2006).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon