用优化的n-甲基 d-葡乙胺保护恢复法制备急性脑切片
摘要
该协议演示了一种优化的N-甲基 D-葡乙胺 (NMDG) 脑切片制备保护恢复方法的实现。一个单一的媒体配方是用来可靠地获得健康的脑切片从动物的任何年龄和不同的实验应用。
摘要
本协议是对脑切片制备的n-甲基 d-葡乙胺 (NMDG) 保护恢复方法的实用指南。最近的许多研究证实了这种方法对增强神经元保存和整体脑切片生存能力的效用。早期使用者的这种技术的实施, 促进了对大脑功能的详细调查, 利用不同的实验应用和跨越广泛的动物年龄, 大脑区域和细胞类型。介绍了采用优化的 NMDG 人工脑脊液 (aCSF) 培养基配方和强化程序, 以可靠地获得用于膜片钳电生理学的健康脑切片的保护恢复脑切片技术的步骤。采用这种更新的方法, 在目标膜片钳记录实验中 gigaohm 密封形成的速度和可靠性有了显著的改善, 同时保持了优良的神经保护, 从而促进了挑战性实验应用。从多神经元膜片钳记录实验中获得了代表性的结果, 以检测年轻的成年转基因小鼠和成熟的成人神经外科标本皮层脑切片的突触连通性。此外, 优化的脑切片 NMDG 保护恢复方法与青少年和成年动物是相容的, 从而解决了原有方法的局限性。总之, 一个单一的媒体配方和脑切片程序可以在不同的物种和年龄实施, 以达到良好的生存能力和组织保存。
引言
急性脑切片制备是神经科学中必不可少的实验模型系统。大约半个世纪以来, 这个平台已经使整个大脑的大脑区域和动物物种有了动态的功能研究。无论预期的应用是生物化学, 功能成像, 形态学, 或电生理学, 这是至关重要的, 以确保最佳的完整性和可行性的切片组织。正是由于这个原因, 高韧性的幼鼠脑切片制剂 (即, 年轻比产后30的小鼠) 一直是迄今为止最喜欢的。从成熟的成年和衰老的动物获得足够健康的脑切片的困难已经被证明是一个巨大的挑战, 对研究成熟大脑的功能结构已经施加了严重的限制。这对于膜片钳记录来说尤其如此, 这项技术需要良好的形态学和功能保护, 并且对于确定单个神经元的详细的内在和突触特性是必不可少的。在过去的几十年中, 绝大多数的补丁钳 electrophysiologists 依赖于一种 "保护切割" 方法, 使用蔗糖取代低 Na+ aCSF1 , 以制备健康的脑切片从青少年, 并在一个远小于程度上, 年轻的成年动物。这种方法的前提是, 被动 Na+流入和随后的水进入和切片切割步骤中的细胞肿胀是主要的侮辱, 导致神经元的生存不佳, 特别是那些神经元位于表面层, 最有可能维持直接外伤的刀片运动。然而, 对于成熟成年动物的脑切片制备方法, 无论采用何种特殊的 aCSF 配方, 保护切割法仍有很大的需要。
此问题的一个简单但有效的解决方案已被描述为2、3、4、5、6并称为 "保护恢复" 脑切片方法。该方法的原版本使用 NMDG 取代 aCSF, 因为 NMDG 被认为是最多才多艺和有效的各种其他候选钠离子替代品 (包括蔗糖, 甘油, 胆碱, 和三)。通过添加 HEPES 来抵抗脑切片水肿并提供更强的 pH 缓冲7, 以及添加补充剂以抵消氧化应激的有害影响 (表 1), 进一步增强了培养基的配方。经经验确定, 在成人脑组织切片后, 在低 Na+、低 Ca2 +和高镁2 + NMDG aCSF 的初期恢复孵化步骤是必要的, 并且足以改善神经元保存在广泛的脑区域、细胞类型和动物年龄3,5,6。
值得注意的是, 现在被称为保护恢复方法的早期化身可以在文献1,8,9,10,11,12,13, 虽然这些早期的作品中未识别或显示成熟成人和衰老动物脑切片和补丁钳记录的全部潜能。此外, 有细微差别的程序变化继续出现, 支持特定的实验应用4,14,15,16。这些众多研究小组的集体工作对保护恢复方法的健壮性给予了高度的信心, 以改善组织保存。NMDG 保护恢复方法已广泛应用于许多已发表的研究报告中, 采用成人动物脑切片制剂。这些急性切片研究跨越皮层3,17,18, 海马15,19,20,21, 巴22,23, 24, 中脑25,26,27,28, 29, 后脑30,31,32,33,34区域以及各种神经递质和 neuromodulator 类型, 包括谷氨酸4、30、GABAergic18、20、31、35 ,36, 多巴胺24,29,37,38, 胆碱能14,37,38, 39, 肾上腺素能 40, 和血清素27, 28 神经传递.该方法也非常适合于 optogenetic 控制转基因动物切片中的神经元活动3,39或以下体内病毒注射17,27, 28,40,41,42,43, 以及功能 Ca2 +成像神经元活动2,44 ,45,46。对短期可塑性的分析4,47,48和各种形式的长期可塑性16,35,48已报告.最近的一项研究应用了 NMDG 保护恢复方法, 以促进广泛和系统地探讨成熟成年小鼠脑切片的视觉皮层突触连接使用 octopatch 记录配置49 -一个强大的证明了该方法的实用性和鲁棒性。保护恢复方法甚至已经成功地应用于先前不可预知的实验情境中, 如改善成人皮层脑切片的血管和毛细血管的保存情况50, 补丁钳记录从移植 interneuron 人口1–1.5 年老年阿尔茨海默病小鼠模型20和成人脑切片受体贩运检测51。
下面的协议描述了实施优化的脑切片准备 NMDG 保护恢复方法的分步过程, 以提高急性脑切片的生存能力。讨论了改善神经元保存的原则, 并论证了这种方法在年轻的成年转基因小鼠脑切片和成熟成人复杂多神经元膜片钳记录实验中的明显好处人类神经外科脑切片。以下协议已被验证的老鼠从21天大到超过一岁以上, 以及人类神经外科标本的成人患者。
研究方案
涉及转基因小鼠的程序已得到艾伦脑科学研究所机构动物护理和使用委员会 (IACUC) 的批准。实验中使用了雄性和雌性 C57BL/6 小鼠 (重量范围10-30 克)。一些代表性的结果描述了从活体人脑切片收集的数据。皮层组织标本在 neurosurgeries 中获得肿瘤切除。有必要清除上覆的皮层组织, 以获得进入患病的组织。根据瑞典医学中心机构审查委员会批准的一项议定书, 在所有病例中均获得知情的患者同意, 以便为研究目的使用神经外科组织。
1. 介质和试剂的制备 (表 1)
注: 溶液应在纯净水中, 不含微量金属和其他杂质。建议在实验当天进行新的解决方案, 但如果需要, 未使用的解决方案可能存储在4摄氏度, 可达1周。以上每种配方的1升足以用于切切片程序。所有 aCSF 解决方案必须在使用卡波金 (95% O2/5% CO2) 之前饱和, 以确保稳定的 pH 缓冲和足够的氧合。所有溶液的 pH 值应调整为 7.3-7.4, 渗透压测量并调整为 300-310 mOsmol/千克。
- 准备 NMDG-HEPES aCSF (毫米):92 NMDG, 2.5 氯化钾, 1.25 NaH2PO4, 30 NaHCO3, 20 HEPES, 25 葡萄糖, 2 硫脲, 5 na 抗坏血酸, 3 na 丙酮酸, 0.5 CaCl2· 2H2O, 10 MgSO4· 7H2o 滴定 pH 为7。3–7.4 17 毫升 +/-0.5 毫升5米盐酸。
注: 本滴定步骤最好在添加价阳离子之前进行, 以避免沉淀;然而, 当 pH 值调整到生理范围时, 降水可以逆转。 - 准备 HEPES 持有 aCSF (毫米):92 氯化钠, 2.5 氯化钾, 1.25 NaH2PO4, 30 NaHCO3, 20 HEPES, 25 葡萄糖, 2 硫脲, 5 na 抗坏血酸, 3 na 丙酮酸, 2 CaCl2· 2H2O, 2 MgSO4· 7H2o 滴定pH 值为 7.3–7.4, 几滴浓缩10氮氢氧化钠。
- 准备录音 aCSF (毫米): 124 氯化钠, 2.5 氯化钾, 1.25 NaH2PO4, 24 NaHCO3, 12.5 葡萄糖, 5 HEPES, 2 CaCl · 2H 2 O, 2 MgSO 2 · 7H 4 o 滴定 pH 值 2-7.3 与几滴浓缩10氮氢氧化钠。
- 准备 Na+钉入溶液 (2 米): 580 毫克氯化钠溶解在5毫升新鲜制备的 NMDG-HEPES aCSF。这是足够的解决方案, 为一个脑切片准备。
- 准备2% 琼脂糖用于组织嵌入。在100毫升 1x PBS 和微波中溶解2克琼脂糖 1B (参见材料表), 直到沸腾。旋流混合, 然后倒入不育的10厘米培养皿的混合物, 并允许固化。将琼脂糖盘存放在4摄氏度的密封塑料袋中, 直到使用。
- 准备注射麻醉工作库存解决方案。混合2.5 克 22, 2-Tribromoethanol 与5毫升 2-甲基-2 丁醇, 然后逐渐溶解在200毫升 PBS, pH 7.0–7.3。使用前用0.22 µm 过滤器过滤库存溶液, 并在4摄氏度的保护下免受光照。
注: 咨询各动物使用委员会关于确定麻醉工作库存解决方案的过期和处置程序的准则和规则。
2. 切片站的设置
- 用组织切片机和手术器械设置切片站 (请参阅材料表)。要校准切片机, 请用快粘胶将锆陶瓷喷油器刀片连接到刀片臂上, 然后插入试样架, 将刀片的前缘与试样架边缘保持一小间隙, 以确保刀片不刮金属。
注: 如果刀片式服务器边缘没有物理损坏, 则可以在不替换的情况下重复使用多个星期甚至几个月。各种组织切片器模型在商业上是可用的, 其中许多可以提供最佳的性能时, 优化校准。理想的仪器应该有最小的 z 轴偏转, 无论是直接测量和调谐或经验的观察。 - 设置一个250毫升烧杯装满200毫升的 NMDG-HEPES aCSF 和预冷冰与恒定的 carbogenation (应用通过气体扩散石浸泡在媒体) > 10 分钟。
注: 本解决方案将用于 transcardial 灌注和切片机储层充填。 - 建立初始的脑切片恢复室, 填充150毫升的 NMDG-HEPES aCSF (保持恒定 carbogenation), 并将房间放在一个热水浴保持在第32-34 °c。
注: 推荐使用爱德华兹和 Konnerth (1992)52的设计后, 此步骤的切片室。这些房间可以提供现成的实验室项目 (250 毫升烧杯, 尼龙网格网, 50 毫升圆锥管, 35 毫米塑料圆碟)。必须小心, 以确保切片网保持无气泡, 特别是那些不断生产的卡波金气泡石, 因为这些可能会导致切片浮起来, 并成为损坏。该网应该被淹没大约1厘米的液体表面。 - 建立脑切片保存室;建议在较大的水库中使用多个独立井的设计 (请参阅材料表)。用450毫升的 HEPES aCSF 填充储层, 在恒定 carbogenation 下加热室温, 直至使用。
注: 在电生理记录前, 脑切片将从最初的恢复室转移到本室进行长期贮存。必须注意确保切片网在任何时候都保持无气泡。 - 制备用于组织嵌入的熔融琼脂糖。使用一个50毫升锥形小瓶的开放端, 像一个饼干切割机, 从以前准备好的盘子里切出2% 块琼脂糖。将锥形小瓶松盖, 然后用微波炉 10–30, 直到琼脂糖融化。不要过热。
- 将熔融琼脂糖倒入1.5 毫升管中。在熔融状态下保持琼脂糖, 使用 thermomixer 设置为42摄氏度, 剧烈晃动。小心地确保熔融琼脂糖不会过早凝固。
- 在这个时候放置在冰上的切片器的配件冷块, 以预凉。
3. Transcardial 灌注
注: transcardial 灌注程序是一个重要步骤, 当与成年动物, 是重要的是实现快速冷却的大脑和减缓新陈代谢通过脑输液低 Na+, 低钙2 +/高毫克2 + aCSF解决.transcardial 灌注也有助于清除脑血管中的红细胞, 从而减少可能干扰荧光标记细胞种群在转基因线上的可视化和靶向的自发荧光。不宜省略 transcardial 灌注。
- 腹腔注射麻醉工作液的深麻醉小鼠 (250 毫克/千克: 0.2 毫升1.25% 麻醉工作库存溶液每10克体重, 请参阅材料表)。2–3分钟后, 通过评估脚趾捏反射, 验证足够的麻醉深度。如果需要, 注入额外的麻醉工作库存量, 并重新评估脚趾捏反射后再2-3 分钟。
- 负载30毫升注射器与25毫升的 carbogenated NMDG-HEPES aCSF 从预冷250毫升烧杯 (2–4°c 是最佳的, 而不是泥泞或冷冻溶液)。附上 25 5/8 口径的针。
- 用鼠标背上, 钉下前爪和后爪, 以保持稳定性。一个15厘米玻璃培养皿填充硬化硅胶工作良好的基础。
- 使用手术刀, 做一个侧向切开打开胸腔在水平的膜片。使用细剪刀切割通过两侧的肋骨保持小心, 以避免修剪心脏和肺部。
- 把肋骨的中心部分钉回, 露出心脏。将30毫升注射器针插入左心室, 用细剪刀切开右心房, 让血液退出心脏。
- 使用人工恒压压低注射器柱塞, 并将该动物与冷冻 NMDG HEPES aCSF 灌注, 速度为10毫升/分钟。
注: 如果灌注成功, 肝脏将会从深红色变为浅黄色, 在某些情况下, 可以观察到在手术结束时从鼻孔中退出的透明液体。
4. 脑解剖和切片
- 斩首的动物。用手术刀打开头上的皮肤, 露出头骨盖。
- 使用精细的超切剪刀剪掉头骨盖上的皮肤, 并在头骨的尾部/腹底两侧侧向一侧的小切口。做额外的浅切口从头骨的尾部/背侧开始移动在延髓方向上的背中线注意不要损害底层的大脑。在嗅觉灯泡的水平上做一个与中线垂直的最终 ' T ' 切口。
注意: 必须小心, 以确保没有损害的大脑区域的利益。特别是, 在任何时候都不应该有任何压缩力应用于大脑本身。 - 使用圆头钳抓住头骨开始在延髓内侧的方面, 并剥离回向尾部侧向方向。重复双方打开和删除头骨的背半部分, 以揭露大脑。轻轻地挖出完整的大脑进入预冷 NMDG-HEPES aCSF 的烧杯中。让大脑均匀冷却1分钟。
- 使用大铲把大脑从烧杯中抬出来, 放到用滤纸覆盖的培养皿上。根据切片的首选角和所需的大脑区域来修剪和阻挡大脑。快速工作, 避免在搬运过程中长期缺氧。
注: 许多切片角度是可能的。精确的阻断方法和切片角度将取决于精确的脑区、细胞类型和要研究的电路。 - 用粘胶将脑块贴在标本架上。收回标本持有人的内块足以完全撤回脑块内。将熔融琼脂糖直接倒入支架内, 直至脑块完全覆盖在琼脂糖中。夹紧前冷却附件冷却块周围的标本持有人为 ~ 十年代直到琼脂糖凝固。
- 将试样架插入切片机上的插座, 并验证正确的对齐方式。用剩余的预冷、含氧 NMDG HEPES aCSF 从250毫升烧杯中填满储层, 并在切片期间将气泡石移入油藏, 以确保充分的氧合。
- 调整千分尺开始推进琼脂糖嵌入脑标本。启动切片器并经验主义地将前进速度和振荡频率调整到所需的水平。
注意: 这两个设置应该在低范围内。为了获得最佳效果, 一刀臂的单一通行证应大约二十年代, 振荡应产生一个非常平滑和柔和的嗡嗡声, 没有明显的嗡嗡作响。 - 继续推进和切片的组织在300µm 增量 (或其他首选厚度), 直到大脑区域的利益完全切片;切片过程的总时间应小于15分钟。
5. 优化 NMDG 保护恢复程序
- 初始 NMDG 恢复步骤 (关键步骤): 在切片过程完成后, 使用截止塑料巴斯德管 t 收集所有切片, 并将其转移到预热 (34 °c) 的初始恢复室, 填充150毫升NMDG-HEPES aCSF。当所有切片移动到恢复腔中时, 立即转移所有切片并启动计时器。
- 请参阅表 2以根据鼠标的年龄确定最佳 Na+峰值时间。
注: 本程序是一种实用的方法, 可实现将 Na+重新引入脑切片腔的控制速率, 并针对特定的脑切片室几何和储层体积和类型进行了优化 (请参阅材料表)。 - 通过在指定的时间添加 na+钉入解决方案的指示卷, 执行逐步 Na+峰值过程。将 Na+钉入解决方案直接添加到初始回收室的涌泉烟囱中, 以方便快速混合。
- 将所有切片转移到 HEPES aCSF 在室温下保持的长期保持室。在启动膜片钳记录实验之前, 允许切片在 HEPES 保持室中恢复1小时。
6. 膜片钳记录
注意: 以下基本过程只是提供了一些实际的注意事项, 并不打算代表补丁夹录音的详细协议, 因为这些程序可以在其他53、54中找到。这个应用需要一个膜片钳电生理钻机。这通常是由一个直立显微镜, 配备红外差分干涉对比 (IR-DIC) 光学和荧光照明系统, 膜片钳放大器和数据数字化仪, 机动机器人和显微镜平台, 隔振台, 法拉第笼, 及溶液加热和灌注系统。样品室和平台应设计为浸没切片记录。对于多神经元膜片钳录音, 需要配备多个放大器、头级和高质量并联的钻机。此外, 为了获得最佳效果, 我们极力推荐配备 900 nm 红外波段通滤波器和匹配光学元件的钻机, 以确保在脑切片的深部 > 50 µm 细胞的充分可视化。Kӧhler 照明的正确对准对清晰的可视化也很重要。
- 制备胞内吸管溶液 (毫米): 130 克葡萄糖酸盐, 4 氯化钾, 10 HEPES, 0.3 EGTA, 10 磷酸肌酸-Na2, 4 MgATP, 0.3Na2-GTP, 13.4 biocytin。调整 pH 值为7.35 与1米 KOH 和渗透压 285–290 mOsmol/千克使用蔗糖的需要。
- 从厚壁硅酸盐玻璃毛细管中制备膜片钳电极;理想的膜片钳电极有一个相对短和粗锥形与〜3–6毫欧填充尖端电阻在浴缸。
- 确保银电极线正确 chlorided, 以确保稳定的记录。做这 (典型) 通过淹没最后3-4 毫米银色导线在液体漂白剂大约30分钟或直到导线变黑。
- 用蠕动泵建立溶液灌注, 3–4毫升/分钟. 通过记录室循环 carbogenated 记录 aCSF, 注意匹配流入和流出以避免溢出。
- 将单个脑切片转移到浸没记录室中, 并使用带有尼龙十字弦的 U 形切片锚将其固定到位。在切换到更高功率目标 (例如、高数值孔径40X 或60X 水浸泡目标) 之前, 使用4X 空气目标识别目标大脑区域。
- 直观地识别一个健康的目标细胞。由红外-DIC 显微镜可视化的神经细胞膜在躯体上的出现, 用于判断候选细胞是否适合于膜片钳记录。
注意: 健康的神经元通常表现为以下特点: 既不萎缩也不肿胀胞体, 膜边缘的软对比, 以及平滑的膜外观。此外, 大多数健康细胞位于30µm 深的切片, 因为肤浅的神经元可能会被破坏的树突状过程。出现皱纹的神经元, 清晰可见的细胞核或 ' 煎蛋 ' 的外观, 或非常黑暗或高对比膜边缘应避免。 - 背部填充5µL 细胞内溶液的贴片吸管, 并将其加载到电极支架上。将吸管移入脑切片上方的记录浴缸中, 并应用轻正压以清除尖端中的任何障碍物。使用膜测试功能将吸管偏移量降至零, 并对尖端电阻进行监测。
- 将吸管尖端与靶神经元的细胞体接触;由于光线正压, 在膜表面形成一个小酒窝。
- 一旦膜酒窝被观察, 迅速消除正压和应用温和吸力, 以方便密封的形成。一旦吸管阻力增加到 > 100 毫欧, 打开一个保持命令的水平, 匹配预期的静止膜电位的目标细胞类型 (-70 mV 是一个很好的出发点)。
- 一旦尖端阻力达到≥1 gigaohm, 试图打破细胞在贴片吸管下面使用短暂的尖锐吸力的膜断裂;"电击" 功能可用于在需要时方便闯入。
注: 在皮层神经元的电压钳实验中, 提出了-70 mV 的保持电位。在实验期间, 健康神经元的漏电流不会超过-100 pA, 但这部分依赖于细胞类型。如果静止膜电位比-50 mV 更偏振光, 或者如果接入电阻改变了20% 以上, 神经元将被排除在分析之外。 -
一旦获得稳定的全细胞膜片钳记录, 目标额外的神经元, 以记录重复步骤6.6–6.10。注意避免机械干扰会导致丢失第一个录音。
- 从第一个神经元中选择100µm 内的其他神经元, 以确保找到 synaptically 耦合神经元的合理概率。
注意: 在建立第一个膜片钳记录之前, 在某些情况下, 在前置多个候选神经元并预先加载和预置所有吸管到各个目标细胞上可能会有帮助。
- 从第一个神经元中选择100µm 内的其他神经元, 以确保找到 synaptically 耦合神经元的合理概率。
结果
本节为常规脑切片制备和膜片钳电生理学实验提供了具有代表性的结果, 采用优化的 NMDG 保护恢复方法 (即, NMDG 保护恢复与渐进 Na+相结合)钉入程序)。首先, 在未实施优化的 NMDG 保护恢复方法 (图 1) 的情况下, 对脑切片的不同脑区进行了形态学保存评估。三月大的成年小鼠被选中进行这些实验, 我们使用红外 DIC 显微镜, 以确定神经元健康的基础上的形状和整体外观的胞体和近端树突。注意在没有保护恢复方法的脑切片的代表性图像中, 大多数神经元的萎缩、固缩出现 (所有图像均在切片制备后获得)。这些控制切片是使用 NMDG aCSF 编写的, 用于 transcardial 灌注和切片步骤, 但最初是在高 Na+包含 HEPES aCSF 中恢复的。相比之下, 使用优化的 NMDG 保护恢复方法制备的切片中的代表性图像显示了适合于膜片钳记录的具有改进形貌 (平滑、更充分、更少皱纹的外观) 的神经元 (图1). 在多个脑区, 包括皮层层、下托、背侧膝状核 (dLGN), 观察到了改善的神经元保存。
其次, 将优化的 NMDG 保护恢复方法与原 NMDG 保护恢复方法 (即) 进行比较, 而不需要渐进 Na+钉入过程)。当应用渐进 Na+峰值过程时, 膜片钳记录尝试中 gigaohm 密封形成的平均时间显著减少 (9.9 秒与33.3 秒、**p < 0.005、配对t测试)与 NMDG 保护恢复步骤一起 (图 2)。快速、可靠的膜封堵时间大大提高了幼脑切片膜片钳记录的吞吐量。根据动物年龄 (表 2), 对最佳 Na+峰值时间进行了进一步修改, 对所有已测试的年龄 (3 周到1岁的老鼠) 都是有益的。在整个钉入过程中, 我们提供了渐进钠离子浓度升高的剖面 (图 3), 以配合表 2中显示的时间表。
作为艾伦研究所细胞类型计划 (http://celltypes.brain-map.org/) 的一部分, 正在进行大规模的努力, 系统地描述年轻成人个体神经元的固有电生理特性 (后天 40-80)。小鼠视觉皮层脑切片从转基因线中提取的细胞类型特异荧光标记表达在基因定义的神经元群中 (皮质层和细胞类型特定的创可驱动线交叉到一项依赖于 a 的荧光记者行55)。图 4显示了从 Parvalbumin (Pvalb)-表达皮质快速峰值 (FS) 中间神经元 (Pvalb-IRES-Cre/Ai14 小鼠) 中记录的触发模式的示例, 以响应一系列包含动态范围的 1 s 电流注入步骤。神经元发射。22皮质 FS 中间神经元数据集的 f-I 曲线显示在右侧。在 Rorb-IRES-Cre/Ai14 小鼠 (图 4) 中, 对 23 Rorb 表达兴奋神经元的特征进行了类似的靶向膜片钳记录实验。不同的健康神经元类型, 包括 FS 中间神经元和锥体神经元跨皮层区域和层可以例行和可靠的目标, 以补丁钳记录至少6-8 小时后切片准备使用此优化协议。
除了测量固有的神经元特性外, 还探讨了在视觉皮层集成电路中的多个同步记录神经元之间的突触连通性。多神经元膜片钳记录技术是异常苛刻的, 因为许多健康候选神经元的定义类型必须在一个相对较小的脑切片领域存在, 以确保一个合理的机会获得高质量同时记录并识别善意突触连接。图 5显示了从年轻的成年 Pvalb-IRES-Cre/Ai14 小鼠脑切片的视觉皮层中两个 tdTomato + FS 中间神经元的配对记录。检测到一个强有力的单向抑制突触连接 (记录与高氯化物内吸管溶液)。给出了用于测量短时突触塑性特性的记录和协议示例。高频列车刺激 (每10、50和100赫兹的10个脉冲) 后依次采用不同时间间隔 (1、2或 4 s) 的单次恢复测试脉冲来测量突触抑郁症恢复的时间过程。
成熟成人体外脑切片中的人皮层神经元也获得了优异的成功. 神经外科标本是从病人进行定期手术切除肿瘤的地方医院。人类神经外科组织采集和脑切片制备的程序与小鼠脑切片程序有几种不同的实用方法。简而言之, 切除后的皮层组织 (病理部位远端) 从手术室采集, 浸入冰冷的含氧 NMDG HEPES aCSF, 从手术室持续冷却和氧合运输到实验室在30分钟以内或更少。脑切片的准备使用 NMDG 保护恢复程序, 并允许恢复大约3小时的延长时间, 然后开始补丁钳录音。图 6显示了一个成功的配对录音实验和一个成功的四个补丁钳录音实验, 从人类的前体脑切片, 这种方式制备的前额皮质区域。配对记录显示从皮质锥体神经元到皮质 interneuron 的单向兴奋性突触输入 (记录为兴奋后突触电流)。在四斑片实验中, 两个兴奋和两个抑制神经元同时记录, 三个抑制性突触连接被发现 (记录为抑制后突触电位) 十二总连接探查。因此, 这种优化的脑切片方法允许在最具挑战性的脑切片应用中取得可靠的实验成功, 包括多神经元膜片钳实验研究急性切除成年人脑中的电路连通性组织.
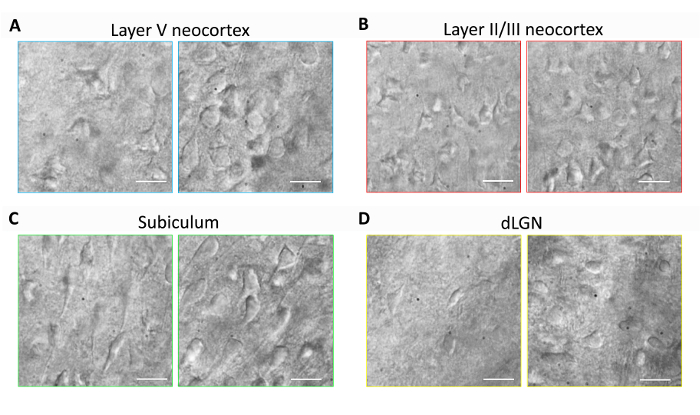
图 1:改进的神经元保存与优化的 NMDG 保护恢复方法的脑切片准备.有代表性的红外-DIC 图像是从不同的大脑区域获得的急性切片从三月大的老鼠。控制 NMDG 保护切割方法没有保护恢复步骤 (左面板) 与优化 NMDG 保护恢复方法 (右面板)。(A) 大脑皮层的层 V, (B) 第二层/第三个大脑皮层, (C) 下托和 (D) 背侧膝状核 (dLGN).所有面板中的刻度条均为20µm.请单击此处查看此图的较大版本.
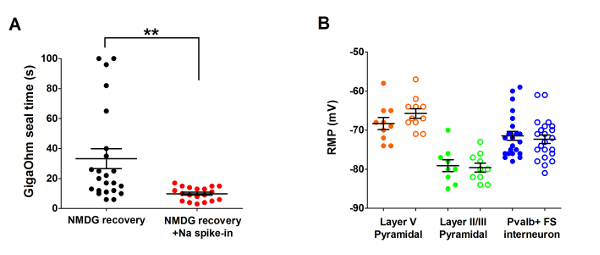
图 2:使用 Na+钉入过程的 NMDG 保护恢复方法对膜片钳记录实验中的 gigaohm 密封的加速速度和可靠性进行了改进.(A) 单独 NMDG 恢复的 gigaohm 密封形成时间图 (黑色数据点, n = 19) 与 NMDG 恢复和 Na+钉入过程 (红色数据点, n = 23)。所有被记录的细胞都是在视觉皮层的第二层/III 或 V 的锥体神经元。注意, 最大的时间是上限在 100s, 以解释细胞从来没有形成 gigaohm 海豹。配对的t-测试, **p < 0.005。(B) 对 V 锥体神经元 (橙色数据点、n = 10/11)、II/III 锥体神经元 (绿色数据点、n = 9/10) 或皮质 Pvalb + FS 中间神经元 (蓝色数据点, n = 23/22) 的静止膜电位 (RMP) 的绘制。实心圆圈表示 NMDG 恢复条件和开放圆圈 NMDG 恢复加上 Na+钉入过程。每个数据点代表一个神经元, 并显示平均值和 +/-SEM。在 RMPs 比较所有三种细胞类型 (配对的t测试) 的脑切片制备条件方面没有显著差异。请单击此处查看此图的较大版本.
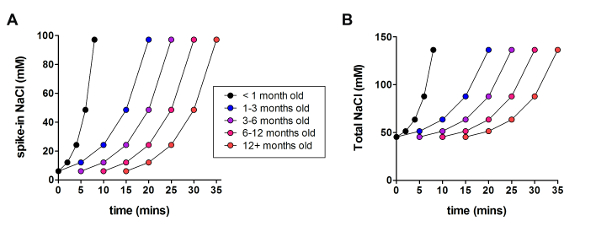
图 3: 在整个钉入过程的过程中, 逐步钠离子浓度升高的剖面.(A) 在氯化钠浓度与时间之间的图。(B) 总胞外氯化钠浓度与时间的图。请单击此处查看此图的较大版本.
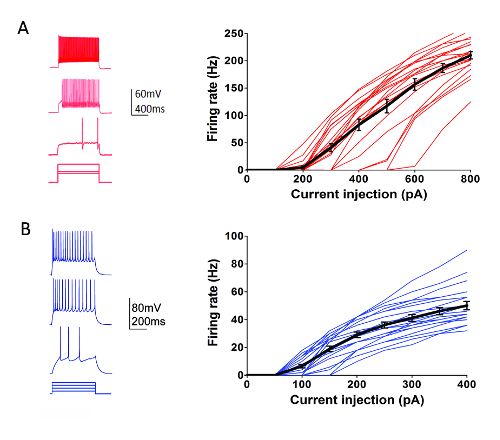
图 4: 基因定义的皮层细胞类型的固有电生理特性.(A) 示例针对 Pvalb + 皮质 FS 中间神经元 (左面板) 的当前注入步骤对神经元激发的跟踪。tdTomato + 神经元是 Pvalb-IRES-Cre/Ai14 小鼠脑切片记录的目标。发射率-电流注入关系 (f-I 曲线) 的汇总数据显示在右侧 (n = 22)。(B) 示例针对 Rorb 表达皮质层 IV 兴奋神经元 (左面板) 的当前注射步骤对神经元发射的痕迹。tdTomato + 神经元是 Rorb-IRES-Cre/Ai14 小鼠脑切片记录的目标。发射率-电流注入关系 (f-I 曲线) 的汇总数据显示在右侧 (n = 23)。每条薄色线表示单个神经元的 f-I 曲线;而粗黑线表示每个组的平均值 +/-SEM.请单击此处查看此图的较大版本.
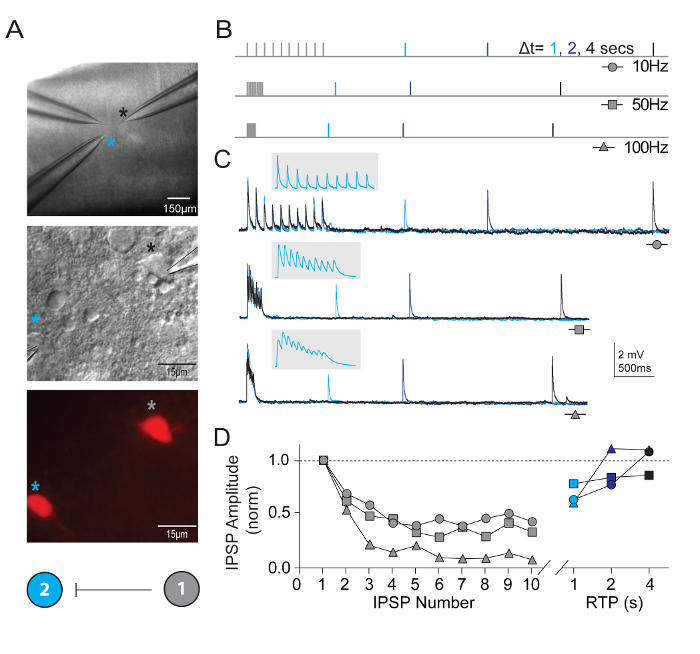
图 5:synaptically 连接 Pvalb-表达皮质 FS 中间神经元的短期可塑性。(A) 差异干扰对比度和荧光用于 tdTomato 阳性、Pvalb 表达 FS 中间神经元小鼠初级视觉皮层的目标。一种颜色编码示意图连接图, 表明两个中间神经元之间的单边突触连接。(B) 用于评估 synaptically 连接神经元的短期动态的刺激协议示意图。10动作电位 (10、50和 100 Hz) 的列车在突触前神经元中诱发, 其次是在列车终止后以不同的延时 (1、2和 4 s) 交付的单个动作电位 (恢复测试脉冲、RTP)。每个 RTP 都是彩色编码的清晰度。(C) 细胞 #2 中相应的单边抑制后突触电位 (uIPSPs) 的平均痕迹, 以响应细胞 #1 中诱发的动作电位的训练。灰色嵌入扩展了时间刻度, 显示了 uIPSP 列车的划分。(D) 规范化的 uIPSP 振幅在不同频率的列车中被绘制为其位置的函数。在所有的输入率下, 净抑郁都是清晰的, uIPSP 在4秒内大幅恢复.请单击此处查看此图的较大版本.
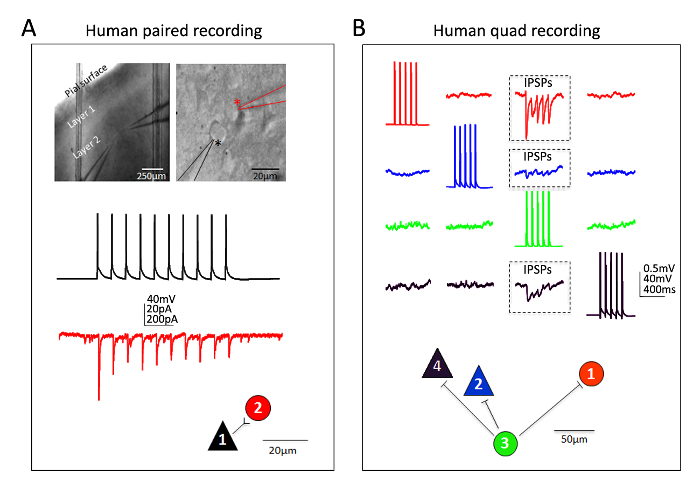
图 6:多神经元膜片钳录音在成人神经外科脑切片.(A) 低和高放大红外-DIC 图像, 表示记录神经元的位置和标识 (顶部面板)。同时记录了锥体神经元 (黑色星号) 和相邻 interneuron (红色星号)。例如从锥体细胞到 interneuron 的单向兴奋性突触连接 (ESPC) 的彩色编码痕迹 (测量为 EPSCs 在电压钳) 和相应的物理连接图 (底部板)。(B) 侧前额叶皮质成人神经外科脑切片的四个贴片钳记录实验。两个锥体神经元和两个中间神经元同时记录, 允许连续探查十二可能的突触连接。在细胞 #3 (绿色痕迹) 的诱发动作电位的列车导致检测到其他三个同时记录的神经元 (三个盒装区域, 顶部板) 的抑制后突触电位 (IPSPs)。每个神经元所记录的响应都是颜色编码的, 以便清晰。物理连接映射显示在底部面板中。注意 (B) 中显示的原始跟踪表示至少连续20个原始数据扫描的平均值。细胞类型的假定识别是基于躯体形态, 在录音过程中用荧光染料填充形态学分析, 以及内在的电生理特性, 包括激发模式对当前注射步骤的反应。请单击此处查看此图的较大版本.
| NMDG-HEPES aCSF | HEPES 控股 aCSF | 录制 aCSF | |||||||
| 组件 | 毫米 | mw | 克/升 | 毫米 | mw | 克/升 | 毫米 | mw | 克/升 |
| NMDG | 92 | 195.22 | 17.96 | ||||||
| 盐酸 | 92 | 36.46 | * | ||||||
| nacl | 92 | 58.44 | 5.38 | 124 | 58.44 | 7.25 | |||
| 氯化钾 | 2。5 | 74.55 | 0.19 | 2。5 | 74.55 | 0.19 | 2。5 | 74.55 | 0.19 |
| NaH2PO4 | 1。2 | 138.00 | 0.17 | 1。2 | 138.00 | 0.17 | 1。2 | 138.00 | 0.17 |
| NaHCO3 | 30 | 84.01 | 2.52 | 30 | 84.01 | 2.52 | 24 | 84.01 | 2.02 |
| HEPES | 20 | 238.31 | 4.77 | 20 | 238.31 | 4.77 | 5 | 238.31 | 1.19 |
| 葡萄糖 | 25 | 180.20 | 4.51 | 25 | 180.20 | 4.51 | 12。5 | 180.20 | 2.25 |
| 抗坏血酸钠 | 5 | 198.00 | 0.99 | 5 | 198.00 | 0.99 | 0 | 198.00 | 0.00 |
| 脲 | 2 | 76.12 | 0.15 | 2 | 76.12 | 0.15 | 0 | 76.12 | 0.00 |
| 丙酮酸钠 | 3 | 110.04 | 0.33 | 3 | 110.04 | 0.33 | 0 | 110.04 | 0.00 |
| MgSO4. 7H2O | 10 | 246.48 | 5毫升 | 2 | 246.48 | 1毫升 | 2 | 246.48 | 1毫升 (2M 库存) |
| CaCl2. 2H2O | 0。5 | 147.01 | 0.25 毫升 | 2 | 147.01 | 1毫升 | 2 | 147.01 | 1毫升 (2M 库存) |
| * NMDG-HEPES aCSF 7.3-7.4 的滴定 pH 值 | |||||||||
| 所有解决方案应在范围 300-310 mOsm/千克 | |||||||||
表 1:媒体配方.
| 动物年龄 | |||||
| 时间 (分钟) * | < 1 月 | 1-3 月 | 3-6 月 | 6-12 月 | 12月以上 |
| 0 | 250µL | 250µL | |||
| 1 | |||||
| 2 | 250µL | ||||
| 3 | |||||
| 4 | 500µL | ||||
| 5 | 250µL | 250µL | |||
| 6 | 1000µL | ||||
| 7 | |||||
| 8 | 2000µL | ||||
| 9 | |||||
| 10 | 转让 | 500µL | 250µL | 250µL | |
| 11 | |||||
| 12 | |||||
| 13 | |||||
| 14 | |||||
| 15 | 1000µL | 500µL | 250µL | 250µL | |
| 16 | |||||
| 17 | |||||
| 18 | |||||
| 19 | |||||
| 20 | 2000µL | 1000µL | 500µL | 250µL | |
| 21 | |||||
| 22 | |||||
| 23 | |||||
| 24 | |||||
| 25 | 转让 | 2000µL | 1000µL | 500µL | |
| 26 | |||||
| 27 | |||||
| 28 | |||||
| 29 | |||||
| 30 | 转让 | 2000µL | 1000µL | ||
| 31 | |||||
| 32 | |||||
| 33 | |||||
| 34 | |||||
| 35 | 转让 | 2000µL | |||
| 36 | |||||
| 37 | |||||
| 38 | |||||
| 39 | |||||
| 40 | 转让 | ||||
| * 时间零点是将切片转移到初始恢复室的时刻 | |||||
表 2:渐进 Na 的推荐计划+按鼠标的年龄进行的钉入过程.
讨论
Na+钉入改善 Gigaohm 密封形成和膜片钳记录成功
NMDG 保护恢复方法的初始版本是专为成年和衰老动物设计的2,5。一些早期的使用者也试图将这种方法应用于青少年动物脑切片 (即, 老鼠 < 30 天)。然而, 人们注意到, 与在这个年龄范围内的 NMDG 保护恢复方法的杰出的视觉上证实的神经元保存相比, gigaohm 海豹的形成可以经常失速, 导致失败的补丁钳录音尝试。一个假说是, NMDG 阳离子更容易被困在青少年脑切片相对于成人脑切片和可能阻碍海豹形成;然而, gigaohm 海豹可以很容易地形成, 而少年脑切片完全淹没在 NMDG aCSF (数据没有显示), 从而表明 NMDG aCSF本身不妨碍 gigaohm 密封的形成。
在初始脑切片恢复步骤完成后, 从低到高的 Na+解决方案的快速过渡会导致神经细胞膜受损, 并 perturbs 密封形成过程。这是直观的, 因为从低到高的 Na+, 冷到暖的温度, 并戏剧性地升高的 Ca2 +到 Mg2 +比率共同导致自发突触活动的大规模复苏。在脑切片过程中, 这种抑制性反弹阶段很可能会在缺血性侮辱后镜像再灌注损伤。因此, 为了进一步减轻在初始恢复阶段的神经细胞膜损伤, 一个渐进的 Na+钉入过程被纳入其中 Na+浓度在 NMDG 保护性恢复孵化室中的升高缓慢和重现性高, 精确的时间。与原来的保护恢复过程一样, 从温度和 Ca2 +/Mg2 +比值提升的时间离解的 Na+升高是有益的。但此外, Na+钉入过程导致在早期时间点上的胞外 Na+浓度的小增量增加, 对晚期时间点的大量增加, 从而提供脑组织更好地适应上升的 Na+级别的机会。该程序是一种替代渐进式解决方案交换控制的灌注泵或重力滴水线, 导致不断增加 Na+水平, 并要求注意流入和流出, 以避免溢出的切片室。值得注意的是, 在这个 Na+尖峰过程中, 切片室中溶液的渗透度在切片返回正常渗透液之前的几分钟内逐渐上升, 但这不会对切片的健康产生负面影响。或补丁钳记录成功。为了更好地保留多巴胺神经元用于修补钳录音的57,58, 以前已经使用了高渗透压切割解决方案, 从而证明此临时在某些情况下, hyperosmolality 可能是有益的。
通过实施一个结合 NMDG 保护恢复方法和渐进 Na+尖峰步骤的优化过程, 这种脑切片方法的效用已经扩展到通过成熟的成年动物年龄来覆盖青少年。此更新的协议现在适用于广泛的动物年龄使用一个单一的最佳 NMDG aCSF 配方和程序。如有必要, Na+钉入过程可应用于逐步延长的延迟和/或较慢的时间路线, 以提高老动物脑切片的生存能力, 我们已经提供了一个基本指南, 建议的峰值时间表根据到动物年龄 (请参见表 2)。虽然我们提供了一个适合广泛应用的基本框架, 但还可以探索更多的先进步骤, 进一步提高成年和衰老动物脑切片的生存能力和寿命。例如, 谷胱甘肽恢复战略在这方面特别有效, 可以按照其他地方的说明执行2,6。
提高挑战性实验的吞吐量
膜片钳记录对突触连通性的分析是一项要求很高的应用, 需要对神经元结构和功能进行良好的保存, 以达到成功的高度可靠性。同时记录的神经元数量呈线性上升, 技术难度水平呈线性上升。有许多故障模式, 最常见的故障原因之一是无法形成足够的 gigaohm 密封到一个或多个目标细胞。这可能大大减慢进展, 特别是当三或更多的神经元必须同时记录。与优化的 NMDG 保护恢复方法相一致, gigaohm 密封的形成时间越快, 多神经元膜片钳记录实验的成功率和吞吐量就显著提高小鼠脑切片和成人神经外科脑切片。提高效率几乎肯定是由于更快速和可靠的 gigaohm 密封形成和改进的神经保护切片与本协议。尽管本协议着重于对补丁钳记录应用的好处, 但对于其他具有挑战性的实验应用, 大脑切片的生存能力至关重要, 预期也会取得类似的成果。
披露声明
作者没有什么可透露的。
致谢
这项工作由艾伦脑科学研究所资助。作者希望感谢艾伦学院创始人保罗 g. 艾伦和朱迪. 艾伦, 他们的远见、鼓励和支持。我们还感谢艾伦研究所的技术支持人员从事动物护理、畜牧业和基因分型。
材料
| Name | Company | Catalog Number | Comments |
| Compresstome VF-200 | Precisionary Instruments | VF-200 | Vibrating tissue slicer (recommended) |
| N-methyl-D-glucamine | Sigma Aldrich | M2004 | aCSF constituent |
| Sodium Chloride | Sigma Aldrich | S3014 | aCSF constituent |
| Potassium Chloride | Sigma Aldrich | P5405 | aCSF constituent |
| Sodium Phosphate monobasic dihydrate | Sigma Aldrich | 71505 | aCSF constituent |
| Sodium Bicarbonate | Sigma Aldrich | S5761 | aCSF constituent |
| HEPES | Sigma Aldrich | H4034 | aCSF constituent |
| Glucose | Sigma Aldrich | G7021 | aCSF constituent |
| Sodium Ascorbate | Sigma Aldrich | A4034 | aCSF constituent |
| Thiourea | Sigma Aldrich | T8656 | aCSF constituent |
| Sodium pyruvate | Sigma Aldrich | P5280 | aCSF constituent |
| Calcium chloride dihydrate | Sigma Aldrich | C7902 | aCSF constituent |
| Magnesium Sulfate heptahydrate | Sigma Aldrich | M1880 | aCSF constituent |
| 2,2,2-Tribromoethanol | Sigma Aldrich | T48402 | Anesthetic component 1 |
| 2-methyl-2-butanol | Sigma Aldrich | 240486 | Anesthetic component 2 |
| Curved blunt forceps | Fine Science Tools | 11065-07 | Brain dissection tools |
| Fine dissecting scissors (supercut) | Fine Science Tools | 14058-09 | Brain dissection tools |
| Large heavy duty scissors 7'' | Fine Science Tools | 14000-18 | Brain dissection tools |
| Metal spatula | Sigma Aldrich | Z511455-1PAK | Brain dissection tools |
| Razor blades | VWR | 89031-954 | Brain dissection tools |
| Brain Slice Keeper-4 | Automate Scientific | S-BSK4 | brain slice holding chamber |
| nylon netting | Warner Instruments | 64-0198 | For building small slice recovery chambers |
| Pyrex glass beakers (250 mL) | VWR | 89090-434 | For building small slice recovery chambers |
| 35 mm plastic dish, round | VWR | 100488-376 | For building small slice recovery chambers |
| Gas diffuser stones (10 µm) | Sigma Aldrich | 59277 | For constant carbogenation (fine bubbles) |
| Agarose Type I-B | Sigma Aldrich | A0576 | For embedding brain specimens |
| Micro loader tips | Eppendorf | 22491229 | For filling patch clamp electrodes |
| Sylgard | VWR | 102092-312 | For making a custom dissecting platform |
| Hydrochloric acid | Sigma Aldrich | H1758-100ML | For pH adjustment of media |
| Sodium Hydroxide | Sigma Aldrich | 221465-25G | For pH adjustment of media |
| Potassium Hydroxide | Sigma Aldrich | 221473 | For pH adjustment of media |
| Plastic transfer pipets 3 mL graduated | VWR | 89497-676 | For slice transfer |
| Zirconium ceramic injector blades | Cadence Specialty Blades | EF-INZ10 | http://cadenceinc.com/ |
| KG-33 borosilicate glass capillary w/filament | King Glass Company | custom quote | ID: 0.87mm, OD 1.50mm |
| Biocytin | Sigma Aldrich | B4261 | Intern pipette solution |
| Phosphocreatine disodium | Sigma Aldrich | P7936 | Intern pipette solution |
| Potassium Gluconate | Sigma Aldrich | G4500-100G | Intern pipette solution |
| EGTA | Sigma Aldrich | E3889 | Intern pipette solution |
| Mg-ATP | Sigma Aldrich | A9187 | Intern pipette solution |
| Na2-GTP | Sigma Aldrich | 51120 | Intern pipette solution |
| sucrose | Sigma Aldrich | S0389 | Intern pipette solution |
| Heated water bath (2.5L) | VWR | 13491-060 | Miscellaneous |
| Filter paper rounds | VWR | 28456-022 | Miscellaneous |
| Cyanoacrylate glue | Amazon | B000BQRBO6 | Miscellaneous |
| Glass petri dish | VWR | 89000-326 | Miscellaneous |
| 10X Phosphate buffered saline | Sigma Aldrich | P5493 | Miscellaneous |
| 30 mL syringes | VWR | BD302832 | Miscellaneous |
| 1 mL syringes | VWR | BD-309628 | Miscellaneous |
| 25 5/8 gauge needles | VWR | 89219-292 | Miscellaneous |
| Thermomixer (w/1.5 mL tube block) | VWR | 89232-908 | To keep agarose molten |
参考文献
- Aghajanian, G. K., Rasmussen, K. Intracellular studies in the facial nucleus illustrating a simple new method for obtaining viable motoneurons in adult rat brain slices. Synapse. 3 (4), 331-338 (1989).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods Mol Biol. 1183, 221-242 (2014).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nat Methods. 8 (9), 745-752 (2011).
- Peca, J., et al. Shank3 mutant mice display autistic-like behaviours and striatal dysfunction. Nature. 472 (7344), 437-442 (2011).
- Ting, J. T. F., et al. Improved methods for acute brain slice preparation from adult and aging animals. Society for Neuroscience Abstracts. 520, (2011).
- Ting, J. T. F., et al. Improved methods for acute brain slice preparation from adult and aging animals (Part II): Glutathione depletion underlies rapid deterioration of adult brain slices. Society for Neuroscience Abstracts. 505, (2012).
- MacGregor, D. G., Chesler, M., Rice, M. E. HEPES prevents edema in rat brain slices. Neurosci Lett. 303 (3), 141-144 (2001).
- Liu, Y. B., Guo, J. Z., Chiappinelli, V. A. Nicotinic receptor-mediated biphasic effect on neuronal excitability in chick lateral spiriform neurons. Neuroscience. 148 (4), 1004-1014 (2007).
- Xiang, Z., Huguenard, J. R., Prince, D. A. GABAA receptor-mediated currents in interneurons and pyramidal cells of rat visual cortex. J Physiol. 506, 715-730 (1998).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nat Protoc. 1 (4), 2075-2081 (2006).
- Contractor, A., et al. Loss of kainate receptor-mediated heterosynaptic facilitation of mossy-fiber synapses in KA2-/- mice. J Neurosci. 23 (2), 422-429 (2003).
- Pita-Almenar, J. D., Collado, M. S., Colbert, C. M., Eskin, A. Different mechanisms exist for the plasticity of glutamate reuptake during early long-term potentiation (LTP) and late LTP. J Neurosci. 26 (41), 10461-10471 (2006).
- Ito, K., Contractor, A., Swanson, G. T. Attenuated plasticity of postsynaptic kainate receptors in hippocampal CA3 pyramidal neurons. J Neurosci. 24 (27), 6228-6236 (2004).
- Van Dort, C. J., et al. Optogenetic activation of cholinergic neurons in the PPT or LDT induces REM sleep. Proc Natl Acad Sci U S A. 112 (2), 584-589 (2015).
- Ferando, I., Mody, I. Altered gamma oscillations during pregnancy through loss of delta subunit-containing GABA(A) receptors on parvalbumin interneurons. Front Neural Circuits. 7, 144 (2013).
- Walker, A. G., et al. Metabotropic glutamate receptor 3 activation is required for long-term depression in medial prefrontal cortex and fear extinction. Proc Natl Acad Sci U S A. 112 (4), 1196-1201 (2015).
- Takahashi, Y. K., et al. Neural estimates of imagined outcomes in the orbitofrontal cortex drive behavior and learning. Neuron. 80 (2), 507-518 (2013).
- Pan, G., et al. Preserving GABAergic interneurons in acute brain slices of mice using the N-methyl-D-glucamine-based artificial cerebrospinal fluid method. Neurosci Bull. 31 (2), 265-270 (2015).
- LaSarge, C. L., Santos, V. R., Danzer, S. C. PTEN deletion from adult-generated dentate granule cells disrupts granule cell mossy fiber axon structure. Neurobiol Dis. 75, 142-150 (2015).
- Tong, L. M., et al. Inhibitory interneuron progenitor transplantation restores normal learning and memory in ApoE4 knock-in mice without or with Abeta accumulation. J Neurosci. 34 (29), 9506-9515 (2014).
- Fleming, R. L., et al. Binge-pattern ethanol exposure during adolescence, but not adulthood, causes persistent changes in GABAA receptor-mediated tonic inhibition in dentate granule cells. Alcohol Clin Exp Res. 37 (7), 1154-1160 (2013).
- Kummer, K. K., El Rawas, R., Kress, M., Saria, A., Zernig, G. Social interaction and cocaine conditioning in mice increase spontaneous spike frequency in the nucleus accumbens or septal nuclei as revealed by multielectrode array recordings. Pharmacology. 95 (1-2), 42-49 (2015).
- Qi, J., et al. A glutamatergic reward input from the dorsal raphe to ventral tegmental area dopamine neurons. Nat Commun. 5, 5390 (2014).
- Wang, L., et al. Modulation of dopamine release in the striatum by physiologically relevant levels of nicotine. Nat Commun. 5, 3925 (2014).
- Siuda, E. R., et al. Spatiotemporal Control of Opioid Signaling and Behavior. Neuron. , (2015).
- Tucker, K. R., Huertas, M. A., Horn, J. P., Canavier, C. C., Levitan, E. S. Pacemaker rate and depolarization block in nigral dopamine neurons: a somatic sodium channel balancing act. J Neurosci. 32 (42), 14519-14531 (2012).
- McDevitt, R. A., et al. Serotonergic versus nonserotonergic dorsal raphe projection neurons: differential participation in reward circuitry. Cell Rep. 8 (6), 1857-1869 (2014).
- Wang, D. V., et al. Mesopontine median raphe regulates hippocampal ripple oscillation and memory consolidation. Nat Neurosci. 18 (5), 728-735 (2015).
- Engle, S. E., Shih, P. Y., McIntosh, J. M., Drenan, R. M. alpha4alpha6beta2* nicotinic acetylcholine receptor activation on ventral tegmental area dopamine neurons is sufficient to stimulate a depolarizing conductance and enhance surface AMPA receptor function. Mol Pharmacol. 84 (3), 393-406 (2013).
- Vance, K. M., Ribnicky, D. M., Rogers, R. C., Hermann, G. E. Artemisia santolinifolia enhances glutamatergic neurotransmission in the nucleus of the solitary tract. Neurosci Lett. 582, 115-119 (2014).
- Dergacheva, O., Boychuk, C. R., Mendelowitz, D. Developmental changes in GABAergic neurotransmission to presympathetic and cardiac parasympathetic neurons in the brainstem. J Neurophysiol. 110 (3), 672-679 (2013).
- Dergacheva, O. Chronic intermittent hypoxia alters neurotransmission from lateral paragigantocellular nucleus to parasympathetic cardiac neurons in the brain stem. J Neurophysiol. 113 (1), 380-389 (2015).
- Dyavanapalli, J., et al. Chronic intermittent hypoxia-hypercapnia blunts heart rate responses and alters neurotransmission to cardiac vagal neurons. J Physiol. 592, 2799-2811 (2014).
- Apostolides, P. F., Trussell, L. O. Regulation of interneuron excitability by gap junction coupling with principal cells. Nat Neurosci. 16 (12), 1764-1772 (2013).
- Graziane, N. M., Polter, A. M., Briand, L. A., Pierce, R. C., Kauer, J. A. Kappa opioid receptors regulate stress-induced cocaine seeking and synaptic plasticity. Neuron. 77 (5), 942-954 (2013).
- Ferando, I., Mody, I. In vitro gamma oscillations following partial and complete ablation of delta subunit-containing GABAA receptors from parvalbumin interneurons. Neuropharmacology. 88, 91-98 (2015).
- Foster, D. J., et al. M5 receptor activation produces opposing physiological outcomes in dopamine neurons depending on the receptor's location. J Neurosci. 34 (9), 3253-3262 (2014).
- Engle, S. E., Broderick, H. J., Drenan, R. M. Local application of drugs to study nicotinic acetylcholine receptor function in mouse brain slices. J Vis Exp. (68), e50034 (2012).
- Wang, L., et al. Temporal components of cholinergic terminal to dopaminergic terminal transmission in dorsal striatum slices of mice. J Physiol. 592, 3559-3576 (2014).
- Holloway, B. B., et al. Monosynaptic glutamatergic activation of locus coeruleus and other lower brainstem noradrenergic neurons by the C1 cells in mice. J Neurosci. 33 (48), 18792-18805 (2013).
- DePuy, S. D., et al. Glutamatergic neurotransmission between the C1 neurons and the parasympathetic preganglionic neurons of the dorsal motor nucleus of the vagus. J Neurosci. 33 (4), 1486-1497 (2013).
- Abbott, S. B., Holloway, B. B., Viar, K. E., Guyenet, P. G. Vesicular glutamate transporter 2 is required for the respiratory and parasympathetic activation produced by optogenetic stimulation of catecholaminergic neurons in the rostral ventrolateral medulla of mice in vivo. Eur J Neurosci. 39 (1), 98-106 (2014).
- Dergacheva, O., Dyavanapalli, J., Pinol, R. A., Mendelowitz, D. Chronic intermittent hypoxia and hypercapnia inhibit the hypothalamic paraventricular nucleus neurotransmission to parasympathetic cardiac neurons in the brain stem. Hypertension. 64 (3), 597-603 (2014).
- Chen, Q., et al. Imaging neural activity using Thy1-GCaMP transgenic mice. Neuron. 76 (2), 297-308 (2012).
- Luongo, F. H., Horn, M. E. Sohal V.S. Putative microcircuit-level substrates for attention are disrupted in mouse models of autism. Biological Psychiatry. 79 (8), 667-675 (2016).
- Vance, K. M., Rogers, R. C., Hermann, G. E. PAR1-activated astrocytes in the nucleus of the solitary tract stimulate adjacent neurons via NMDA receptors. J Neurosci. 35 (2), 776-785 (2015).
- Feliciano, P., Andrade, R., Bykhovskaia, M. Synapsin II and Rab3a cooperate in the regulation of epileptic and synaptic activity in the CA1 region of the hippocampus. J Neurosci. 33 (46), 18319-18330 (2013).
- Tomioka, N. H., et al. Elfn1 recruits presynaptic mGluR7 in trans and its loss results in seizures. Nat Commun. 5, 4501 (2014).
- Jiang, X., et al. Principles of connectivity among morphologically defined cell types in adult neocortex. Science. 350 (6264), 9462 (2015).
- Mishra, A., et al. Imaging pericytes and capillary diameter in brain slices and isolated retinae. Nat Protoc. 9 (2), 323-336 (2014).
- Gabriel, L. R., Wu, S., Melikian, H. E. Brain slice biotinylation: an ex vivo approach to measure region-specific plasma membrane protein trafficking in adult neurons. J Vis Exp. (86), (2014).
- Edwards, F. A., Konnerth, A. Patch-clamping cells in sliced tissue preparations. Methods Enzymol. 207, 208-222 (1992).
- Qi, G., Radnikow, G., Feldmeyer, D. Electrophysiological and morphological characterization of neuronal microcircuits in acute brain slices using paired patch-clamp recordings. J Vis Exp. (95), e52358 (2015).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. J Vis Exp. (91), e51706 (2014).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 13 (1), 133-140 (2010).
- Hille, B. The permeability of the sodium channel to organic cations in myelinated nerve. J Gen Physiol. 58 (6), 599-619 (1971).
- Martin, M., Chen, B. T., Hopf, F. W., Bowers, M. S., Bonci, A. Cocaine self-administration selectively abolishes LTD in the core of the nucleus accumbens. Nat Neurosci. 9 (7), 868-869 (2006).
- Chen, B. T., et al. Cocaine but not natural reward self-administration nor passive cocaine infusion produces persistent LTP in the VTA. Neuron. 59 (2), 288-297 (2008).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。