Voorbereiding van Acute hersenen segmenten met behulp van een geoptimaliseerde N-Methyl-D-glucamine beschermende herstelmethode
* These authors contributed equally
In This Article
Summary
Dit protocol laat zien op de uitvoering van een geoptimaliseerde N-methyl-D-glucamine (NMDG) beschermende herstelmethode van hersenen segment voorbereiding. Een formulering van één medium wordt gebruikt om op betrouwbare wijze het verkrijgen van gezonde hersenen segmenten van dieren van alle leeftijden en voor diverse experimentele toepassingen.
Abstract
Dit protocol is een praktische gids voor de N-methyl-D-glucamine (NMDG) beschermende herstelmethode van hersenen segment voorbereiding. Talrijke recente studies hebben het nut van deze methode voor het verbeteren van de neuronale behoud en algehele hersenen segment levensvatbaarheid gevalideerd. De tenuitvoerlegging van deze techniek door vroege adopters heeft vergemakkelijkt gedetailleerde onderzoeken hersenfunctie met behulp van uiteenlopende experimentele toepassingen en verspreid over een breed scala van dierlijke leeftijden, hersengebieden en celtypes. Stappen worden beschreven voor het uitvoeren van de beschermende herstel hersenen segment techniek met behulp van een geoptimaliseerde NMDG kunstmatige cerebrospinale vloeistof (aCSF) media formulering en de uitgebreide procedure op betrouwbare wijze het verkrijgen van gezonde hersenen segmenten voor patch klem electrofysiologie. Met deze bijgewerkte aanpak een substantiële verbetering wordt waargenomen in de snelheid en betrouwbaarheid van gigaohm zegel formatie tijdens gerichte patch klem opname van experimenten met behoud van uitstekende neuronale behoud, teneinde uitdagende experimentele toepassingen. Representatieve resultaten zijn voorzien van multi neuron patch klem opname experimenten te assay synaptische verbinding in neocortical hersenen plakjes bereid uit jonge volwassen transgene muizen en volwassen volwassen menselijke neurochirurgische specimens. Bovendien is de geoptimaliseerde NMDG beschermende herstelmethode van het snijden van de hersenen is compatibel met zowel jonge als volwassen dieren, dus het oplossen van een beperking van de oorspronkelijke methode. Kortom, kunnen een één medium formulering en hersenen snijden procedure worden geïmplementeerd in verschillende soorten en leeftijden om uitstekende levensvatbaarheid en weefsel behoud.
Introduction
De acute hersenen segment voorbereiding is een essentiële experimentele modelsysteem in de neurowetenschappen. Voor ongeveer de helft van een eeuw heeft dit platform dynamische functionele studies van de levende hersenen over een breed scala aan anatomische hersengebieden en diersoorten. Of de beoogde toepassing biochemie, functionele beeldvorming, morfologie of electrofysiologie is, is het van het grootste belang om optimale integriteit en de levensvatbaarheid van het gesneden weefsel. Het is daarom dat de uiterst robuuste jonge knaagdieren hersenen segment voorbereiding (d.w.z., jonger dan postnatale dag 30 voor muizen) de meest aangewezen tot nu toe is geweest. De moeilijkheid in het verkrijgen van voldoende gezonde hersenen plakjes van volwassen volwassene en veroudering van dieren heeft bewezen een formidabele uitdaging voor de meeste en ernstige beperkingen voor de studie van de functionele architectuur van de volwassen hersenen heeft opgelegd. Dit geldt met name voor patch klem opnemen, een techniek die uitstekende morfologische en functionele behoud vereist en is onmisbaar voor het karakteriseren van gedetailleerde intrinsieke en synaptische eigenschappen van geïdentificeerde één neuronen. Voor de afgelopen decennia, hebben de overgrote meerderheid van patch klem electrophysiologists vertrouwd op een 'beschermende snij'-methode met behulp van sacharose-gesubstitueerde lage nb+ aCSF1 voor het voorbereiden van gezonde hersenen segmenten van jonge, en in veel mindere mate, jonge volwassen dieren. Deze methode is gebaseerd op de vooronderstelling dat passieve nb+ -instroom en latere water ingang en cel zwelling tijdens het segment snijden stap is de overheersende belediging die leidt tot slechte voortbestaan van neuronen, met name voor die neuronen gelegen de oppervlakkige lagen die waarschijnlijk direct trauma van de blade-beweging ondersteunen. Echter, de beschermende snij-methode laat nog veel te wensen overlaat voor hersenen segment bereiding op basis van volwassen volwassen dieren ongeacht de formulering van de bijzondere aCSF geïmplementeerd.
Een eenvoudige maar effectieve oplossing voor dit probleem is beschreven van2,3,,4,,5,6 en aangeduid als de ' beschermende ' brain slice herstelmethode. De oorspronkelijke versie van deze methode gebruikt een NMDG-gesubstitueerde aCSF, zoals NMDG werd geïdentificeerd als de meest veelzijdige en effectieve onder verschillende andere kandidaat-natrium ion substituten (met inbegrip van sacharose, glycerol, choline en Tris). De formulering van de media werd verder versterkt door de toevoeging van HEPES bieden sterkere pH7buffer te weerstaan hersenen segment oedeem, evenals de toevoeging van aanvullingen op het tegengaan van de schadelijke effecten van oxidatieve stress (tabel 1). Het werd empirisch bepaald dat een eerste herstel incubatie stap in lage nb+, lage Ca2 +, en hoge Mg2 + NMDG aCSF onmiddellijk na de volwassen hersenen weefsel snijden was noodzakelijk en voldoende zijn voor neuronale verbeterd behoud over een brede waaier van hersengebieden, celtypes, en dierlijke leeftijden3,5,6.
Met name kunnen vroegere incarnaties van wat nu de beschermende herstelmethode is gesynchroniseerd worden gevonden in de literatuur1,8,9,10,11,,12, 13, hoewel de mogelijkheden voor oudere volwassene en veroudering van dierlijke hersenen segment en patch klem opname was niet herkend of aangetoond in deze eerdere werken. Bovendien blijven de genuanceerde procedurele variaties ontstaan ter ondersteuning van specifieke experimentele toepassingen4,14,15,16. Het collectieve orgaan van het werk van deze talrijke onderzoeksgroepen imparts hoog vertrouwen in de robuustheid van de beschermende herstelmethode voor verbeterde weefsel behoud. De NMDG beschermende herstelmethode is nu wijd goedgekeurd en geïmplementeerd in talrijke gepubliceerde onderzoeken met behulp van volwassen dier hersenen segment preparaten. Deze acute segment studies omvatten neocortical3,17,18, hippocampal15,19,20,21, striatale22 , 23 , 24, veroorzaakt25,26,27,28,29, en hindbrain30,31,32, 33 , 34 regio's, en diverse soorten neurotransmitter en neuromodulator met inbegrip van glutamaterge4,30, GABAergic18,20,31,35 ,36, Dopaminerge24,29,37,38, cholinerge14,37,38, 39, noradrenergic40, en serotonerge27,28 transmissie. De methode is ook geschikt voor optogenetic controle van neuronale activiteit in plakjes afgeleid van transgene dieren3,39 of na in vivo virale injecties17,27, 28,40,41,42,43, als goed zo functioneel Ca2 + beeldvorming van neuronale activiteit2,44 ,45,46. Analyses van zowel de korte termijn plasticiteit4,47,48 en de verschillende vormen van langdurige plasticiteit16,-35,48 geweest gemeld. Een recente studie toegepast de NMDG beschermende herstelmethode om uitgebreide en systematische sonderen van synaptische verbinding in de visuele cortex in volwassen volwassen muis hersenen plakjes met behulp van de octopatch configuratie49 opnemen — een krachtige demonstratie van het nut en de degelijkheid van deze methode. De beschermende herstelmethode is zelfs met succes toegepast in eerder onvoorziene experimentele contexten, zoals verbeterde behoud van therapieën en pericytes in volwassen corticale hersenen segmenten50, patch-clamp opnemen vanaf interneuron populaties in 1-1,5 jaar oud van Alzheimer muis modellen20, en een met mensenhandel assay van volwassen hersenen segment receptor51getransplanteerd.
Het volgende protocol worden stapsgewijze procedures voor de uitvoering van een geoptimaliseerde NMDG beschermende herstelmethode van hersenen segment voorbereiding ter verbetering van de levensvatbaarheid van acute hersenen segmenten beschreven. De beginselen voor betere neuronale behoud worden besproken, evenals de demonstratie van de duidelijke voordelen van deze methodologie voor complexe multi neuron patch klem opnemen van experimenten in zowel jonge volwassen transgene muis hersenen segmenten en volwassen volwassene neurochirurgische hersenen segmenten. Het volgende protocol is gevalideerd voor muizen van 21 dagen oud tot meer dan één jaar oud, ook wat betreft menselijke neurochirurgische specimens afgeleid van volwassen patiënten.
Protocol
Procedures waarbij transgene muizen zijn goedgekeurd door de institutionele Animal Care en gebruik Comité (IACUC) bij het Instituut van Allen voor hersenonderzoek. Zowel mannelijke als vrouwelijke C57BL/6 muizen (gewicht bereik 10-30 g) werden gebruikt in deze experimenten. Aantal representatieve resultaten beschrijven de gegevens verzameld uit levende menselijke hersenen segmenten. Neocortical weefsel specimens werden verkregen tijdens gaven voor het verwijderen van de tumor. Het was noodzakelijk om het verwijderen van het bovenliggende neocortical weefsel voor toegang tot het zieke weefsel. Geïnformeerde patiënt toestemming was verkregen in alle gevallen voor het gebruik van neurochirurgische weefsel voor onderzoek onder een protocol dat is goedgekeurd door de board van de institutionele beoordeling van Zweeds Medical Center.
1. voorbereiding van de Media en reagentia (tabel 1)
Opmerking: Oplossingen moeten worden aangelengd met gezuiverde water dat vrij is van metaalsporen en andere onzuiverheden. Het is aanbevolen dat oplossingen worden vers gemaakt op de dag van het experiment, hoewel ongebruikte oplossingen kunnen bij 4 ° C voor maximaal 1 week worden bewaard indien gewenst. 1 L van elke formulering die hierboven is voldoende voor 1 – 2 snijden procedures. Alle aCSF oplossingen moeten vóór gebruik om stabiele pH buffering en adequate oxygenatie worden verzadigd met carbogen (95% O2/5% CO2). De pH van alle oplossingen moet worden aangepast aan 7.3-7.4 en de osmolaliteit gemeten en aangepast aan de 300-310 mOsmol/kg.
- Bereiden NMDG-HEPES aCSF (in mM): 92 NMDG, 2.5 KCl, 1,25 NaH2PO4, 30 NaHCO3, 20 HEPES, 25 glucose, 2 thioureum, 5 NB-ascorbaat, 3 nb-pyruvaat, 0.5 CaCl2·2H2O en 10 MgSO4·7H2O. Titrate pH 7,3 –7.4 met 17 mL +/-5 M zoutzuur 0,5 mL.
Opmerking: Deze stap van de titratie moet idealiter worden uitgevoerd voordat het prestatiemeteritembestand van divalente kationen om te voorkomen dat neerslag; echter, de neerslag kan worden omgekeerd op aanpassing van de pH aan het fysiologische bereik. - Bereiden HEPES bedrijf aCSF (in mM): 92 NaCl, 2,5 KCl, 1,25 NaH2PO4, 30 NaHCO3, 20 HEPES, 25 glucose, 2 thioureum, 5 NB-ascorbaat, 3 nb-pyruvaat,2·2H, 2 CaCl2O en 2 MgSO4·7H2O. Titrate pH aan 7.3-7.4 met enkele druppels geconcentreerd 10 N NaOH.
- Voorbereiding van opname aCSF (in mM): 124 NaCl, 2,5 KCl, 1,25 NaH2PO424 NaHCO3, 12,5 glucose, 5 HEPES,2·2H, 2 CaCl2O en 2 MgSO4·7H2O. Titrate pH aan 7.3-7.4 met een paar druppels geconcentreerd 10 N NaOH.
- Bereid nb+ spike-in-oplossing (2 M): 580 mg NaCl opgelost in 5 mL vers bereide NMDG-HEPES-aCSF. Dit is genoeg oplossing voor één hersenen segment prep.
- Bereiden van 2% agarose moet worden gebruikt voor het insluiten van weefsel. Los 2 g agarose type 1B (Zie Tabel van materialen) in 100 mL 1 x PBS en magnetron tot gewoon koken. Wervelen om te mengen, dan giet het mengsel in een steriele 10 cm petrischalen en laat het stollen. De plaat agarose bewaren in een afgesloten plastic zak bij 4 ° C tot gebruik.
- Injecteerbare verdoving werkt stamoplossing bereid. Meng 2,5 g van 2,2,2-Tribromoethanol met 2-methyl-2-butanol 5 mL en Los vervolgens geleidelijk in 200 mL PBS, pH 7.0-7.3. Filteren van de stockoplossing met een 0,22 µm filter vóór gebruik en bewaren bij 4 ° C beschermd tegen licht.
Opmerking: Raadpleeg respectieve dierlijke gebruik Comité richtlijnen en regels voor de bepaling van de vervaldatum en verwijdering procedure voor de verdoving werkt stamoplossing.
2. installatie van de segmenteringshulplijnen Station
- De segmenteringshulplijnen station instellen met het weefsel slicer machine en chirurgische instrumenten (Zie Tabel van materialen). Kalibreren van de slicer machine, een zirkonium keramische injector mes hechten aan de arm van de mes met behulp van snel-Lijm lijm, vervolgens de monsterhouder invoegen en uitlijnen van de voorrand van het blad aan het specimen houder rim verlaten van een klein gat om ervoor te zorgen het mes niet schrapen het metaal.
Opmerking: Als het mes-rand niet fysiek is beschadigd het kan worden hergebruikt voor vele weken of zelfs maanden zonder teruglegging. Verschillende weefsel slicer modellen commercieel beschikbaar zijn, waarvan vele bieden uitstekende prestaties wanneer optimaal gekalibreerd. Het ideale instrument moeten minimale z-as afbuiging, ofwel rechtstreeks gemeten en afgestemd of empirisch waargenomen. - Een 250 mL-bekerglas gevuld met 200 mL NMDG-HEPES aCSF en pre chill op ijs met constante carbogenation (toegepast wisselexemplaar een gas diffuser steen ondergedompeld in de media) voor instellen > 10 min.
Opmerking: Deze oplossing zal worden gebruikt voor de transcardial perfusie en voor het vullen van het reservoir machine snijden tijdens het segmenteren. - Instellen van de eerste hersenen segment herstel kamer gevuld met 150 mL NMDG-HEPES aCSF (handhaven constante carbogenation) en plaats van de kamer in een verwarmd waterbad gehandhaafd op 32-34 ° C.
Opmerking: Een kamer van het segment na het ontwerp van Edwards en Konnerth (1992)52 wordt aanbevolen voor deze stap. Deze kamers kunnen worden gemaakt met beschikbaar laboratorium items (bekerglas van 250 mL, nylon mesh verrekening, conische tube van 50 mL, 35 mm kunststof ronde schotel). Zorg moet men zich ervan vergewissen dat het segment verrekening blijft vrij van lucht bubbels, met name die voortdurend geproduceerd door de carbogen gas zeepbel stenen als deze segmenten te zweven omhoog en beschadigd kunnen veroorzaken. De verrekening moet worden ondergedompeld ongeveer 1 cm onder het vloeistofoppervlak. - Instellen van een segment van de hersenen houden kamer; een ontwerp met meerdere onafhankelijke putten in een groter reservoir wordt aanbevolen (Zie Tabel van materialen). Vul het reservoir met 450 mL HEPES aCSF en warm tot kamertemperatuur onder constante carbogenation tot gebruik.
Opmerking: De segmenten van de hersenen zal worden overgedragen van de terugwinning van de eerste kamer naar deze vergaderzaal voor langdurige opslag vóór elektrofysiologische opname. Zorg moet men zich ervan vergewissen dat het segment verrekening blijft vrij van luchtbellen te allen tijde. - Gesmolten agarose voorbereiden voor het insluiten van weefsel. Gebruik het open uiteinde van een flacon 50 mL conische als een cookie cutter te snijden uit een blok van 2% agarose uit de eerder bereid schotel. Losjes cap de conische flacon en magnetron voor 10-30-s tot de agarose is net gesmolten. Niet oververhit raken.
- Giet de gesmolten agarose in 1,5 mL tubes. Het handhaven van het agarose gesmolten met behulp van een thermomixer ingesteld op 42 ° C met krachtig schudden. Zorgvuldig zorgen ervoor dat de gesmolten agarose niet voortijdig doet stollen.
- Plaats de accessoire koelen blok voor de slicer op ijs vooraf afkoelen op dit moment.
3. de Transcardial perfusie
Opmerking: De transcardial perfusie-procedure is een belangrijke stap bij het werken met de volwassen dieren is het belangrijk om snelle koeling van de hersenen en vertraagd metabolisme via hersenen infusie van lage nb+, lage Ca2 +/ hoge Mg2 + aCSF oplossing. De transcardial perfusie serveert ook rode bloedcellen van hersenen therapieën, waardoor autofluorescence die kan interfereren met de visualisatie en doelgerichtheid van fluorescently geëtiketteerde cel populaties in transgene lijnen wissen. Het is niet aan te raden om het weglaten van transcardial perfusie.
- Diep anesthetize muizen door intraperitoneale injectie van verdoving werken stockoplossing (250 mg / kg: 0,2 mL van 1,25% verdoving werkt stockoplossing per 10 g lichaamsgewicht, zie de Tabel van de materialen). Na ~ 2-3 min, controleert u of voldoende diepte van verdoving door beoordeling van Teen snuifje reflex. Indien nodig, injecteren van een extra volume van verdoving werken materieel en herwaarderen van Teen snuifje reflex na een ander 2-3 min.
- Een 30 mL injectiespuit met 25 mL van carbogenated NMDG-HEPES aCSF laden vanuit het vooraf gekoeld 250 mL-bekerglas (2-4 ° C is optimaal, in tegenstelling tot slikkerig of bevroren oplossing). Bevestig een naald 25 5/8 maat.
- Pin met de muis op de rug, de forepaws en de achterste poten voor stabiliteit. Een 15 cm glas petrischaal gevuld met verharde siliconen werken goed als basis.
- Met behulp van een scalpel, maken een laterale incisie te openen van de borstholte op het niveau van het middenrif. Gebruik fijn schaar te snijden via de ribbenkast op ofwel zijde verzorgen om te voorkomen dat het knippen van het hart en de longen.
- PIN terug het middengedeelte van de ribbenkast het hart bloot te stellen. Plaats de naald van de spuit 30 mL in het linkerventrikel en snijd het juiste atrium met een fijne schaar om bloed naar het hart sluiten.
- Druk de plunjer van de injectiespuit met behulp van handmatige constante druk en perfuse van het dier met de gekoelde NMDG-HEPES-aCSF tegen een tarief van ~ 10 mL/min.
Opmerking: Als de perfusie succesvol is de lever zal veranderen van kleur van diep rood tot lichtgeel, en in sommige gevallen duidelijk vloeistoffen kunnen worden waargenomen verlaten de neusgaten tegen het einde van de procedure.
4. brain dissectie en snijden
- Decapitate het dier. Gebruik een scalpel bloot van het GLB van de schedel te openen van de huid op het hoofd.
- Gebruik fijn Super gesneden schaar te knippen weg de huid over het GLB schedel en maak kleine insnijdingen lateraal aan weerszijden op de caudal/ventrale basis van de schedel. Maken extra ondiepe bezuinigingen basisgewicht van het caudal/dorsale aspect van de schedel in de rostraal richting omhoog de dorsale middellijn verzorgen niet om de onderliggende hersenen beschadigen. Maken van een finale 'T' loodrecht op de middellijn gesneden op het niveau van de bulbus bollen.
Opmerking: Zorg moet worden genomen om ervoor te zorgen dat geen schade wordt toegebracht aan de hersenen regio('s) van belang. In het bijzonder, op geen enkel moment moet er een drukkracht toegepast op de hersenen zelf. - Gebruik de ronde-tip verlostang schil terug naar de caudal-laterale richting te begrijpen van de schedel basisgewicht van de rostraal-mediale aspect. Herhaal dit voor beide zijden te kraken open en verwijder de dorsale helften van het GLB van de schedel aan het blootstellen van de hersenen. Schep voorzichtig de intact hersenen af in het bekerglas van vooraf gekoeld NMDG-HEPES-aCSF. Toestaan dat de hersenen te koelen uniform ~ 1 min.
- Gebruik de grote spatel tot opheffing van de hersenen uit het bekerglas en op de petrischaal bedekt met filtreerpapier. Trim en blokkeren de hersenen volgens de gewenste hoek van het snijden en gewenste hersenen regio van belang. Werk snel om te voorkomen dat langdurige zuurstof ontbering tijdens de behandeling.
Opmerking: Veel snijden hoeken zijn mogelijk. De exacte blokkerende methode en snijden hoek hangt af van de exacte hersenen regio celtype en circuit worden bestudeerd. - Het blok van de hersenen naar de monsterhouder met behulp van lijm lijm aanbrengen. Het binnenste stuk van de monsterhouder genoeg te trekken van de hersenen blok volledig binnen worden ingetrokken. Giet de gesmolten agarose rechtstreeks in de houder totdat het blok van de hersenen volledig met agarose bedekt is. Klem het vooraf gekoelde accessoire koelen blok rond de monsterhouder voor ~ 10 s totdat de agarose heeft verhard.
- De monsterhouder in het recipiënt op de machine van de slicer invoegen en controleer of de juiste uitlijning. Vul het reservoir met resterende vooraf gekoeld, zuurstofrijk NMDG-HEPES-aCSF van het bekerglas van 250 mL en een bubble steen verplaatsen in het reservoir voor de duur van het snijden zodat adequate oxygenatie.
- Pas de micrometer om te beginnen met het bevorderen van het agarose-embedded hersenen model. Start de slicer en empirisch het aanpassen van het voorschot snelheid en trilling de frequentie naar het gewenste niveau.
Opmerking: Beide instellingen moeten zich in het basissegment situeerde. Voor het beste resultaat een honkslag doorgeven van de blade-arm moeten nemen ongeveer 20 s en de trilling moet produceren een zeer soepel en zacht zoemend geluid met geen openlijke krijsend. - Blijven bevorderen en segmentering van het weefsel in stappen van 300 µm (of andere gewenste dikte) tot de regio van de hersenen van belang is volledig gesegmenteerd; de totale tijd voor het snijden procedure moet minder dan 15 min.
5. geoptimaliseerde NMDG beschermende invorderingsprocedure
- Eerste NMDG herstelstap (kritieke stap): na voltooiing van de vectorafbeeldingsbestanden procedure, verzamelen van alle segmenten met een licht-donkerscheiding kunststof Pasteur pijp t en ze vervolgens overbrengen naar een voorverwarmde (34 ° C) herstel van de eerste kamer gevuld met 150 mL NMDG-HEPES aCSF. Breng alle segmenten in korte opeenvolging en een timer start, zodra alle segmenten worden verplaatst naar de zaal van herstel.
- Raadpleeg tabel 2 om te bepalen van de optimale nb+ spike-in de planning volgens de leeftijd van de muis.
Opmerking: Deze procedure is een praktische methode om een gecontroleerde snelheid van de herinvoering van nb+ in de hersenen segment kamer en is geoptimaliseerd voor een specifiek segment kamer geometrie en reservoir hersenvolume en type (Zie Tabel van materialen). - De stapsgewijze nb+ spike-in procedure uit te voeren door toevoeging van de aangegeven hoeveelheid nb+ spike-in oplossing aan de aangegeven tijden. Voeg de nb+ spike-in oplossing direct in de schoorsteen van de bubbler van de terugwinning van de eerste kamer om snelle mengen.
- Alle segmenten overbrengen in de HEPES aCSF op lange termijn bedrijf kamer op kamer temperatuur gehouden. Toestaan segmenten te herstellen voor een extra 1 h in de HEPES kamer alvorens aan te vangen patch klem opname experimenten te houden.
6. Patch klem opname
Opmerking: De volgende elementaire procedures alleen bieden enkele praktische overwegingen en zijn niet bedoeld voor het vertegenwoordigen van gedetailleerde protocollen voor patch klem opnamen, zoals deze kunnen worden gevonden elders53,54. Een patch klem electrofysiologie tuig is vereist voor deze toepassing. Dit zal in het algemeen bestaan uit een rechtop Microscoop uitgerust met infrarood differentiële interferentie contrast (IR-DIC) optica en een fluorescentie verlichting systeem, een patch klem versterker en gegevens digitizer, gemotoriseerde micromanipulator en Microscoop platform, vibratie isolatie tabel kooi van Faraday en oplossing verwarming en perfusie systeem. De monsterkamer en platform moeten worden ontworpen voor verzonken segment opname. Voor meerdere neuron patch klem opnames is een tuig uitgerust met meerdere versterkers, hoofd stadia en hoge kwaliteit micromanipulators vereist. Daarnaast voor de beste resultaten een tuig is voorzien van een 900 nm IR band pass filter en bijpassende optische componenten wordt sterk aangeraden om voldoende visualisatie van de cellen gelegen > 50 µm diep in de hersenen-segmenten. Juiste uitlijning voor Kӧhler verlichting is ook belangrijk voor duidelijke visualisatie.
- Bereiden van intracellulaire Pipetteer oplossing (in mM): 130 K-gluconaat, 4 KCl 10 HEPES, 0.3 EGTA, 10 phosphocreatine-Na2, 4 MgATP, 0.3 nb2-GTP en 13.4 biocytin. PH 7,35 met 1 M KOH en de osmolaliteit tot 285 – 290 mOsmol/kg met behulp van sacharose desgewenst aanpassen.
- Voorbereiden patch klem elektroden van borosilicaatglas dikwandige haarvaten; de ideale patch klem elektrode heeft een relatief korte en stompe taper met een ~ 3 – 6 MOhm gevuld tip weerstand in het bad.
- Ervoor zorgen dat de zilveren elektrode draden goed chlorided met het oog op een stabiele opnamen. Hiervoor (typische) door dompelen de laatste 3-4 mm van het zilver draad in bleekwater gedurende ongeveer 30 min of totdat de draad zwart.
- Tot stand brengen oplossing perfusie gebruik een peristaltische pomp ingesteld op 3-4 mL/min. Circulate carbogenated opname van aCSF door de kamer van de opname verzorgen aan instroom en uitstroom te vermijden overloop.
- Pipetteer een enkele hersenen-segment in de onderdompeling opname kamer en veilig oversteken in plaats met behulp van een U-vormige segment anker met nylon snaren. Identificeer de doel hersenen regio met behulp van een 4 X lucht doelstelling alvorens over te schakelen naar een hogere macht doelstelling (bijvoorbeeldhoge numerieke diafragma X 40 of 60 X water onderdompeling doelstellingen).
- Visueel identificeren een gezonde cel. Het uiterlijk van de neuronale membraan op de soma, wordt zoals gevisualiseerd door IR-DIC microscopie, gebruikt voor het beoordelen van de geschiktheid van een kandidaat-cel voor patch klem opname.
Opmerking: Gezonde neuronen vertonen doorgaans de volgende kenmerken: ineengekrompen noch gezwollen waarin, zachte contrast van membraan randen en soepel membraan verschijning. Daarnaast bevindt zich de meerderheid van de gezonde cellen > 30 µm diep in het segment, zoals oppervlakkige neuronen dreigen te worden beschadigd met afgehakte dendritische processen. Neuronen die een geplisseerd verschijning, duidelijk zichtbaar kernen 'gebakken ei' uiterlijk en/of zeer donkere of hoog contrast membraan randen vertonen moeten worden vermeden. - Back-fill de patch Pipetteer met ~ 5 µL van intracellulaire oplossing en het laden op de elektrode-houder. De pipet verplaatsen in het bad van de opname boven het segment van de hersenen en licht positieve druk om eventuele obstakels in de tip van toepassing. Nul van de verschuiving van de pipet en de weerstand van de tip met een membraan test functie te controleren.
- Verplaatsen van het uiteinde van de pipet in contact met de doelgroep neuron de cel lichaam; een klein kuiltje moet vormen op het oppervlak van de membraan als gevolg van de lichte overdruk.
- Zodra een kuiltje membraan wordt waargenomen, snel verwijderen van de overdruk en zachte afzuigen om zegel vorming. Zodra de pipet weerstand neemt toe tot > 100 MOhm, inschakelen van de opdracht van een bedrijf tot een niveau dat overeenkomt met de verwachte rust membraan potentieel voor de gerichte celtype (-70 mV is een goed uitgangspunt).
- Zodra de tip weerstand ≥1 gigaohm bereikt, proberen te breken in de cel door bezwijken van het membraan onder de patch Pipetteer met behulp van korte aanvallen van scherpe zuigkracht; de 'zappen'-functie kan worden gebruikt om de inbraak zo nodig.
Opmerking: Een bedrijf potentieel van-70 mV wordt voorgesteld voor spanning klem experimenten op corticale neuronen. Gezonde neuronen zal hebben een lek huidige niet meer negatieve dan-100 pA voor de duur van het experiment, maar dit is gedeeltelijk afhankelijk van het celtype. Een neuron zouden worden uitgesloten van de analyse als de rustpotentiaal membraan meer depolarized dan -50 was mV, of als de weerstand toegang gewijzigd door meer dan 20%. -
Zodra een stabiel geheel-cel patch klem opname is verkregen, moet u extra neuronen voor opname doel herhaalt u stappen 6.6-6.10. Zorg om mechanische storingen die resulteren zou in het verliezen van de eerste opname.
- Selecteer extra neuronen binnen 100 µm van het eerste neuron om een redelijke waarschijnlijkheid van het vinden van synaptically-coupled neuronen.
Opmerking: Het nuttig kan zijn in sommige gevallen te identificeren van meerdere kandidaat-neuronen vooraan te pre-load en vooraf alle pipetten in de buurt naar de verschillende gerichte cellen plaats voordat de eerste opname van de patch klem.
- Selecteer extra neuronen binnen 100 µm van het eerste neuron om een redelijke waarschijnlijkheid van het vinden van synaptically-coupled neuronen.
Representative Results
Deze sectie bevat representatieve resultaten voor routinematige hersenen segment voorbereiding en patch klem electrofysiologie experimenten met behulp van de geoptimaliseerde NMDG beschermende herstelmethode (d.w.z., NMDG beschermende recovery gecombineerd met geleidelijke nb+ Spike-procedure). Eerste, morfologische behoud van neuronen werd beoordeeld in verschillende hersengebieden hersenen segmenten bereid met of zonder de uitvoering van de geoptimaliseerde NMDG beschermende herstelmethode (Figuur 1). Drie maand oud volwassen muizen werden geselecteerd voor deze experimenten, en we IR-DIC microscopie gebruikt om te bepalen van neuron gezondheid op basis van de vorm en het algehele uiterlijk van de waarin en de proximale dendrites. Let op de vormgeving van het verschrompelde, pyknotische van de meeste neuronen in de representatieve beelden van hersenen segmenten bereid zonder de beschermende herstelmethode (alle beelden werden verkregen 1-2 h na segment voorbereiding). Deze controle segmenten waren bereid met behulp van NMDG aCSF voor transcardial perfusie en snijden stappen maar aanvankelijk werden teruggevonden in hoge nb+-met HEPES aCSF. In tegenstelling, onthullen de representatieve beelden van de segmenten die zijn opgesteld in overeenstemming met de geoptimaliseerde NMDG beschermende herstelmethode neuronen met verbeterde morphologies (gladder, voller, minder geplisseerd verschijning) die geschikt zijn voor patch-clamp opname (figuur 1). de verbeterde neuronale behoud werd waargenomen in meerdere hersengebieden II/III en V, subiculum en Dorsale laterale geniculate nucleus (dLGN) met inbegrip van neocortical lagen.
De geoptimaliseerde NMDG beschermende herstelmethode werd vervolgens vergeleken met de oorspronkelijke NMDG beschermende herstelmethode (dat wil zeggen, zonder de geleidelijke nb+ spike-procedure). De gemiddelde tijd voor gigaohm zegel vorming in patch-clamp opname pogingen was dramatisch en aanzienlijk verminderd (9,9 s versus 33,3 s, **p < 0,005, gepaarde t-test) wanneer de geleidelijke nb+ spike-in procedure wordt toegepast samen met de NMDG beschermende herstelstap (Figuur 2). Het membraan van het sneller en betrouwbaarder afdichten tijden sterk verbeterd de doorvoer van patch-clamp opnemen in jonge volwassen hersenen plakjes. De optimale nb+ spike-in de planning is verder bewerkt volgens dierlijke leeftijd (tabel 2) en is gunstig voor alle leeftijden (3 weken tot 1 jaar oude muizen) getest. Het profiel van geleidelijke natrium ion concentratie tot misbruik van bevoegdheden in de loop van de spike-procedure wordt verstrekt (Figuur 3) ter ondersteuning van de schema's in tabel 2aangegeven.
Als onderdeel van het Allen Instituut cel typen programma (http://celltypes.brain-map.org/) een grootschalige inspanning systematisch aan de gang te is karakteriseren de intrinsieke elektrofysiologische eigenschappen van individuele neuronen in jonge volwassene (postnatale dag 40-80) muis visuele corticale hersenen segmenten afgeleid van transgene lijnen met cel type-specifieke fluorescerende marker expressie in genetisch gedefinieerde neuronale populaties (corticale laag en celtype specifieke Cre stuurprogramma lijnen naar een Cre-afhankelijke TL overgestoken verslaggever lijn55). Figuur 4 ziet u voorbeeld sporen van de patronen van de vuren opgenomen van Parvalbumin (Pvalb)-corticale fast-stekelige (FS) interneuronen (Pvalb-IRES-Cre/Ai14 muizen) uiten in antwoord op een reeks van 1 s huidige injectie stappen die betrekking hebben op het dynamisch bereik van neuron afvuren. De F-curve ik voor een dataset van 22 corticale FS interneuronen wordt weergegeven aan de rechterkant. Vergelijkbaar gericht patch klem opname experimenten werden uitgevoerd om te karakteriseren 23 Rorb-uiten excitatory neuronen in laag IV van Rorb-IRES-Cre/Ai14 muizen (Figuur 4). Diverse gezonde neuron vormen, met inbegrip van FS interneuronen en piramidale neuronen in regio's van de corticale lagen kunnen routinematig en betrouwbaar voor patch-clamp opname voor ten minste 6-8 uur na segment voorbereiding using zulks geoptimaliseerd protocol worden gericht.
Naast het meten van intrinsieke neuronale eigenschappen, was synaptic connectiviteit gesondeerd tussen meerdere tegelijk opgenomen neuronen van gedefinieerde typen in visuele corticale micro schakelingen. De klem van de multi neuron patch opname techniek eist bij wijze van uitzondering, zoals talrijke gezonde kandidaat neuronen van bepaalde categorieën aanwezig zijn binnen een relatief klein gebied van het segment van de hersenen moet met het oog op een redelijke kans op het verkrijgen van hoge kwaliteit gelijktijdige opnamen en het identificeren van bona fide synaptic verbindingen. Figuur 5 toont gepaarde opname van twee tdTomato + FS interneuronen in de visuele cortex van de hersenen segmenten afgeleid van jonge volwassen Pvalb-IRES-Cre/Ai14 muizen. Een sterke unidirectionele remmende synaptische verbinding werd ontdekt (opgenomen met hoge chloride interne Pipetteer oplossing). In het volgende voorbeeld opnames en protocollen voor het meten van de eigenschappen van op korte termijn synaptische plasticiteit worden gepresenteerd. Periodes van hoge frequentie trein stimulatie (10 pulsen elke 10, 50 en 100 Hz) werden gevolgd door enkele herstel test pulsen op verschillende tijdstippen (1, 2 of 4 s) voor het meten van het tijdsverloop van terugwinning van synaptic depressie.
Uitstekende succes heeft ook verkregen voor menselijke neocortical neuronen in volwassen volwassen ex vivo de segmenten van de hersenen. Neurochirurgische specimens zijn verkregen van patiënten die een geplande operaties voor verwijdering van de tumor in lokale ziekenhuizen. De procedures voor menselijke neurochirurgische weefsel collectie en hersenen segment voorbereiding oneens met de muis hersenen segment procedures in een paar praktische manieren. Kortom, het resected neocortical weefsel (distale op de site van pathologie) wordt verzameld van de operatiekamer en ondergedompeld in ijskoude zuurstofrijk NMDG-HEPES-aCSF en vervoerd met continue koeling en oxygenatie van de operatiekamer naar de laboratorium binnen 30 minuten of minder. De segmenten van de hersenen zijn opgesteld op basis van de beschermende invorderingsprocedure NMDG en toegestaan om te herstellen voor een langere periode van ongeveer 3 uur voordat de patch klem opnames. Figuur 6 toont een succesvolle gekoppeld opname experiment en een succesvolle vierpersoonskamers patch klem opname experiment van menselijke ex vivo hersenen segmenten voorbereid op deze wijze uit de frontale cortex-regio. De gepaarde opname toont unidirectioneel excitatory synaptic ingang een corticale piramidale neuron op een corticale interneuron (opgenomen als excitatory postsynaptisch stromingen). In de quad patch experimenteren twee excitatory en twee remmende neuronen gelijktijdig werden geregistreerd en drie remmende synaptic verbindingen werden ontdekt (opgenomen als remmende postsynaptisch potentials) uit twaalf totale verbindingen gesondeerd. Dus, deze geoptimaliseerde hersenen segment methodologie betrouwbare experimentele succes in de meest uitdagende van hersenen segment stelt toepassingen in staat, met inbegrip van multi neuron patch klem experimenten om te studeren circuit connectiviteit in acuut gereseceerd volwassen volwassen menselijke hersenen weefsel.
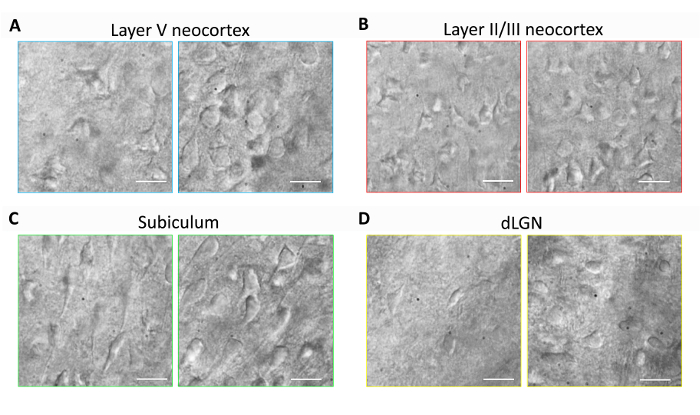
Figuur 1: Verbeterd neuronale behoud met de geoptimaliseerde NMDG beschermende herstelmethode van hersenen segment preparaat. Vertegenwoordiger IR-DIC beelden werden verkregen uit verschillende hersengebieden in acute segmenten van een drie maanden oude muis. Controle NMDG beschermende snij-methode zonder een beschermende herstelstap (linker panelen) versus geoptimaliseerde NMDG beschermende herstelmethode (juiste panelen). (A) laag V van neocortex, (B) laag II/III van neocortex, (C) subiculum en (D) Dorsale laterale geniculate nucleus (dLGN). Schaal bars in alle panelen zijn 20 µm. Klik hier voor een grotere versie van dit cijfer.
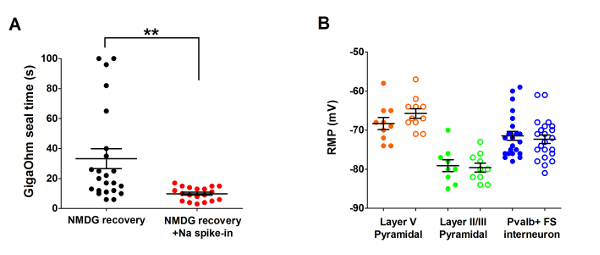
Figuur 2: Snelheid van de versnelde en verbeterde betrouwbaarheid van gigaohm zegel vorming in patch-clamp opname van experimenten met behulp van de beschermende herstelmethode van NMDG nb+ spike-in procedure. (A) Plot van gigaohm zegel formatie tijden voor NMDG herstel alleen (zwarte gegevenspunten, n = 19) versus NMDG herstel plus nb+ spike-in procedure (rode gegevenspunten, n = 23). Alle opgenomen cellen waren piramidale neuronen in laag II/III of deel V van de visuele cortex. Let op, de maximale tijd wordt afgetopt op 100 s ter verantwoording voor cellen die nooit gevormd gigaohm zeehonden. Gepaarde t-test, **p < 0.005. (B) Plot van de rust van de membraanpotentiaal (RMP) voor laag V piramidale neuronen (oranje gegevenspunten, n = 10/11), II/III piramidale neuronen (groene gegevenspunten, n = 9/10), of corticale Pvalb + FS interneuronen (blauwe gegevenspunten, n = 23/22). Gevulde cirkels duiden NMDG recovery voorwaarde en open cirkels NMDG herstel plus nb+ spike-in procedure. Elk gegevenspunt vertegenwoordigt een neuron en zowel het gemiddelde en +/-SEM worden weergegeven. Er zijn geen significante verschillen in RMPs hersenen segment voorbereiding voorwaarden vergelijken voor alle drie typen cel (gepaarde t-test). Klik hier voor een grotere versie van dit cijfer.
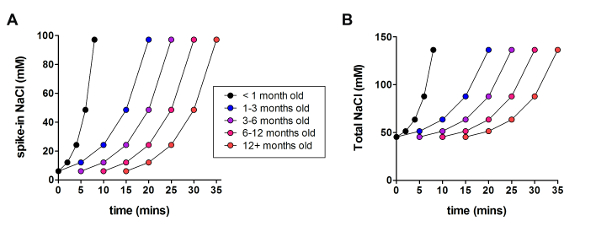
Figuur 3 : Profiel van geleidelijke natrium ion concentratie tot misbruik van bevoegdheden in de loop van de procedure spike. (A) Plot van spike-in de concentratie van de NaCl tegen de tijd. (B) Plot van de totale extracellulaire concentratie van NaCl tegen de tijd. Klik hier voor een grotere versie van dit cijfer.
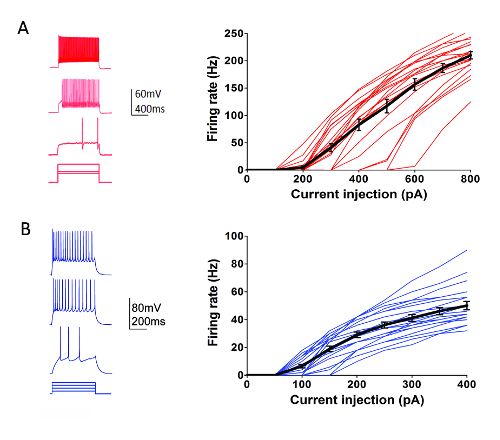
Figuur 4 : Intrinsieke elektrofysiologische eigenschappen van genetisch gedefinieerde corticale celtypes. (A) voorbeeld sporen van neuronale afvuren in reactie op de huidige injectie stappen voor Pvalb + interneuronen corticale FS (linkerdeel). tdTomato + neuronen waren gericht voor opnames in hersenen plakjes van Pvalb-IRES-Cre/Ai14 muizen. Samenvattingsgegevens voor het bakken van de tarief-stroom injectie relatie (F-ik kromme) worden weergegeven aan de rechterkant (n = 22). (B) voorbeeld sporen van neuronale afvuren in reactie op de huidige injectie stappen voor het uitdrukken van Rorb corticale laag IV excitatory neuronen (linkerdeel). tdTomato + neuronen waren gericht voor opnames in hersenen plakjes van Rorb-IRES-Cre/Ai14 muizen. Samenvattingsgegevens voor het bakken van de tarief-stroom injectie relatie (F-ik kromme) worden weergegeven aan de rechterkant (n = 23). Elke dunne gekleurde lijn vertegenwoordigt de F-curve ik voor een enkel neuron; Overwegende dat de dikke zwarte lijnen vertegenwoordigt het gemiddelde voor elke groep +/-SEM. Klik hier voor een grotere versie van dit cijfer.
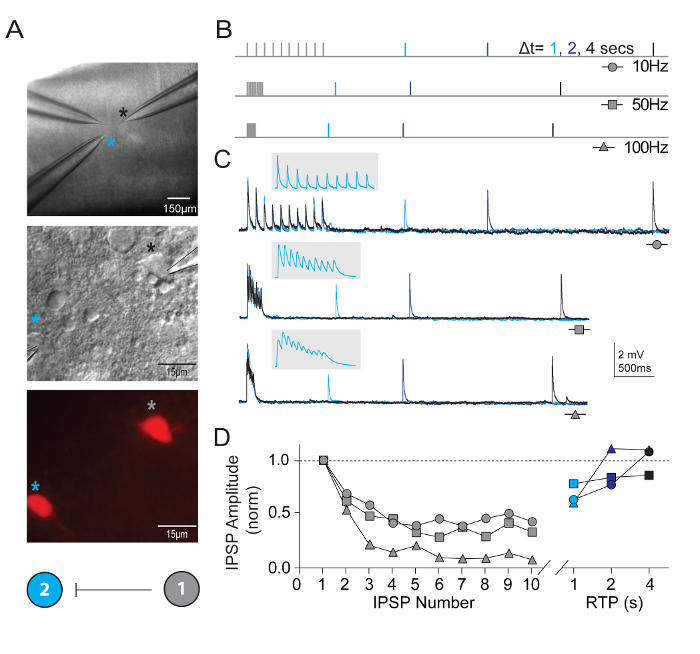
Figuur 5: Op korte termijn plasticiteit in synaptically aangesloten Pvalb-uiten corticale FS interneuronen. (A) differentiële interferentie contrast en epifluorescence werden gebruikt om te richten tdTomato-positief, Pvalb-uiten FS interneuronen van muis primaire visuele cortex. Een kleur gecodeerde schematische connectiviteit diagram aan te tonen een eenzijdige synaptische verbinding tussen de twee interneuronen. (B) Schematische voorstelling van de stimulatie protocollen gebruikt om te beoordelen van de korte-termijndynamiek van synaptically-verbonden neuronen. Treinen van 10 actie potentiaal (10, 50 en 100 Hz) zijn opgeroepen in het presynaptische neuron, gevolgd door een enkele actiepotentiaal (Recovery Test Pulse, RTP) geleverd met verschillende vertraging (1, 2 en 4 s) nadat de trein is beëindigd. Elke RTP zijn kleur gecodeerd voor de duidelijkheid. (C) gemiddelde sporen van overeenkomstige unilaterale remmende post synaptic potentieel (uIPSPs) in cel #2 in reactie op de treinen van de actie potentieel opgeroepen in cel #1. Grijze inzet heeft uitgebreid tijdschaal om aan te tonen van de afbakening van uIPSP trein. (D) Normalized uIPSP amplitudes worden uitgezet als functie van hun standpunt tijdens de treinen op verschillende frequenties. Netto depressie is duidelijk over alle input tarieven met een aanzienlijke herstel van uIPSP bij 4 s. Klik hier voor een grotere versie van dit cijfer.
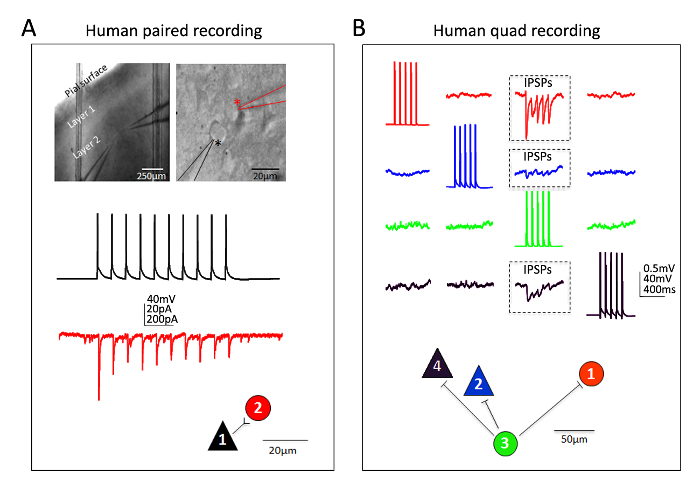
Figuur 6: Multi neuron patch klem opnamen in volwassen mens neurochirurgische brain segmenten. (A) lage en hoge vergroting IR-DIC beelden met vermelding van de locatie en de identiteit van de opgenomen neuronen (bovenste panelen). Een piramidevormige neuron (zwarte sterretje) en de naburige interneuron (rood sterretje) werden gelijktijdig geregistreerd. In het volgende voorbeeld kleurgecodeerde sporen van een unidirectionele excitatory synaptische verbinding (Raadgevend) uit piramidale cel met interneuron (gemeten als EPSCs in spanning klem) en de bijbehorende fysieke verbinding kaart (onderste panelen). (B) Quadruple patch klem opname experiment in een segment van de volwassen menselijke neurochirurgische hersenen van dorsolateral prefrontale cortex. Twee piramidale neuronen en twee interneuronen vastgelegd tegelijk, waardoor voor sequentiële sonderen van twaalf mogelijke synaptic verbindingen. Een trein van evoked potentials van de actie in cel #3 (groen sporen) leidde tot de detectie van remmende post synaptic potentieel (IPSPs) in elk van de andere drie tegelijk opgenomen neuronen (boxed gewesten, top panelen). De reacties van elke individuele neuron opgenomen zijn kleur gecodeerd voor de duidelijkheid. De kaart van de fysieke verbinding wordt weergegeven in het onderste paneel. Opmerking de ruwe sporen weergegeven in (B) vertegenwoordigen de gemiddelden van minstens 20 opeenvolgende onbewerkte gegevens veegt. Vermeende identificatie van celtype was gebaseerd op soma vorm, analyse van de morfologie door fluorescente kleurstof vullen tijdens opnamen en intrinsieke elektrofysiologische eigenschappen met inbegrip van de vuren patronen in antwoord op de huidige injectie stappen. Klik hier voor een grotere versie van dit cijfer.
| NMDG-HEPES-aCSF | HEPES bedrijf aCSF | Opname aCSF | |||||||
| Component | mM | MW | g/Liter | mM | MW | g/Liter | mM | MW | g/Liter |
| NMDG | 92 | 195.22 | 17.96 | ||||||
| HCl | 92 | 36.46 | * | ||||||
| NaCl | 92 | 58.44 | 5.38 | 124 | 58.44 | 7.25 | |||
| KCl | 2.5 | 74.55 | 0.19 | 2.5 | 74.55 | 0.19 | 2.5 | 74.55 | 0.19 |
| NaH2PO4 | 1.2 | 138.00 | 0,17 | 1.2 | 138.00 | 0,17 | 1.2 | 138.00 | 0,17 |
| NaHCO3 | 30 | 84.01 | 2,52 | 30 | 84.01 | 2,52 | 24 | 84.01 | 2.02 |
| HEPES | 20 | 238.31 | 4.77 | 20 | 238.31 | 4.77 | 5 | 238.31 | 1.19 |
| Glucose | 25 | 180.20 | 4,51 | 25 | 180.20 | 4,51 | 12,5 | 180.20 | 2,25 |
| natrium ascorbaat | 5 | 198.00 | 0.99 | 5 | 198.00 | 0.99 | 0 | 198.00 | 0,00 |
| Thioureum | 2 | 76.12 | 0,15 | 2 | 76.12 | 0,15 | 0 | 76.12 | 0,00 |
| natrium pyruvaat | 3 | 110.04 | 0,33 | 3 | 110.04 | 0,33 | 0 | 110.04 | 0,00 |
| MgSO4.7H2O | 10 | 246.48 | 5 mL | 2 | 246.48 | 1 mL | 2 | 246.48 | 1 mL (2M voorraad) |
| CaCl2.2H2O | 0,5 | 147.01 | 0,25 mL | 2 | 147.01 | 1 mL | 2 | 147.01 | 1 mL (2M voorraad) |
| * Titreer pH van NMDG-HEPES aCSF aan 7.3-7.4 met geconcentreerd HCl | |||||||||
| Alle oplossingen moeten in het bereik 300-310 mOsm/Kg | |||||||||
Tabel 1: Media formuleringen.
| Dierlijke leeftijd | |||||
| Tijd (min) * | < 1 maand | 1-3 maanden | 3–6 maanden | 6-12 maanden | 12 + maanden |
| 0 | 250 ΜL | 250 ΜL | |||
| 1 | |||||
| 2 | 250 ΜL | ||||
| 3 | |||||
| 4 | 500 ΜL | ||||
| 5 | 250 ΜL | 250 ΜL | |||
| 6 | 1000 ΜL | ||||
| 7 | |||||
| 8 | 2000 ΜL | ||||
| 9 | |||||
| 10 | overdracht | 500 ΜL | 250 ΜL | 250 ΜL | |
| 11 | |||||
| 12 | |||||
| 13 | |||||
| 14 | |||||
| 15 | 1000 ΜL | 500 ΜL | 250 ΜL | 250 ΜL | |
| 16 | |||||
| 17 | |||||
| 18 | |||||
| 19 | |||||
| 20 | 2000 ΜL | 1000 ΜL | 500 ΜL | 250 ΜL | |
| 21 | |||||
| 22 | |||||
| 23 | |||||
| 24 | |||||
| 25 | overdracht | 2000 ΜL | 1000 ΜL | 500 ΜL | |
| 26 | |||||
| 27 | |||||
| 28 | |||||
| 29 | |||||
| 30 | overdracht | 2.000 ΜL | 1.000 ΜL | ||
| 31 | |||||
| 32 | |||||
| 33 | |||||
| 34 | |||||
| 35 | overdracht | 2.000 ΜL | |||
| 36 | |||||
| 37 | |||||
| 38 | |||||
| 39 | |||||
| 40 | overdracht | ||||
| * Tijd nul is dat de moment segmenten worden overgebracht naar het herstel van de eerste kamer | |||||
Tabel 2: Aanbevolen schema voor geleidelijke nb + spike-in procedure volgens muis leeftijd.
Discussion
Nb + Spike-in verbetert Gigaohm zegel vorming en Patch-Clamp opname van succes
De eerste versie van de beschermende herstelmethode van NMDG werd speciaal ontworpen voor veroudering en volwassen dieren2,5. Sommige vroege adopters hebben ook geprobeerd om te passen deze methode op jonge dierlijke hersenen snijden (dat wil zeggen, muizen < 30 dagen oud). Er heeft echter opgemerkt dat in tegenstelling tot het uitstekende visueel bevestigd neuronale behoud met de NMDG beschermende herstelmethode in deze leeftijdscategorie, gigaohm zegel vorming kan vaak kraam, leiden tot mislukte patch klem opname pogingen. Een hypothese is dat NMDG caties gemakkelijker in juvenile hersenen plakjes ten opzichte van de volwassen hersenen segmenten zitten en zegel vorming belemmeren kunnen; echter gigaohm zeehonden kunnen gemakkelijk vormen terwijl jonge hersenen segmenten zijn volledig ondergedompeld in NMDG aCSF (gegevens niet worden weergegeven), dus met de vermelding dat NMDG aCSF per se is niet belemmeren gigaohm zegel vorming.
De snelle overgang van laag naar hoog nb+ oplossing aan het einde van de eerste hersenen segment herstelstap veroorzaakt schade aan de neuronale membranen en ten van het proces van de vorming van zegel. Dit is intuïtief, gezien het feit dat de overgang van laag naar hoog nb+, koud-te-warm temperatuur, en dramatische verhoging van de Ca2 + naar verhouding Mg2 + gezamenlijk leiden tot een enorme opleving van de spontane activiteit van de synaptische. Deze remmende rebound-fase in de hersenen snijden procedure is waarschijnlijk te spiegelen reperfusie letsel na een ischemische belediging. Dus verder neuronale membraan schade te beperken in de eerste herstelfase die een geleidelijke nb+ spike-procedure is overgenomen waarin de verheffing van nb+ concentratie in de NMDG beschermende herstel incubatie zaal langzaam is en reproducibly verhoogde met precieze timing. Net als in de oorspronkelijke beschermende invorderingsprocedure is de temporele dissociatie van nb+ hoogte van temperatuur en Ca2 +/Mg2 + verhouding hoogte gunstig. Maar daarnaast de nb+ spike-procedure leidt tot kleine incrementele verhoogt in extracellulaire nb+ concentratie over de vroege tijdstippen en forse stijgingen van de richting van de late tijd punten, waardoor het hersenweefsel bieden een kans om beter tegemoet aan de stijgende niveaus van de nb+ . Deze procedure is dat een alternatief voor geleidelijke oplossing uitwisseling gecontroleerd door een perfusie pomp of zwaartekracht infuus lijnen die leiden tot de constante stijgingen van de nb+ niveaus en vereist aandacht voor zowel instroom en uitstroom te vermijden van de overloop van de segment-kamer. Met name in deze nb+ stijgt spike-procedure de osmolaliteit van de oplossing in de zaal segment geleidelijk gedurende enkele minuten voordat de segmenten zijn teruggekeerd naar normale osmolaliteit oplossing, maar dit geen nadelige gevolgen de segment-gezondheid hebben heeft of patch-clamp opname van succes. Een hoge osmolaliteit snijden oplossing is eerder gebruikt voor veroorzaakt segment voorbereidingen om beter behouden dopamine neuronen voor patch klem opnames57,58, aldus aan te tonen dat dit tijdelijke hyperosmolality kan zinvol zijn in sommige contexten.
Door de uitvoering van een geoptimaliseerde procedure combineren de NMDG beschermende herstelmethode en geleidelijke nb+ heeft spike-in stap het nut van deze hersenen segment methodologie uitgebreid tot jonge door volwassen volwassen dier eeuwen heen. Dit bijgewerkte protocol is nu geschikt voor een breed scala van dierlijke leeftijden met behulp van een enkele optimale NMDG aCSF formulering en de procedure. Indien nodig, de nb+ spike-procedure kan worden toegepast met een geleidelijk langer vertraging en/of langzamer tijdsverloop ter verbetering van de levensvatbaarheid van de segmenten van de hersenen van oudere dieren, en we hebben verstrekt een basisgids van aanbevolen spike-in schema's volgens aan dier leeftijd (Zie tabel 2). Terwijl we een fundamenteel kader geschikt voor een breed scala aan toepassingen hebt opgegeven, kunnen aanvullende geavanceerde stappen voor verdere verbetering van de levensvatbaarheid en duurzaamheid van hersenen segmenten van veroudering en volwassen dieren worden onderzocht. Bijvoorbeeld, glutathion restauratie strategieën zijn in dit opzicht bijzonder effectief en kunnen worden toegepast zoals elders beschreven2,6.
Verbetering van de doorvoer voor de aanhouding van experimenten
De analyse van de synaptische verbinding door patch klem opname is een veeleisende toepassing waarvoor uitstekende behoud van zowel de neuronale structuur en de functie met het oog op een hoge betrouwbaarheid van succes. Als het aantal neuronen worden tegelijkertijd geregistreerd stijgt lineair, de technische moeilijkheidsgraad supra-lineair omhoog gaat. Er zijn talrijke mislukking modi, en een van de meest voorkomende oorzaken van mislukkingen is het onvermogen om formulier voldoende gigaohm zeehonden op een of meer van de gerichte cellen. Dit kan dramatisch traag vooruitgang, met name wanneer drie of meer neuronen gelijktijdig moeten worden geregistreerd. Overeenstemming is met het vinden van snellere gigaohm zegel vorming tijd met de geoptimaliseerde NMDG beschermende herstelmethode, er was een aanzienlijke verbetering van het slagingspercentage en de productie van meerdere neuron patch klem opname experimenten met zowel volwassene transgene muis hersenen segmenten en segmenten van de volwassen menselijke neurochirurgische hersenen. De verbeterde efficiëntie is vrijwel zeker toe te schrijven aan zowel de snellere en betrouwbare gigaohm zegel vorming en het verbeterde neuronale behoud van de plakjes met dit protocol. Hoewel dit protocol is gericht op de voordelen expliciet voor patch-clamp opnemen toepassingen, worden vergelijkbare voordelen verwacht voor andere uitdagende experimentele toepassingen waar hersenen segment levensvatbaarheid primordiaal is.
Acknowledgements
Dit werk werd gefinancierd door het Allen Instituut voor hersenonderzoek. De auteurs bedank de Allen Instituut oprichters, Paul G. Allen en Jody Allen, voor hun visie, aanmoediging en ondersteuning. Wij danken ook het Allen Instituut technisch ondersteunend personeel voor het uitvoeren van dierenverzorgers, veehouderij en genotypering.
Materials
| Name | Company | Catalog Number | Comments |
| Compresstome VF-200 | Precisionary Instruments | VF-200 | Vibrating tissue slicer (recommended) |
| N-methyl-D-glucamine | Sigma Aldrich | M2004 | aCSF constituent |
| Sodium Chloride | Sigma Aldrich | S3014 | aCSF constituent |
| Potassium Chloride | Sigma Aldrich | P5405 | aCSF constituent |
| Sodium Phosphate monobasic dihydrate | Sigma Aldrich | 71505 | aCSF constituent |
| Sodium Bicarbonate | Sigma Aldrich | S5761 | aCSF constituent |
| HEPES | Sigma Aldrich | H4034 | aCSF constituent |
| Glucose | Sigma Aldrich | G7021 | aCSF constituent |
| Sodium Ascorbate | Sigma Aldrich | A4034 | aCSF constituent |
| Thiourea | Sigma Aldrich | T8656 | aCSF constituent |
| Sodium pyruvate | Sigma Aldrich | P5280 | aCSF constituent |
| Calcium chloride dihydrate | Sigma Aldrich | C7902 | aCSF constituent |
| Magnesium Sulfate heptahydrate | Sigma Aldrich | M1880 | aCSF constituent |
| 2,2,2-Tribromoethanol | Sigma Aldrich | T48402 | Anesthetic component 1 |
| 2-methyl-2-butanol | Sigma Aldrich | 240486 | Anesthetic component 2 |
| Curved blunt forceps | Fine Science Tools | 11065-07 | Brain dissection tools |
| Fine dissecting scissors (supercut) | Fine Science Tools | 14058-09 | Brain dissection tools |
| Large heavy duty scissors 7'' | Fine Science Tools | 14000-18 | Brain dissection tools |
| Metal spatula | Sigma Aldrich | Z511455-1PAK | Brain dissection tools |
| Razor blades | VWR | 89031-954 | Brain dissection tools |
| Brain Slice Keeper-4 | Automate Scientific | S-BSK4 | brain slice holding chamber |
| nylon netting | Warner Instruments | 64-0198 | For building small slice recovery chambers |
| Pyrex glass beakers (250 mL) | VWR | 89090-434 | For building small slice recovery chambers |
| 35 mm plastic dish, round | VWR | 100488-376 | For building small slice recovery chambers |
| Gas diffuser stones (10 µm) | Sigma Aldrich | 59277 | For constant carbogenation (fine bubbles) |
| Agarose Type I-B | Sigma Aldrich | A0576 | For embedding brain specimens |
| Micro loader tips | Eppendorf | 22491229 | For filling patch clamp electrodes |
| Sylgard | VWR | 102092-312 | For making a custom dissecting platform |
| Hydrochloric acid | Sigma Aldrich | H1758-100ML | For pH adjustment of media |
| Sodium Hydroxide | Sigma Aldrich | 221465-25G | For pH adjustment of media |
| Potassium Hydroxide | Sigma Aldrich | 221473 | For pH adjustment of media |
| Plastic transfer pipets 3 mL graduated | VWR | 89497-676 | For slice transfer |
| Zirconium ceramic injector blades | Cadence Specialty Blades | EF-INZ10 | http://cadenceinc.com/ |
| KG-33 borosilicate glass capillary w/filament | King Glass Company | custom quote | ID: 0.87mm, OD 1.50mm |
| Biocytin | Sigma Aldrich | B4261 | Intern pipette solution |
| Phosphocreatine disodium | Sigma Aldrich | P7936 | Intern pipette solution |
| Potassium Gluconate | Sigma Aldrich | G4500-100G | Intern pipette solution |
| EGTA | Sigma Aldrich | E3889 | Intern pipette solution |
| Mg-ATP | Sigma Aldrich | A9187 | Intern pipette solution |
| Na2-GTP | Sigma Aldrich | 51120 | Intern pipette solution |
| sucrose | Sigma Aldrich | S0389 | Intern pipette solution |
| Heated water bath (2.5L) | VWR | 13491-060 | Miscellaneous |
| Filter paper rounds | VWR | 28456-022 | Miscellaneous |
| Cyanoacrylate glue | Amazon | B000BQRBO6 | Miscellaneous |
| Glass petri dish | VWR | 89000-326 | Miscellaneous |
| 10X Phosphate buffered saline | Sigma Aldrich | P5493 | Miscellaneous |
| 30 mL syringes | VWR | BD302832 | Miscellaneous |
| 1 mL syringes | VWR | BD-309628 | Miscellaneous |
| 25 5/8 gauge needles | VWR | 89219-292 | Miscellaneous |
| Thermomixer (w/1.5 mL tube block) | VWR | 89232-908 | To keep agarose molten |
References
- Aghajanian, G. K., Rasmussen, K. Intracellular studies in the facial nucleus illustrating a simple new method for obtaining viable motoneurons in adult rat brain slices. Synapse. 3 (4), 331-338 (1989).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods Mol Biol. 1183, 221-242 (2014).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nat Methods. 8 (9), 745-752 (2011).
- Peca, J., et al. Shank3 mutant mice display autistic-like behaviours and striatal dysfunction. Nature. 472 (7344), 437-442 (2011).
- Ting, J. T. F., et al. Improved methods for acute brain slice preparation from adult and aging animals. Society for Neuroscience Abstracts. 520, (2011).
- Ting, J. T. F., et al. Improved methods for acute brain slice preparation from adult and aging animals (Part II): Glutathione depletion underlies rapid deterioration of adult brain slices. Society for Neuroscience Abstracts. 505, (2012).
- MacGregor, D. G., Chesler, M., Rice, M. E. HEPES prevents edema in rat brain slices. Neurosci Lett. 303 (3), 141-144 (2001).
- Liu, Y. B., Guo, J. Z., Chiappinelli, V. A. Nicotinic receptor-mediated biphasic effect on neuronal excitability in chick lateral spiriform neurons. Neuroscience. 148 (4), 1004-1014 (2007).
- Xiang, Z., Huguenard, J. R., Prince, D. A. GABAA receptor-mediated currents in interneurons and pyramidal cells of rat visual cortex. J Physiol. 506, 715-730 (1998).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nat Protoc. 1 (4), 2075-2081 (2006).
- Contractor, A., et al. Loss of kainate receptor-mediated heterosynaptic facilitation of mossy-fiber synapses in KA2-/- mice. J Neurosci. 23 (2), 422-429 (2003).
- Pita-Almenar, J. D., Collado, M. S., Colbert, C. M., Eskin, A. Different mechanisms exist for the plasticity of glutamate reuptake during early long-term potentiation (LTP) and late LTP. J Neurosci. 26 (41), 10461-10471 (2006).
- Ito, K., Contractor, A., Swanson, G. T. Attenuated plasticity of postsynaptic kainate receptors in hippocampal CA3 pyramidal neurons. J Neurosci. 24 (27), 6228-6236 (2004).
- Van Dort, C. J., et al. Optogenetic activation of cholinergic neurons in the PPT or LDT induces REM sleep. Proc Natl Acad Sci U S A. 112 (2), 584-589 (2015).
- Ferando, I., Mody, I. Altered gamma oscillations during pregnancy through loss of delta subunit-containing GABA(A) receptors on parvalbumin interneurons. Front Neural Circuits. 7, 144 (2013).
- Walker, A. G., et al. Metabotropic glutamate receptor 3 activation is required for long-term depression in medial prefrontal cortex and fear extinction. Proc Natl Acad Sci U S A. 112 (4), 1196-1201 (2015).
- Takahashi, Y. K., et al. Neural estimates of imagined outcomes in the orbitofrontal cortex drive behavior and learning. Neuron. 80 (2), 507-518 (2013).
- Pan, G., et al. Preserving GABAergic interneurons in acute brain slices of mice using the N-methyl-D-glucamine-based artificial cerebrospinal fluid method. Neurosci Bull. 31 (2), 265-270 (2015).
- LaSarge, C. L., Santos, V. R., Danzer, S. C. PTEN deletion from adult-generated dentate granule cells disrupts granule cell mossy fiber axon structure. Neurobiol Dis. 75, 142-150 (2015).
- Tong, L. M., et al. Inhibitory interneuron progenitor transplantation restores normal learning and memory in ApoE4 knock-in mice without or with Abeta accumulation. J Neurosci. 34 (29), 9506-9515 (2014).
- Fleming, R. L., et al. Binge-pattern ethanol exposure during adolescence, but not adulthood, causes persistent changes in GABAA receptor-mediated tonic inhibition in dentate granule cells. Alcohol Clin Exp Res. 37 (7), 1154-1160 (2013).
- Kummer, K. K., El Rawas, R., Kress, M., Saria, A., Zernig, G. Social interaction and cocaine conditioning in mice increase spontaneous spike frequency in the nucleus accumbens or septal nuclei as revealed by multielectrode array recordings. Pharmacology. 95 (1-2), 42-49 (2015).
- Qi, J., et al. A glutamatergic reward input from the dorsal raphe to ventral tegmental area dopamine neurons. Nat Commun. 5, 5390 (2014).
- Wang, L., et al. Modulation of dopamine release in the striatum by physiologically relevant levels of nicotine. Nat Commun. 5, 3925 (2014).
- Siuda, E. R., et al. Spatiotemporal Control of Opioid Signaling and Behavior. Neuron. , (2015).
- Tucker, K. R., Huertas, M. A., Horn, J. P., Canavier, C. C., Levitan, E. S. Pacemaker rate and depolarization block in nigral dopamine neurons: a somatic sodium channel balancing act. J Neurosci. 32 (42), 14519-14531 (2012).
- McDevitt, R. A., et al. Serotonergic versus nonserotonergic dorsal raphe projection neurons: differential participation in reward circuitry. Cell Rep. 8 (6), 1857-1869 (2014).
- Wang, D. V., et al. Mesopontine median raphe regulates hippocampal ripple oscillation and memory consolidation. Nat Neurosci. 18 (5), 728-735 (2015).
- Engle, S. E., Shih, P. Y., McIntosh, J. M., Drenan, R. M. alpha4alpha6beta2* nicotinic acetylcholine receptor activation on ventral tegmental area dopamine neurons is sufficient to stimulate a depolarizing conductance and enhance surface AMPA receptor function. Mol Pharmacol. 84 (3), 393-406 (2013).
- Vance, K. M., Ribnicky, D. M., Rogers, R. C., Hermann, G. E. Artemisia santolinifolia enhances glutamatergic neurotransmission in the nucleus of the solitary tract. Neurosci Lett. 582, 115-119 (2014).
- Dergacheva, O., Boychuk, C. R., Mendelowitz, D. Developmental changes in GABAergic neurotransmission to presympathetic and cardiac parasympathetic neurons in the brainstem. J Neurophysiol. 110 (3), 672-679 (2013).
- Dergacheva, O. Chronic intermittent hypoxia alters neurotransmission from lateral paragigantocellular nucleus to parasympathetic cardiac neurons in the brain stem. J Neurophysiol. 113 (1), 380-389 (2015).
- Dyavanapalli, J., et al. Chronic intermittent hypoxia-hypercapnia blunts heart rate responses and alters neurotransmission to cardiac vagal neurons. J Physiol. 592, 2799-2811 (2014).
- Apostolides, P. F., Trussell, L. O. Regulation of interneuron excitability by gap junction coupling with principal cells. Nat Neurosci. 16 (12), 1764-1772 (2013).
- Graziane, N. M., Polter, A. M., Briand, L. A., Pierce, R. C., Kauer, J. A. Kappa opioid receptors regulate stress-induced cocaine seeking and synaptic plasticity. Neuron. 77 (5), 942-954 (2013).
- Ferando, I., Mody, I. In vitro gamma oscillations following partial and complete ablation of delta subunit-containing GABAA receptors from parvalbumin interneurons. Neuropharmacology. 88, 91-98 (2015).
- Foster, D. J., et al. M5 receptor activation produces opposing physiological outcomes in dopamine neurons depending on the receptor's location. J Neurosci. 34 (9), 3253-3262 (2014).
- Engle, S. E., Broderick, H. J., Drenan, R. M. Local application of drugs to study nicotinic acetylcholine receptor function in mouse brain slices. J Vis Exp. (68), e50034 (2012).
- Wang, L., et al. Temporal components of cholinergic terminal to dopaminergic terminal transmission in dorsal striatum slices of mice. J Physiol. 592, 3559-3576 (2014).
- Holloway, B. B., et al. Monosynaptic glutamatergic activation of locus coeruleus and other lower brainstem noradrenergic neurons by the C1 cells in mice. J Neurosci. 33 (48), 18792-18805 (2013).
- DePuy, S. D., et al. Glutamatergic neurotransmission between the C1 neurons and the parasympathetic preganglionic neurons of the dorsal motor nucleus of the vagus. J Neurosci. 33 (4), 1486-1497 (2013).
- Abbott, S. B., Holloway, B. B., Viar, K. E., Guyenet, P. G. Vesicular glutamate transporter 2 is required for the respiratory and parasympathetic activation produced by optogenetic stimulation of catecholaminergic neurons in the rostral ventrolateral medulla of mice in vivo. Eur J Neurosci. 39 (1), 98-106 (2014).
- Dergacheva, O., Dyavanapalli, J., Pinol, R. A., Mendelowitz, D. Chronic intermittent hypoxia and hypercapnia inhibit the hypothalamic paraventricular nucleus neurotransmission to parasympathetic cardiac neurons in the brain stem. Hypertension. 64 (3), 597-603 (2014).
- Chen, Q., et al. Imaging neural activity using Thy1-GCaMP transgenic mice. Neuron. 76 (2), 297-308 (2012).
- Luongo, F. H., Horn, M. E. Sohal V.S. Putative microcircuit-level substrates for attention are disrupted in mouse models of autism. Biological Psychiatry. 79 (8), 667-675 (2016).
- Vance, K. M., Rogers, R. C., Hermann, G. E. PAR1-activated astrocytes in the nucleus of the solitary tract stimulate adjacent neurons via NMDA receptors. J Neurosci. 35 (2), 776-785 (2015).
- Feliciano, P., Andrade, R., Bykhovskaia, M. Synapsin II and Rab3a cooperate in the regulation of epileptic and synaptic activity in the CA1 region of the hippocampus. J Neurosci. 33 (46), 18319-18330 (2013).
- Tomioka, N. H., et al. Elfn1 recruits presynaptic mGluR7 in trans and its loss results in seizures. Nat Commun. 5, 4501 (2014).
- Jiang, X., et al. Principles of connectivity among morphologically defined cell types in adult neocortex. Science. 350 (6264), 9462 (2015).
- Mishra, A., et al. Imaging pericytes and capillary diameter in brain slices and isolated retinae. Nat Protoc. 9 (2), 323-336 (2014).
- Gabriel, L. R., Wu, S., Melikian, H. E. Brain slice biotinylation: an ex vivo approach to measure region-specific plasma membrane protein trafficking in adult neurons. J Vis Exp. (86), (2014).
- Edwards, F. A., Konnerth, A. Patch-clamping cells in sliced tissue preparations. Methods Enzymol. 207, 208-222 (1992).
- Qi, G., Radnikow, G., Feldmeyer, D. Electrophysiological and morphological characterization of neuronal microcircuits in acute brain slices using paired patch-clamp recordings. J Vis Exp. (95), e52358 (2015).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. J Vis Exp. (91), e51706 (2014).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 13 (1), 133-140 (2010).
- Hille, B. The permeability of the sodium channel to organic cations in myelinated nerve. J Gen Physiol. 58 (6), 599-619 (1971).
- Martin, M., Chen, B. T., Hopf, F. W., Bowers, M. S., Bonci, A. Cocaine self-administration selectively abolishes LTD in the core of the nucleus accumbens. Nat Neurosci. 9 (7), 868-869 (2006).
- Chen, B. T., et al. Cocaine but not natural reward self-administration nor passive cocaine infusion produces persistent LTP in the VTA. Neuron. 59 (2), 288-297 (2008).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved