Préparation de tranches de cerveau aiguë en utilisant un optimisé N-méthyl-D-glucamine méthode de recouvrement protecteur
* These authors contributed equally
In This Article
Summary
Ce protocole illustre l’implémentation d’un optimisé N-méthyl-D-glucamine (NMDG) méthode de recouvrement protecteur de préparation de tranches de cerveau. Une formulation unique de médias est utilisée pour obtenir fiable des tranches de cerveau sain provenant d’animaux de tout âge et pour diverses applications expérimentales.
Abstract
Ce protocole est un guide pratique pour la N-méthyl-D-glucamine (NMDG) méthode de recouvrement protecteur de préparation de tranches de cerveau. De nombreuses études récentes ont clairement démontré l’utilité de cette méthode pour améliorer la préservation neuronale et viabilité de tranches de cerveau ensemble. La mise en œuvre de cette technique par les adopteurs précoces a facilité des enquêtes détaillées sur le fonctionnement du cerveau à l’aide de diverses applications expérimentales et couvrant un large éventail d’animaux âges, régions cérébrales et types de cellules. Étapes sont décrites pour mener à bien la technique de tranche de cerveau de recouvrement protecteur utilisant un optimisé NMDG artificiel liquide céphalo-rachidien (FSCA) médias formulation et procédure renforcée pour sûrement obtenir des tranches de cerveau sain pour l’électrophysiologie de patch clamp. Avec cette nouvelle approche, on observe une amélioration substantielle dans la vitesse et fiabilité de gigaohm joint la formation durant ciblée patch clamp d’enregistrement des expériences tout en conservant l’excellente conservation neuronale, facilitant ainsi la difficile applications expérimentales. Résultats représentatifs sont pourvu de multiples neurones patch clamp d’enregistrement des expériences pour doser la connectivité synaptique dans des tranches de cerveau néocorticales préparés à partir de souris transgéniques adultes jeunes et matures spécimens adultes de neurochirurgie humaines. En outre, la méthode de recouvrement protecteur NMDG optimisée de tranchage de cerveau est compatible avec les animaux juvéniles et adultes, ainsi résoudre une limitation de la méthodologie originale. En résumé, une formulation unique média et le cerveau tranchage de procédure peuvent être implémentées à travers les différentes espèces et les âges pour atteindre l’excellente conservation de tissus et de viabilité.
Introduction
La préparation de tranches de cerveau aiguë est un système de modèle expérimental essentiel en neurosciences. Environ la moitié d’un siècle, cette plateforme a permis à dynamiques études fonctionnelles du cerveau vivant dans une grande variété d’espèces animales et des régions anatomiques cérébrales. Que l’application soit biochimie, imagerie fonctionnelle, morphologie ou l’électrophysiologie, c’est de la plus haute importance pour assurer l’intégrité optimale et la viabilité des tissus en tranches. C’est pour cette raison que la préparation de tranches de cerveau de rongeurs juvéniles résilience (c.-à-d., plus jeune que postnatal 30 jours chez les souris) a été le plus préféré à ce jour. Tranches de la difficulté à obtenir suffisamment saines du cerveau de l’adulte et vieillissement des animaux s’est avéré pour être un formidable défi pour la plupart et a imposé des restrictions sévères pour l’étude de l’architecture fonctionnelle du cerveau mature. C’est particulièrement vrai pour les patch clamp d’enregistrement, une technique qui requiert l’excellente conservation morphologique et fonctionnelle et est indispensable pour caractériser les propriétés détaillées d’intrinsèques et synaptiques des neurones individuels identifiés. Pour les dernières décennies, la grande majorité des électrophysiologistes de patch clamp se sont appuyés sur une méthode de « protection coupe » préparation des tranches de cerveau sain de juvéniles et dans une moindre mesure avec saccharose substitués en position basse Na+ aCSF1 dans quelle mesure, les jeunes animaux adultes. Cette méthode repose sur la prémisse que les influx de Na+ passive et entrée ultérieure de l’eau et cellule gonflement pendant l’étape de coupe tranche est l’insulte prédominante qui mène à faible taux de survie des neurones, particulièrement pour ces neurones se trouve dans le couches superficielles qui sont plus susceptibles de soutenir un traumatisme direct du mouvement de la lame. Toutefois, la méthode de protection coupe laisse encore beaucoup à désirer pour la préparation de tranches de cerveau des animaux adultes matures quelle que soit la formulation de l’aCSF particulier mis en place.
Une solution simple mais efficace à ce problème a été décrit2,3,4,5,6 et appelle la méthode de tranche de cerveau « valorisation protectrice ». La version originale de cette méthode utilise un FSCA NMDG substituées, comme NMDG a été identifié comme le plus polyvalent et le plus efficace parmi divers autres candidats sodium ion substituts (y compris le saccharose, glycérol, choline et Tris). La formulation de médias a été renforcée par l’ajout de HEPES à résister à l’oedème du cerveau tranche et fournir plus fort pH tampon7, ainsi que l’ajout de suppléments pour contrecarrer les effets néfastes du stress oxydatif (tableau 1). Il a été déterminé empiriquement qu’une incubation de recouvrement initial dans le bas Na+, faible Ca2 +, et haute Mg2 + NMDG FSCA immédiatement après que découpage de tissu de cerveau adulte était nécessaire et suffisante pour amélioré neuronale conservation sur un large éventail de régions du cerveau, types cellulaires et animaux âgés3,5,6.
Notamment, des incarnations antérieures de ce qui est maintenant surnommé la méthode de recouvrement protecteur se trouve dans la littérature1,8,9,10,11,12, 13, bien que le plein potentiel de maturité adulte et vieillissement cerveau animal tranche et patch clamp enregistrement n’était pas reconnu ou démontrée dans ces premiers travaux. En outre, nuancée de variations procédurales continuent d’émerger à l’appui des applications expérimentales spécifiques4,14,15,16. Le corps collectif de travail de ces nombreux groupes de recherche transmet le degré élevé de confiance dans la robustesse de la méthode de recouvrement protecteur pour la préservation des tissus améliorée. La méthode de recouvrement protecteur NMDG a maintenant largement adoptée et mis en œuvre dans de nombreuses études de recherche publiés utilisant des préparations de tranches de cerveau animal adulte. Ces études tranche aiguë span néocorticales3,17,18, hippocampe15,19,20,21, striatum22 , 23 , 24, mésencéphale25,26,27,28,29et rhombencéphale30,31,32, 33 , 34 régions et une variété de types de neurotransmetteurs et neuromodulateur dont glutamatergique4,30, GABAergiques18,20,31,35 ,36, dopaminergiques24,29,37,38, cholinergiques14,37,38, 39, noradrénergique40et sérotoninergiques27,28 neurotransmission. La méthode consiste aussi bien aux optogenetic contrôle de l’activité neuronale en tranches dérivés d’animaux transgéniques3,39 ou suite in vivo des injections virales17,27, 28,40,41,42,43, comme bien comme Ca2 + imagerie fonctionnelle de l’activité neuronale2,44 ,45,46. Analyses de court terme plasticité4,47,48 et diverses formes de longue durée plasticité16,35,48 ont été a rapporté. Une récente étude a appliqué la méthode de recouvrement protecteur NMDG pour faciliter la complète et structurée de palpage de connectivité synaptique dans le cortex visuel dans des coupes de cerveau de souris adultes matures à l’aide de l’octopatch d’enregistrement de configuration49 — un puissant démonstration de l’utilité et la robustesse de cette méthode. La méthode de recouvrement protecteur a même été appliquée avec succès dans des contextes expérimentaux précédemment imprévues, telles que, meilleure préservation du système vasculaire et péricytes dans cerveau cortical adulte tranches50, patch clamp d’enregistrement de transplanté les populations interneurone 1 – 1,5 ans la maladie d’Alzheimer souris modèles20et un cerveau adulte tranche récepteur trafic dosage51.
Le protocole suivant décrit les procédures pas à pas pour implémenter une méthode de recouvrement protecteur NMDG optimisée de préparation de tranches de cerveau afin d’améliorer la viabilité des tranches de cerveau aiguë. Les principes de conservation neuronale améliorée sont discutés, ainsi que de la démonstration des avantages clairs de cette méthodologie pour complexe multi-neurone patch clamp d’enregistrement des expériences dans les coupes de cerveau de souris transgéniques adulte jeune et adulte tranches de cerveau humain de neurochirurgie. Le protocole suivant a été validé chez la souris de l’âge de 21 jours à plus d’un ans, aussi bien en ce qui concerne les prélèvements humains neurochirurgicaux provenant de patients adultes.
Protocol
Procédures impliquant des souris transgéniques ont été approuvés par l’animalier institutionnel et utilisation Comité (IACUC) à l’Institut Allen pour la Science du cerveau. Les souris mâles et femelles C57BL/6 (fourchette de 10 à 30 g) ont été utilisées dans ces expériences. Certains des résultats représentatifs décrivent les données recueillies à partir des tranches de cerveau humain vivant. Des échantillons de tissus néocorticales ont été obtenus au cours de neurochirurgies pour l’enlèvement de la tumeur. Il était nécessaire d’enlever le tissu néocorticale surjacent pour avoir accès à des tissus malades. Consentement éclairé du patient a été obtenue dans tous les cas pour l’utilisation de tissus neurochirurgicale en vertu d’un protocole approuvé par le Conseil d’examen de l’établissement du centre médical suédois à des fins de recherche.
1. préparation des milieux et réactifs (tableau 1)
NOTE : Solutions doivent être composées dans l’eau épurée qui est exempt de métaux-traces et autres impuretés. Il est recommandé que des solutions fraîchement sur le jour de l’expérience, même si des solutions non utilisées peuvent être conservées à 4 ° C pendant 1 semaine, si vous le souhaitez. 1 L de chaque formulation qui précède est suffisant pour 1 – 2 procédures tranchage. Toutes les solutions de l’aCSF doivent être saturées avec carbogen (95 % O25 % CO2) avant usage afin d’assurer la mise en mémoire tampon de pH stable et oxygénation adéquate. Le pH de toutes les solutions doit être ajusté pour 7,3 à 7,4 et osmolalité mesurée et réglée à 300-310 mOsmol/kg.
- Préparer le FSCA NMDG-HEPES (en mM) : 92 NMDG, 2.5 KCl, 1,25 NaH2PO4, 30 NaHCO3, 20 HEPES, glucose 25, 2 thiourée, 5 Na-ascorbate, Na 3-pyruvate, 0,5 CaCl2·2H2O et 10 MgSO4·7H2O. titration pH 7.3 –7.4 avec 17 mL +/-0,5 mL d’acide chlorhydrique 5 M.
Remarque : Cette étape de titrage doit idéalement être effectuée avant l’addition de cations divalents pour éviter la précipitation ; Cependant, la précipitation peut être inversée sur l’ajustement du pH pour les limites physiologiques. - Préparer l’HEPES tenant aCSF (en mM) : 92 NaCl, 2.5 KCl, 1,25 NaH2PO4, 30 NaHCO3, 20 HEPES, glucose 25, 2 thiourée, 5 Na-ascorbate, Na 3-pyruvate, 2 CaCl2·2H2O et 2 MgSO4·7H2O. Titrate pH de 7,3 à 7,4 avec quelques gouttes de concentré 10 N NaOH.
- Préparer l’enregistrement aCSF (en mM) : 124 NaCl, 2.5 KCl, 1,25 NaH2PO4, 24 NaHCO3, glucose 12,5, 5 HEPES, CaCl 22·2H2O et 2 MgSO4·7H2O. titration pH de 7,3 à 7,4 avec quelques gouttes de concentré de 10 N NaOH.
- Préparer Na+ épi-en solution (2 M) : 580 mg de NaCl dissous dans 5 mL de fraîchement préparés NMDG-HEPES fsca. Il s’agit de suffisamment de solution pour la préparation de tranche un cerveau.
- Préparer d’agarose à 2 % à utiliser pour l’incorporation de tissu. Dissoudre 2 g de gel d’agarose type 1 b (voir Table des matières) dans 100 mL de 1 x PBS et micro-ondes jusqu'à ébullition. Agiter pour mélanger, puis versez le mélange dans un plats de Pétri stérile de 10 cm et laisser pour solidifier. Conserver la plaque de gel d’agarose dans un sac en plastique étanche à 4 ° C jusqu'à l’utilisation.
- Préparer un anesthésique injectable solution stock de travail. Mélanger 2,5 g de 2,2,2-Tribromoethanol avec 5 mL de butan-2-méthyl-2-ol et ensuite progressivement dissoudre dans 200 mL de PBS, pH 7,0 à 7,3. Filtrer la solution avec un filtre de 0,22 µm avant de l’utiliser et conserver à 4 ° C, abri de la lumière.
Remarque : Consulter les directives Comité l’utilisation respective des animaux et des règles pour déterminer la procédure d’expiration et l’élimination pour l’anesthésie solution stock de travail.
2. installation de la Station de tranchage
- Mettre en place la station de tranchage avec la machine coupeuse de tissu et les instruments chirurgicaux (voir Table des matières). Pour calibrer la machine trancheuse, fixer une lame d’injecteur en céramique de zirconium sur le bras de la lame à l’aide de la colle rapide-adhésif, puis insérez le porte-échantillon et alignez le bord d’attaque de la lame sur le bord de titulaire spécimen laissant un minuscule espace pour s’assurer que la lame ne frotte pas contre le métal.
Remarque : Si le tranchant de la lame n’est pas physiquement endommagé il peut être réutilisé pour plusieurs semaines ou même mois sans être remplacés. Divers modèles de coupeuse de tissu sont disponibles dans le commerce, dont beaucoup peuvent offrir des performances excellentes lorsque étalonné de façon optimale. L’instrument idéal devrait avoir la déflexion de l’axe z minimale, soit mesurée directement et à l’écoute ou empiriquement observée. - Mettre en place un bécher de 250 mL rempli avec 200 mL de NMDG-HEPES FSCA et pré froid sur la glace avec la constante carbogenation (appliquée par un diffuseur de gaz Pierre immergé dans les médias) pour > 10 min.
NOTE : Cette solution servira à transcardial de perfusion et de remplissage du réservoir de machine à trancher au cours de la section. - Mettre en place la chambre de récupération initiale cerveau tranche contenant 150 mL de NMDG-HEPES aCSF (maintenir constante carbogenation) et placer la chambre dans un bain d’eau chaude maintenu à 32 et 34 ° C.
Remarque : Une tranche chambre après la conception d’Edwards et Konnerth (1992)52 est recommandé pour cette étape. Ces chambres peuvent être faites avec éléments facilement accessibles de laboratoire (bécher de 250 mL en nylon mesh netting, tube de 50 mL conique, plat rond en plastique de 35 mm). Il faut pour s’assurer que la tranche de filet reste libre d’air bubbles, particulièrement celles produites continuellement par les pierres de bulles de gaz carbogen que ceux-ci peuvent causer des tranches de flotter vers le haut et est endommagé. Le filet doit être immergé à peu près 1 cm sous la surface du liquide. - Mettre en place une tranche de cerveau tenant la chambre ; un design avec plusieurs puits indépendants dans un réservoir plus grand est recommandé (voir Table des matières). Remplissez le réservoir avec 450 mL de HEPES FSCA et réchauffer à température ambiante sous carbogenation constante jusqu'à l’utilisation.
NOTE : Les tranches de cerveau seront transférés de la chambre de récupération initiale à cette chambre pour le stockage à long terme avant l’enregistrement électrophysiologique. Il faut pour s’assurer que la tranche filet reste exempt de bulles d’air à tout moment. - Préparer les fondus d’agarose pour l’incorporation de tissu. Utilisez l’extrémité ouverte d’une fiole conique de 50 mL comme un emporte-pièce pour découper un bloc de 2 % d’agarose de la capsule précédemment préparée. Lâchement, boucher le flacon conique, puis micro-onde pendant 10 à 30 s jusqu'à ce que l’agarose est juste fondu. Ne pas surchauffer.
- Versez l’agarose fondu dans des tubes de 1,5 mL. Maintenir l’agarose à l’état fondu à l’aide d’un thermomixer réglé à 42 ° C avec agitation vigoureuse. Veiller scrupuleusement à ce que l’agarose fondu ne solidifie pas prématurément.
- Placez l’accessoire refroidissement bloc pour le segment sur la glace pour refroidir préalablement à cette époque.
3. Transcardial Perfusion
Remarque : La procédure de perfusion de transcardial est une étape importante lorsque vous travaillez avec des animaux adultes et est importante pour obtenir un refroidissement rapide du cerveau et ralentit le métabolisme via la cervelle de faible Na+, faible Ca2 +/ haute Mg2 + FSCA solution. La perfusion de transcardial sert également à dégager les globules rouges de la vascularisation cérébrale, ce qui réduit l’autofluorescence qui peut-être interférer avec la visualisation et le ciblage des populations de cellules fluorescent étiquetés dans les lignées transgéniques. Il n’est pas conseillé d’omettre la perfusion transcardial.
- Anesthésier profondément souris par injection intrapéritonéale de solution anesthésique travail (250 mg / kg : 0,2 mL d’anesthésique à 1,25 % stock solution par 10 g de poids corporel, travail Voir la Table des matières). Après environ 2 à 3 min, vérifier la profondeur suffisante de l’anesthésie en évaluant le réflexe de pincée d’orteil. Si nécessaire, injecter un volume supplémentaire de stock de travail anesthésique et réévaluer le réflexe pincée orteil après encore 2-3 min.
- Charger une seringue de 30 mL avec 25 mL de carbogenated NMDG-HEPES FSCA du bécher préalablement réfrigérées 250 mL (2 à 4 ° C est optimale, par opposition à la solution fondante ou congelée). Attacher une aiguille de calibre 25 5/8.
- Avec la souris sur son dos, fixer les pattes de devant et les pattes pour la stabilité. Un verre de 15 cm boîte de Pétri remplis de silicone durci œuvres ainsi que la base.
- À l’aide d’un scalpel, faites une incision latérale pour ouvrir la cavité thoracique au niveau du diaphragme. Utiliser des ciseaux pour couper à travers la cage thoracique sur chaque côté en prenant soin d’éviter un écrêtage du cœur et des poumons.
- Broche arrière la partie centrale de la cage thoracique pour exposer le cœur. Introduire l’aiguille de la seringue de 30 mL dans le ventricule gauche et couper l’oreillette droite avec des ciseaux fins pour permettre au sang de sortir le coeur.
- Enfoncer le piston de la seringue à l’aide d’une pression constante manuelle et perfuse l’animal avec le FSCA NMDG-HEPES réfrigéré à un taux d’environ 10 mL/min.
Remarque : Si la perfusion est réussie le foie va changer de couleur allant du rouge foncé au jaune pâle et dans certains cas claires liquides peuvent être observés en sortant des narines vers la fin de la procédure.
4. cerveau Dissection et tranchage
- Décapiter l’animal. Utiliser un scalpel pour ouvrir la peau sur la tête et exposer la calotte.
- Taille super fine utiliser ciseaux pour découper la peau sur la calotte et faire des petites incisions latéralement de chaque côté à la caudale de bord ventral/base du crâne. Faites des coupes peu profondes supplémentaires à partir de l’aspect caudal/dorsale du crâne se déplaçant dans la direction rostrale vers le haut de la ligne dorsale médiane en prenant soin de ne pas endommager le cerveau sous-jacent. Faire une finale ' t ' couper perpendiculairement à la ligne médiane au niveau des bulbes olfactifs.
Remarque : Il faut pour assurer qu'aucun dommage n’est fait pour l’ou les régions cérébrales d’intérêt. En particulier, à aucun moment y aurait-il une force de compression appliquée au cerveau lui-même. - Utilisez la pince ronde-astuce pour saisir le crâne à partir de l’aspect médial rostral et peler vers la direction caudale bilatérales. Répéter pour les deux parties à craquer ouvrir et enlever la moitié dorsale de la calotte pour exposer le cerveau. Évider délicatement le cerveau intact dans le bécher de préalablement réfrigérées NMDG-HEPES fsca. Permettent au cerveau d’uniformément refroidir pendant environ 1 min.
- Utilisez la spatule large pour soulever le cerveau, sortir le bol et sur la boîte de Pétri recouvert de papier filtre. Couper et bloquer le cerveau en fonction de l’angle préféré de tranchage et désiré région du cerveau d’intérêt. Travailler rapidement pour éviter la privation d’oxygène prolongée lors de la manipulation.
Remarque : De nombreux angles tranchage sont possibles. L’angle exact de méthode et de tranchage blocage dépendra de la région du cerveau exacte, type de cellule et circuit à étudier. - Fixer le bloc de cerveau pour le porte-échantillon à l’aide de la colle adhésive. Retirer la pièce intérieure de la porte-spécimen assez pour retirer le bloc de cerveau entièrement à l’intérieur. Verser l’agarose fondu directement dans le support jusqu'à ce que le bloc du cerveau est complètement couvert dans l’agarose. Fixer l’accessoire refroidi préalablement refroidissement bloc autour du porte-échantillon pour ~ 10 s jusqu'à ce que l’agarose est solidifiée.
- Insérez le porte-échantillon dans le récipient sur la machine de découpage et de vérifier l’alignement correct. Remplir le réservoir avec restantes préalablement réfrigérée et oxygénée NMDG-HEPES FSCA du bécher de 250 mL et déplacer une pierre de bulle dans le réservoir pendant la durée de découpage afin d’assurer une oxygénation adéquate.
- Ajuster le micromètre pour commencer de faire progresser le spécimen de cerveau d’agarose incorporé. Démarrer la trancheuse et empiriquement, réglez la fréquence de vitesse et d’oscillation d’avance jusqu’au niveau désiré.
Remarque : Ces deux paramètres doivent être dans le bas de gamme. Pour de meilleurs résultats, une seule passe du bras lame devraient prendre environ 20 s et l’oscillation devrait produire un bruit de ronflement très doux et lisse avec aucun bourdonnement manifestes. - Continuer à faire progresser et découper le tissu en 300 µm par incréments (ou autres préférences pour l’épaisseur) jusqu'à la région du cerveau d’intérêt est complètement sectionnée ; la durée totale de la procédure de découpage devrait être inférieur à 15 min.
5. optimisé la procédure de recouvrement protecteur de NMDG
- Étape de récupération initiale NMDG (étape critique) : À l’issue de la procédure de sectionnement, recueillir toutes les tranches à l’aide d’une coupure en plastique Pasteur tuyau t et de les transférer dans une chambre de récupération initiale pré chauffée (34 ° C) contenant 150 mL de NMDG-HEPES fsca. Transfert de toutes les tranches en succession courte et lancer une horloge dès que toutes les tranches sont déplacés dans la chambre de récupération.
- Consultez le tableau 2 pour déterminer la Na+ spike composant logiciel enfichable Schéma optimal selon l’âge de la souris.
Remarque : Cette procédure est une méthode pratique pour atteindre un taux contrôlé de réintroduction de Na+ dans la chambre de tranches de cerveau et est optimisée pour un cerveau spécifique tranche chambre géométrie et réservoir volume et le type (voir Table des matières). - Effectuer la Na+ stepwise spike-dans la procédure en ajoutant les volumes indiqués de Na+ épi-en solution à la fois. Ajouter la Na+ épi-en solution directement dans la cheminée barboteur de la chambre de récupération initiale pour faciliter le mélange rapide.
- Transférer toutes les tranches dans la chambre tenue à long terme de HEPES FSCA maintenue à température ambiante. Permettre aux tranches de récupérer pendant 1 h dans l’HEPES tenant la chambre avant de lancer le patch clamp enregistrement des expériences supplémentaires.
6. Patch Clamp enregistrement
Remarque : Les procédures de base suivants simplement fournissent quelques considérations pratiques et ne visent pas à représenter des protocoles détaillés pour les enregistrements de patch clamp, comme ceux-ci peuvent être trouvés ailleurs53,54. Une plate-forme d’électrophysiologie patch clamp est requise pour cette application. Ce sera généralement composé d’un microscope vertical équipé d’optique (IR-DIC) de contraste interférentiel différentiel infrarouge et un système d’illumination par fluorescence, un amplificateur de patch clamp et numérisation de données, motorisés micromanipulateur et microscope plate-forme, table d’isolement de vibration, cage de Faraday et système de chauffage et de la perfusion de solution. La chambre de l’échantillon et la plate-forme devraient être conçus pour enregistrement tranche submergées. Pour les enregistrements de multi-neurone patch clamp, une plate-forme équipée avec plusieurs amplificateurs, étapes tête et micromanipulateurs de haute qualité est nécessaire. En outre, pour de meilleurs résultats, un gréement équipé d’un filtre passe-bande nm IR 900 et appariement des composants optiques est fortement recommandé pour assurer une visualisation adéquate des cellules situées > 50 µm dans les tranches de cerveau. Un alignement correct pour l’éclairage Kӧhler est également important pour la visualisation claire.
- Préparer la solution de la pipette intracellulaire (en mM) : 130 K-Gluconate, 4 KCl, 10 HEPES, EGTA 0,3 10 phosphocréatine-Na2, MgATP 4, 0,3 Na2-GTP et la biocytine 13,4. Ajuster le pH à 7,35 avec 1 M KOH et l’osmolalité de 285 – 290 mOsmol/kg, à l’aide de saccharose selon les besoins.
- Préparer les électrodes pince patch de capillaires en verre de borosilicate à parois épaisses ; l’électrode de serrage patch idéal a une conicité relativement courte et trapue avec une ~ 3 – 6 MOhm rempli de résistance à la pointe dans le bain.
- Assurez-vous que les câbles d’électrode d’argent sont correctement CHLORUREES afin d’assurer les enregistrements stables. Pour ce faire 3-4 mm de l’argent (typique) en immergeant le dernier fil dans Javel pendant environ 30 min ou jusqu'à ce que le fil noircit.
- Mettre en place une perfusion de solution à l’aide d’une pompe péristaltique la valeur 3 à 4 mL/min. Circulate carbogenated FSCA dans la chambre d’enregistrement en prenant soin de faire pour correspondre les apports et les retraits d’enregistrement pour éviter tout débordement.
- Transférer une tranche unique cerveau dans la chambre d’enregistrement de submersion et la fixer à l’aide d’une ancre en forme de U tranche avec du nylon cross chaînes. Identifier la région cible du cerveau à l’aide d’un objectif d’air 4 X avant de passer à un objectif de puissance plus élevée (p. ex., objectifs à immersion eau forte ouverture numérique 40 X ou 60 X).
- Identifier visuellement une cellule cible en bonne santé. L’apparition de la membrane neuronale dans le soma, comme IR-DIC microscope, est utilisée pour juger de la pertinence d’une cellule de candidat pour l’enregistrement de patch clamp.
NOTE : Neurones sains présentent généralement les caractéristiques suivantes : ratatinée ni enflé corps cellulaires, contraste doux des bords de la membrane et l’aspect de la membrane lisse. En outre, la plupart des cellules saines se trouvent > 30 µm profondément dans la tranche, comme les neurones superficiels sont susceptibles d’être endommagés par rompu prolongements dendritiques. Les neurones qui présentent un aspect froissé, noyaux bien visibles ou « frit oeuf » apparence ou les bords de membrane de contraste très sombre ou haute doivent être évitées. - Remblayer le patch Pipetter ~ 5 µl de la solution intracellulaire et le charger dans le porte-électrode. Déplacer la pipette dans le bain d’enregistrement au-dessus de la tranche de cerveau et appliquez une légère pression positive pour dégager tout blocage dans la pointe. Zéro l’offset de la pipette et surveiller la résistance en pointe à l’aide d’une fonction de test de membrane.
- Déplacer l’embout de la pipette en contact avec des corps de cellulaire du neurone cible ; une petite fossette doit se former sur la surface de la membrane en raison de la légère pression positive.
- Dès qu’on observe une fossette de membrane, rapidement enlever la pression positive et appliquer légère succion pour faciliter la formation de joint. Une fois que la résistance de la pipette augmente à > 100 MOhm, tourner sur une commande d’exploitation à un niveau qui correspond à la membrane de repos attendue possibles pour le type de cellules ciblées (-70 mV est un bon point de départ).
- Une fois la résistance en pointe atteint ≥ 1 gigaohm, tenter de pénétrer dans la cellule par une rupture de la membrane sous la pipette à l’aide de brefs épisodes de forte puissance d’aspiration ; la fonctionnalité « zap » peut être utilisée pour faciliter le rodage au besoin.
Remarque : Un potentiel de maintien de -70 mV est suggérée pour les expériences de serrage de tension sur les neurones corticaux. Les neurones en bonne santé aura une fuite de courante pas plutôt défavorables-100 pA pendant la durée de l’expérience, mais c’est en partie dépendant du type de cellule. Un neurone serait exclus de l’analyse si le potentiel membranaire de repos était plus dépolarisé à -50 mV, ou si la résistance d’accès modifié par plus de 20 %. -
Après avoir obtenu un enregistrement de stable cellule entière patch clamp, cibler les neurones supplémentaires pour l’enregistrement en répétant les étapes 6.6 – 6.10. Prendre soin d’éviter des perturbations mécaniques qui seraient traduirait par la perte du premier enregistrement.
- Sélectionnez les neurones supplémentaires au sein de 100 µm du premier neurone pour assurer une probabilité raisonnable de trouver couplés aux synapses des neurones.
Remarque : Il peut être utile dans certains cas à identifier plusieurs neurones de candidat à l’avant et à précharger et prépositionner toutes les pipettes à proximité de diverses cellules ciblées avant d’établir le premier enregistrement de patch clamp.
- Sélectionnez les neurones supplémentaires au sein de 100 µm du premier neurone pour assurer une probabilité raisonnable de trouver couplés aux synapses des neurones.
Representative Results
Cette section fournit des résultats représentatifs pour la préparation de tranches de cerveau systématique et patch clamp électrophysiologie expériences en utilisant la méthode de recouvrement protecteur NMDG optimisée (c.-à-d., NMDG protection sortie combinée avec progressive Na+ Spike-en procédure). Tout d’abord, morphologique préservation des neurones a été évaluée dans diverses régions du cerveau des tranches de cerveau préparés avec ou sans l’implémentation de la méthode de recouvrement protecteur NMDG optimisée (Figure 1). Souris adultes de trois mois ont été sélectionnés pour ces expériences, et nous avons utilisé la microscopie IR-DIC pour déterminer la santé de neurone basée sur la forme et l’apparence générale des corps cellulaires et des dendrites proximales. Notez l’apparition de pycnotiques échaudés, de la plupart des neurones dans les images représentant des tranches de cerveau préparés sans que la méthode de recouvrement protecteur (toutes les images ont été obtenues de 1 à 2 h après préparation de tranches). Ces tranches de contrôle ont été préparés à l’aide de NMDG FSCA pour perfusion transcardial et découpage des étapes, mais ont été récupérés au départ en haute Na+-contenant HEPES fsca. En revanche, les images représentant les tranches préparés selon la méthode de recouvrement protecteur NMDG optimisée de révèlent des neurones avec des morphologies améliorées (plus lisse, plus complète, moins apparence cloquée) qui conviennent aux patch clamp d’enregistrement (Figure 1). la préservation neuronale améliorée a été observée dans plusieurs régions du cerveau, y compris néocorticales couches II/III et V, subiculum et noyau géniculé latéral dorsal (dLGN).
Ensuite, la méthode de recouvrement protecteur NMDG optimisée a été comparée à la méthode de recouvrement protecteur NMDG originale (c'est-à-diresans la progressive Na+ spike procédure). Le délai moyen pour la formation de joint gigaohm dans patch clamp de tentatives d’enregistrement a été réduit considérablement et de manière significative (9,9 s contre 33,3 s, **p < appariés 0,005, t-test) quand la Na+ progressive spike-dans la procédure a été appliquée ainsi que l’étape de récupération protectrice de NMDG (Figure 2). La membrane plus rapide et plus fiable d’étanchéité fois grandement amélioré le débit du patch clamp d’enregistrement dans des tranches de cerveau adulte jeune. Le Na+ optimale spike-en annexe a été modifiée selon l’animal âge (tableau 2) et a été bénéfique pour tous les âges testés (3 semaines à 1 ans, souris). Le profil de sodium progressive ion concentration altitude tout au long de la procédure PIC est fourni (Figure 3) pour accompagner les horaires indiqués au tableau 2.
Dans le cadre du programme de Types cellulaires Allen Institute (http://celltypes.brain-map.org/) un effort de grande envergure est en cours pour systématiquement caractériser les propriétés électrophysiologiques intrinsèques de neurones individuels chez les jeunes adultes (40-80 du jour après la naissance) tranches de cerveau cortical visuel de souris provenant de lignées transgéniques avec l’expression de la cellule spécifique au type de marqueur fluorescent dans génétiquement définies par les populations neuronales (couche corticale et le type de cellule spécifique Cre pilote lignées croisées à une fluorescence de Cre-dépendante journaliste ligne55). La figure 4 montre des traces d’exemple des modèles de mise à feu enregistrées de la parvalbumine (Pvalb)-exprimant la corticale rapide-dopage les interneurones (FS) (Pvalb-IRES-Cre/Ai14 souris) en réponse à une série de 1 s current injection étapes qui couvrent la gamme dynamique de tir de neurone. Le F-j’ai la courbe pour un dataset de 22 interneurones corticaux de FS est illustré à droite. Similar ciblée patch clamp enregistrement expériences ont été effectuées afin de caractériser les 23 Rorb exprimant des neurones excitateurs dans la couche IV de souris Rorb-IRES-Cre/Ai14 (Figure 4). Neurone sain diverses typologies FS interneurones et des neurones pyramidaux à travers les couches et les régions corticales peuvent régulièrement et sûrement être ciblés pour patch clamp d’enregistrement pendant au moins 6 à 8 heures après optimisé de préparation de tranches utilisant ce protocole.
En plus de mesurer les propriétés neuronales intrinsèques, la connectivité synaptique a été sondée entre plusieurs neurones simultanément enregistrés des types définis dans des microcircuits corticaux visuels. Le multi-neurone patch clamp de la technique d’enregistrement est exceptionnellement exigeant, comme de nombreux neurones sains candidat des types définis doivent être présents dans un champ relativement faible de la tranche de cerveau afin d’assurer une chance raisonnable d’obtenir de haute qualité enregistrements simultanés et identifier les connexions synaptiques bona fide . La figure 5 illustre l’enregistrement apparié des deux interneurones tdTomato + FS dans le cortex visuel des tranches de cerveau dérivée de jeunes adultes Pvalb-IRES-Cre/Ai14 souris. Un fort lien unidirectionnel de synaptique inhibitrice a été détecté (enregistré avec une solution riche en chlore de la pipette interne). Enregistrements d’exemple et de protocoles de mesure des propriétés de plasticité synaptique à court terme sont présentés. Épisodes de train stimulation à haute fréquence (10 impulsions chaque à 10, 50 et 100 Hz) ont été suivis par des impulsions de test de restauration unique à divers intervalles de temps (1, 2 ou 4 s) pour mesurer l’évolution temporelle de la récupération d’une dépression synaptique.
Excellente réussite a aussi été obtenu pour les neurones humains néocorticales en tranches de cerveau mature adult ex vivo . Neurochirurgicales spécimens proviennent de patients subissant des chirurgies planifiées pour l’enlèvement de la tumeur aux hôpitaux locaux. Les modalités de préparation de tissus humains de neurochirurgie collection et cerveau de tranches diffèrent des procédures de tranche de cerveau de souris de plusieurs façons pratiques. En bref, le tissu néocorticale réséqué (distal sur le site de la pathologie) est prélevé dans la salle d’opération et plongé dans glacee oxygéné NMDG-HEPES FSCA et transporté avec refroidissement continu et l’oxygénation de la salle d’opération pour la laboratoire dans les 30 minutes ou moins. Les tranches de cerveau sont préparés à l’aide de la procédure de recouvrement protecteur de NMDG et a permis de récupérer pendant une période prolongée d’environ 3 h avant de commencer les enregistrements de patch clamp. La figure 6 montre un succès jumelé enregistrement expérience ainsi qu’une expérience d’enregistrement pince patch quadruple réussie de humaine ex vivo tranches de cerveau préparés de cette manière de la région du cortex frontal. L’enregistrement apparié montre unidirectionnelle entrée synaptique excitatrice d’un neurone pyramidal corticale sur un interneurone corticale (inscrit comme courants postsynaptiques excitateurs). Dans le patch quad expérimenter deux excitateurs et trois connexions synaptiques inhibitrices ont été détectées (inscrit comme inhibiteurs potentiels post-synaptiques) deux neurones inhibiteurs ont été enregistrés simultanément ses douze connexions totales sondées. Ainsi, cette méthodologie de tranches de cerveau optimisé permet des succès expérimental fiable dans la plus difficile du cerveau tranche applications, y compris les expériences pince multi-neurone patch pour étudier la connectivité de circuit en aiguë réséqué cerveau humain adulte mature tissus.
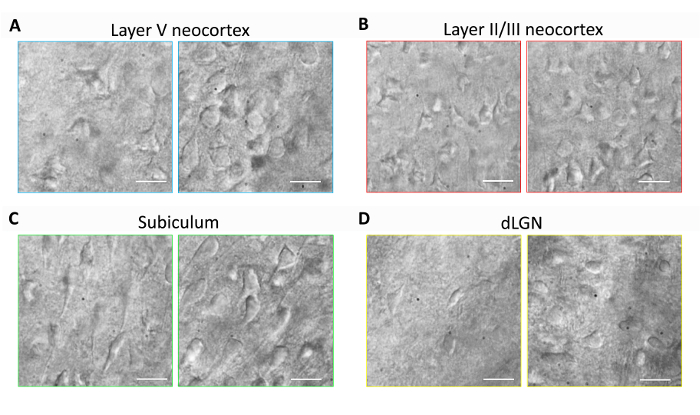
Figure 1 : Meilleure préservation neuronale avec la méthode de recouvrement protecteur NMDG optimisée de préparation de tranches de cerveau. Les images représentant IR-DIC ont été acquises de régions cérébrales diverses tranches aiguës d’une souris âgée de trois mois. Contrôle NMDG protection coupe méthode sans une étape de récupération protectrice (panneaux de gauche) par rapport à la méthode de protection Récupération optimisée NMDG (panneaux de droite). (A) couche V du néocortex, (B) couche II/III du néocortex, subiculum (C) et (D) noyau géniculé latéral dorsal (dLGN). Barres d’échelle dans tous les panneaux sont 20 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
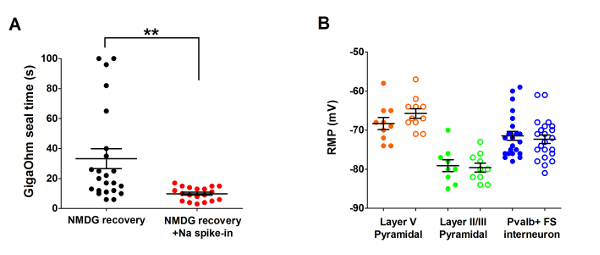
Figure 2 : Vitesse accélérée et une meilleure fiabilité de gigaohm joint formation en patch clamp d’enregistrement des expériences en utilisant la méthode de recouvrement protecteur NMDG avec procédure de spike Na+ . (A) parcelle de formation joint gigaohm fois pour la récupération NMDG seule (noir de points de données, n = 19) contre récupération NMDG ajoute Na+ épi-en procédure (points rouges, n = 23). Toutes les cellules enregistrées étaient des neurones pyramidaux dans la couche II/III ou V du cortex visuel. Noter que le temps maximal est plafonné à 100 s pour tenir compte des cellules qui n’a jamais fait gigaohm joints. Jumelé de t-test, **p < 0,005. (B) parcelle de potentiel membranaire (RMP) des neurones pyramidaux de la couche V de repos (points de données orange, n = 10/11), les neurones pyramidaux II/III (vert points de données, n = 9/10), ou interneurones corticaux de Pvalb + FS (bleu points de données, n = 23/22). Cercles pleins dénotent condition de récupération NMDG et ouvrir les cercles NMDG récupération ajoute Na+ spike-dans la procédure. Chaque point de données représente un neurone et les deux la moyenne et +/-SEM sont affichés. Il n’y a aucune différence significative dans les plans de redressement en comparant les conditions de préparation cerveau tranche pour chacun des trois types de cellules (jumelé t-test). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
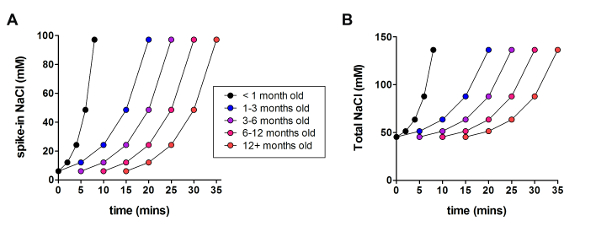
Figure 3 : Profil de sodium progressive ion concentration altitude tout au long de la procédure PIC. (A) terrain de spike-en concentration de NaCl par rapport au temps. (B) terrain de la concentration de NaCl extracellulaire totale par rapport au temps. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
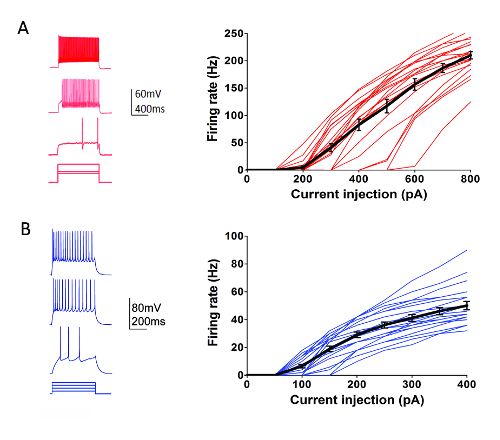
Figure 4 : Propriétés électrophysiologiques intrinsèques des types de cellules corticales génétiquement définies. (A) exemple des traces de tir neuronale en réponse aux actuelles mesures injection pour Pvalb + interneurones corticaux FS (panneau de gauche). tdTomato + neurones ont été ciblées pour les enregistrements dans des tranches de cerveau de souris Pvalb-IRES-Cre/Ai14. Données sommaires pour la relation de l’injection de courant taux de tir (F-j’ai la courbe) sont affichés à droite (n = 22). (B) exemple des traces de tir neuronale en réponse aux étapes d’injection actuel pour exprimant Rorb couche corticale IV excitateurs neurones (panneau de gauche). tdTomato + neurones ont été ciblées pour les enregistrements dans des tranches de cerveau de souris Rorb-IRES-Cre/Ai14. Données sommaires pour la relation de l’injection de courant taux de tir (F-j’ai la courbe) sont affichés à droite (n = 23). Chaque ligne mince colorée représente la F-j’ai la courbe pour un seul neurone ; considérant que, les lignes noires épaisses représente la moyenne pour chaque groupe +/-SEM. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
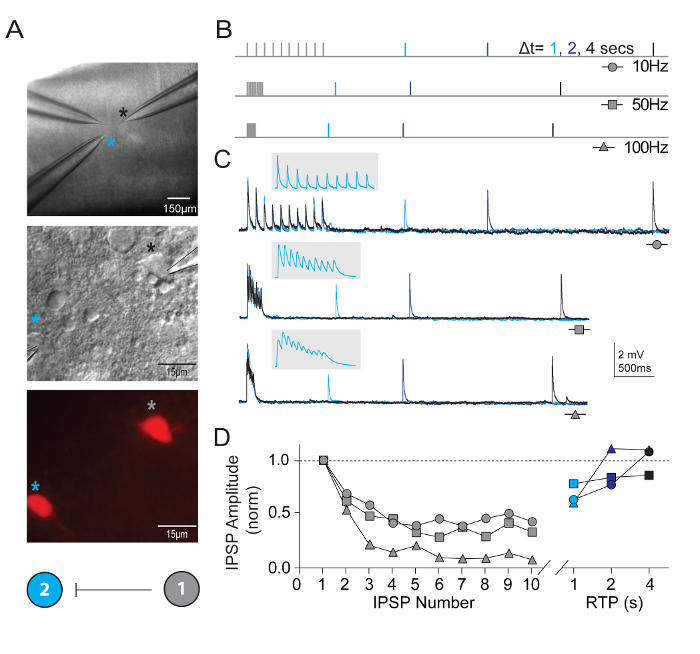
Figure 5 : La plasticité à court terme dans les synapses connectées exprimant le Pvalb corticales interneurones FS. Contraste d’interférence différentielle (A) et épifluorescence ont été utilisés pour cibler des interneurones FS tdTomato séropositifs, exprimant le Pvalb du cortex visuel primaire de souris. Un diagramme de connectivité schématique codé couleur démontrant une connexion synaptique unilatérale entre les deux interneurones. Schéma (B) les protocoles de stimulation utilisée pour évaluer la dynamique à court terme des synapses connectées les neurones. Trains de potentiels d’action 10 (10, 50 et 100 Hz) sont évoqués dans le neurone présynaptique, suivi d’un simple potentiel d’action (impulsion d’essai de récupération, RTP) livré avec différents temps de retard (1, 2 et 4 s) après que le train a pris fin. Chaque RTP sont couleur codée pour plus de clarté. (C) moyenne traces de correspondants unilatérales post-synaptiques potentiels inhibiteurs (uIPSPs) dans la cellule #2, en réponse aux trains de potentiels d’action évoqués dans la cellule #1. Encart gris a élargi l’échelle de temps pour afficher le tracé du train uIPSP. (D) normalisée uIPSP amplitudes sont tracées en fonction de leur position au cours des trains à des fréquences variables. Nette dépression est clairement à travers tout d’entrée tarifs avec une reprise importante d’uIPSP à 4 s. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
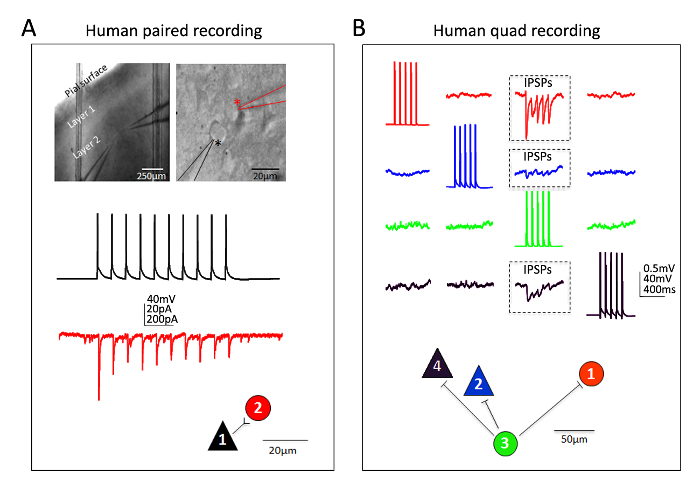
Figure 6 : Tranches de cerveau enregistrements pince multi-neurone patch chez un humain adulte neurochirurgicaux. Images de haute et basse grossissement IR-DIC (A) indiquant l’emplacement et l’identité des neurones enregistrés (panneaux supérieure). Un neurones pyramidaux (astérisque noir) et les voisin interneurone (astérisque rouge) ont été enregistrés simultanément. Couleur exemple codée traces de connexion synaptique excitatrice unidirectionnelle (ESPC) de cellule pyramidale interneurone (mesurée en EPSCs dans la bride de tension) et carte de connexion physique correspondante (panneaux inférieurs). (B) enregistrement de Quadruple patch clamp expérience dans une tranche de cerveau neurochirurgicaux humain adulte du cortex préfrontal dorsolatéral. Deux neurones pyramidaux et deux interneurones sont enregistrés simultanément, permettant de sonder séquentielle de douze possibles connexions synaptiques. Un train de potentiels d’action évoqués dans la cellule #3 (traces verts) a conduit à la détection des potentiels post-synaptiques inhibiteurs (PPSI) dans chacun des trois autres neurones simultanément enregistrés (en boîte de trois régions, panneaux supérieure). Les réponses de chaque neurone individuel sont couleur codée pour plus de clarté. La carte de connexion physique apparaît dans le panneau de fond. Noter les traces bruts indiqués sur (B) représentent les moyennes des balayages de fichiers RAW consécutifs au moins 20. Putative identification du type de cellule reposait sur la forme de soma, analyse de la morphologie de colorant fluorescent durant les enregistrements et les propriétés électrophysiologiques intrinsèques, y compris les patrons de tir en réponse à l’actuelle procédure d’injection. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| NMDG-HEPES FSCA | HEPES holding FSCA | Enregistrement de FSCA | |||||||
| Composant | mM | MW | g/litre | mM | MW | g/litre | mM | MW | g/litre |
| NMDG | 92 | 195,22 | 17.96 | ||||||
| HCl | 92 | 36,46 | * | ||||||
| NaCl | 92 | 58.44 | 5.38 | 124 | 58.44 | 7.25 | |||
| KCl | 2.5 | 74.55 | 0,19 | 2.5 | 74.55 | 0,19 | 2.5 | 74.55 | 0,19 |
| NaH2PO4 | 1.2 | 138.00 | 0,17 | 1.2 | 138.00 | 0,17 | 1.2 | 138.00 | 0,17 |
| NaHCO3 | 30 | 84.01 | 2.52 | 30 | 84.01 | 2.52 | 24 | 84.01 | 2.02 |
| HEPES | 20 | 238.31 | 4.77 | 20 | 238.31 | 4.77 | 5 | 238.31 | 1.19 |
| Glucose | 25 | 180,20 | 4.51 | 25 | 180,20 | 4.51 | 12,5 | 180,20 | 2.25 |
| ascorbate de sodium | 5 | 198.00 | 0.99 | 5 | 198.00 | 0.99 | 0 | 198.00 | 0.00 |
| Thiourée | 2 | 76.12 | 0,15 | 2 | 76.12 | 0,15 | 0 | 76.12 | 0.00 |
| pyruvate de sodium | 3 | 110.04 | 0,33 | 3 | 110.04 | 0,33 | 0 | 110.04 | 0.00 |
| MgSO4.7H2O | 10 | 246.48 | 5 mL | 2 | 246.48 | 1 mL | 2 | 246.48 | 1 mL (Stock 2M) |
| CaCl2.2H2O | 0,5 | 147,01 | 0,25 mL | 2 | 147,01 | 1 mL | 2 | 147,01 | 1 mL (stock 2M) |
| * titrer pH de NMDG-HEPES FSCA de 7,3 à 7,4 avec HCl concentré | |||||||||
| Toutes les solutions doivent être dans la gamme 300-310 mOsm/Kg | |||||||||
Tableau 1 : Formulations médias.
| Animal âge | |||||
| Temps (min) * | < 1 mois | 1-3 mois | 3–6 mois | 6-12 mois | 12 mois + |
| 0 | 250 ΜL | 250 ΜL | |||
| 1 | |||||
| 2 | 250 ΜL | ||||
| 3 | |||||
| 4 | 500 ΜL | ||||
| 5 | 250 ΜL | 250 ΜL | |||
| 6 | 1000 ΜL | ||||
| 7 | |||||
| 8 | 2000 ΜL | ||||
| 9 | |||||
| 10 | transfert | 500 ΜL | 250 ΜL | 250 ΜL | |
| 11 | |||||
| 12 | |||||
| 13 | |||||
| 14 | |||||
| 15 | 1000 ΜL | 500 ΜL | 250 ΜL | 250 ΜL | |
| 16 | |||||
| 17 | |||||
| 18 | |||||
| 19 | |||||
| 20 | 2000 ΜL | 1000 ΜL | 500 ΜL | 250 ΜL | |
| 21 | |||||
| 22 | |||||
| 23 | |||||
| 24 | |||||
| 25 | transfert | 2000 ΜL | 1000 ΜL | 500 ΜL | |
| 26 | |||||
| 27 | |||||
| 28 | |||||
| 29 | |||||
| 30 | transfert | 2 000 ΜL | 1 000 ΜL | ||
| 31 | |||||
| 32 | |||||
| 33 | |||||
| 34 | |||||
| 35 | transfert | 2 000 ΜL | |||
| 36 | |||||
| 37 | |||||
| 38 | |||||
| 39 | |||||
| 40 | transfert | ||||
| * Temps zéro est que les tranches du moment sont transférés dans la chambre de recouvrement initial | |||||
Tableau 2 : Calendrier recommandé pour Na progressive + procédure de pointe selon l’âge de la souris.
Discussion
Na + Spike pinçage Seal Gigaohm Formation et Patch Clamp, enregistrant des succès
La version initiale de la méthode de recouvrement protecteur de NMDG a été spécialement conçue pour les animaux adultes et vieillissement2,5. Certains utilisateurs précoces ont également cherché à appliquer cette méthodologie à cerveau animal juvénile tranchage (c.-à-d., souris < 30 jours). Toutefois, il a été noté que contrairement à l’exceptionnelle confirmée visuellement neuronale préservation avec la méthode de recouvrement protecteur NMDG dans cette tranche d’âge, les gigaohm joint la formation peut se caler fréquemment, menant à échec patch clamp de tentatives d’enregistrement. Une hypothèse est que les cations NMDG sont plus facilement pris au piège dans des tranches de cerveau pour mineurs par rapport à des tranches de cerveau adulte et peuvent gêner la formation de joint ; Cependant, gigaohm joints peuvent se former facilement tandis que les tranches de cerveau juvénile sont entièrement submergés NMDG aCSF (données non présentées), indiquant ainsi que NMDG FSCA en soi pas entrave la formation joint gigaohm.
La transition rapide de la solution de Na+ de faible à élevé à la fin de l’étape de récupération de tranches de cerveau initial provoque des dommages aux membranes neuronales et perturbe le processus de formation du sceau. C’est intuitif, étant donné que la transition de faible à élevé Na+, température froide-au-chaud et une élévation dramatique du Ca2 + Mg2 + ratio collectivement entraîner une réapparition massive de l’activité synaptique spontanée. Cette phase de détente inhibiteur dans le cerveau de tranchage de procédure est susceptible de mettre en miroir la lésion de reperfusion après un accident ischémique. Ainsi, afin d’atténuer les dommages membrane neuronale dans la phase de relèvement initial qu'une progressive Na+ spike procédure a été intégrée dans lequel l’élévation de la concentration de Na+ dans la chambre d’incubation NMDG recouvrement protecteur est lentement et de façon reproductible élevées avec un timing précis. Comme dans la procédure de recouvrement protecteur original, la dissociation temporelle des Na+ élévation de température et Ca2 +/Mg2 + ratio élévation est bénéfique. En outre, la procédure de spike Na+ mène à petites augmentations graduelles des concentrations extracellulaires de Na+ sur les premiers points dans le temps et les fortes augmentations vers les points de temps fin, offrant ainsi le tissu cérébral, mais un occasion de mieux s’adapter à l’élévation du niveau des Na+ . Cette procédure est qu'une alternative à exchange solution progressive contrôlé par une pompe à perfusion ou la gravité des lignes de goutte à goutte qui conduisent à l’augmentation constante des niveaux de Na+ et nécessitent une attention pour les apports et les retraits pour éviter tout débordement de la chambre de la tranche. Notamment, dans ce Na+ procédure PIC l’osmolarité de la solution dans la chambre de tranche augmente progressivement sur une période de plusieurs minutes avant que les tranches sont retournés à la solution dont l’osmolalité est normale, mais cela n’affecte pas négativement la santé tranche ou enregistrement de patch clamp de la réussite. Une solution de découpe haute osmolalité a déjà été utilisée pour les préparations de tranches mésencéphale afin de mieux préserver les neurones de dopamine pour patch clamp enregistrements57,58, démontrant ainsi que ce temporaire hyperosmolalité peut être salutaire dans certains contextes.
En mettant en place une procédure optimisée combinant la méthode de recouvrement protecteur NMDG et progressive Na+ épi-en étape l’utilité de cette méthode de tranche de cerveau a été étendu pour couvrir les jeunes à travers des âges animaux adultes matures. Ce protocole mis à jour est maintenant adapté pour un large éventail d’animaux âgés en utilisant une seule formulation de FSCA NMDG optimale et une procédure. Si nécessaire, la procédure de spike Na+ peut être appliquée avec un retard progressivement plus longue et/ou plus lente évolution temporelle afin d’améliorer la viabilité des tranches de cerveau d’animaux plus âgés, et nous avons fourni un guide de base de recommandée spike-en annexes selon à animal âge (voir tableau 2). Alors que nous avons fourni un cadre de base pour un large éventail d’applications, des étapes avancées supplémentaires peuvent être explorées pour renforcer encore la viabilité et la longévité des tranches de cerveau d’animaux adultes et vieillissement. Par exemple, les stratégies de restauration de glutathion sont particulièrement efficaces à cet égard et peuvent être implémentées comme décrit ailleurs2,6.
Améliorant le débit pour contester les expériences
L’analyse de la connectivité synaptique par enregistrement de patch clamp est une application exigeante nécessitant une excellente conservation de la structure neuronale et la fonction afin d’atteindre une haute fiabilité de succès. Comme le nombre de neurones à enregistrer simultanément augmente linéairement, le niveau de difficulté technique Monte supra-linéairement. Il existe de nombreux modes de défaillance, et une des causes plus fréquentes d’échecs est l’incapacité à joints adéquats gigaohm forme sur une ou plusieurs des cellules ciblées. Cela peut ralentir considérablement des progrès, en particulier lorsque trois ou plusieurs neurones doivent être enregistrés simultanément. Joint de gigaohm conformément à la conclusion de plus rapide temps de formation avec la méthode de recouvrement protecteur NMDG optimisée, il y avait une nette amélioration dans le taux de réussite et le débit d’enregistrement de multiples neurones patch clamp expériences avec les deux adulte transgéniques coupes de cerveau de souris et des tranches de cerveau neurochirurgicaux humain adulte. L’amélioration de l’efficacité est presque certainement attribuable à la fois la formation de joint de gigaohm plus rapide et plus fiable et la préservation neuronale améliorée des tranches avec ce protocole. Bien que ce protocole met l’accent sur les avantages explicitement pour patch clamp de demandes d’enregistrement, des gains similaires sont prévus pour d’autres applications expérimentales difficiles où la viabilité de tranches de cerveau est primordiale.
Acknowledgements
Ce travail a été financé par l’Institut Allen pour la Science du cerveau. Les auteurs tiennent à remercier les fondateurs de Allen Institute, Paul G. Allen et Jody Allen, pour leur vision, encouragement et soutien. Nous remercions également le personnel de soutien technique de Allen Institute pour l’exécution de génotypage, élevage et soins aux animaux.
Materials
| Name | Company | Catalog Number | Comments |
| Compresstome VF-200 | Precisionary Instruments | VF-200 | Vibrating tissue slicer (recommended) |
| N-methyl-D-glucamine | Sigma Aldrich | M2004 | aCSF constituent |
| Sodium Chloride | Sigma Aldrich | S3014 | aCSF constituent |
| Potassium Chloride | Sigma Aldrich | P5405 | aCSF constituent |
| Sodium Phosphate monobasic dihydrate | Sigma Aldrich | 71505 | aCSF constituent |
| Sodium Bicarbonate | Sigma Aldrich | S5761 | aCSF constituent |
| HEPES | Sigma Aldrich | H4034 | aCSF constituent |
| Glucose | Sigma Aldrich | G7021 | aCSF constituent |
| Sodium Ascorbate | Sigma Aldrich | A4034 | aCSF constituent |
| Thiourea | Sigma Aldrich | T8656 | aCSF constituent |
| Sodium pyruvate | Sigma Aldrich | P5280 | aCSF constituent |
| Calcium chloride dihydrate | Sigma Aldrich | C7902 | aCSF constituent |
| Magnesium Sulfate heptahydrate | Sigma Aldrich | M1880 | aCSF constituent |
| 2,2,2-Tribromoethanol | Sigma Aldrich | T48402 | Anesthetic component 1 |
| 2-methyl-2-butanol | Sigma Aldrich | 240486 | Anesthetic component 2 |
| Curved blunt forceps | Fine Science Tools | 11065-07 | Brain dissection tools |
| Fine dissecting scissors (supercut) | Fine Science Tools | 14058-09 | Brain dissection tools |
| Large heavy duty scissors 7'' | Fine Science Tools | 14000-18 | Brain dissection tools |
| Metal spatula | Sigma Aldrich | Z511455-1PAK | Brain dissection tools |
| Razor blades | VWR | 89031-954 | Brain dissection tools |
| Brain Slice Keeper-4 | Automate Scientific | S-BSK4 | brain slice holding chamber |
| nylon netting | Warner Instruments | 64-0198 | For building small slice recovery chambers |
| Pyrex glass beakers (250 mL) | VWR | 89090-434 | For building small slice recovery chambers |
| 35 mm plastic dish, round | VWR | 100488-376 | For building small slice recovery chambers |
| Gas diffuser stones (10 µm) | Sigma Aldrich | 59277 | For constant carbogenation (fine bubbles) |
| Agarose Type I-B | Sigma Aldrich | A0576 | For embedding brain specimens |
| Micro loader tips | Eppendorf | 22491229 | For filling patch clamp electrodes |
| Sylgard | VWR | 102092-312 | For making a custom dissecting platform |
| Hydrochloric acid | Sigma Aldrich | H1758-100ML | For pH adjustment of media |
| Sodium Hydroxide | Sigma Aldrich | 221465-25G | For pH adjustment of media |
| Potassium Hydroxide | Sigma Aldrich | 221473 | For pH adjustment of media |
| Plastic transfer pipets 3 mL graduated | VWR | 89497-676 | For slice transfer |
| Zirconium ceramic injector blades | Cadence Specialty Blades | EF-INZ10 | http://cadenceinc.com/ |
| KG-33 borosilicate glass capillary w/filament | King Glass Company | custom quote | ID: 0.87mm, OD 1.50mm |
| Biocytin | Sigma Aldrich | B4261 | Intern pipette solution |
| Phosphocreatine disodium | Sigma Aldrich | P7936 | Intern pipette solution |
| Potassium Gluconate | Sigma Aldrich | G4500-100G | Intern pipette solution |
| EGTA | Sigma Aldrich | E3889 | Intern pipette solution |
| Mg-ATP | Sigma Aldrich | A9187 | Intern pipette solution |
| Na2-GTP | Sigma Aldrich | 51120 | Intern pipette solution |
| sucrose | Sigma Aldrich | S0389 | Intern pipette solution |
| Heated water bath (2.5L) | VWR | 13491-060 | Miscellaneous |
| Filter paper rounds | VWR | 28456-022 | Miscellaneous |
| Cyanoacrylate glue | Amazon | B000BQRBO6 | Miscellaneous |
| Glass petri dish | VWR | 89000-326 | Miscellaneous |
| 10X Phosphate buffered saline | Sigma Aldrich | P5493 | Miscellaneous |
| 30 mL syringes | VWR | BD302832 | Miscellaneous |
| 1 mL syringes | VWR | BD-309628 | Miscellaneous |
| 25 5/8 gauge needles | VWR | 89219-292 | Miscellaneous |
| Thermomixer (w/1.5 mL tube block) | VWR | 89232-908 | To keep agarose molten |
References
- Aghajanian, G. K., Rasmussen, K. Intracellular studies in the facial nucleus illustrating a simple new method for obtaining viable motoneurons in adult rat brain slices. Synapse. 3 (4), 331-338 (1989).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods Mol Biol. 1183, 221-242 (2014).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nat Methods. 8 (9), 745-752 (2011).
- Peca, J., et al. Shank3 mutant mice display autistic-like behaviours and striatal dysfunction. Nature. 472 (7344), 437-442 (2011).
- Ting, J. T. F., et al. Improved methods for acute brain slice preparation from adult and aging animals. Society for Neuroscience Abstracts. 520, (2011).
- Ting, J. T. F., et al. Improved methods for acute brain slice preparation from adult and aging animals (Part II): Glutathione depletion underlies rapid deterioration of adult brain slices. Society for Neuroscience Abstracts. 505, (2012).
- MacGregor, D. G., Chesler, M., Rice, M. E. HEPES prevents edema in rat brain slices. Neurosci Lett. 303 (3), 141-144 (2001).
- Liu, Y. B., Guo, J. Z., Chiappinelli, V. A. Nicotinic receptor-mediated biphasic effect on neuronal excitability in chick lateral spiriform neurons. Neuroscience. 148 (4), 1004-1014 (2007).
- Xiang, Z., Huguenard, J. R., Prince, D. A. GABAA receptor-mediated currents in interneurons and pyramidal cells of rat visual cortex. J Physiol. 506, 715-730 (1998).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nat Protoc. 1 (4), 2075-2081 (2006).
- Contractor, A., et al. Loss of kainate receptor-mediated heterosynaptic facilitation of mossy-fiber synapses in KA2-/- mice. J Neurosci. 23 (2), 422-429 (2003).
- Pita-Almenar, J. D., Collado, M. S., Colbert, C. M., Eskin, A. Different mechanisms exist for the plasticity of glutamate reuptake during early long-term potentiation (LTP) and late LTP. J Neurosci. 26 (41), 10461-10471 (2006).
- Ito, K., Contractor, A., Swanson, G. T. Attenuated plasticity of postsynaptic kainate receptors in hippocampal CA3 pyramidal neurons. J Neurosci. 24 (27), 6228-6236 (2004).
- Van Dort, C. J., et al. Optogenetic activation of cholinergic neurons in the PPT or LDT induces REM sleep. Proc Natl Acad Sci U S A. 112 (2), 584-589 (2015).
- Ferando, I., Mody, I. Altered gamma oscillations during pregnancy through loss of delta subunit-containing GABA(A) receptors on parvalbumin interneurons. Front Neural Circuits. 7, 144 (2013).
- Walker, A. G., et al. Metabotropic glutamate receptor 3 activation is required for long-term depression in medial prefrontal cortex and fear extinction. Proc Natl Acad Sci U S A. 112 (4), 1196-1201 (2015).
- Takahashi, Y. K., et al. Neural estimates of imagined outcomes in the orbitofrontal cortex drive behavior and learning. Neuron. 80 (2), 507-518 (2013).
- Pan, G., et al. Preserving GABAergic interneurons in acute brain slices of mice using the N-methyl-D-glucamine-based artificial cerebrospinal fluid method. Neurosci Bull. 31 (2), 265-270 (2015).
- LaSarge, C. L., Santos, V. R., Danzer, S. C. PTEN deletion from adult-generated dentate granule cells disrupts granule cell mossy fiber axon structure. Neurobiol Dis. 75, 142-150 (2015).
- Tong, L. M., et al. Inhibitory interneuron progenitor transplantation restores normal learning and memory in ApoE4 knock-in mice without or with Abeta accumulation. J Neurosci. 34 (29), 9506-9515 (2014).
- Fleming, R. L., et al. Binge-pattern ethanol exposure during adolescence, but not adulthood, causes persistent changes in GABAA receptor-mediated tonic inhibition in dentate granule cells. Alcohol Clin Exp Res. 37 (7), 1154-1160 (2013).
- Kummer, K. K., El Rawas, R., Kress, M., Saria, A., Zernig, G. Social interaction and cocaine conditioning in mice increase spontaneous spike frequency in the nucleus accumbens or septal nuclei as revealed by multielectrode array recordings. Pharmacology. 95 (1-2), 42-49 (2015).
- Qi, J., et al. A glutamatergic reward input from the dorsal raphe to ventral tegmental area dopamine neurons. Nat Commun. 5, 5390 (2014).
- Wang, L., et al. Modulation of dopamine release in the striatum by physiologically relevant levels of nicotine. Nat Commun. 5, 3925 (2014).
- Siuda, E. R., et al. Spatiotemporal Control of Opioid Signaling and Behavior. Neuron. , (2015).
- Tucker, K. R., Huertas, M. A., Horn, J. P., Canavier, C. C., Levitan, E. S. Pacemaker rate and depolarization block in nigral dopamine neurons: a somatic sodium channel balancing act. J Neurosci. 32 (42), 14519-14531 (2012).
- McDevitt, R. A., et al. Serotonergic versus nonserotonergic dorsal raphe projection neurons: differential participation in reward circuitry. Cell Rep. 8 (6), 1857-1869 (2014).
- Wang, D. V., et al. Mesopontine median raphe regulates hippocampal ripple oscillation and memory consolidation. Nat Neurosci. 18 (5), 728-735 (2015).
- Engle, S. E., Shih, P. Y., McIntosh, J. M., Drenan, R. M. alpha4alpha6beta2* nicotinic acetylcholine receptor activation on ventral tegmental area dopamine neurons is sufficient to stimulate a depolarizing conductance and enhance surface AMPA receptor function. Mol Pharmacol. 84 (3), 393-406 (2013).
- Vance, K. M., Ribnicky, D. M., Rogers, R. C., Hermann, G. E. Artemisia santolinifolia enhances glutamatergic neurotransmission in the nucleus of the solitary tract. Neurosci Lett. 582, 115-119 (2014).
- Dergacheva, O., Boychuk, C. R., Mendelowitz, D. Developmental changes in GABAergic neurotransmission to presympathetic and cardiac parasympathetic neurons in the brainstem. J Neurophysiol. 110 (3), 672-679 (2013).
- Dergacheva, O. Chronic intermittent hypoxia alters neurotransmission from lateral paragigantocellular nucleus to parasympathetic cardiac neurons in the brain stem. J Neurophysiol. 113 (1), 380-389 (2015).
- Dyavanapalli, J., et al. Chronic intermittent hypoxia-hypercapnia blunts heart rate responses and alters neurotransmission to cardiac vagal neurons. J Physiol. 592, 2799-2811 (2014).
- Apostolides, P. F., Trussell, L. O. Regulation of interneuron excitability by gap junction coupling with principal cells. Nat Neurosci. 16 (12), 1764-1772 (2013).
- Graziane, N. M., Polter, A. M., Briand, L. A., Pierce, R. C., Kauer, J. A. Kappa opioid receptors regulate stress-induced cocaine seeking and synaptic plasticity. Neuron. 77 (5), 942-954 (2013).
- Ferando, I., Mody, I. In vitro gamma oscillations following partial and complete ablation of delta subunit-containing GABAA receptors from parvalbumin interneurons. Neuropharmacology. 88, 91-98 (2015).
- Foster, D. J., et al. M5 receptor activation produces opposing physiological outcomes in dopamine neurons depending on the receptor's location. J Neurosci. 34 (9), 3253-3262 (2014).
- Engle, S. E., Broderick, H. J., Drenan, R. M. Local application of drugs to study nicotinic acetylcholine receptor function in mouse brain slices. J Vis Exp. (68), e50034 (2012).
- Wang, L., et al. Temporal components of cholinergic terminal to dopaminergic terminal transmission in dorsal striatum slices of mice. J Physiol. 592, 3559-3576 (2014).
- Holloway, B. B., et al. Monosynaptic glutamatergic activation of locus coeruleus and other lower brainstem noradrenergic neurons by the C1 cells in mice. J Neurosci. 33 (48), 18792-18805 (2013).
- DePuy, S. D., et al. Glutamatergic neurotransmission between the C1 neurons and the parasympathetic preganglionic neurons of the dorsal motor nucleus of the vagus. J Neurosci. 33 (4), 1486-1497 (2013).
- Abbott, S. B., Holloway, B. B., Viar, K. E., Guyenet, P. G. Vesicular glutamate transporter 2 is required for the respiratory and parasympathetic activation produced by optogenetic stimulation of catecholaminergic neurons in the rostral ventrolateral medulla of mice in vivo. Eur J Neurosci. 39 (1), 98-106 (2014).
- Dergacheva, O., Dyavanapalli, J., Pinol, R. A., Mendelowitz, D. Chronic intermittent hypoxia and hypercapnia inhibit the hypothalamic paraventricular nucleus neurotransmission to parasympathetic cardiac neurons in the brain stem. Hypertension. 64 (3), 597-603 (2014).
- Chen, Q., et al. Imaging neural activity using Thy1-GCaMP transgenic mice. Neuron. 76 (2), 297-308 (2012).
- Luongo, F. H., Horn, M. E. Sohal V.S. Putative microcircuit-level substrates for attention are disrupted in mouse models of autism. Biological Psychiatry. 79 (8), 667-675 (2016).
- Vance, K. M., Rogers, R. C., Hermann, G. E. PAR1-activated astrocytes in the nucleus of the solitary tract stimulate adjacent neurons via NMDA receptors. J Neurosci. 35 (2), 776-785 (2015).
- Feliciano, P., Andrade, R., Bykhovskaia, M. Synapsin II and Rab3a cooperate in the regulation of epileptic and synaptic activity in the CA1 region of the hippocampus. J Neurosci. 33 (46), 18319-18330 (2013).
- Tomioka, N. H., et al. Elfn1 recruits presynaptic mGluR7 in trans and its loss results in seizures. Nat Commun. 5, 4501 (2014).
- Jiang, X., et al. Principles of connectivity among morphologically defined cell types in adult neocortex. Science. 350 (6264), 9462 (2015).
- Mishra, A., et al. Imaging pericytes and capillary diameter in brain slices and isolated retinae. Nat Protoc. 9 (2), 323-336 (2014).
- Gabriel, L. R., Wu, S., Melikian, H. E. Brain slice biotinylation: an ex vivo approach to measure region-specific plasma membrane protein trafficking in adult neurons. J Vis Exp. (86), (2014).
- Edwards, F. A., Konnerth, A. Patch-clamping cells in sliced tissue preparations. Methods Enzymol. 207, 208-222 (1992).
- Qi, G., Radnikow, G., Feldmeyer, D. Electrophysiological and morphological characterization of neuronal microcircuits in acute brain slices using paired patch-clamp recordings. J Vis Exp. (95), e52358 (2015).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. J Vis Exp. (91), e51706 (2014).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 13 (1), 133-140 (2010).
- Hille, B. The permeability of the sodium channel to organic cations in myelinated nerve. J Gen Physiol. 58 (6), 599-619 (1971).
- Martin, M., Chen, B. T., Hopf, F. W., Bowers, M. S., Bonci, A. Cocaine self-administration selectively abolishes LTD in the core of the nucleus accumbens. Nat Neurosci. 9 (7), 868-869 (2006).
- Chen, B. T., et al. Cocaine but not natural reward self-administration nor passive cocaine infusion produces persistent LTP in the VTA. Neuron. 59 (2), 288-297 (2008).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved