Vorbereitung der akuten Gehirnscheiben mit einem optimierten N-Methyl-D-Glucamine-schützende Recovery-Methode
* These authors contributed equally
In This Article
Summary
Dieses Protokoll veranschaulicht die Implementierung einer optimierten N-Methyl-D-Glucamine (NMDG) schützende Wiederherstellungsmethode der Gehirn-Scheibe-Vorbereitung. Eine einziges Medium Formulierung wird verwendet, um Tiere jeden Alters und für verschiedenste experimentelle Anwendungen zuverlässig gesunde Gehirnscheiben einzuholen.
Abstract
Dieses Protokoll ist ein praktischer Leitfaden für die N-Methyl-D-Glucamine (NMDG) schützende Wiederherstellungsmethode der Gehirn-Scheibe-Vorbereitung. Zahlreiche Studien haben die Nützlichkeit dieser Methode zur Verbesserung der neuronalen Erhaltung und insgesamt Gehirn Slice Lebensfähigkeit validiert. Die Umsetzung dieser Technik von "early adopters" hat detaillierte Untersuchungen der Funktion des Gehirns mit vielfältigen experimentellen Anwendungen und umfasst eine Vielzahl von tierischen Alter, Hirnregionen und Zelltypen erleichtert. Die aufgeführten Schritte sind für die Durchführung der schützenden Erholung Gehirn Stück Technik mit einem optimierten NMDG künstliche Liquor cerebrospinalis (ACFS) Medien Formulierung und verbesserte Verfahren, um gesunde Gehirnscheiben für Patch-Clamp-Elektrophysiologie zuverlässig zu erhalten. Mit diesem aktualisierten Ansatz eine wesentliche Verbesserung in der Geschwindigkeit eingehalten wird und Zuverlässigkeit der Gigaohm Dichtung Formation während gezielte Patch Clamp Aufnahme Experimente unter Beibehaltung der ausgezeichnete Erhaltungszustand der neuronalen, wodurch es schwierig experimentelle Anwendungen. Repräsentative Ergebnisse werden bereitgestellt von Multi-Neuron Patch Clamp Experimente zur Testdurchführung Aufnahme synaptischen Konnektivität in neokortikalen Hirnschnitten von jungen Erwachsenen transgenen Mäusen und reifen Erwachsenen menschlichen neurochirurgischen Proben vorbereitet. Darüber hinaus ist die optimierte NMDG schützende Wiederherstellungsmethode des Gehirns schneiden kompatibel mit juvenilen und adulten Tieren, damit eine Einschränkung der ursprünglichen Methode zu lösen. Zusammenfassend lässt sich sagen sind ein einzelnes Medium Formulierung und Gehirn schneiden Verfahren in verschiedenen Arten und Altersklassen, ausgezeichnete Erhaltungszustand der Lebensfähigkeit und Gewebe zu erreichen realisierbar.
Introduction
Die akute Gehirn Slice Vorbereitung ist eine wesentliche experimentelle Modellsystem in den Neurowissenschaften. Für etwa ein halbes Jahrhundert hat diese Plattform dynamische funktionelle Studien des lebenden Gehirns in einer Vielzahl von anatomischen Hirnregionen und Tierarten aktiviert. Ob die beabsichtigte Anwendung Biochemie, funktionelle Bildgebung, Morphologie oder Elektrophysiologie ist, ist es von größter Bedeutung für optimale Integrität und Lebensfähigkeit des geschnittenen Gewebes zu gewährleisten. Es ist aus diesem Grund, dass die hoch belastbare juvenile Nagetier Gehirn Slice Vorbereitung (d.h.jünger als postnatale 30 Tage für Mäuse) bis heute die am meisten bevorzugt wurde. Die Schwierigkeit bei der Beschaffung von ausreichend gesunden Gehirns Scheiben aus älterer Erwachsener und erweist sich eine gewaltige Herausforderung für die meisten Tiere altern und schwere Einschränkungen für die Untersuchung der funktionellen Architektur des Gehirns Reife auferlegt hat. Dies gilt insbesondere für die Patch-Clamp Aufnahme, eine Technik, die erfordert exzellente morphologische und funktionelle Erhaltung und ist unverzichtbar für die Charakterisierung von detaillierter intrinsischer und synaptischer Eigenschaften identifiziert einzelne Neuronen. Für die letzten Jahrzehnte haben die überwiegende Mehrheit der Patch-Clamp-Elektrophysiologen auf eine "schützende" Schnittmethode mit Saccharose ersetzt niedrige Na+ ACFS1 für die Zubereitung von gesunden Hirnschnitten von juvenilen und in weit geringerem verlassen. Umfang, junge Erwachsene Tiere. Diese Methode basiert auf der Prämisse, dass passive Na+ Zustrom und anschließende Wassereintritt und Zelle Schwellung während der Scheibe schneiden Schritt ist die vorherrschende Beleidigung, das führt zu schlechten Überleben der Neuronen, besonders für jene Neuronen befindet sich in der oberflächlichen Schichten, die am ehesten auf direktes Trauma von der Messerbewegung aufrecht zu erhalten. Allerdings lässt die schützende Schnittmethode noch viel zu wünschen übrig für Gehirn Slice Vorbereitung von reife Erwachsene Tiere unabhängig von der besonderen ACFS Rezeptur umgesetzt.
Eine einfache, aber effektive Lösung dieses Problems wurde2,3,4,5,6 beschrieben und bezeichnet die "schützenden" Gehirn Slice Wiederherstellungsmethode. Die ursprüngliche Version dieser Methode verwendet eine NMDG ersetzt ACFS NMDG als vielseitig und effektiv unter verschiedenen anderen Kandidaten Natrium Ion Ersatzstoffe (einschließlich Saccharose, Glycerin, Cholin und Tris) identifiziert wurde. Die Medien-Formulierung wurde weiter verbessert, durch Zugabe von HEPES Slice Hirnödem zu widerstehen und stärkere pH Pufferung7sowie die Zugabe von Ergänzungen, die schädlichen Auswirkungen von oxidativem Stress (Tabelle 1) entgegenzuwirken. Es wurde empirisch festgestellt, dass eine anfänglicher Besserung Inkubation in niedrigen Na+, niedrige Ca2 +, und hohe Mg2 + NMDG ACFS unmittelbar nach erwachsenen Gehirn Gewebe schneiden notwendig und ausreichend für neuronale verbesserte Konservierung über einen weiten Bereich von Gehirnregionen, Zelltypen und tierischen Alter3,5,6.
Vor allem frühere Inkarnationen von was jetzt die schützende Wiederherstellungsmethode genannt wird in der Literatur1,8,9,10,11,12, finden Sie 13, obwohl das Potenzial für älterer Erwachsener und Alterung tierischen Gehirn Slice und Patch Clamp-Aufnahme war nicht erkannt oder in diesen früheren Werken gezeigt. Darüber hinaus weiterhin differenzierte Verfahren Variationen zur Unterstützung der spezifischen experimentellen Anwendungen4,14,15,16entstehen. Die kollektive Körper der Arbeit von diesen zahlreichen Forschungsgruppen vermittelt hohes Vertrauen in die Robustheit des schützenden Wiederherstellungsmethode für verbesserte Gewebe Erhaltung. Die NMDG schützende Wiederherstellungsmethode hat jetzt weithin beschlossen und umgesetzt in zahlreichen veröffentlichten Studien nutzen Erwachsenen tierischen Gehirn Slice Vorbereitungen. Diese akuten Slice Studien umfassen neokortikalen3,17,18, hippocampal15,19,20,21, striatalen22 , 23 , 24, Mittelhirn25,26,27,28,29und Hinterhirn30,31,32, 33 , 34 Regionen und eine Vielzahl von Neurotransmitter und Neuromodulator Arten einschließlich glutamatergen4,30, GABAergen18,20,31,35 ,36, dopaminergen24,29,37,38, cholinerge14,37,38, 39, noradrenergen40und serotonergen27,28 Neurotransmission. Die Methode eignet sich auch gut für optogenetische Kontrolle neuronaler Aktivität in Scheiben von transgenen Tieren3,39 oder nach in-Vivo virale Injektionen17,27abgeleitet, 28,40,41,42,43, als auch funktionelle Ca2 + Bildgebung neuronaler Aktivität2,44 ,45,46. Analysen der kurzfristige Plastizität4,47,48 und vielfältige Formen der langfristigen Plastizität16,35,48 berichtet. Eine aktuelle Studie angewendet die NMDG schützende Wiederherstellungsmethode zur Erleichterung, umfassende und systematische Erforschung der synaptischen Verbindungen im visuellen Kortex in reife Erwachsene Maus Gehirnscheiben mit der Octopatch Aufnahme Konfiguration49 – ein leistungsfähiges Beweis für den nutzen und die Robustheit dieser Methode. Die schützende Wiederherstellungsmethode wurde sogar erfolgreich in zuvor unvorhergesehene experimentelle Kontexte, wie verbesserte Erhaltung der Gefäßsystem und Perizyten im erwachsenen Gehirn kortikale Scheiben50, Patch-Clamp Aufnahme vom angewendet Interneuron Populationen in 1-1,5 Jahr alt von Alzheimer Maus Modelle20und einem Erwachsenen Gehirn Slice Rezeptor Menschenhandel Assay51transplantiert.
Das folgende Protokoll beschreibt Schritt für Schritt Verfahren für die Implementierung eines optimierten NMDG schützende Wiederherstellungsmethode Gehirn Slice Vorbereitung, um die Rentabilität der akuten Hirnschnitten zu verbessern. Die Grundsätze für verbesserte neuronale Erhaltung werden besprochen, sowie Demonstration der klare Vorteile dieser Methodik für komplexe Multi-Neuron Patch Clamp Aufnahme Experimente in jungen Erwachsenen transgenen Maus Gehirnscheiben und älterer Erwachsener menschlichen neurochirurgischen Gehirnscheiben. Das folgende Protokoll wurde für Mäuse aus 21 Tage alt, mehr als ein Jahr alt, als auch für menschliche neurochirurgischen Proben von erwachsenen Patienten abgeleitet validiert.
Protocol
Verfahren im Zusammenhang mit transgenen Mäusen wurden von der institutionellen Animal Care und Nutzung Committee (IACUC) am Allen Institut für Hirnforschung genehmigt. Männliche und weibliche C57BL/6 Mäusen (Gewichtsbereich 10-30 g) wurden in diesen Experimenten verwendet. Einige repräsentative Ergebnisse beschreiben von lebenden menschlichen Gehirnscheiben erhobenen Daten. Neokortikale Gewebeproben wurden während der Neurosurgeries für die Tumor-Entfernung erhalten. Es war notwendig, die darüber liegende neokortikale Gewebe um Zugriff auf das erkrankte Gewebe zu entfernen. Informierte Zustimmung des Patienten wurde in allen Fällen für die Nutzung der neurochirurgischen Gewebe um zu Forschungszwecken unter ein Protokoll genehmigt von der institutionellen Review Board der Swedish Medical Center erhalten.
1. Vorbereitung von Medien und Reagenzien (Tabelle 1)
Hinweis: Lösungen sollten in gereinigtem Wasser bestehen, das frei von Spurenmetallen und andere Verunreinigungen. Es wird empfohlen, Lösungen am Tag des Experiments, frisch zubereitet werden, obwohl nicht verwendete Lösungen bei 4 ° C für bis zu 1 Woche gespeichert werden können, falls gewünscht. Jede Formulierung oben 1 L ist ausreichend für 1 – 2 slicing Verfahren. Alle ACFS Lösungen müssen vor der Verwendung zu stabilen pH Pufferung und adäquate Oxygenierung zu gewährleisten mit Carbogen (95 % O25 % CO2) gesättigt sein. 7,3-7,4 und Osmolalität sollte der pH-Wert aller Lösungen angepasst werden gemessen und auf 300-310 50er/kg eingestellt.
- Bereiten Sie NMDG HEPES ACFS (in mM): 92 NMDG, 2,5 KCl, 1,25 NaH2PO4, 30 Nahco33, 20 HEPES, 25 Glukose, 2 Thioharnstoff, 5 Na-Ascorbat, 3 Na-Pyruvat, 0,5 CaCl2·2H2O und 10 MgSO4·7H2O. Titrate pH-Wert 7,3 –7.4 mit 17 mL +/-0,5 mL 5 M Salzsäure.
Hinweis: Dieser Titration Schritt sollte idealerweise vor der Zugabe von zweiwertigen kationen Niederschläge zu vermeiden durchgeführt werden; jedoch kann der Niederschlag nach Einstellung des pH-Wertes auf den physiologischen Bereich rückgängig gemacht werden. - Bereiten HEPES hält ACFS (in mM): 92 NaCl, 2.5 KCl, 1,25 NaH2PO4, 30 Nahco33, 20 HEPES, 25 Glukose, 2 Thioharnstoff, 5 Na-Ascorbat, 3 Na-Pyruvat, 2 CaCl2·2H2O und 2 MgSO4·7H2O. Titrate pH bis 7,3-7,4 mit einigen Tropfen konzentrierte 10 N NaOH.
- Bereiten Sie Aufnahme ACFS (in mM): 124 NaCl, 2.5 KCl, 1,25 NaH2PO424 Nahco33, 12,5 Glukose, 5 HEPES, 2 CaCl2·2H2O und 2 MgSO4·7H2O. Titrate pH-Wert 7,3-7,4 mit ein paar Tropfen 10 N NaOH konzentriert.
- Bereiten Sie Na+ Spike-in Lösung (2 M): 580 mg NaCl aufgelöst in 5 mL frisch zubereitete NMDG HEPES ACFS. Dies ist genug Lösung für ein Gehirn Slice Prep.
- Bereiten Sie 2 % Agarose für die Einbettung von Gewebe verwendet werden. Lösen Sie 2 g Agarose Typ 1 b (siehe Tabelle der Materialien) in 100 mL 1 x PBS und Mikrowelle zum Kochen bringen nur. Wirbel zu mischen, dann den Teig in eine sterile 10 cm Petrischalen und erstarren lassen. Speichern Sie die Agarose-Platte in einem verschlossenen Plastikbeutel bei 4 ° C bis zur Verwendung.
- Bereiten Sie injizierbare Narkosemittel arbeiten Stammlösung vor. 2,5 g 2,2,2-Tribromoethanol mit 5 mL 2-Methyl-2-Butanol mischen und dann allmählich auflösen in 200 mL PBS, pH 7,0-7,3. Filtern Sie der Stammlösung mit 0,22 µm Filter vor der Verwendung und bei 4 ° C, vor Licht geschützt aufbewahren.
Hinweis: Finden Sie jeweiligen Tiernutzung Ausschuss Richtlinien und Regeln bestimmen das Ablauf und Entsorgung Verfahren für die Betäubung arbeiten Stammlösung.
2. Einstellung der Schneid-Station
- Die slicing-Station mit dem Hobel Tissuemaschine und chirurgische Instrumente (siehe Tabelle der Materialien) eingerichtet. Um die Schneidemaschine Maschine zu kalibrieren, legen Sie eine Zirkonium-Keramik Injektor-Klinge auf der Klinge-Arm mit schnell-Kleber-Klebstoff, dann legen Sie Probenhalter und richten Sie die Vorderkante des Messers an der Probe Halter Felge bleibt eine kleine Lücke um sicherzustellen, dass die Klinge nicht kratzen das Metall.
Hinweis: Wenn die Schneide nicht physisch beschädigt ist es wiederverwendet werden für viele Wochen oder sogar Monate ohne Ersatz. Verschiedene Gewebe Hobel Modelle sind im Handel erhältlich, viele davon bieten hervorragende Leistung beim optimal kalibriert. Das ideale Instrument sollte minimal z-Auslenkung, entweder direkt gemessen und eingestellt oder empirisch beobachtet haben. - Richten Sie eine 250 mL-Becherglas gefüllt mit 200 mL NMDG HEPES ACFS und vor Kälte auf Eis mit konstanten Carbogenation (über einen Gas-Diffusor Stein mitten in den Medien angewendet) für > 10 min.
Hinweis: Diese Lösung wird für Transcardial Perfusion und füllen das slicing Machine Reservoir beim Schneiden verwendet werden. - Richten Sie die erste Gehirn Stück Erholung Kammer gefüllt mit 150 mL NMDG HEPES ACFS (Pflege der konstanten Carbogenation) und die Kammer in einem beheizten Wasserbad auf 32 – 34 ° c gehalten
Hinweis: Eine Scheibe Kammer nach dem Entwurf von Edwards und Konnerth (1992)52 empfiehlt sich für diesen Schritt. Diese Kammern mit leicht verfügbaren Labor Elemente erfolgen können (250 mL-Becherglas, netting, 50 mL konische Rohr, 35 mm Runde Plastikschale Nylon mesh). Vorsicht ist geboten, um sicherzustellen, dass die Scheibe netting bleibt frei von Luft sprudelt, besonders diejenigen, die kontinuierlich von Carbogen Gas Blase Steinen hergestellt, da diese Scheiben hinaufschweben und beschädigt verursachen können. Das Netz sollte etwa 1 cm unter der Flüssigkeitsoberfläche eingetaucht sein. - Einrichten einer Gehirn-Scheibe hält Kammer; eine Design mit mehreren unabhängigen Brunnen in einem größeren Reservoir wird empfohlen (siehe Tabelle der Materialien). Füllen Sie das Reservoir mit 450 mL HEPES ACFS und warme Raumtemperatur unter konstanten Carbogenation bis zur Verwendung.
Hinweis: Die Gehirnscheiben werden aus der Kammer anfänglicher Besserung an diese Kammer für die langfristige Lagerung vor der elektrophysiologischen Aufnahme übertragen werden. Vorsicht ist geboten, um sicherzustellen, dass jederzeit die Scheibe Netting bleibt frei von Luftblasen. - Bereiten Sie flüssige Agarose für die Einbettung von Gewebe. Verwenden Sie das offene Ende eines 50 mL konische Vials wie eine Ausstechform, um einen Block von 2 % Agarose aus der vorbereitete Schale auszuschneiden. Lose Kappe das konische Fläschchen, dann Mikrowelle für 10-30 s, bis die Agarose gerade geschmolzen ist. Nicht überhitzen.
- Gießen Sie das flüssige Agarose in 1,5 mL Röhrchen. Pflegen Sie die Agarose im geschmolzenen Zustand mit einem Thermomixer setzen auf 42 ° C mit kräftig schütteln. Achten Sie sorgfältig darauf, dass die geschmolzenen Agarose nicht vorzeitig zu festigen.
- Legen Sie das Zubehör kühlen Block für den Allesschneider auf Eis bis zu diesem Zeitpunkt Vorkühlen.
3. Transcardial Perfusion
Hinweis: Das Transcardial Perfusion Verfahren ist ein wichtiger Schritt bei der Arbeit mit erwachsenen Tieren und ist wichtig, zu erreichen, schnelle Abkühlung des Gehirns und verlangsamt den Stoffwechsel über Gehirn Infusion von niedrigen Na+, niedrige Ca2 +/ hohe Mg2 + ACFS Lösung. Transcardial Perfusion dient auch zur roten Blutkörperchen vom Gehirn Gefäßsystem, klar die Autofluoreszenz reduziert die Visualisierung und Ausrichtung der Gewebekulturen beschrifteten Zell-Populationen in transgenen Linien beeinträchtigen könnten. Es ist nicht ratsam, Transcardial Perfusion weglassen.
- Tief betäuben Mäuse durch intraperitoneale Injektion von Betäubungsmittel arbeiten-Stammlösung (250 mg / kg: 0,2 mL von 1,25 % Narkose arbeiten Stammlösung pro 10 g Körpergewicht, siehe die Tabelle der Materialien). Nach ~ 2 – 3 min, ausreichenden Tiefe der Narkose durch die Bewertung Zehe Prise Reflex zu überprüfen. Bei Bedarf ein zusätzliches Volumen von Narkose arbeiten Lager zu injizieren und Zehe Prise Reflex nach noch 2-3 min zu überdenken.
- Laden Sie eine 30 mL-Spritze mit 25 mL Carbogenated NMDG HEPES ACFS aus der vorgekühlt 250 mL-Becherglas (2 – 4 ° C ist optimal, im Gegensatz zu matschig oder gefroren Lösung). Legen Sie eine 25 5/8-Gauge-Nadel.
- Mit der Maus auf dem Rücken die Vorderpfoten und Hinterpfoten für Stabilität festzunageln. Eine 15 cm Glas Petrischale gefüllt mit gehärteten Silikon funktioniert gut als Basis.
- Mit einem Skalpell, machen Sie einen seitlichen Schnitt, der Brusthöhle auf der Ebene der Membran zu öffnen. Verwenden Sie feine Schere, um den Brustkorb durchtrennt, auf beiden Seite kümmert sich zur Vermeidung von clipping das Herz und die Lunge.
- PIN wieder den mittleren Bereich des Brustkorbes, das Herz aussetzen. Stechen Sie die Nadel der Spritze 30 mL in den linken Ventrikel und schneiden Sie den rechten Vorhof mit einer feinen Schere erlauben Blut zum Herzen zu beenden.
- Drücken Sie den Spritzenkolben mit manuellen konstanten Druck und Durchspülen Sie des Tieres mit der gekühltes NMDG HEPES ACFS mit einer Rate von ~ 10 mL/min.
Hinweis: Wenn die Perfusion erfolgreich ist die Leber ändert in der Farbe von dunkelrot bis hellgelb und in einigen Fällen klar, dass Flüssigkeiten beobachtet werden können, verlassen die Nasenlöcher am Ende des Verfahrens.
(4) des Gehirns Dissektion und schneiden
- Enthaupten Sie das Tier. Verwenden Sie ein Skalpell zu öffnen die Haut auf dem Kopf und setzen die Schädeldecke.
- Super-Feinschnitt verwenden Schere schneiden Sie die Haut über dem Schädeldach und machen Sie kleine Einschnitte seitlich auf beiden Seiten an der kaudalen/Ventral Basis des Schädels. Stellen Sie zusätzliche flache Einschnitte ab der kaudalen/dorsalen Aspekt des Schädels in die rostral Richtung auf der dorsalen Mittellinie kümmert sich nicht um das zugrunde liegende Gehirn beschädigen. Machen Sie einer endgültige ' t ' senkrecht auf der Mittellinie auf der Ebene der olfaktorischen Birnen geschnitten.
Hinweis: Vorsicht ist geboten, um sicherzustellen, dass das Gehirn Region(en) Interesse kein Schaden zugefügt wird. Insbesondere sollte zu keinem Zeitpunkt dort Druckkraft auf das Gehirn selbst angewendet sein. - Verwenden Sie die Runde Spitze Zange den Schädel ab rostral-medialen Aspekt zu erfassen und zu schälen zurück in die kaudalen lateralen Richtung. Wiederholen Sie für beide Seiten zu knacken öffnen und entfernen Sie die dorsalen Hälften der Käppchen, das Gehirn verfügbar zu machen. Sanft im intakten Gehirn in das Becherglas vorgekühlt NMDG HEPES ACFS aushöhlen. Lassen Sie das Gehirn gleichmäßig ~ 1 min abkühlen.
- Der große Spatel, um das Gehirn aus dem Becherglas und auf der Petrischale mit Filterpapier bedeckt zu heben. Trimmen Sie und blockieren Sie das Gehirn nach den gewünschten Winkel des Schneidens und gewünschte Region des Gehirns von Interesse. Arbeiten Sie schnell, um längeren Sauerstoffmangel während der Behandlung zu vermeiden.
Hinweis: Viele slicing Winkel sind möglich. Der genaue blockierende Methode und schneiden Winkel hängt von der genauen Hirnregion Zelltyp und Schaltung untersucht werden. - Befestigen Sie den Gehirn-Block zu Probenhalter mit Klebstoff Leim. Ziehen Sie das innere Stück Probenhalter genug, den Gehirn Block vollständig innen zurückzuziehen. Gießen Sie die flüssige Agarose direkt in die Halterung, bis der Gehirn Block in Agarose vollständig bedeckt ist. Klemmen Sie das vorgekühlte Zubehör kühlen Block um den Probenhalter für ~ 10 s bis die Agarose erstarrt ist.
- Einsetzen Sie Probenhalter in das Gefäß auf der Schneidemaschine Maschine und überprüfen Sie die korrekte Ausrichtung. Füllen Sie den Tank mit verbleibenden vorgekühlt, sauerstoffreiches NMDG HEPES ACFS aus der 250 mL-Becherglas und bewegen Sie eine Blase Stein in das Reservoir für die Dauer des Schneidens um ausreichende Sauerstoffversorgung sicherzustellen.
- Passen Sie das Mikrometer um Förderung der Agarose eingebettet Gehirn Probe zu beginnen. Starten Sie den Allesschneider und einstellen Sie empirisch die Voraus Geschwindigkeit und Oszillation Frequenz auf das gewünschte Niveau.
Hinweis: Beide Einstellungen sollte im unteren Bereich. Für optimale Ergebnisse eine einzigen pass von der Klinge-Arm nehmen ca. 20 s und die Oszillation eine sehr glatte und sanfte Brummen mit keine offene Summen zu produzieren sollte. - Weiter voran und Schneiden des Gewebes in 300 µm Schritten (oder andere bevorzugte Stärke) bis die Hirnregion des Interesses ist vollständig geschnitten; die Gesamtzeit für das slicing Verfahren sollte weniger als 15 Minuten sein.
5. optimierte NMDG schützende Recovery-Verfahren
- Anfängliche NMDG Wiederherstellungsschritt (kritische Schritt): nach Abschluss der speziellen Verfahren, bis alle Segmente mit einem Cut-off Kunststoff Pasteur Rohr t sammeln und übertragen Sie sie in eine vorgewärmte (34 ° C) anfänglicher Besserung Kammer gefüllt mit 150 mL NMDG HEPES ACFS. Alle Scheiben kurz hintereinander zu übertragen und einen Timer gestartet, sobald alle Scheiben in die Erholung-Kammer verschoben werden.
- Finden Sie in Tabelle 2 um optimale Na+ Spike-im Zeitplan nach Maus Alter zu bestimmen.
Hinweis: Dieses Verfahren ist eine praktische Methode, um eine kontrollierte Wiedereinführung der Na+ in die Gehirn-Scheibe-Kammer zu erzielen und ist optimiert für eine bestimmte Scheibe Kammer Geometrie und Reservoir Hirnvolumen und Typ (siehe Tabelle der Materialien). - Das schrittweise Na+ Spike-Verfahren durchführen, indem man die angegebenen Mengen an Na+ -Spitze-in-Lösung zu den o.g. Zeiten. Fügen Sie die Na+ -Spitze-in-Lösung direkt in den Bubbler Schornstein der Kammer anfänglicher Besserung, rasche Vermischung zu erleichtern.
- Übertragen Sie alle Scheiben auf die HEPES ACFS langfristige Aufnahmekammer auf Raumtemperatur gehalten. Lassen Sie Scheiben für weitere 1 h in der Kammer vor Einleitung Patch Clamp Aufnahme Experimente mit HEPES wiederherstellen.
6. Patch-Clamp-Aufnahme
Hinweis: Die folgenden grundlegenden Verfahren lediglich bieten einige praktische Überlegungen und nicht sollen detaillierte Protokolle für die Patch-Clamp-Aufnahmen, darstellen wie diese53,54an anderer Stelle gefunden werden können. Ein Patch Clamp Elektrophysiologie Rig ist für diese Anwendung erforderlich. Dies wird in der Regel setzt sich aus einem aufrechten Mikroskop ausgestattet mit Infrarot-differential Interferenz Kontrast (IR-DIC) Optik und einem Fluoreszenz-Beleuchtungssystem, ein Patch-Clamp-Verstärker und Daten Digitizer, motorisierte Mikromanipulator und Mikroskop Plattform, Isolierung Vibrationstisch Faraday-Käfig und Lösungs-System für Heizung und Durchblutung. Die Probenkammer und Plattform sind für die untergetauchten Scheibe Aufzeichnung auszulegen. Multi-Neuron Patch Clamp Aufnahmen benötigt eine Anlage mit mehreren Verstärkern, Kopf Bühnen und hochwertige Mikromanipulatoren ausgestattet. Darüber hinaus für beste Ergebnisse, eine Rig mit einem 900 nm IR Band-Pass-Filter ausgestattet und passenden optischen Komponenten wird dringend empfohlen, angemessene Visualisierung der Zellen zu gewährleisten > 50 µm tief in den Gehirnscheiben. Korrekte Ausrichtung für Kӧhler Beleuchtung ist auch wichtig für die übersichtliche Visualisierung.
- Bereiten Sie intrazelluläre Pipette Lösung (in mM): 130 K-Gluconat, 4 10 HEPES, 0,3 EGTA, KCl, 10 Phosphokreatin-Na2, 4 MgATP, 0,3 Na2-GTP und 13.4 Biocytin. Passen Sie der pH-Wert auf 7,35 mit 1 M KOH und die Osmolalität, 285-290 50er/kg mit Saccharose, je nach Bedarf an.
- Bereiten Sie Patch Clamp Elektroden aus dickwandigen Borosilikatglas Kapillaren; die ideale Patch Clamp Elektrode hat einen relativ kurzen und pummelig Kegel mit einem ~ 3 – 6 MOhm gefüllt Tipp Widerstand in der Badewanne.
- Sicherstellen Sie, dass die Silberelektrode Drähte richtig chlorided um stabile Aufnahmen zu gewährleisten. Dazu (typisch) durch Eintauchen des letztes 3-4 mm Silber Draht in flüssiges Bleichmittel für ca. 30 min oder bis der Draht schwarz wird.
- Etablieren Sie Lösung Perfusion mit einem peristaltischen Pumpe setzen auf 3 – 4 mL/min Circulate Carbogenated Aufnahme ACFS durch die Aufnahme Kammer kümmert sich um die Be- und Entlüftungsöffnungen übereinstimmen, um Überlauf zu vermeiden.
- Eine einzelnes Gehirn-Scheibe in der Überflutung Aufnahme Kammer übertragen und sichern mit einem u-förmigen Stück Anker mit Nylon Saiten zu überqueren. Identifizieren Sie die Zielregion Gehirn mit einer 4 X Luft Ziel vor dem Wechsel zu einer höheren Macht Ziel (z. B.hoher numerischer Apertur X 40 oder 60 X Wasser eintauchen Ziele).
- Eine gesunde Zielzelle visuell zu identifizieren. Das Aussehen der neuronalen Membran an der Soma wird wie durch IR-DIC Mikroskopie, visualisiert verwendet, um die Eignung eines Kandidaten-Zelle für Patch-Clamp-Aufnahme beurteilen.
Hinweis: Gesunde Neuronen weisen in der Regel die folgenden Funktionen: geschrumpfte weder geschwollene Somata, weicher Kontrast der Membran Kanten und glatte Membran aussehen. Darüber hinaus befinden sich die Mehrheit der gesunden Zellen > 30 µm tief in die Scheibe, wie oberflächliche Neuronen mit beschädigt werden dürften durchtrennt dendritischen Prozesse. Neuronen, die einen zerknitterten auftritt, deutlich sichtbare Kerne oder "Spiegelei" aussehen oder sehr dunkle oder hohen Kontrast Membran Kanten aufweisen sollte vermieden werden. - Rücken-Füllung der Patch pipette mit ~ 5 µL des intrazellulären Lösung und legen Sie es auf der Elektrodenhalter. Bewegen Sie die Pipette in die Aufnahme Wanne oberhalb des Gehirns Schnitts und üben Sie leichten positiven Druck, alle Hindernisse in der Spitze zu löschen. Den Pipette Offset Null und den Tipp-Widerstand mit Hilfe einer Membran-Test-Funktion zu überwachen.
- Verschieben Sie die Pipettenspitze in Kontakt mit dem Ziel Neurons Zellkörper; ein kleines Grübchen sollte auf der Membranoberfläche aufgrund der leichten Überdruck bilden.
- Sobald eine Membran Grübchen beobachtet wird, schnell abnehmen Sie den positiven-Luftdruck und sanfte Saugwirkung um Dichtung Bildung zu erleichtern. Sobald der Pipette Widerstand steigt auf > 100 MOhm, schalten Sie einen Betriebs-Befehl auf ein Niveau, das die erwartete ruhende Membran entspricht Potenzial für die gezielte Zelltyp (-70 mV ist ein guter Ausgangspunkt).
- Sobald die Spitze Widerstand ≥1 Gigaohm erreicht, versuchen Sie, in die Zelle zu brechen, durch zerreißen der Membran unterhalb der Patch-Pipette mit kurze Anfälle von scharfen Absaugung; die "Zap" Funktion kann genutzt werden, um Einbruch zu erleichtern, je nach Bedarf.
Hinweis: Ein Holding Potential von-70 mV empfiehlt sich für Spannung Klemme Experimente auf kortikale Neuronen. Gesunde Neuronen haben ein Leckstrom nicht mehr negativ als-100 pA für die Dauer des Experiments, aber dies ist teilweise abhängig vom Zelltyp. Eine Neuron würde von der Analyse ausgeschlossen werden, wenn die Membran-Ruhepotential mehr erschüttert als-50 war mV, oder wenn der Zugang Widerstand um mehr als 20 % verändert. -
Sobald eine stabile ganze Zelle Patch Clamp Aufnahme vorliegt, gezielt zusätzliche Neuronen für die Aufnahme durch Wiederholen der Schritte 6,6 – 6.10. Achten Sie darauf, um mechanische Störungen zu vermeiden, die dazu führen würde, die erste Aufnahme zu verlieren.
- Wählen Sie zusätzliche Neuronen innerhalb von 100 µm aus das erste Neuron einen hinreichender Wahrscheinlichkeit des Findens Nervenzellen synaptisch verbunden sicherzustellen.
Hinweis: Es kann hilfreich sein in einigen Fällen mehrere Kandidaten Neuronen nach vorne zu identifizieren und zu Vorspannung und Vorposition alle Pipetten in der Nähe zu den verschiedenen gezielten Zellen vor der Gründung der ersten Patch Clamp Aufnahme.
- Wählen Sie zusätzliche Neuronen innerhalb von 100 µm aus das erste Neuron einen hinreichender Wahrscheinlichkeit des Findens Nervenzellen synaptisch verbunden sicherzustellen.
Representative Results
Dieser Abschnitt enthält repräsentative Ergebnisse für Routine Gehirn Slice Vorbereitung und Patch Clamp Elektrophysiologie Experimente mit optimierten NMDG schützende Recovery-Methode (d.h., NMDG schützende Erholung kombiniert mit schrittweisen Na+ Spike-in-Verfahren). Erste, morphologische Erhaltung der Neuronen wurde in verschiedenen Gehirnregionen von Gehirnscheiben vorbereitet, mit oder ohne Umsetzung optimierte NMDG schützende Wiederherstellungsmethode (Abbildung 1) bewertet. Drei Monate alte erwachsener Mäuse wurden für diese Experimente ausgewählt, und wir IR-DIC Mikroskopie um Neuron Gesundheit anhand der Form und die Gesamterscheinung der Somata und proximalen Dendriten zu bestimmen. Beachten Sie die verkümmerten, pyknotischen Darstellung von den meisten Neuronen in den repräsentativen Bildern von Gehirnscheiben vorbereitet, ohne die schützende Wiederherstellungsmethode (alle Bilder wurden 1 – 2 h nach der Scheibe Zubereitung erhalten). Diese Kontrolle Scheiben wurden mit NMDG ACFS für Transcardial Perfusion und schneiden Schritte vorbereitet aber waren zunächst erholte sich in hohen Na+-mit HEPES ACFS. Im Gegensatz dazu zeigen die repräsentative Bilder aus den Scheiben mit den optimierten NMDG schützende Wiederherstellungsmethode zubereitet Neuronen mit verbesserten Morphologien (weicher, voller, weniger gekräuselte aussehen), die geeignet sind für die Patch-Clamp Aufnahme (Abbildung 1). die verbesserte neuronale Erhaltung wurde beobachtet, einschließlich der neokortikalen über mehrere Hirnregionen "layers" II/III und V, Subiculum und dorsalen seitlichen gekniet Kern (CGN).
Als nächstes wurde die optimierte NMDG schützende Wiederherstellungsmethode mit der ursprünglichen NMDG schützende Wiederherstellungsmethode (d. h.ohne das allmähliche Na+ Spike-Verfahren) verglichen. Die durchschnittliche Zeit für Gigaohm Dichtung Bildung in Patch-Clamp Aufnahme Versuche war dramatisch und deutlich reduziert (9,9 s gegenüber 33,3 s, **p < 0,005, gepaarten t-test) als das allmähliche Na+ Spike-Verfahren angewendet wurde zusammen mit der NMDG schützende Wiederherstellungsschritt (Abbildung 2). Schnellere und zuverlässigere Membran Abdichtung mal stark verbessert den Durchsatz der Patch-Clamp Aufnahme in jungen Erwachsenen Gehirnscheiben. Der optimale Na+ Spike-in Zeitplan wurde weiter modifiziert nach tierischen Alter (Tabelle 2) und war von Vorteil für alle Altersgruppen (3 Wochen bis 1 Jahr alten Mäusen) getestet. Das Profil der allmählichen Natrium-Ionen-Konzentration Höhe im Laufe des Verfahrens Spike-in steht zur Verfügung (Abbildung 3), um die in Tabelle 2dargestellten Zeitpläne zu begleiten.
Als Teil des Allen Institute Zelle Arten Program (http://celltypes.brain-map.org/) eine groß angelegte-Versuch im Gange, systematisch ist charakterisieren Sie elektrophysiologischen Eigenschaften einzelner Neuronen bei jungen Erwachsenen (postnatale Tag 40-80) Maus visuellen kortikalen Gehirnscheiben abgeleitet von transgenen Linien mit Zelle Typ-spezifischen fluoreszierenden Marker Ausdruck in genetisch definiert neuronalen Populationen (kortikale Schicht und Zelltyp spezifische Cre Fahrer Linien, eine Cre-abhängige Leuchtstofflampen überschritten Reporter-Linie55). Abbildung 4 zeigt Beispiel Spuren die Impulsmuster aufgezeichnet von Parvalbumin (Pvalb)-mit dem Ausdruck kortikalen schnell Spick (FS) Interneurone (Pvalb-IRES-Cre/Ai14 Mäuse) als Reaktion auf eine Reihe von 1 s aktuelle Injektion-Schritten, die den Dynamikbereich abdecken Neuron feuern. Die F-Kurve ich für ein Dataset 22 kortikalen FS Interneurone auf der rechten Seite angezeigt wird. Ähnlich wie gezielte Patch Clamp Aufnahme Experimente wurden durchgeführt, um die 23 Rorb exprimierenden exzitatorische Neuronen in Schicht IV von Rorb-IRES-Cre/Ai14 Mäusen (Abbildung 4) charakterisieren. Diverse gesunde Neuron-Typen einschließlich FS Interneurone und pyramidale Neuronen in kortikalen Regionen und Schichten können regelmäßig und zuverlässig für die Patch-Clamp für mindestens 6-8 Stunden Aufzeichnung, nachdem Slice Vorbereitung mit diesem Protokoll optimiert ausgerichtet werden.
Neben der Messung neuronaler Eigenschaften, wurde synaptische Verbindungen zwischen mehreren gleichzeitig aufgezeichnete Neuronen des definierten Typen in visuellen kortikalen Mikroschaltungen sondiert. Die Multi-Neuron Patch Clamp Aufnahme Technik ist außergewöhnlich anspruchsvoll, wie zahlreiche gesunde Kandidat Neuronen des definierten Typen in einem relativ kleinen Bereich des Gehirns Slice vorhanden sein müssen, um eine realistische Aussicht auf hohe Qualität zu gewährleisten, gleichzeitige Aufnahmen und Bona Fide synaptischen Verbindungen zu identifizieren. Abbildung 5 zeigt gekoppelten Aufnahme von zwei TdTomato + FS Interneurone im visuellen Kortex von Hirnschnitten von jungen Erwachsenen Pvalb-IRES-Cre/Ai14 Mäusen abgeleitet. Eine starke unidirektionale inhibitorische synaptische Verbindung wurde erkannt (aufgenommen mit hohen internen Pipette Kochsalzlösung). Beispiel-Aufzeichnungen und Protokolle zur Messung der Eigenschaften von kurzfristigen synaptische Plastizität werden vorgestellt. Anfälle von hochfrequenten Zug Stimulation (jeweils 10 Impulse bei 10, 50 und 100 Hz) folgten Wiederherstellung einzelner Prüfimpulse in verschiedenen Zeitintervallen (1, 2 oder 4 s), den zeitlichen Verlauf der Genesung von synaptische Depression zu messen.
Ausgezeichnetem Erfolg wurde auch für menschliche neokortikalen Neuronen im reifen Erwachsenen ex Vivo Gehirnscheiben erteilt. Neurochirurgischen Exemplare stammen von Patienten, die eine geplante Operationen für Tumor-Entfernung an den örtlichen Krankenhäusern. Die Verfahren für menschliches Gewebe neurochirurgischen Sammlung und Gehirn Slice Erstellung unterscheiden sich von der Maus Gehirn Slice Verfahren auf praktische Weise. In Kürze neokortikalen resezierten Gewebes (distal auf der Website der Pathologie) aus dem OP erhoben und in eiskalte sauerstoffreiches NMDG HEPES ACFS eingetaucht und transportiert mit kontinuierliche Kühlung und Oxygenierung von den OP-Saal, der Labor innerhalb von 30 Minuten oder weniger. Die Gehirnscheiben sind die NMDG schützende Wiederherstellungsprozedur zubereitet und erlaubt, über einen längeren Zeitraum von etwa 3 h vor Einleitung eines Patch-Clamp-Aufnahmen wiederherstellen. Abbildung 6 zeigt eine erfolgreiche Aufzeichnung Experiment und eine erfolgreiche vierfach Patch Clamp Aufnahme Experiment aus menschlichen ex Vivo Gehirnscheiben vorbereitet auf diese Weise aus der frontalen Kortex Region gepaart. Die gepaarte Aufnahme zeigt unidirektional erregenden synaptischen Inputs eines kortikalen pyramidenförmigen Neurons auf einer kortikalen Interneuron (verzeichnet als exzitatorischen postsynaptischen Ströme). In der Quad-Patch experimentieren zwei exzitatorischen und zwei hemmende Neuronen gleichzeitig aufgenommen wurden, und drei inhibitorische synaptische Verbindungen festgestellt (notiert als inhibitorischen postsynaptischen Potenziale) aus zwölf Verbindungen insgesamt sondiert. So ermöglicht diese optimierte Gehirn Slice Methode zuverlässige experimentelle Erfolg in die größte Herausforderung des Gehirns Slice-Anwendungen, einschließlich Multi-Neuron Patch Clamp Experimente zur Schaltung Konnektivität in akut resezierten reife Erwachsene menschliche Gehirn zu studieren Gewebe.
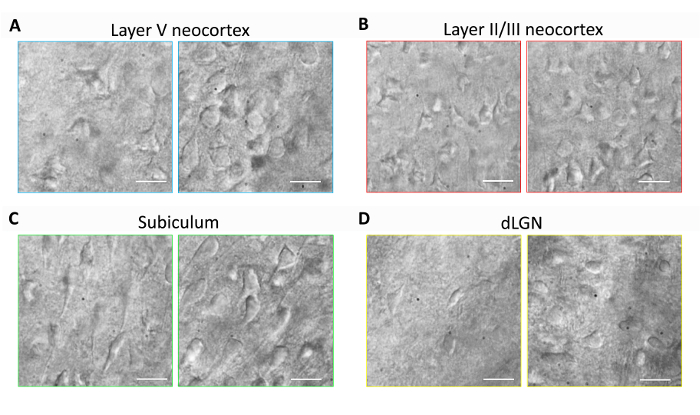
Abbildung 1: Verbesserte neuronale Erhaltung mit der optimierten NMDG schützende Wiederherstellungsmethode Gehirn Slice Vorbereitung. Vertreter IR-DIC-Bilder wurden aus verschiedenen Gehirnregionen bei akuten Scheiben von einem drei Monate alten Maus erworben. Regelverfahren Sie NMDG schützende schneiden ohne eine schützende Wiederherstellungsschritt (linke Platten) im Vergleich zu optimierten NMDG schützende Wiederherstellungsmethode (richtigen Platten). (A) Schicht des Neocortex, (B) Layer II/III der Neokortex, (C) Subiculum und (D) dorsalen seitlichen gekniet Kern (CGN) V. Maßstabsbalken in alle Platten sind 20 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
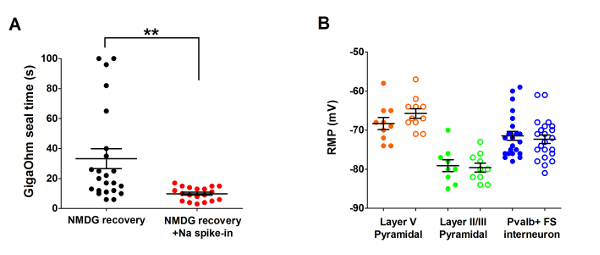
Abbildung 2: Beschleunigte Geschwindigkeit und verbesserte Zuverlässigkeit der Gigaohm Dichtung Bildung in Patch-Clamp Experimente Na+ -Spitze-in-Verfahren die NMDG schützende Wiederherstellungsmethode mit Aufnahme. (A) Grundstück Gigaohm Dichtung Bildung Zeiten für NMDG Erholung allein (schwarze Datenpunkte, n = 19) versus NMDG Erholung plus Na+ -Spitze-in-Verfahren (rote Datenpunkte, n = 23). Alle aufgezeichneten Zellen wurden pyramidale Neuronen in Layer II/III oder V des visuellen Kortex. Beachten Sie, dass die maximale Zeit ist begrenzt auf 100 s, um Zellen zu berücksichtigen, die nie Gigaohm Dichtungen gebildet. Gepaart t-test, **p < 0,005. (B) Grundstück ruhen Membranpotential (RMP) für Schicht V pyramidale Neuronen (orange Datenpunkte, n = 10/11), II/III pyramidale Neuronen (grüne Datenpunkte, n = 9/10), oder kortikale Pvalb + FS Interneurone (blau Datenpunkte, n = 23/22). Solide Kreise bezeichnen NMDG Erholung Zustand und Kreise NMDG Erholung plus Na+ -Spitze-in-Verfahren zu öffnen. Jeder Datenpunkt stellt ein Neuron und sowohl der Mittelwert und + /-SEM werden angezeigt. Es gibt keine signifikanten Unterschiede im Gehirn Slice Herstellungsbedingungen zu vergleichen, für alle drei Arten Zelle RMPs (gepaart t-test). Bitte klicken Sie hier für eine größere Version dieser Figur.
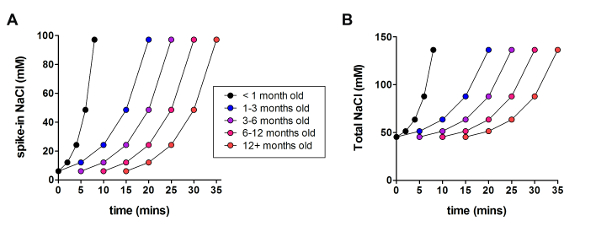
Abbildung 3 : Profil der allmählichen Natrium Ionen-Konzentration Höhe im Laufe des Verfahrens Spike in. (A) Grundstück von Spike-in NaCl-Konzentration im Vergleich zur Zeit. (B) Grundstück von insgesamt extrazelluläre NaCl-Konzentration im Vergleich zur Zeit. Bitte klicken Sie hier für eine größere Version dieser Figur.
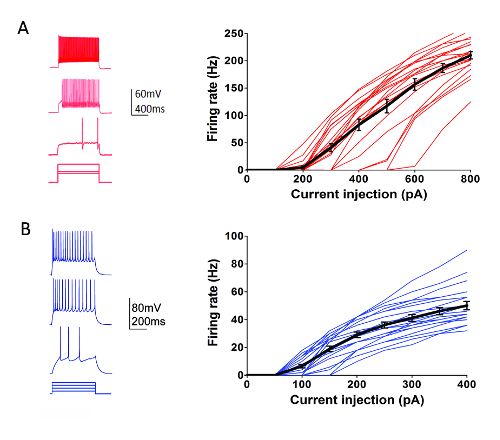
Abbildung 4 : Elektrophysiologische Eigenschaften des genetisch definiert kortikalen Zelltypen. (A) Beispiel Spuren der neuronalen Zündung als Reaktion auf aktuelle Injektion Schritte für Pvalb + kortikalen FS Interneurone (linken). TdTomato + Neuronen wurden gezielt für Aufnahmen in Hirnschnitten von Pvalb-IRES-Cre/Ai14 Mäuse. Zusammenfassung der Daten für das Abfeuern von Tarif-Current Injection Beziehung (F-Kurve ich) werden auf der rechten Seite angezeigt (n = 22). (B) Beispiel Spuren der neuronale feuern als Reaktion auf aktuelle Injektion Schritte für Rorb exprimierenden kortikale Schicht IV exzitatorischen Neuronen (linken). TdTomato + Neuronen wurden gezielt für Aufnahmen in Hirnschnitten von Rorb-IRES-Cre/Ai14 Mäuse. Zusammenfassung der Daten für das Abfeuern von Tarif-Current Injection Beziehung (F-Kurve ich) werden auf der rechten Seite angezeigt (n = 23). Jede dünne farbige Linie repräsentiert die F-Kurve ich für ein einzelnes Neuron; in der Erwägung, dass die dicken schwarzen Linien entspricht dem Durchschnitt für jede Gruppe + / SEM Klicken Sie bitte hier, um eine größere Version dieser Figur.
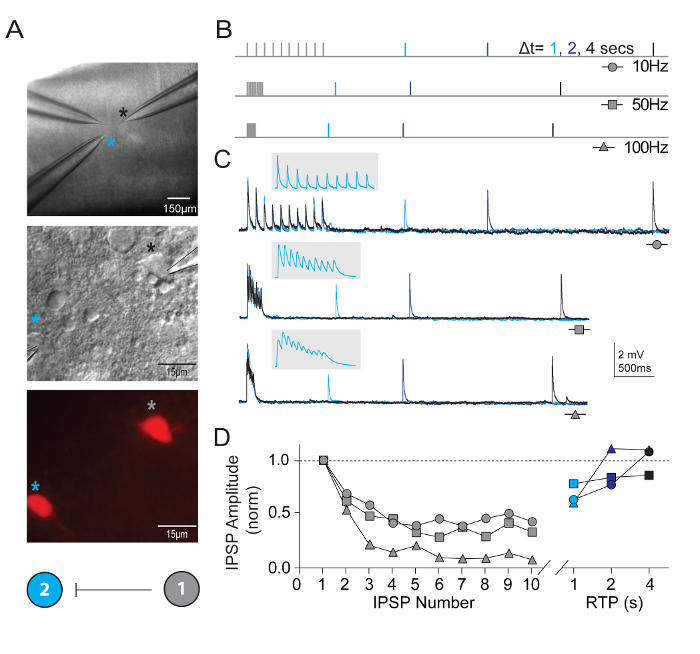
Abbildung 5: Kurzfristige Plastizität in synaptisch verbunden mit dem Ausdruck Pvalb kortikalen FS Interneurone. (A) Differential Interferenz Kontrast und Epifluoreszenz wurden verwendet, um TdTomato-positiv, Pvalb exprimierenden FS Interneurone der Maus primären visuellen Cortex. Ein Farb-codierte schematische Konnektivität-Diagramm zeigen eine einseitige synaptische Verbindung zwischen den beiden Interneuronen. (B) schematische Darstellung der Stimulation-Protokolle verwendet, um kurzfristige Dynamik der Nervenzellen synaptisch verbunden zu bewerten. Züge von 10 Aktionspotentialen (10, 50 und 100 Hz) in der präsynaptischen Nervenzelle, gefolgt von einem einzigen Aktionspotential (Test Erholungspuls, RTP) geliefert mit unterschiedlichen zeitlichen Verzögerung hervorgerufen werden (1, 2 und 4 s) nach der Zug beendet wurde. Jedes RTP sind farbcodiert für Klarheit. (C) durchschnittliche Spuren der entsprechenden einseitige inhibitorischen postsynaptischen Potenziale (uIPSPs) in Zelle #2 als Reaktion auf Züge von Aktionspotentialen in Zelle #1 hervorgerufen. Graue Einschub erweitert Zeitskala zur Abgrenzung der uIPSP Zug zeigen. (D) normalisierte uIPSP Amplituden werden in Abhängigkeit von ihrer Position gezeichnet, während Züge bei unterschiedlichen Frequenzen. NET Depression ist quer durch alle Preise mit eine deutliche Belebung des uIPSP 4 s. Klicken Sie bitte hier, um eine größere Version dieser Figur.
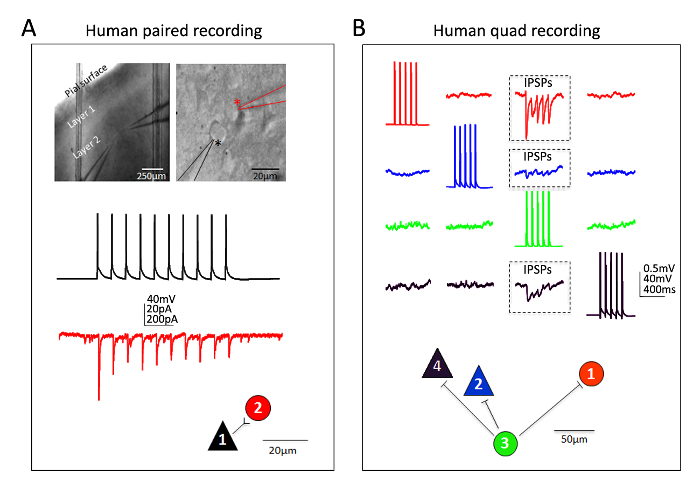
Abbildung 6: Multi-Neuron Patch Clamp Aufnahmen im neurochirurgischen erwachsenen Menschen Gehirn Scheiben. (A) niedriger und hoher Vergrößerung IR-DIC-Bilder unter Angabe von Ort und Identität der aufgezeichneten Neuronen (Paneele). Eine pyramidale Neuron (schwarze Sternchen) und benachbarten Interneuron (rotes Sternchen) wurden gleichzeitig aufgezeichnet. Beispiel-farbig markierte Spuren einer unidirektionalen exzitatorische synaptische Verbindung (ESPC) aus pyramidenförmigen Zelle Interneuron (gemessen als EPSCs in Spannung Klemme) und entsprechende physikalische Karte (untere Verkleidungen). (B) Vierfach Patch Clamp Aufnahme Experiment in einem Erwachsenen menschlichen neurochirurgischen Gehirn Scheibe dorsolateralen präfrontalen Kortex. Zwei pyramidale Neuronen und zwei Interneuronen werden gleichzeitig erfasst ermöglicht sequenzielle Sondierung von zwölf möglichen synaptischen Verbindungen. Ein Zug der evozierten Aktionspotentiale in Zelle #3 (grüne Spuren) führte zur Erkennung von inhibitorischen postsynaptischen Potenziale (IPSPs) in jedem der anderen drei gleichzeitig aufgezeichneten Neuronen (drei Box Regionen, Paneele). Die Antworten von jedem einzelnen Neuron aufgenommen sind farbcodiert für Klarheit. Die physische Verbindung Karte wird im unteren Bereich angezeigt. Beachten Sie, dass die rohen Spuren angezeigt (B) die Durchschnittswerte von mindestens 20 aufeinander folgenden Rohdaten fegt darstellen. Vermeintliche Identifizierung des Zelltyps beruhte auf Soma Form, Analyse der Morphologie von fluoreszierenden Farbstoff während Aufnahmen und elektrophysiologische Eigenschaften einschließlich die Impulsmuster der Reaktionen auf aktuelle Injektion Schritte. Bitte klicken Sie hier für eine größere Version dieser Figur.
| NMDG HEPES ACFS | HEPES Holding ACFS | Aufnahme der ACFS | |||||||
| Komponente | mM | MW | g/Liter | mM | MW | g/Liter | mM | MW | g/Liter |
| NMDG | 92 | 195.22 | 17.96 | ||||||
| HCl | 92 | 36,46 | * | ||||||
| NaCl | 92 | 58.44 | 5.38 | 124 | 58.44 | 7.25 | |||
| KCl | 2.5 | 74.55 | 0,19 | 2.5 | 74.55 | 0,19 | 2.5 | 74.55 | 0,19 |
| NaH2PO4 | 1.2 | 138.00 | 0,17 | 1.2 | 138.00 | 0,17 | 1.2 | 138.00 | 0,17 |
| Nahco33 | 30 | 84.01 | 2.52 | 30 | 84.01 | 2.52 | 24 | 84.01 | 2.02 |
| HEPES | 20 | 238.31 | 4.77 | 20 | 238.31 | 4.77 | 5 | 238.31 | 1.19 |
| Glukose | 25 | 180.20 | 4.51 | 25 | 180.20 | 4.51 | 12.5 | 180.20 | 2.25 |
| Natrium-Ascorbat | 5 | 198,00 | 0.99 | 5 | 198,00 | 0.99 | 0 | 198,00 | 0.00 |
| Thioharnstoff | 2 | 76.12 | 0,15 | 2 | 76.12 | 0,15 | 0 | 76.12 | 0.00 |
| Natrium-Pyruvat | 3 | 110.04 | 0,33 | 3 | 110.04 | 0,33 | 0 | 110.04 | 0.00 |
| MgSO4.7H2O | 10 | 246.48 | 5 mL | 2 | 246.48 | 1 mL | 2 | 246.48 | 1 mL (2M lieferbar) |
| CaCl2.2h2O | 0,5 | 147.01 | 0,25 mL | 2 | 147.01 | 1 mL | 2 | 147.01 | 1 mL (2M lieferbar) |
| * titrieren Sie pH-Wert des NMDG HEPES ACFS auf 7,3-7,4 mit konzentrierter HCl | |||||||||
| Alle Lösungen sollten im Bereich 300-310 mOsm/Kg sein. | |||||||||
Tabelle 1: Medien Formulierungen.
| Tierische Alter | |||||
| Zeit (min) * | < 1 Monat | 1-3 Monate | 3–6 Monate | 6–12 Monate | 12 + Monate |
| 0 | 250 ΜL | 250 ΜL | |||
| 1 | |||||
| 2 | 250 ΜL | ||||
| 3 | |||||
| 4 | 500 ΜL | ||||
| 5 | 250 ΜL | 250 ΜL | |||
| 6 | 1000 ΜL | ||||
| 7 | |||||
| 8 | 2000 ΜL | ||||
| 9 | |||||
| 10 | Transfer | 500 ΜL | 250 ΜL | 250 ΜL | |
| 11 | |||||
| 12 | |||||
| 13 | |||||
| 14 | |||||
| 15 | 1000 ΜL | 500 ΜL | 250 ΜL | 250 ΜL | |
| 16 | |||||
| 17 | |||||
| 18 | |||||
| 19 | |||||
| 20 | 2000 ΜL | 1000 ΜL | 500 ΜL | 250 ΜL | |
| 21 | |||||
| 22 | |||||
| 23 | |||||
| 24 | |||||
| 25 | Transfer | 2000 ΜL | 1000 ΜL | 500 ΜL | |
| 26 | |||||
| 27 | |||||
| 28 | |||||
| 29 | |||||
| 30 | Transfer | 2.000 ΜL | 1.000 ΜL | ||
| 31 | |||||
| 32 | |||||
| 33 | |||||
| 34 | |||||
| 35 | Transfer | 2.000 ΜL | |||
| 36 | |||||
| 37 | |||||
| 38 | |||||
| 39 | |||||
| 40 | Transfer | ||||
| * Zeit Null ist, dass die Moment-Scheiben in die anfängliche Erholung Kammer übertragen werden | |||||
Tabelle 2: Empfohlene Zeitplan für die schrittweise Na + Spike-Verfahren altersgerechte Maus.
Discussion
Na + Spike-in verbessert Gigaohm Dichtung Bildung und Patch-Clamp Aufnahme Erfolg
Die erste Version des NMDG-schützende Recovery-Methode wurde speziell für Erwachsene und alternde Tiere2,5. Einige "early adopters" haben auch versucht, diese Methodik für juvenile Tiere Gehirn aufschneiden gelten (d.h., Mäuse < 30 Tage alt). Allerdings wurde festgestellt, dass im Gegensatz zu den herausragenden visuell bestätigt neuronalen Erhaltung mit der NMDG schützende Wiederherstellungsmethode in dieser Altersgruppe, Gigaohm Dichtung Bildung häufig, stall kann zu fehlerhaften Patch Clamp Aufnahme Versuche. Eine Hypothese ist, dass NMDG kationen leichter in juvenile Gehirnscheiben im Vergleich zu Erwachsenen Gehirnscheiben gefangen sind und Dichtung Bildung behindern können; Allerdings Gigaohm Dichtungen können leicht bilden, während juvenile Gehirnscheiben in NMDG ACFS (Daten nicht gezeigt) vollständig untergetaucht sind, so zeigt, dass NMDG ACFS per se nicht behindert Gigaohm Dichtung Bildung.
Der rasche Übergang von niedrigen bis hohen Na+ Lösung am Ende der ersten Gehirn Slice Wiederherstellungsschritt verursacht Schäden an neuronalen Membranen und stört die Dichtung Entstehungsprozess. Dies ist intuitiv, angesichts der Tatsache, dass der Übergang von niedrigen bis hohen Na+, kalt-warmen Temperatur und dramatischen Erhöhung der Ca2 + Mg2 + -Verhältnis führen gemeinsam zu einem massiven Wiederaufflammen der spontane synaptische Aktivität. Diese hemmenden Zugstufenphase im Gehirn schneiden Verfahren wird voraussichtlich Reperfusion Verletzungen nach ischämischen Beleidigung zu spiegeln. Damit zur weiteren Abmilderung neuronalen Membran Schaden in der ersten Erholungsphase, die eine allmähliche Na+ Spike-Verfahren aufgenommen worden in der Höhe von Na+ -Konzentration in der NMDG schützende Erholung Inkubation Kammer langsam ist und reproduzierbar erhöhten mit präzisem Timing. Wie in der ursprünglichen schützende Recovery-Verfahren ist die zeitliche Trennung von Na+ Höhe von Temperatur und Ca2 +/Mg2 + Verhältnis Höhe vorteilhaft. Aber darüber hinaus das Na+ Spike-Verfahren führt zu kleinen inkrementellen Anstieg der extrazellulären Na+ -Konzentration über die frühen Zeitpunkten und hohe Zuwächse auf die späten Zeitpunkte, dadurch bieten das Hirngewebe ein Möglichkeit, besser auf die steigenden Na+ -Ebenen zu empfangen. Dieses Verfahren ist eine Alternative zur schrittweisen Lösung Austausch durch eine Perfusion Pumpe oder Schwerkraft Tropf Linien gesteuert, die führen zu einem ständigen Anstieg der Na+ Ebenen und erfordern Aufmerksamkeit auf Be- und Entlüftungsöffnungen auf der Scheibe Kammer überläuft. Bemerkenswert ist, steigt in dieser Na+ Spike-Verfahren der Osmolalität die Lösung in der Slice-Kammer langsam über einen Zeitraum von mehreren Minuten bevor die Scheiben sind normale Osmolalität Lösung zurück, aber dies nicht die Slice-Gesundheit beeinträchtigen oder Patch-Clamp Aufnahme Erfolg. Eine hohe Osmolalität Schneidelösung hat zuvor für Mittelhirn Slice Vorbereitungen verwendet worden, um besser Dopamin-Neuronen für Patch Clamp Aufnahmen57,58, so demonstriert, dass diesem temporären bewahren Hyperosmolality kann in manchen Situationen hilfreich sein.
Durch die Implementierung eines optimierten Verfahrens Kombination der NMDG schützende Wiederherstellungsmethode und allmähliche Na+ hat Spike-in Schritt die Nützlichkeit dieses Gehirn-Scheibe-Methodik ausgeweitet durch reife Erwachsene Tiere Alter Jugendlicher. Dieses aktualisierte Protokoll eignet sich nun für eine Vielzahl von tierischen Alter mit einem einzigen optimale NMDG ACFS Formulierung und Verfahren. Falls erforderlich, das Na+ Spike-Verfahren aufgebracht werden, mit einer zunehmend längere Verzögerung und/oder langsamer zeitlichen Verlauf, die Lebensfähigkeit der Hirnschnitten von älteren Tieren zu verbessern, und wir schufen einen grundlegenden Leitfaden der empfohlenen Spike-in Zeitpläne gemäß zu Tier Alter (siehe Tabelle 2). Während wir ein Grundgerüst für eine Vielzahl von Anwendungen zur Verfügung gestellt haben, können Sie zusätzliche erweiterte Schritte erkunden für Wirtschaftlichkeit und Langlebigkeit von Hirnschnitten von Erwachsenen und alternde Tiere weiter zu verbessern. Z. B. Glutathion Restaurierung Strategien sind in dieser Hinsicht besonders effektiv und können an anderer Stelle beschrieben,2,6implementiert werden.
Verbesserung der Durchsatz für anspruchsvolle Experimente
Die Analyse der synaptischen Konnektivität durch Patch-Clamp-Aufnahme ist eine anspruchsvolle Anwendung, die ausgezeichnete Erhaltungszustand der neuronalen Struktur und Funktion erfordert, um eine hohe Zuverlässigkeit der Erfolg zu erzielen. Als die Zahl der Neuronen gleichzeitig aufgezeichnet werden steigt linear, die technischen Schwierigkeitsgrad supra-linear steigt. Gibt es zahlreiche Fehlermöglichkeiten, und eine der häufigsten Ursachen von Fehlern ist die Unfähigkeit, Form ausreichend Gigaohm Dichtungen auf eine oder mehrere der gezielten Zellen. Dies kann dramatisch langsame Fortschritte, insbesondere dann, wenn drei oder mehr Neuronen müssen gleichzeitig aufgezeichnet werden. Einklang mit der Feststellung der schneller Gigaohm Dichtung Bildung Zeit mit der optimierten NMDG schützende Wiederherstellungsmethode, gab es eine deutliche Verbesserung der Erfolgsquote und Durchsatz der Multi-Neuron Patch Clamp Aufnahme Experimente mit beiden Erwachsenen transgenen Maus Gehirnscheiben und Erwachsenen menschlichen neurochirurgischen Gehirnscheiben. Die verbesserte Effizienz ist fast sicher auf die schnelle und zuverlässige Gigaohm Dichtung Bildung und die verbesserte neuronale Erhaltung der Scheiben mit diesem Protokoll zurückzuführen. Obwohl dieses Protokoll auf die Vorteile explizit für die Patch-Clamp Aufnahme Anwendungen konzentriert, sind ähnliche Gewinne für andere anspruchsvollen experimentelle Anwendungen erwarten wo Gehirn Slice Lebensfähigkeit von größter Bedeutung ist.
Acknowledgements
Diese Arbeit wurde von Allen Institut für Hirnforschung finanziert. Die Autoren danken Allen Institute Gründer, Paul G. Allen und Jody Allen, für ihre Vision, Ermutigung und Unterstützung. Wir danken auch der Mitarbeiter des technischen Supports Allen Institut zur Durchführung Tierpflege, Tierhaltung und Genotypisierung.
Materials
| Name | Company | Catalog Number | Comments |
| Compresstome VF-200 | Precisionary Instruments | VF-200 | Vibrating tissue slicer (recommended) |
| N-methyl-D-glucamine | Sigma Aldrich | M2004 | aCSF constituent |
| Sodium Chloride | Sigma Aldrich | S3014 | aCSF constituent |
| Potassium Chloride | Sigma Aldrich | P5405 | aCSF constituent |
| Sodium Phosphate monobasic dihydrate | Sigma Aldrich | 71505 | aCSF constituent |
| Sodium Bicarbonate | Sigma Aldrich | S5761 | aCSF constituent |
| HEPES | Sigma Aldrich | H4034 | aCSF constituent |
| Glucose | Sigma Aldrich | G7021 | aCSF constituent |
| Sodium Ascorbate | Sigma Aldrich | A4034 | aCSF constituent |
| Thiourea | Sigma Aldrich | T8656 | aCSF constituent |
| Sodium pyruvate | Sigma Aldrich | P5280 | aCSF constituent |
| Calcium chloride dihydrate | Sigma Aldrich | C7902 | aCSF constituent |
| Magnesium Sulfate heptahydrate | Sigma Aldrich | M1880 | aCSF constituent |
| 2,2,2-Tribromoethanol | Sigma Aldrich | T48402 | Anesthetic component 1 |
| 2-methyl-2-butanol | Sigma Aldrich | 240486 | Anesthetic component 2 |
| Curved blunt forceps | Fine Science Tools | 11065-07 | Brain dissection tools |
| Fine dissecting scissors (supercut) | Fine Science Tools | 14058-09 | Brain dissection tools |
| Large heavy duty scissors 7'' | Fine Science Tools | 14000-18 | Brain dissection tools |
| Metal spatula | Sigma Aldrich | Z511455-1PAK | Brain dissection tools |
| Razor blades | VWR | 89031-954 | Brain dissection tools |
| Brain Slice Keeper-4 | Automate Scientific | S-BSK4 | brain slice holding chamber |
| nylon netting | Warner Instruments | 64-0198 | For building small slice recovery chambers |
| Pyrex glass beakers (250 mL) | VWR | 89090-434 | For building small slice recovery chambers |
| 35 mm plastic dish, round | VWR | 100488-376 | For building small slice recovery chambers |
| Gas diffuser stones (10 µm) | Sigma Aldrich | 59277 | For constant carbogenation (fine bubbles) |
| Agarose Type I-B | Sigma Aldrich | A0576 | For embedding brain specimens |
| Micro loader tips | Eppendorf | 22491229 | For filling patch clamp electrodes |
| Sylgard | VWR | 102092-312 | For making a custom dissecting platform |
| Hydrochloric acid | Sigma Aldrich | H1758-100ML | For pH adjustment of media |
| Sodium Hydroxide | Sigma Aldrich | 221465-25G | For pH adjustment of media |
| Potassium Hydroxide | Sigma Aldrich | 221473 | For pH adjustment of media |
| Plastic transfer pipets 3 mL graduated | VWR | 89497-676 | For slice transfer |
| Zirconium ceramic injector blades | Cadence Specialty Blades | EF-INZ10 | http://cadenceinc.com/ |
| KG-33 borosilicate glass capillary w/filament | King Glass Company | custom quote | ID: 0.87mm, OD 1.50mm |
| Biocytin | Sigma Aldrich | B4261 | Intern pipette solution |
| Phosphocreatine disodium | Sigma Aldrich | P7936 | Intern pipette solution |
| Potassium Gluconate | Sigma Aldrich | G4500-100G | Intern pipette solution |
| EGTA | Sigma Aldrich | E3889 | Intern pipette solution |
| Mg-ATP | Sigma Aldrich | A9187 | Intern pipette solution |
| Na2-GTP | Sigma Aldrich | 51120 | Intern pipette solution |
| sucrose | Sigma Aldrich | S0389 | Intern pipette solution |
| Heated water bath (2.5L) | VWR | 13491-060 | Miscellaneous |
| Filter paper rounds | VWR | 28456-022 | Miscellaneous |
| Cyanoacrylate glue | Amazon | B000BQRBO6 | Miscellaneous |
| Glass petri dish | VWR | 89000-326 | Miscellaneous |
| 10X Phosphate buffered saline | Sigma Aldrich | P5493 | Miscellaneous |
| 30 mL syringes | VWR | BD302832 | Miscellaneous |
| 1 mL syringes | VWR | BD-309628 | Miscellaneous |
| 25 5/8 gauge needles | VWR | 89219-292 | Miscellaneous |
| Thermomixer (w/1.5 mL tube block) | VWR | 89232-908 | To keep agarose molten |
References
- Aghajanian, G. K., Rasmussen, K. Intracellular studies in the facial nucleus illustrating a simple new method for obtaining viable motoneurons in adult rat brain slices. Synapse. 3 (4), 331-338 (1989).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods Mol Biol. 1183, 221-242 (2014).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nat Methods. 8 (9), 745-752 (2011).
- Peca, J., et al. Shank3 mutant mice display autistic-like behaviours and striatal dysfunction. Nature. 472 (7344), 437-442 (2011).
- Ting, J. T. F., et al. Improved methods for acute brain slice preparation from adult and aging animals. Society for Neuroscience Abstracts. 520, (2011).
- Ting, J. T. F., et al. Improved methods for acute brain slice preparation from adult and aging animals (Part II): Glutathione depletion underlies rapid deterioration of adult brain slices. Society for Neuroscience Abstracts. 505, (2012).
- MacGregor, D. G., Chesler, M., Rice, M. E. HEPES prevents edema in rat brain slices. Neurosci Lett. 303 (3), 141-144 (2001).
- Liu, Y. B., Guo, J. Z., Chiappinelli, V. A. Nicotinic receptor-mediated biphasic effect on neuronal excitability in chick lateral spiriform neurons. Neuroscience. 148 (4), 1004-1014 (2007).
- Xiang, Z., Huguenard, J. R., Prince, D. A. GABAA receptor-mediated currents in interneurons and pyramidal cells of rat visual cortex. J Physiol. 506, 715-730 (1998).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nat Protoc. 1 (4), 2075-2081 (2006).
- Contractor, A., et al. Loss of kainate receptor-mediated heterosynaptic facilitation of mossy-fiber synapses in KA2-/- mice. J Neurosci. 23 (2), 422-429 (2003).
- Pita-Almenar, J. D., Collado, M. S., Colbert, C. M., Eskin, A. Different mechanisms exist for the plasticity of glutamate reuptake during early long-term potentiation (LTP) and late LTP. J Neurosci. 26 (41), 10461-10471 (2006).
- Ito, K., Contractor, A., Swanson, G. T. Attenuated plasticity of postsynaptic kainate receptors in hippocampal CA3 pyramidal neurons. J Neurosci. 24 (27), 6228-6236 (2004).
- Van Dort, C. J., et al. Optogenetic activation of cholinergic neurons in the PPT or LDT induces REM sleep. Proc Natl Acad Sci U S A. 112 (2), 584-589 (2015).
- Ferando, I., Mody, I. Altered gamma oscillations during pregnancy through loss of delta subunit-containing GABA(A) receptors on parvalbumin interneurons. Front Neural Circuits. 7, 144 (2013).
- Walker, A. G., et al. Metabotropic glutamate receptor 3 activation is required for long-term depression in medial prefrontal cortex and fear extinction. Proc Natl Acad Sci U S A. 112 (4), 1196-1201 (2015).
- Takahashi, Y. K., et al. Neural estimates of imagined outcomes in the orbitofrontal cortex drive behavior and learning. Neuron. 80 (2), 507-518 (2013).
- Pan, G., et al. Preserving GABAergic interneurons in acute brain slices of mice using the N-methyl-D-glucamine-based artificial cerebrospinal fluid method. Neurosci Bull. 31 (2), 265-270 (2015).
- LaSarge, C. L., Santos, V. R., Danzer, S. C. PTEN deletion from adult-generated dentate granule cells disrupts granule cell mossy fiber axon structure. Neurobiol Dis. 75, 142-150 (2015).
- Tong, L. M., et al. Inhibitory interneuron progenitor transplantation restores normal learning and memory in ApoE4 knock-in mice without or with Abeta accumulation. J Neurosci. 34 (29), 9506-9515 (2014).
- Fleming, R. L., et al. Binge-pattern ethanol exposure during adolescence, but not adulthood, causes persistent changes in GABAA receptor-mediated tonic inhibition in dentate granule cells. Alcohol Clin Exp Res. 37 (7), 1154-1160 (2013).
- Kummer, K. K., El Rawas, R., Kress, M., Saria, A., Zernig, G. Social interaction and cocaine conditioning in mice increase spontaneous spike frequency in the nucleus accumbens or septal nuclei as revealed by multielectrode array recordings. Pharmacology. 95 (1-2), 42-49 (2015).
- Qi, J., et al. A glutamatergic reward input from the dorsal raphe to ventral tegmental area dopamine neurons. Nat Commun. 5, 5390 (2014).
- Wang, L., et al. Modulation of dopamine release in the striatum by physiologically relevant levels of nicotine. Nat Commun. 5, 3925 (2014).
- Siuda, E. R., et al. Spatiotemporal Control of Opioid Signaling and Behavior. Neuron. , (2015).
- Tucker, K. R., Huertas, M. A., Horn, J. P., Canavier, C. C., Levitan, E. S. Pacemaker rate and depolarization block in nigral dopamine neurons: a somatic sodium channel balancing act. J Neurosci. 32 (42), 14519-14531 (2012).
- McDevitt, R. A., et al. Serotonergic versus nonserotonergic dorsal raphe projection neurons: differential participation in reward circuitry. Cell Rep. 8 (6), 1857-1869 (2014).
- Wang, D. V., et al. Mesopontine median raphe regulates hippocampal ripple oscillation and memory consolidation. Nat Neurosci. 18 (5), 728-735 (2015).
- Engle, S. E., Shih, P. Y., McIntosh, J. M., Drenan, R. M. alpha4alpha6beta2* nicotinic acetylcholine receptor activation on ventral tegmental area dopamine neurons is sufficient to stimulate a depolarizing conductance and enhance surface AMPA receptor function. Mol Pharmacol. 84 (3), 393-406 (2013).
- Vance, K. M., Ribnicky, D. M., Rogers, R. C., Hermann, G. E. Artemisia santolinifolia enhances glutamatergic neurotransmission in the nucleus of the solitary tract. Neurosci Lett. 582, 115-119 (2014).
- Dergacheva, O., Boychuk, C. R., Mendelowitz, D. Developmental changes in GABAergic neurotransmission to presympathetic and cardiac parasympathetic neurons in the brainstem. J Neurophysiol. 110 (3), 672-679 (2013).
- Dergacheva, O. Chronic intermittent hypoxia alters neurotransmission from lateral paragigantocellular nucleus to parasympathetic cardiac neurons in the brain stem. J Neurophysiol. 113 (1), 380-389 (2015).
- Dyavanapalli, J., et al. Chronic intermittent hypoxia-hypercapnia blunts heart rate responses and alters neurotransmission to cardiac vagal neurons. J Physiol. 592, 2799-2811 (2014).
- Apostolides, P. F., Trussell, L. O. Regulation of interneuron excitability by gap junction coupling with principal cells. Nat Neurosci. 16 (12), 1764-1772 (2013).
- Graziane, N. M., Polter, A. M., Briand, L. A., Pierce, R. C., Kauer, J. A. Kappa opioid receptors regulate stress-induced cocaine seeking and synaptic plasticity. Neuron. 77 (5), 942-954 (2013).
- Ferando, I., Mody, I. In vitro gamma oscillations following partial and complete ablation of delta subunit-containing GABAA receptors from parvalbumin interneurons. Neuropharmacology. 88, 91-98 (2015).
- Foster, D. J., et al. M5 receptor activation produces opposing physiological outcomes in dopamine neurons depending on the receptor's location. J Neurosci. 34 (9), 3253-3262 (2014).
- Engle, S. E., Broderick, H. J., Drenan, R. M. Local application of drugs to study nicotinic acetylcholine receptor function in mouse brain slices. J Vis Exp. (68), e50034 (2012).
- Wang, L., et al. Temporal components of cholinergic terminal to dopaminergic terminal transmission in dorsal striatum slices of mice. J Physiol. 592, 3559-3576 (2014).
- Holloway, B. B., et al. Monosynaptic glutamatergic activation of locus coeruleus and other lower brainstem noradrenergic neurons by the C1 cells in mice. J Neurosci. 33 (48), 18792-18805 (2013).
- DePuy, S. D., et al. Glutamatergic neurotransmission between the C1 neurons and the parasympathetic preganglionic neurons of the dorsal motor nucleus of the vagus. J Neurosci. 33 (4), 1486-1497 (2013).
- Abbott, S. B., Holloway, B. B., Viar, K. E., Guyenet, P. G. Vesicular glutamate transporter 2 is required for the respiratory and parasympathetic activation produced by optogenetic stimulation of catecholaminergic neurons in the rostral ventrolateral medulla of mice in vivo. Eur J Neurosci. 39 (1), 98-106 (2014).
- Dergacheva, O., Dyavanapalli, J., Pinol, R. A., Mendelowitz, D. Chronic intermittent hypoxia and hypercapnia inhibit the hypothalamic paraventricular nucleus neurotransmission to parasympathetic cardiac neurons in the brain stem. Hypertension. 64 (3), 597-603 (2014).
- Chen, Q., et al. Imaging neural activity using Thy1-GCaMP transgenic mice. Neuron. 76 (2), 297-308 (2012).
- Luongo, F. H., Horn, M. E. Sohal V.S. Putative microcircuit-level substrates for attention are disrupted in mouse models of autism. Biological Psychiatry. 79 (8), 667-675 (2016).
- Vance, K. M., Rogers, R. C., Hermann, G. E. PAR1-activated astrocytes in the nucleus of the solitary tract stimulate adjacent neurons via NMDA receptors. J Neurosci. 35 (2), 776-785 (2015).
- Feliciano, P., Andrade, R., Bykhovskaia, M. Synapsin II and Rab3a cooperate in the regulation of epileptic and synaptic activity in the CA1 region of the hippocampus. J Neurosci. 33 (46), 18319-18330 (2013).
- Tomioka, N. H., et al. Elfn1 recruits presynaptic mGluR7 in trans and its loss results in seizures. Nat Commun. 5, 4501 (2014).
- Jiang, X., et al. Principles of connectivity among morphologically defined cell types in adult neocortex. Science. 350 (6264), 9462 (2015).
- Mishra, A., et al. Imaging pericytes and capillary diameter in brain slices and isolated retinae. Nat Protoc. 9 (2), 323-336 (2014).
- Gabriel, L. R., Wu, S., Melikian, H. E. Brain slice biotinylation: an ex vivo approach to measure region-specific plasma membrane protein trafficking in adult neurons. J Vis Exp. (86), (2014).
- Edwards, F. A., Konnerth, A. Patch-clamping cells in sliced tissue preparations. Methods Enzymol. 207, 208-222 (1992).
- Qi, G., Radnikow, G., Feldmeyer, D. Electrophysiological and morphological characterization of neuronal microcircuits in acute brain slices using paired patch-clamp recordings. J Vis Exp. (95), e52358 (2015).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. J Vis Exp. (91), e51706 (2014).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 13 (1), 133-140 (2010).
- Hille, B. The permeability of the sodium channel to organic cations in myelinated nerve. J Gen Physiol. 58 (6), 599-619 (1971).
- Martin, M., Chen, B. T., Hopf, F. W., Bowers, M. S., Bonci, A. Cocaine self-administration selectively abolishes LTD in the core of the nucleus accumbens. Nat Neurosci. 9 (7), 868-869 (2006).
- Chen, B. T., et al. Cocaine but not natural reward self-administration nor passive cocaine infusion produces persistent LTP in the VTA. Neuron. 59 (2), 288-297 (2008).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved