最適化されたNを使用して急性脳スライスの準備-メチル-D-glucamine 保護回復法
* These authors contributed equally
In This Article
Summary
このプロトコルは、最適化されたNの実装方法を示します-メチル-D-glucamine (NMDG) 保護回復法脳スライス標本。1 つのメディアの定式化は、確実にあらゆる年齢層の様々 な実験用の動物から健康な脳のスライスを取得する使用されます。
Abstract
このプロトコルはNへの実用的なガイド-メチル-D-glucamine (NMDG) 保護回復法脳スライス標本。多くの最近の研究は、神経保存と全体的な脳スライスの生存率を高めるためのこの方法の有用性を検証しました。早期導入によるこの技術の実装は、脳機能を実験的、多様なアプリケーションを使用して、動物の年齢、脳領域、および細胞のタイプの広い範囲にわたる詳細な調査を促進しています。NMDG 人工髄液 (アプライド) メディアの最適化された定式化と強化されたプロシージャを使用して確実に入手できるパッチ クランプ電気生理学のための健康な脳スライス保護回復脳スライス技術を実施するための手順のとおりです。この更新方法は、速度の大幅な改善が観察され、gigaohm の信頼性シール対象パッチク ランプ優れた神経保存、それにより挑戦的な促進を維持しながら実験を記録中に形成実験アプリケーション。代表的な結果は、若い大人のトランスジェニック マウスと成熟した大人の人間脳神経外科標本から調製した新皮質脳スライスのシナプス接続多ニューロン パッチク ランプを試金する実験の記録から提供されています。さらに、脳スライスの最適化された NMDG 保護回復法はこのように独自の方法論の限界を解決する少年と成人の両方の動物と互換性が。要約すると、様々 な種や優れた生存率および組織の保全を達成するために年齢の間で 1 つのメディアの定式化と脳スライス手順を実装できます。
Introduction
急性脳スライス標本は、神経科学における重要な実験系です。約半世紀のこのプラットフォームがさまざまな解剖学的な脳領域と動物種の間で動的生きている脳機能学を有効に。かどうかは、目的のアプリケーション生化学、機能イメージ投射、形態、または電気生理学は、最適な整合性とスライスした組織の生存を確保する最も重要なのです。それは、高い弾力性のある少年の齧歯動物の脳スライス標本 (すなわちマウスの生後 30 未満) の日付に最も好ましいいるこの理由です。成熟した大人からスライスの十分に健康な脳を得ることが困難とほとんどの手ごわい挑戦をあると証明した動物を高齢化し成熟した脳の機能的な建築を勉強するための厳しい制限を課しています。これは特にパッチク ランプ記録、優秀な形態および機能の保全を必要とし、特定された単一ニューロンの組み込みとシナプスの詳細なプロパティを特徴付けるために不可欠な技術に当てはまります。過去数十年間パッチ クランプ electrophysiologists の大半は少年とはるかに低い健康な脳スライスを準備するためショ糖置換低 Na+アプライド1を使用して '保護切断' メソッドに依存しています。程度、若い大人動物。このメソッドはパッシブ Na+流入とそれに続く水の侵入と細胞のスライス切断段階膨張がそれらのニューロンにあるため特にニューロンの貧しい人々 の生存につながる優勢な侮辱をあるという前提に基づいて、ブレードの動きから直接の外傷を維持する可能性が最も高い浅層。しかし、保護加工法はまだ実装されている特定のアプライドの定式化に関係なく成熟した大人の動物から脳スライス標本を望まれるべき多くを残します。
この問題にシンプルだが効果的なソリューションがされている2,3,4,5,6を説明し、'保護回復' 脳スライス法と呼ばれます。このメソッドの元のバージョンは、NMDG は、最も汎用性と様々 な他候補ナトリウム イオンの代替品 (スクロース、グリセリン、コリン、トリスなど) の間で効果的なとして同定された NMDG 置換のアプライドを使用します。メディアの定式化は、脳スライス浮腫に抵抗し、強力な pH7第をバッファリングを提供 HEPES 添加と酸化ストレス (表 1) の有害な影響を打ち消すためにサプリメントの添加によってさらに強化されました。それ、経験的に決め、最初の回復培養ステップ低 na+、低 Ca2 +、高 Mg2 + NMDG アプライド必要かつ充分にいた大人の脳組織スライス直後後が神経改善動物年齢3,5,6細胞の種類、脳の広い範囲にわたって保全。
特に、何が今保護回復法と呼ばれる以前の化身は文学1,8,9,10、11,12,で見つけることができます。13、完全な成熟した大人、動物の脳のスライスとパッチ ・ クランプ記録を高齢化はなかったが認識またはこれらの初期の作品で実証します。さらに、微妙な手順のバリエーションは、実験用途4,14,15,16を支持して出てくる続けます。これらの多数の研究グループの仕事の集合体は、改良された組織保存の保護回復法のロバスト高信頼を付与します。NMDG 保護回復法今広く採用され大人動物脳スライス標本を用いた多くの研究発表研究で実装されています。これらの急性スライス研究にまたがる新皮質3,17,18, 海馬15,19,20,21, 線条体22,23,24 日、中脳25,26,27,28,29, と後脳30,31,32,33,34領域、およびさまざまな神経伝達物質や神経調節物質のグルタミン酸作動性4,30, gaba 作動性18,20,31,35 など ,36, ドーパミン24,29,37,38, コリン作動性14,37,38, 39、40ノルアドレナリンとセロトニン27,28神経伝達。メソッドはトランスジェニック動物3,39または生体内でウイルス注射17,27、次の派生のスライスにおける神経活動の光遺伝学的制御に適しています 28,40,41,42,43, 神経活動244,の機能的な Ca2 +イメージングとして ,,4546。短期可塑性4,47,48と長期的な可塑性16,35,48の多様な形態の解析がされています。報告しました。最近の研究は広範かつ系統的な構成49を記録 octopatch を使用して成熟した成体マウスの脳スライスの視覚野のシナプス接続のプロービングを容易にする NMDG 保護回復法を適用-強力なこのメソッドの堅牢性とユーティリティのデモンストレーション。保護回復法は、血管および成人の大脳皮質脳スライス50、パッチク ランプ記録から周の保存性の向上など、以前不測の実験的コンテキストで正常に適用されているも1-1.5 歳アルツハイマー病マウス モデル20と、成人の脳スライス受容体輸送アッセイ51介在ニューロン集団を移植しました。
次のプロトコルでは、急性の脳スライスの生存率を改善するために脳スライス標本の最適化の NMDG 保護回復メソッドを実装するための手順について説明します。この複雑な多ニューロン パッチ クランプ若い大人トランスジェニック マウスの脳スライスと成熟した大人の両方の実験を記録手法の明確な利点のデモだけでなく、神経保存性の向上のための原則を紹介します。脳神経外科脳スライス。成人患者から派生した人間の脳標本はして、次のプロトコルを 1 つ以上歳 21 日古いからマウスのも検証されています。
Protocol
トランスジェニック マウスを含むプロシージャは脳科学機関動物ケアおよび使用委員会 (IACUC) アレンの協会によって承認されています。男性と女性の両方の c57bl/6 マウス (重量範囲 10-30 g) は、これらの実験で使用されました。代表的な結果のいくつかは生きている人間の脳のスライスから収集されるデータについて説明します。新皮質の組織標本は、腫瘍除去のため neurosurgeries の間に得られました。病気の組織へのアクセスを得るために上を覆う大脳新皮質組織を除去する必要があります。スウェーデンの医療センターの倫理委員会によって承認されたプロトコルの下で研究目的のため脳組織の使用のためのすべてのケースで情報に基づいた患者の同意が得られました。
1. メディアおよび試薬 (表 1) の準備
注: ソリューションは、微量金属やその他の不純物のない純水で提示しなければなりません。未使用ソリューション可能性があります保存が 4 ° C で最大 1 週間必要な場合、ソリューションで作成している新鮮な実験の日をお勧めします。上記それぞれの製剤の 1 L は 1-2 スライス手順に十分です。アプライドのすべてのソリューションは、安定した pH 緩衝と十分な酸素供給を確保するため使用する前にカーボゲン ・ (95% O25% CO2) と飽和状態になる必要があります。すべてのソリューションの pH を調整する 7.3 7.4 と浸透圧測定し、300 310 mOsmol/kg に調整。
- NMDG HEPES アプライド (mM) での準備: 92 NMDG、2.5 KCl、1.25 NaH2PO4, 30 NaHCO3、20 HEPES、25 グルコース、2 チオ尿素、5 Na ・ アスコルビン酸、ピルビン酸 Na 3-、0.5 CaCl2·2H2O、および 10 MgSO4·7H2滴定修 pH 7.35 M 塩酸 0.5 mL ± 17 mL と –7.4。
理想的には注: 沈殿物; を避けるために 2価陽イオンの添加する前にこの滴定手順を実行する必要があります。ただし、降水量は生理的な範囲に pH の調整によって反転できます。 - アプライド (mM) を保持 HEPES を準備: 92 NaCl、2.5 KCl、1.25 NaH2PO4, 30 NaHCO3、20 HEPES、25 グルコース、2 チオ尿素、アスコルビン酸 Na 5、3 Na ピルビン酸、2 CaCl2·2H2O 2 MgSO4·7H2滴定修pH 7.3 – 7.4 を数滴にするには、10 N NaOH が集中しています。
- (MM) で記録アプライドの準備: 124 NaCl、2.5 KCl、1.25 NaH2PO4、24 NaHCO3、12.5 グルコース、5 HEPES、2 CaCl2·2H2O 2 MgSO4·7H2O. 滴定 pH 7.3 7.4 に数滴10 N NaOH を集中しました。
- Na+スパイクのソリューション (2 M) を準備: 作りたて NMDG HEPES アプライドの 5 mL に溶解した塩化ナトリウム 580 mg。一つの脳スライスの準備のため十分なソリューションです。
- ティッシュを埋め込むに使用する 2% の agarose を準備します。アガロース タイプ 1 b の 2 g を溶解 (材料の表を参照してください) だけ沸騰するまで PBS、電子レンジ × 1 100 ml。渦巻き模様のミックス、滅菌 10 cm シャーレに混合物を注ぐし固化することができます。使用するまで 4 ° C で密閉されたビニール袋にアガロース ・ プレートを格納します。
- 注射用麻酔薬の原液を作業を準備します。2-メチル-2-ブタノールの 5 ml 2,2,2 Tribromoethanol 2.5 g を混合し、200 mL の PBS、pH 7.0-7.3 に徐々 に溶解します。0.22 μ m フィルターを使用する前に原液をフィルターし、光から保護 4 ° C で保存します。
注: は、原液を使用する麻酔薬の有効期限と廃棄の手順を決定するためそれぞれの動物の使用委員会ガイドラインとルールを参照してください。
2. スライスの駅の設定
- 組織スライサー マシンと手術器具 (材料の表を参照してください)、スライスの駅を設定します。、スライサー マシンを調整するには、ジルコニウム セラミック インジェクター ブレードを高速接着剤接着剤を用いたブレード アームに接続し、試料ホルダーを挿入し、ブレードがこすりしないように小さなギャップを残して試料ホルダーの縁に刃の先端を揃える金属。
注: 刃先が物理的に破損していない場合それ再利用できる多くの数週間あるいは数ヶ月交換せず。市販されているさまざまな組織スライサー モデル、多くの最適キャリブレーションと優れたパフォーマンスを提供できます。理想的な計測器最小 z 軸たわみ、直接測定し調整または経験的に観察が必要です。 - 250 mL NMDG HEPES アプライドと氷の上の前の寒さの 200 ml が入ったビーカー (メディアに没頭して石ガス ディフューザーを介して適用) 定数 carbogenation のセットアップ > 10 分。
注: transcardial の灌流及び断面中にスライシング マシン貯水池を埋めるため、このソリューションは使用しています。 - 150 ml NMDG HEPES アプライドの初期脳スライス回復室を設定 (定数 carbogenation を維持) 32-34 ° C で維持される温水浴でチャンバーを配置し、
注: デザイン後スライス室エドワーズの Konnerth (1992 年)52は、この手順をオススメです。これらの部屋は容易に利用可能な検査項目を行うことができます (250 mL ビーカー、ナイロン メッシュ網、50 mL の円錐管、35 mm のプラスチック製の丸いお皿)。ネッティング空気の無料のままスライスの泡、特に継続的にカーボゲン ・ ガス泡石プロデュースこれらはスライスをフロートし、破損を引き起こす可能性があることを確認するには、注意が必要です。網は、液体の表面の下で約 1 cm 水没する必要があります。 - 保持室; 脳スライスをセットアップします。大きな貯水池の複数の独立した井戸の設計をお勧めします (材料の表を参照してください)。リザーバーは使用するまで 450 ml HEPES アプライドと室温一定 carbogenation の下に暖かいの。
注: 脳スライスは最初の回復室からこの商工会議所電気生理学的記録の前に長期保存のために転送されます。気泡の自由のスライス網遺跡が常時確保するため注意が必要があります。 - ティッシュを埋め込むため溶融アガロースを準備します。クッキーの抜き型のような 50 mL コニカル バイアルのオープン エンドを使用して、事前に準備された皿から 2% の agarose のブロックをカットします。緩く円錐バイアルのキャップ、10-30 s agarose が丁度溶けるまで電子レンジします。過熱しません。
- 溶融アガロースを 1.5 mL チューブに注ぐ。活発な動揺で 42 ° C に設定 thermomixer を使用して溶融状態でアガロースを維持します。慎重に溶融 agarose が途中で凝固しないことを確認します。
- この時点であらかじめ冷たい氷のスライサーのブロックを低温アクセサリーを配置します。
3. Transcardial 潅流
注: transcardial 潅流プロシージャ大人動物を操作するときの重要なステップし脳の急速な冷却を達成することが重要で、低 Na+の脳注入を介して代謝を減速、低 Ca2 +/高 Mg2 +アプライドソリューションです。Transcardial 血流も蛍光可視化と形質転換線の蛍光に分類された細胞集団のターゲットに干渉する可能性を軽減する脳血管から赤血球をオフに提供しています。Transcardial 血流を省略することはお勧めできません。
- 深く麻酔作業原液腹腔内投与によるマウスの麻酔 (250 mg/kg: 0.2 mL 1.25% の麻酔薬 10 g 体重当たり原液を作業テーブルの材料を参照してください)。後 ~ 2-3 分、つま先ピンチ反射を評価することによって十分な麻酔深度を確認します。必要に応じて、追加麻酔在庫量を注入し、別の 2 〜 3 分後つま先ピンチ反射を再評価します。
- (2-4 ° C が最適、雪解けや冷凍のソリューションではなく) 中古冷蔵 250 mL ビーカーから carbogenated NMDG HEPES アプライドの 25 mL と 30 mL シリンジをロードします。25 5/8 ゲージの針を取り付けます。
- その裏にマウスで、前足と後足は前足の安定をピンで止めます。15 cm ガラス シャーレは、ベースとしてよく硬化シリコーン作品に満ちています。
- メスを使えば、横切開を横隔膜のレベルで胸腔内を開きます。どちら側の世話に心臓と肺をクリッピングを避けるために胸郭をカットする高級はさみを使用します。
- ピン中心部を公開する胸郭の中央部分。30 mL の注射器の針を左心室に挿入し、血液が心臓を終了するように細かいハサミで右房をカットします。
- 手動の一定の圧力を使用してシリンジのプランジャーを押し下げるし、〜 10 mL/分の速度でチルド NMDG HEPES アプライドで動物を灌流します。
メモ: 灌流が成功した場合は、深い赤色から淡い黄色に色およびプロシージャの終わりに向かって鼻を終了する流体を観測できる明確ないくつかのケースで肝臓が変更します。
4. 脳の解剖とスライス
- 動物の首をはねます。メスを使用して頭部の皮膚を開き、スカル キャップを公開します。
- 使用罰金スーパー カットはさみスカル キャップの上の皮膚を切り取るし、小切開横尾/腹の両側にスカルの基本に。基になる脳を損傷しないように注意を取って背側正中線上を吻側方向に動いてスカルの尾側/背側側面から始まるその他の浅いカットを作る。最終的な 'T を作る' 嗅球のレベルで正中線に垂直をカットします。
注: 興味の脳領域への損傷が行われないように注意する必要があります。特に、時間がない時あります脳自体に適用される圧縮の力がかかります。 - 吻側内側面から頭蓋骨を把握し尾側方向に向かって皮をむくラウンド先端の鉗子を使用します。クラックする両側の繰り返しを開き、脳を公開する頭蓋骨キャップの背側の半分を削除します。中古冷蔵 NMDG HEPES アプライドのビーカーに脳をそのままを優しくかき出します。〜 1 分を均一に冷却する脳を許可します。
- 大きなヘラを使用して、フィルターの紙で覆われてペトリ皿にビーカーから脳を持ち上げます。トリムし、スライスの好みの角度によると脳領域を必要に応じて脳をブロックします。処理中に長時間の酸素欠乏を避けるためにすぐに動作します。
注: 多くのスライス角度が可能です。正確なブロッキング メソッドとスライス角度は調査されるべき正確な脳の領域、細胞型、および回路が異なります。 - 接着剤を使用して試料ホルダーに頭脳のブロックに貼付します。十分な脳ブロックの完全に内側を撤回する試料ホルダーの内側部分を撤回します。脳ブロックが agarose で完全に覆われるまでは、ホルダーに直接溶融アガロースを注ぐ。〜 10 用試料ホルダーの周囲にブロックを低温予冷アクセサリー クランプ s agarose が固化するまで。
- 試料ホルダーをスライサー マシンのソケットに挿入し、適切なアライメントを確認します。リザーバーは 250 mL のビーカーから残り中古冷蔵、酸素 NMDG HEPES アプライド、貯水池に十分な酸素を確保するためのスライスの間バブル石を移動します。
- アガロース埋め込み脳標本を前進を開始するマイクロ メーターを調整します。スライサーを開始し、経験的希望のレベルまで進歩速度および発振周波数を調整します。
注: 両方の設定は、低域でする必要があります。最高の結果を得るには、単一を取る約 20 s と振動する必要がありますとなりますないあからさまな賑やかで非常に滑らかで穏やかなハミング ノイズ ブレード アームの渡します。 - 先へ進めし、300 μ m 刻み (または他の好適な厚さ) で脳の領域まで興味のティッシュをスライスは断面が完全に;スライス手順の合計時間は、15 分未満にする必要があります。
5. NMDG 保護回復手順の最適化
- 初期 NMDG 回復ステップ (重要なステップ): 断面の手順が完了したら、カットオフ プラスチック パスツール パイプ t を使用してスライスのすべてを収集し、150 ml の初期回復商工会議所に予め温めておいた (34 ° C) に転送NMDG HEPES アプライド。短い連続ですべてのスライスを転送し、すべてのスライスは、回復室に移動するとすぐに、タイマーを開始します。
- 表 2マウスの年齢に応じて最適な Na+スパイクのスケジュールを決定するを参照してください。
注: この手順は、脳スライス室に Na+の再導入速度の制御を達成するために実用的な方法 (材料表参照) 特定の脳スライス チャンバー形状と貯留層ボリュームと種類の最適化します。 - ステップワイズ スパイクで Na+を実行で示された Na+スパイクでソリューションの指定されたボリュームを追加回。急速混合を容易にする最初の回復室のバブラー煙突に直接ソリューション スパイクで Na+を追加します。
- すべてのスライスを室温で維持される HEPES アプライド長期保持チャンバーに転送します。保持室パッチ クランプ記録実験を開始する前に HEPES でさらに 1 時間を回復するスライスを許可します。
6. パッチ ・ クランプ記録
注: 次の基本的な手順だけいくつかの実用的な考慮事項を提供、これら見つけることができます他の場所,5354としてパッチ クランプの録音のための詳しいプロトコルを表すにはものではありません。パッチ クランプ電気生理学リグはこのアプリケーションに必要です。これ、一般的に装備されて赤外線差動干渉の対照 (IR DIC) 光学正立顕微鏡で構成されます、蛍光照明システム、パッチ クランプ アンプとデータ デジタイザー電動マイクロマニピュレーターと顕微鏡プラットフォーム、除振台、ファラデーケージの中に、ソリューションの暖房および灌流システム試料室とプラットフォームは、浸漬スライス記録を設計するべきです。多ニューロン パッチ クランプ録画、複数のアンプ、ヘッドのステージ、および高品質のマニピュレーターを装備したリグが必要です。また、最高の結果を得るには、リグは 900 nm IR バンドパス フィルターを装備、光学部品のマッチングは細胞の適切な可視化を確保するため勧め > 50 μ m 脳スライスで深い。Kӧhler 照明の適切な配置も明確に可視化のために重要です。
- (MM) の細胞内ピペット ソリューションを準備: グルコン酸 K 130-4 10 クレアチンリン酸 Na2, 4 MgATP 0.3 Na, 0.3 グリコールエーテルジアミン四酢酸 10 HEPES KCl2-GTP と 13.4 biocytin。1 M コで 7.35 に pH, 285-290 mOsmol/kg 必要としてショ糖を使用して浸透圧を調整します。
- ホウケイ酸ガラスの肉厚の毛細血管からパッチ クランプ電極を準備します。理想的なパッチ クランプ電極が比較的短いとずんぐりしたテーパー m ω に満ちた ~ 3-6 お風呂で先端抵抗。
- 銀電極ワイヤが正しく安定した録音を確保するために chlorided ことを確認します。これを行うに液体漂白剤約 30 分、またはワイヤーが黒くなるまでの最後の沈没によって (典型的な) 3-4 mm 銀のワイヤーします。
- オーバーフローを避けるため蠕動性ポンプ流入と流出を合わせて世話録音室をアプライドの記録 3-4 mL/分循環 carbogenated に設定を用いた灌流を確立します。
- 水没記録室に単一の脳スライスを転送し、セキュリティで保護された場所にナイロンとスライスの U 字アンカーを使用して文字列をクロスします。高い電力目的 (例えば、高開口数 40 X、60 X 水浸漬の目的) に切り替える前に 4 X 空気目的を使用してターゲットの脳の領域を特定します。
- 健康的な標的細胞を視覚的に識別します。相馬では、神経細胞の膜の外観 IR DIC 顕微鏡による可視化は、パッチ ・ クランプ記録のセルが候補者の適合性を判断するために使用されます。
注: 健康的なニューロンは通常次の機能を展示: 縮んだもいつつ、ソフト コントラスト膜エッジと滑らかな膜外観の腫れ。さらに、健康な細胞の大半がある > 30 μ m、スライスで深い表面的なニューロンで破損している可能性があると切断樹状突起。しわの外観をはっきりと見える核または '目玉' の外観、または非常に暗いまたは高コントラスト膜の端を示すニューロンは避けるべきであります。 - 埋戻しパッチ ピペットの細胞内の溶液の ~ 5 μ L で、電極ホルダーに読み込みます。脳スライスの上記録風呂にピペットを移動し、先端に障害物を除去する光の肯定的な圧力を適用します。ピペットのオフセットをゼロし、膜のテスト機能を用いた先端抵抗を監視します。
- ピペット チップ ターゲット ニューロンの細胞体との接触を移動します。光の肯定的な圧力により膜表面の小さなディンプルを形成する必要があります。
- 膜ディンプルを観察すると、すぐに迅速の肯定的な圧力を削除し、シール形成を容易にする穏やかな吸引を適用します。ピペットの抵抗増加に一度 > 100 m ω 型の対象となるセルの潜在的な予想される静止膜に一致するレベルに保持コマンドをオンに (-70 mV 良い出発点である)。
- 先端抵抗 ≥ 1 gigaohm に達すると、鋭い吸引; の簡単な発作を使用してパッチ ピペットの下にある膜を破裂してセルに侵入を試みる'攻撃' の機能は、必要に応じて侵入を容易に利用されるかもしれない。
注:-70 の開催可能性皮質ニューロンの電圧クランプ実験用 mV が示唆されました。健康的なニューロン リーク電流-100 pA よりもこれ以上負実験の期間がこれはセルの種類に一部依存。静止膜電位は-50 よりより脱分極場合解析から除外されるニューロン mV、またはアクセス抵抗が 20% 以上変更された場合。 -
安定の全細胞パッチ ・ クランプ記録を取得した後手順 6.6-6.10 を繰り返すことによって記録のための追加のニューロンをターゲットします。最初の記録を失うことになる機械的障害を避けるために注意してください。
- ニューロンのシナプス結合を見つけることの合理的な確率を確保するための最初の神経細胞から 100 μ m 内にある追加のニューロンを選択します。
メモ: 前もって複数の候補者のニューロンを識別するために、事前読み込みし、最初のパッチク ランプ記録を確立する前に様々 な標的細胞に近くすべてピペットを事前位置にいくつかのケースで役に立つ場合があります。
- ニューロンのシナプス結合を見つけることの合理的な確率を確保するための最初の神経細胞から 100 μ m 内にある追加のニューロンを選択します。
Representative Results
このセクションはルーチン脳スライス標本と最適化された NMDG 保護回復法 (すなわち、漸進的な Na+と結合される NMDG 保護回復を用いたパッチ クランプ電気生理学実験の代表的な結果を提供します。スパイクのプロシージャ)。脳スライスの最適化された NMDG 保護回復法 (図 1) の実装の有無を準備の様々 な脳領域におけるニューロンの最初、形態の保存を行った。これらの実験のため 3 月の古い成体マウスおよびニューロン状態を形状と突起の近位樹状突起全体の外観に基づいて判断する IR DIC 顕微鏡を用いています。(すべての画像はスライスの準備の後の 1-2 h を得られた) 保護回復法を使わず脳スライスの代表的なイメージの大部分のニューロンのしわが寄った、異型の外観を注意してください。これらのコントロールのスライス NMDG アプライドを用いた灌流 transcardial と手順をスライスした、高 Na+で回収された当初-アプライド HEPES を含みます。対照的に、最適化された NMDG 保護回復法によるスライスから代表的なイメージは、パッチク ランプ記録 (図に適した改良された形態 (スムーザー、フラー、しわを寄せられた外観以下) とニューロンを明らかにします。1). 神経保存性の向上が認められた複数の脳領域 II/III と V、subiculum、背外側膝状体 (dLGN) 新皮質を含むレイヤーします。
次に、最適化された NMDG 保護回復法は、元 NMDG の保護回復方法を (すなわち、漸進的な Na+スパイクのプロシージャなし) と比較した.パッチク ランプ記録試みの gigaohm シール形成の平均時間が劇的に大幅減少 (9.9 33.3 対 s s、* *p < 0.005、ペアt-テスト)、漸進的なプロシージャのスパイクで Na+が適用されました。一緒に NMDG 保護回復ステップ (図 2)。大きく時間をシールより速くより信頼性の高い膜は、パッチク ランプ若い成体脳スライス内の記録のスループットを向上します。スケジュール スパイクに最適な Na+動物年齢 (表 2) によるとさらに変更された (1 歳のマウスに 3 週間) をテストしたすべての年齢のために有益だった.スパイクの手続きの過程で段階的なナトリウム イオン濃度上昇のプロファイルは、表 2に示すスケジュールに同行する (図 3) を提供しています。
ヤング アダルト (生後 40-80) で個々 のニューロンの本質的な電気生理学的特性を特徴付ける大規模な努力は進行中に体系的にアレン研究所細胞型プログラム (http://celltypes.brain-map.org/) の一部として神経集団の遺伝的定義 (皮質層と Cre ドライバーの特定の行を Cre 依存蛍光に渡った細胞型の細胞型-特異的蛍光マーカー発現トランスジェニック系統から派生したマウス視覚皮質脳スライス記者行55を)。図 4は、パルブアルブミン (Pvalb) から記録された発火パターンの例のトレースを示しています-1 s 現在注入ステップのダイナミック レンジをカバーする一連の応答で皮質高速スパイク (FS) 介在 (Pvalb-IRES-Cre/Ai14 マウス) を表現します。神経細胞の発火。F-カーブ右 22 皮質 FS 介在ニューロンのデータセットを示しています。ターゲットと同様 23 変異表現興奮性ニューロンの変異-IRES-Cre/Ai14 マウス (図 4) から IV のレイヤーを特徴付けるパッチ クランプ記録実験を行った。多様な健康的なニューロン型 FS 介在ニューロンと錐体細胞を含む皮質領域にわたって日常的にかつ確実にターゲットにできますパッチク ランプ スライス標本がこれを使用して最適化を行うプロトコルを少なくとも 6-8 時間の記録のため。
神経の組み込みプロパティを測定するだけでなくシナプス結合は視覚皮質回路で定義されている型の同時に記録された複数のニューロン間プローブでした。記録技術多ニューロン パッチ クランプは要求して非常に定義されている型の多数の正常な候補ニューロンは高品質を得る合理的な機会を確保するために脳スライスの比較的小さいフィールド内に存在する必要があります、同時録音は、 bona fideシナプス接続を識別します。図 5は、若い大人 Pvalb-IRES-Cre/Ai14 マウス由来脳スライスの視覚野における tdTomato + FS ニューロン 2 つのペアの記録を示します。強い逆回転防止抑制性シナプス結合 (高塩化物内部ピペット ソリューションと記録されている) が検出されました。例の録音と短期シナプス可塑性の特性測定のためのプロトコルが表示されます。高周波列車刺激 (10 パルス各 10、50、および 100 Hz) の発作は、さまざまな時間間隔で 1 つの復旧テスト パルスが続いていた (1、2、または 4 s) シナプスからの回復の経過を測定します。
優秀な成功は、成熟した成人前のヴィヴォ脳スライスにおける人間の大脳皮質ニューロンにも得られています。脳神経外科標本は、スケジュールされた地元の病院で摘出手術を受けている患者から取得されます。人間の脳神経外科の組織コレクションと脳スライス標本の方法は、いくつかの実用的な方法でマウスの脳スライス手順とは異なります。(病理学のサイトに遠位) 切除の新皮質組織の手術室から収集し冷えた酸素 NMDG HEPES アプライドに浸漬し、継続的な低温とする手術室から酸素で運ばれた簡単に言うと、30 分以内の実験室。脳スライスは NMDG 保護回復プロシージャを使用して準備、パッチ クランプ録音を開始する前に約 3 時間の長時間をリカバリできます。図 6に示します成功したペアに実験と人間前のヴィヴォ脳スライスが前頭皮質領域からこの方法で準備から成功した 4 人のパッチ クランプ記録実験を記録します。ペアの記録は (興奮性シナプス電流として記録されて) 皮質介在ニューロンに皮質錐体細胞から単方向の興奮性シナプス入力を示します。四角形パッチで興奮性の 2 つの実験し、2 つの抑制性ニューロンが同時に記録された (抑制性シナプス後電位として記録されて) 3 つの抑制性シナプス結合が検出されたプローブ接続数が 12 から。したがって、この最適化された脳スライスの方法論により脳の最も挑戦的で信頼性の高い実験成功、スライスなどには、複数のニューロン パッチ クランプ実験による鋭く摘出成熟した成人の脳の回路接続を検討組織。
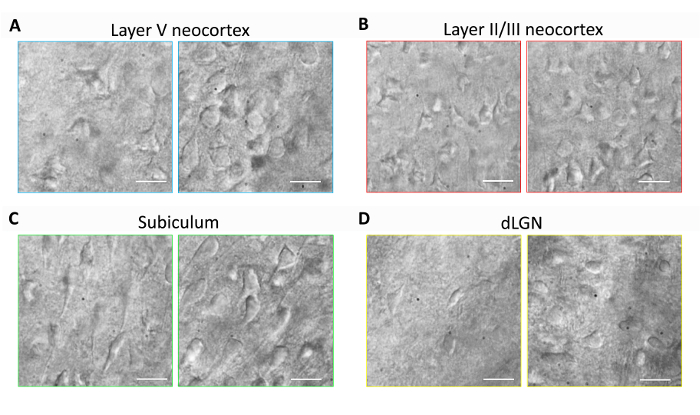
図 1:最適化された NMDG 保護回復脳スライス標本法と神経の保存を改善します。代表 IR DIC 画像に 3 か月の古いマウスから急性スライスにおける多様な脳部位から買収されました。最適化された NMDG 保護回復法 (右側のパネル) 対保護回復ステップ (左側パネル) なし NMDG 保護切断方法を制御します。(A) (B) レイヤー II/III (D) 背外側膝状体 (dLGN)、(C) subiculum、大脳新皮質の大脳新皮質の層 V。すべてのパネルのスケール バーは、20 μ mこの図の拡大版を表示するにはここをクリックしてください。 。
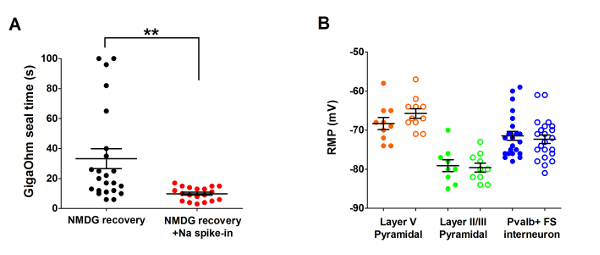
図 2:加速速度と gigaohm の信頼性を向上させるシール パッチク ランプ記録 Na+スパイクの手順と NMDG 保護回復法を用いた実験における形成します。(A) プロット gigaohm シール形成の回だけで NMDG 回復のため (黒のデータ ポイント、n = 19) と NMDG 回復 ++ Na スパイクの手続き (赤のデータ ポイント、n = 23)。記録のすべてのセルが第 II/III または視覚野の V 層の錐体細胞。注意してください、最大時間の上限は 100 s 決して gigaohm シールを形成する細胞を考慮します。ペアt-テスト、* *p < 0.005。静止膜電位 (RMP) の V 層の錐体細胞の (B) プロット (オレンジ データ ポイント、n = 10/11)、第 II/III 錐体細胞 (緑のデータ ポイント、n = 9/10)、または皮質 Pvalb + FS 介在ニューロン (青のデータ ポイント、n = 23/22)。黒丸は NMDG 回復条件を表し、円 NMDG 回復プラス Na+スパイクでプロシージャを開きます。各データ ポイントは一つのニューロンと両方の平均値を表し、SEM の +/-が表示されます。脳スライス作製条件を比較するすべての 3 つの細胞型の RMPs に大幅な違いがない (ペアt-テスト)。この図の拡大版を表示するのにはここをクリックしてください。
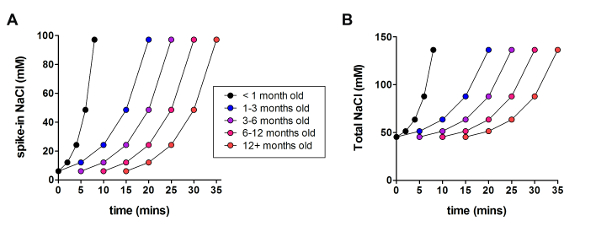
図 3: スパイクの手続きの過程で段階的なナトリウム イオン濃度上昇のプロファイルします。(A) スパイクの NaCl 濃度対時間のプロット。(B) 細胞外 NaCl 濃度対時間のプロット。この図の拡大版を表示するのにはここをクリックしてください。
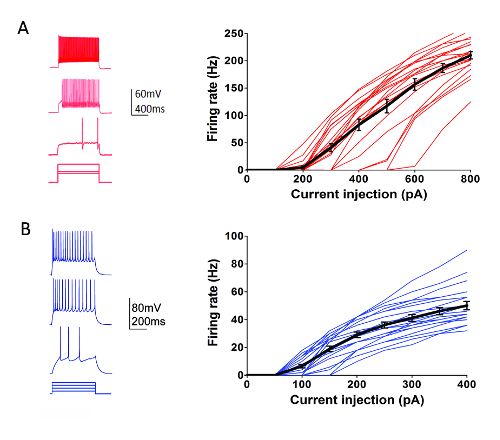
図 4: 大脳皮質細胞の遺伝的に定義されている型の本質的な電気生理学的プロパティ。(A) の例は、介在ニューロン FS 皮質 Pvalb + (左側のパネル) の現在の注入手順に応答ニューロンのトレースします。tdTomato + ニューロンは、Pvalb-IRES-Cre/Ai14 マウス脳切片での録音のために目標とされました。焼成率電流注入関係の集計データ (F-曲線) 右に示されている (n = 22)。(B) の例では、変異表現皮質層 IV 興奮性ニューロン (左側のパネル) の現在の注入手順に応答ニューロンのトレースします。tdTomato + ニューロンは、変異-IRES-Cre/Ai14 マウス脳切片での録音のために目標とされました。焼成率電流注入関係の集計データ (F-曲線) 右に示されている (n = 23)。薄い色の各行を表す F-単一ニューロン; 曲線一方、太い黒線が SEM. ± グループごとに平均値を表しますこの図の拡大版を表示するのにはここをクリックしてください。
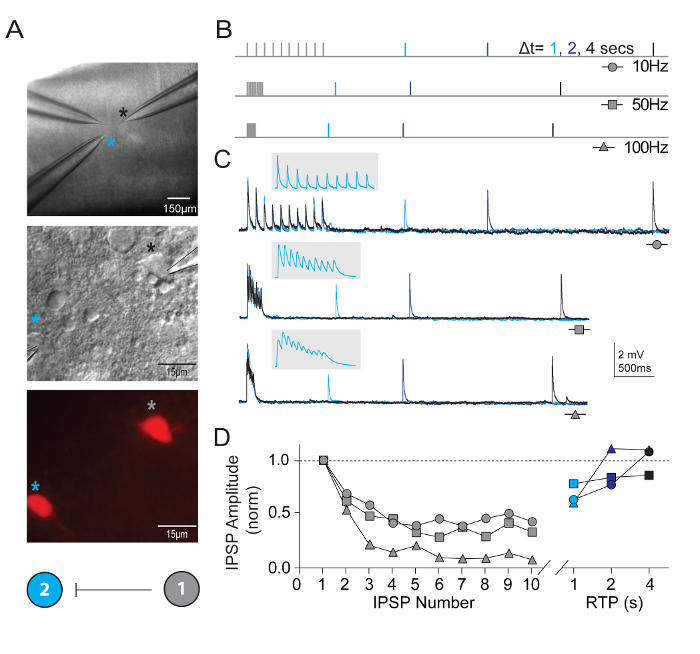
図 5:シナプス接続の Pvalb 発現皮質 FS ニューロンにおける短期可塑性。(A) 微分干渉コントラストと落射蛍光マウス視覚野の tdTomato 陽性、Pvalb 表現 FS の介在ニューロンを対象に使われました。2 つの介在ニューロン間の一方的なシナプス結合を示す色コード化された回路接続図。神経細胞のシナプス接続の短期的なダイナミクスを評価するために使用される刺激プロトコルの (B) の模式図。10 活動電位の列車 (10、50、および 100 Hz) を別の時間の遅れで配信される単一アクション可能性 (回復テスト パルス、RTP) 続いて、シナプス前ニューロンに誘発 (1、2、および 4 s) 列車が終了した後。各 RTP は、明確に色分けされています。(C) 対応する一方的な抑制性シナプス後電位 (uIPSPs) のセル #1 で誘発される活動電位の列車への応答のセル #2 の平均の痕跡。灰色のはめ込みは、uIPSP 鉄道の描写を表示するタイム スケールを拡大しています。(D) 正規化 uIPSP 振幅は周波数を変えることで電車の中に彼らの位置の関数としてプロットされます。Net のうつ病は 4 uIPSP の実質的な回復とすべての入力率の反対側、s.この図の拡大版を表示するのにはここをクリックしてください。
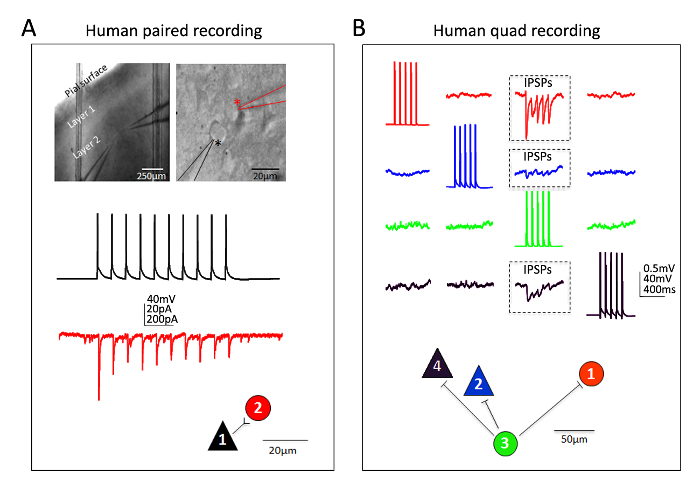
図 6:多ニューロン パッチ クランプ録音大人の人間の脳神経外科で脳スライス。(A) 低および高倍率 IR DIC 画像位置と記録されたニューロン (トップ パネル) の id を示します。錐体細胞 (黒アスタリスク) と近隣の介在 (赤いアスタリスク) は同時に記録しました。例色は介在ニューロン (工として電圧クランプで測定)、対応する物理的な接続マップ (底面) 錐体細胞から単一指向性の興奮性シナプス接続 (espc ていた) の痕跡をコーディングしました。(B) 4 人パッチク ランプ実験背外側前頭前野の成人の脳神経外科脳スライス。2 つの錐体ニューロンと介在ニューロンの 2 つは 12 の可能なシナプス接続のシーケンシャル プロービングを可能にする同時に記録されます。#3 (緑トレース) のセルに誘発電位の列車は、それぞれ、他の 3 つ同時に記録されたニューロン (ボックス化された 3 つの地域、上部パネル) の抑制性シナプス後電位 (IPSPs) の検出につながった。それぞれの個々 のニューロンから記録された応答は、わかりやすくするため色分けです。物理的な接続マップは、下のパネルに表示されます。(B) に示すように原料のトレースを表すスイープ、少なくとも 20 の連続した生データの平均値に注意してください。セルの種類の推定同定は、相馬形状、蛍光染料の録画、および現在の注入手順への応答の発火パターンを含む本質的な電気生理学的特性の中に詰物によって形態の分析に基づいていた。この図の拡大版を表示するのにはここをクリックしてください。
| NMDG HEPES アプライド | HEPES 持株アプライド | アプライドの記録 | |||||||
| コンポーネント | mM | MW | g/リットル | mM | MW | g/リットル | mM | MW | g/リットル |
| NMDG | 92 | 195.22 | 17.96 | ||||||
| HCl | 92 | 36.46 | * | ||||||
| 塩化ナトリウム | 92 | 58.44 | 5.38 | 124 | 58.44 | 7.25 | |||
| KCl | 2.5 | 74.55 | 0.19 | 2.5 | 74.55 | 0.19 | 2.5 | 74.55 | 0.19 |
| NaH2PO4 | 1.2 | 138.00 | 0.17 | 1.2 | 138.00 | 0.17 | 1.2 | 138.00 | 0.17 |
| NaHCO3 | 30 | 84.01 | 2.52 | 30 | 84.01 | 2.52 | 24 | 84.01 | 2.02 |
| HEPES | 20 | 238.31 | 4.77 | 20 | 238.31 | 4.77 | 5 | 238.31 | 1.19 |
| グルコース | 25 | 180.20 | 4.51 | 25 | 180.20 | 4.51 | 12.5 | 180.20 | 2.25 |
| アスコルビン酸ナトリウム | 5 | 198.00 | 0.99 | 5 | 198.00 | 0.99 | 0 | 198.00 | 0.00 |
| チオ尿素 | 2 | 76.12 | 0.15 | 2 | 76.12 | 0.15 | 0 | 76.12 | 0.00 |
| ピルビン酸ナトリウム | 3 | 110.04 | 0.33 | 3 | 110.04 | 0.33 | 0 | 110.04 | 0.00 |
| MgSO4.7H2O | 10 | 246.48 | 5 mL | 2 | 246.48 | 1 mL | 2 | 246.48 | 1 mL (2 M 株式) |
| CaCl2.2H2O | 0.5 | 147.01 | 0.25 mL | 2 | 147.01 | 1 mL | 2 | 147.01 | 1 mL (2 M 株式) |
| * 7.3 7.4 濃塩酸を使用する NMDG HEPES アプライドの pH 滴定しなさい | |||||||||
| すべてのソリューションにする必要があります範囲 300 310 Mosm/kg | |||||||||
表 1:メディア製剤。
| 動物の年齢 | |||||
| 時間 (分) * | < 1 ヶ月 | 1-3 ヶ月 | 3-6 ヶ月 | 6-12 ヶ月 | 12 カ月以上 |
| 0 | 250 Μ L | 250 Μ L | |||
| 1 | |||||
| 2 | 250 Μ L | ||||
| 3 | |||||
| 4 | 500 Μ L | ||||
| 5 | 250 Μ L | 250 Μ L | |||
| 6 | 1000 Μ L | ||||
| 7 | |||||
| 8 | 2000 Μ L | ||||
| 9 | |||||
| 10 | 転送 | 500 Μ L | 250 Μ L | 250 Μ L | |
| 11 | |||||
| 12 | |||||
| 13 | |||||
| 14 | |||||
| 15 | 1000 Μ L | 500 Μ L | 250 Μ L | 250 Μ L | |
| 16 | |||||
| 17 | |||||
| 18 | |||||
| 19 | |||||
| 20 | 2000 Μ L | 1000 Μ L | 500 Μ L | 250 Μ L | |
| 21 | |||||
| 22 | |||||
| 23 | |||||
| 24 | |||||
| 25 | 転送 | 2000 Μ L | 1000 Μ L | 500 Μ L | |
| 26 | |||||
| 27 | |||||
| 28 | |||||
| 29 | |||||
| 30 | 転送 | 2,000 Μ L | 1,000 Μ L | ||
| 31 | |||||
| 32 | |||||
| 33 | |||||
| 34 | |||||
| 35 | 転送 | 2,000 Μ L | |||
| 36 | |||||
| 37 | |||||
| 38 | |||||
| 39 | |||||
| 40 | 転送 | ||||
| * 時間ゼロはちょっとスライスが初期回復室に転送されます。 | |||||
表 2:段階的な Na の推奨スケジュール+マウスの年齢によるとスパイクの手続き。
Discussion
Na+スパイクの Gigaohm シール形成とパッチク ランプ記録の成功を向上させます。
NMDG 保護回復法の初期バージョンは、成人・高齢の動物2,5用に設計されました。一部のアーリー アダプターの少年動物脳スライスにこの方法論を適用しようとしているも (すなわち、マウス < 30 日古い)。しかし、優れた目視により確認神経保存この年齢範囲の NMDG 保護回復法を用いたと対照をなして gigaohm シール形成できます頻繁失速、パッチク ランプ失敗した試行を記録するリードが指摘されています。1 つの仮説は、NMDG 陽イオンより容易に成人の脳のスライスに対する若年脳スライスに閉じ込められているシールの形成を妨げることができます。しかし、少年の脳スライスが NMDG アプライド (データは示されていない) で完全に水中に沈む中 gigaohm シールが形作ることができる容易に、こうしてを示すその NMDG アプライド自体を妨害されていない gigaohm シール形成。
低-高 Na+ソリューション初期脳スライスの回復手順の完了時からの急速な転移神経細胞膜に損傷を引き起こすし、シールの形成過程を摂動します。低-高 Na+、冷たい・暖かい温度、および Ca2 +の劇的な上昇から Mg2 +比への移行は、総称して自発的なシナプスの大規模な復活につながることを考えれば、これは直感的。この抑制のリバウンド局面がプロシージャをスライス脳では虚血性の侮辱の後再灌流障害を反映する可能性が。したがって、さらに Na+ NMDG 保護回復培養室内濃度分布の標高はゆっくりと漸進的な Na+スパイクのプロシージャが組み込まれています最初の回復段階で神経細胞膜の損傷を軽減します。再現性をもって正確なタイミングに昇格。元の保護回復プロシージャように温度から Na+の高度と Ca2 +/Mg2 +比昇格一時的な解離は有益です。さらに、Na+スパイクの手続きが早い時点と脳組織が生じます、遅い時間ポイントに向かって大きく細胞外の Na+濃度が小さい増加につながるが、Na+濃度の上昇に合わせてより良い機会。この手順は、段階的なソリューション exchange に代わる制御灌流ポンプまたは重力によって点滴ライン Na+レベルの定数の増加につながる、流入と流出スライス チャンバーのオーバーフローを避けるために注意が必要です。特に、この Na+でスパイクの手続きスライス チャンバーに溶液の浸透圧次第にスライスは通常浸透圧溶液に返されますが、これはない健康に悪影響スライスする前に数分間の期間または、パッチク ランプ記録成功。高浸透圧切削ソリューションより良い、この一時的なパッチ クランプ記録57,58, 真正のドーパミン神経細胞を維持するために脳スライス標本で以前使用されていますhyperosmolality は、いくつかの文脈に有益である可能性があります。
NMDG 保護回復法と段階的な Na+最適化されたプロシージャを実装することで成熟した大人の動物の年齢層を介して少年をカバーするスパイクのステップこの脳スライスの方法論のユーティリティを拡張されています。この更新されたプロトコルは、単一の最適な NMDG アプライド定式化およびプロシージャを使用して動物の年齢の広い範囲に適しています今。必要に応じて、徐々 に長く遅延および/またはより古い動物から脳スライスの生存率を高める遅い時間コースと Na+スパイクの手続きを適用でき、推奨は、スパイクでのよるとスケジュールの基本的なガイドを提供しています。動物に年齢 (表 2参照)。一方、我々 は、幅広いアプリケーションに適した基本的なフレームワークを提供している、生存率と脳スライス成人・高齢の動物からの寿命をさらに強化するため追加の高度な手順を調べることができます。たとえば、グルタチオン復元戦略はこの点に特に効果的し、2,6を他の場所で説明されているように実装することができます。
実験に挑戦のためのスループットの向上
パッチ ・ クランプ記録によってシナプス結合の解析は、成功の高い信頼性を実現するために神経細胞の構造と機能の両方の優秀な保存を必要とする要求の厳しいアプリケーションです。同時に記録されるニューロンの数として上がるまで直線的にスープラ-直線的技術的な難しさのレベルが 。多数の障害モードがあります、障害の最も頻繁な原因の 1 つ 1 つまたは複数の標的細胞に十分な gigaohm 印を結びができません。進行状況、特に 3 時が大幅に低下することができますこのまたはより多くのニューロンを同時に記録する必要があります。高速の発見と一致 gigaohm 最適化された NMDG 保護回復法と形成時間をシール、トランスジェニック両方の大人と成功率と多ニューロン パッチク ランプ実験のスループットに著しい改善があったマウスの脳スライスおよび成人の脳神経外科脳スライス。効率の向上より迅速かつ信頼性の高い gigaohm シール形成とこのプロトコルとスライスの神経保存性の向上の両方にほとんど確かに起因します。このプロトコルは、パッチク ランプ記録アプリケーションを明示的に利点に焦点を当て、脳スライスの生存が最優先他の挑戦的な実験アプリケーション同様の利益が予想されます。
Acknowledgements
この作品は、頭脳科学のためのアレンの協会によって賄われていた。著者のアレンの協会創設者、ポール g. アレンとジョディのアレン、ビジョン、励まし、サポートに感謝したいです。また、動物の世話、飼育、遺伝子型を実行するためのアレンの協会テクニカル サポート スタッフを感謝いたします。
Materials
| Name | Company | Catalog Number | Comments |
| Compresstome VF-200 | Precisionary Instruments | VF-200 | Vibrating tissue slicer (recommended) |
| N-methyl-D-glucamine | Sigma Aldrich | M2004 | aCSF constituent |
| Sodium Chloride | Sigma Aldrich | S3014 | aCSF constituent |
| Potassium Chloride | Sigma Aldrich | P5405 | aCSF constituent |
| Sodium Phosphate monobasic dihydrate | Sigma Aldrich | 71505 | aCSF constituent |
| Sodium Bicarbonate | Sigma Aldrich | S5761 | aCSF constituent |
| HEPES | Sigma Aldrich | H4034 | aCSF constituent |
| Glucose | Sigma Aldrich | G7021 | aCSF constituent |
| Sodium Ascorbate | Sigma Aldrich | A4034 | aCSF constituent |
| Thiourea | Sigma Aldrich | T8656 | aCSF constituent |
| Sodium pyruvate | Sigma Aldrich | P5280 | aCSF constituent |
| Calcium chloride dihydrate | Sigma Aldrich | C7902 | aCSF constituent |
| Magnesium Sulfate heptahydrate | Sigma Aldrich | M1880 | aCSF constituent |
| 2,2,2-Tribromoethanol | Sigma Aldrich | T48402 | Anesthetic component 1 |
| 2-methyl-2-butanol | Sigma Aldrich | 240486 | Anesthetic component 2 |
| Curved blunt forceps | Fine Science Tools | 11065-07 | Brain dissection tools |
| Fine dissecting scissors (supercut) | Fine Science Tools | 14058-09 | Brain dissection tools |
| Large heavy duty scissors 7'' | Fine Science Tools | 14000-18 | Brain dissection tools |
| Metal spatula | Sigma Aldrich | Z511455-1PAK | Brain dissection tools |
| Razor blades | VWR | 89031-954 | Brain dissection tools |
| Brain Slice Keeper-4 | Automate Scientific | S-BSK4 | brain slice holding chamber |
| nylon netting | Warner Instruments | 64-0198 | For building small slice recovery chambers |
| Pyrex glass beakers (250 mL) | VWR | 89090-434 | For building small slice recovery chambers |
| 35 mm plastic dish, round | VWR | 100488-376 | For building small slice recovery chambers |
| Gas diffuser stones (10 µm) | Sigma Aldrich | 59277 | For constant carbogenation (fine bubbles) |
| Agarose Type I-B | Sigma Aldrich | A0576 | For embedding brain specimens |
| Micro loader tips | Eppendorf | 22491229 | For filling patch clamp electrodes |
| Sylgard | VWR | 102092-312 | For making a custom dissecting platform |
| Hydrochloric acid | Sigma Aldrich | H1758-100ML | For pH adjustment of media |
| Sodium Hydroxide | Sigma Aldrich | 221465-25G | For pH adjustment of media |
| Potassium Hydroxide | Sigma Aldrich | 221473 | For pH adjustment of media |
| Plastic transfer pipets 3 mL graduated | VWR | 89497-676 | For slice transfer |
| Zirconium ceramic injector blades | Cadence Specialty Blades | EF-INZ10 | http://cadenceinc.com/ |
| KG-33 borosilicate glass capillary w/filament | King Glass Company | custom quote | ID: 0.87mm, OD 1.50mm |
| Biocytin | Sigma Aldrich | B4261 | Intern pipette solution |
| Phosphocreatine disodium | Sigma Aldrich | P7936 | Intern pipette solution |
| Potassium Gluconate | Sigma Aldrich | G4500-100G | Intern pipette solution |
| EGTA | Sigma Aldrich | E3889 | Intern pipette solution |
| Mg-ATP | Sigma Aldrich | A9187 | Intern pipette solution |
| Na2-GTP | Sigma Aldrich | 51120 | Intern pipette solution |
| sucrose | Sigma Aldrich | S0389 | Intern pipette solution |
| Heated water bath (2.5L) | VWR | 13491-060 | Miscellaneous |
| Filter paper rounds | VWR | 28456-022 | Miscellaneous |
| Cyanoacrylate glue | Amazon | B000BQRBO6 | Miscellaneous |
| Glass petri dish | VWR | 89000-326 | Miscellaneous |
| 10X Phosphate buffered saline | Sigma Aldrich | P5493 | Miscellaneous |
| 30 mL syringes | VWR | BD302832 | Miscellaneous |
| 1 mL syringes | VWR | BD-309628 | Miscellaneous |
| 25 5/8 gauge needles | VWR | 89219-292 | Miscellaneous |
| Thermomixer (w/1.5 mL tube block) | VWR | 89232-908 | To keep agarose molten |
References
- Aghajanian, G. K., Rasmussen, K. Intracellular studies in the facial nucleus illustrating a simple new method for obtaining viable motoneurons in adult rat brain slices. Synapse. 3 (4), 331-338 (1989).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods Mol Biol. 1183, 221-242 (2014).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nat Methods. 8 (9), 745-752 (2011).
- Peca, J., et al. Shank3 mutant mice display autistic-like behaviours and striatal dysfunction. Nature. 472 (7344), 437-442 (2011).
- Ting, J. T. F., et al. Improved methods for acute brain slice preparation from adult and aging animals. Society for Neuroscience Abstracts. 520, (2011).
- Ting, J. T. F., et al. Improved methods for acute brain slice preparation from adult and aging animals (Part II): Glutathione depletion underlies rapid deterioration of adult brain slices. Society for Neuroscience Abstracts. 505, (2012).
- MacGregor, D. G., Chesler, M., Rice, M. E. HEPES prevents edema in rat brain slices. Neurosci Lett. 303 (3), 141-144 (2001).
- Liu, Y. B., Guo, J. Z., Chiappinelli, V. A. Nicotinic receptor-mediated biphasic effect on neuronal excitability in chick lateral spiriform neurons. Neuroscience. 148 (4), 1004-1014 (2007).
- Xiang, Z., Huguenard, J. R., Prince, D. A. GABAA receptor-mediated currents in interneurons and pyramidal cells of rat visual cortex. J Physiol. 506, 715-730 (1998).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nat Protoc. 1 (4), 2075-2081 (2006).
- Contractor, A., et al. Loss of kainate receptor-mediated heterosynaptic facilitation of mossy-fiber synapses in KA2-/- mice. J Neurosci. 23 (2), 422-429 (2003).
- Pita-Almenar, J. D., Collado, M. S., Colbert, C. M., Eskin, A. Different mechanisms exist for the plasticity of glutamate reuptake during early long-term potentiation (LTP) and late LTP. J Neurosci. 26 (41), 10461-10471 (2006).
- Ito, K., Contractor, A., Swanson, G. T. Attenuated plasticity of postsynaptic kainate receptors in hippocampal CA3 pyramidal neurons. J Neurosci. 24 (27), 6228-6236 (2004).
- Van Dort, C. J., et al. Optogenetic activation of cholinergic neurons in the PPT or LDT induces REM sleep. Proc Natl Acad Sci U S A. 112 (2), 584-589 (2015).
- Ferando, I., Mody, I. Altered gamma oscillations during pregnancy through loss of delta subunit-containing GABA(A) receptors on parvalbumin interneurons. Front Neural Circuits. 7, 144 (2013).
- Walker, A. G., et al. Metabotropic glutamate receptor 3 activation is required for long-term depression in medial prefrontal cortex and fear extinction. Proc Natl Acad Sci U S A. 112 (4), 1196-1201 (2015).
- Takahashi, Y. K., et al. Neural estimates of imagined outcomes in the orbitofrontal cortex drive behavior and learning. Neuron. 80 (2), 507-518 (2013).
- Pan, G., et al. Preserving GABAergic interneurons in acute brain slices of mice using the N-methyl-D-glucamine-based artificial cerebrospinal fluid method. Neurosci Bull. 31 (2), 265-270 (2015).
- LaSarge, C. L., Santos, V. R., Danzer, S. C. PTEN deletion from adult-generated dentate granule cells disrupts granule cell mossy fiber axon structure. Neurobiol Dis. 75, 142-150 (2015).
- Tong, L. M., et al. Inhibitory interneuron progenitor transplantation restores normal learning and memory in ApoE4 knock-in mice without or with Abeta accumulation. J Neurosci. 34 (29), 9506-9515 (2014).
- Fleming, R. L., et al. Binge-pattern ethanol exposure during adolescence, but not adulthood, causes persistent changes in GABAA receptor-mediated tonic inhibition in dentate granule cells. Alcohol Clin Exp Res. 37 (7), 1154-1160 (2013).
- Kummer, K. K., El Rawas, R., Kress, M., Saria, A., Zernig, G. Social interaction and cocaine conditioning in mice increase spontaneous spike frequency in the nucleus accumbens or septal nuclei as revealed by multielectrode array recordings. Pharmacology. 95 (1-2), 42-49 (2015).
- Qi, J., et al. A glutamatergic reward input from the dorsal raphe to ventral tegmental area dopamine neurons. Nat Commun. 5, 5390 (2014).
- Wang, L., et al. Modulation of dopamine release in the striatum by physiologically relevant levels of nicotine. Nat Commun. 5, 3925 (2014).
- Siuda, E. R., et al. Spatiotemporal Control of Opioid Signaling and Behavior. Neuron. , (2015).
- Tucker, K. R., Huertas, M. A., Horn, J. P., Canavier, C. C., Levitan, E. S. Pacemaker rate and depolarization block in nigral dopamine neurons: a somatic sodium channel balancing act. J Neurosci. 32 (42), 14519-14531 (2012).
- McDevitt, R. A., et al. Serotonergic versus nonserotonergic dorsal raphe projection neurons: differential participation in reward circuitry. Cell Rep. 8 (6), 1857-1869 (2014).
- Wang, D. V., et al. Mesopontine median raphe regulates hippocampal ripple oscillation and memory consolidation. Nat Neurosci. 18 (5), 728-735 (2015).
- Engle, S. E., Shih, P. Y., McIntosh, J. M., Drenan, R. M. alpha4alpha6beta2* nicotinic acetylcholine receptor activation on ventral tegmental area dopamine neurons is sufficient to stimulate a depolarizing conductance and enhance surface AMPA receptor function. Mol Pharmacol. 84 (3), 393-406 (2013).
- Vance, K. M., Ribnicky, D. M., Rogers, R. C., Hermann, G. E. Artemisia santolinifolia enhances glutamatergic neurotransmission in the nucleus of the solitary tract. Neurosci Lett. 582, 115-119 (2014).
- Dergacheva, O., Boychuk, C. R., Mendelowitz, D. Developmental changes in GABAergic neurotransmission to presympathetic and cardiac parasympathetic neurons in the brainstem. J Neurophysiol. 110 (3), 672-679 (2013).
- Dergacheva, O. Chronic intermittent hypoxia alters neurotransmission from lateral paragigantocellular nucleus to parasympathetic cardiac neurons in the brain stem. J Neurophysiol. 113 (1), 380-389 (2015).
- Dyavanapalli, J., et al. Chronic intermittent hypoxia-hypercapnia blunts heart rate responses and alters neurotransmission to cardiac vagal neurons. J Physiol. 592, 2799-2811 (2014).
- Apostolides, P. F., Trussell, L. O. Regulation of interneuron excitability by gap junction coupling with principal cells. Nat Neurosci. 16 (12), 1764-1772 (2013).
- Graziane, N. M., Polter, A. M., Briand, L. A., Pierce, R. C., Kauer, J. A. Kappa opioid receptors regulate stress-induced cocaine seeking and synaptic plasticity. Neuron. 77 (5), 942-954 (2013).
- Ferando, I., Mody, I. In vitro gamma oscillations following partial and complete ablation of delta subunit-containing GABAA receptors from parvalbumin interneurons. Neuropharmacology. 88, 91-98 (2015).
- Foster, D. J., et al. M5 receptor activation produces opposing physiological outcomes in dopamine neurons depending on the receptor's location. J Neurosci. 34 (9), 3253-3262 (2014).
- Engle, S. E., Broderick, H. J., Drenan, R. M. Local application of drugs to study nicotinic acetylcholine receptor function in mouse brain slices. J Vis Exp. (68), e50034 (2012).
- Wang, L., et al. Temporal components of cholinergic terminal to dopaminergic terminal transmission in dorsal striatum slices of mice. J Physiol. 592, 3559-3576 (2014).
- Holloway, B. B., et al. Monosynaptic glutamatergic activation of locus coeruleus and other lower brainstem noradrenergic neurons by the C1 cells in mice. J Neurosci. 33 (48), 18792-18805 (2013).
- DePuy, S. D., et al. Glutamatergic neurotransmission between the C1 neurons and the parasympathetic preganglionic neurons of the dorsal motor nucleus of the vagus. J Neurosci. 33 (4), 1486-1497 (2013).
- Abbott, S. B., Holloway, B. B., Viar, K. E., Guyenet, P. G. Vesicular glutamate transporter 2 is required for the respiratory and parasympathetic activation produced by optogenetic stimulation of catecholaminergic neurons in the rostral ventrolateral medulla of mice in vivo. Eur J Neurosci. 39 (1), 98-106 (2014).
- Dergacheva, O., Dyavanapalli, J., Pinol, R. A., Mendelowitz, D. Chronic intermittent hypoxia and hypercapnia inhibit the hypothalamic paraventricular nucleus neurotransmission to parasympathetic cardiac neurons in the brain stem. Hypertension. 64 (3), 597-603 (2014).
- Chen, Q., et al. Imaging neural activity using Thy1-GCaMP transgenic mice. Neuron. 76 (2), 297-308 (2012).
- Luongo, F. H., Horn, M. E. Sohal V.S. Putative microcircuit-level substrates for attention are disrupted in mouse models of autism. Biological Psychiatry. 79 (8), 667-675 (2016).
- Vance, K. M., Rogers, R. C., Hermann, G. E. PAR1-activated astrocytes in the nucleus of the solitary tract stimulate adjacent neurons via NMDA receptors. J Neurosci. 35 (2), 776-785 (2015).
- Feliciano, P., Andrade, R., Bykhovskaia, M. Synapsin II and Rab3a cooperate in the regulation of epileptic and synaptic activity in the CA1 region of the hippocampus. J Neurosci. 33 (46), 18319-18330 (2013).
- Tomioka, N. H., et al. Elfn1 recruits presynaptic mGluR7 in trans and its loss results in seizures. Nat Commun. 5, 4501 (2014).
- Jiang, X., et al. Principles of connectivity among morphologically defined cell types in adult neocortex. Science. 350 (6264), 9462 (2015).
- Mishra, A., et al. Imaging pericytes and capillary diameter in brain slices and isolated retinae. Nat Protoc. 9 (2), 323-336 (2014).
- Gabriel, L. R., Wu, S., Melikian, H. E. Brain slice biotinylation: an ex vivo approach to measure region-specific plasma membrane protein trafficking in adult neurons. J Vis Exp. (86), (2014).
- Edwards, F. A., Konnerth, A. Patch-clamping cells in sliced tissue preparations. Methods Enzymol. 207, 208-222 (1992).
- Qi, G., Radnikow, G., Feldmeyer, D. Electrophysiological and morphological characterization of neuronal microcircuits in acute brain slices using paired patch-clamp recordings. J Vis Exp. (95), e52358 (2015).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. J Vis Exp. (91), e51706 (2014).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 13 (1), 133-140 (2010).
- Hille, B. The permeability of the sodium channel to organic cations in myelinated nerve. J Gen Physiol. 58 (6), 599-619 (1971).
- Martin, M., Chen, B. T., Hopf, F. W., Bowers, M. S., Bonci, A. Cocaine self-administration selectively abolishes LTD in the core of the nucleus accumbens. Nat Neurosci. 9 (7), 868-869 (2006).
- Chen, B. T., et al. Cocaine but not natural reward self-administration nor passive cocaine infusion produces persistent LTP in the VTA. Neuron. 59 (2), 288-297 (2008).
Explore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved