Подготовка фрагментов острого мозга, с помощью оптимизированного N-метил-D-glucamine защитные восстановления метод
* These authors contributed equally
In This Article
Summary
Этот протокол демонстрируется реализация оптимизированной N-метил-D-glucamine (NMDG) защитные восстановления метод подготовки срез мозга. Один СМИ формулировка используется надежно получить здоровый мозг кусочки от животных, любого возраста и для различных экспериментальных приложений.
Abstract
Этот протокол представляет собой практическое руководство для N-метил-D-glucamine (NMDG) защитные восстановления метод подготовки срез мозга. Многочисленные недавние исследования подтвердили полезность этого метода для повышения нейрональных сохранения и общей жизнеспособности срез мозга. Реализация этого метода в начале усыновителей способствовала подробные расследования функции мозга с помощью различных экспериментальных приложений и охватывающих широкий спектр животных возрастов, области мозга и типов клеток. Шаги, намеченные для проведения защитных восстановления мозга ломтик техника с использованием оптимизированный NMDG искусственные спинномозговой жидкости (ФАГО) СМИ разработки и усовершенствованной процедуры надежно получить здоровый мозг ломтики для патч зажим электрофизиологии. Этот обновленный подход наблюдается значительное улучшение в скорости и надежности gigaohm уплотнение в процессе целенаправленной фиксации записи экспериментов при сохранении отличную нейрональных сохранения, способствуя тем самым сложным экспериментальных приложений. Представитель результаты предоставляются от мульти нейрон фиксации записи экспериментов для assay синаптической связи кортикальное мозга ломтиками готовится из молодых взрослых трансгенных мышей и зрелого взрослого человека нейрохирургических образцов. Кроме того оптимизированный метод защитные восстановления NMDG мозга нарезки совместим с несовершеннолетних и взрослых животных, таким образом разрешения ограничение оригинальной методологии. В резюме формулирования одного средства массовой информации и мозга, нарезка процедура может осуществляться различных видов и возрастов для достижения отличные сохранения жизнеспособности и тканей.
Introduction
Подготовка кусочек острого мозга является важным Экспериментальная модель системой в неврологии. Примерно половину века эта платформа позволила динамических функциональных исследований мозга жизни через широкий спектр видов животных и анатомические мозга. Является ли предполагаемого применения биохимии, функциональной томографии, морфология или электрофизиологии, это крайне важно для обеспечения оптимального целостности и жизнеспособности кусочки ткани. Именно по этой причине, что подготовка срез весьма устойчивыми несовершеннолетних грызунов мозга (т.е., моложе, чем послеродовой день 30 для мышей) был наиболее предпочтительным на сегодняшний день. Трудности в получении достаточно здорового мозга кусочки от зрелых взрослых и старения животных оказалась грозный вызов для большинства и ввел жесткие ограничения для изучения функциональной архитектуры зрелого мозга. Это особенно верно для фиксации записи, технику, которая требует отличные морфологических и функциональных сохранения и является необходимым условием для характеризующие подробные внутренние и синаптическую свойства выявленных одного нейронов. За последние несколько десятилетий подавляющее большинство электрофизиологов зажим патч полагались на «защитные резки» метод, с помощью сахарозы замещенных низкой Na+ -фаго1 для подготовки здоровый мозг фрагменты из несовершеннолетних и в гораздо меньшей степени, молодых взрослых животных. Этот метод основан на предпосылке, что пассивный Na+ приток и последующих воды вход и клеток опухоль на этапе резки срез является преобладающим оскорбления, что приводит к плохой выживания нейронов, особенно для этих нейронов, расположенных в поверхностные слои, которые с наибольшей вероятностью для поддержания прямой травмы от движения лезвия. Однако метод защитные резки по-прежнему оставляет желать много лучшего для подготовки срез мозга от зрелых взрослых животных независимо от конкретной фаго разработки реализована.
Простые, но эффективные решения этой проблемы был описан2,3,4,5,6 и называют метод slice «защитные восстановления» мозга. Оригинальной версии этот метод использует NMDG-замещенных фаго, как NMDG была определена как наиболее универсальный и эффективный среди различных других кандидата натрия Ион заменителей (в том числе сахарозы, глицерин, холин и Tris). При разработке средств массовой информации был еще более усиливается добавлением HEPES противостоять ломтик отек мозга и обеспечить более рН буферизации7, а также дополнение добавки для противодействия пагубные последствия оксидативного стресса (Таблица 1). Эмпирически было установлено, что инкубации первоначального восстановления шаг в низкой Na+, низкий Ca2 +, и высокой мг2 + NMDG фаго сразу после резки ткани взрослого мозга был необходимой и достаточной для улучшения нейронов сохранение в широком диапазоне областей мозга, типы клеток и животных возрасте3,5,6.
Примечательно ранее воплощения то, что теперь называют метод защитные восстановления можно найти в литературе1,8,9,10,11,12, 13, хотя полный потенциал для Зрелые взрослого и старения животных мозг срез и патч зажим записи не было признано или продемонстрировал в этих более ранних работах. Кроме того нюансы процедурные различия продолжают появляться в поддержку конкретных экспериментальных приложений4,14,,1516. Коллективный орган работы этих многочисленных исследовательских групп придает высокую уверенность в надежности метода защитные восстановления для сохранения Улучшенная ткани. Метод восстановления защитных NMDG теперь были широко приняты и осуществлены в многочисленных опубликованных научных исследований, используя фрагмент подготовки взрослых животных мозга. Эти острый срез исследования охватывают кортикальное3,17,18, гиппокампа15,19,20,21, полосатой22 , 23 , 24, средний мозг25,26,27,28,29и задний мозг30,,3132, 33 , 34 регионов и различных нейромедиаторов и нейромодулятора типов, включая глутаматергические4,30, ГАМК18,,2031,35 ,36, дофаминергической24,29,37,38, холинергических14,,3738, 39, норадренергической40и серотонинергической27,28 синапсах. Этот метод также хорошо подходит для контроля активности нейронов в фрагментов, полученных от трансгенных животных3,39 или после в vivo вирусный инъекции17,27, optogenetic 28,40,,4142,43, как также как функциональные Ca2 + визуализация активности нейронов2,44 ,45,46. Анализ краткосрочных пластичности4,,4748 и различных форм долгосрочного пластичности16,,3548 были сообщениям. Недавнее исследование применяется метод NMDG защитные восстановления для облегчения широкое и систематическое зондирование синаптической связи в зрительной коре в зрелых взрослых мыши срезы мозга с помощью octopatch, записи конфигурации49 — мощный демонстрация полезности и надежности этого метода. Метод восстановления защитных даже успешно применяется в ранее непредвиденных экспериментальной контекстах, например, улучшение сохранения сосудистую и pericytes взрослых коры мозга ломтики50, фиксации записи из пересаженные межнейронного населения в 1-1,5 лет болезни Альцгеймера мыши модели20и взрослого мозга ломтик рецептор людьми пробирного51.
Следующий протокол описывает пошаговые процедуры для реализации оптимизированный метод защитные восстановления NMDG мозга фрагмент подготовки для повышения жизнеспособности острого мозга ломтиками. Принципы для улучшения сохранения нейрональных обсуждаются, а также демонстрация четкие преимущества этой методологии для сложных мульти нейрон фиксации записи экспериментов в молодых взрослых трансгенные мыши мозга ломтиками и зрелого взрослого мозг человека нейрохирургических ломтиками. Следующий протокол был утвержден для мышей от 21 дней до более чем одного года, а также для человека нейрохирургических образцов, полученных от взрослых пациентов.
Protocol
Процедуры с участием трансгенных мышей были одобрены институциональный уход животных и использование Комитет (IACUC) в институте Аллен мозга науки. В этих экспериментах использовались мышей C57BL/6 мужчин и женщин (весовой диапазон 10-30 г). Некоторые из результатов, представитель описывают данные, собранные из кусочков жизни человеческого мозга. Кортикальное ткани образцы были получены при нейрохирургических операций для удаления опухоли. Было необходимо удалить вышележащих кортикальное ткани, чтобы получить доступ к пораженной ткани. Информированного согласия пациента был получен во всех случаях использования нейрохирургических ткани для исследовательских целей под протоколом, утвержденным институциональных Наблюдательный Совет шведского медицинского центра.
1. подготовка средств массовой информации и реагентов (таблица 1)
Примечание: Решения должны состоять в очищенной воде, которая свободна микроконцентрации металлов и других примесей. Рекомендуется сделать свежие решения в день эксперимента, хотя неиспользованные растворы можно хранить при 4 ° C на срок до 1 недели, при желании. 1 Л каждый выше формулировка достаточна для нарезки процедуры 1-2. Все фаго решения должны насыщенный Карбоген (95% O2/5% CO2) перед использованием для обеспечения стабильного рН буферизации и адекватной оксигенации. PH всех решений следует скорректировать до 7,3-7.4 и осмотического давления измеряется и приспособлены к 300-310 mOsmol/кг.
- Подготовить фаго NMDG-HEPES (в мм): 92 NMDG, 2,5 KCl, 1,25 NaH2PO4, 30 NaHCO3, 20 HEPES, 25 глюкозы, 2 тиомочевины, 5 Na аскорбат, 3 Na пируват, 0.5 CaCl2·2H2O и 10 MgSO4·7H2O. Titrate pH 7,3 –7.4 с 17 мл + /-0,5 мл 5 М соляной кислоты.
Примечание: Этот шаг титрования должны идеально производиться перед добавлением двухвалентной катионов, чтобы избежать осадки; Однако высыпание может быть отменено после регулировки рН физиологической диапазон. - Подготовка HEPES Холдинг Фаго (в мм): 92 NaCl, 2,5 KCl, 1,25 NaH2PO4, 30 NaHCO3, 20 HEPES, 25 глюкозы, 2 тиомочевины, 5 Na аскорбат, 3 Na пируват, 2 CaCl2·2H2O и 2 MgSO4·7H2O. Titrate pH 7,3 – 7,4 с несколькими каплями сосредоточено 10 N NaOH.
- Подготовка записи Фаго (в мм): 124 NaCl, 2,5 KCl, 1,25 NaH2PO4, 24 NaHCO3, 12,5 глюкозы, 5 HEPES, 2 CaCl2·2H2O и 2 MgSO4·7H2O. Titrate pH 7,3-7.4 с несколько капель в основном 10 N NaOH.
- Приготовляют Na+ Спайк в раствор (2 М): 580 мг NaCl растворяют в 5 мл свежеприготовленные фаго NMDG-HEPES. Это достаточно решение для одного мозга ломтик prep.
- Готовить 2% агарозном использоваться для врезать ткани. Растворите 2 g агарозы Тип 1B (см. Таблицу материалы) в 100 мл 1 x PBS и микроволновая печь до просто кипения. Вихрем перемешать, а затем вылейте смесь в Петри стерильные 10 см и позволяют укрепить. Храните пластину агарозы в запечатанный пластиковый пакет на 4 ° C до использования.
- Подготовьте инъекционные анестетики, работает Стоковый раствор. Смешайте 2,5 g 2,2,2-Tribromoethanol с 5 мл 2-метил-2-бутанола и затем постепенно растворить в 200 мл PBS, pH 7.0 – 7,3. Фильтр Стоковый раствор с 0,22 мкм фильтром перед использованием и хранить при 4 ° C, защищать от света.
Примечание: Консультации соответствующих животных использования Комитетом руководящие принципы и правила для определения истечения и удаления процедура работает Стоковый раствор анестетика.
2. Установка режущей станции
- Настройка станции нарезки с машина резки ткани и хирургических инструментов (см. Таблицу материалы). Для калибровки машина резки, придают лезвием керамической форсунки цирконий лезвия руку, используя быстрый клей клей, а затем вставьте держатель образца и выровнять передний край лезвия к ОПРАВЕ держатель образца, оставляя крошечный разрыв, чтобы убедиться, что лезвие не царапать металла.
Примечание: Если край лезвия не поврежден физически он может быть повторно использован для многих недель или даже месяцев без замены. Коммерчески доступны различные модели срез ткани, многие из которых может обеспечить отличную производительность при оптимально откалиброван. Идеальный инструмент должен иметь минимальный z-axis прогиб, либо непосредственно измеряется и настроены или эмпирически наблюдается. - Настройка 250 мл стакан, наполненный 200 мл NMDG-HEPES фаго и предварительно холод на льду с постоянным carbogenation (применяется через диффузор газ камень погружен в СМИ) для > 10 мин.
Примечание: Это решение будет использоваться для transcardial перфузии и для заполнения режущей машины водохранилище при резании. - Настройка первоначального мозга ломтик восстановления камеры заполнены с 150 мл NMDG-HEPES Фаго (поддерживать постоянной carbogenation) и палата в ванну с подогретой водой, поддерживается на 32-34 ° C.
Примечание: Ломтик камере после дизайн Эдвардс и Konnerth (1992)52 рекомендуется для этого шага. Эти камеры могут быть сделаны с легко доступных лабораторных предметов (стакан 250 мл, нейлоновая сетка рабица, 50 мл Конические трубки, пластиковых круглых блюдо 35 мм). Должны позаботиться о том, чтобы обеспечить, что срез, сетка остается свободным воздуха пузыри, особенно тех, кто постоянно производимые Карбоген газового пузыря камни, поскольку они могут вызвать фрагментов плавать вверх и повреждены. Сетки должны быть погружены в воду примерно 1 см под поверхностью жидкости. - Настройка ломтиком мозга, держа камеру; дизайн с несколькими независимыми скважин в крупных водохранилища рекомендуется (см. Таблицу материалы). Заполните резервуар с 450 мл HEPES фаго и теплой комнатной температуре под постоянным carbogenation до использования.
Примечание: Срезы мозга будут переданы из камеры для первоначального восстановления этой камеры для длительного хранения до электрофизиологических записи. Необходимо обеспечить, что срез сетка остается свободным пузырьков воздуха во все времена. - Подготовьте расплавленного агарозы для врезать ткани. Используйте открытый конец конические флакон 50 мл как печенья в вырезал блок 2% агарозном от ранее приготовленное блюдо. Слабо шапочка коническая флакона, а затем микроволновой печи в течение 10 – 30 с до агарозы просто растаял. Не перегревается.
- Налейте 1.5 мл пробирок расплавленным агарозы. Поддерживать агарозы в расплавленном состоянии с помощью thermomixer, установить до 42 ° C с энергичной встряхивания. Тщательно убедитесь, что расплавленный агарозы не затвердеть преждевременно.
- Место аксессуар охлаждения блока для резки на льду для предварительного охлаждения на данный момент.
3. Transcardial перфузии
Примечание: Процедура transcardial перфузии является важным шагом, при работе с взрослых животных и имеет важное значение для достижения быстрого охлаждения мозга и замедляется метаболизм через мозг вливания низкой Na+, низким уровнем Ca2 +/ высокая мг2 + фаго решение. Transcardial перфузии также служит для очистки красные кровяные клетки от мозга сосудистую, который уменьшает аутофлюоресценция, которые могут препятствовать визуализации и ориентации дневно обозначенные клеточных популяций в трансгенных линий. Это не целесообразно опустить transcardial перфузии.
- Глубоко анестезировать мышей внутрибрюшинной инъекцией анестезии рабочие Стоковый раствор (250 мг / кг: 0.2 мл 1,25% обезболивающий работает Стоковый раствор на 10 г массы тела, см. Таблицу материалов). После ~ 2-3 мин, проверьте достаточной глубины анестезии путем оценки мыс щепотку рефлекс. Если требуется, придать дополнительный объем запасов анестезии рабочие и переоценку мыс щепотку рефлекс после еще 2-3 мин.
- Загрузите 30 мл шприц с 25 мл carbogenated NMDG-HEPES фаго из предварительно охлажденные 250 мл стакан (2 – 4 ° C является оптимальным, в отличие от решения сентиментальный или замороженные). Прикрепите 25 5/8 иглы.
- С помощью мыши на его спине Сцепляющий вниз передних лапах и задние лапы для стабильности. 15 см стекло Петри заполнены с закаленной силиконовые работает также как база.
- С помощью скальпеля, сделайте боковой разрез открыть грудной полости на уровне диафрагмы. Используйте тонкой ножницы, чтобы вырезать через грудную клетку на обе стороны позаботиться чтобы избежать отсечения сердца и легких.
- Штифт обратно центральную часть грудной клетки подвергать сердце. Вставьте иглу шприца 30 мл в левый желудочек и вырезать правое предсердие с тонкой ножницы, чтобы позволить крови для выхода из сердца.
- Надавите на поршень шприца, используя ручной постоянное давление и perfuse животное с охлажденной фаго NMDG-HEPES со скоростью ~ 10 мл/мин.
Примечание: Если перфузии является успешным печени будет меняться в цвет от темно-красного до бледно-желтого и в некоторых случаях ясно, что жидкости может наблюдаться выход ноздри в конце процедуры.
4. мозг диссекции и нарезки
- Обезглавить животного. Для открытия кожу на голове и разоблачить тюбетейке используйте скальпель.
- Использование тонкой супер-вырезать ножницами срезаем кожу над тюбетейке и сделать небольшие разрезы боково на обе стороны в хвостовой/вентральный основания черепа. Сделайте дополнительные неглубокие порезы, начиная хвостового/спинной части черепа, в ростральной направлении вверх спинной срединной линии, стараясь не повредить основные мозга. Сделать окончательный 'T' сократить перпендикулярно к средней линии на уровне обонятельных луковиц.
Примечание: Необходимо будет позаботиться чтобы убедиться, что никаких повреждений делается для мозга регион(ы) интерес. В частности не должно быть каких-либо сжимающей силы, приложенной к самого мозга. - Используйте корнцанг раунд наконечник понять черепа, начиная с ростральной медиальной аспект и пил обратно в направлении хвостового боковое. Повторите эти действия для обеих сторон взломать открыть и удалить спинной половинки тюбетейке подвергать мозга. Аккуратно вырезать нетронутыми мозга в стакан предварительно охлажденные фаго NMDG-HEPES. Разрешить мозга равномерно охладить ~ 1 мин.
- Используйте большой шпателем снять мозг из стакан и на Петри блюдо, покрытые фильтровальной бумаги. Обрезка и блокировать мозга согласно предпочтительным угол резки и желаемого мозг региона интерес. Работайте быстро, чтобы избежать длительного кислородного голодания во время обработки.
Примечание: Многие нарезки углы возможны. Точное блокирующий метод и нарезки угол будет зависеть от точного мозга региона, типа клеток и цепи необходимо изучить. - Прикрепите блок мозга для держателя образца, используя клей клей. Убрать внутреннюю часть держателя образца, достаточно снять полностью внутри блока мозга. Залейте расплавленный агарозы прямо в держатель до тех пор, пока блок мозг полностью покрыта агарозы. Зажим предварительно охлажденным аксессуар охлаждения блока вокруг держатель образца для ~ 10 s до тех пор, пока затвердевшим агарозы.
- Вставьте держатель образца в сосуд на машина резки и проверьте правильное выравнивание. Заполните резервуар с оставшихся предварительно охлажденных, кислородом фаго NMDG-HEPES от 250 мл стакан и переместить камень пузыря в водохранилище на время нарезки для обеспечения адекватной оксигенации.
- Отрегулируйте микрометра начать продвижение агарозы встроенный мозга образца. Начать с Тесак и эмпирически настройки заранее скорость и колебания частоты до желаемого уровня.
Примечание: Оба параметры должны быть в нижнем диапазоне. Для достижения наилучших результатов один пройти руки лезвия следует принять около 20 s и колебаний следует производить очень гладкая и нежная жужжащий шум с без явной жужжание. - Продолжать продвижение и нарезки ткани в 300 мкм с шагом (или другим предпочтительным толщина) до мозга регионе интереса полностью секционного; Общее время для нарезки процедуры должно быть менее чем за 15 мин.
5. Оптимизированная процедура восстановления защитных NMDG
- Первоначальный этап восстановления NMDG (критический шаг): после завершения процедуры резания, собрать все фрагменты, используя пластиковые трубы t Пастер отсечения и передавать их в камеру первоначального восстановления подогретым (34 ° C), заполнены с 150 мл NMDG-HEPES фаго. Передача всех фрагментов в короткие последовательности и запустить таймер, как только все срезы смещены в камеру восстановления.
- Обратитесь к таблице 2 для определения оптимального Na+ Спайк в расписание, согласно возраста мыши.
Примечание: Эта процедура является практический метод для достижения руемой скорости реинтродукции Na+ в зале срез мозга и оптимизирована для конкретных мозга ломтик объем геометрии и водохранилище камеры и тип (см. Таблицу материалы). - Проведения поэтапного Na+ Спайк в процедуры, добавив указанные объемы Na+ Спайк в решения в указанных раз. Na+ Спайк в решение можно Добавьте непосредственно в трубу барботер первоначального восстановления камеры для облегчения быстрого смешивания.
- Передать все срезы HEPES фаго долгосрочный холдинг камеры поддерживается при комнатной температуре. Разрешить фрагментов восстановить еще 1 ч в HEPES, держа камеру перед запуском патча зажим записи экспериментов.
6. патч зажим запись
Примечание: Следующие основные процедуры просто предоставляют некоторые практические соображения и не предназначены для представления подробных протоколов для патч зажим записи, как они могут быть найдены в других местах53,54. Для этого приложения требуется патч зажим электрофизиологии Рог. Это правило будет состоять из вертикально микроскопа, оснащены инфракрасной дифференциальной помехи контраст (IR-DIC) Оптика и освещение флюоресценции, патч зажим усилителя и данных дигитайзера, моторизованные микроманипулятор и Микроскоп платформа, вибрационный стол изоляции, клетки Фарадея и решения системы отопления и перфузии. Пример камеры и платформы должны разрабатываться для погружных фрагмента записи. Для записи патч мульти нейрон зажим буровой установки с несколькими усилители, головы этапов и высокое качество микроманипуляторов не требуется. Кроме того, для достижения наилучших результатов, буровой установки оснащены 900 нм ИК фильтр группы и соответствующие компоненты Оптические настоятельно рекомендуется для обеспечения адекватной визуализации ячеек, расположенных > 50 мкм в глубине мозга ломтиками. Правильное выравнивание для Kӧhler освещения также имеет важное значение для четкой визуализации.
- Приготовляют раствор внутриклеточных пипетки (в мм): 130 K-глюконат, 4 KCl, 0,3 EGTA, 10 HEPES, 10 Креатинфосфорная кислота Na2, 4 MgATP, 0.3 Na2-GTP и 13.4 biocytin. Отрегулируйте pH до 7,35 с 1 M Кох и осмотического давления до 285 – 290 mOsmol/кг, используя сахарозу как требуется.
- Подготовить патч зажим электроды из толстостенной боросиликатного стекла капилляров; идеальный патч зажим электрода имеет относительно короткий и короткими конусом с ~ 3 – 6 МОМ заполнены совет сопротивления в ванне.
- Убедитесь, что Серебряный электрод провода правильно chlorided, с тем чтобы обеспечить стабильные записей. Сделать это (типичный), погрузив последние 3-4 мм серебра проволоки по в жидкий отбеливатель для примерно 30 минут или до тех пор, пока проволока темнеет.
- Создать решение перфузии, с использованием перистальтического насоса, равным 3 – 4 мл/мин Circulate carbogenated запись фаго через запись камеры, заботясь, чтобы соответствовать приток и отток, чтобы избежать переполнения.
- Передача одного мозга ломтик в камеру записи погружения и обеспечить на месте с помощью срез, U-образный якорь с нейлоном крест строк. Определение целевого региона мозга с помощью 4 X воздушные цели перед переходом к более высокой мощности цели (например, высокая числовая апертура 40 X или 60 X целей погружения воды).
- Визуально Определите здорового целевую ячейку. Появление нейрональных мембран на сома, как визуализированное ИК-DIC микроскопии, используется чтобы судить о пригодности ячейку кандидата для записи зажим патч.
Примечание: Здоровый нейроны обычно демонстрируют следующие возможности: усохшие ни опухшие, somata, мягкий контраст мембраны краями и гладкой мембраны внешний вид. Кроме того, большинство здоровых клеток расположены > 30 мкм глубоко в разрезе, как поверхностный нейроны могут быть повреждены с разорвала дендритных процессы. Следует избегать нейронов, которые демонстрируют гофрированные внешний вид, четко видны ядер или «жареные яйца» внешний вид или очень темные или высокий контраст мембраны края. - Обратно заполните патч Пипетка с ~ 5 мкл внутриклеточных решения и загрузить его на держатель электрода. Переместите пипетку в записи ванна выше срез мозга и применять легкие положительным давлением, чтобы очистить любые препятствия в кончик. Нулевое смещение пипетки и контролировать сопротивление кончик, используя функцию мембраны тест.
- Извлекайте наконечник пипетки контакт с целевой Нейрон тела клетки; небольшая ямка должны образовывать на поверхности мембраны из-за света положительным давлением.
- Как только наблюдается мембраны Ямочка, быстро удалить положительным давлением и применять нежные всасывания для облегчения формирования уплотнения. После пипеткой сопротивление увеличивается для > 100 МОМ, включите Холдинг команды до уровня, который соответствует ожидаемым покоя мембраны потенциал для тип целевой ячейки (-70 mV является хорошей отправной точкой).
- После того, как кончик сопротивления достигает ≥1 gigaohm, пытаются разбить ячейку путем разрыва мембраны под пипеткой патч с помощью краткого приступы резкого всасывания; Функция «зап» могут быть использованы для облегчения взлома, при необходимости.
Примечание: Проведение потенциал -70 mV предлагается для напряжения зажим экспериментов на корковых нейронов. Здоровые нейронов будет иметь текущий утечки не более негативным, чем-100 ПА в течение всего эксперимента, но это отчасти зависит от типа ячейки. Нейрон будут исключены из анализа если мембранный потенциал покоя было более деполяризованный чем -50 МВ, или изменении сопротивления доступ более чем на 20%. -
После получения стабильной поклеточного патч зажим запись целевой дополнительные нейронов для записи, повторив шаги 6.6-6.10. Позаботьтесь, чтобы избежать механического беспорядков, что приведет к потере первая запись.
- Выберите дополнительные нейронов в пределах 100 мкм первый нейрон обеспечить разумную вероятность нахождения синаптически сочетании нейронов.
Примечание: Это может быть полезно в некоторых случаях для идентификации нескольких кандидат нейронов фронт и предварительной загрузки и предварительно позиции все пипетки поблизости в различные целевые клетки до создания первой записи зажим патч.
- Выберите дополнительные нейронов в пределах 100 мкм первый нейрон обеспечить разумную вероятность нахождения синаптически сочетании нейронов.
Representative Results
Этот раздел предоставляет представителя результаты для подготовки ломтик повседневной мозга и патч зажим электрофизиологии эксперименты с использованием оптимизированных NMDG защитные метод восстановления (то есть, NMDG защитные восстановления в сочетании с постепенным Na+ Спайк-процедура). Во-первых, морфологические сохранение нейронов оценивалась в различных регионах мозга мозга ломтиками, подготовленные с или без реализации метода оптимизированный NMDG защитные восстановления (рис. 1). Три месяца взрослых мышей были отобраны для этих экспериментов, и мы использовали ИК-DIC микроскопии для определения здоровья нейрон, основанный на форму и общий вид somata и проксимальной дендритов. Обратите внимание, сморщенные, pyknotic появление большинства нейронов в представительных изображения срезов мозга, подготовлен без защитного восстановления метод (все изображения были получены 1-2 ч после подготовки фрагмента). Эти фрагменты контроля были подготовлены с использованием фаго NMDG для transcardial перфузии и нарезки шаги, но первоначально были найдены в высокой Na+-содержащих фаго HEPES. В противоположность этому представитель изображений из фрагментов, подготовлен с использованием метода защитные восстановления оптимизированный NMDG выявить нейронов с улучшение морфологии (гладкой, полнее, менее гофрированные внешний вид), которые подходят для фиксации записи (Рисунок 1). было отмечено улучшение нейрональных сохранение в нескольких регионах мозга включая кортикальное слои II/III и V, subiculum и спинной латеральное коленчатое (dLGN).
Далее оптимизированный метод защитные восстановления NMDG был по сравнению с оригинальной NMDG защитные метод восстановления (то есть, без постепенного Na+ Спайк-процедуре). Резко и существенно сократить среднее время формирования gigaohm уплотнение в фиксации записи попыток (9,9 s против 33,3 s, **p < 0,005, парных t-тест) когда постепенно Na+ Спайк в процедура была применена Вместе с NMDG защитные восстановления шаг (рис. 2). Быстрее и надежнее мембраны, герметизация раз значительно улучшить пропускную способность фиксации записи в молодых взрослых мозга ломтиками. Оптимальное Na+ Спайк в график далее была изменена согласно возрасту животных (Таблица 2) и был полезным для людей всех возрастов, испытания (3 недели до 1 года старых мышей). Профиль постепенного натрия Ион концентрации высоты на протяжении процедуры Спайк в предоставляется (рис. 3), чтобы сопровождать расписания, показано в таблице 2.
В рамках программы типы клеток института Аллен (http://celltypes.brain-map.org/) крупномасштабных усилий ведется систематически характеризуют электрофизиологических свойств отдельных нейронов в молодых взрослых (послеродовой день 40-80) ломтики визуального коры мозга мыши производный от трансгенных линий с выражением флуоресцентные метки определенного типа клеток в генетически определена нейрональных популяций (коркового слоя и тип клеток, конкретные КРР драйвер линии пересекли Cre зависимых люминесцентные Репортер линии55). На рисунке 4 показан пример следы стрельбы шаблонов, записанные с Парвальбумин (Pvalb)-выражая корковых интернейронов быстро пики (FS) (Pvalb-IRES-Cre/Ai14 мышей) в ответ на ряд 1 s текущего инъекции шагов, которые охватывают весь динамический диапазон Нейрон стрельбы. F-кривой, для набора 22 корковых FS интернейронов это показано на рисунке справа. Аналогичные целевые патч зажим записи были эксперименты характеризовать 23 Rorb выражая возбуждающих нейронов в слое IV от Rorb-IRES-Cre/Ai14 мышей (рис. 4). Регулярно и надежно разнообразные здоровые нейрон типов, включая FS интернейронов и пирамидальных нейронов коркового регионов и слоев можно использовать для фиксации записи для по крайней мере 6-8 ч после подготовки фрагмента, используя это оптимизированный протокол.
Помимо измерения внутренние свойства нейронов, был исследован синаптической связи между несколькими одновременно зарегистрированных нейронов определенных типов в визуальные корковых микросхемы. Мульти нейрон фиксации записи технику исключительно требует, как многочисленные здоровые кандидат нейронов определенных типов должны присутствовать в относительно небольшом поле срез мозга для того чтобы обеспечить разумный шанс получения высокого качества Одновременная запись и выявления bona fide синаптических связей. Рисунок 5 показывает парные записи двух tdTomato + FS интернейронов в зрительной коре мозга фрагментов, полученных от молодых взрослых мышах Pvalb-IRES-Cre/Ai14. Однонаправленный ингибирующее синаптической связи был обнаружен (записанный с высоким содержанием хлоридов внутренней пипеткой раствор). Представлен пример записи и протоколы для измерения свойств краткосрочных синаптической пластичности. Приступы высокой частоты поезд стимуляции (10 импульсов каждой в 10, 50 и 100 Гц) последовали один восстановления испытательных импульсов на различных временных интервалах (1, 2 или 4 s) для измерения времени курс восстановления синаптических депрессии.
Отличные успехи также были получены для человека кортикальное нейронов в зрелых взрослых ex vivo срезы мозга. Нейрохирургические образцы получены от пациентов, перенесших запланированные операции для удаления опухоли в местных больницах. Процедуры сбора и мозг подготовки нейрохирургических тканей человека ломтик отличаются от процедур срез мозга мыши в нескольких практических путей. В краткой, резецированный кортикальное ткани (дистальной на сайт патологии) собираются из операционной комнате и погружается в ледяной кислородом фаго NMDG-HEPES и перевозятся с непрерывное охлаждение и оксигенация из операционной комнате для Лаборатория в течение 30 минут или меньше. Срезы мозга готовятся с использованием процедуры восстановления защитных NMDG и позволено восстановить на длительное время около 3 ч до начала записи зажим патч. На рисунке 6 показан успешный паре записи эксперимент и зажим записи эксперимент успешным четырехместные патч от человека ex vivo срезы мозга подготовлен таким образом от лобной коры региона. Парные запись демонстрирует однонаправленный возбуждающим синаптических ввода от корковых Пирамидальный нейрон на корковых межнейронного (записан как возбуждающих постсинаптических токов). В четырехъядерных патч эксперимента два возбуждающих и два ингибирующих нейронов были записаны одновременно, и три ингибирующее синаптических связей были обнаружены (записан как тормозящий постсинаптических потенциалов) из двенадцати всего соединений исследован. Таким образом эта методология срез оптимизированный мозга позволяет надежные экспериментальные успеха в самых сложных мозга фрагмент приложения, включая мульти нейрон патч зажим экспериментов для изучения схемы подключения в остро резецированный зрелого взрослого человеческого мозга ткани.
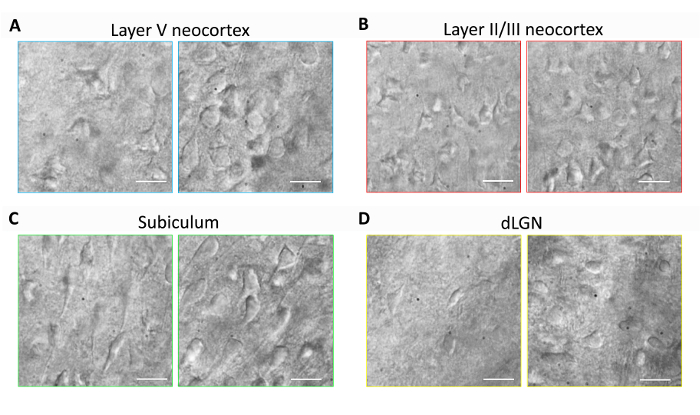
Рисунок 1: Улучшена нейрональных сохранения с оптимизированный метод защитные восстановления NMDG срез мозга подготовки. Представитель ИК-DIC изображения были приобретены из разнообразных мозга регионов в острых фрагментов из три месяца мыши. Управление NMDG защитные резки метод без защитного восстановления шаг (левой панели) по сравнению с оптимизированный метод NMDG защитные восстановления (правой панели). (A) слой V из коры головного мозга, (B) Layer II/III коры головного мозга, subiculum (C) и (D) спинной латеральное коленчатое (dLGN). Масштаб гистограммы в всех панелей являются 20 мкм. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
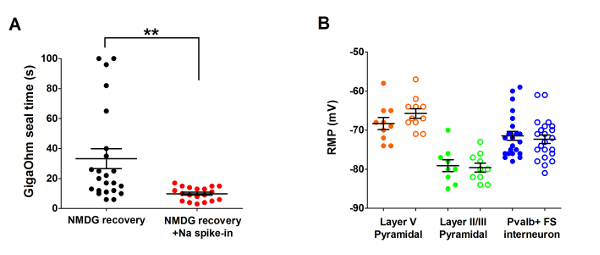
Рисунок 2: Ускорение скорости и повышения надежности gigaohm уплотнение формирования в фиксации записи экспериментов с использованием метода восстановления защитных NMDG Na+ Спайк в процедуре. (A) участок gigaohm уплотнение формирования раз для NMDG восстановления только (черные точки данных, n = 19) по сравнению с NMDG восстановления плюс Na+ Спайк в процедуре (красный данных точек, n = 23). Все записанные клетки были пирамидных нейронов слоя II/III и V зрительной коры. Обратите внимание, что максимальное время ограничен 100 s для учета клетки, которые никогда не образуются gigaohm тюленей. Паре t-теста, **p < 0,005. (B) участок отдыха мембранного потенциала (РМП) для пирамидных нейронов слоя V (оранжевый данных точек, n = 10/11), пирамидальные нейроны II/III (зеленые точки данных, n = 9/10), или корковые Pvalb + FS интернейронов (синий точек данных, n = 23/22). Закрашенные круги обозначают NMDG восстановления состояния и открыть круги NMDG восстановления плюс Na+ Спайк в процедуре. Каждая точка данных представляет один нейрон и оба средняя и + / SEM отображаются. Существует никаких существенных различий в ПРХ, сравнивая условия подготовки срез мозга для всех трех ячеек типа (паре t-тест). Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
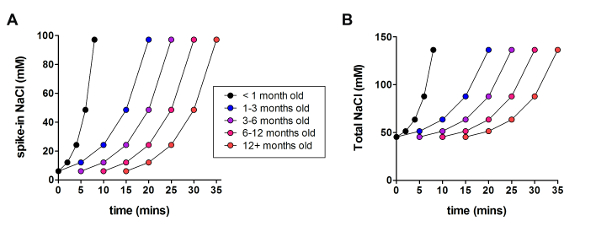
Рисунок 3 : Профиль постепенного натрия ионной концентрации возвышения на протяжении процедуры Спайк в. (A) участок Спайк в концентрации NaCl против времени. (B) участок всего внеклеточной концентрации NaCl против времени. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
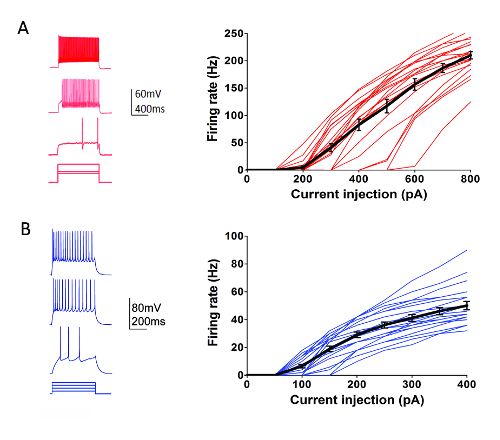
Рисунок 4 : Электрофизиологических свойств типов генетически определена корковых клеток. (A) пример следы нейронов стрельбы в ответ на текущие инъекции шаги для Pvalb + корковых FS интернейронов (левая панель). tdTomato + нейронов предназначались для записей в срезах головного мозга от Pvalb-IRES-Cre/Ai14 мышей. Сводные данные для стрельбы текущий курс инъекций отношения (F-я кривой) показано на рисунке справа (n = 22). (B) пример следы нейронов стрельбы в ответ на текущие инъекции шаги для Rorb выражая коркового слоя IV возбуждающих нейронов (левая панель). tdTomato + нейронов предназначались для записей в срезах головного мозга от Rorb-IRES-Cre/Ai14 мышей. Сводные данные для стрельбы текущий курс инъекций отношения (F-я кривой) показано на рисунке справа (n = 23). Каждая тонкая цветная линия представляет F-кривой, для одного нейрона; в то время как толстые черные линии представляет среднее значение для каждой группы + / SEM. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
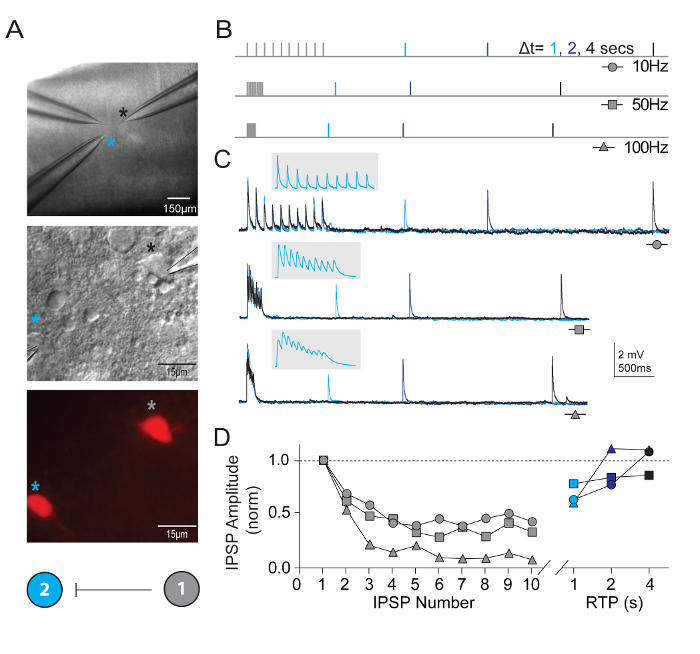
Рисунок 5: Краткосрочные пластичности в синаптически связи Pvalb выражая корковых FS интернейронов. (A) дифференциальной помехи контраст и эпифлуоресцентного были использованы для tdTomato позитивных, выражая Pvalb FS интернейронов из первичной зрительной коры мыши. Цветом схемы схема подключения, демонстрируя одностороннее синаптической связи между двумя интернейронов. (B) схема стимуляции протоколов, используемых для оценки краткосрочных динамика синаптически связанных нейронов. Поезда 10 потенциалы действия (10, 50 и 100 Гц) вызывали в Пресинаптический нейрон, следуют один потенциал действия (восстановления тестовый импульс, RTP) поставляется с различными время задержки (1, 2 и 4 s) после завершения поезд. Каждый RTP являются цветом для ясности. (C) средняя следы соответствующего одностороннего ингибирующее пост синаптических потенциалов (uIPSPs) в ячейке #2 в ответ на поезда потенциалы действия вызывали в ячейке #1. Серый врезные расширил масштаб времени, чтобы показать разграничения uIPSP поезда. (D) нормированный uIPSP амплитуд выводятся как функция их положение во время поезда на различных частотах. NET депрессия это ясный через все входные цены с существенного восстановления uIPSP в 4 s. пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
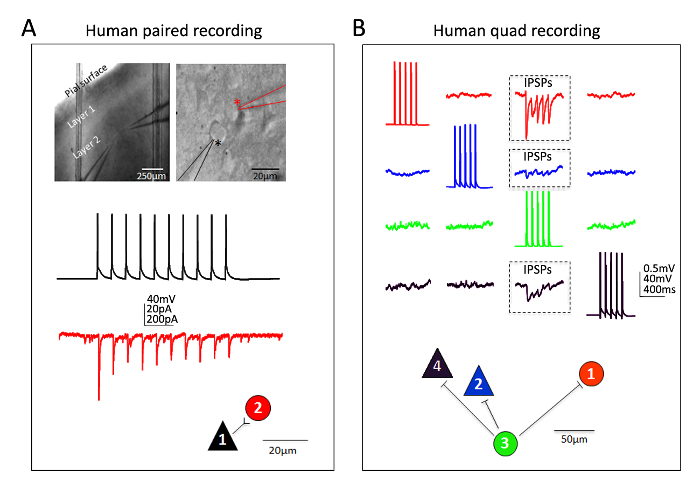
Рисунок 6: Патч мульти нейрон зажим записи в взрослого человека нейрохирургических мозг ломтиками. (A) низкого и высокого увеличения ИК-DIC изображений указанием местоположения и идентичность записанных нейронов (верхней панели). Пирамидальный нейрон (черный звездочка) и межнейронного соседних (красная звездочка) были записаны одновременно. Пример цвет кодированная следы однонаправленный возбуждающим синаптической связи (УНПЦ) от пирамидальной клетке (измеряется как EPSCs в мембраной) межнейронного и соответствующего физического подключения карты (нижней панели). (B) Двухместный патч зажим записи эксперимент в разрезе взрослого мозга человека нейрохирургических Дорсолатеральное префронтальной коры. Два пирамидных нейронов и два интернейронов записываются одновременно, позволяя для последовательного зондировать двенадцати возможных синаптических связей. Поезд вызванные потенциалы действия в ячейке #3 (зеленый следы) привели к обнаружения ингибирующее пост синаптических потенциалов (IPSPs) в каждом из трех других одновременно зарегистрированных нейронов (трех регионов в штучной упаковке, верхней панели). Эти ответы, записанные с каждой индивидуальной нейрон являются цветом для ясности. Физическое подключение карта отображается в нижней панели. Обратите внимание, что сырье следов, показано в пункте (B) представляют собой средние по меньшей мере 20 последовательных необработанных данных зачисток. Предполагаемый идентификации типа ячейки был основан на сома форму, анализ морфологии, флуоресцентные краски, заполнение во время записи и внутренние электрофизиологических свойств, включая обжиг шаблоны в ответ на текущие инъекции шаги. Пожалуйста, нажмите здесь, чтобы посмотреть большую версию этой фигуры.
| NMDG-HEPES фаго | HEPES Холдинг фаго | Запись фаго | |||||||
| Компонент | Мм | МВТ | g/литр | Мм | МВТ | g/литр | Мм | МВТ | g/литр |
| NMDG | 92 | 195.22 | 17,96 | ||||||
| HCl | 92 | 36.46 | * | ||||||
| NaCl | 92 | 58,44 | 5.38 | 124 | 58,44 | 7.25 | |||
| KCl | 2.5 | 74.55 | 0.19 | 2.5 | 74.55 | 0.19 | 2.5 | 74.55 | 0.19 |
| NaH2PO4 | 1.2 | 138,00 | 0.17 | 1.2 | 138,00 | 0.17 | 1.2 | 138,00 | 0.17 |
| NaHCO3 | 30 | 84.01 | 2.52 | 30 | 84.01 | 2.52 | 24 | 84.01 | 2.02 |
| HEPES | 20 | 238.31 | 4.77 | 20 | 238.31 | 4.77 | 5 | 238.31 | 1.19 |
| Глюкоза | 25 | 180.20 | 4.51 | 25 | 180.20 | 4.51 | 12.5 | 180.20 | 2.25 |
| Аскорбат натрия | 5 | 198.00 | 0.99 | 5 | 198.00 | 0.99 | 0 | 198.00 | 0.00 |
| Тиомочевина | 2 | 76.12 | 0,15 | 2 | 76.12 | 0,15 | 0 | 76.12 | 0.00 |
| пируват натрия | 3 | 110.04 | 0,33 | 3 | 110.04 | 0,33 | 0 | 110.04 | 0.00 |
| MgSO4.7H2O | 10 | 246.48 | 5 мл | 2 | 246.48 | 1 мл | 2 | 246.48 | 1 мл (2M акций) |
| CaCl2.2H O2 | 0.5 | 147.01 | 0,25 мл | 2 | 147.01 | 1 мл | 2 | 147.01 | 1 мл (2M акций) |
| * Титруйте pH фаго NMDG-HEPES до 7,3-7.4 с использованием концентрированной HCl | |||||||||
| Все решения должны быть в диапазоне 300-310 мОсм/кг | |||||||||
Таблица 1: СМИ формулировки.
| Возраст животных | |||||
| Время (мин) * | < 1 месяц | 1-3 месяца | 3–6 месяцев | 6–12 месяцев | 12 месяцев |
| 0 | 250 МКЛ | 250 МКЛ | |||
| 1 | |||||
| 2 | 250 МКЛ | ||||
| 3 | |||||
| 4 | 500 МКЛ | ||||
| 5 | 250 МКЛ | 250 МКЛ | |||
| 6 | 1000 МКЛ | ||||
| 7 | |||||
| 8 | 2000 МКЛ | ||||
| 9 | |||||
| 10 | передача | 500 МКЛ | 250 МКЛ | 250 МКЛ | |
| 11 | |||||
| 12 | |||||
| 13 | |||||
| 14 | |||||
| 15 | 1000 МКЛ | 500 МКЛ | 250 МКЛ | 250 МКЛ | |
| 16 | |||||
| 17 | |||||
| 18 | |||||
| 19 | |||||
| 20 | 2000 МКЛ | 1000 МКЛ | 500 МКЛ | 250 МКЛ | |
| 21 | |||||
| 22 | |||||
| 23 | |||||
| 24 | |||||
| 25 | передача | 2000 МКЛ | 1000 МКЛ | 500 МКЛ | |
| 26 | |||||
| 27 | |||||
| 28 | |||||
| 29 | |||||
| 30 | передача | 2000 МКЛ | 1000 МКЛ | ||
| 31 | |||||
| 32 | |||||
| 33 | |||||
| 34 | |||||
| 35 | передача | 2000 МКЛ | |||
| 36 | |||||
| 37 | |||||
| 38 | |||||
| 39 | |||||
| 40 | передача | ||||
| * Время ноль является момент фрагменты передаются в камеру первоначального восстановления | |||||
Таблица 2: Рекомендуемый график постепенного Na + Спайк в процедуре по возрасту мыши.
Discussion
Na + Спайк - улучшает уплотнение Gigaohm формирования и фиксации записи успех
Первоначальный вариант метода NMDG защитные восстановления был специально разработан для взрослых и старение животных2,5. Некоторые ранние также стремились применять эту методологию для несовершеннолетних животных мозг нарезки (то есть, мышей < 30 дней). Однако было отмечено, что в отличие от выдающиеся визуально подтвердила нейронов сохранение с помощью метода NMDG защитные восстановления этой возрастной, формирование gigaohm уплотнение может часто стойло, приводит к Сбой фиксации записи попыток. Одна из гипотез является что NMDG катионов большей готовностью попали в ломтики несовершеннолетних мозга относительно взрослого мозга ломтиками и может препятствовать печать формирования; Однако gigaohm уплотнения легко могут образовываться в то время как фрагменты несовершеннолетних мозг полностью погруженной в NMDG Фаго (данные не показаны), таким образом указывает что NMDG фаго само по себе не препятствует gigaohm уплотнение формирования.
Быстрый переход от низкой к высокой Na+ решения в связи с завершением этапа восстановления первоначального мозга ломтик наносит ущерб нейрональных мембран и возмущает процесс формирования печать. Это интуитивно, учитывая, что переход от низкой к высокой Na+, холодной и теплой температуры и резкое повышение Ca2 + Mg2 + соотношение коллективно приводят к массовым возрождение спонтанной синаптической активности. Этот этап ингибирующее отскок в головном мозге, нарезка процедура скорее всего зеркало реперфузионных повреждений после ишемического инсульта. Таким образом для дальнейшего смягчения ущерба нейрональных мембран на этапе первоначального восстановления, постепенно Na+ Спайк-процедура была включена в котором повышение концентрации Na+ в зале NMDG защитные восстановления инкубации это медленно и можно воспроизвести повышенных с точные сроки. Как и оригинальные защитные восстановления процедуры выгодно височной диссоциации Na+ высота от температуры и Ca2 +/Mg2 + соотношение высоты. Но Кроме того, Na+ Спайк в процедура приводит к небольшой прирост в внеклеточной концентрации Na+ более ранние моменты времени и увеличений к конце моменты времени, тем самым предоставляя ткани мозга возможность для лучшего размещения для повышения уровня Na+ . Эта процедура является альтернативой постепенное решение Обмен контролируется перфузионного насоса или тяжести капельной линии, которые приводят к постоянным увеличением уровня Na+ и требуют внимания к приток и отток, чтобы избежать переполнения срез камеры. В частности в этом Na+ Спайк в процедуре осмотического давления раствора в зале срез постепенно повышается в течение нескольких минут, прежде чем срезы возвращаются в нормальное осмоляльность решение, но это не повлияло отрицательно ломтик здоровья или фиксации записи успех. Решение высокой осмотического давления резки ранее был использован для подготовки срез мозга для того, чтобы лучше сохранить дофаминовых нейронов для патч зажим записей57,58, продемонстрировав тем самым, что это временное hyperosmolality может быть полезным в некоторых контекстах.
Путем реализации оптимизированной процедуры, сочетая метода защитные восстановления NMDG и постепенное Na+ Спайк в шаге утилита этой методологии срез мозга был расширен для покрытия несовершеннолетних веками зрелых взрослых животных. Этот обновленный Протокол теперь подходит для широкого спектра животных возрастов, с использованием единого оптимального формулирования фаго NMDG и процедуры. При необходимости, Na+ Спайк в процедура может быть применена с прогрессивно больше задержки или медленнее время курс повышения жизнеспособности срезы мозга из старых животных, и мы предоставили основное руководство рекомендованных Спайк графиков согласно чтобы животное возраст (см. таблицу 2). В то время как мы обеспечили основные рамки, подходит для широкого спектра приложений, дополнительные передовые шаги могут быть изучены для дальнейшего укрепления жизнеспособности и долговечность срезы мозга от взрослых и старение животных. К примеру глутатион восстановление стратегии являются особенно эффективными в этом отношении и может быть реализован как описано в других разделах2,6.
Повышение пропускной способности для сложных экспериментов
Требовательных приложение, которое требует отличные сохранение нейронные структуры и функции для того, чтобы достичь высокой надежности успеха является анализ синаптической связи патч зажим записи. Как количество нейронов одновременно регистрируются идет вверх линейно, уровень технической сложности поднимается выше линейно. Существуют многочисленные типы сбоя, и один из наиболее частых причин сбоев является неспособность формы адекватные gigaohm пломбы на один или несколько целевых ячеек. Это может значительно замедлить прогресс, особенно тогда, когда три или более нейронов должны быть записаны одновременно. Согласуется с выводом быстрее gigaohm уплотнение время формирования с оптимизированный метод NMDG защитные восстановления, существует заметное улучшение в успех скорость и пропускную способность патч мульти нейрон зажим записи экспериментов с обоих взрослых трансгенных мозг мыши и взрослого мозга человека нейрохирургических фрагменты. Повышение эффективности почти наверняка объясняется более быстрое и надежное уплотнение формирования gigaohm и улучшение нейрональных сохранение фрагментов с настоящим Протоколом. Хотя этот протокол фокусируется на преимущества явно для фиксации записи приложений, аналогичные прирост ожидается для других сложных экспериментальных приложений, где мозг ломтик жизнеспособность имеет первостепенное значение.
Acknowledgements
Эта работа финансировалась Институтом Аллен мозга науки. Авторы хотели бы поблагодарить учредителей Института Аллен, G. Пол Аллен и Джоди Аллен, за их дальновидность, поощрения и поддержки. Мы также благодарим Аллен институт технического вспомогательного персонала для выполнения ухода за животными, животноводства и генотипирования.
Materials
| Name | Company | Catalog Number | Comments |
| Compresstome VF-200 | Precisionary Instruments | VF-200 | Vibrating tissue slicer (recommended) |
| N-methyl-D-glucamine | Sigma Aldrich | M2004 | aCSF constituent |
| Sodium Chloride | Sigma Aldrich | S3014 | aCSF constituent |
| Potassium Chloride | Sigma Aldrich | P5405 | aCSF constituent |
| Sodium Phosphate monobasic dihydrate | Sigma Aldrich | 71505 | aCSF constituent |
| Sodium Bicarbonate | Sigma Aldrich | S5761 | aCSF constituent |
| HEPES | Sigma Aldrich | H4034 | aCSF constituent |
| Glucose | Sigma Aldrich | G7021 | aCSF constituent |
| Sodium Ascorbate | Sigma Aldrich | A4034 | aCSF constituent |
| Thiourea | Sigma Aldrich | T8656 | aCSF constituent |
| Sodium pyruvate | Sigma Aldrich | P5280 | aCSF constituent |
| Calcium chloride dihydrate | Sigma Aldrich | C7902 | aCSF constituent |
| Magnesium Sulfate heptahydrate | Sigma Aldrich | M1880 | aCSF constituent |
| 2,2,2-Tribromoethanol | Sigma Aldrich | T48402 | Anesthetic component 1 |
| 2-methyl-2-butanol | Sigma Aldrich | 240486 | Anesthetic component 2 |
| Curved blunt forceps | Fine Science Tools | 11065-07 | Brain dissection tools |
| Fine dissecting scissors (supercut) | Fine Science Tools | 14058-09 | Brain dissection tools |
| Large heavy duty scissors 7'' | Fine Science Tools | 14000-18 | Brain dissection tools |
| Metal spatula | Sigma Aldrich | Z511455-1PAK | Brain dissection tools |
| Razor blades | VWR | 89031-954 | Brain dissection tools |
| Brain Slice Keeper-4 | Automate Scientific | S-BSK4 | brain slice holding chamber |
| nylon netting | Warner Instruments | 64-0198 | For building small slice recovery chambers |
| Pyrex glass beakers (250 mL) | VWR | 89090-434 | For building small slice recovery chambers |
| 35 mm plastic dish, round | VWR | 100488-376 | For building small slice recovery chambers |
| Gas diffuser stones (10 µm) | Sigma Aldrich | 59277 | For constant carbogenation (fine bubbles) |
| Agarose Type I-B | Sigma Aldrich | A0576 | For embedding brain specimens |
| Micro loader tips | Eppendorf | 22491229 | For filling patch clamp electrodes |
| Sylgard | VWR | 102092-312 | For making a custom dissecting platform |
| Hydrochloric acid | Sigma Aldrich | H1758-100ML | For pH adjustment of media |
| Sodium Hydroxide | Sigma Aldrich | 221465-25G | For pH adjustment of media |
| Potassium Hydroxide | Sigma Aldrich | 221473 | For pH adjustment of media |
| Plastic transfer pipets 3 mL graduated | VWR | 89497-676 | For slice transfer |
| Zirconium ceramic injector blades | Cadence Specialty Blades | EF-INZ10 | http://cadenceinc.com/ |
| KG-33 borosilicate glass capillary w/filament | King Glass Company | custom quote | ID: 0.87mm, OD 1.50mm |
| Biocytin | Sigma Aldrich | B4261 | Intern pipette solution |
| Phosphocreatine disodium | Sigma Aldrich | P7936 | Intern pipette solution |
| Potassium Gluconate | Sigma Aldrich | G4500-100G | Intern pipette solution |
| EGTA | Sigma Aldrich | E3889 | Intern pipette solution |
| Mg-ATP | Sigma Aldrich | A9187 | Intern pipette solution |
| Na2-GTP | Sigma Aldrich | 51120 | Intern pipette solution |
| sucrose | Sigma Aldrich | S0389 | Intern pipette solution |
| Heated water bath (2.5L) | VWR | 13491-060 | Miscellaneous |
| Filter paper rounds | VWR | 28456-022 | Miscellaneous |
| Cyanoacrylate glue | Amazon | B000BQRBO6 | Miscellaneous |
| Glass petri dish | VWR | 89000-326 | Miscellaneous |
| 10X Phosphate buffered saline | Sigma Aldrich | P5493 | Miscellaneous |
| 30 mL syringes | VWR | BD302832 | Miscellaneous |
| 1 mL syringes | VWR | BD-309628 | Miscellaneous |
| 25 5/8 gauge needles | VWR | 89219-292 | Miscellaneous |
| Thermomixer (w/1.5 mL tube block) | VWR | 89232-908 | To keep agarose molten |
References
- Aghajanian, G. K., Rasmussen, K. Intracellular studies in the facial nucleus illustrating a simple new method for obtaining viable motoneurons in adult rat brain slices. Synapse. 3 (4), 331-338 (1989).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods Mol Biol. 1183, 221-242 (2014).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nat Methods. 8 (9), 745-752 (2011).
- Peca, J., et al. Shank3 mutant mice display autistic-like behaviours and striatal dysfunction. Nature. 472 (7344), 437-442 (2011).
- Ting, J. T. F., et al. Improved methods for acute brain slice preparation from adult and aging animals. Society for Neuroscience Abstracts. 520, (2011).
- Ting, J. T. F., et al. Improved methods for acute brain slice preparation from adult and aging animals (Part II): Glutathione depletion underlies rapid deterioration of adult brain slices. Society for Neuroscience Abstracts. 505, (2012).
- MacGregor, D. G., Chesler, M., Rice, M. E. HEPES prevents edema in rat brain slices. Neurosci Lett. 303 (3), 141-144 (2001).
- Liu, Y. B., Guo, J. Z., Chiappinelli, V. A. Nicotinic receptor-mediated biphasic effect on neuronal excitability in chick lateral spiriform neurons. Neuroscience. 148 (4), 1004-1014 (2007).
- Xiang, Z., Huguenard, J. R., Prince, D. A. GABAA receptor-mediated currents in interneurons and pyramidal cells of rat visual cortex. J Physiol. 506, 715-730 (1998).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nat Protoc. 1 (4), 2075-2081 (2006).
- Contractor, A., et al. Loss of kainate receptor-mediated heterosynaptic facilitation of mossy-fiber synapses in KA2-/- mice. J Neurosci. 23 (2), 422-429 (2003).
- Pita-Almenar, J. D., Collado, M. S., Colbert, C. M., Eskin, A. Different mechanisms exist for the plasticity of glutamate reuptake during early long-term potentiation (LTP) and late LTP. J Neurosci. 26 (41), 10461-10471 (2006).
- Ito, K., Contractor, A., Swanson, G. T. Attenuated plasticity of postsynaptic kainate receptors in hippocampal CA3 pyramidal neurons. J Neurosci. 24 (27), 6228-6236 (2004).
- Van Dort, C. J., et al. Optogenetic activation of cholinergic neurons in the PPT or LDT induces REM sleep. Proc Natl Acad Sci U S A. 112 (2), 584-589 (2015).
- Ferando, I., Mody, I. Altered gamma oscillations during pregnancy through loss of delta subunit-containing GABA(A) receptors on parvalbumin interneurons. Front Neural Circuits. 7, 144 (2013).
- Walker, A. G., et al. Metabotropic glutamate receptor 3 activation is required for long-term depression in medial prefrontal cortex and fear extinction. Proc Natl Acad Sci U S A. 112 (4), 1196-1201 (2015).
- Takahashi, Y. K., et al. Neural estimates of imagined outcomes in the orbitofrontal cortex drive behavior and learning. Neuron. 80 (2), 507-518 (2013).
- Pan, G., et al. Preserving GABAergic interneurons in acute brain slices of mice using the N-methyl-D-glucamine-based artificial cerebrospinal fluid method. Neurosci Bull. 31 (2), 265-270 (2015).
- LaSarge, C. L., Santos, V. R., Danzer, S. C. PTEN deletion from adult-generated dentate granule cells disrupts granule cell mossy fiber axon structure. Neurobiol Dis. 75, 142-150 (2015).
- Tong, L. M., et al. Inhibitory interneuron progenitor transplantation restores normal learning and memory in ApoE4 knock-in mice without or with Abeta accumulation. J Neurosci. 34 (29), 9506-9515 (2014).
- Fleming, R. L., et al. Binge-pattern ethanol exposure during adolescence, but not adulthood, causes persistent changes in GABAA receptor-mediated tonic inhibition in dentate granule cells. Alcohol Clin Exp Res. 37 (7), 1154-1160 (2013).
- Kummer, K. K., El Rawas, R., Kress, M., Saria, A., Zernig, G. Social interaction and cocaine conditioning in mice increase spontaneous spike frequency in the nucleus accumbens or septal nuclei as revealed by multielectrode array recordings. Pharmacology. 95 (1-2), 42-49 (2015).
- Qi, J., et al. A glutamatergic reward input from the dorsal raphe to ventral tegmental area dopamine neurons. Nat Commun. 5, 5390 (2014).
- Wang, L., et al. Modulation of dopamine release in the striatum by physiologically relevant levels of nicotine. Nat Commun. 5, 3925 (2014).
- Siuda, E. R., et al. Spatiotemporal Control of Opioid Signaling and Behavior. Neuron. , (2015).
- Tucker, K. R., Huertas, M. A., Horn, J. P., Canavier, C. C., Levitan, E. S. Pacemaker rate and depolarization block in nigral dopamine neurons: a somatic sodium channel balancing act. J Neurosci. 32 (42), 14519-14531 (2012).
- McDevitt, R. A., et al. Serotonergic versus nonserotonergic dorsal raphe projection neurons: differential participation in reward circuitry. Cell Rep. 8 (6), 1857-1869 (2014).
- Wang, D. V., et al. Mesopontine median raphe regulates hippocampal ripple oscillation and memory consolidation. Nat Neurosci. 18 (5), 728-735 (2015).
- Engle, S. E., Shih, P. Y., McIntosh, J. M., Drenan, R. M. alpha4alpha6beta2* nicotinic acetylcholine receptor activation on ventral tegmental area dopamine neurons is sufficient to stimulate a depolarizing conductance and enhance surface AMPA receptor function. Mol Pharmacol. 84 (3), 393-406 (2013).
- Vance, K. M., Ribnicky, D. M., Rogers, R. C., Hermann, G. E. Artemisia santolinifolia enhances glutamatergic neurotransmission in the nucleus of the solitary tract. Neurosci Lett. 582, 115-119 (2014).
- Dergacheva, O., Boychuk, C. R., Mendelowitz, D. Developmental changes in GABAergic neurotransmission to presympathetic and cardiac parasympathetic neurons in the brainstem. J Neurophysiol. 110 (3), 672-679 (2013).
- Dergacheva, O. Chronic intermittent hypoxia alters neurotransmission from lateral paragigantocellular nucleus to parasympathetic cardiac neurons in the brain stem. J Neurophysiol. 113 (1), 380-389 (2015).
- Dyavanapalli, J., et al. Chronic intermittent hypoxia-hypercapnia blunts heart rate responses and alters neurotransmission to cardiac vagal neurons. J Physiol. 592, 2799-2811 (2014).
- Apostolides, P. F., Trussell, L. O. Regulation of interneuron excitability by gap junction coupling with principal cells. Nat Neurosci. 16 (12), 1764-1772 (2013).
- Graziane, N. M., Polter, A. M., Briand, L. A., Pierce, R. C., Kauer, J. A. Kappa opioid receptors regulate stress-induced cocaine seeking and synaptic plasticity. Neuron. 77 (5), 942-954 (2013).
- Ferando, I., Mody, I. In vitro gamma oscillations following partial and complete ablation of delta subunit-containing GABAA receptors from parvalbumin interneurons. Neuropharmacology. 88, 91-98 (2015).
- Foster, D. J., et al. M5 receptor activation produces opposing physiological outcomes in dopamine neurons depending on the receptor's location. J Neurosci. 34 (9), 3253-3262 (2014).
- Engle, S. E., Broderick, H. J., Drenan, R. M. Local application of drugs to study nicotinic acetylcholine receptor function in mouse brain slices. J Vis Exp. (68), e50034 (2012).
- Wang, L., et al. Temporal components of cholinergic terminal to dopaminergic terminal transmission in dorsal striatum slices of mice. J Physiol. 592, 3559-3576 (2014).
- Holloway, B. B., et al. Monosynaptic glutamatergic activation of locus coeruleus and other lower brainstem noradrenergic neurons by the C1 cells in mice. J Neurosci. 33 (48), 18792-18805 (2013).
- DePuy, S. D., et al. Glutamatergic neurotransmission between the C1 neurons and the parasympathetic preganglionic neurons of the dorsal motor nucleus of the vagus. J Neurosci. 33 (4), 1486-1497 (2013).
- Abbott, S. B., Holloway, B. B., Viar, K. E., Guyenet, P. G. Vesicular glutamate transporter 2 is required for the respiratory and parasympathetic activation produced by optogenetic stimulation of catecholaminergic neurons in the rostral ventrolateral medulla of mice in vivo. Eur J Neurosci. 39 (1), 98-106 (2014).
- Dergacheva, O., Dyavanapalli, J., Pinol, R. A., Mendelowitz, D. Chronic intermittent hypoxia and hypercapnia inhibit the hypothalamic paraventricular nucleus neurotransmission to parasympathetic cardiac neurons in the brain stem. Hypertension. 64 (3), 597-603 (2014).
- Chen, Q., et al. Imaging neural activity using Thy1-GCaMP transgenic mice. Neuron. 76 (2), 297-308 (2012).
- Luongo, F. H., Horn, M. E. Sohal V.S. Putative microcircuit-level substrates for attention are disrupted in mouse models of autism. Biological Psychiatry. 79 (8), 667-675 (2016).
- Vance, K. M., Rogers, R. C., Hermann, G. E. PAR1-activated astrocytes in the nucleus of the solitary tract stimulate adjacent neurons via NMDA receptors. J Neurosci. 35 (2), 776-785 (2015).
- Feliciano, P., Andrade, R., Bykhovskaia, M. Synapsin II and Rab3a cooperate in the regulation of epileptic and synaptic activity in the CA1 region of the hippocampus. J Neurosci. 33 (46), 18319-18330 (2013).
- Tomioka, N. H., et al. Elfn1 recruits presynaptic mGluR7 in trans and its loss results in seizures. Nat Commun. 5, 4501 (2014).
- Jiang, X., et al. Principles of connectivity among morphologically defined cell types in adult neocortex. Science. 350 (6264), 9462 (2015).
- Mishra, A., et al. Imaging pericytes and capillary diameter in brain slices and isolated retinae. Nat Protoc. 9 (2), 323-336 (2014).
- Gabriel, L. R., Wu, S., Melikian, H. E. Brain slice biotinylation: an ex vivo approach to measure region-specific plasma membrane protein trafficking in adult neurons. J Vis Exp. (86), (2014).
- Edwards, F. A., Konnerth, A. Patch-clamping cells in sliced tissue preparations. Methods Enzymol. 207, 208-222 (1992).
- Qi, G., Radnikow, G., Feldmeyer, D. Electrophysiological and morphological characterization of neuronal microcircuits in acute brain slices using paired patch-clamp recordings. J Vis Exp. (95), e52358 (2015).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. J Vis Exp. (91), e51706 (2014).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 13 (1), 133-140 (2010).
- Hille, B. The permeability of the sodium channel to organic cations in myelinated nerve. J Gen Physiol. 58 (6), 599-619 (1971).
- Martin, M., Chen, B. T., Hopf, F. W., Bowers, M. S., Bonci, A. Cocaine self-administration selectively abolishes LTD in the core of the nucleus accumbens. Nat Neurosci. 9 (7), 868-869 (2006).
- Chen, B. T., et al. Cocaine but not natural reward self-administration nor passive cocaine infusion produces persistent LTP in the VTA. Neuron. 59 (2), 288-297 (2008).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved