Sign In
Preparación de rebanadas cerebrales agudas mediante un optimizado N-metil-D-glucamine recuperación protección método
* These authors contributed equally
In This Article
Summary
Este protocolo muestra la implementación de un optimizado N-metil-D-glucamine (NMDG) método de protección recuperación de preparación de corte de cerebro. Una formulación de medios de comunicación solo se utiliza para obtener confiablemente rebanadas de cerebro sano de animales de cualquier edad y para diversas aplicaciones experimentales.
Abstract
Este protocolo es una guía práctica para el N-metil-D-glucamine (NMDG) método de protección recuperación de preparación de corte de cerebro. Numerosos estudios recientes han validado la utilidad de este método para mejorar la preservación neuronal y viabilidad de rebanada de cerebro total. La aplicación de esta técnica por pioneros ha facilitado investigaciones detalladas en función cerebral utilizando diversas aplicaciones experimentales y que abarcan una amplia gama de edades animales, regiones del cerebro y tipos de la célula. Se describen los pasos para llevar a cabo la técnica de corte de cerebro protección recuperación utilizando una formulación de medios de comunicación de líquido cefalorraquídeo artificial (aCSF) NMDG optimizada y un procedimiento mejorado para obtener confiablemente rebanadas de cerebro sano para electrofisiología de la abrazadera del remiendo. Con este enfoque actualizado, se observa una mejora sustancial en la velocidad y fiabilidad del gigaohm sello de formación durante la abrazadera del remiendo dirigido experimentos de grabación manteniendo excelente preservación neuronal, facilitando así un reto aplicaciones experimentales. Resultados representativos son siempre de la abrazadera del remiendo de la neurona de múltiples experimentos para ensayo de grabación conectividad sináptica en rebanadas de cerebro neocortical preparado a partir de ratones transgénicos adulto joven y madurados ejemplares adultos de Neurocirugía humanas. Además, el método de recuperación protección NMDG optimizado de corte de cerebro es compatible con animales juveniles y adultos, por lo tanto resolver una limitación de la metodología original. En Resumen, una sola formulación y procedimiento de corte de cerebro se pueden implementar a través de diversas especies y edades para lograr preservación excelente de la viabilidad y el tejido.
Introduction
La preparación de rebanada cerebral aguda es un sistema esencial de modelo experimental en Neurociencia. Aproximadamente la mitad de un siglo, esta plataforma permite estudios dinámicos funcionales del cerebro vivo en una amplia variedad de especies animales y regiones anatómicas del cerebro. Si el uso es bioquímica, proyección de imagen funcional, morfología y electrofisiología, es de suma importancia para garantizar una óptima integridad y viabilidad de los tejidos en rodajas. Es por ello que la preparación de la rebanada del cerebro roedores juveniles altamente resistente (es decir, menores de día postnatal 30 para ratones) ha sido el preferido hasta la fecha. La dificultad en la obtención de cerebro suficientemente sano rebanadas de adulto maduro y crianza de animales ha demostrado para ser un desafío formidable para la mayoría y ha impuesto severas limitaciones para el estudio de la arquitectura funcional del cerebro maduro. Esto es particularmente cierto para la abrazadera del remiendo de grabación, una técnica que requiere preservación morfológica y funcional excelente y es indispensable para la caracterización detalladas propiedades intrínsecas y sinápticas de las neuronas individuales identificadas. Durante las últimas décadas, la gran mayoría de electrofisiólogos de abrazadera del remiendo se ha basado en un método de 'protección corte' utilizando sacarosa-sustituido bajo Na+ aCSF1 para la preparación de rodajas de cerebro sano de juvenil y en mucho menor medida, los animales adultos jóvenes. Este método se basa en la premisa que afluencia de Na+ pasiva y entrada de agua posterior y celular inflamación durante el paso de corte de la rebanada es el insulto predominante que lleva a la pobre supervivencia de las neuronas, particularmente para las neuronas ubicadas en la capas superficiales que son más propensos a mantener el trauma directo del movimiento de la hoja. Sin embargo, el método de corte protector todavía deja mucho que desear para la preparación de rebanada de cerebro de animales adultos maduros independientemente de la formulación particular aCSF implementado.
Una solución simple pero efectiva a este problema ha sido descrito2,3,4,5,6 y denomina el método de corte de cerebro 'protección recuperación'. La versión original de este método utiliza un aCSF NMDG-sustituido, NMDG fue identificado como el más versátil y efectivo entre varios otros candidatos sodio iones sustitutos (como sacarosa, glicerol, colina y Tris). La formulación de los medios de comunicación fue reforzada por la adición de HEPES para resistir el edema de la rebanada del cerebro y proporcionan más fuerte pH buffer7, así como la adición de suplementos para contrarrestar los efectos perjudiciales del estrés oxidativo (tabla 1). Se determinó empíricamente que una incubación de recuperación inicial en baja Na+, baja Ca2 +, y alto Mg2 + NMDG aCSF inmediatamente después de corte de tejido de cerebro adulto era necesario y suficiente para mejora neuronal conservación sobre una amplia gama de regiones cerebrales, tipos de células y animales edad3,5,6.
En particular, las encarnaciones anteriores de lo que ahora es llamado el método de recuperación protección pueden encontrarse en la literatura1,8,9,10,11,12, 13, aunque todo el potencial para maduros adultos y envejecimiento animal cerebro rebanada y parche abrazadera grabación no fue reconocida o demostrada en estos trabajos anteriores. Además, matizadas variaciones procesales siguen apareciendo en apoyo de aplicaciones experimentales4,14,15,16. El cuerpo colectivo de trabajo de estos numerosos grupos de investigación imparte alta confianza en la robustez del método de protección recuperación para la preservación de tejido mejorado. El método de recuperación protección NMDG ahora ha sido ampliamente adoptado y aplicado en numerosos estudios de investigación publicados utilizando preparaciones de rebanada de cerebro de animales adultos. Estos estudios de corte aguda palmo neocortical3,17,18, hipocampo15,19,20,21, estriado22 , 23 , 24, midbrain25,26,27,28,29y cerebelo30,31,32, 33 , regiones de 34 y una variedad de tipos de neurotransmisor y neuromodulador incluyendo glutamatérgica4,30, GABAérgico18,20,31,35 ,36, dopaminérgico24,29,37,38, colinérgicos14,37,38, 39, noradrenérgicas40y serotonergic27,28 neurotransmisión. El método está también bien adaptado para el control de optogenetic de la actividad neuronal en sectores derivados de animales transgénicos3,39 o siguiendo en vivo inyecciones virales17,27, 28,40,41,42,43, como bien como Ca2 + proyección de imagen funcional de la actividad neuronal2,44 ,45,46. Análisis de corto plazo plasticidad4,47,48 y diversas formas de plasticidad a largo plazo16,de35,48 han sido registrados. Un reciente estudio aplicó el método de recuperación protección NMDG para facilitar amplia y sistemática de sondeo de la conectividad sináptica en la corteza visual en rebanadas de cerebro de ratón adulto maduro usando el octopatch grabación configuración49 — un poderoso demostración de la utilidad y la robustez de este método. El método de recuperación protección incluso se ha aplicado con éxito en contextos experimentales previamente imprevistos, tales como, mejor preservación de la vasculatura y del pericitos en el cerebro cortical adulto rodajas50, abrazadera del remiendo de la grabación trasplantado las poblaciones interneurona en 1 a 1,5 años de Alzheimer ratón modelos20y un cerebro adulto rebanada del receptor tráfico ensayo51.
El siguiente protocolo describe los procedimientos paso a paso para implementar un método de protección recuperación NMDG optimizado de preparación de rebanada del cerebro para mejorar la viabilidad de las rebanadas de cerebro agudo. Se discuten los principios para la mejor preservación neuronal, así como la demostración de los beneficios claros de esta metodología para abrazadera de parche neurona múltiples complejos experimentos de grabación en rebanadas de cerebro de ratón transgénico adulto joven y adulto maduro rebanadas de cerebro humano neuroquirúrgica. El siguiente protocolo validado para ratones de 21 días de edad a más de un años de edad, así como por muestras neuroquirúrgicas humanas derivadas de pacientes adultos.
Protocol
Procedimientos que involucran ratones transgénicos han sido aprobados por el institucional cuidado Animal y el Comité uso (IACUC) en el Instituto Allen para la ciencia del cerebro. Machos y hembras ratones C57BL/6 (rango 10-30 g de peso) fueron utilizados en estos experimentos. Algunos de los resultados representativos describen datos obtenidos de rodajas de cerebro humano vivo. Muestras de tejido neocortical se obtuvieron durante neurocirugías para retiro del tumor. Fue necesario retirar el tejido neocortical sobrepuesto para acceder al tejido enfermo. Se obtuvo consentimiento informado del paciente en todos los casos para el uso del tejido neuroquirúrgico para fines de investigación bajo un protocolo aprobado por la Junta de revisión institucional del centro médico de sueco.
1. preparación de medios y reactivos (cuadro 1)
Nota: Soluciones deben hacerse para arriba en agua purificada libre de metales traza y otras impurezas. Se recomienda hacer soluciones recién en el día del experimento, aunque las soluciones pueden ser almacenadas a 4 ° C hasta 1 semana, si lo desea. 1 L de cada formulación anterior es suficiente para los procedimientos de corte de 1-2. Todas las soluciones aCSF deben saturarse con carbogen (95% O25% CO2) antes de su uso para la amortiguación de pH estable y oxigenación adecuada. El pH de las soluciones debe ajustarse a 7.3-7.4 y la osmolalidad medida y ajustado a 300-310 mOsmol/kg.
- Preparar la aCSF NMDG HEPES (en mM): 92 NMDG, 2.5 KCl, 1.25 NaH2PO4, 30 NaHCO3, 20 HEPES, glucosa 25, tiourea 2, 5 Na-ascorbato, piruvato de Na 3 y 0,5 CaCl2·2H2O 10 MgSO4·7H2O. valorar pH 7.3 –7.4 con 17 mL +/-0,5 mL de ácido clorhídrico de 5 M.
Nota: Este paso de titulación debe idealmente realizarse antes de la adición de cationes divalentes para evitar la precipitación; sin embargo, la precipitación puede revertirse al ajuste del pH al rango fisiológico. - Preparar HEPES con aCSF (en mM): NaCl 92, 2.5 KCl, 1.25 NaH2PO4, 30 NaHCO3, 20 HEPES, glucosa 25, tiourea 2, 5 Na-ascorbato, Na 3-piruvato, 2 CaCl2·2H2O y 2 MgSO4·7H2O. valorar pH 7.3-7.4 con varias gotas de había concentrado 10 N NaOH.
- Preparar la grabación aCSF (en mM): 124 NaCl, 2.5 KCl, 1.25 NaH2PO4, 24 NaHCO3, glucosa 12.5, 5 HEPES, 2 CaCl2·2H2O y 2 MgSO4·7H2O. valorar pH 7.3-7.4 con unas gotas de concentrado 10 N NaOH.
- Na+ spike en la solución (2 M): 580 mg de NaCl disuelto en 5 mL de la aCSF NMDG HEPES recién preparada. Esto es suficiente solución para preparación de corte de un cerebro.
- Preparar agarosa 2% para inclusión de tejidos. Disolver 2 g de agarosa tipo 1B (véase Tabla de materiales) en 100 mL de 1 x PBS y microondas hasta que hierva apenas. Agitar para mezclar, luego Vierta la mezcla en una placas de Petri estériles de 10 cm y dejar solidificar. Almacenar la placa de agarosa en una bolsa de plástico sellada a 4 ° C hasta su uso.
- Preparar el anestésico inyectable solución stock. 2,5 g de Tribromoethanol 2,2,2 la mezcla con 5 mL de 2-metil-2-butanol y luego poco a poco se disuelven en 200 mL de PBS, pH 7.0-7.3. Filtrar la solución con un filtro de 0,22 μm antes de usar y almacenar a 4 ° C protegido de la luz.
Nota: Consulte las directrices del Comité de uso animal y las reglas para determinar el procedimiento de caducidad y disposición para la anestesia solución stock.
2. configuración de la estación de corte
- Configurar la estación de corte con la máquina de cortar del tejido y los instrumentos quirúrgicos (véase Tabla de materiales). Para calibrar la máquina de cortar, coloque una lámina de cerámica del inyector de circonio en el brazo de la cuchilla usando pegamento adhesivo rápido, luego inserte el soporte de muestra y alinee el borde de la hoja hasta el borde del porta muestra dejando un espacio pequeño para asegurarse de que no raspar la hoja el metal.
Nota: Si el filo no está físicamente dañado puede ser reutilizado por muchas semanas o incluso meses sin reemplazo. Varios modelos de máquina de cortar tejido están disponibles en el mercado, muchos de los cuales pueden proporcionar excelente rendimiento óptimo calibrado. El instrumento ideal debe tener desviación mínima del eje z, mide directamente y afinado o empíricamente observados. - Configurar un vaso de precipitados de 250 mL llenado con 200 mL de HEPES NMDG aCSF y enfríe previamente en hielo con carbogenation constante (aplicado a través de un difusor de gas piedra inmerso en los medios de comunicación) para > 10 minutos.
Nota: Esta solución se usará para perfusión de transcardial y para llenar el depósito de la máquina rebanadora durante el seccionamiento. - Configurar la cámara de recuperación de rebanada cerebral inicial con 150 mL de HEPES NMDG aCSF (mantener constante carbogenation) y coloque la cámara en un baño de agua caliente mantenido a 32-34 ° C.
Nota: Una rebanada cámara después de que el diseño de Edwards y Konnerth (1992)52 se recomienda este paso. Estas cámaras se pueden hacer con artículos de laboratorio disponibles (vaso de precipitados de 250 mL, malla de nylon malla, tubo cónico de 50 mL, plato redondo de plástico de 35 mm). Debe tenerse cuidado para asegurar que el segmento de red sigue siendo libre de aire de burbujas, particularmente los producidos continuamente por las piedras de burbujas de gas de carbogen ya que puede causar cortes flotar para arriba y se dañan. La red debe estar sumergida aproximadamente 1 cm debajo de la superficie del líquido. - Configurar un trozo de cerebro con cámara; se recomienda un diseño con múltiples pozos independientes en un depósito más grande (véase Tabla de materiales). Llene el depósito con 450 mL de HEPES aCSF y caliente a la temperatura debajo de carbogenation constante hasta su uso.
Nota: Las rebanadas de cerebro se transferirán de la cámara de recuperación inicial a esta cámara para almacenamiento a largo plazo antes de la grabación electrofisiológica. Debe tenerse cuidado para asegurar que los restos de la red de rebanada sin burbujas de aire en todo momento. - Preparar agarosa fundida para inclusión de tejidos. Utilice el extremo abierto de un frasco cónico de 50 mL como un cortador de galletas para cortar un bloque de agarosa al 2% desde el plato previamente preparado. Libremente y tapa el frasco cónico, luego microondas para 10 – 30 s hasta que la agarosa se derrita. No recaliente.
- Verter la agarosa fundida en tubos de 1,5 mL. Mantener la agarosa en estado fundido con un Termomezcladores a 42 ° C con agitación vigorosa. Con cuidado en asegurar que la agarosa fundida no solidifique prematuramente.
- Coloque el accesorio de refrigeración bloque para la máquina de cortar el hielo para pre-enfriar en este momento.
3. Transcardial perfusión
Nota: El procedimiento de perfusión de transcardial es un paso importante cuando se trabaja con animales adultos es importante para lograr un enfriamiento rápido del cerebro y ralentizado el metabolismo mediante infusión de cerebro de baja Na+, baja Ca2 +alta Mg2 + aCSF solución. La perfusión de transcardial también sirve para eliminar los glóbulos rojos de la vasculatura cerebral, que reduce la autofluorescencia que pudiera interferir con la visualización y focalización de las poblaciones de la célula fluorescente etiquetado en líneas transgénicas. No es recomendable omitir la perfusión transcardial.
- Profundamente anestesiar ratones por inyección intraperitoneal de solución stock de trabajo anestésico (250 mg / kg: 0.2 mL de anestésico 1.25% solución stock por peso corporal de 10 g, vea la Tabla de materiales). Después de 2 – 3 min, verificar suficiente profundidad de la anestesia mediante la evaluación el reflejo de pellizco del dedo del pie. Si es necesario, inyectar un volumen adicional de acciones de trabajo anestésico y reevaluar reflejo de pellizco del dedo del pie después de otro 2-3 minutos.
- Cargar una jeringa de 30 mL con 25 mL de carbogenated HEPES NMDG aCSF desde el vaso de precipitados de 250 mL previamente refrigerada (2 – 4 º C es óptima, en contraposición a la solución de granizado o helada). Coloque una aguja de calibre 25 5/8.
- Con el ratón en su parte posterior, precisar las patas delanteras y patas traseras para la estabilidad. Un vidrio de 15 cm plato de Petri lleno de silicona endurecida obras así como la base.
- Con un bisturí, haga una incisión lateral para abrir la cavidad torácica a nivel del diafragma. Utilice tijeras finas para cortar a través de la caja torácica en cualquier lado teniendo cuidado de evitar clipping el corazón y los pulmones.
- El perno hacia atrás la parte central de la caja torácica para exponer el corazón. Inserte la aguja de la jeringa de 30 mL en el ventrículo izquierdo y corte la aurícula derecha con tijeras finas para permitir que la sangre salga del corazón.
- Presione el émbolo de la jeringa usando una presión constante manual y perfusión del animal con la aCSF NMDG HEPES refrigerada a una velocidad de ~ 10 mL/min.
Nota: Si la perfusión es satisfactoria el hígado va a cambiar en color de rojo oscuro a amarillo pálido y en algunos casos claros se observan líquidos saliendo de las fosas nasales hacia el final del procedimiento.
4. disección y corte de cerebro
- Decapitar el animal. Utilice un bisturí para abrir la piel en la cabeza y exponer el gorro.
- Corte super fino uso las tijeras para cortar la piel sobre el casquillo del cráneo y hacer pequeñas incisiones lateralmente a ambos lados en el caudal/ventral base del cráneo. Haga cortes poco profundos adicionales desde el aspecto caudal dorsal del cráneo en la dirección rostral hasta la línea media dorsal teniendo cuidado de no para dañar el cerebro subyacente. Hacer un final ' t ' corte perpendicular a la línea media a nivel de los bulbos olfativos.
Nota: Se debe tener cuidado para que no perjudicar a las regiones cerebrales de interés. En particular, en ningún momento debe existir cualquier fuerza de compresión aplicada al cerebro sí mismo. - Use las pinzas de punta redonda para sostener el cráneo desde el aspecto medial rostral y pelar hacia la dirección del caudal lateral. Repetición de ambos lados abrir y quitar la mitad dorsal de la tapa del cráneo para exponer el cerebro. Sacar suavemente el cerebro intacto en el vaso previamente enfriado NMDG HEPES aCSF. Permite el cerebro ~ 1 min enfriar uniformemente.
- Utilice la espátula grande para levantar el cerebro fuera del vaso y sobre el plato de Petri cubiertas con papel de filtro. Ajustar y bloquear el cerebro según el ángulo de corte y desea región cerebral de interés. Trabajar rápidamente para evitar la privación prolongada de oxígeno durante la manipulación.
Nota: Muchos ángulos de corte son posibles. El ángulo de método y de corte bloqueo exacto dependerá de la región exacta del cerebro, tipo de la célula y circuito a estudiar. - Fijar el bloque de cerebro al titular de la pieza usando pegamento adhesivo. Retire la pieza interior del titular muestra suficiente para retirar el bloque de cerebro completamente dentro. Verter la agarosa fundida directamente en el soporte hasta que el bloque del cerebro está completamente cubierto en agarosa. Sujete el accesorio previamente enfriado refrigeración bloque alrededor de mordazas para ~ 10 s hasta que la agarosa ha solidificado.
- Inserte el soporte de la muestra en el receptáculo de la máquina de cortar y verificar la alineación apropiada. Llene el depósito con restante previamente fría, oxigenada NMDG HEPES aCSF desde el vaso de precipitados de 250 mL y mover una piedra de burbujas en el depósito para la duración del corte para asegurar oxigenación adecuada.
- Ajustar el micrómetro para comenzar a avanzar en la muestra de cerebro embebido en agarosa. Inicie la máquina de cortar y empíricamente ajustar la frecuencia de velocidad y oscilación de avance al nivel deseado.
Nota: Ambos ajustes deben ser en la gama baja. Para mejores resultados, un solo pase del brazo de la cuchilla deben tomar aproximadamente 20 s y la oscilación debe producir un zumbido muy suave y lentos con ningún zumbido abierta. - Continuar avanzando y cortar el tejido en 300 μm incrementos (u otro grueso preferido) hasta la región del cerebro de interés se secciona completamente; el tiempo total para el procedimiento de corte debe ser menos de 15 minutos.
5. optimizado NMDG recuperación protección procedimiento
- Paso de recuperación NMDG inicial (paso crítico): al finalizar el procedimiento de seccionamiento, recoger todas las rodajas con un corte plástico Pasteur tubo t y transferirlas a una cámara de recuperación inicial de precalentado (34 ° C) con 150 mL de NMDG HEPES aCSF. Transferencia de todos los sectores en corta sucesión e iniciar un temporizador como todos los sectores se mueven en la sala de recuperación.
- Consulte la tabla 2 para determinar el óptimo Na+ spike en horario según la edad del ratón.
Nota: Este procedimiento es un método práctico para lograr una velocidad controlada de reintroducción de Na+ en la cámara de corte de cerebro y está optimizado para un volumen de geometría y depósito de la cámara slice específicas del cerebro y el tipo (véase Tabla de materiales). - Efectuar el paso a paso Na+ en espiga sumando los volúmenes indicados de Na+ spike en solución en el indicado veces. Añadir la Na+ spike en solución directamente en la chimenea del Pelele de la cámara de recuperación inicial para facilitar la mezcla rápida.
- Transferencia de todos los sectores a la cámara de retención a largo plazo aCSF HEPES mantenida a temperatura ambiente. Permiten rebanadas para recuperarse de una 1 h adicional en el HEPES sosteniendo la cámara antes de iniciar los experimentos de patch clamp grabación.
6. parche abrazadera grabación
Nota: Los siguientes procedimientos básicos simplemente proporcionan algunas consideraciones prácticas y no pretenden representar protocolos detallados para las grabaciones de la abrazadera del remiendo, como estos se pueden encontrar en otra parte53,54. Un aparejo de electrofisiología patch clamp se requiere para esta aplicación. Esto generalmente se compondrá de un microscopio vertical equipado con óptica de contraste (IR-DIC) infrarrojo interferencia diferencial y un sistema de iluminación de fluorescencia, un amplificador de la abrazadera del remiendo y digitalizador de datos, motorizados micromanipulador y microscopio plataforma de tabla de aislamiento de la vibración, jaula de Faraday y sistema de calefacción y de la perfusión de la solución. La cámara de la muestra y la plataforma deben estar diseñados para grabación rebanada sumergida. Para las grabaciones de la abrazadera del parche multi-neurona, se requiere una plataforma equipada con múltiples amplificadores, etapas de cabeza y micromanipuladores de alta calidad. Además, para obtener mejores resultados, una plataforma equipada con un filtro de paso de banda nm IR 900 y componentes ópticos que emparejan se recomienda para una visualización adecuada de las células ubicadas > 50 μm en las rebanadas de cerebro. La alineación apropiada para la iluminación de Kӧhler también es importante para una visualización clara.
- Preparar solución de pipeta intracelular (en mM): 130 K-gluconato, 4 KCl, 10 HEPES, 0.3 EGTA, 10 fosfocreatina-Na2, 4 MgATP, Na 0.32-GTP y 13,4 biocitina. Ajustar el pH a 7.35 con 1 M de KOH y la osmolaridad a 285-290 mOsmol/kg utilizando sacarosa como sea necesario.
- Preparación de electrodos de pinza de parche de Capillares de vidrio de borosilicato de paredes gruesas; el electrodo de la pinza de parche ideal tiene una conicidad relativamente corta y rechoncha con un 3-6 MOhm lleno de resistencia de punta en el baño.
- Asegurar que los cables de electrodo de plata clorurados correctamente con el fin de asegurar grabaciones estables. Hacer esto 3-4 mm de la plata (típico) sumergiendo el último alambre en líquido blanqueador por aproximadamente 30 min o hasta que el alambre se vuelve negro.
- Establecer perfusión de solución utilizando una bomba peristáltica a 3 – 4 mL/min circular carbogenated aCSF a través de la cámara de grabación teniendo cuidado para que coincida con la entrada y salida de grabación para evitar desbordamiento.
- Transferencia de una porción de cerebro solo en la cámara de grabación de sumersión y asegure en su lugar mediante un ancla de rodaja en forma de U con nylon Cruz cadenas. Identificar la región del cerebro objetivo usando un objetivo de aire X 4 antes de cambiar a un objetivo de energía más alta (p. ej., objetivos de inmersión de agua de alta apertura numérica 40 X o 60 X).
- Identificar visualmente una célula objetivo saludable. La aparición de la membrana neuronal en el soma, como visualizar por microscopía de IR-DIC, se utiliza para juzgar la idoneidad de una célula de candidato para la grabación de abrazadera del remiendo.
Nota: Las neuronas saludables exhiben típicamente las características siguientes: encogido ni hinchada somata, contraste suave de los bordes de la membrana y el aspecto de membrana lisa. Además, la mayoría de las células sanas se encuentran > 30 μm en el segmento, como las neuronas superficiales son propensos a dañarse con separado procesos dendríticos. Deben evitarse las neuronas que presentan un aspecto arrugado, núcleos claramente visibles o apariencia 'huevo frito' o los bordes de la membrana muy oscuro o alto contraste. - Back-fill el parche pipetear con ~ 5 μl de solución intracelular y cargarlo en el portaelectrodo. La pipeta en el baño de la grabación por encima de la rebanada del cerebro y aplicar ligera presión positiva para despejar obstrucciones en la punta. Cero el desplazamiento de la pipeta y controlar la resistencia de punta, utilizando una función de prueba de la membrana.
- Mover la punta en contacto con el cuerpo de la célula de la neurona de destino; un hoyuelo pequeño debe formar en la superficie de la membrana debido a la ligera presión positiva.
- Tan pronto como se observa un hoyuelo de membrana, rápidamente Retire la presión positiva y aplica una succión suave para facilitar la formación de sello. Una vez que aumenta la resistencia de la pipeta a > 100 MOhm, activar un comando de retención a un nivel que coincide con la membrana de reclinación anticipada posibles para el tipo de célula específica (-70 mV es un buen punto de partida).
- Una vez que la resistencia de punta alcanza gigaohm ≥1, intente entrar en la célula por ruptura de la membrana debajo de la pipeta de parche con breves episodios de aspiración aguda; la función 'zap' puede ser utilizada para facilitar el rodaje según sea necesario.
Nota: Un cartera potencial de -70 mV se sugiere para experimentos de fijación de voltaje en neuronas corticales. Las neuronas saludables tendrán una fuga de corriente negativa no más que pA-100 para la duración del experimento, pero esto es en parte dependiente en el tipo de célula. Una neurona se quedarían excluida del análisis de si el potencial de membrana reposo fue más despolarizado de -50 mV, o si la resistencia de acceso cambia por más de 20%. -
Una vez que se obtiene una grabación de abrazadera estable de células completas de parche, destino neuronas adicionales para grabación repitiendo pasos 6.6, 6.10. Tenga cuidado para evitar disturbios mecánicos que resultarían en la pérdida de la primera grabación.
- Seleccione las neuronas adicionales dentro de 100 μm de la primera neurona para asegurar una probabilidad razonable de encontrar neuronas synaptically junto.
Nota: Puede ser útil en algunos casos para identificar múltiples neuronas de candidato en el frente y precarga y pre-posición pipetas todos cercanos a las diferentes células apuntadas antes de establecer la primera grabación de abrazadera del remiendo.
- Seleccione las neuronas adicionales dentro de 100 μm de la primera neurona para asegurar una probabilidad razonable de encontrar neuronas synaptically junto.
Representative Results
Esta sección proporciona resultados representativos para la preparación de rebanada de cerebro rutinaria y experimentos de electrofisiología patch clamp utilizando el método de recuperación protección NMDG optimizado (es decir, NMDG protección recuperación combinada con gradual Na+ Spike en procedimiento). Preservación primera, morfológico de las neuronas se evaluó en diversas regiones del cerebro de rebanadas de cerebro preparados con o sin aplicar el método de recuperación protección NMDG optimizado (figura 1). Ratones adultos de tres meses fueron seleccionados para estos experimentos, y utilizamos microscopía IR-DIC para determinar salud neuronal basado en la forma y el aspecto general de los Somas y dendritas proximales. Tenga en cuenta el aspecto picnótico marchitas, de las neuronas la mayoría de las imágenes representativas de las rebanadas de cerebro preparados sin el método de recuperación protectora (todas las imágenes se obtuvieron 1 – 2 h después de la preparación de la rebanada). Estas rodajas de control fueron preparados utilizando NMDG aCSF para perfusión de transcardial y cortar pasos pero fueron inicialmente recuperados en alta Na+-que contienen HEPES aCSF. Por el contrario, las imágenes representativas de las rebanadas preparadas usando el método de recuperación protección optimizado de NMDG revelan las neuronas con morfologías mejorados (más suaves, más completa, menos apariencia arrugada) que son adecuados para la abrazadera del remiendo (figura la grabación 1). se observó la mayor preservación neuronal a través de múltiples regiones del cerebro incluyendo neocortical capas II/III y V, subiculum y el núcleo geniculado lateral dorsal (dLGN).
A continuación, el método de recuperación protección NMDG optimizado se comparó con NMDG recuperación protección método original (es decir, sin el gradual Na+ spike en procedimiento). El tiempo medio para la formación de sello gigaohm en abrazadera del remiendo intentos de grabación se redujo significativamente y de manera dramática (9,9 s versus 33.3 s, **p < 0.005, pares t-prueba) cuando se aplicó el gradual Na+ spike en procedimiento junto con el paso de la recuperación protección NMDG (figura 2). La membrana más rápida y más confiable sellado veces grandemente había mejorado el rendimiento de la abrazadera del remiendo en rebanadas de cerebro adulto joven. El óptimo Na+ spike en horario más fue modificado según la edad del animal (tabla 2) y fue beneficioso para todas las edades pruebas (de 3 semanas a ratones 1 años de edad). El perfil de elevación de concentración de ion sodio gradual en el transcurso del procedimiento de spike se ofrece (figura 3) para acompañar los horarios que se muestran en la tabla 2.
Como parte del programa de tipos de celular de Instituto de Allen (http://celltypes.brain-map.org/) un esfuerzo de gran escala está en marcha para sistemáticamente caracterizar las propiedades electrofisiológicas intrínsecas de neuronas individuales en adulto joven (40-80 de día postnatal) rebanadas de cerebro cortical visual ratón derivan de líneas transgénicas con expresión de marcador fluorescente tipo específico de célula en poblaciones neuronales genéticamente definidos (capa cortical y Cre líneas conductor cruzaron a un fluorescente de Cre-dependiente del tipo de la célula reportero de línea55). La figura 4 muestra huellas de ejemplo de los patrones de disparo de parvalbúmina (Pvalb)-expresar fast spiking corticales interneuronas de (FS) (ratones Pvalb-IRES-Cre/Ai14) en respuesta a una serie de 1 pasos de inyección actual s que cubren el rango dinámico de disparo de la neurona. El F-de la curva para un conjunto de datos de 22 interneuronas corticales de FS se muestra a la derecha. Similar objetivada se realizaron experimentos de grabación de abrazadera parche para caracterizar 23 neuronas excitatorias Rorb expresando en la capa IV de Rorb-IRES-Cre/Ai14 ratones (figura 4). Tipos de neurona sana diversos incluyendo interneuronas FS y neuronas piramidales en las capas y regiones corticales pueden rutinariamente y confiable dirigidos para grabar durante al menos 6-8 h después de rodaja preparación utilizando esta optimizado el protocolo de la abrazadera del remiendo.
Además de medir propiedades neuronales intrínsecas, fue sondeado conectividad sináptica entre las neuronas registradas simultáneamente múltiples de tipos definidos en microcircuitos corticales visuales. La abrazadera del remiendo de multi-neurona técnica de grabación es excepcionalmente exigente, como numerosas neuronas sanas candidato de tipos definidos deben estar presentes dentro de un campo relativamente pequeño de la rebanada del cerebro con el fin de asegurar una probabilidad razonable de obtener alta calidad grabaciones simultáneas y la identificación de conexiones sinápticas de bona fide . La figura 5 muestra pareada grabación de interneuronas del dos tdTomato + FS en la corteza visual de rebanadas cerebrales derivados de ratones adultos jóvenes de Pvalb-IRES-Cre/Ai14. Una fuerte conexión sináptica inhibitoria unidireccional fue detectada (grabado con solución de cloruro alta de interior de la pipeta). Se presentan registros de ejemplo y protocolos para medir propiedades de plasticidad sináptica a corto plazo. Peleas de la estimulación del tren de alta frecuencia (10 pulsos cada 10, 50 y 100 Hz) fueron seguidos por recuperación solo examen de los pulsos en diversos intervalos de tiempo (1, 2 o 4 s) para medir el curso del tiempo de recuperación de la depresión sináptica.
Excelente éxito también se ha obtenido para las neuronas neocorticales humanas en rebanadas de cerebro maduro adulto ex vivo . Neuroquirúrgicas muestras se obtienen de pacientes sometidos a cirugías programadas para la extracción del tumor en los hospitales locales. Los procedimientos para la preparación de tejidos humanos neuroquirúrgica colección y cerebro rebanada difieren de los procedimientos de rebanada del cerebro de ratón en algunos aspectos prácticos. En breve, tejido neocortical resecado (distal al sitio de la patología) se recoge de la sala de operaciones e inmerso en helada oxigenada NMDG HEPES aCSF y transportado con refrigeración continua y oxigenación de la sala de operaciones para la laboratorio dentro de 30 minutos o menos. Las rebanadas de cerebro son preparadas mediante el procedimiento de recuperación protección NMDG y permitió recuperar durante un tiempo prolongado de aproximadamente 3 h antes de iniciar grabaciones de patch clamp. La figura 6 muestra un acertado apareado grabación experimento y un experimento de grabación exitosa revisión cuádruple abrazadera de humanas ex vivo cerebro rebanadas preparadas en esta manera de la región de la corteza frontal. La grabación apareada muestra unidireccional entrada sináptica excitatoria de una neurona cortical piramidal sobre una interneurona cortical (registrado como corrientes postsinápticas excitatorias). En la versión cuádruple experimentar dos excitatorios y dos neuronas inhibitorias se registraron simultáneamente, y se detectaron tres conexiones sinápticas inhibitorias (registrado como potenciales inhibidores postsinápticos) de conexiones total doce sondeadas. Por lo tanto, esta metodología de corte de cerebro optimizado permite éxito experimental confiable en los más difíciles del cerebro rebanada aplicaciones, incluyendo múltiples neuronas parche abrazadera experimentos para estudiar la conectividad de circuito en el cerebro humano adulto maduro agudo resecado tejido.
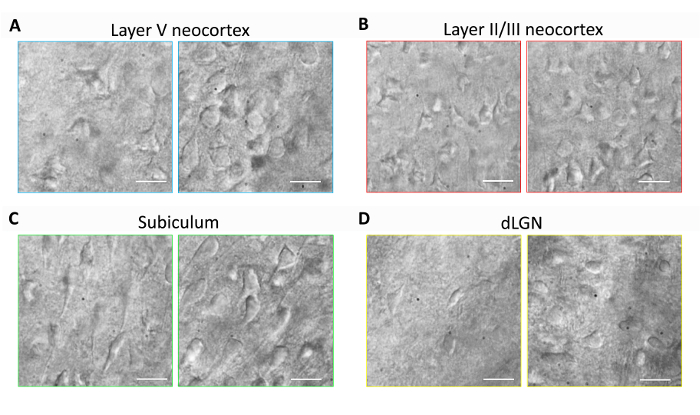
Figura 1: Mejoró preservación neuronal con el método de recuperación protección NMDG optimizado de preparación de corte de cerebro. Se adquirieron imágenes representante IR-DIC de regiones diversas del cerebro en rebanadas agudos de un ratón de tres meses de edad. Método de corte protector NMDG sin un paso de recuperación protección (paneles de la izquierda) de control versus método de protección recuperación NMDG optimizado (paneles de la derecha). (A) capa V de corteza, (B) capa II/III de neocortex, subiculum (C) y (D) núcleo geniculado lateral dorsal (dLGN). Barras de escala en todos los paneles son 20 μm. haga clic aquí para ver una versión más grande de esta figura.
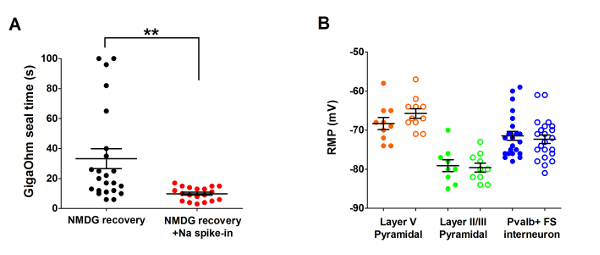
Figura 2: Acelerado velocidad y confiabilidad mejorada del gigaohm sellan formación en abrazadera del remiendo grabación experimentos utilizando el método de recuperación protección NMDG con procedimiento de spike Na+ . Parcela (A) de formación de sello gigaohm veces para la recuperación NMDG solo (negro los puntos de datos, números = 19) versus recuperación NMDG más Na+ spike en procedimiento (puntos rojo, números = 23). Todas las células registradas eran neuronas piramidales en la capa II/III o V de la corteza visual. Tenga en cuenta, el tiempo máximo se limita a 100 s para tener en cuenta las células que no formaron nunca sellos gigaohm. Junto t-test, **p < 0.005. (B) parcela de reposo potencial de membrana (RMP) de neuronas piramidales de la capa V (puntos naranja, números = 10/11), neuronas piramidales II/III (verde los puntos de datos, números = 9/10), o interneuronas corticales de Pvalb + FS (azul de puntos de datos, números = 23/22). Círculos sólidos denotan condición de recuperación NMDG y abren círculos NMDG recuperación plus Na+ spike-en procedimiento. Cada punto de datos representa una neurona y tanto la media y +/-SEM se muestran. No hay diferencias significativas en RMPs comparar condiciones de preparación de corte de cerebro para los tres tipos de células (emparejado t-test). Haga clic aquí para ver una versión más grande de esta figura.
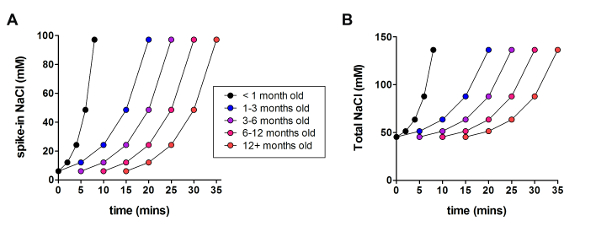
Figura 3 : Perfil de elevación de concentración de ion sodio gradual en el curso del procedimiento en punto de. (A) parcela de spike en NaCl concentración frente al tiempo. (B) parcela de concentración extracelular total de NaCl versus tiempo. Haga clic aquí para ver una versión más grande de esta figura.
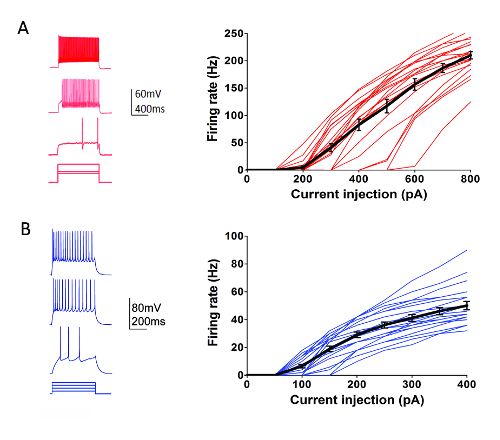
Figura 4 : Propiedades electrofisiológicas intrínsecas de tipos de la célula cortical definida genéticamente. Ejemplo de (A) traza de disparo neuronal en respuesta a los actuales pasos de inyección para Pvalb + cortical FS interneuronas (panel izquierdo). tdTomato + neuronas fueron objeto de grabaciones en rebanadas de cerebro de ratones Pvalb-IRES-Cre/Ai14. Datos de resumen para la cocción de relación de corriente de la tasa de inyección (F-de la curva) se muestran a la derecha (n = 22). En el ejemplo (B) se traza de disparo neuronal en respuesta a los actuales pasos de inyección para Rorb expresar capas corticales IV neuronas excitatorias (panel izquierdo). tdTomato + neuronas fueron objeto de grabaciones en rebanadas de cerebro de ratones Rorb-IRES-Cre/Ai14. Datos de resumen para la cocción de relación de corriente de la tasa de inyección (F-de la curva) se muestran a la derecha (n = 23). Cada línea delgada de color representa la F-de la curva de una sola neurona; mientras que las líneas negras gruesas representa la media para cada grupo +/-SEM. haga clic aquí para ver una versión más grande de esta figura.
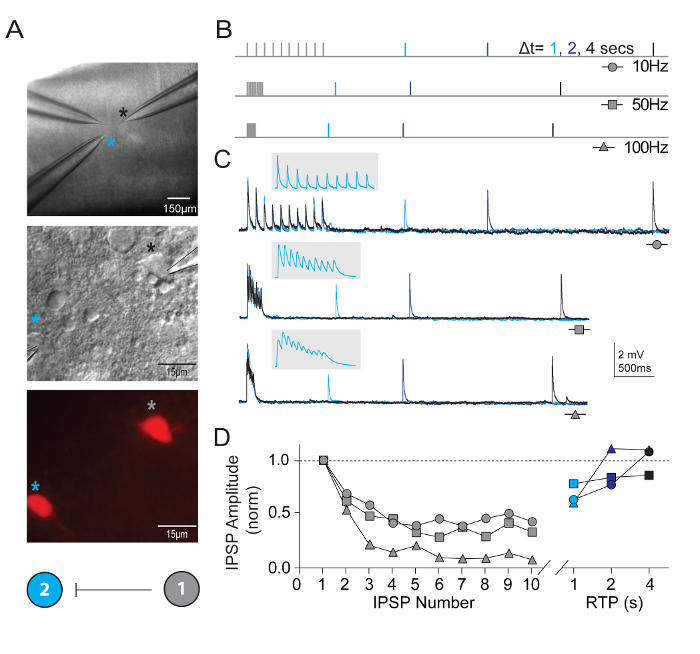
Figura 5: Plasticidad a corto plazo en interneuronas FS corticales expresando Pvalb synaptically conectadas. Contraste de interferencia diferencial (A) y epifluorescencia fueron utilizados tratar tdTomato-positivo, expresando Pvalb interneuronas de FS de la corteza visual primaria de ratón. Diagrama esquemático de conectividad demostrando una unilateral conexión sináptica entre las dos interneuronas había codificado por un color. (B) esquema de los protocolos de estimulación para evaluar la dinámica a corto plazo de las neuronas synaptically conectadas. Trenes de potenciales de acción 10 (10, 50 y 100 Hz) son evocados en la neurona presináptica, seguida por un solo potencial de acción (pulso de prueba de recuperación, RTP) entregado con retraso de tiempo diferentes (1, 2 y 4 s) después de que el tren ha terminado. Cada RTP son color cifrado para la claridad. (C) promedio rastros del correspondientes unilaterales inhibidores potenciales postsinápticos (uIPSPs) en la celda #2 en respuesta a los trenes de potenciales de acción evocados en la celda #1. Recuadro gris ha ampliado la escala de tiempo para mostrar el trazado del tren de uIPSP. (D) normalizado uIPSP amplitudes se trazan en función de su posición durante el entrena en diferentes frecuencias. Depresión neta es claro a través de tarifas de entrada todo con una recuperación sustancial de uIPSP en 4 s. haga clic aquí para ver una versión más grande de esta figura.
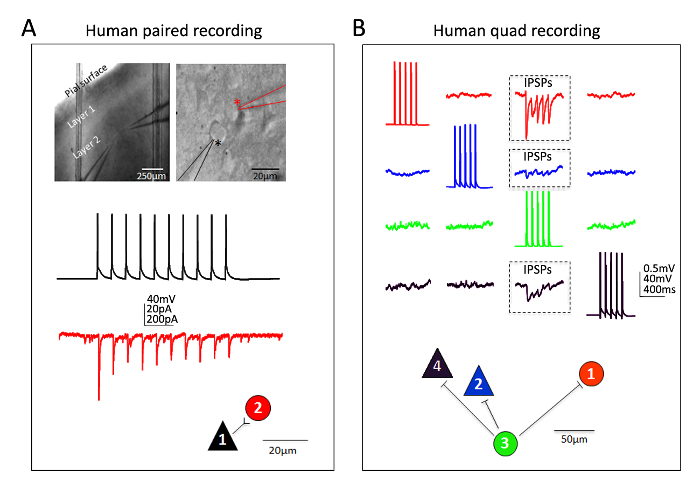
Figura 6: Grabaciones de abrazadera parche multi-neurona en humano adulto Neurocirugía cerebro cortes. (A) imágenes de alta y baja magnificación IR-DIC indicando la ubicación y la identidad de las neuronas registradas (paneles superiores). Una neurona piramidal (asterisco negro) y vecino interneurona (asterisco rojo) se registraron simultáneamente. Ejemplo color cifró los rastros de una conexión sináptica excitatoria unidireccional (ESPC) de células piramidales interneurona (medido como EPSCs en pinza de tensión) y el correspondiente mapa de conexión física (paneles inferiores). Experimento de grabación de abrazadera cuádruple parche (B) en una rebanada del cerebro neuroquirúrgica humano adulto del corteza prefrontal dorsolateral. Dos neuronas piramidales y dos interneuronas ha sido simultáneamente, permitiendo sondeo secuencial de doce posibles conexiones sinápticas. Un tren de potenciales de acción evocados en la celda #3 (rastros verdes) condujo a la detección de potenciales postsinápticos inhibitorios (IPSPs) en cada una de las otras neuronas simultáneamente registradas tres (tres regiones en caja, paneles superiores). Las respuestas de cada neurona individual son color cifrado para la claridad. En el panel inferior se muestra el mapa de conexión física. Tenga en cuenta los rastros crudos que se muestra en (B) representan los promedios de barridos de datos raw consecutivos por lo menos 20. Supuesta identificación del tipo de célula se basó en la forma del soma, análisis de la morfología de colorante fluorescente de relleno durante las grabaciones y propiedades electrofisiológicas intrínsecas incluyendo los patrones de disparo en respuesta a los pasos de inyección actual. Haga clic aquí para ver una versión más grande de esta figura.
| NMDG HEPES aCSF | HEPES holding aCSF | Grabación aCSF | |||||||
| Componente | mM | MW | g/litro | mM | MW | g/litro | mM | MW | g/litro |
| NMDG | 92 | 195.22 | 17.96 | ||||||
| Ácido clorhídrico | 92 | 36,46 | * | ||||||
| NaCl | 92 | 58.44 | 5,38 | 124 | 58.44 | 7.25 | |||
| KCl | 2.5 | 74.55 | 0.19 | 2.5 | 74.55 | 0.19 | 2.5 | 74.55 | 0.19 |
| NaH2PO4 | 1.2 | 138.00 | 0.17 | 1.2 | 138.00 | 0.17 | 1.2 | 138.00 | 0.17 |
| NaHCO3 | 30 | 84.01 | 2.52 | 30 | 84.01 | 2.52 | 24 | 84.01 | 2.02 |
| HEPES | 20 | 238.31 | 4.77 | 20 | 238.31 | 4.77 | 5 | 238.31 | 1.19 |
| Glucosa | 25 | 180.20 | 4.51 | 25 | 180.20 | 4.51 | 12.5 | 180.20 | 2.25 |
| ascorbato de sodio | 5 | 198.00 | 0.99 | 5 | 198.00 | 0.99 | 0 | 198.00 | 0.00 |
| Tiourea | 2 | 76.12 | 0.15 | 2 | 76.12 | 0.15 | 0 | 76.12 | 0.00 |
| piruvato de sodio | 3 | 110.04 | 0.33 | 3 | 110.04 | 0.33 | 0 | 110.04 | 0.00 |
| MgSO4.7H2O | 10 | 246.48 | 5 mL | 2 | 246.48 | 1 mL | 2 | 246.48 | 1 mL existencia (2M) |
| CaCl2.2 h2O | 0.5 | 147.01 | 0.25 mL | 2 | 147.01 | 1 mL | 2 | 147.01 | 1 mL existencia (2M) |
| * valorar pH de HEPES NMDG aCSF a 7.3-7.4 con HCl concentrado | |||||||||
| Todas las soluciones deben estar en el rango 300-310 mOsm/Kg | |||||||||
Tabla 1: Formulaciones de medios de comunicación.
| Animal edad | |||||
| Tiempo (min) * | < 1 mes | 1-3 meses | 3–6 meses | 6–12 meses | 12 + meses |
| 0 | 250 ΜL | 250 ΜL | |||
| 1 | |||||
| 2 | 250 ΜL | ||||
| 3 | |||||
| 4 | 500 ΜL | ||||
| 5 | 250 ΜL | 250 ΜL | |||
| 6 | 1000 ΜL | ||||
| 7 | |||||
| 8 | 2000 ΜL | ||||
| 9 | |||||
| 10 | transferencia | 500 ΜL | 250 ΜL | 250 ΜL | |
| 11 | |||||
| 12 | |||||
| 13 | |||||
| 14 | |||||
| 15 | 1000 ΜL | 500 ΜL | 250 ΜL | 250 ΜL | |
| 16 | |||||
| 17 | |||||
| 18 | |||||
| 19 | |||||
| 20 | 2000 ΜL | 1000 ΜL | 500 ΜL | 250 ΜL | |
| 21 | |||||
| 22 | |||||
| 23 | |||||
| 24 | |||||
| 25 | transferencia | 2000 ΜL | 1000 ΜL | 500 ΜL | |
| 26 | |||||
| 27 | |||||
| 28 | |||||
| 29 | |||||
| 30 | transferencia | ΜL DE 2.000 | 1000 ΜL | ||
| 31 | |||||
| 32 | |||||
| 33 | |||||
| 34 | |||||
| 35 | transferencia | ΜL DE 2.000 | |||
| 36 | |||||
| 37 | |||||
| 38 | |||||
| 39 | |||||
| 40 | transferencia | ||||
| * Hora cero es que las rodajas de momento son transferidas en la cámara de recuperación inicial | |||||
Tabla 2: Horario recomendado para Na gradual + procedimiento de punto según la edad del ratón.
Discussion
Na + Spike - mejora Gigaohm sello formación y éxito la grabación de la abrazadera del remiendo
La versión inicial del método de recuperación protección NMDG fue diseñada específicamente para animales adultos y envejecimiento2,5. Algunos pioneros también han intentado aplicar esta metodología a corte juvenil cerebro animal (es decir, ratones < 30 días de edad). Sin embargo, se ha observado que a diferencia de la excepcional confirmado visualmente neuronal preservación con el método de recuperación protección NMDG en este rango de edad, gigaohm sello formación puede frecuentemente puesto hacia fuera, hacia la abrazadera del remiendo fallidos intentos de grabación. Una hipótesis es que NMDG cationes más fácilmente son atrapados en rebanadas de cerebro juvenil en relación con rebanadas del cerebro adulto y pueden impedir la formación de sello; sin embargo, gigaohm juntas pueden formar fácilmente mientras que rebanadas de cerebro juvenil están completamente sumergidos en NMDG aCSF (datos no mostrados), así indicando NMDG aCSF por sí no impide el gigaohm sello formación.
La transición rápida de solución de Na+ de bajo a alto al finalizar el paso de recuperación de rebanada de cerebro inicial causa daño a las membranas neuronales y perturba el proceso de formación de sello. Esto es intuitivo ya que la transición de bajo a alto Na+, temperatura de fría a caliente y elevación dramática de la Ca2 + Mg2 + relación entre llevar colectivamente a un resurgimiento masivo de la actividad sináptica espontánea. Esta fase de rebote inhibitorio en el cerebro rebanado procedimiento es probable que después de un insulto isquémico por reperfusión del espejo. Así, a otros mitigar daño de la membrana neuronal en la fase de recuperación inicial que se ha incorporado un gradual Na+ spike en procedimiento en el que la elevación de la concentración de Na+ en la cámara de incubación NMDG protección recuperación es lenta y reproducible con la sincronización exacta. Como en el procedimiento de recuperación protectora original, la disociación temporal de Na+ elevación de la temperatura y Ca2 +/Mg2 + cociente de la elevación es beneficiosa. Pero además, el Na+ spike en procedimiento conduce a aumento incremental en la concentración extracelular de Na+ sobre los primeros momentos y grandes aumentos hacia los puntos finales del tiempo, así que el tejido cerebral una oportunidad para acomodar mejor a los crecientes niveles de Na+ . Este procedimiento es que una alternativa al intercambio de solución gradual controlado por una bomba de perfusión o gravedad líneas de goteo que conducen a incrementos constantes en los niveles de Na+ y requieren atención para entrada y salida para evitar el desbordamiento de la cámara del sector. En particular, en este Na+ procedimiento de spike la osmolalidad de la solución en la cámara de corte poco a poco se levanta durante un período de varios minutos antes de las láminas vuelven a solución osmolalidad normal, pero esto no afectó negativamente la salud del sector o abrazadera del remiendo éxito la grabación. Una solución de corte de alta osmolaridad se ha utilizado anteriormente para las preparaciones de cerebro medio rebanada para mejor preservar las neuronas de dopamina para patch clamp grabaciones57,58, demostrando así que este temporal hyperosmolality puede ser beneficioso en algunos contextos.
Mediante la aplicación de un procedimiento optimizado que combina el método de recuperación protección NMDG y gradual Na+ spike en paso la utilidad de esta metodología de rebanada del cerebro se ha ampliado para cubrir menores a través de las edades animales adultos maduras. Este protocolo actualizado ahora es conveniente para una amplia gama de edades animales mediante un único óptimo NMDG aCSF formulación y procedimiento. Si es necesario, el procedimiento de punto Na+ puede ser aplicado con un retardo progresivamente más largo o más lento curso del tiempo para mejorar la viabilidad de las rebanadas de cerebro de animales más viejos, y hemos proporcionado a una guía básica de recomendado spike en horarios según para animales de edad (ver tabla 2). Mientras que hemos proporcionado un marco básico adecuado para una amplia gama de aplicaciones, pasos avanzados adicionales pueden ser exploradas para mejorar aún más la viabilidad y longevidad de las rebanadas de cerebro de animales adultos y envejecimiento. Por ejemplo, estrategias de restauración de glutatión son particularmente eficaces en este sentido y pueden aplicarse como se describe en otra parte2,6.
Mejora de rendimiento para impugnar experimentos
El análisis de la conectividad sináptica por la grabación de abrazadera del remiendo es una aplicación exigente que requiere excelente preservación de la estructura neuronal y función para lograr una alta confiabilidad del éxito. Como el número de neuronas al mismo tiempo grabar sube linealmente, el nivel de dificultad técnica aumenta supra-linealmente. Hay numerosos modos de falla, y una de las causas más frecuentes de fracasos es la incapacidad para sellos de forma adecuada gigaohm en uno o más de las células apuntadas. Esto dramáticamente puede ralentizar el progreso, sobre todo cuando tres o más neuronas se registrarán simultáneamente. Consistente con el hallazgo de más rápido gigaohm sello tiempo de formación con el método de recuperación protección NMDG optimizado, hubo una notable mejora en la tasa de éxito y rendimiento de grabación de múltiples neuronas parche abrazadera experimentos con tanto adulto transgénicos rebanadas de cerebro de ratón y rebanadas de cerebro neuroquirúrgica humano adulto. La mejora de la eficiencia es seguramente atribuible a la formación de sello gigaohm más rápido y confiable y la mejor preservación neuronal de las rebanadas con este protocolo. Aunque este protocolo se centra en los beneficios expresamente para aplicaciones de grabación de la abrazadera del remiendo, se anticipan aumentos similares para otras aplicaciones experimentales difíciles donde la viabilidad de rebanada del cerebro es fundamental.
Acknowledgements
Este trabajo fue financiado por el Instituto Allen para la ciencia del cerebro. Los autores desean agradecer a los fundadores del Instituto Allen, Paul G. Allen y Jody Allen, por su visión, ánimo y apoyo. Agradecemos también el personal de apoyo técnico del Instituto de Allen para realizar genotipado, la cría y cuidado de los animales.
Materials
| Name | Company | Catalog Number | Comments |
| Compresstome VF-200 | Precisionary Instruments | VF-200 | Vibrating tissue slicer (recommended) |
| N-methyl-D-glucamine | Sigma Aldrich | M2004 | aCSF constituent |
| Sodium Chloride | Sigma Aldrich | S3014 | aCSF constituent |
| Potassium Chloride | Sigma Aldrich | P5405 | aCSF constituent |
| Sodium Phosphate monobasic dihydrate | Sigma Aldrich | 71505 | aCSF constituent |
| Sodium Bicarbonate | Sigma Aldrich | S5761 | aCSF constituent |
| HEPES | Sigma Aldrich | H4034 | aCSF constituent |
| Glucose | Sigma Aldrich | G7021 | aCSF constituent |
| Sodium Ascorbate | Sigma Aldrich | A4034 | aCSF constituent |
| Thiourea | Sigma Aldrich | T8656 | aCSF constituent |
| Sodium pyruvate | Sigma Aldrich | P5280 | aCSF constituent |
| Calcium chloride dihydrate | Sigma Aldrich | C7902 | aCSF constituent |
| Magnesium Sulfate heptahydrate | Sigma Aldrich | M1880 | aCSF constituent |
| 2,2,2-Tribromoethanol | Sigma Aldrich | T48402 | Anesthetic component 1 |
| 2-methyl-2-butanol | Sigma Aldrich | 240486 | Anesthetic component 2 |
| Curved blunt forceps | Fine Science Tools | 11065-07 | Brain dissection tools |
| Fine dissecting scissors (supercut) | Fine Science Tools | 14058-09 | Brain dissection tools |
| Large heavy duty scissors 7'' | Fine Science Tools | 14000-18 | Brain dissection tools |
| Metal spatula | Sigma Aldrich | Z511455-1PAK | Brain dissection tools |
| Razor blades | VWR | 89031-954 | Brain dissection tools |
| Brain Slice Keeper-4 | Automate Scientific | S-BSK4 | brain slice holding chamber |
| nylon netting | Warner Instruments | 64-0198 | For building small slice recovery chambers |
| Pyrex glass beakers (250 mL) | VWR | 89090-434 | For building small slice recovery chambers |
| 35 mm plastic dish, round | VWR | 100488-376 | For building small slice recovery chambers |
| Gas diffuser stones (10 µm) | Sigma Aldrich | 59277 | For constant carbogenation (fine bubbles) |
| Agarose Type I-B | Sigma Aldrich | A0576 | For embedding brain specimens |
| Micro loader tips | Eppendorf | 22491229 | For filling patch clamp electrodes |
| Sylgard | VWR | 102092-312 | For making a custom dissecting platform |
| Hydrochloric acid | Sigma Aldrich | H1758-100ML | For pH adjustment of media |
| Sodium Hydroxide | Sigma Aldrich | 221465-25G | For pH adjustment of media |
| Potassium Hydroxide | Sigma Aldrich | 221473 | For pH adjustment of media |
| Plastic transfer pipets 3 mL graduated | VWR | 89497-676 | For slice transfer |
| Zirconium ceramic injector blades | Cadence Specialty Blades | EF-INZ10 | http://cadenceinc.com/ |
| KG-33 borosilicate glass capillary w/filament | King Glass Company | custom quote | ID: 0.87mm, OD 1.50mm |
| Biocytin | Sigma Aldrich | B4261 | Intern pipette solution |
| Phosphocreatine disodium | Sigma Aldrich | P7936 | Intern pipette solution |
| Potassium Gluconate | Sigma Aldrich | G4500-100G | Intern pipette solution |
| EGTA | Sigma Aldrich | E3889 | Intern pipette solution |
| Mg-ATP | Sigma Aldrich | A9187 | Intern pipette solution |
| Na2-GTP | Sigma Aldrich | 51120 | Intern pipette solution |
| sucrose | Sigma Aldrich | S0389 | Intern pipette solution |
| Heated water bath (2.5L) | VWR | 13491-060 | Miscellaneous |
| Filter paper rounds | VWR | 28456-022 | Miscellaneous |
| Cyanoacrylate glue | Amazon | B000BQRBO6 | Miscellaneous |
| Glass petri dish | VWR | 89000-326 | Miscellaneous |
| 10X Phosphate buffered saline | Sigma Aldrich | P5493 | Miscellaneous |
| 30 mL syringes | VWR | BD302832 | Miscellaneous |
| 1 mL syringes | VWR | BD-309628 | Miscellaneous |
| 25 5/8 gauge needles | VWR | 89219-292 | Miscellaneous |
| Thermomixer (w/1.5 mL tube block) | VWR | 89232-908 | To keep agarose molten |
References
- Aghajanian, G. K., Rasmussen, K. Intracellular studies in the facial nucleus illustrating a simple new method for obtaining viable motoneurons in adult rat brain slices. Synapse. 3 (4), 331-338 (1989).
- Ting, J. T., Daigle, T. L., Chen, Q., Feng, G. Acute brain slice methods for adult and aging animals: application of targeted patch clamp analysis and optogenetics. Methods Mol Biol. 1183, 221-242 (2014).
- Zhao, S., et al. Cell type-specific channelrhodopsin-2 transgenic mice for optogenetic dissection of neural circuitry function. Nat Methods. 8 (9), 745-752 (2011).
- Peca, J., et al. Shank3 mutant mice display autistic-like behaviours and striatal dysfunction. Nature. 472 (7344), 437-442 (2011).
- Ting, J. T. F., et al. Improved methods for acute brain slice preparation from adult and aging animals. Society for Neuroscience Abstracts. 520, (2011).
- Ting, J. T. F., et al. Improved methods for acute brain slice preparation from adult and aging animals (Part II): Glutathione depletion underlies rapid deterioration of adult brain slices. Society for Neuroscience Abstracts. 505, (2012).
- MacGregor, D. G., Chesler, M., Rice, M. E. HEPES prevents edema in rat brain slices. Neurosci Lett. 303 (3), 141-144 (2001).
- Liu, Y. B., Guo, J. Z., Chiappinelli, V. A. Nicotinic receptor-mediated biphasic effect on neuronal excitability in chick lateral spiriform neurons. Neuroscience. 148 (4), 1004-1014 (2007).
- Xiang, Z., Huguenard, J. R., Prince, D. A. GABAA receptor-mediated currents in interneurons and pyramidal cells of rat visual cortex. J Physiol. 506, 715-730 (1998).
- Bischofberger, J., Engel, D., Li, L., Geiger, J. R., Jonas, P. Patch-clamp recording from mossy fiber terminals in hippocampal slices. Nat Protoc. 1 (4), 2075-2081 (2006).
- Contractor, A., et al. Loss of kainate receptor-mediated heterosynaptic facilitation of mossy-fiber synapses in KA2-/- mice. J Neurosci. 23 (2), 422-429 (2003).
- Pita-Almenar, J. D., Collado, M. S., Colbert, C. M., Eskin, A. Different mechanisms exist for the plasticity of glutamate reuptake during early long-term potentiation (LTP) and late LTP. J Neurosci. 26 (41), 10461-10471 (2006).
- Ito, K., Contractor, A., Swanson, G. T. Attenuated plasticity of postsynaptic kainate receptors in hippocampal CA3 pyramidal neurons. J Neurosci. 24 (27), 6228-6236 (2004).
- Van Dort, C. J., et al. Optogenetic activation of cholinergic neurons in the PPT or LDT induces REM sleep. Proc Natl Acad Sci U S A. 112 (2), 584-589 (2015).
- Ferando, I., Mody, I. Altered gamma oscillations during pregnancy through loss of delta subunit-containing GABA(A) receptors on parvalbumin interneurons. Front Neural Circuits. 7, 144 (2013).
- Walker, A. G., et al. Metabotropic glutamate receptor 3 activation is required for long-term depression in medial prefrontal cortex and fear extinction. Proc Natl Acad Sci U S A. 112 (4), 1196-1201 (2015).
- Takahashi, Y. K., et al. Neural estimates of imagined outcomes in the orbitofrontal cortex drive behavior and learning. Neuron. 80 (2), 507-518 (2013).
- Pan, G., et al. Preserving GABAergic interneurons in acute brain slices of mice using the N-methyl-D-glucamine-based artificial cerebrospinal fluid method. Neurosci Bull. 31 (2), 265-270 (2015).
- LaSarge, C. L., Santos, V. R., Danzer, S. C. PTEN deletion from adult-generated dentate granule cells disrupts granule cell mossy fiber axon structure. Neurobiol Dis. 75, 142-150 (2015).
- Tong, L. M., et al. Inhibitory interneuron progenitor transplantation restores normal learning and memory in ApoE4 knock-in mice without or with Abeta accumulation. J Neurosci. 34 (29), 9506-9515 (2014).
- Fleming, R. L., et al. Binge-pattern ethanol exposure during adolescence, but not adulthood, causes persistent changes in GABAA receptor-mediated tonic inhibition in dentate granule cells. Alcohol Clin Exp Res. 37 (7), 1154-1160 (2013).
- Kummer, K. K., El Rawas, R., Kress, M., Saria, A., Zernig, G. Social interaction and cocaine conditioning in mice increase spontaneous spike frequency in the nucleus accumbens or septal nuclei as revealed by multielectrode array recordings. Pharmacology. 95 (1-2), 42-49 (2015).
- Qi, J., et al. A glutamatergic reward input from the dorsal raphe to ventral tegmental area dopamine neurons. Nat Commun. 5, 5390 (2014).
- Wang, L., et al. Modulation of dopamine release in the striatum by physiologically relevant levels of nicotine. Nat Commun. 5, 3925 (2014).
- Siuda, E. R., et al. Spatiotemporal Control of Opioid Signaling and Behavior. Neuron. , (2015).
- Tucker, K. R., Huertas, M. A., Horn, J. P., Canavier, C. C., Levitan, E. S. Pacemaker rate and depolarization block in nigral dopamine neurons: a somatic sodium channel balancing act. J Neurosci. 32 (42), 14519-14531 (2012).
- McDevitt, R. A., et al. Serotonergic versus nonserotonergic dorsal raphe projection neurons: differential participation in reward circuitry. Cell Rep. 8 (6), 1857-1869 (2014).
- Wang, D. V., et al. Mesopontine median raphe regulates hippocampal ripple oscillation and memory consolidation. Nat Neurosci. 18 (5), 728-735 (2015).
- Engle, S. E., Shih, P. Y., McIntosh, J. M., Drenan, R. M. alpha4alpha6beta2* nicotinic acetylcholine receptor activation on ventral tegmental area dopamine neurons is sufficient to stimulate a depolarizing conductance and enhance surface AMPA receptor function. Mol Pharmacol. 84 (3), 393-406 (2013).
- Vance, K. M., Ribnicky, D. M., Rogers, R. C., Hermann, G. E. Artemisia santolinifolia enhances glutamatergic neurotransmission in the nucleus of the solitary tract. Neurosci Lett. 582, 115-119 (2014).
- Dergacheva, O., Boychuk, C. R., Mendelowitz, D. Developmental changes in GABAergic neurotransmission to presympathetic and cardiac parasympathetic neurons in the brainstem. J Neurophysiol. 110 (3), 672-679 (2013).
- Dergacheva, O. Chronic intermittent hypoxia alters neurotransmission from lateral paragigantocellular nucleus to parasympathetic cardiac neurons in the brain stem. J Neurophysiol. 113 (1), 380-389 (2015).
- Dyavanapalli, J., et al. Chronic intermittent hypoxia-hypercapnia blunts heart rate responses and alters neurotransmission to cardiac vagal neurons. J Physiol. 592, 2799-2811 (2014).
- Apostolides, P. F., Trussell, L. O. Regulation of interneuron excitability by gap junction coupling with principal cells. Nat Neurosci. 16 (12), 1764-1772 (2013).
- Graziane, N. M., Polter, A. M., Briand, L. A., Pierce, R. C., Kauer, J. A. Kappa opioid receptors regulate stress-induced cocaine seeking and synaptic plasticity. Neuron. 77 (5), 942-954 (2013).
- Ferando, I., Mody, I. In vitro gamma oscillations following partial and complete ablation of delta subunit-containing GABAA receptors from parvalbumin interneurons. Neuropharmacology. 88, 91-98 (2015).
- Foster, D. J., et al. M5 receptor activation produces opposing physiological outcomes in dopamine neurons depending on the receptor's location. J Neurosci. 34 (9), 3253-3262 (2014).
- Engle, S. E., Broderick, H. J., Drenan, R. M. Local application of drugs to study nicotinic acetylcholine receptor function in mouse brain slices. J Vis Exp. (68), e50034 (2012).
- Wang, L., et al. Temporal components of cholinergic terminal to dopaminergic terminal transmission in dorsal striatum slices of mice. J Physiol. 592, 3559-3576 (2014).
- Holloway, B. B., et al. Monosynaptic glutamatergic activation of locus coeruleus and other lower brainstem noradrenergic neurons by the C1 cells in mice. J Neurosci. 33 (48), 18792-18805 (2013).
- DePuy, S. D., et al. Glutamatergic neurotransmission between the C1 neurons and the parasympathetic preganglionic neurons of the dorsal motor nucleus of the vagus. J Neurosci. 33 (4), 1486-1497 (2013).
- Abbott, S. B., Holloway, B. B., Viar, K. E., Guyenet, P. G. Vesicular glutamate transporter 2 is required for the respiratory and parasympathetic activation produced by optogenetic stimulation of catecholaminergic neurons in the rostral ventrolateral medulla of mice in vivo. Eur J Neurosci. 39 (1), 98-106 (2014).
- Dergacheva, O., Dyavanapalli, J., Pinol, R. A., Mendelowitz, D. Chronic intermittent hypoxia and hypercapnia inhibit the hypothalamic paraventricular nucleus neurotransmission to parasympathetic cardiac neurons in the brain stem. Hypertension. 64 (3), 597-603 (2014).
- Chen, Q., et al. Imaging neural activity using Thy1-GCaMP transgenic mice. Neuron. 76 (2), 297-308 (2012).
- Luongo, F. H., Horn, M. E. Sohal V.S. Putative microcircuit-level substrates for attention are disrupted in mouse models of autism. Biological Psychiatry. 79 (8), 667-675 (2016).
- Vance, K. M., Rogers, R. C., Hermann, G. E. PAR1-activated astrocytes in the nucleus of the solitary tract stimulate adjacent neurons via NMDA receptors. J Neurosci. 35 (2), 776-785 (2015).
- Feliciano, P., Andrade, R., Bykhovskaia, M. Synapsin II and Rab3a cooperate in the regulation of epileptic and synaptic activity in the CA1 region of the hippocampus. J Neurosci. 33 (46), 18319-18330 (2013).
- Tomioka, N. H., et al. Elfn1 recruits presynaptic mGluR7 in trans and its loss results in seizures. Nat Commun. 5, 4501 (2014).
- Jiang, X., et al. Principles of connectivity among morphologically defined cell types in adult neocortex. Science. 350 (6264), 9462 (2015).
- Mishra, A., et al. Imaging pericytes and capillary diameter in brain slices and isolated retinae. Nat Protoc. 9 (2), 323-336 (2014).
- Gabriel, L. R., Wu, S., Melikian, H. E. Brain slice biotinylation: an ex vivo approach to measure region-specific plasma membrane protein trafficking in adult neurons. J Vis Exp. (86), (2014).
- Edwards, F. A., Konnerth, A. Patch-clamping cells in sliced tissue preparations. Methods Enzymol. 207, 208-222 (1992).
- Qi, G., Radnikow, G., Feldmeyer, D. Electrophysiological and morphological characterization of neuronal microcircuits in acute brain slices using paired patch-clamp recordings. J Vis Exp. (95), e52358 (2015).
- Booker, S. A., Song, J., Vida, I. Whole-cell patch-clamp recordings from morphologically- and neurochemically-identified hippocampal interneurons. J Vis Exp. (91), e51706 (2014).
- Madisen, L., et al. A robust and high-throughput Cre reporting and characterization system for the whole mouse brain. Nat Neurosci. 13 (1), 133-140 (2010).
- Hille, B. The permeability of the sodium channel to organic cations in myelinated nerve. J Gen Physiol. 58 (6), 599-619 (1971).
- Martin, M., Chen, B. T., Hopf, F. W., Bowers, M. S., Bonci, A. Cocaine self-administration selectively abolishes LTD in the core of the nucleus accumbens. Nat Neurosci. 9 (7), 868-869 (2006).
- Chen, B. T., et al. Cocaine but not natural reward self-administration nor passive cocaine infusion produces persistent LTP in the VTA. Neuron. 59 (2), 288-297 (2008).
This article has been published
Video Coming Soon
ISSN 1940-087X
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.