Bu içeriği görüntülemek için JoVE aboneliği gereklidir. Oturum açın veya ücretsiz deneme sürümünü başlatın.
Zebra balığı Kalkınma Uzun Süreli Görüntüleme için A yönlü Montaj Yöntemi
Bu Makalede
Özet
Here, we present a versatile mounting method that allows for the long-term time-lapse imaging of the posterior body development of live zebrafish embryos without perturbing normal development.
Özet
Zebra balığı embriyolar nedeniyle erişilebilirlik ve optik şeffaflık kolaylığı karmaşık morfogenetik süreçleri incelemek için ideal bir deneysel sistem sunuyoruz. Özellikle, arka gövde uzama çoklu doku deformasyonları vücut ekseninin büyük bir kısmı oluşumunu yönlendirmek için birlikte hareket hangi embriyonik gelişiminde önemli bir süreçtir. Uzun vadeli time-lapse görüntüleme ile bu süreci gözlemlemek için yeterli destek mikroskop ve iktisap transferi sırasında doğru yönde örnekleri korumak için izin veren bir montaj tekniği kullanmak gerekir. Buna ek olarak, montaj aynı zamanda normal gelişimini etkilemeden arka gövde bölgenin büyümesi için yeterli hareket özgürlüğü sağlamak zorundadır. Son olarak, çeşitli görüntüleme set-up üzerinde görüntüleme izin montaj yönteminin çok yönlülüğü de belirli bir ölçüde olması gerekir. Burada, arka gövde elongatio gelişimini görüntüleme için bir montaj tekniği sunmakn Zebra balığı D. rerio içinde. Bu teknik uzatmak ve normalde geliştirmek için arka gövde bölgeyi dışarı çıkarken, baş ve yolk kesesi bölgeleri neredeyse tamamen agaroz dahildir şekilde embriyoların montaj içerir. Biz bu dik, ters ve dikey ışık sayfalık mikroskopisi set-up için adapte edilebilir gösterecektir. Bu protokol posterior vücut için görüntüleme için embriyolar montaj odaklanırken, kolayca zebrabalıkları gelişmenin birden yönlerini canlı görüntüleme için adapte edilebilir.
Giriş
Arka gövde uzama embriyo vücut eksenine büyük bir kısmını oluşturmak üzere uzandığı tarafından embriyonik gelişiminde önemli bir süreçtir. Bu, birden fazla hücre davranışları Bireysel dokular düzeyinde morfonogenezi oluşturmak için koordineli hareket hangi kompleks morfogenetik işlemin örneğidir. Bu diferansiyel doku deformasyonları sonra bütün yapı düzeyinde posterior vücudun uzamasını oluşturmak için birlikte hareket. Bu süreçler kontrollü ve gelişme sırasında koordine nasıl anlamak için, (moleküller, hücreler, hücre popülasyonlarının ve dokuların düzeyinde yani), birden ölçeklerde bu süreçleri takip etmek gerekir ve tüm yapının morfonogenezi doğrudan ilişkilendirmek için .
optik şeffaflık ve küçük boyutlu minimal invaziv ışık görüntüleme uygulaması için izin verdiği Zebra balığı embriyolar liv için uygundur yaklaşımlar görüntüleme arka gövde uzaması için idealdire görüntüleme. 1 Bu moleküllerin seviyesinde arka gövde gelişimi üzerine ışık tutmuştur son yayınların bir dizi kanıtlanmıştır, 2 adet tek kişilik hücreler, 4 yanı sıra hücre popülasyonu ve tüm organ seviyesinde 3 ve inter-doku davranışları. 5
Böyle konfokal, çoklu foton mikroskopi ve seçici düzlem aydınlatma mikroskobu (SPIM) gibi gelişmiş görüntüleme teknikleri hafif toksisite ve fotoğraf ağartma etkisini azalan gelişim süreçleri uzun vadeli görüntüleme sağlayan vardır. Canlı örneklerin montajı için sağlam teknikler üç hedeflere ulaşmak için gerekli olan: 1) Yeterli destek mikroskop ve satın alma sırasında nakil sırasında doğru yönde örnekleri korumak için, 2) numune hareketinin yeterli özgürlüğü büyümesi için izin vermek için normal devel etkilemeden arka vücut bölgesiopment ve nihayet 3) montaj yönteminin çok yönlülüğü içinde belirli bir dereceye kadar farklı görüntüleme set-up üzerinde görüntüleme izin vermek.
Bu protokol zebrabalıkları D. rerio gelişimini görüntüleme için bir montaj tekniği tanıttı. Bu teknik uzatmak ve normalde geliştirmek için arka gövde bölgeyi terk ederken baş ve yolk kesesi bölgeleri neredeyse tamamen, agaroz dahildir şekilde embriyoların montaj içerir. Bu şekilde, aynı zamanda, agaroz, standart ışık görüntüleme teknikleriyle sokulmuşlardır gelişmekte vücudun diğer bölgelerinde uzun süreli görüntüleme için uygun bir yöntemdir. değiştirici yönlerde embriyolar monte edilmesi de mümkündür, ancak bu protokol, bir yanal yönde embriyoların monte gösterir. Ayrıca, dik ters ve dikey ışık sayfalık mikroskobu kurulumları yöntemi uyarlamak nasıl gösterecektir.
Protokol
1. Çözelti Hazırlanması ve çekti Cam İğne
- 20 mM Tris pH 8.8 içinde 4 mg / mL Tricaine (3-amino-benzoik asit etil ester, aynı zamanda adı etil 3-aminobenzoat) içindeki bir 25x stok çözeltisi yapmak ve bu çözelti, pH 4 mL mağaza tarafından 7. kısım en getirmek -20 ° C.
NOT: anestetik Tricaine böylece kas seğirmesi ve hareketi 6 engelleme nöral voltaj bağımlı sodyum kanalları tercihen hareket eder. - E3 embriyo ortam içinde 0.17 mg / ml'lik bir nihai konsantrasyonda Tricaine bir çalışma çözeltisi yapın. 7
NOT: Bu çözeltinin pH değeri sürüklenir olarak hazırlıksız bir şekilde çalışma çözeltisi Tricaine sağlayın. - Bir mikrodalga fırında çözelti ısıtılarak 50 ml bir tüp içinde E3 embriyo ortamı içinde% 1.5 bir son konsantrasyona kadar düşük erime noktası agaroz eritilir. bir su banyosu ya da tezgah üstü inkübatör ya 45 ° C - bu çözüm 42 muvazene edelim. Dikey için büyük yemekleri hazırlarken eğerIşık sayfalık görüntüleme (adım 4), agaroz E3 embriyo orta% 1 standart erime ek 25 ml yapmak.
- OD 1.20 mm, ID 0.69 mm, uzunluğu 10 mm boyutları ile filaman kılcal damarlar ile borosilikat camını kullanın.
- Keskin forseps bir çift ile Velocity 50, Zaman 225, Basınç 500. 120 çekin, Isı 600, break: kılcal damar Ekipman ve Kimyasalları, aşağıdaki ayarları kullanın Tablo açıklanan ısıtma filament iğne çektirmesi türüne çekilirse sadece noktadan iğne hangi o embriyolar yönlendirici ve aşırı agaroz kaldırmak için temiz ve keskin iğne oluşturmak için esner. Bir mikro-neşter ayrıca aşırı agaroz kaldırmak için kullanılabilir.
Ters çevrilmiş veya Dikey Mikroskopi için Embriyolar 2. gömülmesi
- E3 embriyo orta uygun aşamaya embriyolar yükseltmek. 7
- binoküler dissec altında keskin forseps bir çift ile gerekli aşamada, dechorionate embriyolarting mikroskop.
- Tricaine çözelti içinde en az 5 dakika boyunca dechorionated embriyolar inkübe edin.
- erimiş agaroz çözelti, 45 ° C'ye soğuduktan sonra, E3 orta minimum transfer 50 ml tüp içine doğrudan dechorionated embriyo transferi için bir cam Pasteur pipet kullanın.
- orta montaj yaklaşık 1 ml ile embriyo çıkarın ve yak. 10 mm kuyucuklarda ile 35 mm cam tabanlı petri merkezi daire embriyo ile birlikte montaj orta 100 ul.
- Montaj orta ayar gibi, dışa doğru (Şekil 1A) bakan kuyruğu ile agaroz çemberin kenarına embriyo taşıyın. Jel tamamen ayarlanana kadar istenilen yanal yönde embriyo korumak için kılcal iğne kullanın. görüntü arka gövde gelişimine, mümkün olduğunca yan bir yönde embriyo yönlendirmek için özen gösterin. Bu nedenle, dikkat Farkları bu pozisyonda embriyo muhafazaKılcal iğne ile ts.
Not: gerekirse birden çok embriyo, bu noktada monte kaba ilave edilebilir. Bu durumda, ilk çanak içine agaroz düşük eritebilir aktarmak ve agaroz damla merkezine embriyolar ekleyin. Ardından, cam yüzük kenarlarına embriyoların dışarı itmek ve istenilen pozisyona yolunuzu. Altı embriyolar kadar Agaroz katılaşmış olur önce bu şekilde monte edilebilir.
Arka Gövde Çevresi Fazla Agaroz 3. Kaldırma
NOT: Bu kısım agaroz arka gövde çevresindeki bölge uzaklaştırılır prosedür açıklanmaktadır. Posterior vücut uzama durumunda, kuyruk büyümek-out normalde sağlamak için önemlidir. Embriyo tamamen agaroz ile dahil edildikten sonra agaroz kaldırarak, embriyo baş bölgesi ve yumurta sarısının yaklaşık yarısı tarafından kapalı bırakılır.
- Agaroz açılan donduktan sonra, petri di selTricaine çözelti ile sh.
- iletilen ışık tabanı ile diseksiyon binoküler mikroskop altında, güçlü bir kontrast çalışması yoluyla açıkça görülebilir agaroz kesimler için izin veren şekilde ayna konumunu ve gelen ışığın açısını ayarlamak.
- Kesme gerçekleştirmek için 1 (Şekil 1), sadece hücre gruplarının 5 (5. pozisyonuna oluşturucu kalp alanına posterior pozisyonda sarısı üzerinde agaroz orta yol kesmek için Kılcal iğne veya mikro-neşter kullanmak ön somite).
- gösterildiği gibi şekillendirme kalbe komşu ilk kesim ve cama agaroz üzerinden tam bir şekilde başlayın.
- Yukarı gördüm ve Şekil 1 gösterildiği gibi embriyo üzerinde uzun bir kesim yapmak için başlayan ederken aşağı yavaşça derin agaroz içinde kılcal veya mikro-neşter tutmak ve. embriyo ya da yumurta sarısı delmeden mümkün olduğunca embriyo yakın kesti.
- Daha sonra, hale kesikler 2 ve 3 (Şekil 1 ), Embriyo karşı konumundan ve cam tüm yol aşağı gidiş kesim ile başlayan dipli çanak. ilk 5 Somitlerin teğet olacak şekilde arka gövdesinin tamamen ortaya dorsalward için izin, 2 kesim yapın. sarısı yüzeyi ile 90 ° açıyla 3 kesilir ve Heartfield'le başlayarak olun.
Not: tam blok (adım 3.6) halinde agaroz giderilmesinde yardımcı (Şekil 1 'de gösterildiği gibi), cam dairenin kenarında kadar agaroz kesilmesi. Ancak, bu gerekli değildir. - kesikler 1 ve 3 kesiştiği noktada başlayarak, yavaş yavaş arka gövdesini çevreleyen agaroz kare çıkarmak için yukarı doğru kaldırarak ederken kesim 2 sonuna doğru yavaş bir çapraz kesim yapmak.
Notlar: Bazı durumlarda, bu tek bir blok çıkacak ve işlem bir hareket içinde tamamlanır. Diğerlerinde, bu dis-lodge embriyoyu çevreleyen tüm agaroz birkaç deneme alabilir. - Keskin forseps bir çift ile, yerinden b kaldırmakEmbriyo ortamından agaroz kilitler. Bu süreçte yardımcı yemeğin yanına agaroz parçaları taşımak ve agaroz parçaları kaldırarak ederken destek olarak petri duvarını kullanmak için.
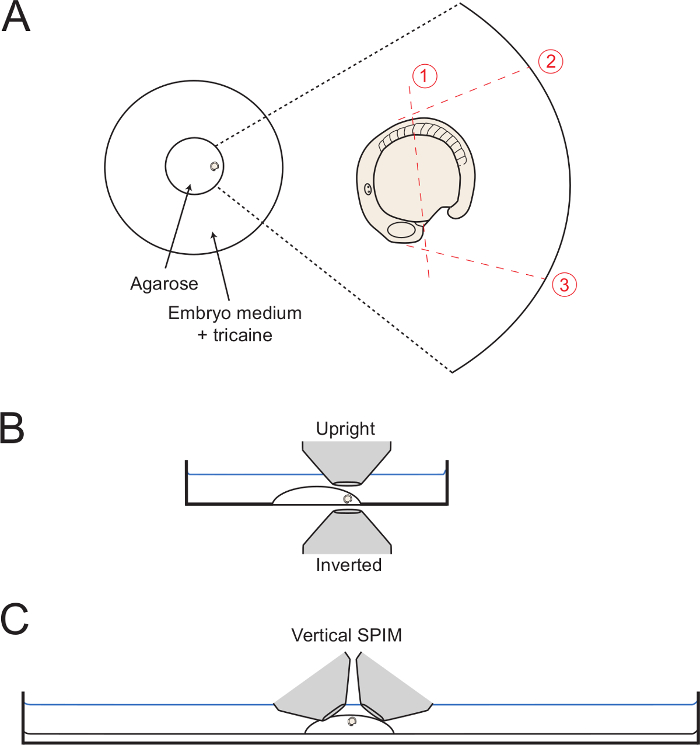
Şekil 1: Montaj Set-up Diyagramları. (A) Diyagram, bir petri çanağı içinde merkezi bir cam halka içinde monte edilen embriyo konumunu göstermektedir. Sağ tarafta agaroz dottted kırmızı çizgilerle gösterilen çevreleyen yoluyla birbirini izleyen kesim ile embriyo bir zoom. (B) monte embriyolar hem ters ve dik hedefleri için erişim kolaylığı göstererek yan görünümde diagrammed olduğunu. (C) embriyolar dikey ışık levha görüntüleme set-up için monte edilebilir gösteren benzer bir digram. cl LütfenBu rakamın büyük halini görmek için buraya ick.
- kas seğirmesi tam bu noktada bloke değilse, 4 mg / ml, pH 7 stok çözeltisinden Tricaine damla ekleyin.
4. Dikey Işık sayfalık Mikroskopi için Embriyolar montajı
NOT: Bu yukarıda özetlenen yönteme bir varyasyon dikey odaklı SPIM tarafından örneklerin görüntüleme için birden hedeflerin erişim sağlar olduğunu. Bu varyasyon arkasındaki fikir, iki görüntüleme hedeflerinin kolay erişim sağlamak için, çanak alt biraz daha yüksek örnek asansör etmektir.
- montaj örneği önce, kaplama 5 mm bir yüksekliğe E3 ortam içinde% 1 agaroz ile 100 mm'lik bir plastik Petri tabağı ve set sağlar.
- çanağın merkezine 1 mi, düşük erime noktasına sahip agaroz bir damla yerleştirin ve ayarlamak için olanak sağlar.
- Ancak bölüm 2'de gibi düşük erime noktalı agaroz yerleştirme embriyolar, bu kez 50 ml tüp embriyo kaldırmakagaroz çözeltisi (0.5 mi) daha küçük bir damla ve çanağın ortasında açılan ml 1 üstünde, bu küçük bir damla yerleştirin.
- küçük bir damla merkezinde embriyo yerleştirin ve jel set kadar onun doğru yönünü korumak için kılcal iğne kullanın.
- Tricaine çalışma solüsyonu ile çanak sel ve 3. bölümde olduğu gibi ancak% 1 standart agaroz yastık yoluyla kesmeden aşırı agaroz çıkarın.
Sonuçlar
Yukarıda özetlenen protokol uzun vadeli time lapse görüntüleme için zebra balığı embriyolarının montajı için çok yönlü bir teknik ayrıntıları. Bunun bir örneği, Şekil 2A ve / görüntü, Şekil 1 'animasyon gösterilir. Embriyolar mRNA photoconvertible floresan protein kikumeGR kodlayan 1 hücre aşamasında enjekte edilmiştir. 10X objektif bir ters konfokal mikroskop, yukarıda tarif edilen ve 12 saat boyunca görüntülenmiş...
Tartışmalar
Bu montaj tekniği embriyoların mikroskop ve çoklu uzunluk ölçeklerinde arka gövde uzama aşağıdaki amaçlayan üzerinde uzun vadeli zaman atlamalı görüntüleme deneyleri transferi sırasında hareketsiz tutulması sağlar. her iki dik olarak ters çevrilmiş mikroskop set up üzerinde görüntüleme sağlar ve bir öneri, bu daha dikey yönlendirilmiş SPIM uyarlanabilir nasıl yapılması ile Ayrıca, çok yönlüdür.
Bu protokol kritik bir adım, bu yapının normal gelişimini...
Açıklamalar
The authors have nothing to disclose.
Teşekkürler
Estelle Hirsinger: Core funding from the Institut Pasteur and Agence Nationale de la Recherche (ANR-10-BLAN-121801 DEVPROCESS). Estelle Hirsinger is from the Centre National de la Recherche Scientifique (CNRS). Benjamin Steventon was funded by the Agence Nationale de la Recherche (ANR- 10-BLAN-121801 DEVPROCESS), then a Roux fellowship (Institut Pasteur) then an AFM-Téléthon fellowship (number 16829). He is now supported by a Wellcome Trust/Royal Society Sir Henry Dale Fellowship.
Malzemeler
| Name | Company | Catalog Number | Comments |
| CONSUMABLES | |||
| Glass-bottomed dishes | Mattek | P35-1.5-10-C | 35mm petri dish, 10mm microwell. No. 1.5 cover glass |
| Capillaries for injection needles | Sutter | BF 120-94-10 | We use orosilicate glass with filament, OD 1.20 mm, ID 0.94 mm, length 10 cm. However, filament needles are not necessary and most injection standard needles should work. |
| Micro-scalpel | Feather | P-715 | Micro Feather disposable opthalmic scalpel with plastic handle |
| Pasteur Pipettes | 230 mm long | ||
| REAGENTS | |||
| Tricaine | Sigma-Aldrich | A5040 | |
| Low-melting point agarose | Sigma-Aldrich | A9414 | |
| EQUIPMENT | |||
| Fine forceps | FINE SCIENCE TOOLS GMBH | 11252-30 | Dumont #5 |
| Needle puller | Sutter | P97 | Heating-filament needle puller |
| Binocular dissecting microscope | Leica | S8 Apo |
Referanslar
- Graeden, E., Sive, H. Live Imaging of the Zebrafish Embryonic Brain by Confocal Microscopy. J Vis Exp. (26), e1-e2 (2009).
- Delaune, E. A., François, P., Shih, N. P., Amacher, S. L. Single-Cell-Resolution Imaging of the Impact of Notch Signaling and Mitosis on Segmentation Clock Dynamics. Dev Cell. 23 (5), 995-1005 (2012).
- Lawton, A. K., et al. Regulated tissue fluidity steers zebrafish body elongation. Development. 140 (3), 573-582 (2013).
- Dray, N., et al. Cell-Fibronectin Interactions Propel Vertebrate Trunk Elongation via Tissue Mechanics. Curr Biol. 23 (14), 1335-1341 (2013).
- Steventon, B., et al. Species tailoured contribution of volumetric growth and tissue convergence to posterior body elongation in vertebrates. Development. 143, 1732-1741 (2016).
- Attili, S., Hughes, S. M. Anaesthetic Tricaine Acts Preferentially on Neural Voltage-Gated Sodium Channels and Fails to Block Directly Evoked Muscle Contraction. PLoS ONE. 9 (8), 103751-103756 (2014).
- Westerfield, M. . The Zebrafish Book, 5th Edition; A guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Schröter, C., et al. Dynamics of zebrafish somitogenesis. Dev Dyn. 237 (3), 545-553 (2008).
- Megason, S. G. In toto imaging of embryogenesis with confocal time-lapse microscopy. Methods Mol Biol (Clifton, N.J.). 546, 317-332 (2009).
- Sugiyama, M., et al. Illuminating cell-cycle progression in the developing zebrafish embryo. PNAS. 106 (49), 20812-20817 (2009).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiDaha Fazla Makale Keşfet
This article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır