Quantifier les cellules microgliales morphologie de microphotographies d’immunohistochimie préparé des tissus à l’aide de ImageJ
In This Article
Summary
Les microglies sont des cellules immunitaires du cerveau qui enquête et réagissent à la physiologie du cerveau altéré par des modifications morphologiques qui peuvent être évalués quantitativement. Ce protocole décrit un ImageJ base protocole d’analyse pour représenter la microglie morphologie comme continue des données selon des indicateurs tels que la ramification de la cellule, la complexité et la forme.
Abstract
Les microglies sont des phagocytes de cerveau qui participent à l’homéostasie du cerveau et d’enquête en permanence leur environnement pour dysfonctionnement, les blessures et la maladie. Comme les premiers intervenants, la microglie ont des fonctions importantes pour atténuer la dysfonction neurone et cellule gliale, et dans ce processus, ils subissent un large éventail de modifications morphologiques. La microglie morphologies peuvent être classés de manière descriptive ou, alternativement, peuvent être quantifiés comme une variable continue des paramètres tels que la ramification de la cellule, la complexité et la forme. Méthodes pour quantifier les cellules microgliales sont appliquées à des cellules individuelles, peu de techniques s’appliquent aux multiples microglies dans un ensemble photomicrographie. Cette méthode vise à quantifier les multiples et des cellules individuelles à l’aide de protocoles de ImageJ facilement disponibles. Ce protocole est un résumé des étapes et plugins ImageJ recommandé pour convertir les images binaires et squelettisés représentant photomicrographies fluorescence et lumineux-zone et de les analyser à l’aide de logiciels plugins AnalyzeSkeleton (2D/3D) et FracLac pour la collecte de données de morphologie. Les sorties de ces plugins résument la morphologie cellulaire en ce qui concerne les points finaux de process, jonctions et longueur ainsi que complexité, la forme des cellules et des descripteurs de taille. Le protocole d’analyse squelette décrit ci-après est bien adapté pour une analyse régionale des microglies multiples au sein d’un ensemble photomicrographie ou d’une région d’intérêt (ROI), tandis que FracLac fournit une analyse de cellules individuelles complémentaires. Combinés, le protocole prévoit un objectif, un outil d’évaluation sensibles et complète qui peut être utilisé pour stratifier entre microglie diverses morphologies présentes dans le cerveau en bonne santé et blessé.
Introduction
La microglie ont une réponse morphologique immédiate et diverse altérations dans cerveau physiologie1 selon un continuum de possibilités allant de morphologies hyper-ramification et extrêmement complexes aux morphologies hors ramifiés et amiboïdes2 . La microglie peut-être aussi devenir polarisée et bâtonnets3. Ramification de cellules de la microglie est communément définie comme une forme complexe ayant plusieurs processus et est souvent rapportée que le nombre de points de terminaison par cellule et la longueur des prolongements cellulaires. Puisque les microglies sont finement réglé à fonction neuronale et gliale et cellules continue diaphonie et in vivo la motilité4,5, microglie morphologies pouvant servir comme indicateurs de fonctions cellulaires variés et dysfonctionnements dans le cerveau. Une approche quantitative est nécessaire pour décrire adéquatement la diversité de ces modifications morphologiques et de distinguer les différences entre les cellules ramifiées qui se produisent avec subtiles perturbations physiologiques (tels que l’épilepsie5,6 et7de la commotion cérébrale) en plus de blessures brut (par exemple, accident vasculaire cérébral,8). Une utilisation accrue de morphologie quantification7,8,9,10,11,12,13,14 révélera toute la gamme des microglies morphologies au cours de la santé et la maladie. La présente étude détails l’utilisation progressive des plugins ImageJ nécessaire de résumer les microglies morphologie de fluorescents ou non fluorescent photomicrographies des microglies acquis dans les tissus de rongeurs fixe après l’immunohistochimie (IHC).
Centrale pour les techniques d’analyse décrites ici sont le ImageJ plugins AnalyzeSkeleton (2D/3D)15, développé en 2010 afin de quantifier les grandes structures mammaires et FracLac16, développé en 2014 pour intégrer l’analyse ImageJ et fractale à quantifier les formes individuelles de la microglie. Ces plugins fournissent une analyse rapide de la ramification de la microglie dans photomicrographies entières ou plusieurs cellules microgliales d’un retour sur investissement défini dans une microphotographie. Cette analyse peut être utilisée seul ou en complément avec l’analyse fractale. L’analyse fractale de cellule unique (FracLac) nécessite un investissement de temps mais offre plusieurs sorties de morphologie au sujet de la complexité de la microglie, forme et taille. L’utilisation de ces deux outils n’est pas superflue, comme cellule de ramification est complémentaire à la complexité de la cellule et la combinaison de plusieurs paramètres peut-être servir à distinguer les microglies diverses morphologies dans datasets12,17.
Protocol
Toutes les expériences ont été approuvés par et interprétés conformément aux directives établies par l’Université de l’Arizona institutionnels animalier et utiliser Comité et les NIH guidelines pour le soin et l’utilisation des animaux de laboratoire. Il a pris soin de minimiser l’inconfort et la douleur animale. Méthodes d’euthanasie sont selon un protocole approuvé et se composent de décapitation cervicale sous anesthésie isoflurane.
1. préparation du tissu
NOTE : Procéder de la microglie morphologie analyse sur des échantillons de tissus cryoprotected fixe, afin de préserver la morphologie cellulaire. Ce qui suit est un protocole standard utilisé pour préparer et découper directement des tissus fixes pour fluorescence IHC.
- Supprimer les cerveaux de souris ou de rats provenant d’un animal euthanasié après l’expérience souhaitée et selon un protocole standard de laboratoire. Placer le cerveau dans un flacon de 10 mL contenant 5 mL d’une solution de paraformaldéhyde de 4 % pendant 24 h à 4 ° C. Puis rincer et placer dans 5-10 mL d’un phosphate saccharose 30 % solution (PBS, 0,01 M) pendant 72 h tamponnée à 4 ° C. Stocker des cerveaux tout à-80 ° C jusqu'à ce que le tissu sectionnant avec un cryostat, ou à 4 ° C si sectionnement avec un microtome.
Remarque : Ce protocole n'a pas encore été testé à l’aide de tissus en tranches de tissus inclus en paraffine. - Section du tissu cérébral de l’épaisseur de coupe désirée et l’orientation à l’aide de sections flottantes soit un cryostat ou microtome et ranger dans une solution de cryoprotection (50 mM PBS, éthylène glycol, glycérol) à-20 ° C.
Remarque : Ce protocole a été réalisé avec succès sur des sections de tissu coronale allant de 50 µm à 200 µm d’épaisseur. Des sections de tissu moins que 50 µm ne peut pas capturer l’étendue complète des processus de la microglie, tandis que dans des sections de tissu épais, IHC coloration peut être imparfaite due à la pénétration des anticorps dans le tissu. Le tissu peut être soit sectionnée dans un coronale ou sagittale orientation et ce choix dépendra l’ou les régions objectif et cerveau expérimentale à étudier.
2. immunohistochimie
Remarque : Les méthodes d’analyse de squelette et fractale peuvent être appliqués à fluorescence ou 3, IHC 3′-diaminobenzidine (DAB). Ce qui suit est un protocole standard de fluorescence d’IHC et peut-être être substitué au besoin. Fluorescence IHC rendements supérieure visualisation des prolongements cellulaires comparativement aux DAB IHC.
- Les sections de tissu dans un flacon de verre de 4 mL (cerveau des souris jusqu'à 15 sections/flacon) et incuber 1 ml de solution contenant jusqu'à 10 % de sérum de cheval, PBS (0,01 M), 0,5 % Triton, 0,04 % NaN3 à température ambiante (23 ° C) pendant 1 h.
- Laver pendant 5 min avec du PBS (0,01 M) trois fois à la température ambiante.
- Incubation avec l’anticorps primaire (Iba1, 1:1, 000) à température ambiante pendant 72 h dans 1 mL de solution contenant PBS (0,01 M), 0,5 % Triton, 0,04 % NaN3et couvert (pour préserver l’efficacité de3 NaN).
- Laver pendant 5 min avec du PBS (0,01 M) trois fois à la température ambiante.
- Incubation avec l’anticorps secondaire (anti-lapin 488, 1/250) couvert à température ambiante pendant 4 h dans 1 mL de solution contenant PBS (0,01 M), 0,5 % Triton, 0,04 % NaN3
- Laver pendant 5 min avec du PBS (0,01 M) trois fois à la température ambiante.
- Monter les sections de tissu de cerveau (nombre et orientation basée sur la préférence) aux diapositives subbed, appliquer un milieu de montage soft-set à la diapositive et placez la lamelle sur le tissu. Stocker les lames à 4 ° C.
Remarque : Il faut une épaisseur de lamelle de 1,5 verre pour l’imagerie confocale. Soft-set est un milieu de montage préféré parce que la viscosité élevée ne compresse pas le tissu et meilleur conserve la morphologie par rapport aux supports de montage fixe.
3. imagerie
- Image Iba1 cellules positives dans la section de tissu de cerveau en utilisant un microscope lumineux-zone ou confocal ayant une capacité d’acquisition de z-pile à l’aide d’un 20 X objective ou plus.
Remarque : Paramètres et du logiciel d’imagerie doit être constante pour toutes les acquisitions de la photomicrographie lors d’une expérience. Détail excellent processus est obtenue à l’aide d’un 40 X ou 63 X objectif. Il est possible d’appliquer le protocole d’analyse squelette décrit ci-après pour une microphotographie entière ou un retour sur investissement de plusieurs cellule dans une plus grande microphotographie.- Acquisition d’images 8 bits en utilisant les paramètres logiciels appropriés spécifiques au logiciel de microscope.
Remarque : La conversion de fichiers à 8 bits postérieure à l’acquisition peut fausser la collecte de données. - Acquérir au moins un tapis z 30 µm avec pas plus d’un intervalle de 2 µm entre les images en utilisant les paramètres logiciels appropriés spécifiques au logiciel de microscope.
Remarque : Le microscope et le logiciel doivent permettre une acquisition d’images dans un axe X, Y et Z. Une z-pile peut être augmentée, et l’intervalle peut être diminuée pour fournir des détails supplémentaires de la microglie. En échange, imagerie temps augmentera. Utilisez l’échantillonnage Nyquist lorsque c’est possible pour la microscopie de fluorescence.
- Acquisition d’images 8 bits en utilisant les paramètres logiciels appropriés spécifiques au logiciel de microscope.
- Enregistrez tous les fichiers comme des fichiers Tif ou tel que requis par le logiciel de microscope.
- Ouvrez les fichiers Tif dans ImageJ et utiliser la barre d’outils pour diviser les canaux en cliquant sur Image | Couleur | Canaux Splitet empiler les images en cliquant sur Image | Piles | X le projet | Projection d’intensité maximale le cas échéant. Enregistrer en tant que fichiers .tif.
4. squelette analyse
- Télécharger Fidji ou ImageJ du < https://imagej.net/Fiji/Downloads>. Pour les plugins individuels, veuillez télécharger AnalyzeSkeleton(2D/3D) de < http://imagej.net/AnalyzeSkeleton>15 et télécharger FracLac de < https://imagej.nih.gov/ij/plugins/fraclac/fraclac.html>16.
Remarque : L’ensemble du processus de la conversion une microphotographie d’une image binaire squelette prend moins de 1 min. - Si vous utilisez une microphotographie de fluorescence, assurez-vous que l’image est 8 bits et convertir en niveaux de gris pour mieux visualiser une coloration positive tous. Utilisez la barre d’outils, puis cliquez sur Image | Tables de choix | Gris. Si vous utilisez une photographie de lumineux-zone DAB, première utilisation le passe-bande FFT filtre plugin (à l’aide de la barre d’outils en cliquant sur processus | FFT | filtre passe-bande) et ensuite de les convertir en niveaux de gris.
NOTE : Aux fins du présent protocole, ImageJ par défaut pour un filtre passe-bande de FFT est suffisante (filtre jusqu'à 3 pixels, jusqu'à 40, aucune suppression de bande). Application d’un filtre passe-bande FFT supprime les bruits (petits éléments) tout en préservant les aspects dans l’ensemble plus grands de l’image. Ceci est particulièrement utile dans des images de champ lumineux, où se divise et fissures dans les tissus peuvent apparaître comme toile de fond et donc compliquer l' analyse squelette18. - Ajuster la luminosité et le contraste si l’image est trop sombre et le processus de la microglie ne peut être visualisé. Utilisez la barre d’outils, puis cliquez sur Image | Ajuster | Luminosité/contraste. Réglez les curseurs minimales ou maximales selon les besoins, jusqu’aux bords de l’histogramme, mais pas plus de précisions.
Remarque : Dans ImageJ, luminosité et le contraste sont changées en mettant à jour la table de choix de l’image (LUT), alors les valeurs de pixel sont inchangées. Max et min curseurs contrôlent les limites inférieures et supérieures de la plage d’affichage, avec les valeurs de pixel au-dessus de 255 apparaissant blanche et pixel au-dessous de 0 apparaissant noir18. Dans le cas des microphotographies de fluorescence, le curseur maximal doit être utilisé, alors que le curseur minimal sera utilisé pour photomicrographies DAB teinté la microglie. - Un filtre d’accentuation pour augmenter encore plus le contraste à l’aide de la barre d’outils en cliquant sur processus | Les filtres | Masque flou. Aux fins du présent protocole, les paramètres par défaut de ImageJ (un rayon de pixel de 3 et masque poids 0,6) sont utilisés.
Remarque : Le masque flou aiguise et améliore les fonctionnalités de bord d’une image en soustrayant une version floue de l’image (masque flou) de l’original et ensuite de fusionner l’image obtenue avec une version fort contraste de l’image originale. Par conséquent, le filtre Accentuation ne crée pas de détails, mais plutôt précise le détail existant dans une image. Le rayon affectant les modifications comment floues l’accentuation sera (et donc combien flou disparaît), et le poids du masque définissant des changements du degré de contraste qui sera fusionné avec le masque flou (et donc permet d’ajuster le contraste de l’image finale). - Exécuter une étape de nettoyer pour enlever le poivre bruit généré par l’accentuation. Utilisez la barre d’outils, puis cliquez sur processus | Bruit | Nettoyer.
NOTE : Nettoyer supprime les bruits poivre en remplaçant chaque pixel avec la valeur médiane dans son quartier de 3 × 3. L’effet est que valeurs aberrantes en intensité sont remplacés par le pixel médian sans affecter la netteté des bords,18. - Convertir l’image binaire à l’aide de la barre d’outils en cliquant sur Image | Ajuster | Seuil de.
NOTE : Seuillage stratifie les images en niveaux de gris en présentant un intérêt par rapport à fond et convertit l’image en binaire18. - Appliquer le déparasitage, proche-et de supprimer des fonctions de valeurs aberrantes : dans l’image binaire résultante, il peut y avoir bruit de fond simple pixel et les lacunes entre les processus.
- Appliquez la fonction nettoyer à l’aide de la barre d’outils en cliquant sur processus | Bruit | Nettoyer.
Remarque : Appliquer déparasitage vers le fichier binaire image supprime tout bruit de pixels restant. - Appliquez la fonction étroite à l’aide de la barre d’outils en cliquant sur processus | Binaire | Proche.
NOTE : Ce plugin permet de connecter deux pixels foncés s’ils sont séparés par des pixels jusqu'à 2. - Appliquer la fonction de valeurs aberrantes de supprimer à l’aide de la barre d’outils en cliquant sur processus | Bruit | Supprimer les valeurs aberrantes.
NOTE : Aux fins du présent protocole, valeurs aberrantes lumineux sont ciblés avec un rayon de pixel de 2 et un seuil de 50. Ce plugin remplace un pixel de valeur aberrante claire ou sombre par les pixels médians dans les environs, si elle s’écarte de plus d’une certaine valeur (le seuil)18.
- Appliquez la fonction nettoyer à l’aide de la barre d’outils en cliquant sur processus | Bruit | Nettoyer.
- Enregistrez l’image dans un fichier séparé pour les futures analyses d’utilisation et/ou de la fractale et skeletonize l’image en utilisant la barre d’outils en cliquant sur processus | Binaire | Skeletonize.
- Sélectionnez l’image squelette et exécutez le plugin AnalyzeSkeleton(2D/3D) à l’aide de la barre d’outils en cliquant sur Plugins | Squelette | Analyser le squeletteet en vérifiant la boîte d’Information de la direction générale.
Remarque : Il est probable que le traitement de l’image nécessite optimisation avec l’ajout ou la suppression des étapes suggérées ci-dessus. Dans ce processus, images squelettisés sont évalués pour une précision en créant une superposition de squelette et de l’image originale. Somas devraient être seule origine points avec processus émanant du centre ; somas circulaires confondent les données et doivent être évitées au moyen d’ajustement du protocole. Un exemple d’un point unique origine versus circulaires somas est illustré à la Figure 1.
Problèmes communs résultant en squelettes non représentatif et proposé des solutions :
- Image trop sombre : convertir en niveaux de gris, ajuster les curseurs de luminosité/contraste ou appliquer le masque flou
- Trop d’arrière-plan : ajuster les curseurs de luminosité/contraste, appliquer déparasitage et/ou supprimer des valeurs aberrantes
- Somas circulaires en image squelette (particulièrement pour les images de fluorescence) : appliquer filtre passe-bande FFT, et/ou masque flou
- Fissures dans les tissus (en particulier pour les images de lumineux-zone) : appliquer filtre passe-bande FFT, et/ou nettoyer
- Copier toutes les données à partir des résultats et informations de branche sorties et collez les données dans une feuille de calcul Excel.
- Dans Excel, découper les données afin d’éliminer les fragments de squelette qui résultent de l’acquisition d’IHC et d’image.
- Dupliquez le classeur d’expérience avec la sortie de données brutes de squelette analyse et ajouter la garniture au nom de fichier. Découpage des données ultérieures tous devrait avoir lieu dans le classeur dupliqué pour préserver les données brutes pour une utilisation future et de référence.
- Déterminer la longueur des fragments est supprimé à partir du dataset en ouvrant l’image squelette dans ImageJ et en sélectionnant l’outil de ligne. Mesurer plusieurs fragments, compte tenu de la durée moyenne et définir une valeur seuil.
Remarque : Pour l’application des données présentées ici, la longueur tombée fragments indésirables est de 0,5. Cette valeur doit être cohérente tout au long d’un dataset. - Custom trier la feuille de calcul Excel par en cliquant sur Trier et filtrer | Tri personnalisé. Trier par « point de terminaison voxels » du plus grand au plus petit et un nouveau niveau, par « Mx branche pt » du plus grand au plus petit.
- Supprimez chaque ligne contenant 2 points de terminaison avec une longueur maximum des branches inférieures à la valeur seuil (i.e., 0,5). Somme des données dans la colonne de points de terminaison pour calculer le nombre total de points de terminaison recueillis dans l’image.
- Répéter pour les données d’information Branch : Trier par « longueur de la branche » du plus grand au plus petit. Faites défiler les données et supprimer tous les rangs qui a une longueur de la branche inférieure à la valeur seuil(i.e., 0,5). Somme des valeurs dans la colonne longueur pour calculer la longueur cumulée de toutes les branches prélevés dans l’image.
- Répétez les étapes 4.11.3-4.11.5 pour chaque image/feuille jusqu'à ce que toutes les données ont été taillées et additionnées.
- Diviser les données de chaque image (additionnées de nombre de points de terminaison et a résumé la longueur des branches) par le nombre de cellules microgliales somas dans l’image correspondante. Entrez les données finales (direction et points de terminaison/cellule longueur/cellule) dans un logiciel de statistique.
NOTE : Les données de longueur/cellule de somme direction peuvent exiger la conversion de longueur en pixels en microns.
5. analyse fractale
Remarque : FracLac est en mesure d’exécuter un certain nombre d’analyses de forme différente qui ne sont pas couverts par le présent protocole. Pour une explication plus détaillée des FracLac de diverses fonctions, consulter le manuel de FracLac à < https://imagej.nih.gov/ij/plugins/fraclac/FLHelp/Introduction.htm> et références associées 2,16,19. Analyse fractale utilise les étapes du protocole 4.1 à 4.7 décrit ci-dessus.
- Déterminer la taille du ROI qui sera utilisé pour toute analyse fractale. Utilisez l’outil rectangle pour dessiner le ROI. Assurez-vous que la boîte est assez grande pour capturer toute la cellule et peut rester cohérente dans l’ensemble du dataset.
Remarque : Utiliser la sélection rectangle plutôt que la sélection à main levée pour s’assurer que tous les ROIs sont le même rectangle de taille, et par conséquent, les cellules ont la même échelle. Ce ne serait pas le cas si la sélection à main levée ont été utilisée parce que ImageJ sera auto-échelle un ROI carré pour s’adapter à différentes fenêtres rectangulaires de tailles résultant dans des cellules avec des échelles différentes. Alors que les formes fractales sont indépendants d’une échelle, le processus d’analyse fractale en utilisant FracLac pour ImageJ est tributaire de l’échelle16. Ainsi, il y a la nécessité d’un retour sur investissement de taille constamment tout au long de la collecte de données. - Choisir au hasard les microglies pour analyse fractale dans chaque photomicrographie et image binaire correspondant. Dans la fenêtre Gestionnaire de ROI, sélectionnez mise à jour pour verrouiller le ROI sur la position de la cellule. Utilisez Ctrl + Shift + D pour dupliquer la zone dans le retour sur investissement dans une nouvelle fenêtre et enregistrez la cellule recadrée. Sur l’image binaire correspondant (à partir de l’analyse du squelette), dupliquez la zone avec la même cellule en utilisant le gestionnaire de ROI. Répétez jusqu'à ce qu’un nombre suffisant de cellules ont été choisi au hasard pour analyse fractale et enregistrer tous les fichiers.
Remarque : Un générateur de nombres aléatoires et une grille numérotée peuvent servir à sélectionner au hasard des cellules. - Ouvrez l’image binaire avec la cellule individuelle. Double-cliquez sur l’outil Pinceau, définir la couleur au noir et ajuster la largeur de la brosse selon les besoins. La photomicrographie correspondant en utilisant comme référence, utilisez le pinceau pour supprimer les processus de la cellule adjacente, connecter les processus fragmentées et isoler les cellules d’intérêt. Une fois que la cellule binaire a été isolée, enregistrez le fichier binaire.
NOTE : Holding « alt » passera le pinceau de la couleur de premier plan (noir) à la couleur d’arrière-plan (blanc). - Convertir la cellule binaire à un contour à l’aide de la barre d’outils via processus | Binaire | Plan.
Remarque : FracLac pour Image J peut être utilisé sur des formes solides ou forme souligne, toutefois, convention actuelle est d’utiliser la forme décrit16. - Dans la barre d’outils, ouvrez FracLac à l’aide de la barre d’outils en cliquant sur Plugins | Analyse fractale | FracLac et sélectionnez BC (boîte compteur). Dans les paramètres de la Grille de Design , la valeur Num G 4. Sous options de graphique , cochez la case de mesures visant à analyser l’enveloppe convexe et le cercle englobant de la cellule. Lorsque vous avez terminé, sélectionnez OK.
NOTE : Num G est le nombre de zone de comptage des orientations de grille utilisées lors de l’analyse et la plage recommandée pour Num G 4-12. Le paramètre Num G et la fourchette proposée est examiné à fond dans le manuel de FracLac16. Augmentant le Num G peut considérablement ralentir calcul. FracLac paramètres suffit à mettre en place une fois par session. Une fois que les paramètres entrés, le bouton Scan deviendront disponible. - Sélectionnez le bouton Scan pour scanner boîte-compteur sur l’image sélectionnée.
NOTE : Le scan va générer trois fenêtres avec des sorties de données : coque et cercle résultats, comte de la boîte de résumé fichier et Types de Scan. La fenêtre de Scan Types contienne un journal des paramètres utilisés, déviations ainsi en standard pour certaines mesures. Aux fins du présent protocole, la fenêtre Types de Scan n’est pas utilisée et peut être fermée ou enregistrée pour référence ultérieure. - Dans la fenêtre de la coque et les Résultats de cercle , copier des données tout désirées (i.e., densité, le rapport travée et circularité) résultats. Dans la fenêtre Résumé du nombre de boîte , copiez les données souhaitées (i.e., dimension fractale et lacunarité) des résultats. Transférer les données copiées dans un fichier Excel ou le logiciel statistique.
NOTE : Une liste complète de le FracLac sortie des données sont fournies et bien expliquées dans le FracLac pour ImageJ manuel16.
Representative Results
Les protocoles d’analyse de la morphologie microglie décrits ci-après résument les étapes utiles dans le traitement des fluorescentes et microphotographies DAB pour analyse morphométrique. Ces étapes sont visuellement résumées dans la Figure 2 et Figure 3. L’objectif de ces mesures est de créer une image représentative de binaire et squelette qui modélise correctement la photomicrographie original telles que les données recueillies sont valides. Après l’application du protocole, le plugin AnalyzeSkeleton génère une image squelette marquée dont le nombre de points de terminaison et branche (i.e., processus) lengthcan être résumé à partir des fichiers de sortie qui en résulte. Points de terminaison et traiter les données de longueur sont ensuite utilisées pour estimer l’étendue de la ramification des microglies dans la photomicrographie ou le retour sur investissement. Figure 4 résume les données qui en résulte (points de terminaison/cellule et processus longueur/cellule) recueillies avec et sans l’application du protocole. Alors que des tendances similaires existent, les données résumées dans la Figure 4F sont moins variables que celles de la Figure 4E. En outre, ces données montrent une sensibilité accrue pour détecter les différences entre les groupes lorsque le protocole est appliqué. Enfin, les soins doivent être prises concernant la variabilité inter-utilisateur dans l’application du protocole. Ces différences sont résumées par la Figure 5 où le même ensemble de données a été analysé par deux utilisateurs indépendants selon un protocole identique résumées ci-dessus.
Morphologie supplémentaires données proviennent de cellules individuelles isolées à partir des images binaires créés lors de l’application du protocole. Les étapes du protocole pour analyser la morphologie des microglies avant et en utilisant le plugin FracLac sont résumées dans la Figure 6. Nous illustrons cette analyse dans les deux blessés (Figure 6 a) et blessé des tissus (Figure 6 b). Images représentatives du binaire, décrite, convexe coque/encapsulation cercle et case comptage des exemples pour chaque cellule analysée avec et sans le protocole application sont indiquées dans la Figure 6–F. Ces images aident à illustrer les origines des différences dans les données de morphologie qui sont résumées dans la Figure 6.
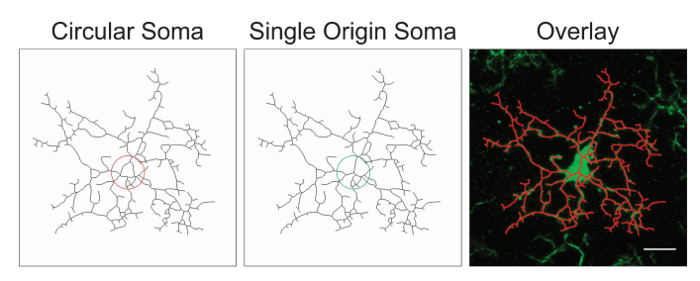
Figure 1. Illustrations des microglies squelette avec un circulaire soma (sous-optimal) versus un soma de même origine (optimal) et la superposition correspondante entre la cellule de squelette et la photomicrographie original. Echelle = 10 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
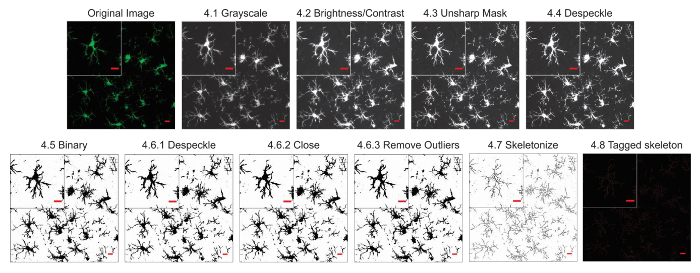
Figure 2. Protocole d’application de microphotographies fluorescents. Illustrations du protocole squelette analyse appliqué à une microphotographie fluorescente avec une seule cellule recadrée pour afficher les détails. Echelle = 10 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
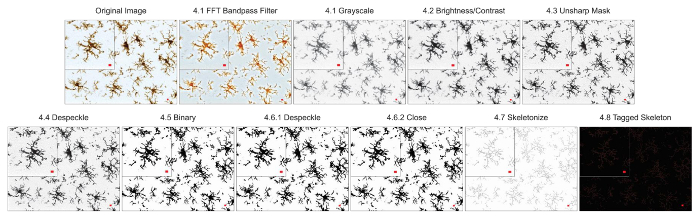
Figure 3. Application du protocole de lumineux-zone DAB photomicrographies. Illustrations du protocole squelette analyse appliqué à une microphotographie DAB lumineux-zone avec une seule cellule recadrée pour afficher les détails. Echelle = 10 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
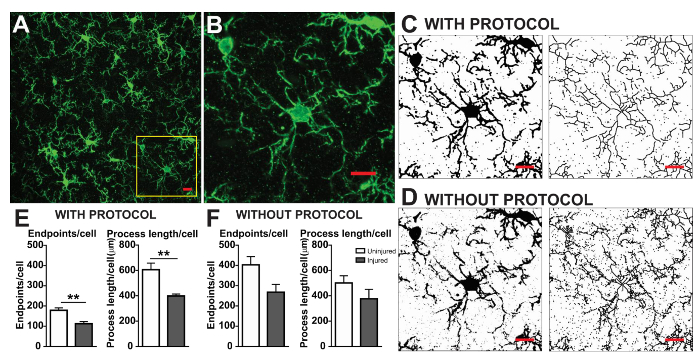
Figure 4. Analyse des données avec et sans l’application du protocole. (A) une microphotographie exemple d’IHC fluorescent et recadrée cellule correspondant à la boîte jaune (B). Images de binaire et squelettisés exemple avec (C) et sans (D), le protocole appliqué comme décrit. Données sommaires de microglie points de terminaison/cellule et processus longueur/cellule dans indemnes (blanc) et blessé le tissu cortical (gris) avec (E) et sans (F) le protocole appliqué. Analyse statistique au moyen de l’élève test t et n = 3, ** dénote p < 0,01. Echelle = 10 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
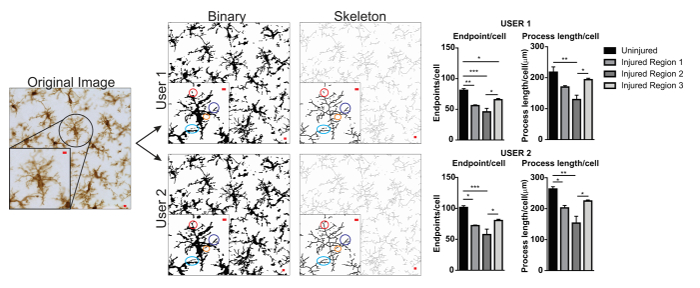
Figure 5. Différences d’utilisateur associé à l’application du protocole. Un exemple d’une conversion image et protocole original d’images binaires et squelettes par utilisateur 1 et utilisateur 2. Différences entre les deux images sont mises en évidence avec des cercles colorés. Graphiques sommaires des microglies points de terminaison/cellule et processus des données longueur/cellule dans des régions de cerveau blessé et blessé par utilisateur 1 et utilisateur 2. Analyse statistique ANOVA et échantillon taille est n = 3 ; p < 0,05, **p < 0,01, ***p < 0,001. Echelle = 10 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
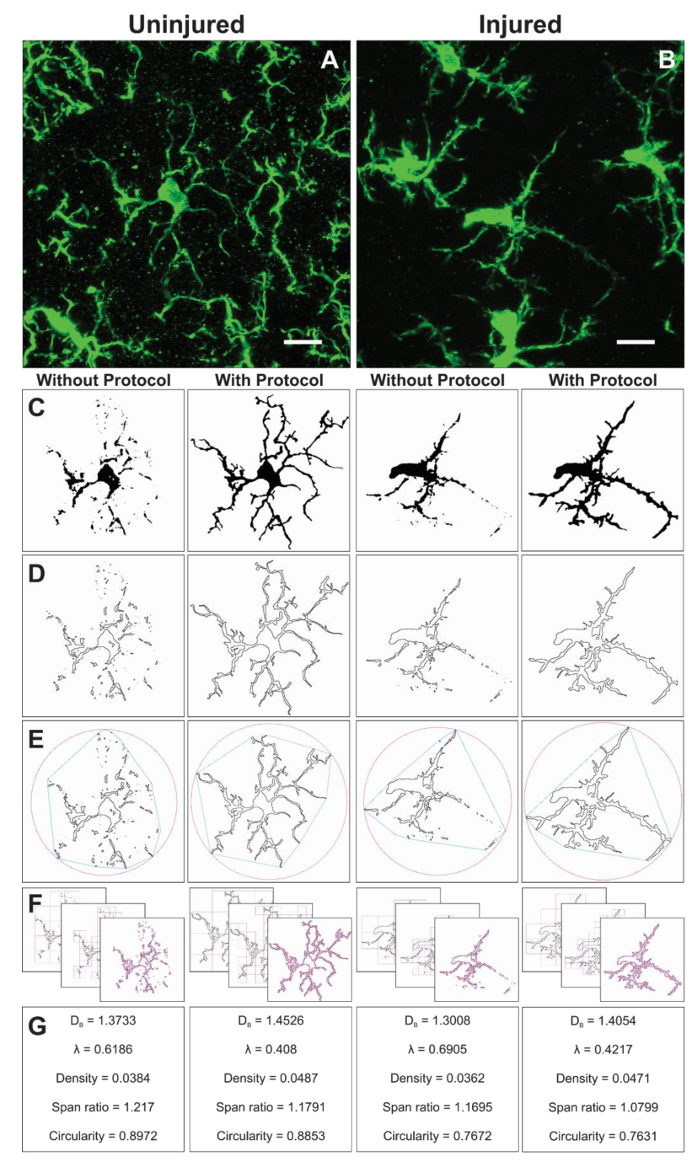
Figure 6. Analyse fractale avec et sans l’application du protocole. Exemple de recadrée photomicrographies des microglies dans le blessé (A) et blessé (B) cortex avec binaire correspondant (C) et des images de contour (D) qui entraînent avec et sans le protocole appliqué. L’enveloppe convexe associé (bleu) et en joignant le cercle (rose) pour les formes de contour correspondant (E) sont utilisés pour calculer la densité de la forme, span ratio et circularité (G). La zone de comptage méthode est illustrée en (F) et utilisée pour la dimension fractale (D,B) et lacunarité (λ) calculs (G). Echelle = 10 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Les cellules de la microglie sont finement accordées à la physiologie et la pathologie au sein de leurs micro-domaines et affichent un large éventail de morphologies2 fois subtiles7,14 et blessures brut8. L’utilisation de protocoles ImageJ rend quantification de la morphologie de la microglie accessible à tous les laboratoires comme plate-forme et plugins sont un logiciel de traitement d’images open source. Si le protocole décrit se concentre sur le traitement de l’image et l’analyse à l’aide de ce logiciel, l’uniformité de la collecte des données, la validité et la fiabilité commence par l’excellent IHC et microscopie. Ce protocole est utilisé pour améliorer le binaire, squelette et représentations contour des microphotographies ensemble et cellules individuelles mais ne peut pas prendre la place de pauvres IHC coloration et microscopie qui aboutit à faible contraste, floue ou déformée des images. Comme une autre considération, il faut ne pas d’aplatir le tissu cérébral pendant l’entreposage, avant incision, qui affecte irrévocablement la morphologie de la microglie. Enfin, au sein de chaque expérience, les microglies doivent être copié à l’aide de la même échelle, mais aussi le même microscope. Instrumentation, objectifs et logiciels varient de microscopes qui entraînera les photomicrographies tailles différentes malgré des objectifs similaires et changer le détail ainsi que le nombre de cellules au sein de chaque trame. Par exemple, acquisition d’images à l’aide d’un objectif X 40 sur un Leica SPII entraîne deux fois le nombre de cellules et moins de détails que l’acquisition à l’aide d’un Zeiss 880. Cela est particulièrement important pour les données de ramification des cellules prélevées dans l’ensemble du cadre plutôt que d’une seule cellule, comme cela devient une question d’échantillonnage des données.
En règle générale, analyse du squelette qui utilise la photomicrographie entière précède l’analyse fractale de cellule unique pour deux raisons. Ramification de cellule déterminant de toutes les cellules dans une microphotographie est rapide lorsque comparée à l’analyse fractale de cellule unique et peut être considérée comme un outil de dépistage si le temps est un facteur. En outre, les images binaires au cours de l’analyse de squelette sont utilisées pour analyse fractale. Une fois l’image, il y a un certain nombre d’étapes critiques qui peuvent influencer les résultats de l’analyse de squelette et introduire l’utilisateur-influence. Les étapes du protocole qui sont plus variable entre les utilisateurs ce sont l’étape 4.2 (luminosité croissante de l’image) et 4.5 (déterminer le seuil). Si possible, un nombre optimal pour augmenter la luminosité (curseur max ou min entre 0 et 255) est déterminé et maintenu constant pour toutes les images et les utilisateurs. Lorsque la variabilité de l’image est grande, l’utilisateur peut choisir à la place une luminosité qui variera entre les images. Par ailleurs, si les images sont lumineuses et le contraste est élevé, puis augmentation de luminosité peut être omis et seuillage peut être normalisée à l’aide d’un filtre de seuil de spécialité (e.g., Huang) plutôt que la valeur par défaut plus variable. Une fois optimisées, les paramètres doivent être respectées afin de minimiser l’influence utilisateur supplémentaire.
Un exemple de la variabilité de l’utilisateur est présenté dans la Figure 5. Valeurs de données ont augmenté à 1 utilisateur par rapport à l’utilisateur 2 et donc variabilité augmenterait si les utilisateur 1 et utilisateur 2 a contribué à la collecte de données. Un exemple des différences dans l’utilisateur 1 et utilisateur 2 des images binaires et squelettisés sont soulignées par des cercles colorés (Figure 5). Dans ce cas, les deux utilisateurs ont été brièvement formés étudiants de premier cycle ayant une expertise limitée dans la microglie. Surveillance régulière et l’encadrement par une expert avec protocole accrue d’entraînement2 la microglie peuvent réduire la variabilité inter-utilisateur. Bien que non évalués ici, analyse fractale est moins sujette à la variabilité inter-utilisateur parce que les cellules binaires sont manuellement et individuellement isolées d’une microphotographie, plutôt que de compter uniquement sur seuillage afin de déterminer les formes de la microglie. Cependant, toutes les méthodes possèdent une variabilité entre les utilisateurs. Par conséquent, un seul utilisateur (idéalement, formé par une expertise dans les cellules de la microglie) devrait terminer la collecte de données pour un dataset entier.
Modifications supplémentaires peuvent être facilement apportées à ce protocole et dépendront de la qualité d’image et les efforts déployés pour réduire le bruit et assurer la connectivité de processus. Par exemple, si le contraste est suffisant, puis masque flou n’est pas nécessaire et peut être omis. Il est prudent de les optimiser et finaliser le protocole pour un ensemble spécifique d’images, tant cas expérimentaux et témoins, avant de collecter des données d’un jeu entier. Enfin, les plugins supplémentaires peut être utilisé en lieu et place d’autres pour clarifier ou aiguiser les images qui n’étaient pas décrits dans le présent protocole tels que dilater ou aiguiser.
Avantages du présent protocole sont sa disponibilité universelle et son adaptabilité. En outre, évaluer la ramification de cellule à l’aide de AnalyzeSkeleton est rapide et applicable à un ensemble photomicrographie. Des avantages de l’approche de l’analyse de plusieurs cellules sont l’accent mis sur une région entière plutôt que des cellules individuelles. Par conséquent, il est possible d’évaluer rapidement la ramification moyenne (en termes de points de terminaison et la longueur du processus) de toutes les cellules microgliales au sein de l’image. Squelette analyse fournit une analyse de plusieurs cellules : un échantillon de données en termes de nombre de cellules qui ne peut être égalé par analyse fractale en raison de l’investissement de temps nécessaire pour isoler des cellules individuelles de photomicrographies. Une instance où cela pourrait être mieux adapté serait dans le dépistage des microglies morphologies à proximités d’une lésion focale. Une des limites est le rendu d’image de tout le domaine pour créer des modèles de squelette de microphotographies IHC est imparfait par rapport à l’approche de cellule unique beaucoup plus de temps. En outre, une analyse de la région n’est pas appropriée aux circonstances où les microglies morphologies sont radicalement différents dans le même champ. Enfin, cette méthode d’analyse est tributaire du nombre de cellules, un paramètre qui peut-être différer entre les conditions expérimentales.
Analyse fractale se déroule sur une seule cellule et complète donc la sortie de données de ramification moyenne des cellules issues de l’analyse du squelette. Bien que beaucoup plus de temps consommé, cet investissement donne un large éventail de données morphométriques. Par exemple, la cellule densité, span ratio, et données de circularité décrivent, élongation, forme et la taille de l’esquisse de la cellule, respectivement. Lacunarité et dimension fractale résument la complexité de la cellule et l’hétérogénéité de la forme, respectivement. On trouvera un résumé plus approfondi de la manière dont chaque paramètre est calculé et comment les données peuvent être interprétées dans le manuel interactif16 et les détails sont à considérer en ce qui concerne la question spécifique de recherche. Les résultats du protocole décrit dans les outils sensibles pour quantifier les petits changements dans les morphologies des microglies 2D qui peuvent survenir dans des conditions physiologiques et pathologiques. L’analyse morphométrique supplémentaires tels que la solidité, convexité et facteur de forme16,20 peut être possible si génère des formes 3D.
Adaptation et développement de protocole est continue et axée sur l’utilisateur. Il a été étendu de fluorescence8 à DAB/lumineux-zone images7 , mais pas encore pour tissus incorporé de paraffine. On outre, il peut être utilisé en conjonction avec des logiciels propriétaires comme Imaris pour analyse complémentaire. Ce protocole peut être appliqué à une variété de physiologie et n’est pas limité dans la microglie mais peut être appliqué à toute cellule ou tissu avec motifs particuliers ou des formes qui peuvent être identifiés à l’aide de méthodes IHC. Enfin, avec la taille de l’échantillon suffisant, une analyse multivariée ou cluster peut être appliquée pour stratifier des microglies selon morphologie12,21; Il s’agit d’informations utiles comme la morphologie de la microglie est un indicateur essentiel des fonctions de microglie et des réponses à leur environnement. L’appréciation de la diversité morphologique microgliale est en expansion et important de bien comprendre les interactions neurone-glie-vasculaire au cours de la santé et la maladie. La croissance dans ce domaine est renforcée par des protocoles bien développés, facile à utiliser et reproductibles pour quantifier et résumer la microglie morphologie à l’aide de multiples variables continues.
Acknowledgements
Cette étude a reçu le soutien financier de NINR (F32NR013611). Nous tenons encore à remercier les développeurs de AnalyzeSkeleton(2D/3D) et FracLac (Arganda-Carreras et coll. et Karperien et al., respectivement) sans laquelle l’analyse décrite dans les présentes ne serait pas possible.
Materials
| Name | Company | Catalog Number | Comments |
| primary antibody anti-IBA1 | Wako | 019-19741 | rabbit host |
| Vectashield soft mount | Vector Labs | H-1000 | |
| Secondary antibody | Jackson ImmunorResearch | 711-545-152 | donkey host |
| 4 mL glass vial | Wheaton | UX-08923-11 | |
| Triton X-100 | Fisher Scientific | BP151 | |
| Sodium Azide (NaN3) | Sigma | S-8032 | |
| glass coverslip | Fisher Scientific | 12-544-G |
References
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nat Neurosci. 8 (6), 752-758 (2005).
- Karperien, A., Ahammer, H., Jelinek, H. F. Quantitating the subtleties of microglial morphology with fractal analysis. Front Cell Neurosci. 7 (3), eCollection (2013).
- Taylor, S. E., Morganti-Kossmann, C., Lifshitz, J., Ziebell, J. M. Rod microglia: a morphological definition. PLoS One. 9 (5), e97096 (2014).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308 (5726), 1314-1318 (2005).
- Abiega, O., et al. Neuronal Hyperactivity Disturbs ATP Microgradients, Impairs Microglial Motility, and Reduces Phagocytic Receptor Expression Triggering Apoptosis/Microglial Phagocytosis Uncoupling. PLoS Biol. 14 (6), e1002466 (2016).
- Wyatt-Johnson, S. K., Herr, S. A., Brewster, A. L. Status Epilepticus Triggers Time-Dependent Alterations in Microglia Abundance and Morphological Phenotypes in the Hippocampus. Front Neurol. 8 (700), eCollection (2017).
- Morrison, H., Young, K., Qureshi, M., Rowe, R. K., Lifshitz, J. Quantitative microglia analyses reveal diverse morphologic responses in the rat cortex after diffuse brain injury. Sci Rep. 7 (1), 13211 (2017).
- Morrison, H. W., Filosa, J. A. A quantitative spatiotemporal analysis of microglia morphology during ischemic stroke and reperfusion. J Neuroinflammation. 10 (4), (2013).
- Gyoneva, S., Traynelis, S. F. Norepinephrine modulates the motility of resting and activated microglia via different adrenergic receptors. J Biol Chem. 288 (21), 15291-15302 (2013).
- Xu, H., et al. Environmental Enrichment Potently Prevents Microglia-Mediated Neuroinflammation by Human Amyloid beta-Protein Oligomers. J Neurosci. 36 (35), 9041-9056 (2016).
- Rodriguez, J. J., Noristani, H. N., Verkhratsky, A. Microglial response to Alzheimer's disease is differentially modulated by voluntary wheel running and enriched environments. Brain Struct Funct. 220 (2), 941-953 (2015).
- Soltys, Z., et al. Quantitative morphological study of microglial cells in the ischemic rat brain using principal component analysis. J Neurosci Methods. 146 (1), 50-60 (2005).
- Orlowski, D., Soltys, Z., Janeczko, K. Morphological development of microglia in the postnatal rat brain. A quantitative study. Int J Dev Neurosci. 21 (8), 445-450 (2003).
- Morrison, H. W., Filosa, J. A. Sex differences in astrocyte and microglia responses immediately following middle cerebral artery occlusion in adult mice. Neuroscience. 339, (2016).
- Arganda-Carreras, I., Fernandez-Gonzalez, R., Munoz-Barrutia, A., Ortiz-De-Solorzano, C. 3D reconstruction of histological sections: Application to mammary gland tissue. Microsc Res Tech. 73 (11), 1019-1029 (2010).
- Davis, B. M., Salinas-Navarro, M., Cordeiro, M. F., Moons, L., De Groef, L. Characterizing microglia activation: a spatial statistics approach to maximize information extraction. Sci Rep. 7 (1), 1576 (2017).
- . ImageJ User Guide Available from: https://imagej.nih.gov/ij/docs/guide/ (2014)
- Karperien, A. L., Jelinek, H. F., , Fractal, Multifractal, and Lacunarity Analysis of Microglia in Tissue Engineering. Front Bioeng Biotechnol. 3 (51), eCollection (2015).
- Martyanova, E. K., Tishkina, A. O. 3D quantitative analysis of microglial morphology. available as conference preceedings SkoltechOn. , (2015).
- Fernandez-Arjona, M. D. M., Grondona, J. M., Granados-Duran, P., Fernandez-Llebrez, P., Lopez-Avalos, M. D. Microglia Morphological Categorization in a Rat Model of Neuroinflammation by Hierarchical Cluster and Principal Components Analysis. Front Cell Neurosci. 11 (235), eCollection (2017).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved