Quantifizierung der Mikroglia Morphologie von Mikrofotos von Immunohistochemistry vorbereitet Gewebe mit ImageJ
In diesem Artikel
Zusammenfassung
Mikroglia sind immun Gehirnzellen, die Umfrage und reagieren auf veränderte Gehirnphysiologie durch morphologische Veränderungen, die quantitativ ausgewertet werden kann. Dieses Protokoll beschreibt eine ImageJ basierte Analyse Protokoll, Mikroglia Morphologie als kontinuierliche Daten nach Metriken wie Zelle Verzweigung, Komplexität und Form darzustellen.
Zusammenfassung
Mikroglia sind Gehirn Fresszellen, die im Gehirn Homöostase teilnehmen und kontinuierlich vermessen ihr Umfeld für Funktionsstörungen, Verletzungen und Krankheiten. Als die first Responder Mikroglia haben wichtige Funktionen, Neuronen und Glia Dysfunktion zu mildern, und in diesem Prozess durchlaufen sie eine breite Palette von morphologischen Veränderungen. Mikroglia Morphologien können deskriptiv eingestuft werden oder alternativ als eine kontinuierliche Variable Parameter wie Zelle Verzweigung, Komplexität und Form quantifiziert werden können. Während Methoden zur Quantifizierung der Mikroglia auf einzelne Zellen angewendet werden, gelten einige Techniken für mehrere Mikroglia in eine gesamte Mikrophotographie. Der Zweck dieser Methode ist, mehrere zu quantifizieren und Einzelzellen mit leicht verfügbaren ImageJ-Protokolle. Dieses Protokoll ist eine Zusammenfassung der Schritte und ImageJ Plugins empfohlen, Fluoreszenz und Hellfeld Vergößerung in repräsentativen binäre und skelettierten Bilder umzuwandeln und zu analysieren mit Software-Plugins AnalyzeSkeleton (2D/3D) und FracLac für die Datenerfassung der Morphologie. Die Ausgänge dieser Plugins zusammenfassen Zellmorphologie Prozess Endpunkte, Kreuzungen, und Länge sowie Komplexität, Zelle Form und Größe Deskriptoren. Das Skelett Analyse Protokoll beschriebenen eignet sich gut für eine regionale Analyse von mehreren Mikroglia innerhalb eines gesamten Mikrophotographie oder Region of Interest (ROI), während FracLac eine ergänzende individuelle Zellanalyse bietet. Kombiniert, sieht das Protokoll ein objektives, sensible und umfassende Bewertungswerkzeug, das verwendet werden, um zwischen vielfältigen Mikroglia Morphologien im Gehirn gesund und Verletzten zu Schichten.
Einleitung
Mikroglia haben eine sofortige und vielfältigen morphologischen Antwort auf Veränderungen im Gehirn Physiologie1 entlang eines Kontinuums von Möglichkeiten dieses Bereichs von hyper-Verzweigung und hochkomplexe Morphologien, de-verzweigten und amöboiden Morphologien2 . Mikroglia kann auch polarisiert und stabförmige3geworden. Mikroglia Zelle Verzweigung wird im Allgemeinen als eine komplexe Form mit mehreren Prozessen definiert und wird oft als die Anzahl der Endpunkte pro Zelle und die Länge der Zelle Prozesse berichtet. Da Mikroglia sind abgestimmt auf neuronalen und Gliazellen Funktion durch kontinuierliche Zellezelle Übersprechen und in Vivo Motilität4,5, können als Indikatoren für verschiedene Zellfunktionen und Dysfunktionen Mikroglia Morphologien dienen. im Gehirn. Ein quantitativer Ansatz ist notwendig, um die Vielfalt dieser morphologischen Veränderungen angemessen zu beschreiben und die Unterschiede zwischen den verzweigten Zellen zu unterscheiden, die mit subtilen physiologische Störungen (z. B. Epilepsie5,6 auftreten und Gehirnerschütterung7) zusätzlich zu grobe Verletzungen (z. B. Takt8). Ein vermehrter Einsatz von Morphologie Quantifizierung7,8,9,10,11,12,13,14 zeigen die ganze Vielfalt der Mikroglia Morphologien in Gesundheit und Krankheit. Die vorliegende Studie Details der schrittweise Einsatz von ImageJ Plugins notwendig, Mikroglia Morphologie von Leuchtstofflampen oder nicht-fluoreszierende Vergößerung der Mikroglia zusammenfassen in festen Nagetier Gewebe nach Immunhistochemie (IHC) erworben.
Im Mittelpunkt stehen, die Analyse-Techniken, die hier beschriebenen die ImageJ Plugins AnalyzeSkeleton (2D/3D)15, entwickelt im Jahr 2010 auf große Mamma Strukturen, zu quantifizieren und FracLac16, entwickelt im Jahr 2014 auf ImageJ und Fraktal-Analyse zu integrieren einzelnen Mikroglia Formen zu quantifizieren. Diese Plugins bieten eine schnelle Analyse der Mikroglia Verzweigung im gesamten Mikrofotos oder mehrere Mikroglia einen definierten ROI innerhalb einer Mikrophotographie. Diese Analyse kann alleine oder in Ergänzung mit Fraktalanalyse verwendet werden. Die einzelligen Fraktalanalyse (FracLac) erfordert eine Investition von Zeit, sondern bietet mehrere Morphologie Ausgaben bezüglich Mikroglia Komplexität, Form und Größe. Die Verwendung beider Tools ist nicht überflüssig, als Zelle Verzweigung ist komplementär zur Zelle Komplexität und die Kombination von mehreren Parametern verwendet werden, zu unterscheiden zwischen verschiedenen Mikroglia Morphologien in Datasets12,17.
Protokoll
Alle Experimente wurden genehmigt und durchgeführt gemäß den Richtlinien von der University of Arizona institutionelle Animal Care and verwenden Committee und der NIH-Leitlinien für die Pflege und Verwendung von Labortieren. Darauf wurde geachtet, tierische Schmerzen und Beschwerden zu minimieren. Euthanasie-Methoden werden gemäß einem genehmigten Prüfplan und zervikalen Enthauptung Isoflurane Narkose bestehen.
(1) Gewebe-Vorbereitung
Hinweis: Führen Sie Mikroglia-Morphologie-Analyse an festen, Cryoprotected Gewebeproben Zellmorphologie zu bewahren. Das folgende ist ein Standardprotokoll zur Vorbereitung und fixierte Gewebe für Fluoreszenz IHC direkt schneiden.
- Entfernen Sie Maus oder Ratte Gehirne von einem euthanasierten Tier nach dem gewünschten Experiment und nach einem standard-Labor-Protokoll. Legen Sie das Gehirn in ein 10 mL Fläschchen mit 5 mL einer 4 % Paraformaldehyd Lösung für 24 h bei 4 ° C. Dann spülen und Platz in 5 bis 10 mL einer 30 % Saccharose-Phosphat gepufferte Lösung (PBS, 0,01 M) für 72 h bei 4 ° C. Ganze Köpfe bei-80 ° C bis Gewebe Schneiden mit einem Kryostaten oder bei 4 ° C zu speichern, wenn mit einem Mikrotom schneiden.
Hinweis: Dieses Protokoll ist noch nicht getestet mit Gewebe aus Paraffin-eingebetteten Gewebe geschnitten. - Abschnitt das Hirngewebe, die gewünschte Schnittdicke und Ausrichtung mit einem Kryostaten oder Mikrotom und Speicher frei schwebenden Abschnitte in einer Cryoprotection-Lösung (50 mM PBS, Ethylenglykol, Glycerin) bei-20 ° C.
Hinweis: Dieses Protokoll wurde erfolgreich auf koronalen Gewebeschnitte von 50 µm bis 200 µm Dicke durchgeführt. Gewebe Abschnitte weniger als 50 µm nicht die volle Spanne der Mikroglia Prozesse, während in dicken Gewebeschnitten erfassen kann, IHC Beflecken unvollkommen durch Antikörper Eindringen in das Gewebe sein kann. Gewebe kann geschnittenen entweder in einem koronalen oder sagittale Ausrichtung und diese Wahl hängt von der experimentellen Ziel und Gehirn Region(en) untersucht werden.
(2) Immunhistochemie
Hinweis: Skelett und Fraktal-Analyse-Methoden können entweder Fluoreszenz oder 3, 3 '-Diaminobenzidine (DAB) IHC angewendet werden. Im folgenden ist ein standard Fluoreszenz-IHC-Protokoll und kann nach Bedarf ersetzt werden. Fluoreszenz IHC liefert überlegene Visualisierung der Zellprozesse DAB IHC gegenüber.
- Legen Sie die Gewebeschnitte in einem 4 mL Glasflasche (bis zu 15 Maus Gehirn Abschnitte/Vial) und inkubieren Sie mit 1 mL Lösung enthält bis zu 10 % Pferd Serum, PBS (0,01 M), 0,5 % Triton, 0,04 % NaN3 bei Zimmertemperatur (23 ° C) für 1 h.
- Waschen Sie für 5 min mit PBS (0,01 M) dreimal bei Raumtemperatur.
- Inkubieren Sie mit dem primären Antikörper (Iba1, 1:1 000) bei Raumtemperatur für 72 h in 1 mL der Lösung mit PBS (0,01 M), 0,5 % Triton, 0,04 % NaN3und abgedeckt (um die NaN3 Wirksamkeit zu erhalten).
- Waschen Sie für 5 min mit PBS (0,01 M) dreimal bei Raumtemperatur.
- Mit dem sekundären Antikörper (Anti-Kaninchen 488, 1: 250) bedeckt bei Raumtemperatur für 4 h in 1 mL der Lösung mit PBS (0,01 M), 0,5 % Triton, 0,04 % NaN3 inkubieren
- Waschen Sie für 5 min mit PBS (0,01 M) dreimal bei Raumtemperatur.
- Montieren Sie das Gehirn Gewebeschnitte (Anzahl und Ausrichtung basierend auf Einstellungen) subbed Folien, wenden ein Soft-Set Eindeckmittel auf der Folie und legen Sie das Deckglas über das Gewebe. Speichern Sie die Folien bei 4 ° C.
Hinweis: Eine 1,5 Glasstärke Deckglas ist erforderlich für die konfokale Bildgebung. Soft-Set ist eine bevorzugte Eindeckmedium, da die hohe Viskosität nicht, das Gewebe komprimieren und beste behält die Morphologie im Vergleich zu hart eingestellt Montage Medien.
(3) Bildgebung
- Bild Iba1 positive Zellen im Bereich Gehirn Gewebe mit einem Hellfeld oder confocal Mikroskop, die eine Z-Stapel Erwerb Fähigkeit mit ein 20 X Objektiv oder mehr hat.
Hinweis: Die Imaging-Parameter und Gerätesoftware sollte für alle Mikrophotographie Erwerb in einem Experiment konstant sein. Ausgezeichnete Prozessdetail erhält man mit einem 40 X oder 63 X Objektiv. Es ist möglich, eine gesamte Mikrophotographie oder eine multizelle ROI innerhalb einer größeren Mikrophotographie beschriebene Skelett Analyse-Protokoll anzuwenden.- 8-Bit-Bilder mithilfe der entsprechenden Softwareeinstellungen speziell für die Mikroskop-Software zu erwerben.
Hinweis: Die Konvertierung von Dateien auf 8-Bit nach der Übernahme kann die Datenerhebung verfälschen. - Mindestens 30 µm Z-Stapel mit nicht mehr als eine 2 µm Intervall zwischen den Bildern mit den entsprechenden Software-Einstellungen spezifisch für die Mikroskop-Software zu erwerben.
Hinweis: Das Mikroskop und die Software dürfen für die Bildaufnahme in X-, Y- und Z-Achse. Ein Z-Stack kann erhöht werden, und das Intervall kann verringert werden, um zusätzliche Mikroglia Detail bieten. Im Gegenzug erhöht die imaging-Zeit. Benutzen Sie wo möglich Nyquist Sampling für Fluoreszenz-Mikroskopie.
- 8-Bit-Bilder mithilfe der entsprechenden Softwareeinstellungen speziell für die Mikroskop-Software zu erwerben.
- Speichern Sie alle Dateien als Tif-Dateien oder als von der Mikroskop-Software erforderlich.
- Öffnen Sie die Tif-Dateien in ImageJ und verwenden Sie die Symbolleiste, um Kanäle aufgeteilt, indem Sie auf Bild | Farbe | Split-Kanäle, und Stapeln Bilder durch Klicken auf Bild | Stapel | X Projekt | Maximale Intensität Projektion gegebenenfalls. Als .tif-Dateien speichern.
(4) Skelett Analyse
- Laden Sie Fidschi oder ImageJ aus < Https://imagej.net/Fiji/Downloads>. Für die einzelnen Plugins herunterladen AnalyzeSkeleton(2D/3D) von < Http://imagej.net/AnalyzeSkeleton>15 und download FracLac von < Https://imagej.nih.gov/ij/plugins/fraclac/fraclac.html>16.
Hinweis: Der gesamte Prozess der Konvertierung eine Mikrophotographie mit binären skelettierten dauert weniger als 1 min. - Wenn eine Fluoreszenz Mikrophotographie verwenden, stellen Sie sicher, dass das Bild 8-Bit und konvertieren in Graustufen, am besten alle positive Färbung zu visualisieren. Verwenden Sie die Symbolleiste und klicken Sie auf Bild | Lookup-Tabellen | Grauen. Wenn mit einem DAB Hellfeld Foto, erster Einsatz der FFT-Bandpass filter Plugin (über die Symbolleiste durch Klicken auf Prozess | FFT | Bandpassfilter) und dann in Graustufen umwandeln.
Hinweis: Für die Zwecke dieses Protokolls ImageJ-Standardeinstellungen für eine FFT-Bandpass-Filter sind ausreichend (Filter bis zu 3 Pixel, bis zu 40, keine Streifen-Unterdrückung). Eine FFT Bandpass Filters entfernt Rauschen (kleine Objekte) unter Beibehaltung der insgesamt größere Aspekte des Bildes. Dies ist besonders nützlich im Hellfeld Bilder, wo spaltet und Risse im Gewebe können als Hintergrund erscheinen und somit erschweren das Skelett Analyse18. - Passen Sie die Helligkeit und den Kontrast, wenn das Bild zu dunkel ist und der Mikroglia-Prozess kann nicht dargestellt werden. Verwenden Sie die Symbolleiste und klicken Sie auf Bild | Anpassen | Helligkeit/Kontrast. Nach Bedarf, bis zum Rand des Histogramms aber nicht weiter passen Sie die minimale oder maximale Schieberegler an.
Hinweis: In ImageJ, sind Helligkeit und Kontrast geändert durch eine Aktualisierung des Bildes Lookup-Tabelle (LUT), so dass Pixelwerte unverändert sind. Max und min Schieberegler steuern die unteren und oberen Grenzen des Anzeigebereichs, mit Pixelwerte über 255 erscheinen weiß und Pixelwerte unter 0 erscheinen schwarz18. Bei Fluoreszenz Mikrofotos sollte die maximale Schieberegler verwendet werden, während die minimale Schieberegler für Mikrofotos von DAB gebeizt Mikroglia verwendet wird. - Führen Sie einen Unscharf maskieren Filter Kontrast über die Symbolleiste durch Klicken auf Prozess weiter zu steigern | Filter | Unscharf Maske. Für die Zwecke dieses Protokolls, ImageJ Standardeinstellungen (Radius von 3 Pixel und Maske Gewicht von 0,6) dienen.
Hinweis: Unscharf maskieren schärft und verbessert die Kanten-Features eines Bildes durch Subtraktion eine unscharfe Version des Bildes (Unscharf maskieren) vom Original, und dann das resultierende Bild mit einer kontrastreichen Version des Originalbildes zusammenführen. Daher Unscharf maskieren Filter schafft keine Details, sondern vielmehr verdeutlicht die bestehenden Details in einem Bild. Der Radius Einstellungsänderungen wie verschwommen Unscharf maskieren wird (und somit wieviel Unschärfe wird entfernt), und die Maske Gewicht Einstellung ändert den Grad der Kontrast, der das Unscharf maskieren mit zusammengeführt werden (und somit stellt den Kontrast des fertigen Bildes). - Führen Sie einen Filter Schritt um Koteletts Lärm erzeugt durch das Unscharf maskieren zu entfernen. Verwenden Sie die Symbolleiste und klicken Sie auf Prozess | Lärm | Despeckle.
Hinweis: Despeckle entfernt Koteletts Geräusche ersetzt jedes Pixel mit der Medianwert in seiner Nachbarschaft 3 × 3. Der Effekt ist, dass Ausreißer in der Intensität durch das mittlere Pixel ersetzt werden, ohne die Schärfe der Kanten18. - Konvertieren Sie das Bild zur Binärdatei mithilfe der Symbolleiste klicken Sie Bild | Anpassen | Schwelle.
Hinweis: Schnittstellenüberwachung schichtet die Graustufenbilder in Features von Interesse im Vergleich zu Hintergrund und wandelt das Bild in binären18. - Filter, enger-, anwenden und Entfernen von Ausreißern Funktionen: In der daraus resultierenden binäres Bild möglicherweise einzelne Pixel Hintergrundgeräusche und Lücken zwischen Prozessen.
- Wenden Sie die Filter-Funktion mithilfe der Symbolleiste durch Klicken auf Prozess | Lärm | Despeckle.
Hinweis: Die Anwendung auf die Binärdatei despeckle Bild entfernt alle verbleibenden Einzelpixel-Geräusche. - Wenden Sie die schließen-Funktion mithilfe der Symbolleiste durch Klicken auf Prozess | Binäre | Enge.
Hinweis: Dieses Plugin verbindet zwei dunkle Pixel, wenn sie durch bis zu 2 Pixel getrennt sind. - Gelten die Ausreißer-Funktion entfernen mithilfe der Symbolleiste durch Klicken auf Prozess | Lärm | Ausreißer entfernen.
Hinweis: Für die Zwecke dieses Protokolls sind helle Ausreißer mit einem Pixel Radius von 2 und einem Schwellenwert von 50 ausgerichtet. Dieses Plugin ersetzt einen helle oder dunkle Ausreißer Pixel durch die mittlere Pixel in der näheren Umgebung, wenn es um mehr als einen bestimmten Wert (die Schwelle)18 weicht.
- Wenden Sie die Filter-Funktion mithilfe der Symbolleiste durch Klicken auf Prozess | Lärm | Despeckle.
- Speichern Sie das Bild als separate Datei zur späteren Verwendung und/oder Fraktal-Analyse und skeletonize das Bild mithilfe der Symbolleiste durch Klicken auf Prozess | Binäre | Skeletonize.
- Wählen Sie das skelettierte Bild und führen Sie das Plugin AnalyzeSkeleton(2D/3D) mithilfe der Symbolleiste klicken Sie Plugins | Skelett | Analysieren Sie Skelett, und aktivieren Sie das Kontrollkästchen Brancheninformationen.
Hinweis: Es ist wahrscheinlich, dass die Bildbearbeitung Optimierung mit dem Hinzufügen oder Löschen von der oben vorgeschlagenen Schritte benötigen. In diesem Prozess werden skelettierten Bilder für Genauigkeit beurteilt, indem man eine Überlagerung des Skeletts und das Originalbild. SOMAS sollten einzelne Ursprungspunkte mit Prozessen, die vom Mittelpunkt ausgeht; kreisförmige Somas verwirren die Daten und durch Protokoll Anpassung vermieden werden. Ein Beispiel für einen einzigen Ursprungspunkt gegen kreisförmige Somas ist in Abbildung 1dargestellt.
Häufige Probleme, was zu nicht-repräsentative Skelette und Lösungsvorschläge:
- Bild zu dunkel: in Graustufen konvertieren, stellen Sie Helligkeit/Kontrast-Regler und/oder Unscharf maskieren anwenden
- Zu viel Hintergrund: Stellen Sie Helligkeit/Kontrast-Regler, Filter anwenden und/oder Ausreißer entfernen
- Kreisförmige Somas skelettierten Bild (vor allem für Fluoreszenzbilder): FFT Bandpass Filter und/oder Unscharf maskieren auftragen
- Risse im Gewebe (vor allem für Hellfeld Bilder): FFT Bandpass Filter anwenden und/oder Filter
- Kopieren Sie alle Daten aus den Ergebnissen und filialinformationen Ausgänge und die Daten in eine Excel-Tabelle einfügen.
- Schneiden Sie in Excel die Daten um Skelett-Fragmente zu entfernen, die durch Erwerb von IHC und Bild entstehen.
- Duplizieren der Experiment-Arbeitsmappe mit der raw-Daten-Ausgabe vom Skelett Analyse und TRIM zu den Dateinamen hinzufügen. Alle nachfolgenden Daten Trimmen sollte in der duplizierten Arbeitsmappe die unformatierten Daten für zukünftige Verwendung und Referenz zu bewahren auftreten.
- Bestimmen Sie die Länge von Fragmenten aus dem Dataset getrimmt wird, indem das skelettierte Bild in ImageJ und das Linien-Werkzeug auswählen. Messen Sie mehrere Fragmente, Kenntnis nehmend von der durchschnittlichen Länge, und entscheiden Sie sich für einen cutoff Wert.
Hinweis: Für die Zwecke der hier präsentierten Daten ist die cutoff Länge für unerwünschte Fragmente 0,5. Dieser Wert sollte in einem Dataset übereinstimmen. - Benutzerdefiniert sortieren die Excel-Tabelle durch Klick auf Art & Filter | Benutzerdefinierte Sortierung. Sortieren Sie nach "Endpunkt Voxel" vom größten zum kleinsten und in eine neue Ebene von "Mx Zweig pt" vom größten zum kleinsten.
- Entfernen Sie jede Zeile, die enthält 2 Endpunkte mit einer maximal Länge von weniger als den cutoff Wert (d. h.., 0,5). Summieren Sie die Daten in der Spalte der Endpunkte, die Gesamtzahl der Endpunkte gesammelt aus dem Bild zu berechnen.
- Für Zweig Daten wiederholen: Sortieren nach "astlänge" vom größten zum kleinsten. Blättern Sie durch die Daten und entfernen Sie jede Zeile, die eine Niederlassung Länge von weniger als den cutoff Wert hat(d. h.., 0,5). Addieren Sie die Werte in der Filiale Länge Spalte um die summierte Länge aller Branchen gesammelt aus dem Bild berechnen.
- Wiederholen Sie Schritte 4.11.3-4.11.5 für jedes Bild/Blatt, bis alle Daten zusammengefasst und gekürzt haben.
- Teilen Sie die Daten aus jedem Bild (Anzahl der Endpunkte summiert und summiert astlänge) durch die Anzahl der Mikroglia Somas in das entsprechende Bild. Die endgültigen Daten (Endpunkte/Zelle & Zweig Länge/Zelle) in statistischer Software eingeben.
Hinweis: Die summierte Zweig Länge/Zellendaten möglicherweise Umwandlung von Länge in Pixeln zu Mikrometer.
(5) Fraktal-Analyse
Hinweis: FracLac ist in der Lage, eine Reihe unterschiedlicher Form-Analysen, die nicht behandelt werden in diesem Protokoll. Für eine ausführlichere Erklärung des FracLac verschiedene Funktionen ist, siehe Handbuch des FracLac in < Https://imagej.nih.gov/ij/plugins/fraclac/FLHelp/Introduction.htm> und zugehörigen Referenzen 2,16,19. Fraktalanalyse nutzt die Protokoll-Schritte 4.1-4.7 beschriebenen.
- Bestimmen Sie die Größe des ROI, die für alle Fraktalanalyse verwendet werden. Verwenden Sie das Rechteck-Werkzeug, um den ROI zu zeichnen. Sicherstellen Sie, dass die Box groß genug ist, um die gesamte Zelle erfassen und kann in das Dataset konsistent bleiben.
Hinweis: Verwenden Sie die Rechteckauswahl anstatt der Freihandauswahl um sicherzustellen, dass alle ROIs die gleiche Größe Rechteck sind, und daher die Zellen verfügen über den gleichen Maßstab. Dies wäre nicht der Fall, wenn der Freihandauswahl verwendet wurden, weil ImageJ AutoSkalieren wird einen quadratische ROI um verschieden große rechteckige Fenster, wodurch Zellen mit unterschiedlichen Maßstäben zu passen. Fraktale Formen maßstabsunabhängige sind, ist der Fraktal-Analyse-Prozess mit FracLac für ImageJ Skala16abhängig. Daher besteht die Notwendigkeit für einen durchweg große ROI in der gesamten Datensammlung. - Nach dem Zufallsprinzip wählen Sie Mikroglia für Fraktalanalyse in jedem Mikrophotographie und entsprechenden binäres Bild aus. Wählen Sie im Fenster ROI-Manager Update auf den ROI auf die Position der Zelle zu sperren. Verwenden Sie STRG + UMSCHALT + D , um den Bereich innerhalb des ROI als neues Fenster zu duplizieren, und speichern Sie die zugeschnittene Zelle. Duplizieren Sie auf das entsprechende binäre Bild (aus der Skelett-Analyse) das Gebiet mit der gleichen Zelle mit dem ROI-Manager. Wiederholen Sie, bis eine ausreichende Anzahl von Zellen für die Fraktalanalyse nach dem Zufallsprinzip ausgewählt wurden und speichern Sie alle Dateien.
Hinweis: Einen Zufallszahlen-Generator und eine nummerierte Gitter lässt sich nach dem Zufallsprinzip Zellen auszuwählen. - Öffnen Sie das binäre Bild mit der einzelnen Zelle. Doppelklicken Sie auf das Pinsel-Werkzeug, die Farbe auf schwarz gesetzt und die Pinsel Breite nach Bedarf anpassen. Verwenden Sie die passenden Mikrophotographie als Referenz verwenden, die Pinsel entfernen neben Zellprozesse, fragmentierte Prozesse zu verbinden und isolieren die Zelle von Interesse. Sobald die binären Zelle isoliert wurde, speichern Sie die binäre-Datei.
Hinweis: Halten Sie 'Alt' schaltet den Pinsel aus der Vordergrundfarbe (schwarz) auf die Hintergrundfarbe (weiß). - Eine Übersicht über die Symbolleiste über Prozess die binären Zelle umwandeln | Binäre | Gliederung.
Hinweis: FracLac für Bild J auf beiden festen Formen einsetzbar oder Form skizziert, um Form verwenden16skizziert ist jedoch aktuelle Konvention. - In der Symbolleiste öffnen Sie FracLac über die Symbolleiste durch Klicken auf Plugins | Fraktalanalyse | FracLac , und wählen Sie BC (Feld gezählt). Setzen Sie in den Raster Design -Einstellungen Num G auf 4. Kontrollkästchen Sie unter Grafik -Optionen das Metriken die konvexe Hülle und begrenzungskreises der Zelle zu analysieren. Wenn Sie fertig sind, wählen Sie "OK".
Hinweis: Num G ist die Anzahl der Kästchen zählen Raster Orientierungen verwendet während des Scans und des empfohlenen Bereichs für Num G 4-12. Die Num G-Einstellung und das empfohlene Intervall wird in den FracLac manuelle16gründlich überprüft. Erhöhung der Num G kann Rechenzeiten deutlich verlangsamen. FracLac Einstellungen müssen nur einmal pro Sitzung eingerichtet werden. Nachdem die Einstellungen eingegeben haben, werden die Scan-Taste verfügbar. - Wählen Sie die Schaltfläche " Scannen " um einen Kasten zählen auf das ausgewählte Bild Scan.
Hinweis: Der Scan erzeugt drei Fenster mit Datenausgänge: Rumpf und Kreis Ergebnisse, Box Graf Zusammenfassung Dateien und Scan-Arten. Das Scan-Arten-Fenster enthält ein Protokoll verwendeten Einstellungen, als auch als standard-Abweichungen für bestimmte Maßnahmen. Für die Zwecke dieses Protokolls das Fenster Scan-Arten wird nicht verwendet und möglicherweise geschlossen oder für spätere Verwendung gespeichert. - Im Fenster Rumpf und Kreis Ergebnisse kopieren Sie alle gewünschte Daten (zB., Dichte, Span-Verhältnis und Zirkularität) Ergebnisse. Im Feld Anzahl Zusammenfassung Fenster kopieren Sie die gewünschten Daten (zB., Fraktale Dimension und Lacunarity) Ergebnisse. Übertragen Sie die kopierten Daten auf eine Excel-Datei oder Statistik-Software.
Hinweis: Eine vollständige Auflistung der FracLac Ausgang Daten bereitgestellt und in der FracLac für ImageJ manuelle16ausführlich erklärt.
Ergebnisse
Die Mikroglia Morphologie Analyseprotokolle beschriebenen zusammenfassen Schritte bei der Bearbeitung von Leuchtstofflampen und DAB Mikrofotos für morphometrische Analyse hilfreich. Diese Schritte werden in Abbildung 2 optisch zusammengefasst und Abbildung 3. Das Ziel dieser Schritte ist ein repräsentatives Bild der binären und skelettierten erstellen, das entsprechend der ursprünglichen Mikrophotographie Modelle, so dass die angesammelten Daten gültig sind. Nach Protokoll Anwendung ergeben das AnalyzeSkeleton-Plugin tagged Skelett Bilder aus denen die Anzahl der Endpunkte und Zweig (dh., Prozess) Lengthcan von daraus resultierenden Ausgabedateien zusammengefasst werden. Endpunkte und Länge Prozessdaten werden dann verwendet, um das Ausmaß der Mikroglia Verzweigung in der Mikrophotographie oder ROI zu schätzen. Abbildung 4 fasst die resultierenden Daten (Endpunkte und Prozess/Länge/Zelle) mit und ohne Protokoll Anwendung. Während ähnliche Tendenzen vorhanden sind, sind die Daten zusammengefasst in Abbildung 4F weniger Variable als in Abbildung 4E. Diese Daten veranschaulichen darüber hinaus erhöhten Empfindlichkeit zur Erkennung Unterschiede zwischen den Gruppen, wenn das Protokoll angewendet wird. Zu guter Letzt muss darauf geachtet werden, über Inter Benutzer Variabilität in der Anwendung des Protokolls. Solche Unterschiede sind in Abbildung 5 zusammengefasst wo demselben Datensatz durch zwei unabhängige Benutzer, die Anwendung eines identischen Protokolls wie oben zusammengefasst analysiert wurde.
Zusätzliche Morphologie Daten werden aus einzelnen Zellen isoliert von den binären Bildern während der Protokoll-Anwendung erstellt. Die Protokoll-Schritte zu analysieren, Mikroglia Morphologie vor und mit das FracLac-Plugin sind in Abbildung 6zusammengefasst. Wir illustrieren diese Analyse in beide unverletzt (Abb. 6A) und (Abb. 6 b) Gewebe verletzt. Repräsentative Bilder von binären, skizzierte, konvexen Rumpf/Verkapselung Kreis und Feld zählen Beispiele für jede Zelle analysiert mit und ohne das Protokoll Anwendung sind in Abbildung 6–F. Diese Bilder helfen, die Ursprünge der Unterschiede in der Morphologie Daten veranschaulichen, die in Abbildung 6zusammengefasst sind.
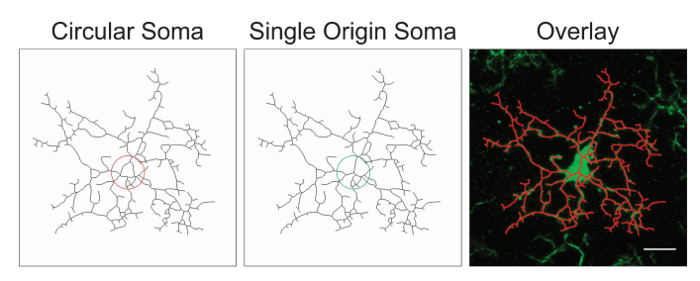
Abbildung 1: Abbildungen der skelettierten Mikroglia mit einer kreisförmigen Soma (suboptimale) im Vergleich zu einem einzigen Ursprung Soma (optimal) und die entsprechende Überlagerung zwischen der skelettierten Zelle und die ursprüngliche Mikrophotographie. Maßstabsleiste = 10 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
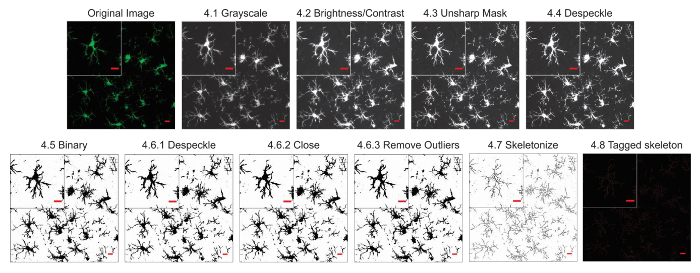
Abbildung 2: Protokoll Anwendung auf fluoreszierende oberflächenmustern. Abbildungen des Protokolls Skelett Analyse auf eine fluoreszierende Mikrophotographie mit einer einzelnen Zelle angewendet abgeschnitten, um Details anzuzeigen. Maßstabsleiste = 10 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
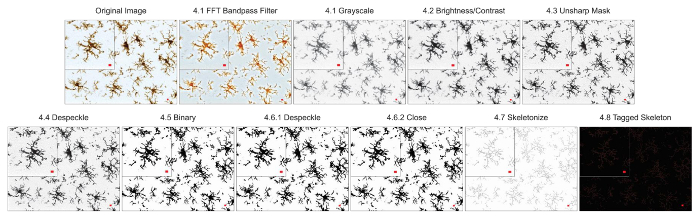
Abbildung 3. Protokolls Anwendung Hellfeld DAB oberflächenmustern. Abbildungen des Protokolls Skelett Analyse angewendet, ein Hellfeld DAB Mikrophotographie mit einer einzelnen Zelle beschnitten, um Details anzuzeigen. Maßstabsleiste = 10 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
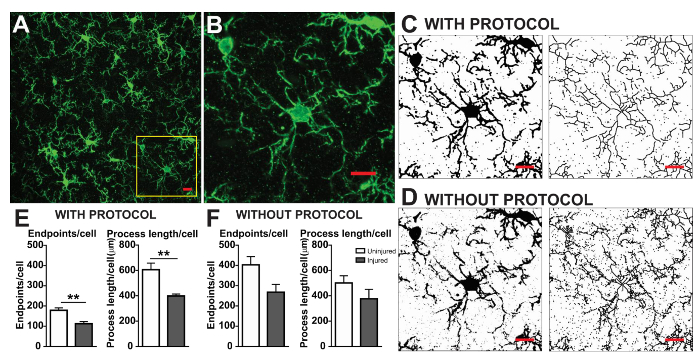
Abbildung 4. Datenanalyse mit und ohne Protokoll Anwendung. (A) ein Beispiel Mikrophotographie fluoreszierende IHC und beschnittenen Zelle, die den gelben Kasten unter (B). Binäre und skelettierten Beispielbilder mit (C) und ohne (D) das Protokoll angewendet wie beschrieben. Zusammenfassung der Daten der Mikroglia Endpunkte und Prozess/Länge/Zelle in unverletzt (weiß) und verletzte (grau) kortikalen Gewebe mit (E) und ohne (F) das Protokoll angewendet. Statistische Analyse mit Hilfe des Student t-Test und n = 3, ** p < 0,01 bezeichnet. Maßstabsleiste = 10 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
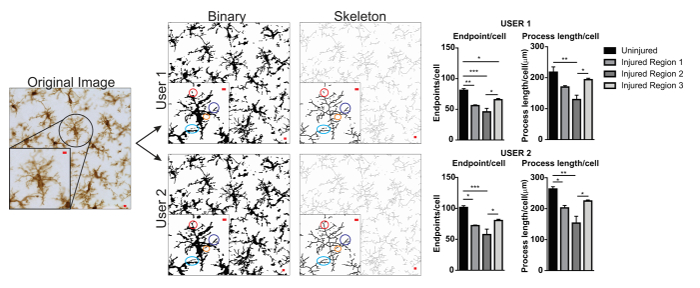
Abbildung 5. Benutzer-Unterschiede mit Protokoll Anwendung. Ein Beispiel für ein original Bild und Protokoll Umstellung auf binäre und Skelett Bilder von Benutzer 1 und Benutzer 2. Unterschiede zwischen den beiden Bildern sind mit passenden farbigen Kreise hervorgehoben. Zusammenfassende Graphiken von Mikroglia Endpunkte/Zelle und Prozessdaten Länge/Zelle in unverletzt und Geschädigten Hirnregionen von Benutzer 1 und Benutzer 2. Statistische Auswertung ANOVA mit Probe beträgt n = 3; p < 0,05, **p < 0,01 ***p < 0,001. Maßstabsleiste = 10 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
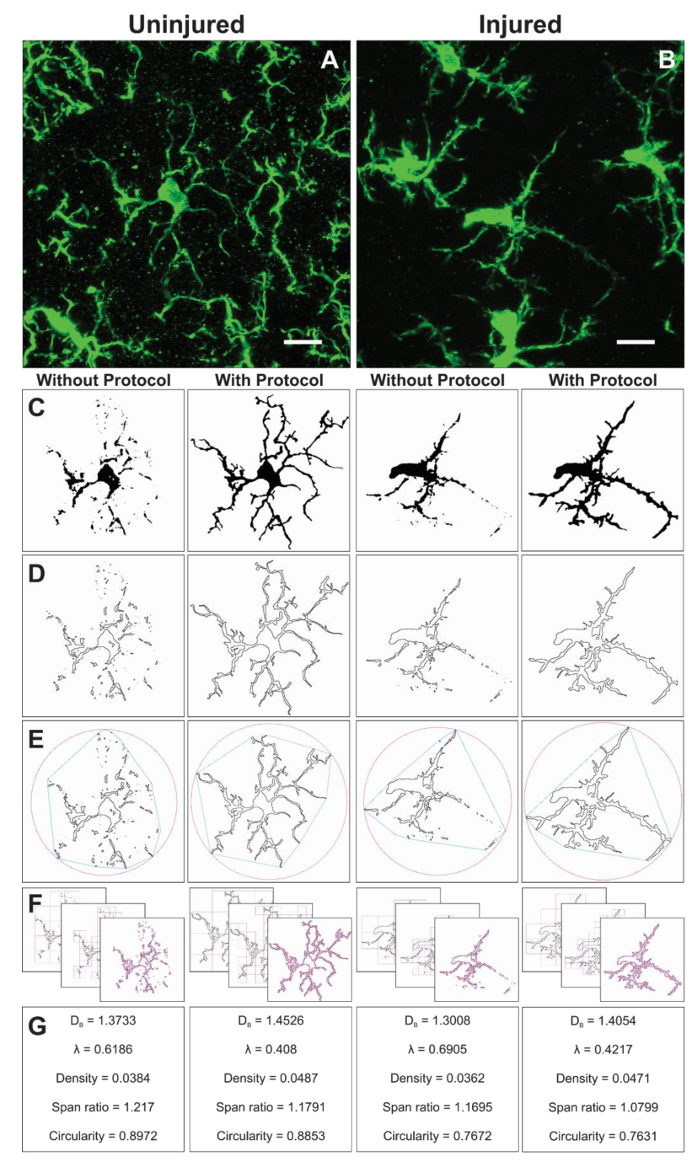
Abbildung 6. Fraktalanalyse mit und ohne Protokoll Anwendung. Beispiel für verkürzte Vergößerung der Mikroglia im unverletzten (A) und verletzte (B) Kortex mit entsprechenden binären (C) und Gliederung (D) Bilder, die mit und ohne das Protokoll angewendet ergeben. Die damit verbundenen konvexe Hülle (blau) und umschließenden Kreis (rosa) für die entsprechende Kontur Formen (E) werden verwendet, um Form Dichte berechnen, erstrecken sich über Verhältnis und Zirkularität (G). Feld Zählmethode ist illustriert (F) und für die Fraktale Dimension (D-B) und Lacunarity (λ) Berechnungen (G) verwendet. Maßstabsleiste = 10 µm. Bitte klicken Sie hier für eine größere Version dieser Figur.
Diskussion
Mikroglia-Zellen sind abgestimmt auf die Physiologie und Pathologie innerhalb ihrer mikrodomänen und ein breites Spektrum von Morphologien2 im subtilen7,14 und grober Verletzung8anzeigen. Die Verwendung von ImageJ Protokollen macht Mikroglia Morphologie Quantifizierung als Plattform für alle Laboratorien zugänglich und Plugins sind ein Open-Source-Bildbearbeitungsprogramm. Während die beschriebene Protokoll auf Bildverarbeitung und-Analyse mit dieser Software gerichtet ist, beginnt die Konsistenz der Datensammlung, Validität und Reliabilität mit ausgezeichneten IHC und Mikroskopie. Dieses Protokoll wird verwendet, um binäre, Skelett und Gliederung Darstellungen der gesamten Mikrofotos und Einzelzellen zu verbessern, aber kann nicht an die Stelle der Armen IHC beflecken und Mikroskopie, die Ergebnisse in geringem Kontrast, unscharf oder verzerrt Bilder. Als eine weitere Überlegung muss darauf geachtet werden, nicht auf das Hirngewebe während der Lagerung vor dem Schneiden, glätten, das Mikroglia Morphologie unwiderruflich verändert. Zu guter Letzt muss innerhalb jedes Experiment Mikroglia abgebildet werden mit der gleichen Skala sowie die gleichen Mikroskop. Instrumentierung, Ziele und Software variieren unter Mikroskopen die führen zu unterschiedlicher Größe Mikrofotos trotz ähnlicher Zielsetzung und ändern Sie die Details sowie die Anzahl der Zellen in jedem Frame. Bildaufnahme mit einem 40 X Objektiv auf eine Leica SPII ergibt beispielsweise zweimal die Anzahl der Zellen und weniger Details als Erwerb mit einem Zeiss-880. Dies ist besonders wichtig für die Zelle Verzweigung Daten aus den gesamten Rahmen, anstatt eine einzelne Zelle, da dies ein Problem der Daten Probenahme wird.
In der Regel vorausgeht Skelett Analyse, die die gesamte Mikrophotographie nutzt die einzelne Zelle Fraktal-Analyse aus zwei Gründen. Bestimmende Zelle Verzweigung aller Zellen in einem Mikrophotographie ist schnell im Vergleich zu der einzelnen Zelle Fraktalanalyse und als ein Screening-Instrument angesehen werden, kann wenn Zeit ein Faktor ist. Darüber hinaus werden die binären Bildern abgeleitet während Skelett Analyse für Fraktalanalyse verwendet. Sobald ein Image erstellt, gibt es eine Reihe von kritischen Schritte, die Einfluss Skelett Analyseergebnisse und Benutzer-Einfluss vorstellen kann. Die Protokoll-Schritte, die meisten variabel zwischen Benutzern sind Schritt 4.2 (zunehmende Helligkeit) und 4,5 (Bestimmung des Schwellenwerts). Soweit möglich, wird eine optimale Anzahl Erhöhung der Helligkeit (Max oder min Schieberegler zwischen 0-255) bestimmt und für alle Bilder und Anwender konstant gehalten. Wo Bild Variabilität groß ist, können die Benutzer stattdessen eine Helligkeit, die zwischen den Bildern variieren. Alternativ, wenn Bilder hell sind und Kontrast hoch ist, dann Helligkeit erhöhen kann weggelassen werden und Schwellwerte kann mithilfe eines Filters Spezialität Schwelle standardisiert werden (zB., Huang) anstatt die variablere Standard. Sobald optimiert, sollte die Parameter eingehalten werden um zusätzliche Benutzer-Einfluss zu minimieren.
Ein Beispiel für Benutzer Variabilität ist in Abbildung 5dargestellt. Datenwerte wurden in User 1 versus User 2 erhöht und daher würde die Variabilität erhöht werden, wenn Benutzer 1 und Benutzer 2 zur Datenerhebung beigetragen. Ein Beispiel für die Unterschiede in der Benutzer 1 und Benutzer 2 binäre und skelettierten Bilder sind deutlich durch farbige Kreise (Abbildung 5). In diesem Fall waren beide Benutzer kurz ausgebildeten Studenten mit begrenzten Expertise in der Mikroglia. Regelmäßige Kontrolle und Betreuung durch einen Experten zusammen mit erhöhten Protokoll Training2 Mikroglia können Inter Benutzer Variabilität reduzieren. Obwohl hier nicht bewertet, ist Fraktalanalyse weniger anfällig für Inter Benutzer Variabilität da binäre Zellen einzeln und manuell von einem Mikrophotographie, anstatt allein auf Schnittstellenüberwachung Mikroglia Formen bestimmen isoliert sind. Alle Methoden besitzen jedoch eine gewisse Variabilität zwischen den Nutzern. Daher ein einzelner Benutzer (im Idealfall ausgebildet durch einiges an Fachwissen in Mikroglia-Zellen) sollte die Datensammlung für eine gesamte Dataset abgeschlossen.
Zusätzliche Änderungen dieses Protokolls leicht erfolgen können und hängt die Bildqualität und die Bemühungen zur Reduzierung von Lärm und Prozess-Konnektivität zu gewährleisten. Zum Beispiel, wenn Kontrast ausreicht, dann Unscharf maskieren ist nicht notwendig und kann weggelassen werden. Es ist ratsam, zu optimieren und das Protokoll für eine bestimmte Gruppe von Bildern, experimentelle Fälle und Kontrollen, vor dem Sammeln von Daten aus einem ganzen Satz abzuschließen. Zu guter Letzt zusätzliche Plugins verwendet werden, anstelle von anderen zu formulieren oder zu schärfen Bilder, die in diesem Protokoll nicht beschrieben wurden wie zu dehnen oder zu schärfen.
Vorteile dieses Protokolls sind seine universelle Verfügbarkeit und Anpassungsfähigkeit. Darüber hinaus ist die Beurteilung Zelle Verzweigung mit AnalyzeSkeleton schnell und auf eine gesamte Mikrophotographie anwendbar. Ein Vorteil der multizelle Analyseansatz ist der Fokus auf einer ganzen Region anstatt einzelner Zellen. Daher ist es möglich, die durchschnittliche Auswirkung (in Bezug auf die Endpunkte und Prozess-Länge) alle Mikroglia im Bild schnell zu beurteilen. Skelett-Analyse liefert eine Analyse mehrerer Zellen: eine Auswahl der Daten in Bezug auf die Anzahl der Zellen, die nicht von Fraktalanalyse aufgrund der erforderlichen Zeit Investitionen, einzelne Zellen von Mikrofotos isolieren abgestimmt werden. Eine Instanz, wo dies am besten geeignet sein könnte, wäre in screening-Mikroglia Morphologien in Nähe einer fokalen Verletzung. Eine Einschränkung ist, dass das ganze Feld Bildrendering Skelettmodelle IHC Mikrofotos erstellen unvollkommen im Vergleich zu der zeitaufwändiger Einzelzelle Ansatz ist. Darüber hinaus sind eine regionsanalyse nicht Umständen angemessen Mikroglia Morphologien drastisch unterschiedlich im gleichen Bereich. Zu guter Letzt ist diese Analysemethode abhängig von Zellzahl, ein Parameter, der zwischen experimentellen Bedingungen abweichen.
Fraktalanalyse erfolgt auf eine einzelne Zelle und ergänzt somit die durchschnittliche Zelle Verzweigung Datenausgabe aus dem Skelett Analyse. Obwohl viel mehr zeitaufwendig, verschiedenste morphometrische Daten diese Investition bringt. Z. B. Zelle Dichte, Span-Verhältnis und Zirkularität Daten beschreiben die Größe, die Dehnung und die Form der Zelle Gliederung, beziehungsweise. Fraktale Dimension und Lacunarity fassen die Zelle Komplexität und Heterogenität der Form, beziehungsweise. Eine ausführlichere Zusammenfassung der wie jeder Parameter berechnet wird und wie Daten interpretiert werden können finden Sie in der interaktiven manuelle16 und so detailliert betrachtet werden, in Bezug auf die spezifische Fragestellung. Das beschriebene Protokoll führt zu empfindlichen Werkzeuge, kleine Änderungen in 2D Mikroglia Morphologien zu quantifizieren, die unter physiologischen und pathologischen Bedingungen auftreten können. Zusätzliche morphometrische Analyse wie Solidität, Konvexität und Form Faktor16,20 wenn 3D-Formen erzeugen möglicherweise.
Protokollentwicklung und Anpassung ist kontinuierlich und nutzerorientierten. Es wurde von Fluoreszenz8 DAB/Hellfeld Bilder7 aber noch nicht zu paraffin eingebettete Gewebe ausgedehnt. Es außerdem für zusätzliche Analysen in Verbindung mit proprietärer Software wie Imaris einsetzbar. Dieses Protokoll kann auch auf eine Vielzahl von Physiologie und beschränkt sich nicht auf Mikroglia aber angewandt werden, um jede Zelle oder eines Gewebes mit bestimmten Mustern oder Formen, die mit IHC Methoden identifiziert werden können. Mit ausreichender Stichprobengröße kann schließlich eine Multivariate oder Cluster-Analyse angewendet werden, um Schichten Mikroglia nach Morphologie12,21; Dies ist sinnvolle Informationen wie Mikroglia Morphologie ein wichtiger Indikator der Mikroglia Funktionen und Reaktionen auf ihre Umgebung ist. Die Wertschätzung für die Mikroglia morphologische Vielfalt ist expandierenden und zum Verständnis wichtig Neuron-Glia-Kreislauf Interaktionen in Gesundheit und Krankheit. Wachstum in diesem Bereich wird ergänzt durch gut ausgebaute, einfach zu bedienen und reproduzierbare Protokolle zu quantifizieren und Mikroglia Morphologie mit mehreren kontinuierlichen Variablen zusammenfassen.
Offenlegungen
Die Autoren haben nichts preisgeben.
Danksagungen
Diese Studie erhielten finanzielle Unterstützung von NINR (F32NR013611). Wir möchten weiter bestätigen und danken den Entwicklern von AnalyzeSkeleton(2D/3D) und FracLac (Arganda Carreras Et Al. und Karperien Et Al., beziehungsweise) ohne den hier beschriebene Analyse nicht möglich wäre.
Materialien
| Name | Company | Catalog Number | Comments |
| primary antibody anti-IBA1 | Wako | 019-19741 | rabbit host |
| Vectashield soft mount | Vector Labs | H-1000 | |
| Secondary antibody | Jackson ImmunorResearch | 711-545-152 | donkey host |
| 4 mL glass vial | Wheaton | UX-08923-11 | |
| Triton X-100 | Fisher Scientific | BP151 | |
| Sodium Azide (NaN3) | Sigma | S-8032 | |
| glass coverslip | Fisher Scientific | 12-544-G |
Referenzen
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nat Neurosci. 8 (6), 752-758 (2005).
- Karperien, A., Ahammer, H., Jelinek, H. F. Quantitating the subtleties of microglial morphology with fractal analysis. Front Cell Neurosci. 7 (3), eCollection (2013).
- Taylor, S. E., Morganti-Kossmann, C., Lifshitz, J., Ziebell, J. M. Rod microglia: a morphological definition. PLoS One. 9 (5), e97096 (2014).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308 (5726), 1314-1318 (2005).
- Abiega, O., et al. Neuronal Hyperactivity Disturbs ATP Microgradients, Impairs Microglial Motility, and Reduces Phagocytic Receptor Expression Triggering Apoptosis/Microglial Phagocytosis Uncoupling. PLoS Biol. 14 (6), e1002466 (2016).
- Wyatt-Johnson, S. K., Herr, S. A., Brewster, A. L. Status Epilepticus Triggers Time-Dependent Alterations in Microglia Abundance and Morphological Phenotypes in the Hippocampus. Front Neurol. 8 (700), eCollection (2017).
- Morrison, H., Young, K., Qureshi, M., Rowe, R. K., Lifshitz, J. Quantitative microglia analyses reveal diverse morphologic responses in the rat cortex after diffuse brain injury. Sci Rep. 7 (1), 13211 (2017).
- Morrison, H. W., Filosa, J. A. A quantitative spatiotemporal analysis of microglia morphology during ischemic stroke and reperfusion. J Neuroinflammation. 10 (4), (2013).
- Gyoneva, S., Traynelis, S. F. Norepinephrine modulates the motility of resting and activated microglia via different adrenergic receptors. J Biol Chem. 288 (21), 15291-15302 (2013).
- Xu, H., et al. Environmental Enrichment Potently Prevents Microglia-Mediated Neuroinflammation by Human Amyloid beta-Protein Oligomers. J Neurosci. 36 (35), 9041-9056 (2016).
- Rodriguez, J. J., Noristani, H. N., Verkhratsky, A. Microglial response to Alzheimer's disease is differentially modulated by voluntary wheel running and enriched environments. Brain Struct Funct. 220 (2), 941-953 (2015).
- Soltys, Z., et al. Quantitative morphological study of microglial cells in the ischemic rat brain using principal component analysis. J Neurosci Methods. 146 (1), 50-60 (2005).
- Orlowski, D., Soltys, Z., Janeczko, K. Morphological development of microglia in the postnatal rat brain. A quantitative study. Int J Dev Neurosci. 21 (8), 445-450 (2003).
- Morrison, H. W., Filosa, J. A. Sex differences in astrocyte and microglia responses immediately following middle cerebral artery occlusion in adult mice. Neuroscience. 339, (2016).
- Arganda-Carreras, I., Fernandez-Gonzalez, R., Munoz-Barrutia, A., Ortiz-De-Solorzano, C. 3D reconstruction of histological sections: Application to mammary gland tissue. Microsc Res Tech. 73 (11), 1019-1029 (2010).
- Davis, B. M., Salinas-Navarro, M., Cordeiro, M. F., Moons, L., De Groef, L. Characterizing microglia activation: a spatial statistics approach to maximize information extraction. Sci Rep. 7 (1), 1576 (2017).
- . ImageJ User Guide Available from: https://imagej.nih.gov/ij/docs/guide/ (2014)
- Karperien, A. L., Jelinek, H. F., , Fractal, Multifractal, and Lacunarity Analysis of Microglia in Tissue Engineering. Front Bioeng Biotechnol. 3 (51), eCollection (2015).
- Martyanova, E. K., Tishkina, A. O. 3D quantitative analysis of microglial morphology. available as conference preceedings SkoltechOn. , (2015).
- Fernandez-Arjona, M. D. M., Grondona, J. M., Granados-Duran, P., Fernandez-Llebrez, P., Lopez-Avalos, M. D. Microglia Morphological Categorization in a Rat Model of Neuroinflammation by Hierarchical Cluster and Principal Components Analysis. Front Cell Neurosci. 11 (235), eCollection (2017).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten