Sign In
ImageJ का उपयोग Immunohistochemistry तैयार ऊतक के Photomicrographs से Microglia आकृति विज्ञान बढ़ाता
In This Article
Summary
Microglia मस्तिष्क प्रतिरक्षा कोशिकाओं है कि सर्वेक्षण और सुघड़ परिवर्तन जो मात्रात्मक मूल्यांकन किया जा सकता है के माध्यम से बदल मस्तिष्क शरीर क्रिया विज्ञान के लिए प्रतिक्रिया कर रहे हैं । यह प्रोटोकॉल कक्ष प्रभाव, जटिलता, और आकृति जैसे मीट्रिक के अनुसार सतत डेटा के रूप में microglia आकृति विज्ञान का प्रतिनिधित्व करने के लिए एक ImageJ आधारित विश्लेषण प्रोटोकॉल को रेखांकित करता है.
Abstract
Microglia मस्तिष्क फ़ैगोसाइट कि मस्तिष्क homeostasis में भाग लेने और लगातार रोग, चोट, और रोग के लिए अपने पर्यावरण सर्वेक्षण कर रहे हैं । पहले प्रतिक्रिया के रूप में, microglia के लिए ंयूरॉन और glia शिथिलता को कम करने के लिए महत्वपूर्ण कार्य किया है, और इस प्रक्रिया में, वे सुघड़ परिवर्तन की एक व्यापक रेंज से गुजरना । Microglia morphologies वर्णनात्मक या वर्गीकृत किया जा सकता है, वैकल्पिक रूप से, ऐसे सेल असर, जटिलता, और आकार के रूप में मानकों के लिए एक सतत चर के रूप में quantified जा सकता है । जबकि microglia को बढ़ाता है के लिए तरीकों एकल कोशिकाओं को लागू कर रहे हैं, कुछ तकनीकों को एक पूरे photomicrograph में एकाधिक microglia के लिए लागू होते हैं । इस विधि के प्रयोजन के लिए आसानी से उपलब्ध ImageJ प्रोटोकॉल का उपयोग कर कई और एकल कोशिकाओं यों तो है । इस प्रोटोकॉल कदम और ImageJ plugins के प्रतिनिधि द्विआधारी और कंकाल छवियों में प्रतिदीप्ति और उज्ज्वल क्षेत्र photomicrographs बदलने के लिए और उंहें सॉफ्टवेयर plugins AnalyzeSkeleton का उपयोग कर विश्लेषण करने की सिफारिश की एक सारांश है (2d/ आकृति विज्ञान डेटा संग्रह के लिए । इन plugins के outputs प्रक्रिया अंतिमबिंदु, जंक्शनों, और लंबाई के रूप में के रूप में अच्छी तरह से जटिलता, कोशिका आकार, और आकार वर्णनकर्ता के मामले में कक्ष आकृति विज्ञान संक्षेप । यहां वर्णित कंकाल विश्लेषण प्रोटोकॉल एक पूरे photomicrograph या ब्याज के क्षेत्र (रॉय) के भीतर एक से अधिक microglia के क्षेत्रीय विश्लेषण के लिए अच्छी तरह से अनुकूल है, जबकि FracLac एक पूरक व्यक्ति सेल विश्लेषण प्रदान करता है । संयुक्त, प्रोटोकॉल एक उद्देश्य, संवेदनशील, और व्यापक आकलन उपकरण है कि विभिंन microglia स्वस्थ और घायल मस्तिष्क में मौजूद morphologies के बीच stratify के लिए इस्तेमाल किया जा सकता प्रदान करता है ।
Introduction
Microglia एक तत्काल और विविध सुघड़ की प्रतिक्रिया मस्तिष्क शरीर क्रिया विज्ञान में परिवर्तन करने के लिए1 है कि हाइपर-निहितार्थ और उच्च जटिल morphologies से de-ramified और amoeboid morphologies 2 से लेकर रेंज . Microglia भी ध्रुवीकरण और रॉड के आकार का हो सकता है3। Microglia सेल असर आमतौर पर एक जटिल आकार एकाधिक प्रक्रियाओं होने के रूप में परिभाषित किया गया है और अक्सर प्रति कक्ष अंतिमबिंदु की संख्या और सेल प्रक्रियाओं की लंबाई के रूप में सूचित किया है । चूंकि microglia पतले सतत सेल-सेल क्रॉस-टॉक और vivo गतिशीलता4,5, microglia morphologies विविध सेल कार्यों और शिथिलताओं के संकेतकों के रूप में सेवा कर सकते है के माध्यम से न्यूरॉन और glial समारोह को देखते है मस्तिष्क में । इन सुघड़ परिवर्तनों की विविधता का पर्याप्त रूप से वर्णन करने के लिए और सूक्ष्म शारीरिक perturbations के साथ होने ramified कोशिकाओं के बीच मतभेदों को भेद करने के लिए एक मात्रात्मक दृष्टिकोण आवश्यक है (जैसे मिर्गी5,6 और हिलाना7) सकल चोट के अलावा (जैसे स्ट्रोक8) । आकृति विज्ञान ठहराव7,8,9,10,11,12,13,14 का एक बढ़ा उपयोग स्वास्थ्य और रोग के दौरान microglia morphologies की पूर्ण विविधता का खुलासा करेगा । वर्तमान अध्ययन ImageJ के stepwise प्रयोग के लिए आवश्यक plugins के उपयोग की जरूरत है या गैर फ्लोरोसेंट photomicrographs microglia के immunohistochemistry (आइएचसी) के बाद फिक्स्ड कुतर ऊतक में अधिग्रहीत microglia आकृति का सारांश ।
विश्लेषण तकनीकों के लिए केंद्रीय यहां वर्णित ImageJ plugins AnalyzeSkeleton (2d/15, २०१० में विकसित करने के लिए बड़े स्तन संरचनाओं यों तो, और FracLac16, २०१४ में विकसित करने के लिए एकीकृत ImageJ और भग्न विश्लेषण कर रहे है व्यक्तिगत microglia आकार को बढ़ाता है । इन plugins पूरे photomicrographs या एक photomicrograph के भीतर एक परिभाषित रॉय के एकाधिक microglia के भीतर microglia असर का एक तेजी से विश्लेषण प्रदान करते हैं । इस विश्लेषण अकेले या भग्न विश्लेषण के साथ पूरक में इस्तेमाल किया जा सकता है । एकल सेल भग्न विश्लेषण (FracLac) समय के निवेश की आवश्यकता है, लेकिन microglia जटिलता, आकार, और आकार के बारे में एकाधिक आकृति विज्ञान outputs प्रदान करता है । दोनों उपकरणों का उपयोग बेमानी नहीं है, कोशिका के प्रभाव के रूप में कोशिका जटिलता के पूरक है, और एकाधिक मापदंडों का संयोजन डेटासेट के भीतर विविध microglia morphologies के बीच अंतर करने के लिए इस्तेमाल किया जा सकता है12,17.
Protocol
सभी प्रयोगों द्वारा अनुमोदित किया गया था और एरिजोना संस्थागत पशु देखभाल और उपयोग समिति और प्रयोगशाला पशुओं की देखभाल और उपयोग के लिए NIH दिशा निर्देशों के विश्वविद्यालय द्वारा स्थापित दिशा निर्देशों के अनुसार प्रदर्शन किया । देखभाल के लिए पशुओं के दर्द और असुविधा को कम करने के लिए लिया गया था । इच्छामृत्यु के तरीके एक अनुमोदित प्रोटोकॉल के अनुसार हैं और isoflurane संज्ञाहरण के तहत गर्भाशय ग्रीवा के decapitation से मिलकर बनता है ।
1. टिशू वडा
नोट: कक्ष आकृति विज्ञान को संरक्षित करने के लिए निश्चित, cryoprotected ऊतक नमूनों पर microglia आकृति विज्ञान विश्लेषण बाहर ले. निंनलिखित के लिए तैयार है और सीधे प्रतिदीप्ति आइएचसी के लिए निर्धारित ऊतक टुकड़ा एक मानक प्रोटोकॉल है ।
- एक euthanized जानवर से वांछित प्रयोग के बाद माउस या चूहे दिमाग निकालें और एक मानक प्रयोगशाला प्रोटोकॉल के अनुसार । 4 डिग्री सेल्सियस पर 24 घंटे के लिए एक 4% paraformaldehyde समाधान के 5 मिलीलीटर युक्त एक 10 मिलीलीटर की शीशी में मस्तिष्क रखें । फिर कुल्ला और 4 डिग्री सेल्सियस पर ७२ एच के लिए एक 30% सुक्रोज फॉस्फेट बफर समाधान (पंजाबियों, ०.०१ मीटर) के 5-10 मिलीलीटर में जगह है । -८० ° c पर पूरे दिमाग की दुकान एक cryostat, या 4 ° c के साथ जब तक कि एक microtome के साथ अनुभाग के साथ खोदी ऊतक ।
नोट: इस प्रोटोकॉल अभी तक तेल से कटा हुआ ऊतक-एंबेडेड ऊतक का उपयोग कर परीक्षण नहीं किया गया है । - धारा के मस्तिष्क ऊतक वांछित अनुभाग मोटाई और अभिविन्यास का उपयोग कर या तो एक cryostat या microtome और एक cryoprotection समाधान में मुक्त अस्थायी वर्गों की दुकान (५० mM पंजाब, ईथीलीन ग्लाइकोल, ग्लिसरॉल)-20 ° c.
नोट: यह प्रोटोकॉल सफलतापूर्वक ५० µm से २०० µm मोटाई में से लेकर राज्याभिषेक ऊतक वर्गों पर किया गया है । ऊतक वर्गों से कम ५० µm microglia प्रक्रियाओं की पूर्ण अवधि पर कब्जा नहीं हो सकता है, जबकि मोटी ऊतक वर्गों में, आइएचसी धुंधला ऊतक में एंटीबॉडी पैठ के कारण अपूर्ण हो सकता है । ऊतक या तो एक राज्याभिषेक या sagittal उंमुखीकरण में खोदी जा सकती है और इस विकल्प का अध्ययन किया जा करने के लिए प्रयोगात्मक लक्ष्य और मस्तिष्क क्षेत्र (ओं) पर निर्भर करेगा ।
2. Immunohistochemistry
नोट: कंकाल और भग्न विश्लेषण विधियों या तो प्रतिदीप्ति या 3, 3 '-diaminobenzidine (ढाब) आइएचसी के लिए लागू किया जा सकता है । निंनलिखित एक मानक प्रतिदीप्ति आइएचसी प्रोटोकॉल है और जरूरत के रूप में प्रतिस्थापित किया जा सकता है । प्रतिदीप्ति आइएचसी जब ढाब आइएचसी की तुलना में सेल प्रक्रियाओं के बेहतर दृश्य पैदावार ।
- एक 4 मिलीलीटर कांच की शीशी में ऊतक वर्गों प्लेस (अप करने के लिए 15 माउस मस्तिष्क वर्गों/शीशी) और 10% हार्स सीरम से युक्त समाधान के 1 मिलीलीटर के साथ मशीन, पंजाब (०.०१ मी.), ०.५% ट्राइटन, ०.०४% नण य 1 ज के लिए कमरे के तापमान (23 ° c) पर3 .
- पंजाब के साथ 5 मिनट के लिए धो लें (०.०१ मी) कमरे के तापमान पर तीन बार ।
- पंजाब (०.०१ मीटर), ०.५% ट्राइटन, ०.०४% नण3, और कवर (नण य3 के प्रभाव को बनाए रखने के लिए) में ७२ h के लिए कमरे के तापमान पर प्राथमिक एंटीबॉडी (Iba1, 1:1000) के साथ मशीन ।
- पंजाब के साथ 5 मिनट के लिए धो लें (०.०१ मी) कमरे के तापमान पर तीन बार ।
- माध्यमिक एंटीबॉडी के साथ मशीन (विरोधी खरगोश ४८८, 1:250) के लिए कमरे के तापमान पर कवर 4 एच के लिए 1 पंजाब (०.०१ एम) युक्त समाधान की मिलीलीटर, ०.५% ट्राइटन, ०.०४% नण3
- पंजाब के साथ 5 मिनट के लिए धो लें (०.०१ मी) कमरे के तापमान पर तीन बार ।
- स्लाइड subbed करने के लिए मस्तिष्क ऊतक वर्गों (संख्या और वरीयता के आधार पर उन्मुखीकरण) माउंट, एक नरम-सेट बढ़ते माध्यम से लागू होता है, और ऊतक पर coverslip जगह है । स्लाइड 4 ° c पर संग्रहीत है ।
नोट: एक १.५ ग्लास coverslip मोटाई फोकल इमेजिंग के लिए आवश्यक है । नरम सेट एक पसंदीदा बढ़ते माध्यम है क्योंकि उच्च चिपचिपापन ऊतक सेक नहीं है और सबसे अच्छा आकृति विज्ञान जब हार्ड सेट बढ़ते मीडिया की तुलना में बरकरार रखती है ।
3. इमेजिंग
- छवि Iba1 मस्तिष्क ऊतक अनुभाग में सकारात्मक कोशिकाओं एक उज्ज्वल क्षेत्र या फोकल माइक्रोस्कोप है कि एक z-ढेर अधिग्रहण एक 20X उद्देश्य या अधिक का उपयोग करने की क्षमता है का उपयोग कर ।
नोट: इमेजिंग पैरामीटर और सॉफ्टवेयर सेट-अप एक प्रयोग में सभी photomicrograph अधिग्रहण के लिए स्थिर होना चाहिए । उत्कृष्ट प्रक्रिया विस्तार एक 40X या 63X उद्देश्य का उपयोग कर प्राप्त की है । यह एक संपूर्ण photomicrograph या एक बहु-सेल रॉय एक बड़ा photomicrograph के भीतर के लिए यहां वर्णित कंकाल विश्लेषण प्रोटोकॉल लागू करने के लिए संभव है ।- उपयुक्त सॉफ्टवेयर माइक्रोस्कोप सॉफ्टवेयर करने के लिए विशिष्ट सेटिंग्स का उपयोग करके 8 बिट छवियों मोल ।
नोट: 8-बिट पोस्ट-प्राप्ति के लिए फ़ाइलों का कनवर्ज़न डेटा संग्रह को विकृत कर सकता है । - प्राप्त एक 30 µm z-के साथ कोई अधिक से अधिक एक 2 µm अंतराल के साथ छवियों को उपयुक्त सॉफ्टवेयर माइक्रोस्कोप सॉफ्टवेयर के लिए विशिष्ट सेटिंग्स का उपयोग कर ।
नोट: माइक्रोस्कोप और सॉफ्टवेयर एक एक्स, वाई, और जेड अक्ष में छवि अधिग्रहण के लिए अनुमति चाहिए । z-स्टैक बढ़ सकता है, और अतिरिक्त microglia विवरण प्रदान करने के लिए अंतराल में कमी हो सकती है । एक्सचेंज में, इमेजिंग समय में वृद्धि होगी । प्रतिदीप्ति माइक्रोस्कोपी के लिए जहां संभव Nyquist नमूना का उपयोग करें ।
- उपयुक्त सॉफ्टवेयर माइक्रोस्कोप सॉफ्टवेयर करने के लिए विशिष्ट सेटिंग्स का उपयोग करके 8 बिट छवियों मोल ।
- Tif फ़ाइलों के रूप में या माइक्रोस्कोप सॉफ्टवेयर द्वारा आवश्यक के रूप में सभी फ़ाइलों को बचाओ ।
- ImageJ में Tif फ़ाइलें खोलें और उपकरण पट्टी का उपयोग करने के लिए छवि क्लिक करके चैनल विभाजित करें । रंग | चैनल भाजित, और चित्र क्लिक करके ढेर छवियों । पोट | एक्स परियोजना । अधिकतम तीव्रता प्रोजेक्शन जहां उचित है । tif फ़ाइलों के रूप में सहेजें ।
4. कंकाल विश्लेषण
- फिजी या ImageJ से < https://imagej.net/Fiji/Downloads>. डाउनलोड करें व्यक्तिगत plugins के लिए, < http://imagej.net/AnalyzeSkeleton>15 से (2d/AnalyzeSkeleton डाउनलोड करें और < https://imagej.nih.gov/ij/plugins/fraclac/fraclac.html>16से FracLac डाउनलोड कर ᱶ ।
नोट: एक द्विआधारी कंकाल छवि के लिए एक photomicrograph बदलने की पूरी प्रक्रिया से कम 1 मिनट लेता है । - यदि एक प्रतिदीप्ति photomicrograph का उपयोग कर, सुनिश्चित करें कि छवि 8 बिट है और ग्रेस्केल में कनवर्ट करने के लिए सबसे अच्छा सभी सकारात्मक धुंधला कल्पना । टूलबार का उपयोग करें और छवि । लुकअप तालिका । ग्रेस. यदि एक ढाब उज्ज्वल क्षेत्र तस्वीर का उपयोग कर, पहले FFT bandpass फ़िल्टर प्लगइन का उपयोग करें (प्रक्रिया पर क्लिक करके उपकरण पट्टी का उपयोग । FFT | bandpass फ़िल्टर) और फिर ग्रेस्केल में कनवर्ट करें ।
नोट: इस प्रोटोकॉल के प्रयोजनों के लिए, ImageJ एक FFT Bandpass फ़िल्टर के लिए डिफ़ॉल्ट सेटिंग्स पर्याप्त है (अप करने के लिए 3 पिक्सेल फ़िल्टर, ४० के लिए नीचे, कोई धारी दमन) । छवि के समग्र बड़े पहलुओं को बनाए रखते हुए एक FFT Bandpass फिल्टर आवेदन शोर (छोटी सुविधाओं) को हटा. यह उज्ज्वल क्षेत्र छवियों में विशेष रूप से उपयोगी है, जहां विभाजन और ऊतकों में दरारें पृष्ठभूमि के रूप में दिखाई देते हैं और इस तरह कंकाल विश्लेषण18जटिल कर सकते हैं. - यदि छवि बहुत मंद है और microglia प्रक्रिया को विज़ुअलाइज़ नहीं किया जा सकता है तो चमक और कंट्रास्ट समायोजित करें । टूलबार का उपयोग करें और छवि । समायोजित करें । चमक कंट्रास्ट/ आवश्यकतानुसार न्यूनतम या अधिकतम स्लाइडर्स समायोजित करें, हिस्टोग्राम के किनारों तक, लेकिन आगे नहीं.
नोट: ImageJ में, चमक और कंट्रास्ट छवि के लुकअप तालिका (LUT) को अद्यतन करके परिवर्तित हो जाते हैं, इसलिए पिक्सेल मान अपरिवर्तित रहते हैं । अधिकतम और न्यूनतम स्लाइडर्स प्रदर्शन रेंज की निचली और ऊपरी सीमा को नियंत्रित करते हैं, ऊपर पिक्सेल मानों के साथ २५५ सफेद और पिक्सेल मानों को दिखाई दे रहा है 0 दिखने वाला काला18। प्रतिदीप्ति photomicrographs के मामले में, अधिकतम स्लाइडर इस्तेमाल किया जाना चाहिए, जबकि न्यूनतम स्लाइडर ढाब दाग microglia के photomicrographs के लिए इस्तेमाल किया जाएगा. - प्रक्रिया को क्लिक करके उपकरण पट्टी का उपयोग करके कंट्रास्ट बढ़ाने के लिए एक शार्प मास्क फ़िल्टर चलाएं । फिल्टर । तेज मास्क। इस प्रोटोकॉल के प्रयोजनों के लिए, ImageJ की डिफ़ॉल्ट सेटिंग्स (3 और ०.६ के मुखौटा वजन की एक पिक्सेल त्रिज्या) का उपयोग किया जाता है ।
नोट: unशार्प मास्क पैनापन और छवि के एक धुंधला संस्करण मूल से (unशार्प मास्क), और फिर मूल छवि के एक उच्च विपरीत संस्करण के साथ परिणामी छवि विलय द्वारा एक छवि की बढ़त सुविधाओं को बढ़ाता है.... इसलिए, शार्प मास्क फ़िल्टर विवरण नहीं बनाता है, बल्कि एक छवि में मौजूदा विवरण स्पष्ट करता है । परिवर्तन की स्थापना कैसे धुंधली तेज मुखौटा (और इस प्रकार होगा कितना धुंधला हटा दिया जाएगा), और मुखौटा वजन सेटिंग कंट्रास्ट की डिग्री है कि तेज मुखौटा के साथ विलय हो जाएगा परिवर्तन (और इस तरह अंतिम छवि के विपरीत समायोजित कर देता है) । - तेज मुखौटा द्वारा उत्पन्न नमक और काली मिर्च के शोर को दूर करने के लिए एक despeckle कदम प्रदर्शन । टूलबार का उपयोग करें और प्रक्रिया | रव | Despeckle।
नोट: Despeckle अपने 3 × 3 पड़ोस में औसत मूल्य के साथ प्रत्येक पिक्सेल की जगह से नमक और काली मिर्च शोर हटा । प्रभाव यह है कि तीव्रता में outliers18किनारों के तेज को प्रभावित किए बिना औसत पिक्सेल द्वारा प्रतिस्थापित कर रहे हैं । - छवि को क्लिक करके उपकरण पट्टी का उपयोग कर बाइनरी में परिवर्तित करें । समायोजित करें । दहलीज.
नोट: stratifies की पृष्ठभूमि बनाम रुचि की सुविधाओं में ग्रेस्केल छवियों को थ्रेशोल्ड करना और छवि को बाइनरी18में कनवर्ट करता है । - despeckle लागू करें, बंद करें, और outliers फ़ंक्शन को निकालें: परिणामी बायनेरी छवि में, हो सकता है एकल-पिक्सेल पृष्ठभूमि शोर और प्रक्रियाओं के बीच अंतराल ।
- प्रक्रिया क्लिक करके टूलबार का उपयोग करके despeckle फ़ंक्शन लागू करें । रव | Despeckle।
नोट: बाइनरी छवि के लिए despeckle लागू कर रहा है किसी भी शेष एकल पिक्सेल शोर निकालता है । - प्रक्रिया क्लिक करके उपकरण पट्टी का उपयोग करके बंद करें फ़ंक्शन को लागू करना | बाइनरी | बंद करें।
नोट: यदि वे 2 पिक्सेल तक अलग कर रहे हैं इस प्लगइन दो डार्क पिक्सेल जोड़ता है. - प्रक्रिया क्लिक करके उपकरण पट्टी का उपयोग करके निकालें outliers फ़ंक्शन लागू करें । रव | Outliers निकालें।
नोट: इस प्रोटोकॉल के प्रयोजनों के लिए, उज्ज्वल outliers 2 की एक पिक्सेल त्रिज्या और ५० की दहलीज के साथ लक्षित कर रहे हैं । इस प्लगइन के आसपास के क्षेत्र में औसत पिक्सल द्वारा एक उज्ज्वल या अंधेरे ग़ैर पिक्सेल बदलता है अगर यह एक निश्चित मूल्य (दहलीज)18से अधिक द्वारा भटक ।
- प्रक्रिया क्लिक करके टूलबार का उपयोग करके despeckle फ़ंक्शन लागू करें । रव | Despeckle।
- भविष्य के उपयोग और/या भग्न विश्लेषण के लिए एक अलग फ़ाइल के रूप में छवि सहेजें और प्रक्रिया पर क्लिक करके उपकरण पट्टी का उपयोग कर छवि skeletonize । बाइनरी | Skeletonize।
- कंकाल छवि का चयन करें और प्लगइन AnalyzeSkeleton (2d/भागो Plugins क्लिक करके टूलबार का उपयोग कर) । कंकाल । कंकाल का विश्लेषणकरें, और शाखा जानकारी बॉक्स की जाँच ।
नोट: यह संभावना है कि छवि प्रसंस्करण के अलावा या ऊपर सुझाए गए चरणों का विलोपन के साथ अनुकूलन की आवश्यकता होगी । इस प्रक्रिया में, कंकाल छवियों कंकाल और मूल छवि के एक ओवरले बनाने के द्वारा सटीकता के लिए मूल्यांकन कर रहे हैं । सोमा केंद्र से निकलने वाली प्रक्रियाओं के साथ एकल मूल अंक होना चाहिए; परिपत्र सोमाs डेटा को मिला और प्रोटोकॉल समायोजन के माध्यम से बचा जाना चाहिए । परिपत्र सोमा बनाम एकल मूल बिंदु का एक उदाहरण चित्रा 1में सचित्र है ।
गैर-प्रतिनिधि कंकाल और सुझाए गए समाधानों के परिणामस्वरूप होने वाली सामान्य समस्याएँ:
- छवि बहुत मंद: greyscale में कनवर्ट करें, चमक/कंट्रास्ट स्लाइडर को समायोजित करें, और/या शार्प मास्क लागू करें
- बहुत अधिक पृष्ठभूमि: चमक/कंट्रास्ट स्लाइडर समायोजित करें, Despeckle लागू करें, और/outliers निकालें
- कंकाल छवि में परिपत्र सोमा (विशेष रूप से प्रतिदीप्ति छवियों के लिए): लागू FFT Bandpass फ़िल्टर, और/
- ऊतक में दरारें (विशेष रूप से उज्ज्वल क्षेत्र छवियों के लिए): FFT Bandpass फ़िल्टर लागू करें, और/Despeckle
- परिणाम और शाखा जानकारी outputs से सभी डेटा की प्रतिलिपि बनाएं और एक एक्सेल स्प्रेडशीट में डेटा पेस्ट करें ।
- Excel में, आइएचसी और छवि प्राप्ति से परिणाम कंकाल अंशों को निकालने के लिए डेटा ट्रिम करें ।
- raw डेटा आउटपुट के साथ experiment कार्यपुस्तिका को कंकाल विश्लेषण से डुप्लिकेट करें और फ़ाइल नाम के लिए ट्रिम जोड़ें । भविष्य में उपयोग और संदर्भ के लिए अपुष्ट डेटा को रक्षित करने के लिए डुप्लिकेट किए गए कार्यपुस्तिका में सभी अनुवर्ती डेटा ट्रिमिंग होना चाहिए ।
- निर्धारित करें कि ImageJ में कंकाल की गई छवि को खोलकर और रेखा उपकरण का चयन करके अंशों की कौन-सी लंबाई डेटासेट से ट्रिम की जाएगी । कई टुकड़ों को मापने, औसत लंबाई के नोट लेने, और एक कटऑफ मूल्य पर फैसला ।
नोट: यहाँ प्रस्तुत डेटा के प्रयोजनों के लिए, अनचाहे अंशों के लिए कटऑफ लंबाई ०.५ है. यह मान किसी डेटासेट के दौरान एकरूप होना चाहिए । - कस्टम सॉर्ट और फ़िल्टर क्लिक करके Excel स्प्रेडशीट सॉर्ट करें । कस्टम सॉर्टकरें । "समापन बिंदु voxels" के आधार पर सबसे बड़े से छोटी और, एक नए स्तर में, "Mx शाखा पॉइंट" से सबसे बड़े से छोटी तक सॉर्ट करें ।
- 2 अंतिमबिंदु से कम कटऑफ मान (जैसे, ०.५) की अधिकतम शाखा लंबाई के साथ प्रत्येक पंक्ति निकालें । छवि से एकत्रित अंतिमबिंदु की कुल संख्या की गणना करने के लिए अंतिमबिंदु स्तंभ में डेटा का योग है ।
- शाखा जानकारी डेटा के लिए दोहराएँ: सबसे बड़े से छोटी से ' शाखा लंबाई ' के आधार पर क्रमबद्ध करें. डेटा के माध्यम से स्क्रॉल करें और कटऑफ मान से कम की एक शाखा लंबाई है कि हर पंक्ति को दूर(अर्थात, ०.५). छवि से एकत्रित सभी शाखाओं की अभिव्यक्त लंबाई की गणना करने के लिए शाखा लंबाई स्तंभ में मानों का योग करें ।
- दोहराएँ कदम 4.11.3-4.11.5 हर छवि के लिए/पत्रक जब तक सभी डेटा छंटनी और अभिव्यक्त किया गया है.
- इसी छवि में microglia सोमाओं की संख्या से प्रत्येक छवि (समापन की संख्या और संक्षेप शाखा लंबाई) से डेटा विभाजित करें । सांख्यिकीय सॉफ़्टवेयर में अंतिम डेटा (अंतिमबिंदु/सेल और शाखा की लंबाई/
नोट: संक्षेप शाखा लंबाई/सेल डेटा को पिक्सेल में लंबाई से माइक्रोन के लिए रूपांतरण की आवश्यकता हो सकती है ।
5. भग्न विश्लेषण
नोट: FracLac विभिंन आकार विश्लेषण है कि इस प्रोटोकॉल में शामिल नहीं है की एक संख्या को चलाने में सक्षम है । FracLac के विभिन्न फ़ंक्शंस के अधिक विस्तृत विवरण के लिए, < https://imagej.nih.gov/ij/plugins/fraclac/FLHelp/Introduction.htm> और संबद्ध संदर्भ 2,16,19पर FracLac मैनुअल देखें । भग्न विश्लेषण प्रोटोकॉल कदम 4.1-4.7 ऊपर वर्णित का उपयोग करता है ।
- रॉय कि सभी भग्न विश्लेषण के लिए इस्तेमाल किया जाएगा के आकार का निर्धारण । ROI बनाने के लिए आयत टूल का उपयोग करें. सुनिश्चित करें कि संपूर्ण कक्ष को कैप्चर करने के लिए बॉक्स काफी बड़ा है और डेटासेट के दौरान एकरूप रह सकता है.
नोट: यह सुनिश्चित करने के लिए मुक्तहस्त चयन के बजाय आयत चयन का उपयोग करें कि सभी ROIs समान आकार के आयत हैं, और इसलिए, कक्षों का समान स्केल है । यह मामला अगर मुक्तहस्त चयन इस्तेमाल किया गया है क्योंकि ImageJ स्वत: एक वर्ग रॉय पैमाने पर अलग आकार आयताकार खिड़कियों अलग तराजू के साथ कोशिकाओं में जिसके परिणामस्वरूप फिट होगा नहीं होगा । जबकि भग्न आकार पैमाने पर स्वतंत्र हैं, भग्न विश्लेषण ImageJ के लिए FracLac का उपयोग करने की प्रक्रिया पैमाने पर निर्भर है16। इस प्रकार, वहां एक लगातार डेटा संग्रह भर में रॉय आकार के लिए की जरूरत है । - बेतरतीब ढंग से प्रत्येक photomicrograph और इसी बाइनरी छवि में भग्न विश्लेषण के लिए microglia का चयन करें । roi प्रबंधक विंडो में, roi को सेल की स्थिति पर लॉक करने के लिए अपडेट करें चुनें । ROI के भीतर क्षेत्र को नई विंडो के रूप में डुप्लिकेट करने के लिए Ctrl + Shift + D का उपयोग करें, और फिर क्रॉप किए गए कक्ष को सहेजें । संगत बाइनरी छवि (कंकाल विश्लेषण से) पर, ROI प्रबंधक का उपयोग करके उसी कक्ष के साथ क्षेत्र को डुप्लिकेट करें. कोशिकाओं की एक पर्याप्त संख्या बेतरतीब ढंग से भग्न विश्लेषण के लिए चुना गया है और सभी फ़ाइलों को बचाने जब तक दोहराएँ ।
नोट: एक यादृच्छिक संख्या जनरेटर और एक गिने ग्रिड बेतरतीब ढंग से कोशिकाओं का चयन करने के लिए इस्तेमाल किया जा सकता है । - व्यक्तिगत कक्ष के साथ बाइनरी छवि खोलें । तूलिका उपकरण पर डबल क्लिक करें, रंग काला करने के लिए सेट, और ब्रश चौड़ाई आवश्यकतानुसार समायोजित । एक संदर्भ के रूप में मिलान photomicrograph का उपयोग करना, तूलिका सन्निकट कोशिका प्रक्रियाओं को हटाने के लिए उपयोग, खंडित प्रक्रियाओं को जोड़ने, और ब्याज की कोशिका को अलग. बाइनरी कक्ष अलग किया गया है एक बार, बायनेरी फ़ाइल सहेजें ।
नोट: ' alt ' धारण करने से तूलिका का अग्रभाग का रंग (black) बैकग्राउंड रंग (white) से स्विच होगा । - बाइनरी सेल को प्रक्रिया के माध्यम से टूलबार का उपयोग करके किसी बाह्यरेखा में रूपांतरित करें | बाइनरी | बाह्यरेखा।
नोट: छवि J के लिए FracLac या तो ठोस आकृतियों या आकृति की रूपरेखा पर उपयोग किया जा सकता है, तथापि, वर्तमान कन्वेंशन आकृति16का उपयोग करने के लिए है । - टूलबार में, प्लग-इन क्लिक करके टूलबार का उपयोग करके FracLac खोलें । भग्न विश्लेषण । FracLac और बीसी (बॉक्स काउंटिंग)का चयन करें । ग्रिड डिज़ाइन सेटिंग्स में, Num G को 4 सेट करें । ग्राफ़िक्स विकल्प के अंतर्गत, कक्ष के उत्तल पतवार और बाउंडिंग सर्कल का विश्लेषण करने के लिए मेट्रिक ्स बॉक्स की जांच करें । समाप्त होने पर, ठीकका चयन करें ।
नोट: num g, स्कैन के दौरान उपयोग किए जाने वाले ग्रिड ओरिएंटेशन की संख्या और Num g के लिए अनुशंसित श्रेणी 4-12 है । Num G सेटिंग और सुझाई गई श्रेणी को FracLac मैनुअल16में अच्छी तरह से समीक्षा की जाती है । Num G बढ़ाना उल्लेखनीयतया परिकलन समय धीमा कर सकता है । FracLac सेटिंग्स केवल सत्र प्रति एक बार स्थापित करने की आवश्यकता होगी । एक बार सेटिंग्स दर्ज किया गया है, स्कैन बटन उपलब्ध हो जाएगा । - चयनित छवि पर एक बॉक्स-गणना स्कैन चलाने के लिए स्कैन बटन का चयन करें ।
नोट: स्कैन डेटा outputs के साथ तीन खिड़कियों: पतवार और सर्कल परिणाम, बॉक्स गणना सारांश फ़ाइल, और प्रकार स्कैन उत्पंन करेगा । स्कैन प्रकार विंडो में एक लॉग सेटिंग्स का उपयोग किया जाता है, साथ ही कुछ उपायों के लिए मानक विचलन है । इस प्रोटोकॉल के प्रयोजनों के लिए, स्कैन प्रकार विंडो उपयोग नहीं किया जाता है और बंद या भविष्य में संदर्भ के लिए सहेजा जा सकता है । - पतवार और सर्कल परिणाम खिड़की में, सभी वांछित डेटा की प्रतिलिपि (यानी, घनत्व, अवधि अनुपात, और परिपत्र) परिणाम । बॉक् स गणना सारांश विंडो में, इच्छित डेटा (यानी, भग्न आयाम और lacunarity) परिणामों की प्रतिलिपि बनाएं । प्रतिलिपि बनाए गए डेटा को किसी Excel फ़ाइल या सांख्यिकीय सॉफ़्टवेयर में स्थानांतरित करें ।
नोट: FracLac आउटपुट डेटा की एक पूरी सूची प्रदान की और अच्छी तरह से ImageJ मैनुअल के लिए FracLac में समझाया गया है16.
Representative Results
microglia आकृति विज्ञान विश्लेषण प्रोटोकॉल वर्णित इस के साथ साथ morphometric विश्लेषण के लिए फ्लोरोसेंट प्रसंस्करण और ढाब photomicrographs में सहायक कदम संक्षेप । चित्र 2 और आरेख 3में इन चरणों को विज़ुअल रूप से सारांशित कर रहे हैं । इन कदमों का लक्ष्य एक प्रतिनिधि बाइनरी और कंकाल छवि है कि उचित मॉडल मूल photomicrograph ऐसी है कि संचित डेटा मांय है बनाने के लिए है । प्रोटोकॉल अनुप्रयोग के बाद, AnalyzeSkeleton प्लगइन एक टैग की गईं कंकाल छवि जिसमें से समापन और शाखा (यानी, प्रक्रिया) की संख्या lengthcan आउटपुट फ़ाइलों से सारांशित किया जा करने में परिणाम है । समापन और प्रक्रिया लंबाई डेटा तो photomicrograph या रॉय में microglia असर की हद तक अनुमान करने के लिए उपयोग किया जाता है । आरेख 4 के साथ और प्रोटोकॉल अनुप्रयोग के बिना एकत्रित परिणामी डेटा (अंतिमबिंदु/कक्ष और प्रक्रिया लंबाई/कक्ष) संक्षिप्त करता है । समान रुझान मौजूद होने पर, आरेख 4F में सारांशित डेटा चित्रा 4Eकी तुलना में कम परिवर्तनशील होता है । इसके साथ ही, इन डेटा प्रोटोकॉल लागू करते समय समूहों के बीच अंतर का पता लगाने के लिए बढ़ी हुई संवेदनशीलता को समझाने । अंत में, देखभाल प्रोटोकॉल के आवेदन में अंतर उपयोगकर्ता परिवर्तनशीलता के विषय में लिया जाना चाहिए । इस तरह के मतभेदों को चित्रा 5 जहां एक ही डेटा सेट द्वारा दो स्वतंत्र उपयोगकर्ताओं के ऊपर संक्षेप के रूप में एक समान प्रोटोकॉल लागू करने से विश्लेषण किया गया संक्षेप हैं ।
अतिरिक्त आकृति विज्ञान डेटा प्रोटोकॉल अनुप्रयोग के दौरान बनाए गए बाइनरी छवियों से पृथक एकल कक्षों से एकत्रित किए जाते हैं. FracLac प्लगइन का उपयोग करने से पहले और microglia आकृति का विश्लेषण करने के लिए प्रोटोकॉल चरण आरेख 6में सारांशित किए जाते हैं । हम दोनों को घायल (चित्रा 6A) और घायल (फिगर घमण्ड) ऊतक में इस विश्लेषण का वर्णन । द्विआधारी, रेखांकित, उत्तल पतवार/encapsulating सर्कल के प्रतिनिधि छवियां, और बॉक्स गिनती प्रत्येक कोशिका के लिए उदाहरण के साथ और प्रोटोकॉल आवेदन के बिना विश्लेषण किया चित्रा 6C-F. ये छवियां आरेख 6Gमें संक्षिप्त किए गए आकृति विज्ञान डेटा में अंतर के मूल को समझाने में मदद करती हैं ।
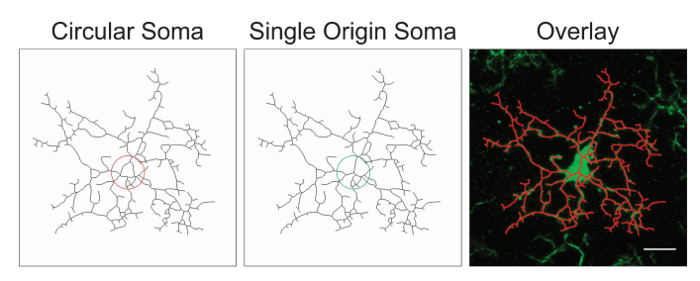
चित्र 1. एक परिपत्र सोमा के साथ कंकाल microglia के चित्र (इष्टतम) एक एकल मूल सोमा बनाम (इष्टतम) और कंकाल सेल और मूल photomicrograph के बीच इसी ओवरले । स्केल बार = 10 µm. इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें.
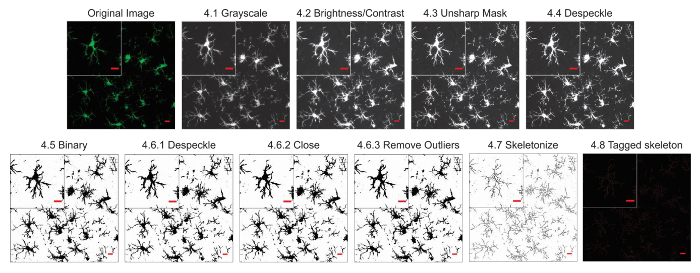
चित्र 2. फ्लोरोसेंट photomicrographs के लिए प्रोटोकॉल आवेदन । कंकाल विश्लेषण प्रोटोकॉल के चित्र एक एकल कोशिका के साथ एक फ्लोरोसेंट photomicrograph के लिए लागू विवरण दिखाने के लिए फसली । स्केल बार = 10 µm. इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें.
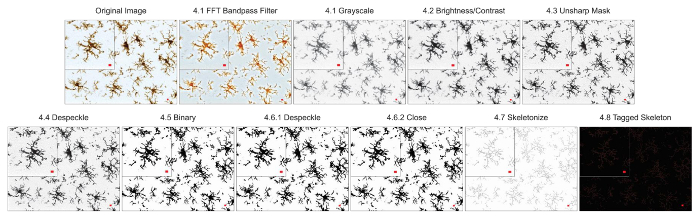
चित्र 3. प्रोटोकॉल अनुप्रयोग उज्ज्वल करने के लिए-क्षेत्र ढाब photomicrographs । एक चमकदार क्षेत्र ढाब photomicrograph के लिए लागू कंकाल विश्लेषण प्रोटोकॉल के चित्र विवरण दिखाने के लिए एक एकल कोशिका फसली के साथ । स्केल बार = 10 µm. इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें.
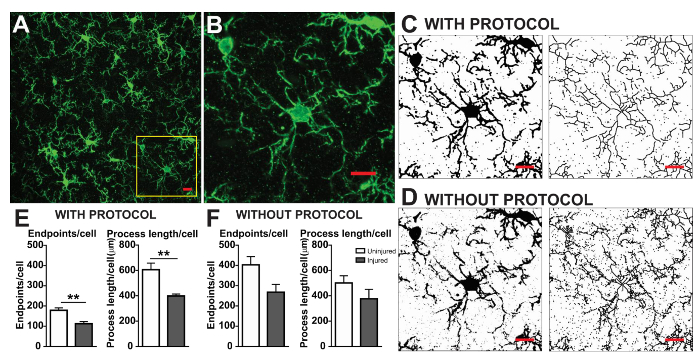
चित्र 4. के साथ और प्रोटोकॉल अनुप्रयोग के बिना डेटा विश्लेषण । (क) (ख) में पीले बॉक्स के लिए इसी फ्लोरोसेंट आइएचसी और फसली सेल का एक उदाहरण photomicrograph. उदाहरण के साथ बाइनरी और कंकाल छवियों (C) और बिना (D) प्रोटोकॉल को वर्णित के रूप में लागू किया गया है । microglia अंतिमबिंदु का सारांश डेटा/सेल और प्रक्रिया की लंबाई/(सफेद) और घायल (ग्रे) cortical ऊतक के साथ (E) और बिना (F) प्रोटोकॉल लागू किया गया । छात्र के t-परीक्षण और n = 3, * * के उपयोग से सांख्यिकीय विश्लेषण p < ०.०१ । स्केल बार = 10 µm. इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें.
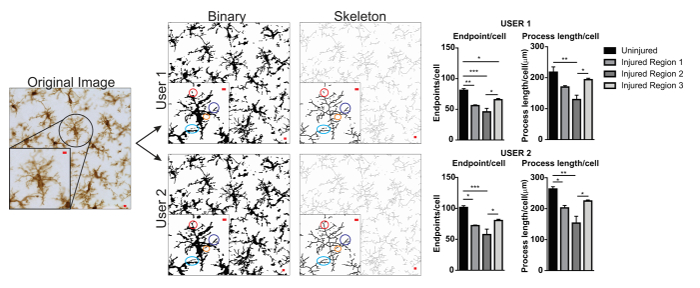
चित्र 5. प्रोटोकॉल अनुप्रयोग के साथ उपयोगकर्ता अंतर । उपयोगकर्ता 1 और उपयोगकर्ता 2 द्वारा बाइनरी और कंकाल छवियों के लिए एक मूल छवि और प्रोटोकॉल रूपांतरण का एक उदाहरण । दो छवियों के बीच अंतर मिलान रंग हलकों के साथ उजागर कर रहे हैं । microglia अंतिमबिंदु का सारांश रेखांकन/सेल और प्रक्रिया लंबाई/घायल और घायल मस्तिष्क क्षेत्रों में उपयोगकर्ता 1 और उपयोगकर्ता 2 द्वारा सेल डेटा । ANOVA और नमूना आकार के साथ सांख्यिकीय विश्लेषण n = 3 है; * p < ०.०५, * * p < ०.०१, * * *p < ०.००१ । स्केल बार = 10 µm. इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें.
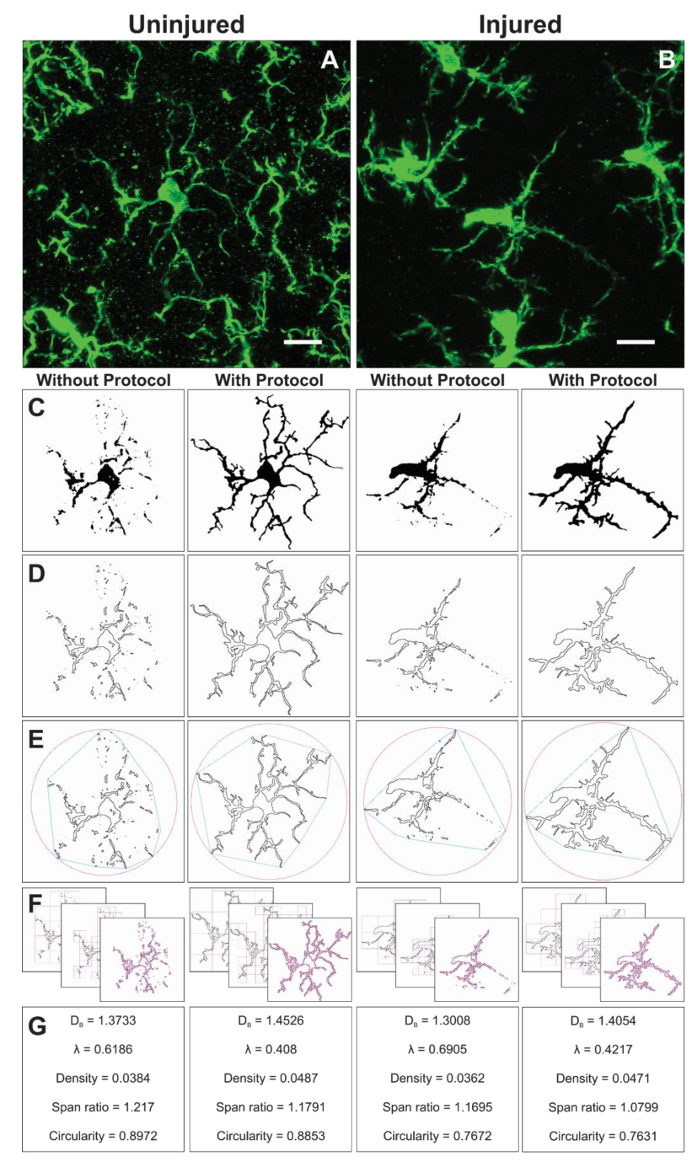
चित्रा 6. भग्न विश्लेषण के साथ और प्रोटोकॉल अनुप्रयोग के बिना । microglia के घायल (A) और घायल (B) के साथ प्रांतस्था (C), और बाह्यरेखा (D) छवियों के साथ और बिना प्रोटोकॉल लागू किए गए परिणाम में photomicrographs की फसली का उदाहरण । संबंधित उत्तल पतवार (नीला) और संलग्न सर्कल (गुलाबी) इसी रूपरेखा आकृतियों (E) के लिए आकार घनत्व, अवधि अनुपात, और परिपत्र (जी) की गणना करने के लिए उपयोग किया जाता है । बॉक्स गिनती विधि (च) में सचित्र है, और भग्न आयाम (DB) और lacunarity (λ) गणना (G) के लिए प्रयुक्त । स्केल बार = 10 µm. इस आंकड़े का एक बड़ा संस्करण देखने के लिए यहां क्लिक करें.
Discussion
Microglia कोशिकाओं को पतले उनके सूक्ष्म डोमेन के भीतर शरीर क्रिया विज्ञान और विकृति को देखते है और दोनों सूक्ष्म7,14 और सकल चोट8में morphologies2 की एक विविध रेंज प्रदर्शित । ImageJ प्रोटोकॉल का उपयोग microglia आकृति विज्ञान ठहराव सभी प्रयोगशालाओं के लिए सुलभ बनाता है के रूप में मंच और plugins एक खुला स्रोत छवि प्रसंस्करण सॉफ्टवेयर हैं । जबकि वर्णित प्रोटोकॉल छवि प्रसंस्करण और इस सॉफ्टवेयर का उपयोग कर विश्लेषण पर ध्यान केंद्रित है, डेटा संग्रह, वैधता की निरंतरता, और विश्वसनीयता उत्कृष्ट आइएचसी और माइक्रोस्कोपी के साथ शुरू होता है । इस प्रोटोकॉल का उपयोग बाइनरी, कंकाल, और संपूर्ण photomicrographs और एकल कोशिकाओं की रूपरेखा निरूपण में सुधार करने के लिए किया जाता है लेकिन गरीब आइएचसी धुंधला और माइक्रोस्कोपी की जगह नहीं ले सकता जो कम कंट्रास्ट, धुंधले या विकृत छवियों में परिणाम देता है । एक अतिरिक्त विचार के रूप में, देखभाल के भंडारण के दौरान मस्तिष्क के ऊतकों को समतल करने के लिए नहीं लिया जाना चाहिए, से पहले खोदी है, जो irrevocably बदल microglia आकृति विज्ञान. अंत में, प्रत्येक प्रयोग के भीतर, microglia एक ही पैमाने के रूप में के रूप में अच्छी तरह से एक ही खुर्दबीन का उपयोग imaged होना चाहिए । इंस्ट्रूमेंटेशन, उद्देश्य, और सॉफ्टवेयर सूक्ष्मदर्शी जो विभिंन आकार photomicrographs में इसी तरह के उद्देश्यों के बावजूद परिणाम होगा और विस्तार के रूप में के रूप में अच्छी तरह से प्रत्येक फ्रेम के भीतर कोशिकाओं की संख्या में परिवर्तन के बीच बदलती हैं । उदाहरण के लिए, छवि अधिग्रहण पर एक 40X उद्देश्य का उपयोग कर एक Leica SPII परिणामों में दो बार कक्षों की संख्या और एक जीस ८८० का उपयोग करके प्राप्ति से कम विवरण । यह एक सेल के बजाय पूरे फ्रेम से एकत्र सेल असर डेटा के लिए विशेष रूप से महत्वपूर्ण है, के रूप में यह डेटा नमूने का एक मुद्दा बन जाता है ।
सामांय में, कंकाल विश्लेषण जो पूरे photomicrograph इस्तेमाल दो कारणों के लिए एकल कोशिका भग्न विश्लेषण से पहले । एक photomicrograph में सभी कोशिकाओं के सेल असर का निर्धारण तेजी से जब एकल कोशिका भग्न विश्लेषण की तुलना में है और एक स्क्रीनिंग उपकरण के रूप में माना जा सकता है अगर समय एक कारक है । इसके अलावा, कंकाल विश्लेषण के दौरान व्युत्पंन द्विआधारी छवियों भग्न विश्लेषण के लिए उपयोग किया जाता है । एक बार imaged, वहां महत्वपूर्ण कदम है कि कंकाल विश्लेषण परिणामों को प्रभावित और उपयोगकर्ता-प्रभाव परिचय हो सकता है की एक संख्या हैं । उपयोगकर्ता के बीच सबसे चर रहे है जो प्रोटोकॉल चरण चरण ४.२ (बढ़ती छवि चमक) और ४.५ चरण (थ्रेशोल्ड का निर्धारण) है । जहां संभव हो, एक इष्टतम संख्या चमक बढ़ाने के लिए (अधिकतम या 0-255 के बीच न्यूनतम स्लाइडर) निर्धारित और सभी छवियों और उपयोगकर्ताओं के लिए लगातार आयोजित किया जाता है. जहां छवि परिवर्तनशीलता महान है, उपयोगकर्ता इसके बजाय एक चमक है कि छवियों के बीच भिंन हो जाएगा चुन सकते हैं । वैकल्पिक रूप से, अगर छवियों उज्ज्वल है और इसके विपरीत उच्च है, तो बढ़ती चमक और लोप किया जा सकता है थ्रेसहोल्ड एक विशेषता दहलीज फिल्टर (उदा, हुआंग) के बजाय अधिक चर डिफ़ॉल्ट का उपयोग करके मानकीकृत किया जा सकता है । एक बार अनुकूलित, पैरामीटर के लिए पालन किया जाना चाहिए ताकि अतिरिक्त उपयोगकर्ता प्रभाव को कम करने के लिए ।
उपयोगकर्ता परिवर्तनशीलता का एक उदाहरण चित्रा 5में प्रस्तुत किया गया है । डेटा मान उपयोगकर्ता 1 बनाम उपयोगकर्ता 2 में बढ़ गए थे और इसलिए दोनों उपयोगकर्ता 1 और उपयोगकर्ता 2 डेटा संग्रह करने के लिए योगदान दिया, तो परिवर्तनशीलता बढ़ जाएगा । उपयोगकर्ता 1 और उपयोगकर्ता 2 बाइनरी और कंकाल छवियों में अंतर का एक उदाहरण रंगीन हलकों (चित्रा 5) द्वारा हाइलाइट किए गए हैं । इस उदाहरण में, दोनों उपयोगकर्ताओं को संक्षेप में microglia में सीमित विशेषज्ञता के साथ स्नातक छात्रों को प्रशिक्षित किया गया । नियमित निरीक्षण और वृद्धि हुई प्रोटोकॉल प्रशिक्षण के साथ एक microglia विशेषज्ञ द्वारा सलाह2 अंतर उपयोगकर्ता परिवर्तनशीलता को कम कर सकते हैं । हालांकि यहां मूल्यांकन नहीं, भग्न विश्लेषण कम अंतर उपयोगकर्ता परिवर्तनशीलता के अधीन है क्योंकि बाइनरी कोशिकाओं को मैंयुअल रूप से कर रहे है और व्यक्तिगत रूप से एक photomicrograph से अलग बजाय केवल microglia आकार निर्धारित करने के लिए थ्रेसहोल्ड पर निर्भर । हालांकि, सभी विधियों के पास उपयोगकर्ताओं के बीच कुछ परिवर्तनशीलता है । इसलिए, एक एकल उपयोगकर्ता (आदर्श, microglia कोशिकाओं में कुछ विशेषज्ञता द्वारा प्रशिक्षित) एक पूरे डेटासेट के लिए डेटा संग्रह पूरा करना चाहिए.
अतिरिक्त संशोधनों को आसानी से इस प्रोटोकॉल के लिए किया जा सकता है और छवि गुणवत्ता पर निर्भर करेगा, और शोर को कम करने और प्रक्रिया कनेक्टिविटी सुनिश्चित करने के लिए लिया गया प्रयास । उदाहरण के लिए, यदि इसके विपरीत पर्याप्त है, तो तेज मुखौटा आवश्यक नहीं है और छोड़ा जा सकता है । यह अनुकूलन और छवियों का एक विशिष्ट सेट, दोनों प्रयोगात्मक मामलों और नियंत्रण, एक पूरे सेट से डेटा इकट्ठा करने से पहले के लिए प्रोटोकॉल को अंतिम रूप देने के लिए विवेकपूर्ण है । अंत में, अतिरिक्त plugins दूसरों के स्थान पर इस्तेमाल किया जा सकता है स्पष्ट या चित्र है कि इस तरह के फैलाव या पैनापन के रूप में इस प्रोटोकॉल में वर्णित नहीं थे पैनापन ।
इस प्रोटोकॉल के लाभ अपनी सार्वभौमिक उपलब्धता और अनुकूलन क्षमता हैं । इसके अलावा, AnalyzeSkeleton का उपयोग कर सेल असर का आकलन जल्दी है और एक पूरे photomicrograph के लिए लागू है । बहु-कक्ष विश्लेषण approach का लाभ एकल कक्षों के बजाय किसी संपूर्ण क्षेत्र पर फ़ोकस होता है । इसलिए, यह जल्दी से (समापन और प्रक्रिया की लंबाई के संदर्भ में) औसत असर का आकलन करने के लिए संभव है छवि के भीतर सभी microglia की । कंकाल विश्लेषण कई कोशिकाओं का एक विश्लेषण प्रदान करता है: photomicrographs से एकल कोशिकाओं को अलग करने के लिए आवश्यक समय निवेश के कारण भग्न विश्लेषण से मिलान नहीं किया जा सकता है कि सेल संख्या के संदर्भ में एक डेटा नमूना । एक उदाहरण है जहां यह सबसे अच्छा हो सकता है उपयुक्त स्क्रीनिंग microglia morphologies में proximities में एक फोकल चोट के लिए होगा । एक सीमा पूरे क्षेत्र छवि प्रतिपादन आइएचसी photomicrographs के कंकाल मॉडल बनाने के लिए अपूर्ण है जब अधिक समय लेने वाली एकल कोशिका दृष्टिकोण की तुलना में है । इसके अलावा, एक क्षेत्र विश्लेषण जहां microglia morphologies एक ही क्षेत्र के भीतर काफी अलग है परिस्थितियों के लिए उपयुक्त नहीं है । अंत में, इस विश्लेषण विधि सेल गिनती, प्रयोगात्मक स्थितियों के बीच अलग हो सकता है कि एक पैरामीटर पर निर्भर है ।
भग्न विश्लेषण एक ही सेल पर आयोजित की जाती है और इसलिए औसत सेल असर डेटा कंकाल विश्लेषण से उत्पंन उत्पादन पूरक । हालांकि ज्यादा समय लगता है, इस निवेश morphometric डेटा की एक व्यापक रेंज पैदावार । उदाहरण के लिए, कक्ष घनत्व, अवधि अनुपात, और प्रचलन डेटा क्रमशः कक्ष बाह्यरेखा के आकार, बढ़ाव, और आकृति का वर्णन करते हैं । भग्न आयाम और lacunarity सेल जटिलता और आकार विविधता, क्रमशः संक्षेप । एक और अधिक गहराई से सारांश कैसे प्रत्येक पैरामीटर की गणना की है और कैसे डेटा की व्याख्या की जा सकती है इंटरैक्टिव मैनुअल में प्रदान की जाती है16 और इस तरह के विस्तार विशिष्ट अनुसंधान प्रश्न के संबंध में विचार किया जाना चाहिए । वर्णित प्रोटोकॉल संवेदनशील उपकरणों में परिणाम 2 डी microglia morphologies है कि शारीरिक और रोग की स्थिति में हो सकता है में छोटे परिवर्तनों को बढ़ाता है । अतिरिक्त morphometric विश्लेषण जैसे ठोसता, convexity, और फार्म फैक्टर16,20 अगर 3 डी आकार पैदा संभव हो सकता है ।
प्रोटोकॉल विकास और अनुकूलन सतत और उपयोगकर्ता संचालित है । यह प्रतिदीप्ति8 से बढ़ाया गया है ढाब/उज्ज्वल क्षेत्र छवियां7 लेकिन अभी तक नहीं आयल एंबेडेड ऊतक । इसके अलावा, यह अतिरिक्त विश्लेषण के लिए Imaris जैसे मालिकाना सॉफ्टवेयर के साथ संयोजन के रूप में इस्तेमाल किया जा सकता है । इस प्रोटोकॉल शरीर विज्ञान की एक किस्म के लिए लागू किया जा सकता है और microglia तक ही सीमित नहीं है, लेकिन किसी भी कोशिका या विशेष पैटर्न या आकार है कि आइएचसी तरीकों का उपयोग कर पहचाना जा सकता है के साथ ऊतक के लिए लागू किया जा सकता है । अंत में, पर्याप्त नमूना आकार के साथ, एक बहुभिंनरूपी या क्लस्टर विश्लेषण आकृति विज्ञान12,21के अनुसार stratify microglia के लिए लागू किया जा सकता; यह सार्थक जानकारी के रूप में microglia आकृति विज्ञान microglia कार्यों और उनके परिवेश के लिए प्रतिक्रियाओं का एक महत्वपूर्ण संकेतक है । microglial सुघड़ विविधता के लिए सराहना का विस्तार और महत्वपूर्ण है के लिए पूरी तरह से समझ ंयूरॉन-glia-संवहनी बातचीत के दौरान स्वास्थ्य और रोग । इस क्षेत्र में वृद्धि अच्छी तरह से विकसित की, उपयोग करने के लिए आसान है, और reproducible प्रोटोकॉल को बढ़ाता है और एकाधिक सतत चर का उपयोग microglia आकृति विज्ञान सारांश के द्वारा बढ़ाया है ।
Acknowledgements
इस अध्ययन को NINR (F32NR013611) से वित्तीय सहायता प्राप्त हुई. हम आगे स्वीकार करते है और AnalyzeSkeleton के डेवलपर्स (2d/3d) और FracLac (Arganda-Carreras एट अल. और Karperien एट अल., क्रमशः) के बिना जो विश्लेषण वर्णित के लिए संभव नहीं होगा धंयवाद देना चाहूंगा ।
Materials
| Name | Company | Catalog Number | Comments |
| primary antibody anti-IBA1 | Wako | 019-19741 | rabbit host |
| Vectashield soft mount | Vector Labs | H-1000 | |
| Secondary antibody | Jackson ImmunorResearch | 711-545-152 | donkey host |
| 4 mL glass vial | Wheaton | UX-08923-11 | |
| Triton X-100 | Fisher Scientific | BP151 | |
| Sodium Azide (NaN3) | Sigma | S-8032 | |
| glass coverslip | Fisher Scientific | 12-544-G |
References
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nat Neurosci. 8 (6), 752-758 (2005).
- Karperien, A., Ahammer, H., Jelinek, H. F. Quantitating the subtleties of microglial morphology with fractal analysis. Front Cell Neurosci. 7 (3), eCollection (2013).
- Taylor, S. E., Morganti-Kossmann, C., Lifshitz, J., Ziebell, J. M. Rod microglia: a morphological definition. PLoS One. 9 (5), e97096 (2014).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308 (5726), 1314-1318 (2005).
- Abiega, O., et al. Neuronal Hyperactivity Disturbs ATP Microgradients, Impairs Microglial Motility, and Reduces Phagocytic Receptor Expression Triggering Apoptosis/Microglial Phagocytosis Uncoupling. PLoS Biol. 14 (6), e1002466 (2016).
- Wyatt-Johnson, S. K., Herr, S. A., Brewster, A. L. Status Epilepticus Triggers Time-Dependent Alterations in Microglia Abundance and Morphological Phenotypes in the Hippocampus. Front Neurol. 8 (700), eCollection (2017).
- Morrison, H., Young, K., Qureshi, M., Rowe, R. K., Lifshitz, J. Quantitative microglia analyses reveal diverse morphologic responses in the rat cortex after diffuse brain injury. Sci Rep. 7 (1), 13211 (2017).
- Morrison, H. W., Filosa, J. A. A quantitative spatiotemporal analysis of microglia morphology during ischemic stroke and reperfusion. J Neuroinflammation. 10 (4), (2013).
- Gyoneva, S., Traynelis, S. F. Norepinephrine modulates the motility of resting and activated microglia via different adrenergic receptors. J Biol Chem. 288 (21), 15291-15302 (2013).
- Xu, H., et al. Environmental Enrichment Potently Prevents Microglia-Mediated Neuroinflammation by Human Amyloid beta-Protein Oligomers. J Neurosci. 36 (35), 9041-9056 (2016).
- Rodriguez, J. J., Noristani, H. N., Verkhratsky, A. Microglial response to Alzheimer's disease is differentially modulated by voluntary wheel running and enriched environments. Brain Struct Funct. 220 (2), 941-953 (2015).
- Soltys, Z., et al. Quantitative morphological study of microglial cells in the ischemic rat brain using principal component analysis. J Neurosci Methods. 146 (1), 50-60 (2005).
- Orlowski, D., Soltys, Z., Janeczko, K. Morphological development of microglia in the postnatal rat brain. A quantitative study. Int J Dev Neurosci. 21 (8), 445-450 (2003).
- Morrison, H. W., Filosa, J. A. Sex differences in astrocyte and microglia responses immediately following middle cerebral artery occlusion in adult mice. Neuroscience. 339, (2016).
- Arganda-Carreras, I., Fernandez-Gonzalez, R., Munoz-Barrutia, A., Ortiz-De-Solorzano, C. 3D reconstruction of histological sections: Application to mammary gland tissue. Microsc Res Tech. 73 (11), 1019-1029 (2010).
- Davis, B. M., Salinas-Navarro, M., Cordeiro, M. F., Moons, L., De Groef, L. Characterizing microglia activation: a spatial statistics approach to maximize information extraction. Sci Rep. 7 (1), 1576 (2017).
- . ImageJ User Guide Available from: https://imagej.nih.gov/ij/docs/guide/ (2014)
- Karperien, A. L., Jelinek, H. F., , Fractal, Multifractal, and Lacunarity Analysis of Microglia in Tissue Engineering. Front Bioeng Biotechnol. 3 (51), eCollection (2015).
- Martyanova, E. K., Tishkina, A. O. 3D quantitative analysis of microglial morphology. available as conference preceedings SkoltechOn. , (2015).
- Fernandez-Arjona, M. D. M., Grondona, J. M., Granados-Duran, P., Fernandez-Llebrez, P., Lopez-Avalos, M. D. Microglia Morphological Categorization in a Rat Model of Neuroinflammation by Hierarchical Cluster and Principal Components Analysis. Front Cell Neurosci. 11 (235), eCollection (2017).
Explore More Articles
This article has been published
Video Coming Soon
ISSN 1940-087X
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved
We use cookies to enhance your experience on our website.
By continuing to use our website or clicking “Continue”, you are agreeing to accept our cookies.