Method Article
免疫組織化学準備 ImageJ を用いた組織の顕微鏡写真からミクログリアの形態の定量化
要約
ミクログリアは、調査、定量的評価されるかもしれない形態の変化によって変えられた脳生理学に反応する脳の免疫細胞です。このプロトコルの概要、ImageJ ベースのセル分枝、複雑さ、および図形などによると継続的なデータとしてミクログリアの形態を表す解析プロトコル。
要約
ミクログリアは脳食脳のホメオスタシスに参加し、疾患、損傷、機能不全のために環境を継続的に調査します。最初のレスポンダーとしてミクログリアは、ニューロンとグリア細胞の機能障害を軽減するために重要な機能を持っているし、この過程で、彼らは広範な形態学的変化を受けます。ミクログリアの形態は唱え分類できます。 または、または、セルの分枝、複雑さ、および図形などのパラメーターを連続変数として定量化することができます。ミクログリアを定量化するためのメソッドは、単一のセルに適用される、ほとんどのテクニック全体の顕微鏡写真で複数のミクログリアに適用されません。このメソッドの目的は、複数を定量化して容易に利用可能な ImageJ プロトコルを使用して単一セル。このプロトコルの手順の概要は、ImageJ プラグインの蛍光および明るいフィールド顕微鏡写真を代表的なバイナリとスケルトンの画像に変換し、それらを分析するをお勧めします AnalyzeSkeleton (2 D ・ 3 D) と FracLac のソフトウェアのプラグインを使用して、データ収集の形態。これらのプラグインの出力は、プロセスのエンドポイント、接合、および長さの複雑さ、セル形状とサイズの記述子の面で細胞の形態をまとめたものです。記載スケルトン分析プロトコルは、FracLac は、相補的な個々 のセル分析を提供に対し全体の顕微鏡写真や利益 (率 ROI) の領域内の複数のミクログリアの地域分析に適して。プロトコルは組み合わせることで、目的、多様なミクログリアの形態の健康と負傷者の脳内に存在間を分類する使用ことができます、敏感で、包括的なアセスメント ツールを提供します。
概要
ミクログリアは、脱分岐し、アメーバ形態2 にハイパー分岐と非常に複雑な形態からその範囲可能性の連続体に沿って脳生理学1で変化への迅速かつ多様な形態学的応答を持っています。.ミクログリアは、偏光と棒状の3もなります。ミクログリア細胞分岐は複数のプロセスを持つ複雑な形状としてよく定義されているし、セルごとのエンドポイントの数や細胞プロセスの長さとしてしばしば報告されています。ミクログリアの形態が多様な細胞機能と機能障害の指標として役立つかもしれないミクログリアが細かく連続細胞間クロストークとin vivo運動4,5を介して神経細胞およびグリア細胞の機能に調整されているので脳内。定量的アプローチ (てんかん5,6など微妙な生理学的な摂動で発生する分岐し細胞間の違いを区別するためにこれらの形態学的変化の多様性を十分に説明する必要があります。脳震盪7) (ストローク8) など総損傷に加えて。形態の定量化7,8,9,10、11,12,13,14の使用の増加健康と病気の間にフル ミクログリアの形態の多様性を明らかになります。本研究は ImageJ プラグイン ミクログリアの蛍光または非蛍光性顕微鏡写真からミクログリアの形態を要約する必要の段階的な使用は、免疫組織染色 (IHC) 後固定の齧歯動物のティッシュで取得した情報。
中央ここで説明されている分析手法には、ImageJ プラグイン AnalyzeSkeleton (2 D ・ 3 D)15、乳腺の大型構造物を定量化する 2010年で開発された FracLac16, 2014 年 ImageJ とフラクタル解析を統合するために開発されました。個々 のミクログリア図形を定量化します。これらのプラグインは、全体の顕微鏡写真内ミクログリア分枝の迅速分析または顕微鏡写真内で定義された投資収益率の複数のミクログリアを提供します。この分析は、単独またはフラクタル解析を補完するために使用可能性があります。単一セルのフラクタル解析 (FracLac) は時間の投資が必要ですが、ミクログリアの複雑さ、形状、およびサイズに関する複数の形態の出力を提供します。両方のツール使用は冗長ではありません、分枝はセルの複雑さに相補的な細胞として、データセット12,17内の多様なミクログリアの形態を区別する複数のパラメーターの組み合わせを使用することがあります。
プロトコル
すべての実験はによって承認され、アリゾナ大学の制度上の動物のケアおよび使用委員会と管理と実験動物の使用のための NIH ガイドラインによって確立されたガイドラインに従って実行されます。ケアは、動物の痛みや不快感を最小限に抑えるために運ばれました。安楽死方法は承認されたプロトコルによると、イソフルラン麻酔下で子宮頸の斬首で構成します。
1. ティッシュの準備
注: は、細胞の形態を維持するために固定、cryoprotected 組織サンプルでミクログリアの形態分析を実施します。以下は、準備し、直接蛍光 IHC の固定ティッシュをスライスする標準プロトコルです。
- 目的の実験後、標準的な実験室のプロトコルに従って、マウスまたはラットの脳を euthanized 動物から削除します。4 ° C で 24 時間 4% パラホルムアルデヒド溶液の 5 mL を 10 mL のバイアルに脳を配置します。その後洗い流し、30% ショ糖リン酸塩の 5-10 mL に場所が 4 ° C で 72 時間のためのソリューション (PBS、0.01 M) をバッファーミクロトームで、セクショニング、クライオスタットとティッシュまで-80 ° c または 4 ° C で全脳を格納します。
注: このプロトコルはまだテストされていません組織のパラフィン包埋組織からスライスを使用します。 - 希望する切片厚および-20 ° C で (50 mM PBS、エチレング リコール、グリセリン) に対する凍害保護作用ソリューションのクライオスタットやミクロトームとストアの浮遊セクションを使用して向きに脳組織のセクション
注: このプロトコル行われている正常に冠状切片厚み 200 μ m 50 μ m からまでに。ティッシュ セクションの以下より 50 μ m 厚い切片中のミクログリア プロセスの完全なスパンを捕獲しないかもしれない、IHC 染色できない抗体組織浸透による完璧な。組織断面、コロナのいずれかまたは矢状方向、この選択は調査される実験的目標と脳領域に依存します。
2. 免疫組織化学
注: 蛍光または 3, 3 '-ジアミノベンジジン (軽打) IHC スケルトンとフラクタル解析の手法を適用できます。次は標準的な蛍光 IHC プロトコルで、必要に応じてに代えることができます。蛍光 IHC 細胞プロセス軽く IHC と比較して優れた可視化が得られます。
- 4 mL バイアル (最大 15 マウス脳のセクション/バイアル) にティッシュ セクションを配置し、1 ml の PBS (0.01 M)、0.5% トリトン、0.04% ナン3室温 (23 ° C) 1 h で 10% 馬の血清に含まれるソリューションの間孵化させなさい。
- 部屋の温度で 3 回 PBS (0.01 M) で 5 分間洗ってください。
- 1 mL の PBS (0.01 M)、0.5% トリトン、0.04% ナン3を含む、(NaN3の有効性を保持する) に覆われている溶液で 72 時間室温で一次抗体 (Iba1、1:1, 000) で孵化させなさい。
- 部屋の温度で 3 回 PBS (0.01 M) で 5 分間洗ってください。
- PBS (0.01 M)、0.5% トリトン、0.04% ナン3溶液 1 mL に 4 時間室温で覆われた二次抗体 (抗家兎 488, 1: 250) と孵化します。
- 部屋の温度で 3 回 PBS (0.01 M) で 5 分間洗ってください。
- 话スライドに脳組織切片 (数と向きの設定に基づいて) をマウントして、ソフト セット取付中をスライドに適用し、coverslip のティッシュをかぶせます。4 ° C でスライドを保存します。
注: 1.5 ガラス coverslip 厚さ共焦点イメージングに必要です。高粘度では組織が圧縮されません、ベスト メディアをゆるませたマウントと比較して形態が保持されますので、ソフト セット、好ましい実装媒体です。
3. イメージング
- 20 X 客観的またはそれ以上を使用して z 集録機能を持つ明視野または共焦点顕微鏡を用いた脳組織切片における Iba1 陽性細胞をイメージします。
注: パラメーターとソフトウェア設定をイメージング実験ですべての顕微鏡写真獲得のため一定必要があります。優れたプロセスの詳細は、40 X または X の 63 の目的を使用して取得されます。全体の顕微鏡写真や大きい顕微鏡内複数セルの投資収益率を記載スケルトン分析のプロトコルを適用することが可能です。- 顕微鏡のソフトウェアに固有の適切なソフトウェア設定を使用して 8 ビット画像を取得します。
メモ: 8 ビットの取得後にファイルの変換は、データ コレクションをゆがむ場合があります。 - 顕微鏡のソフトウェアに固有の適切なソフトウェア設定を使用してイメージの 2 μ m 間隔以上では少なくとも 30 μ m z スタックを取得します。
注: 顕微鏡およびソフトウェアの X、Y、および Z 軸の画像取り込みようにします。Z スタックを増加可能性があります、および間隔は、ミクログリアの追加詳細を提供するために減らすことができます。Exchange では、イメージング時間が増加します。蛍光顕微鏡用ナイキスト サンプリング可能な場合を使用します。
- 顕微鏡のソフトウェアに固有の適切なソフトウェア設定を使用して 8 ビット画像を取得します。
- Tif ファイルとして、または顕微鏡のソフトウェアに必要なすべてのファイルを保存します。
- ImageJ で Tif ファイルを開くし、ツールバーを使用して、の画像をクリックしてチャンネルを分割 |カラー |チャンネルの分割との画像をクリックして画像をスタック |スタック |プロジェクト x |最大強度投影適切な場所。.Tif ファイルとして保存します。
4. 骨格分析
- フィジーや ImageJ からダウンロード < https://imagej.net/Fiji/Downloads>。個々 のプラグインをダウンロードしてから AnalyzeSkeleton(2D/3D) < http://imagej.net/AnalyzeSkeleton>15から FracLac をダウンロード、< https://imagej.nih.gov/ij/plugins/fraclac/fraclac.html>16。
注: 顕微鏡写真をスケルトンの画像に変換する全体のプロセスは、1 分未満かかります。 - 蛍光顕微鏡写真を使用する場合は、画像が 8 ビットを確認し、最高すべて陽性を視覚化するグレースケールに変換します。ツールバーを使用して、画像をクリックして |ルックアップ テーブル |グレー。FFT 帯域通過フィルターのプラグインである軽打の明視野の写真、最初の使用を使用している場合 (プロセスをクリックして、ツールバーを使用して |FFT |バンドパス フィルター) グレースケールに変換します。
注: この議定書の目的のため ImageJ FFT バンドパス フィルターの既定の設定は、十分な (最大 40、ないストライプ抑制までの 3 ピクセル フィルター) です。FFT のバンドパス フィルターを適用する画像の全面的でより大きい側面を維持しながらノイズ (小特集) を削除します。これは明視野画像に特に有用、分割組織に亀裂することができます背景として表示され、従って18スケルトン分析を複雑にして。 - 画像が暗すぎる、ミクログリアのプロセスを可視化することはできない場合は、明るさとコントラストを調整します。ツールバーを使用して、画像をクリックして |調整 |明るさ/コントラスト。ヒストグラムがさらにエッジまで、必要に応じて、最小値または最大スライダーを調整します。
注: ImageJ で明るさとコントラストが更新する変更イメージのルックアップ テーブル (LUT)、ピクセルの値が変更されていないので。最大と最小のスライダーは、現れる白 255 を超えるピクセル値とピクセル値 0 黒18を表示の下で、表示範囲の上限と下限の制限を制御します。蛍光顕微鏡写真の場合最大スライダーを使用最小スライダーは DAB 染色ミクログリアの顕微鏡写真に使用するのに対し。 - さらにプロセスをクリックして、ツールバーを使用してコントラストを増加するアンシャープ マスク フィルターを実行 |フィルター |アンシャープ マスク。ImageJ の既定の設定は、この議定書の目的のため (3 のピクセル半径 0.6 の重量をマスクと) 使用されます。
注: アンシャープ マスク シャープにしぼやけてバージョンの元からイメージ (アンシャープ マスク) を減算すること、元の画像の高コントラストのバージョンと結果の画像をマージによってイメージのエッジ機能を強化します。したがって、アンシャープ マスク フィルターの詳細を作成しません、むしろイメージで既存の詳細を明らかにします。設定変更どのようにぼやけてのアンシャープ マスク半径になります (およびしたがって、どのくらいのぼかしが削除されます)、およびマスク重量設定が変更にアンシャープ マスクがマージされるコントラストの程度 (およびこうして最終的なイメージのコントラストを調整します)。 - アンシャープ マスクによって生成されたごま塩ノイズを除去するノイズ除去の手順を実行します。ツールバーを使用して、プロセスをクリックして |ノイズ |輪郭以外をぼかす。
注: 輪郭以外をぼかす 3 × 3 近所の中央値で各ピクセルを置き換えてごま塩ノイズを削除します。効果は、強度の外れ値がエッジ18の鋭さに影響を与えずに中央のピクセルで置換されます。 - 画像をの画像をクリックして、ツールバーを使用してバイナリに変換 |調整 |しきい値。
注: 閾値背景対興味の機能に複数のグレースケール画像を層別化するし、バイナリ18に画像を変換します。 - 閉じる-ノイズ除去を適用して外れ値関数を削除: 結果のバイナリ イメージである可能性があります単一ピクセル バック グラウンド ノイズ、プロセス間のギャップ。
- プロセスをクリックして、ツールバーを使用してノイズ関数を適用する |ノイズ |輪郭以外をぼかす。
注: を適用するバイナリに輪郭以外をぼかすイメージは、任意の残りの単一ピクセルのノイズを削除します。 - プロセスをクリックして、ツールバーを使用して、close 関数を適用 |バイナリ |近くに。
注: 最大 2 ピクセル単位で区切られます場合、このプラグインは 2 つの暗いピクセルを接続します。 - プロセスをクリックして、ツールバーを使用して削除外れ値関数を適用する |ノイズ |外れ値を削除。
注: この議定書の目的のため明るい外れ値は 2 ピクセルの半径としきい値が 50 の目標は。このプラグインは、それ以上の特定の値 (閾値) の18で外れる場合に周辺地域の中央のピクセルによって明るいまたは暗い外れ値ピクセルを置き換えられます。
- プロセスをクリックして、ツールバーを使用してノイズ関数を適用する |ノイズ |輪郭以外をぼかす。
- 将来使用するフラクタル分析のための別のファイルとしてイメージを保存し、プロセスをクリックして、ツールバーを使用してイメージを収縮 |バイナリ |収縮。
- スケルトンのイメージを選択し、プラグインのプラグインをクリックしてツールバーを使用して AnalyzeSkeleton(2D/3D) を実行 |スケルトン |骨格を分析、分岐情報ボックスをチェックします。
注:、画像処理、追加または上記の推奨される手順の削除による最適化が必要そうです。この過程で、スケルトンの画像はスケルトンと元のイメージのオーバーレイを作成することによって精度の評価されます。細胞体の中心から発せられるプロセスで単一の起源ポイントをする必要があります。円形細胞体データを混乱させるとプロトコルの調整を避けるべきであります。円形細胞体対単一の起源のポイントの例を図 1に示します。
一般的な問題と推奨される解決策の代表でないスケルトンの結果:
- あまりにも薄暗いイメージ: グレースケールに変換する、明るさ/コントラスト スライダーを調整、アンシャープ マスクを適用
- あまりにも多くの背景: 明るさ/コントラスト スライダーを調整、ノイズ除去、適用および/または外れ値を削除
- (特に蛍光画像) のスケルトン画像の円形細胞体: FFT 形バンドパス フィルターやアンシャープ マスクの適用
- (特に明視野画像) のための組織におけるき裂: FFT 形バンドパス フィルターの適用および/または輪郭以外をぼかす
- 結果からすべてのデータをコピーおよび分岐情報出力し、Excel スプレッドシートにデータを貼り付けます。
- Excel では、IHC と画像に起因するスケルトンのフラグメントを削除するデータをトリミングします。
- スケルトン分析から出力される生データと実験ブックを複製し、ファイル名にトリムを追加します。将来の使用と参照用の生データを保持する複製されたブックですべてのそれに続くデータ トリミングが発生します。
- フラグメントの長さは、ImageJ でスケルトンの画像を開き、[線] ツールを選択するデータセットから除去されますを決定します。平均の長さのメモを取る、いくつかの断片を測定し、カットオフ値を決定します。
注: ここで表示されるデータのため、不要なフラグメントのカットオフ長さは 0.5 です。この値はデータセット全体にわたって一貫性のあるになります。 - カスタム クリック並べ替え & フィルターで Excel スプレッドシートを並べ替える |ユーザー設定の並べ替え。「エンドポイント ボクセル」最大から最小にし、最小から最大"Mx 支店 pt"の新しいレベルの順に並べ替えます。
- カットオフ値未満の最大の枝の長さと 2 のエンドポイントを含むすべての行を削除する(すなわち.、0.5)。イメージから収集されたエンドポイントの合計数を計算するエンドポイントの列のデータを合計します。
- 支店情報データの繰り返し: 最大から最小「枝の長さ」で並べ替えます。データをスクロールし、カットオフ値未満の枝の長さを持つすべての行を削除する(すなわち.、0.5)。イメージから収集したすべての支店の合計の長さを計算する支店長の列の値を合計します。
- すべてのデータのトリミングおよび要約を完了するまですべての画像/シートの手順 4.11.3-4.11.5 を繰り返します。
- 対応するイメージのミクログリア細胞体の数によって (エンドポイントの数の合計し、枝の長さの合計) それぞれのイメージからデータを分割します。統計ソフトウェアに最終的なデータ (エンドポイント/セル ・支店長/セル) を入力します。
注: 合計支店長/セルのデータは、ピクセル単位の長さからミクロンへの変換を必要があります。
5. フラクタル解析
注: FracLac は、このプロトコルではカバーされていない異なる形状分析の数を実行することです。FracLac の詳細な説明のさまざまな機能で FracLac のマニュアルを参照してください < https://imagej.nih.gov/ij/plugins/fraclac/FLHelp/Introduction.htm> と関連する参照2,16,19。フラクタルは、プロトコル手順 4.1 4.7 上記を利用しています。
- すべてのフラクタル解析に使用する ROI のサイズを決定します。四角形ツールを使用して、投資収益率を描きます。ボックス セル全体をキャプチャするのに十分な大きさは、データセットにわたって一貫性を維持することができることを確認します。
注: は、すべて・ ロワが同じ大きさで分類された四角形のセルが同じスケールを持っているため、ことを確認するのにフリーハンドの選択ではなく、四角形の選択範囲を使用します。ImageJ は自動スケール セルに異なるスケールの異なるサイズの長方形窓に合わせて正方形 ROI のでフリーハンドの選択が使用された場合は、このケースとは言えません。フラクタル図形はスケールに依存しない、ImageJ の FracLac を使用してフラクタル解析プロセスはスケール16に依存です。したがって、データ コレクション全体で一貫したサイズの投資収益率の必要性があります。 - 顕微鏡写真と各対応するバイナリ イメージのフラクタル解析におけるミクログリアがランダムに選択します。ROI マネージャー] ウィンドウでセルの位置に投資収益率をロックする更新プログラムを選択します。新しいウィンドウとして ROI 内の領域を複製するCtrl + Shift + Dを使用して、トリミングされたセルを保存します。(スケルトン分析) から対応する画像の ROI マネージャーを使用して、同じセル領域を重複してください。十分な細胞数フラクタル解析のためにランダムに選択されているし、すべてのファイルを保存するまでを繰り返します。
注: 乱数ジェネレーター、番号の付いたグリッド セルをランダムに選択する使用できます。 - 個々 のセルのバイナリ イメージを開きます。[ペイント ブラシ] ツールをダブルクリックし、色を黒に設定必要に応じて、ブラシの幅を調整します。一致する顕微鏡写真を参考にして、隣接する細胞プロセスを削除し、断片化されたプロセスに接続する興味のセルを分離絵筆を使用します。バイナリのセルが孤立している、一度は、バイナリ ファイルを保存します。
注: 'alt' を保持している背景色 (白) を前景の色 (黒) から絵筆を切り替えられます。 - バイナリのセルをプロセス経由でツールバーを使用してアウトラインに変換 |バイナリ |概要。
注: 画像 J の FracLac はどちらのソリッド図形で使用できるまたは図形の概要、現在のコンベンションは、16の概要図形を使用します。 - ツールバーで、プラグインをクリックしてツールバーを使用して FracLac を開く |フラクタル解析 |FracLac BC (ボックス カウント)を選択します。グリッド デザイン設定でNum Gを 4 に設定します。[グラフィックオプション] 凸包とセルの外接する円を分析する統計情報をチェックします。終了したら、 [ok]を選択します。
注: Num G ボックス スキャン中に使用されるグリッド方向をカウント数、数 G の推奨範囲は 4-12。Num G 設定と推奨される範囲を徹底的に FracLac マニュアル16のレビューします。Num G を増やす計算時間が著しく低下することができます。FracLac 設定は、セッションごとに 1 回設定するだけ必要があります。設定を入力すると、スキャン ボタンは可能になります。 - 選択したイメージのボックス カウントのスキャンを実行し、スキャンボタンを選択します。
注: スキャン データ出力の 3 つのウィンドウが生成されます: 船体とサークルの結果、ボックス カウント概要ファイル、およびスキャンの種類。スキャンの種類] ウィンドウに使用される設定のログが含まれています, 同様に標準偏差が特定の測定します。このプロトコルのため、スキャンの種類] ウィンドウを使用しないと閉鎖または将来の参考のために保存します。 - 船体とサークルの結果ウィンドウで、必要なすべてのデータをコピー (すなわち。、密度、スパン比と真円度) 結果。ボックス カウントの概要] ウィンドウで、目的のデータをコピー (すなわち。、フラクタル次元とベクトル) 結果。コピーしたデータを転送すると、Excel ファイルまたは統計解析ソフトウェア。
メモ: FracLac の完全なリストは出力データは、ImageJ マニュアル16FracLac で徹底的に説明されています。
結果
ミクログリアの形態分析のプロトコルに記載は、蛍光のおよび形態計測学的解析のための軽打の顕微鏡写真の処理に役立つ手順をまとめたものです。これらの手順を図 2に視覚的にまとめますと図 3。これらの手順の目標は、蓄積されたデータが有効になるよう適切に元の顕微鏡写真をモデル化する代表的なバイナリと白骨イメージを作成することです。プロトコル アプリケーション後 AnalyzeSkeleton プラグインの結果からタグ付けのスケルトン画像エンドポイントや支店の数 (すなわち。、プロセス) でできた金管楽器は、結果として得られる出力ファイルから要約します。エンドポイント ・ プロセスの長さデータは、顕微鏡写真や投資収益率のミクログリア分枝の程度を推定する使用されます。図 4は、プロトコル アプリケーションと収集結果のデータ (エンドポイント/セルとプロセスの長さ/セル) をまとめたものです。同様の傾向が存在する図 4 階に集約されたデータは図 4Eに比べて変化が少ないです。これらのデータが、プロトコルが適用されたときのグループ間の違いを検出する感度の向上を説明するさらに、します。最後に、ケアは、プロトコルのアプリケーションにおけるユーザ間変動に関する取られなければなりません。図 5上述と同じプロトコルを適用する 2 つの独立したユーザーが同じデータ セットを行ったによってこのような違いをまとめます。
その他の形態のデータは、プロトコルの適用時に作成されたバイナリ イメージから分離された単一のセルから収集されます。前にミクログリアの形態および図 6に FracLac プラグインをまとめてを使用して分析するプロトコル手順。我々 は両方無傷 (図 6 a) でこの分析を説明し、(図 6 b) 組織を負傷しました。バイナリ、アウトライン、ハル/カプセル化円、およびボックスのカウント例で各セルを分析し、図 6-f.に表示されますアプリケーション プロトコルを使用せずに凸の代表的な画像これらのイメージは、図 6に示す形態データの相違の起源を説明するために役立ちます。
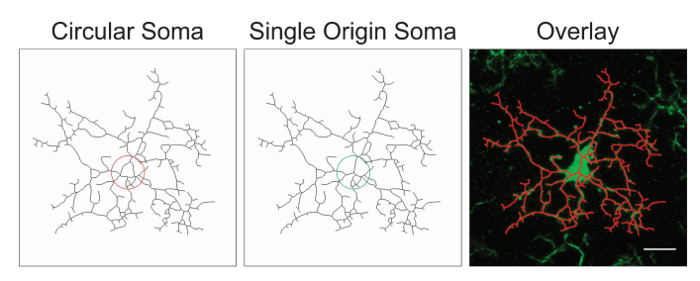
図 1。(最適な) 単一の起源相馬と白骨細胞と元の顕微鏡写真の対応するオーバーレイ (準) 円形相馬と白骨ミクログリアのイラスト。スケール バー = 10 μ m.この図の拡大版を表示するのにはここをクリックしてください。
図 2。蛍光顕微鏡写真にアプリケーションをプロトコルします。詳細を表示する単一細胞の蛍光顕微鏡写真に適用されるスケルトン分析プロトコルのイラストをトリミングしました。スケール バー = 10 μ m.この図の拡大版を表示するのにはここをクリックしてください。
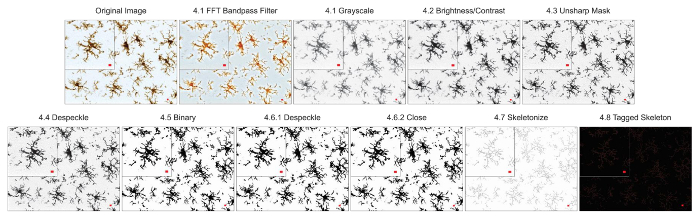
図 3。明視野 DAB にプロトコル アプリケーション顕微鏡写真。トリミングの詳細を表示する単一のセルに明視野軽打の顕微鏡写真に適用されるスケルトン分析プロトコルのイラスト。スケール バー = 10 μ m.この図の拡大版を表示するのにはここをクリックしてください。
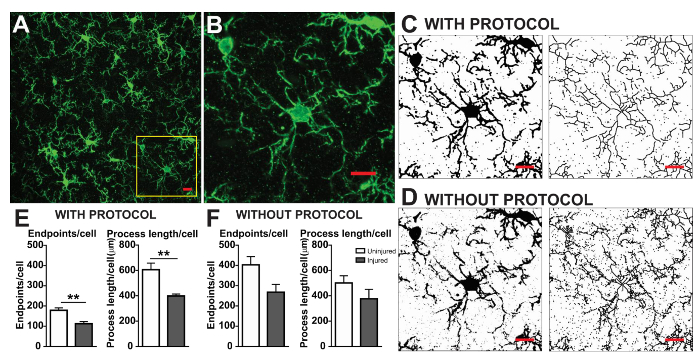
図 4。データ分析とプロトコル アプリケーションなし。(A) (B) で黄色い箱に対応する蛍光 IHC とトリミングの例の顕微鏡写真。例のバイナリと白骨画像 (C) および (D) に従って適用プロトコルなし。ミクログリア エンドポイント/セルとプロセスの長さ/セルの集計データ (白) を無傷し、プロトコルの適用なし (F) (E) (グレー) 大脳皮質組織を負傷しました。スチューデント t 検定と n を使用して統計分析、3 を = * * p < 0.01 を表します。スケール バー = 10 μ m.この図の拡大版を表示するのにはここをクリックしてください。
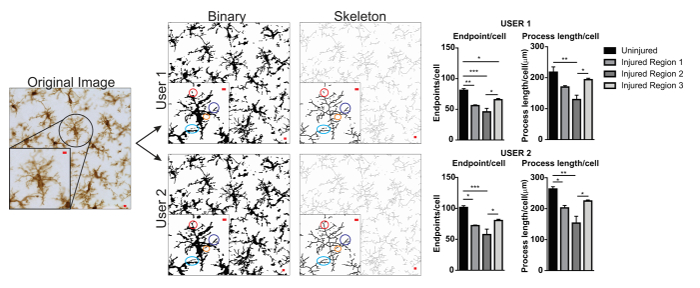
図 5。プロトコルのアプリケーションとユーザーの違い。ユーザー 1 とユーザー 2 がバイナリとスケルトンの画像にオリジナル画像とプロトコル変換の例です。色のついた丸が一致する 2 つの画像間の相違点がハイライトされます。ユーザー 1 とユーザー 2 が無傷と負傷者の脳領域におけるミクログリア エンドポイント/セルとプロセスの長さ/セルのデータの概要のグラフ。統計分析分散分析とサンプル サイズが n = 3;p < 0.05 * *p < 0.01 * * *p < 0.001。スケール バー = 10 μ m.この図の拡大版を表示するのにはここをクリックしてください。
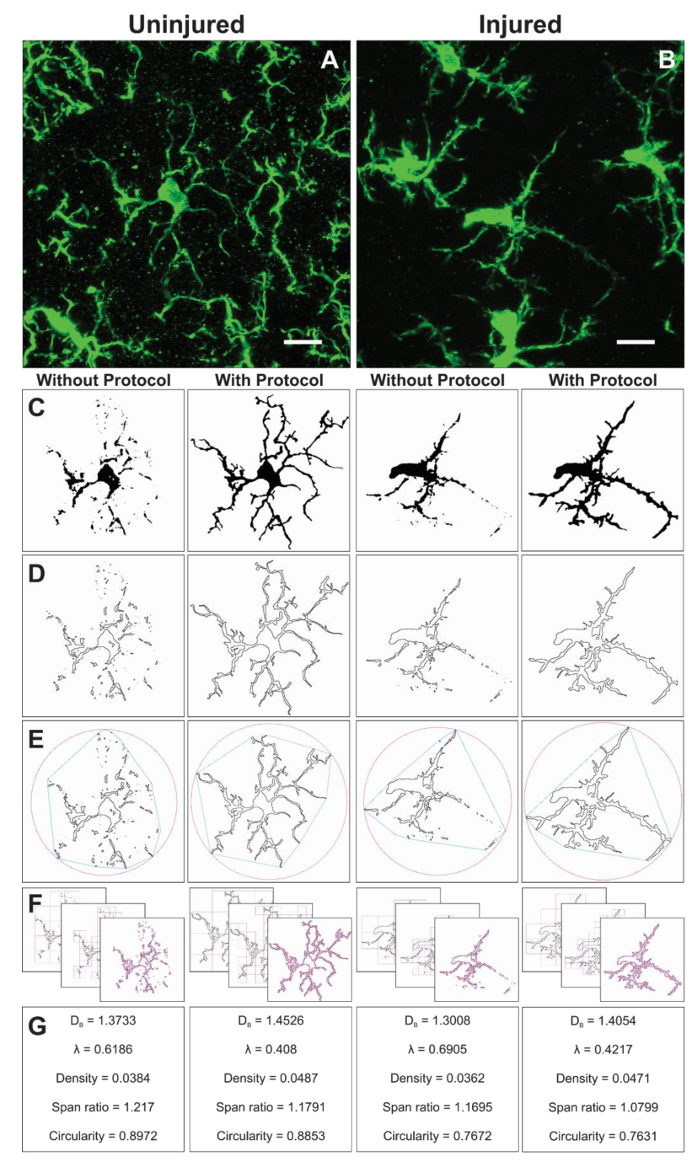
図 6。フラクタル解析プロトコル アプリケーションと。無傷 (A) と (C) 対応するバイナリおよび適用プロトコルと結果概要 (D) 画像で負傷した (B) 皮質におけるミクログリアのトリミングの顕微鏡写真の例です。関連付けられている凸型ハル (青) と対応するアウトライン図形 (E) (ピンク) サークル囲む形密度計算、比率、および真円度 (G) にまたがるされます。ボックスカウンティング法は (F) に示す、フラクタル次元 (D ・B) とベクトル (λ) 計算 (G) に使用します。スケール バー = 10 μ m.この図の拡大版を表示するのにはここをクリックしてください。
ディスカッション
ミクログリア細胞生理学および病理学のマイクロ ドメイン内には、細かくチューニングし、微妙な7,14の総損傷8形態2の多様な範囲を表示します。ImageJ プロトコルの使用は、プラットフォームとしてミクログリアの形態の定量化をすべて研究所にアクセスできるように、プラグイン、オープン ソース画像処理ソフト。記述されていたプロトコルは画像処理と解析のこのソフトウェアを使用して焦点を当て、信頼性、妥当性、データ コレクションの整合性は、優れた IHC と顕微鏡によって始まります。このプロトコルを使用してバイナリ、スケルトン、および全体の顕微鏡写真と単一セルのアウトライン表現の向上が、貧しい IHC 染色の場所を取ることができないと低コントラストになる顕微鏡がぼやけて、または画像の歪み。追加の考慮事項としてミクログリアの形態を決定的に変えるごとに区分化する前に、ストレージの中に脳を平らにしないように注意する必要があります。最後に、各実験内、ミクログリアは同じ顕微鏡と同様に、同じスケールを使用して視覚化される必要があります。計測、目標、およびソフトウェアは、同様の目的にもかかわらず異なるサイズの顕微鏡写真の結果、各フレーム内のセルの数と同様、細部が変更された顕微鏡の間で異なります。たとえば、ライカ SPII で 40 × 対物を使用してイメージ買収の結果ほどツァイス 880 を使用してより詳細なデータとセルの数 2 回で。これは、このデータのサンプリングの問題になりますフレーム全体ではなく、単一のセルからセル分岐データにとって特に重要。
一般に、全体の顕微鏡写真を生かしたスケルトン分析 2 つの理由のため単一細胞のフラクタル解析の前に。顕微鏡写真のすべてのセルの決定のセル分枝は急速な単一細胞のフラクタル解析と比較して、時間が重要な場合、スクリーニング ツールとして考慮されるかもしれない。さらに、スケルトン分析中に派生したバイナリ イメージはフラクタル解析の使用します。このイメージを作成すると、一度スケルトン分析結果に影響を与える可能性があります、ユーザー影響を紹介する重要な手順の数があります。ユーザー間のほとんどの変数は、プロトコルの手順ステップ 4.2 (増加のイメージの明るさ)、ステップ (しきい値の決定) 4.5。可能であれば、輝度 (0-255 の間 max または min スライダー) を高めるための最適な数が決定、すべての画像とユーザーの一定に保たれます。画像変動は素晴らしいが、ユーザーは画像によって異なります明るさを代わりに選択できます。また、画像は明るく、コントラストが高い場合、省略できますし、明るさを増加と専門のしきい値フィルターを使用して、しきい値を標準化できます (e.g。、黄) より変数の既定値ではなく。最適化されれば、追加ユーザー影響を最小限にするためにパラメーターを従う必要があります。
ユーザーの変動の例を図 5に示します。ユーザー 1 とユーザー 2 に増加したデータ値、したがってユーザー 1 とユーザー 2 はデータの収集に貢献した場合、変動を増加するでしょう。ユーザー 1 とユーザー 2 のバイナリとスケルトンのイメージの違いの例は色のついた丸 (図 5) で強調表示されます。この場合、両方のユーザーはミクログリアの限られた専門知識を持つ簡潔に訓練を受けた学部生だった正規監督とミクログリア増加プロトコル トレーニング2と共に専門家による指導・助言は、ユーザ間の可変性を減らすことができます。ここで評価されていません、フラクタル解析がユーザ間変動の影響受けにくいバイナリ細胞ミクログリアの図形を決定するしきい値に頼るのではなく、顕微鏡写真から手動で、個別に分離されているため。ただし、すべてのメソッドは、ユーザー間のいくつかの変動を持っています。したがって、単一のユーザー (理想的には、ミクログリア細胞のいくつかの専門知識によって訓練) データセット全体のデータ収集を完了する必要があります。
追加の変更はこのプロトコルを簡単に行うことができ、画質とノイズを低減し、プロセスの接続を確保する取り組みによって異なります。たとえば、コントラストが適切な場合、アンシャープ マスク必要はありませんし、省略することができます。最適化し、画像、実験例、セット全体からデータを収集する前に、コントロールの特定のセットのプロトコルを完了することをお勧めします。明確またはこのプロトコルに記載されたいない画像をシャープに代わりに他の最後に、追加プラグインを使用するようにさせるか、または研ぐ。
このプロトコルの利点は、その普遍的な可用性と適応性です。さらに、AnalyzeSkeleton を使用してセルの結果を評価する方が迅速かつ全体の顕微鏡写真に適用です。多細胞の解析アプローチの利点は単一のセルではなく、地域全体に焦点を当てるです。そのため、画像内のすべてのミクログリアの (エンドポイント ・ プロセスの長さの面で平均分枝を迅速に評価することが可能です。スケルトン分析を提供する複数のセルの解析: 顕微鏡写真からの単一のセルを隔離する必要な時間の投資のためのフラクタル解析を用いた一致ことはできませんセル数の面でデータ サンプリング。スクリーニングの焦点の傷害に近接電波のミクログリアの形態で最適ありますインスタンスになります。1 つの制限は、IHC 顕微鏡写真のスケルトン モデルを作成するフィールド全体イメージのレンダリングがより時間がかかる単一セル方式と比較して完璧ではないです。さらに、領域の分析は状況に適切なミクログリアの形態が大きく異なる同じフィールド内です。最後に、この分析法は細胞数、実験条件が異なる場合がありますパラメーターに依存しています。
フラクタル解析は、単一のセルに実施し、したがってスケルトン分析で得られた平均セル分岐データ出力を補完します。ただしより多くの時間がかかり、この投資は、地形データの広い範囲を得られます。たとえば、細胞の密度、スパン比と真円度データ サイズ、伸長、およびセル アウトラインの形をそれぞれについて説明します。フラクタル次元とベクトルは、それぞれセル複雑さと図形の不均一性をまとめたものです。インタラクティブ マニュアル16で各パラメーターの計算方法とデータがどのように解釈されるかもしれないの詳細な概要を提供し、そのような詳細は、具体的な研究の質問に関連して考慮すべき。生理学的および病理学的条件で発生する可能性があります 2 D ミクログリアの形態の小さな変化を定量化する敏感なツールで説明されているプロトコル結果。堅さ、凸状、フォーム ファクター16,20など追加形態計測学的解析が可能な 3次元形状を生成する場合あります。
プロトコルの開発と適応は継続的かつユーザー駆動です。それは蛍光8からパラフィン埋め込まれた組織に DAB/明視野画像7がまだ拡張されています。これまた、詳細な分析、Imaris など独自のソフトウェアと組み合わせて使用されることができます。このプロトコルさまざまな生理学に適用することができます、ミクログリアに限定されない、任意のセルまたはティッシュ特定のパターンまたは IHC メソッドを使用して識別することができる図形に適用されます。最後に、十分なサンプル サイズを持つ多変量またはクラスター分析に適用できる形態12,21によるとミクログリアを階層化これは、ミクログリアの形態はミクログリアの機能とその周辺への応答の重要な指標として意味のある情報です。ミクログリアの形態学的多様性のための感謝は、拡大と健康と病気の間にニューロン-グリア細胞血管の相互作用を十分に理解することが重要です。この分野の成長は、定量化し、複数の連続変数を用いたミクログリアの形態を要約のよく発達した、使いやすく、再現性のあるプロトコルによって強化されています。
開示事項
著者が明らかに何もありません。
謝辞
本研究は、NINR (F32NR013611) から金融サポートを受け取った。さらにお客様し、AnalyzeSkeleton(2D/3D) と FracLac の開発者に感謝したいと思います (アルガンダ ・ カレーラスらや Karperienら、それぞれ) を記載分析不可能なし。
資料
| Name | Company | Catalog Number | Comments |
| primary antibody anti-IBA1 | Wako | 019-19741 | rabbit host |
| Vectashield soft mount | Vector Labs | H-1000 | |
| Secondary antibody | Jackson ImmunorResearch | 711-545-152 | donkey host |
| 4 mL glass vial | Wheaton | UX-08923-11 | |
| Triton X-100 | Fisher Scientific | BP151 | |
| Sodium Azide (NaN3) | Sigma | S-8032 | |
| glass coverslip | Fisher Scientific | 12-544-G |
参考文献
- Davalos, D., et al. ATP mediates rapid microglial response to local brain injury in vivo. Nat Neurosci. 8 (6), 752-758 (2005).
- Karperien, A., Ahammer, H., Jelinek, H. F. Quantitating the subtleties of microglial morphology with fractal analysis. Front Cell Neurosci. 7 (3), eCollection (2013).
- Taylor, S. E., Morganti-Kossmann, C., Lifshitz, J., Ziebell, J. M. Rod microglia: a morphological definition. PLoS One. 9 (5), e97096 (2014).
- Nimmerjahn, A., Kirchhoff, F., Helmchen, F. Resting microglial cells are highly dynamic surveillants of brain parenchyma in vivo. Science. 308 (5726), 1314-1318 (2005).
- Abiega, O., et al. Neuronal Hyperactivity Disturbs ATP Microgradients, Impairs Microglial Motility, and Reduces Phagocytic Receptor Expression Triggering Apoptosis/Microglial Phagocytosis Uncoupling. PLoS Biol. 14 (6), e1002466 (2016).
- Wyatt-Johnson, S. K., Herr, S. A., Brewster, A. L. Status Epilepticus Triggers Time-Dependent Alterations in Microglia Abundance and Morphological Phenotypes in the Hippocampus. Front Neurol. 8 (700), eCollection (2017).
- Morrison, H., Young, K., Qureshi, M., Rowe, R. K., Lifshitz, J. Quantitative microglia analyses reveal diverse morphologic responses in the rat cortex after diffuse brain injury. Sci Rep. 7 (1), 13211 (2017).
- Morrison, H. W., Filosa, J. A. A quantitative spatiotemporal analysis of microglia morphology during ischemic stroke and reperfusion. J Neuroinflammation. 10 (4), (2013).
- Gyoneva, S., Traynelis, S. F. Norepinephrine modulates the motility of resting and activated microglia via different adrenergic receptors. J Biol Chem. 288 (21), 15291-15302 (2013).
- Xu, H., et al. Environmental Enrichment Potently Prevents Microglia-Mediated Neuroinflammation by Human Amyloid beta-Protein Oligomers. J Neurosci. 36 (35), 9041-9056 (2016).
- Rodriguez, J. J., Noristani, H. N., Verkhratsky, A. Microglial response to Alzheimer's disease is differentially modulated by voluntary wheel running and enriched environments. Brain Struct Funct. 220 (2), 941-953 (2015).
- Soltys, Z., et al. Quantitative morphological study of microglial cells in the ischemic rat brain using principal component analysis. J Neurosci Methods. 146 (1), 50-60 (2005).
- Orlowski, D., Soltys, Z., Janeczko, K. Morphological development of microglia in the postnatal rat brain. A quantitative study. Int J Dev Neurosci. 21 (8), 445-450 (2003).
- Morrison, H. W., Filosa, J. A. Sex differences in astrocyte and microglia responses immediately following middle cerebral artery occlusion in adult mice. Neuroscience. 339, (2016).
- Arganda-Carreras, I., Fernandez-Gonzalez, R., Munoz-Barrutia, A., Ortiz-De-Solorzano, C. 3D reconstruction of histological sections: Application to mammary gland tissue. Microsc Res Tech. 73 (11), 1019-1029 (2010).
- Davis, B. M., Salinas-Navarro, M., Cordeiro, M. F., Moons, L., De Groef, L. Characterizing microglia activation: a spatial statistics approach to maximize information extraction. Sci Rep. 7 (1), 1576 (2017).
- . ImageJ User Guide Available from: https://imagej.nih.gov/ij/docs/guide/ (2014)
- Karperien, A. L., Jelinek, H. F., , Fractal, Multifractal, and Lacunarity Analysis of Microglia in Tissue Engineering. Front Bioeng Biotechnol. 3 (51), eCollection (2015).
- Martyanova, E. K., Tishkina, A. O. 3D quantitative analysis of microglial morphology. available as conference preceedings SkoltechOn. , (2015).
- Fernandez-Arjona, M. D. M., Grondona, J. M., Granados-Duran, P., Fernandez-Llebrez, P., Lopez-Avalos, M. D. Microglia Morphological Categorization in a Rat Model of Neuroinflammation by Hierarchical Cluster and Principal Components Analysis. Front Cell Neurosci. 11 (235), eCollection (2017).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved