Transformeren, genoom bewerking en Fenotyping de stikstoffixatie tropische Cannabaceae boom Parasponia andersonii
In This Article
Summary
Parasponia andersonii is een snelgroeiende tropische boom die behoort tot de cannabis familie (Cannabaceae) en kan stikstof fixerende wortel knobbeltjes vormen in samenwerking met de Rhizobium. Hier beschrijven we een gedetailleerd protocol voor omgekeerde genetische analyses in P. andersonii op basis van Agrobacterium tumefaciens-gemedieerde stabiele transformatie en op crispr/Cas9 gebaseerde genoom bewerking.
Abstract
Parasponia andersonii is een snelgroeiende tropische boom die behoort tot de cannabis familie (Cannabaceae). Samen met 4 extra soorten vormt het de enige bekende niet-peulvrucht Lineage die een stikstoffixatie van knobbel-symbiose met Rhizobium tot stand kan brengen. Vergelijkende studies tussen peulvruchten en P. andersonii kunnen waardevol inzicht geven in de genetische netwerken die de onderliggende knobbel-formatie vormen. Om vergelijkende studies te faciliteren, hebben we onlangs het P. andersonii genoom en de gevestigde Agrobacterium tumefaciens-gemedieerde stabiele transformatie en crispr/Cas9 gebaseerde genoom Editing gesequenced. Hier bieden we een gedetailleerde beschrijving van de transformatie-en genoom bewerkingsprocedures die zijn ontwikkeld voor P. andersonii. Daarnaast beschrijven we procedures voor de kiem ontkieming en karakterisering van symbiotische fenotypes. Met dit protocol kunnen stabiele transgene Mutant lijnen worden gegenereerd in een periode van 2-3 maanden. Vegetatieve in vitro vermeerdering van T0 transgene lijnen maakt het mogelijk fenotyping experimenten uit te voeren na 4 maanden na de co-teelt van A. tumefaciens . Daarom is dit protocol slechts marginaal langer dan de voorbijgaande Agrobacterium rhizogenesgebaseerde wortel transformatie methode die beschikbaar is voor P. andersonii, maar biedt een aantal duidelijke voordelen. Samen staan de hier beschreven procedures toe om P. andersonii te gebruiken als een onderzoeksmodel voor studies gericht op het begrijpen van symbiotische associaties en mogelijk andere aspecten van de biologie van deze tropische boom.
Introduction
Parasponia andersonii is een tropische boom die behoort tot de cannabis familie (Cannabaceae) en is inheems in Papoea-Nieuw-Guinea en verschillende Pacifische eilanden1,2,3. Samen met 4 extra parasponia -soorten vertegenwoordigt het de enige Lineage van niet-peulvruchten die een stikstoffixatie van knobbel-symbiose met Rhizobia kan instellen. Deze symbiose is goed bestudeerd in de peulvruchten (Fabaceae) modellen Medicago truncatula en Lotus japonicus, die heeft geresulteerd in het verwerven van gedetailleerde kennis van de moleculaire genetische aard van knobbel vorming en functioneren4. Bovendien werd aangetoond dat de wortel knokkel symbiose in peulvruchten wordt gebaseerd op de veel oudere en wijdverbreide arbusculaire behorend symbiose5. Fylogenomische vergelijkingen suggereren dat de stikstof-Fixing knobbel symbiose van peulvruchten, parasponia, evenals, de zogenaamde actinorhizal plantensoorten die gastheer diazotrofische frankia bacteriën, hebben een gedeelde evolutionaire oorsprong 6,7,8. Om te bepalen of de genen die zijn geïdentificeerd om te worden betrokken bij de vorming van peulvruchten zijn het deel van een gediende genetische basis, studies over niet-peulvruchten soorten zijn essentieel. Daarom stellen wij voor om P. andersonii te gebruiken als vergelijkend onderzoeksmodel, naast peulvruchten, om de belangrijkste genetische netwerken te identificeren die de onderliggende knobbel-vorming en-werking vormen.
P. andersonii is een pionier die kan worden gevonden op de hellingen van vulkanische heuvels. Het kan voldoen aan de groeisnelheden van 45 cm per maand en bereik lengtes tot 10 meter9. P. andersonii bomen zijn wind-bestuikte, die wordt vergemakkelijkt door de vorming van aparte mannelijke en vrouwelijke bloemen3,10. We hebben onlangs het diploïde genoom (2n = 20; 560 MB/1C) van P. andersoniigesequenced en geannoteerd en een concept genoomsequenties van 2 extra parasponia -soorten samengesteld; P. rigida en p. rugosa6. Dit onthulde ~ 35.000 P. andersonii Gene modellen die kunnen worden geclusterd in > 20000 orthogroepen samen met genen van m. truncatula, sojabonen (Glycine max), Arabidopsis thaliana, Woodland aardbei ( Fragaria russula), trema orientalis, Black Cotton populier (Populus balsem) en eucalyptueuze (eucalyptus grandis)6. Bovendien identificeerden transcriptome vergelijkingen tussen M. truncatula en P. andersonii een set van 290 putatieve orthologues die een nodule-verbeterd expressie patroon in beide soorten6vertonen. Dit biedt een uitstekende bron voor vergelijkende studies.
Om de genfunctie in P. andersonii wortels en knobbeltjes te bestuderen, is een protocol voor Agrobacterium rhizogenes-gemedieerde wortel transformatie vastgesteld11. Met dit protocol kunnen samengestelde planten die transgene wortels dragen in een relatief kort tijdsbestek worden opgewekt. Deze methode is, ook, op grote schaal toegepast in het onderzoek van de leguaan-symbiose12,13,14. Het nadeel van deze methode is echter dat alleen wortels worden getransformeerd en dat elke transgene wortel een onafhankelijk transformatie evenement vormt, wat resulteert in substantiële variatie. De transformatie is ook van voorbijgaande aard en transgene lijnen kunnen niet worden gehandhaafd. Dit maakt A. rhizogenesgebaseerde wortel transformatie minder geschikt voor crispr/Cas9-gemedieerde genoom bewerking. Bovendien, A. rhizogenes draagt zijn wortel inducerende Locus (rol) genen naar de plant genoom, die eenmaal uitgedrukt interfereren met hormoon homeostase15. Dit maakt het bestuderen van de rol van plantenhormonen in A. rhizogenes-getransformeerde wortels uitdagend. Om deze beperkingen te overwinnen, hebben we recentelijk een protocol ontwikkeld voor de transformatie van Agrobacterium tumefaciensen crispr/Cas9-gemedieerde mutagenese van P. andersonii10.
Hier bieden we een gedetailleerde beschrijving van de a. tumefaciens-gebaseerde transformatie procedure en reverse genetics pipeline ontwikkeld voor P. andersonii. Daarnaast bieden we protocollen voor de downstream behandeling van transgene plantlets, inclusief assays om symbiotische interacties te bestuderen. Met behulp van het protocol dat hier wordt beschreven, kunnen meerdere transgene lijnen worden gegenereerd in een periode van 2-3 maanden. In combinatie met CRISPR/Cas9-gemedieerde mutagenese, maakt dit een efficiënte generatie van afdek gemuteerde lijnen mogelijk. Deze gemuteerde lijnen kunnen vegetatief worden gekweekt in vitro10,16,17, waardoor voldoende materiaal kan worden gegenereerd om fenotypische karakterisering te starten na 4 maanden nadat de transformatie procedure 10is geïnitieerd. Dit geheel van procedures moet een laboratorium in staat stellen om P. andersonii te adopteren als een onderzoeksmodel voor studies gericht op het begrijpen van de verenigingen van rhizobial en behorend, evenals mogelijk andere aspecten van de biologie van deze tropische boom.
Protocol
1. groeien P. andersonii bomen in de kas
-
Ontkieren P. andersonii WU1 zaden18.
- Gebruik verse Parasponia bessen of dompel gedroogde bessen in water gedurende 2 uur om te hydrateren. Squash bessen op een stukje tissuepapier of wrijf tegen de binnenkant van een theezeef om de zaden te verwijderen.
- Desinfecteer zaden met commercieel bleekmiddel (~ 4% hypochloriet) gedurende 15-20 min en spoel de zaden vervolgens 6 keer met gesteriliseerd water.
- Breng de zaden over naar steriele 200 μL PCR-buizen. Vul de buizen met gesteriliseerd water, zodat de zaden volledig worden ondergedompeld. Incuberen de buisjes gedurende 10 dagen in een Thermocycler met het volgende programma: 30 cycli (7 °C gedurende 4 uur, 28 °C gedurende 4 uur). Gebruik geen verwarmd deksel, want dit kan de zaden doden.
- Maak de SH-0 platen (Zie tabel 1). Breng de zaden over naar SH-0 platen en incuberen bij 28 °C, 16 h:8 h dag: nacht. Sluitplaten met 2 lagen elastische afdichtings folie om drogen te voorkomen tijdens de incubatie bij 28 °C.
- Nadat zaailingen hun eerste set van echte bladeren (~ 3-4 weken na incubatie bij 28 °C) hebben ontwikkeld, breng je zaailingen over naar potten gevuld met commerciële potgrond en Bedek je de zaailingen met een doorzichtige plastic beker om uitdroging te voorkomen. Plaats potten in een 28 °C klimaatkamer of kas, ~ 85% RH, onder een 16 h:8 h dag: nacht regime.
- Verwijder na 1 week de doorzichtige plastic beker. Water de potten regelmatig en wanneer bomen groeien groter supplement met kunstmest om groei te ondersteunen.
2. klonen van constructies voor CRISPR/Cas9-gemedieerde mutagenese van P. andersonii
Opmerking: Standaard binaire transformatie vectoren kunnen worden gebruikt voor de stabiele transformatie van P. andersonii. Hier, als voorbeeld, is een procedure voor het genereren van constructies voor CRISPR/Cas9-gemedieerde mutagenese met behulp van modulair klonen (bijvoorbeeld, Golden Gate)19.
- Identificeer gids RNA doel sequenties voor het gen (s) van belang, met behulp van bioinformatica software met een ingebouwde CRISPR ontwerptool. Kies gids RNA sequenties gelegen aan de 5 '-end van de codeer volgorde van het doel gen om de kans op het verkrijgen van volledige Knockouts te vergroten. Zorg ervoor dat u controleert op off-target effecten door te zoeken tegen de P. andersonii genoome6.
Opmerking: gebruik 2 Sgrna's per doel gen, bij voorkeur 200-300 BP uit elkaar. Dit kan verwijderingen genereren die kunnen worden geïdentificeerd door PCR en vervolgens door agarose gel elektroforese. - Genereer Level 1 Golden Gate constructies met de sgRNA sequenties.
- Ontwerp primers om te versterken elke afzonderlijke sgRNA door het inbrengen van de 20 BP gids sequentie op de positie van N(20) in de volgende primer sequentie: 5 '-TGTGGTCTCAATTGN(20) gttttagagctagaaatagcaag-3 '.
Opmerking: als de geleidervolgorde gelijk is aan GN(19), verwijdert u de G aan het einde van de geleidervolgorde 5 ' voordat u deze in de primer reeks invoegt. - PCR versterken sgrnas van pICH86966:: AtU6p:: sgRNA_PDS20 met behulp van de voorwaartse primers ontworpen bij stap 2.2.1 en de universele omgekeerde primer: 5 '-TGTGGTCTCAAGCGTAATGCCAACTTTGTAC-3 '. Gebruik een high-fidelity hitte stabiele DNA-polymerase en de volgende PCR-condities: 98 °C gedurende 30 sec.; 30 cycli (98 °C voor 10 s; 53 °C gedurende 20 s; 72 °C gedurende 10 sec.); 72 °C gedurende 7 min. succesvolle PCR-reacties opleveren een 165 BP amplicon.
- Kolom-Reinig de PCR-ampliconlengte voor Temp met een commerciële PCR-reinigingsset. Vervolgens, opzetten Golden Gate reacties op Clone sgRNAs achter de Arabidopsis thaliana ATU6P kleine RNA promotor: 10 ng van de sgRNA PCR amplicon, 150 ng van pICSL01009:: AtU6p20, 60 ng van de passende niveau 1 acceptor vector, 2 μL T4 Ligase-buffer, 2 μL 0,1% van het runderserum albumine (BSA), 0,5 μL BsaI, 0,5 μL T4 ligase, vul aan tot 20 μL met ultra zuiver water. Zorg ervoor dat alle Sgrna's in dezelfde richting worden gekloond om haarspeld vorming te voorkomen.
- Incubate reacties in een Thermocycler met het volgende programma: 37 °C gedurende 20 sec.; 26 cycli (37 °C gedurende 3 min; 16 °C gedurende 4 min); 50 °C gedurende 5 min; 80 °C gedurende 5 min. Transformeer Golden Gate reacties op Escherichia coli en plaat op lb medium21 bevattende ampicilineen (50 mg/l), X-Gal (200 mg/l) en Iptg (1 mm).
Opmerking: bereid de voorraadoplossingen van IPTG en X-gal voor, respectievelijk in ultra zuiver water en dimethylformamide. Filter steriliseren de ampicillaire en IPTG-voorraadoplossingen en slaan alle voorraden op-20 °C. Draag handschoenen bij het hanteren van dimethylformamide. - Selecteer witte kolonies en Isoleer plasmiden met een commerciële plasmide isolatie kit. Sequentie Verifieer geïsoleerde plasmiden voordat je verdergaat met de Golden Gate Level 2-assemblage.
- Ontwerp primers om te versterken elke afzonderlijke sgRNA door het inbrengen van de 20 BP gids sequentie op de positie van N(20) in de volgende primer sequentie: 5 '-TGTGGTCTCAATTGN(20) gttttagagctagaaatagcaag-3 '.
- Monteer Level 2 Golden Gate constructies voor de stabiele transformatie.
- Voer een Golden Gate-reactie uit met behulp van de Level 1 AtU6p:: sgRNA constructies (gegenereerd onder punt 2,2) en pICH47802::Nptii, pICH47742:: 35SPro:: ωnls-ACas9:: 35Ster, het niveau 2 acceptor pICSL4723 en de juiste einde-linker (Zie Engler et al.22). Voer de volgende reacties uit: gebruik ~ 100 fmol van elke donor vector en ~ 20 fmol van de acceptor vector en voeg 2 μL T4 ligase buffer, 2 μL 0,1% BSA, 0,5 μL BpiI, 0,5 μL T4 ligase, vul aan tot 20 μL met ultra zuiver water.
Opmerking: het niveau 1 plasmiden pICH47802::nptii, pICH47742:: 35SPro:: ωnls-aCas9:: 35Ster moet eerst worden gekloond (Zie aanvullend bestand 1), zoals wordt beschreven voor sgrnas onder paragraaf 2,220,22 ,23. - Inincuberen reacties zoals onder stap 2.2.4 en transformeren in E. coli. Plaat op LB medium met kanamycine. Selecteer de volgende dag witte kolonies en Isoleer plasmiden. Bepaal de juiste plasmide assemblage door een restrictie-verterings analyse.
- Voer een Golden Gate-reactie uit met behulp van de Level 1 AtU6p:: sgRNA constructies (gegenereerd onder punt 2,2) en pICH47802::Nptii, pICH47742:: 35SPro:: ωnls-ACas9:: 35Ster, het niveau 2 acceptor pICSL4723 en de juiste einde-linker (Zie Engler et al.22). Voer de volgende reacties uit: gebruik ~ 100 fmol van elke donor vector en ~ 20 fmol van de acceptor vector en voeg 2 μL T4 ligase buffer, 2 μL 0,1% BSA, 0,5 μL BpiI, 0,5 μL T4 ligase, vul aan tot 20 μL met ultra zuiver water.
- Transformeer niveau 2 constructies naar Agrobacterium tumefaciens stam AGL124.
3. stabiele transformatie van P. andersonii
- Inoculeren 2 LB platen met de juiste antibiotica met een. tumefaciens stam AGL1 getransformeerd met de constructie van belang. Incuberen de platen bij 28 °C gedurende 2 dagen.
- Oogst jonge takken van broeikas bomen. Gebruik ongeveer 5 takken van 5-8 cm lang voor elke transformatie. Zorg ervoor dat u alleen gezonde niet-geïnfecteerde takken gebruikt. Verwijder de bladeren door ze zo te snijden dat ~ 1 cm2 van het blad weefsel aan het einde van elke petiole overblijft. Gooi de bladeren weg.
- Desinfecteer het weefsel gedurende 15 minuten met 1:1-verdund commercieel bleekmiddel (~ 2% hypochloriet na verdunning) met enkele druppels Polysorbaat 20. Spoel het weefsel vervolgens 6 keer af met geautoclaveerd water.
Let op: deze stap, evenals, de volgende stappen moeten worden uitgevoerd in een laminaire down-flow kabinet te houden weefsel steriel. - Resuspendeer de A. tumefaciens cellen van 1-2 platen in 25 ml infiltratie medium (Zie tabel 1) met acetosyringone (20 mg/L) en een niet-ionische oppervlakteactieve stof (0,001% v/v) om een optische dichtheid (OD600) van ~ 5 te bereiken.
Let op: bereid de acetosyringone stockoplossing voor in 70% ethanol en bewaar bij-20 °c. De niet-ionogene oppervlakteactieve stof moet filter-gesteriliseerd zijn voordat deze aan het infiltratie medium wordt toegevoegd. - Snijd zowel de steel en het bast weefsel in stukjes van ~ 1 cm in lengte binnen de A. tumefaciens suspensie, waardoor er verse wonden aan beide kanten ontstaan. Laat weefsel stukken in de A. tumefaciens suspensie voor 10-30 min.
- Bereid het wortel middel (Zie tabel 1) en Voeg na autoclaven acetosyringone (20 mg/L) toe. Droge weefsel stukjes op een steriel stukje filtreerpapier en plaats het op het medium (~ 10 Explants/plaat). Incuberen de platen in het donker bij 21 °C gedurende 2 dagen.
Opmerking: laat het medium afkoelen tot ~ 60 °c voordat u acetosyringone toevoegt. - Inspecteer de platen na 2 dagen op schimmel of voor de hand liggende bacteriële besmetting (andere bacteriën dan A. tumefaciens). Verontreinigde platen moeten worden weggegooid.
- Bereid vloeibaar SH-10 medium (Zie tabel 1). Voeg na autoclaven Polysorbaat 20 (0,01%, v/v) toe. Breng weefsel stukken over naar 10 mL SH-10 met Polysorbaat 20. Gedurende een periode van ten minste 10 min, zachtjes schudden elke 2-3 min om het weefsel te wassen.
- Was twee extra keer met verse SH-10 met Polysorbaat 20. Deze tijden is een incubatietijd van 2-3 min per wasstap voldoende.
- Maak het wortel medium klaar (Zie tabel 1). Na autoclaven, voeg cefotaxime (300 mg/L) en kanamycine (50 mg/L) en giet platen. Voor de secundaire transformaties (transformaties van transgene kanamycine-resistente lijnen), apply hygromycine (15 mg/L) selectie.
- Droge weefsel stukjes op steriele stukjes filtreerpapier. Daarna, overbrengen van weefsel stukken naar de platen bereid in stap 3,9.
- Incuberen platen gedurende 7 dagen bij 28 °C, 16 h:8 uur dag: nacht. Elke 2 dagen controleren van de platen voor schimmel of bacteriële besmetting en overmatige groei van A. tumefaciens. In geval van verontreiniging, overdracht van niet-geïnfecteerde stukken naar een verse plaat.
- Breng na 7 dagen weefsel stukken over naar het voortplantings medium (Zie tabel 1) met cefotaxime (300 mg/l) en kanamycine (50 mg/l). Incubate platen bij 28 °C, 16 h:8 h dag: nacht. Vernieuw de platen één keer per week totdat er transgene scheuten ontstaan. Zorg ervoor dat u alleen niet-geïnfecteerde weefsel stukken naar verse platen overdraagt. Gooi de stukjes die zijn begroeid door A. tumefaciens.
- Eenmaal putend-transgene scheuten zijn ≥ 1 cm in lengte, snijd shoots en kweek ze zelfstandig in het voortplantings medium met cefotaxime (300 mg/L) en kanamycine (50 mg/L). Om ervoor te zorgen dat Shoots onafhankelijke transformanten vertegenwoordigen, neemt u slechts één shoot van elke kant van een explant.
- Vegetatief propageren van put-transgene scheuten zoals beschreven onder stap 5,2.
4. genotypering van putatief-transgene scheuten
- Ontwerp primers die de sgRNA herkenning site (s) beslaan. Om PCR-ampliconlengte voor temp-sequencing toe te staan, kiest u primers 150-250 BP uit de buurt van de herkenning van de sgrna-site (s).
- Knip een blad punt (~ 5 mm) van elke transgene shoot om gegenotypeerd te worden. Oogst ook een wild-type controlemonster.
- Voer 50 μL PCR-reacties uit met behulp van de primers die zijn ontworpen bij stap 4,1 en een commerciële Kit om DNA rechtstreeks uit plantaardige monsters te versterken. Als alternatief kunnen PCR-reacties worden uitgevoerd op gezuiverd DNA met behulp van een high-fidelity polymerase.
- Afzonderlijke PCR-amplicons op een 1,5-2% agarose-gel.
- Analyseer de resultaten van de Elektroforese van de gel. Controleer voor monsters die meerdere bands produceren (meer dan 1 allel) en PCR-amplicons met maten die verschillen van wild type, wat de aanwezigheid van middelgrote indels aangeeft.
- Volgorde PCR-amplicons om de exacte mutaties te identificeren. Voor monsters die één PCR-amplicon produceren, kunnen PCR-producten direct worden gesequentieerd. Monsters die meer dan 1 band produceren na Elektroforese van de gel of die heterozygoot lijken te zijn na directe sequencing van de PCR-amplicon, moeten eerst worden gekloond tot een bot-end kloon vector. Volg vervolgens meerdere klonen voor elk monster om alle mogelijke allelen in het monster te identificeren.
- Lijn sequentie resultaten uit naar het gen van belang en Inspecteer de uitlijning om te controleren op mutaties in de buurt van de sgRNA target site (s). Controleer vervolgens of deze mutaties frame verschuivingen maken. Gooi lijnen weg met > 2 allelen en lijnen met in-frame mutaties.
- Selecteer verschillende regels voor verdere analyse.
- Geselecteerde regels propageren zoals beschreven onder stap 5,2.
- Wanneer lijnen verschillende nieuwe scheuten hebben ontwikkeld, neem dan nieuwe monsters van ≥ 3 blad uiteinden en herhaal stappen 4.3-4.7. Bepaal of de mutaties die in elk van de monsters van dezelfde lijn en van het oorspronkelijke PCR-monster aanwezig zijn, identiek zijn. Lijnen die dezelfde mutaties in alle monsters opleveren, worden homogeen gemuleerd en kunnen worden gebruikt voor verdere experimenten. Regels negeren die niet dezelfde resultaten opleveren als deze regels zijn Chimeric.
5. bereiding van Geroote P. andersonii plantlets voor experimenten
-
Start een nieuwe weefselkweek lijn van P. andersonii.
- Oogst axillaire knoppen, jonge toevallige scheuten of blad weefsel van gezonde bomen. Als alternatief kunnen zaailingen als uitgangsmateriaal worden gebruikt.
- Desinfecteer het weefsel met behulp van 1:1-verdund commercieel bleekwater (~ 2% hypochloriet na verdunning) met enkele druppels Polysorbaat 20 gedurende 15 min. daarna, spoel weefsel 6 keer met behulp van geautoclaveerd.
Let op: deze stap, evenals, de volgende stappen moeten worden uitgevoerd in een laminaire down flow of laminaire cross flow kabinet om weefsel steriel te houden. - Overdracht van weefsel naar propagatie medium (Zie tabel 1). Sluitplaten met 2 lagen elastische afdichtings folie en incuberen platen bij 28 °C, 16 h:8 h dag: nacht.
- Inspecteer de platen om de paar dagen gedurende de eerste 2 weken om ervoor te zorgen dat weefsel vrij is van schimmel-of bacteriële besmetting.
- Propageren van weefsel door het plaatsen van ~ 10 scheuten op een verse plaat van propagatie medium en sluit de plaat met 2 lagen elastische afdichtings folie. Incubate platen bij 28 °C, 16 h:8 h dag: nacht. Herhaal deze stap elke 4 weken.
- Als de scheuten > 1 cm lang zijn, snijd de scheuten op hun basis en plaats ze op het wortel medium (Zie tabel 1). Ongeveer 10 scheuten kunnen op een enkele wortel plaat worden geplaatst. Positie schiet rechtop door het inbrengen van de basale punt van de shoot in het medium. Wortels verschijnen op 10-14 dagen na incubatie van de platen bij 28 °C, 16 h:8 h dag: nacht.
Opmerking: wortel niet alle scheuten maar houd deel voor de voortplanting van de weefselcultuur (zie stap 5,2).
6. nodulation van P. andersonii plantlets in potten
-
Bereid Rhizobium entmateriaal.
- Inoculeren 10 mL vloeibaar YEM medium (Zie tabel 2) uit één enkele kolonie Mesorhizobium plurifarium BOR26 en incuberen bij 28 °c gedurende 2 dagen.
Opmerking: M. plurifarium BOR2 heeft de voorkeur omdat het efficiënt nodulates P. andersonii. Echter, andere Rhizobium stammen kunnen ook worden gebruikt voor is van P. andersonii (bijv. bradyrhizobium elkanii WUR325, Rhizobium tropici CIAT89926,27 of bradyrhizobium SP. Kelud2A4). - Gebruik de 10 mL cultuur om een groter volume vloeibaar YEM medium te beënten. Het volume van deze cultuur is afhankelijk van het aantal potten dat moet worden inocculeerd.
- Bereid vloeibaar EKM medium (Zie tabellen 3, tabel 4). Centrifugeer de bacteriecultuur gedurende 10 minuten bij 3.500 x g om de cellen te oogsten. Vervolgens, resuspendeer de bacteriële pellet in vloeibare EKM (gebruik ongeveer hetzelfde volume als de oorspronkelijke YEM-cultuur) en bepaal de optische dichtheid (OD600).
- Inoculeren 10 mL vloeibaar YEM medium (Zie tabel 2) uit één enkele kolonie Mesorhizobium plurifarium BOR26 en incuberen bij 28 °c gedurende 2 dagen.
- Voor ~ 20 potten, bereid 3 L vloeibaar EKM medium en inoculeren met de rhizobiale suspensie bereid bij stap 6.1.3. om OD600 = 0,025 te bereiken.
- Meng 3 L EKM met Rhizobia met 1.250 g perliet. Voeg vervolgens 210 g van dit mengsel toe aan steriele doorschijnende polypropyleen potten. Als alternatief, in plaats van perliet, gebruik zand als een substraat voor is testen.
- Plant 1-3 P. andersonii plantlets in elke pot. Bereid ook verschillende potten met P. andersonii plantlets die zijn getransformeerd met de crispr-Control construct (Zie aanvullende tabel 1). Weeg verschillende potten af om tijdens het experiment waterverlies te kunnen bepalen. Bedek de bodem van elke pot om de wortels te beschermen tegen blootstelling aan licht.
- Inbroed potten in een geklimatiseerde groei ruimte (28 °C, 16 h:8 h dag: nacht) voor 4-6 weken. Eenmaal per week weeg je verschillende potten af om waterverlies te bepalen. Als waterverlies hoger is dan 10 mL, vul dan aan met ultra zuiver water om het verlies te compenseren.
- Reinig na 4-6 weken de wortels van perliet en bepaal de knobbel-getallen met een verrekijker om de nodulatie-efficiëntie te onderzoeken.
7. nodulation van P. andersonii plantlets op platen
-
Voor bereiding van cellofaan membranen 28.
- Snijd de cellofaan membraan om te passen in een vierkante 12 cm x 12 cm Petri schaaltje. Snijd de membranen een beetje korter aan de bovenkant om ruimte te maken voor de scheuten om te groeien.
- Om de permeabiliteit van cellofaan membranen te verhogen, kook de membranen in EDTA-oplossing (1 g/L) gedurende 20 min. spoel daarna ten minste 6x met gedemineraliseerd water om de EDTA te verwijderen.
Nb: als het droge membraan de neiging heeft om te kreukt wanneer het in aanraking komt met water, dompel de droge membranen één voor één in de oplossing. - Leg de membranen horizontaal in een dun laagje water in een ronde glasplaat. Steriliseer de membranen door twee keer te autoclaven.
- Plaats 1 geautoclaveerd cellofaan membraan op een vierkant 12 x 12 cm Petri schaaltje met agar-stold EKM medium (Zie tabel 3, tabel 4). Plaats twee 3 weken oude geworteld P. andersonii plantlets (zie rubriek 5) of 4 weken oude zaailingen (zie paragraaf 1,1) op de bovenkant van het membraan. Zorg ervoor dat je alleen plantlets of zaailingen kiest met wortels die witte wortel uiteinden hebben, wat aangeeft dat deze wortels nog steeds groeien.
- Bedek de wortels voorzichtig met een tweede cellofaan membraan, waardoor een sandwich laag ontstaat. Verzegel de plaat met 3 lagen elastische afdichtings folie. Wikkel de onderste helft van de platen met aluminiumfolie, om de wortels te bedekken tegen blootstelling aan licht.
- Inbroed de platen in een geklimatiseerde groei ruimte (28 °C, 16 h:8 h dag: nacht) gedurende 3-4 weken. Markeer de positie van de wortel tips om de wortelgroei na verloop van tijd te volgen.
- Als de EKM-platen door langdurige incubatie beginnen te drogen, breng de planten dan een paar dagen vóór de bacteriële inoculatie over naar verse EKM-platen.
- Bereid het bacteriële entmateriaal zoals beschreven bij stap 6,1.
- Verwijder het bovenste cellofaan membraan en breng 1 mL Rhizobium cultuur (OD600 = 0,025) aan op de wortels. Plaats vervolgens een nieuw cellofaan membraan op de inocculeerde wortels. Wikkel de buitenkant van de plaat met behulp van aluminiumfolie om de wortels te bedekken tegen blootstelling aan licht.
- Na 4 weken onderzoekt u knobbel-getallen met een verrekijker om de nodulatie-efficiëntie te bepalen.
8. nodulation van P. andersonii zaailingen in zakjes
- Kieren van P. andersonii zaden zoals beschreven in punt 1,1. Nadat de zaadlobben volledig zijn opgedoken (~ 12 dagen op sh-0 platen bij 28 °c), breng de zaailingen over naar zakjes.
- Om de zakjes voor te bereiden, scheur het gevouwen gedeelte van de papieren lont en voeg 7 mL gemodificeerd EKM medium toe (Zie tabel 3, tabel 4).
- Plaats 1 of 2 zaailingen door de wortels tussen beide vellen papier te plaatsen die de papieren lont vormen en de voorste kunststof plaat van het opvangzakje.
- Bescherm de wortels tegen blootstelling aan licht, door aluminiumfolie rond het opvangzakje te vouwen. Onderbreek de zakjes in een plastic doos bedekt met een doorschijnend deksel om een hoge luchtvochtigheid te behouden. Plaats de doos in een geklimatiseerde groei ruimte (28 °C, 16 h:8 uur dag: nacht).
- Compenseren van Waterverdamping door het toevoegen van steriel Ultra zuiver water, als zodanig dat de papieren lont vochtig blijft (Vermijd staande water aan de onderkant van het zakje). Na de eerste week, dit vereist over het algemeen toe te voegen 2-3 ml elke 4 dagen.
- Bereid het bacteriële entmateriaal zoals beschreven bij stap 6,1.
- Nadat zaailingen gedurende 10-12 dagen in zakjes zijn geteeld, wordt het wortelstelsel met 500 μL van de Rhizobium-cultuur (OD600 = 0,025) inoculeren.
- Volg de knobbel-formatie door de tijd heen. Vier weken na de inoculatie kunnen knobbeltjes worden geteld en geoogst om de nodulatie-efficiëntie te bepalen.
9. analyse van nodule Cytoarchitecture
- Verzamel 10-15 knobbeltjes in een 2 mL buisje met fixeermiddel (5% Glutaaraldehyde in 0,1 M fosfaatbuffer, pH 7,2). Breng een vacuüm aan voor 1/2-1 uur en incuberen 's nachts bij 4 °C. Gedurende deze periode zinken de monsters naar de bodem van de buis.
Opmerking: de fixatieve oplossing kan bij 4 °c worden bewaard voor ~ 2-4 weken voorafgaand gebruik. Zorg ervoor dat u handschoenen draagt bij het werken met weefsel fixatief. - Was de knobbeltjes 2x met 0,1 M fosfaatbuffer, pH 7,2. Breng 10 min intervallen aan tussen elke wasstap.
- Dehydraat de monsters door ze vervolgens te bebroed in 30%, 50%, 70% en 100% ethanol. Om ervoor te zorgen dat al het water uit de monsters wordt verwijderd, herhaalt u de 100% ethanol stap 3x. Breng 10 min intervallen aan tussen elke dehydratie stap.
- Bereid polymerisatie mengsel I (PM-I) door 1 pak verharder I toe te voegen aan 2,5 mL PEG400 gemengd met 100 mL HEMA (2-hydroxyethyl methacrylaat)-gebaseerde hars oplossing. Roer de oplossing voor ~ 15 min om de verharder I volledig los te maken. Daarna, bewaar PM-I bij-20 °C.
- Verwijder de ethanol uit stap 9,3. en infiltreren de monsters in de volgende volgorde: PM-I:100% ethanol (1:3, v/v), PM-I:100% ethanol (1:1, v/v), en PM-I:100% ethanol (3:1, v/v). Inbroed de monsters in elke oplossing bij RT voor 1/2-1 uur of totdat de monsters naar de bodem zinken.
- Inincuberen monsters 's nachts bij 4 °C in 100% PM-I oplossing.
- Bereid polymerisatie mengsel II door het mengen van PM-I en Hardener II in een 15:1 (v/v) verhouding. Vul de plastic mal met de polymerisatie oplossing, oriënteer de monsters horizontaal aan de onderkant van de mal en dek af met een stukje elastische afdichtings folie. Vermijd de vorming van luchtbellen.
Opmerking: als de oplossing begint te polymeriseren bij blootstelling aan rt, probeer dan de monsters zo snel mogelijk in de plastic houder te oriënteren. Polymerisatie wordt voltooid na een nachtelijke incubatie bij RT, of 1 uur bij 37 °C. - Verwijder de afdekking van de elastische afdichtings folie uit stap 9,7 en plaats een houder op de gepolymeriseerde monsters. Om de houder op de monsters te monteren, Los 10 mL methylmethacrylaat-hars poeder op in 5 mL methyl methacrylaat-gebaseerde hars oplossing. Voeg snel de oplossing toe aan het gat in de bovenkant van de houder.
Opmerking: Voer de polymerisatie stap uit in de afzuigkap (~ 30 min bij RT). - Microtoom sectie monsters tot een dikte van 4-5 μm. plaats een Microscoop-dia op een 58 °C hete plaat en voeg een grote druppel water toe aan elke dia. Plaats de delen op de bovenkant van het water. Zodra het water is verdampd, zullen de secties zich aan de glijbaan hechten.
- Vlek dia's door onderdompelen in 0,05% (w/v) toluïdine blauw voor 2 min. Spoel vervolgens de dia's 3x met ultra zuiver water. Dia's kunnen worden waargenomen met behulp van een helder-veld Microscoop.
10. mycorrhization van P. andersonii plantlets
-
Voorbereiding Rhizophagus irregularis spores ' entmateriaal
- Maak een stapel polyester geweven filters met de volgende maten (van boven naar beneden): 210 μm, 120 μm en 36 μm maaswijdte.
- Pipetteer de benodigde hoeveelheid van een commerciële Spore suspensie op de stapel polyester filters. Spoel de filters 3x af met 100 mL geautoclaveerd gedemineraliseerd water. De sporen worden bewaard op het oppervlak van de 36 μm filter.
Opmerking: bereid de Spore suspensie in de laminaire cross flowkast voor om verontreiniging te voorkomen. - Demonteer de polyester stapel en houd het filter 36 μm alleen. Herhaal de wasstap met geautoclaveerd gedemineraliseerd water voor minstens 6x.
- Plaats het filter op een Petri schaaltje en onderbreek de sporen in geautoclaveerd gedemineraliseerd water. Gebruik een volume water dat gelijk is aan het volume van de in stap 10.1.2 gebruikte Spore suspensie. Breng de Spore suspensie over naar een steriele buis via Pipetting.
- Plaats 5 druppels van 20 μL van de Spore suspensie op een glazen glijbaan en Tel het aantal sporen met een helder-veld Microscoop. Zet spore tellingen om in een verhouding van sporen/mL en Verdun de Spore suspensie tot deze 250 sporen/mL bereikt. Bewaar de Spore suspensie bij 4 °C.
- Mycorrhization assay uitvoeren. Voeg hiertoe 800 g geautoclaveerd zand toe, aangevuld met 70 mL 1/2-Hoagland medium tot steriele doorschijnende polypropyleen potten (Zie tabel 5-6). Meng zand en medium direct in de pot door krachtig te schudden.
- Plaats een P. andersonii plantlet in elke pot en Pipetteer 1 ml van de Spore suspensie direct op de wortel van de p. andersonii plantlet. Zorg ervoor dat er verschillende potten met P. andersonii plantlets worden verwerkt met een crispr-Control constructie (Zie aanvullende tabel 1).
- Inbroed potten in een geklimatiseerde groei ruimte (28 °C, 16 h:8 uur dag: nacht) gedurende 6 weken.
- Haal de planten uit de potten en was de wortels met stromend water om zo veel mogelijk zand te verwijderen.
- Snijd de wortels in 1 cm lange stukken en kook de wortel stukjes in 10% KOH (w/v) gedurende 20 min bij 90 °C. Plaats vervolgens de gekookte wortels op een celzeef met een maaswijdte van 100 μm en spoel 3x met 50 mL water.
- Vlek wortels met 0,05% (w/v) trypan blauw in lactoglycerol (300 mL melkzuur; 300 mL glycerol; en 400 mL gedemineraliseerd water) gedurende 5 min bij 90 °C in een waterbad of verwarmingsblok. Vervolgens, overdracht wortels naar 30% glycerol. De basismonsters kunnen worden opgeslagen op RT.
- Plaats 15-25 wortel fragmenten op een enkele Microscoop glijbaan. Voeg 30% glycerol toe en dek af met een afdekglas en druk op totdat de wortel stukken plat worden. Observeer de wortel fragmenten met een helder-veld microscoop en scoor de kolonisatie van behorend.
Opmerking: een methode voor het scoren van mycorrhization wordt beschreven volgens Trouvelot et al.29. Deze methode maakt gebruik van verschillende klassen (% F,% M en% A), die een snelle schatting van het niveau van behorend kolonisatie van elk wortel fragment en overvloed aan arbuscules mogelijk maakt.
Representative Results
P. andersonii tRees kan worden geteeld in een geconditioneerde kas bij 28 °c en ~ 85% relatieve vochtigheid (Figuur 1a). Onder deze omstandigheden beginnen bomen te bloeien op 6-9 maanden na het planten. Vrouwelijke P. andersonii bloemen produceren bessen die elk een enkel zaadje bevatten. Tijdens de rijping veranderen de bessen van kleur; eerst van groen naar wit en vervolgens van wit naar bruin (Figuur 1b). Zaden geëxtraheerd uit de gerijchte bruine bessen, ontkiemen goed na een 10-daagse temperatuurcyclus en een 7-daagse incubatie op SH-0 platen (figuur 1c). Gekierde zaden blijven zich ontwikkelen tot jonge zaailingen die kunnen worden gebruikt voor experimenten na ~ 4 weken (figuur 1d).
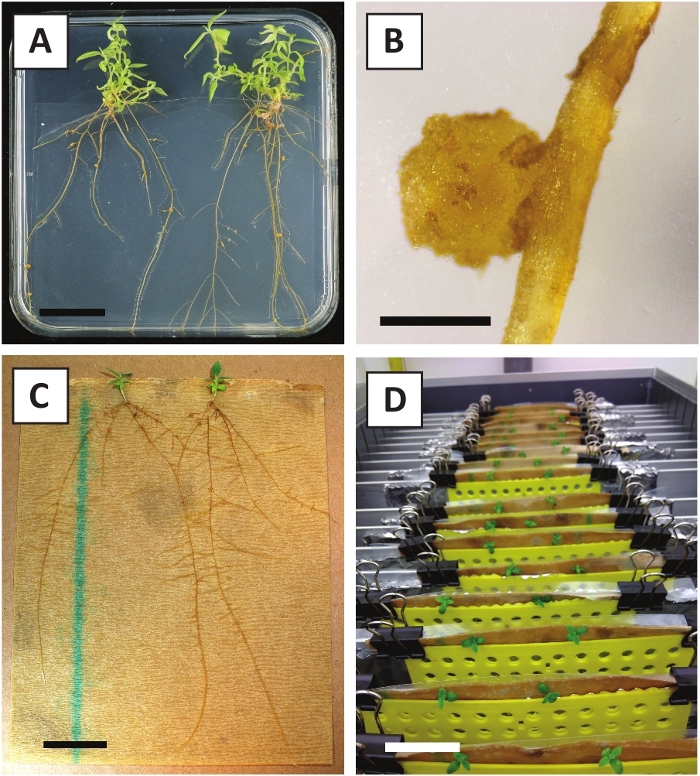
We hebben eerder aangetoond dat petiolen en segmenten van jonge P. andersonii stengels efficiënt kunnen worden getransformeerd met behulp van een. tumefaciens stam AGL110. Aan het begin van de transformatie procedure worden de weefsel explantaten samen met A. tumefaciens gedurende 2 dagen bij 21 °c (Figuur 2a) gecultiveerd. Langdurige co-teelt resulteert in de overkolonisatie van de weefsel explanten door A. tumefaciens en moet daarom worden voorkomen (Figuur 2b). Na de co-teeltperiode worden weefsel explantaten overgebracht naar selectieve media, die uitgroei van getransformeerde weefsels bevordert. Twee tot drie weken later worden kleine groene micro-Calli in het algemeen waargenomen langs het oorspronkelijke wondoppervlak (figuur 2c). Deze Calli moet blijven groeien en ontwikkelen 1 of meer putatief getransformeerde scheuten op 6-8 weken nadat de transformatie procedure is geïnitieerd (figuur 2D). In dit stadium, transformatie efficiëntie meestal variëren van ~ 10-30% voor transformaties geïnitieerd met weefsel explantaten genomen uit volwassen en deels houtachtige takken (tabel 7). Als transformaties worden geïnitieerd met explantaten afkomstig van de jonge en snel groeiende uiteinden van takken die nog geen bloemen dragen, kunnen transformatie rendementen van ~ 65-75% worden bereikt (tabel 7). Af en toe worden witachtige Calli gevormd aan de zijkant van een explant die niet in contact is met het medium en daarom geen kanamycine-selectie ervaart. Deze Calli zijn vaak niet transgene en elke scheuten gevormd uit deze Calli zal over het algemeen bleken en sterven na direct contact met kanamycine-bevattende medium (figuur 2e). In het geval dat de transformatie snelheid laag is en/of het uitgangsmateriaal suboptimaal was, kunnen weefsel stukken bruin worden (figuur 2F) en lijden aan overmatige proliferatie door A. tumefaciens (figuur 2g). Om te voorkomen dat A. tumefaciens het verspreiden en overgroeien van nabijgelegen explantaten, is regelmatige verfrissing van het medium vereist, en ernstig geïnfecteerde explanten moeten worden verwijderd. Zodra individuele transgene scheuten in het voortplantings medium worden geplaatst, wordt overmatige proliferatie door A. tumefaciens meestal niet meer voorkomen (figuur 2H). Transgene scheuten kunnen worden vermenigvuldigd door voortplanting in vitro, die zal leiden tot tientallen scheuten in een periode van één maand (Figuur 3a-B). Deze scheuten kunnen worden geplaatst op Rooten medium, die wortelvorming moet induceren na ~ 2 weken (Figuur 3C-D). Geroote plantlets kunnen vervolgens worden gebruikt voor experimenten.
Om Knockout Mutant Lines te maken, maken we gebruik van CRISPR/Cas9-gemedieerde mutagenese. Daartoe maken we gebruik van een binaire vector die het kanamycine-resistentie-gen Nptiibevat, een Cas9-coderings sequentie die wordt aangestuurd door de CaMV35S promotor en 2 Sgrna's per doel gen die worden uitgedrukt uit de ATU6P kleine RNA Promoter20. Een grafische voorstelling van de constructie die wordt gebruikt voor CRISPR/Cas9-gemedieerde mutagenese van P. andersonii wordt verstrekt in Fig. 4a. Met behulp van deze methode wordt genoom bewerking waargenomen in ~ 40% van Putin-getransformeerde scheuten10. Om gemuteerde lijnen te identificeren, worden Putte-getransformeerde scheuten gegenotypeerd voor mutaties op de sgRNA-doelsite (s) met behulp van primers die de beoogde regio beslaan. Een voorbeeld van de verwachte resultaten wordt gegeven in Figuur 4. Zoals blijkt uit de foto genomen na gel elektroforese, verschillende monsters produceren een PCR-ampliconlengte voor Temp met vergelijkbare grootte aan het wild type (figuur 4b). Deze planten kunnen kleine indels bevatten die niet kunnen worden gevisualiseerd door de Elektroforese van agarose gel of onbewerkt blijven door het Cas9 enzym. Bovendien leveren verschillende monsters banden die verschillend zijn van het wild type (bijv. de lijnen 2, 4, 7 en 8 in figuur 4b). In deze lijnen bevatten 1 (lijnen 4, 7 en 8) of beide (lijn 2) allelen grotere indels die gemakkelijk kunnen worden gevisualiseerd. De precieze aard van de mutaties op de doellocatie (s) wordt onthuld na PCR-ampliconlengte voor temp-sequencing. Zoals blijkt uit figuur 4c, kunnen zowel kleine indels van 1-4 BP als ook grotere deleties worden verkregen na crispr/Cas9 mutagenese. In figuur 4cis de sequentie van lijn 1 identiek aan die van het wild type, wat aangeeft dat deze lijn ontsnapt aan het bewerken en daarom moet worden weggegooid. Onder de lijnen die mutaties bevatten, kunnen heterozygoot, homozygoot en bi-allelic mutanten worden geïdentificeerd (figuur 4c). Heterozygoot mutanten zijn echter over het algemeen zeldzaam10. Homozygoot-of bi-allelische knock-mutanten kunnen vegetatief worden vermeerderd om voldoende materiaal voor fenotypische analyse te verkrijgen. Aangezien fenotypische analyse wordt uitgevoerd in de T0 -generatie, is het belangrijk om te controleren of de gemuteerde lijnen Chimeric zijn. Hiertoe moet genotypering worden herhaald op ten minste 3 verschillende monsters die uit elke gemuteerde lijn worden genomen. Als de genoom resultaten identiek zijn aan elkaar en het oorspronkelijke genotype monster (bijvoorbeeld lijn 8 in figuur 4D), is de lijn homogeen gemuleerd en kan deze worden gebruikt voor verdere analyse. Als de genoom resultaten echter verschillen tussen onafhankelijke monsters (bijvoorbeeld lijn 4 in figuur 4D), is de gemuteerde lijn chimeer en moet deze worden weggegooid.
Inoculatie van P. andersonii met M. plurifarium BOR2 resulteert in de vorming van wortel knobbeltjes (Figuur 5). Zoals te zien is in figuur 5a, worden deze knobbeltjes verspreid over het wortelsysteem. Knobbeltjes van P. andersonii zijn licht bruin van kleur, maar kunnen gemakkelijk worden gediscrimineerd uit het wortel weefsel op basis van hun vorm (Figuur 5b). Inoculatie-experimenten in potten en daaropvolgende groei voor 4-6 weken resulteren meestal in de vorming van ~ 10-30 knobbeltjes (Figuur 6a). Een soortgelijk aantal knobbeltjes wordt gevormd na het inenten van EKM-plaat-gekweekte P. andersonii plantlets na 4 weken na de inoculatie (Figuur 6a). In zakjes vormen P. andersonii zaailingen meestal ~ 5-15 knobbeltjes na 5 weken na de inoculatie (Figuur 5C-D, 6a). Om de knobbel cytoarchitecture te analyseren, kunnen knobbeltjes worden gesectioneerd en geobserveerd met behulp van heldere microscopie. Figuur 6b toont een voorbeeld van een longitudinaal gedeelte door het midden van een P. andersonii nodule. Deze sectie toont de centrale vasculaire bundel van een P. andersonii knobbel, die wordt geflankeerd door knobbel lobben met geïnfecteerde cellen (Figuur 6b).
P. andersonii plantlets kunnen ook mycorrhized zijn. Na 6 weken van de inoculatie met R. irregularisbereikt de kolonisatie frequentie van behorend meestal > 80% (figuur 6c). Op dit moment, over het algemeen ~ 30% van de cellen bevatten arbuscules (figuur 6C). Een representatief beeld van een P. andersonii wortel segment dat arbuscles bevat, wordt weergegeven in figuur 6d.

Figuur 1: representatieve beelden van een P. andersonii boom, zaden en zaailingen. A) zes maanden oude P. andersonii boom geteeld in potgrond in een broeikasgassen geconditioneerd op 28 ° c. B) representatief beeld van P. andersonii bessen in verschillende stadia van rijping. Jonge P. andersonii bessen (onrijp) zal van kleur veranderen van groen naar wit en tenslotte tot bruin (rijp) bij rijping. C) P. andersonii zaden geïnineerd op sh-0 medium voor 1 week. Een zwarte cirkel duidt op een gekiende zaailing. D) vier weken oude P. andersonii zaailingen geteeld in sh-0 medium. Schaal staven zijn gelijk aan 25 cm in (a) en 1 cm in (B-D). Klik hier om een grotere versie van dit cijfer te bekijken.
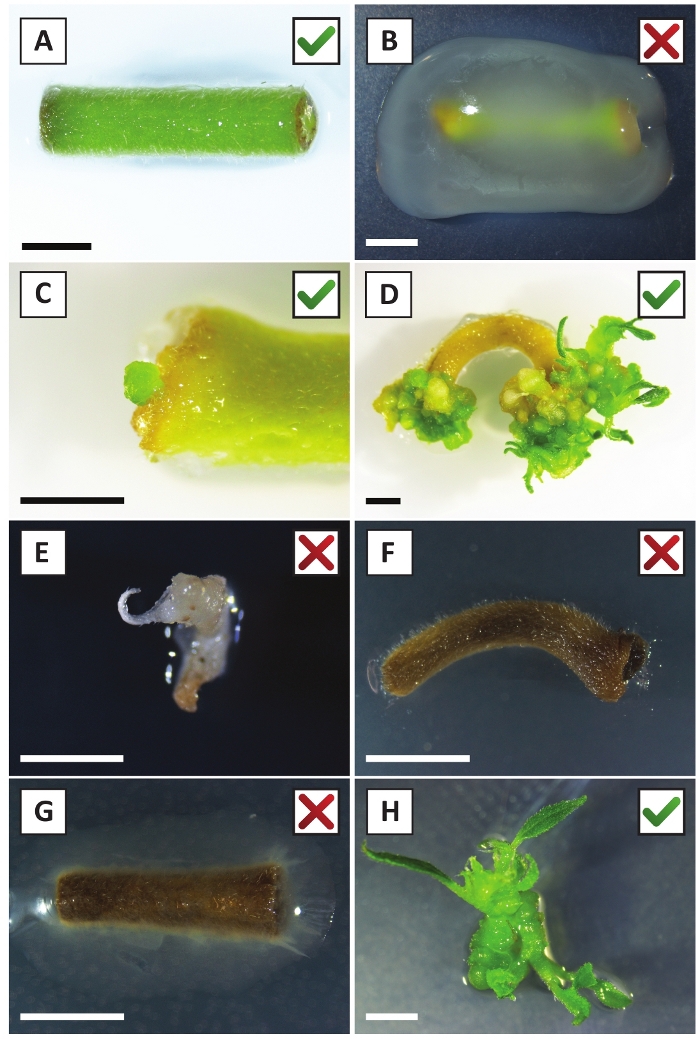
Figuur 2: representatieve beelden van explantaten in verschillende stadia van de stabiele transformatie procedure. A) desamen met A. tumefaciensgecultiveerde explant. B) explant overwoekerd door A. tumefaciens tijdens de eerste 2 weken na de transformatie. C) transgene micro-Callus gevormd in de buurt van de wond plaats van een explant op 2,5 weken na de co-teelt. D) representatief beeld van een explant op 6 weken na de co-teelt waaruit blijkt dat er scheuten van (transgene) Calli ontstaan. (E) representatief beeld van een shoot die witachtig wordt en uiteindelijk sterft wanneer in direct contact met kanamycine-bevattende medium. Deze shoot is hoogstwaarschijnlijk niet-transgene en ontsnapte kanamycine selectie wanneer aangesloten op de explant. F) representatief imago van een niet succesvol getransformeerde explant. G) representatief beeld van een niet succesvol getransformeerde explant, overwoekerd door A. tumefaciens. H) één transgene shoot op het propagatie medium na 8 weken na de co-teelt met A. tumefaciens. Schaal staven gelijk aan 2,5 mm. dozen met groene vinkjes of rode kruisjes duiden op een geslaagde of mislukte transformatie van Explants respectievelijk. Klik hier om een grotere versie van dit cijfer te bekijken.

Figuur 3: representatieve beelden van in vitro vermeerdering. A) op het voortplantings medium gekweekte scheuten. Het beeld werd genomen 1 week nadat de platen werden vernieuwd. B) op het voortplantings medium gekweekte scheuten. Het beeld werd genomen 4 weken nadat de platen werden vernieuwd. C) vers gesneden scheuten die op het wortel medium worden geplaatst. D) gedurende 2 weken geïnineerd op het wortel middel. Let op de aanwezigheid van wortels. Schaal staven zijn gelijk aan 2,5 cm. Klik hier om een grotere versie van dit cijfer te bekijken.
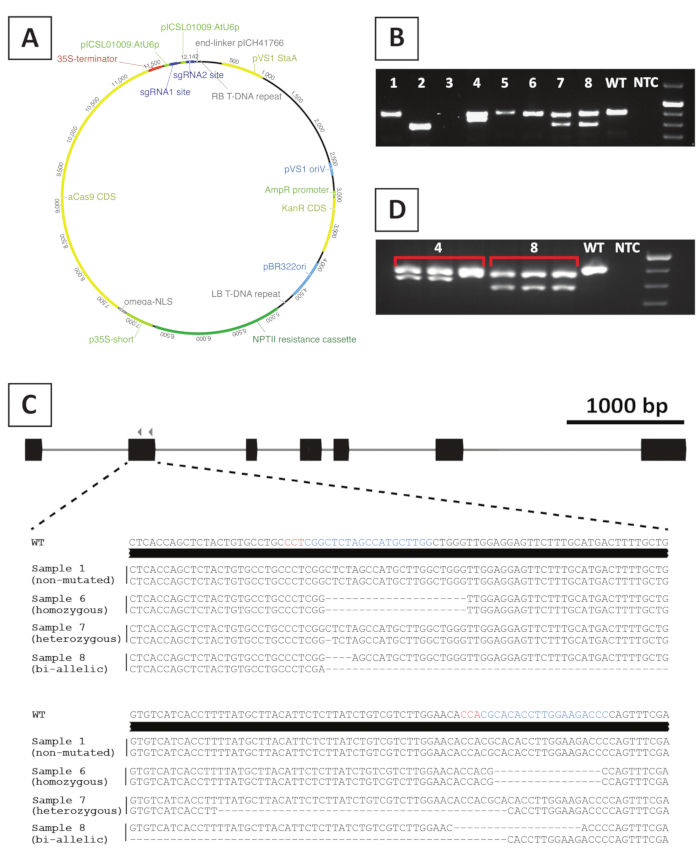
Figuur 4: representatieve resultaten na genotypering van P. andersonii T0 transgene crispr/Cas9 Mutant Lines. A) representatievekaart van een binaire vector die wordt gebruikt voor door crispr/Cas9 gemedieerde mutagenese van P. andersonii. B) representatief resultaat na PCR-gebaseerde genotypering van potentiële crispr/Cas9 Mutante lijnen met gebruikmaking van primers in de sgRNA target site (s). Getoond is een beeld na agarose gel elektroforese van amplicons. Monsters uit afzonderlijke transgene lijnen worden aangegeven met getallen. Wild type (WT) en geen sjabloon besturingselement (NTC) geven rijstroken aan met respectievelijk positieve en negatieve controles. C) Schematische weergave van mutant allelen verkregen na crispr/Cas9-gemedieerde genbewerking. Gemarkeerd in blauwe en rode kleuren zijn de sgRNA target sites en PAM sequenties, respectievelijk. D) representatief resultaat na PCR-gebaseerde screening op potentiële chimerische Mutant lijnen. Getoonde is een beeld na agarose gel elektroforese van 3 individuele monsters genomen uit de Mutant lijnen 4 en 8. Merk op dat transgene Mutant lijn 4 Chimeric is. Klik hier om een grotere versie van dit cijfer te bekijken.
Figuur 5: representatieve beelden van nodulatie-assays in platen en zakjes. A) nodulatie op platen met agar-ekm-medium en geënt met M. plurifarium BOR2 gedurende 4 weken. B) representatief beeld van een P. andersonii wortel nodule. Het beeld werd genomen na 4 weken na inoculatie met M. plurifarium BOR2. C) nodulatie in zakjes met vloeibaar ekm-medium. Zaailingen werden gedurende 5 weken met Bradyrhizobium SP. Kelud2A4 geënt. D) representatief beeld van een complete installatie die wordt gebruikt voor de is in zakjes. Schaal staven zijn gelijk aan 2,5 cm in (a, C), 1 mm in (B) en 5 cm in (D). Klik hier om een grotere versie van dit cijfer te bekijken.
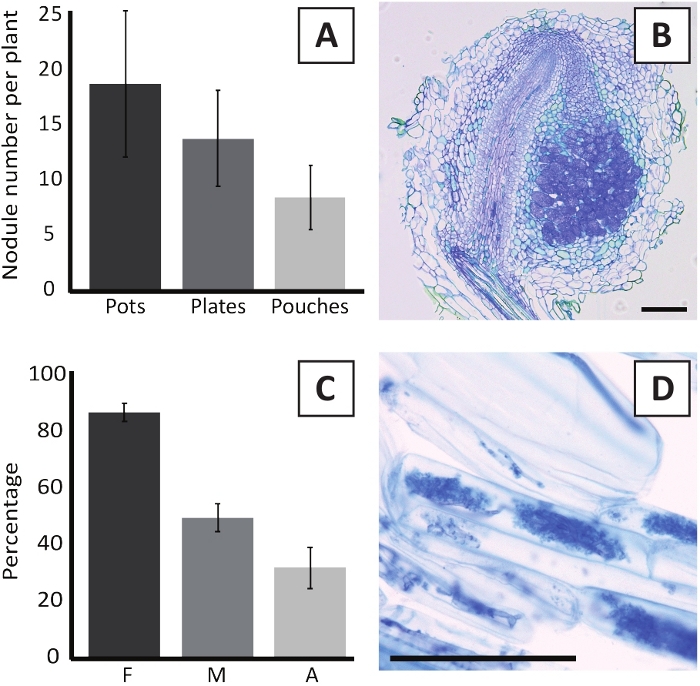
Figuur 6: representatieve resultaten van de is-en mycorrhization-assays. A) representatief staafdiagram met het aantal knobbeltjes dat per plant wordt gevormd na 4 weken na inoculatie met M. plurifarium BOR2 in potten of op platen en na 5 weken na inoculatie met Bradyrhizobium SP. Kelud2A4 in zakjes. Gegevens vertegenwoordigen gemiddelde ± SD (n = 10). B) representatief beeld van een longitudinaal gedeelte door middel van een knobbel gevormd na 4 weken na inoculatie met M. plurifarium BOR2. De sectie is gekleurd met toluïdine Blue. C) representatieve staafgrafiek met kwantificering van de mycorrhization. Variabelen gekwantificeerd volgens Trouvelot et al.29 zijn F, de frequentie van geanalyseerde wortel fragmenten die mycorrhized zijn; M, de intensiteit van de infectie; A, de overvloed aan volwassen arbuscules in het totale wortelsysteem. Mycorrhization werd na 6 weken gekwantificeerd na inoculatie met R. irregularis (stam DAOM197198). Gegevens vertegenwoordigen gemiddelde ± SD (n = 10). D) representatief beeld van volwassen arbuscules aanwezig in P. andersonii wortel corticale cellen na 6 weken na inoculatie met R. irregularis. Schaal staven gelijk aan 75 μm. Klik hier om een grotere versie van dit cijfer te bekijken.
| Samengestelde | SH-0 | SH-10 | Propagatie medium | Rooting medium | Infiltratie medium |
| SH-basaal zout medium | 3,2 g | 3,2 g | 3,2 g | 3,2 g | 3,2 g |
| SH-vitamine mengsel | 1 g | 1 g | 1 g | 1 g | 1 g |
| Sacharose | - | 10 g | 20 g | 10 g | 10 g |
| BAP (1 mg/mL) | - | - | 1 mL (4,44 μM) | - | - |
| IBA (1 mg/mL) | - | - | 100 μL (0,49 μM) | 1 mL (4,92 μM) | - |
| NAA (1 mg/mL) | - | - | - | 100 μL (0,54 μM) | - |
| 1 M MES pH = 5,8 | 3 mL | 3 mL | 3 mL | 3 mL | 3 mL |
| 1 M KOH | PH aanpassen naar 5,8 | PH aanpassen naar 5,8 | PH aanpassen naar 5,8 | PH aanpassen naar 5,8 | PH aanpassen naar 5,8 |
| DaiShin agar | 8 g | - | 8 g | 8 g | - |
Tabel 1: samenstelling van Schenk-Hildebrandt30 media gebruikt voor het kweken van P. andersonii zaailingen, stabiele transformatie en in vitro vermeerdering. Los vaste verbindingen op in 750 mL ultrazuiver water voordat u vloeibare voorraden toevoegt. Vul daarna het volledige medium in op 1 L. bereid BAP, IBA, NAA voorraden in 0,1 M KOH en winkel bij-20 oC.
| Voor Autoclaveren: | ||
| Samengestelde | Hoeveelheid per liter | Eindconcentratie |
| Mannitol | 5 g | 27,45 mM |
| Na-gluconaat | 5 g | 22,92 mM |
| Gistextract | 0,5 g | - |
| MgSO4· 7h2O | 0,2 g | 0,81 mM |
| Nacl | 0,1 g | 1,71 mM |
| K2HPO4 | 0,5 g | 2,87 mM |
| Na Autoclaveren: | ||
| Samengestelde | Hoeveelheid per liter | Eindconcentratie |
| 1,5 M CaCl2 | 1 mL | 1,5 mM |
Tabel 2: samenstelling van gist-mannitol (YEM) medium dat wordt gebruikt voor het kweken van Rhizobium. Stel de pH in op 7,0 en vul met ultra zuiver water tot 1 L. Voeg 15 g microagar toe voor het autoclaven om de agar-gestijde YEM-medium voor te bereiden.
| Voor Autoclaveren: | |||
| Samengestelde | Voorraad concentratie | Hoeveelheid per liter medium | Eindconcentratie |
| KH2po4 | 0,44 M | Voeg 2 mL | 0,88 mM |
| K2HPO4 | 1,03 M | Voeg 2 mL | 2,07 mM |
| 500x micro-Elements stockoplossing | - | Voeg 2 mL | - |
| MES pH = 6.6 | 1 M | Voeg 3 mL | 3 mM |
| Hcl | 1 M | PH aanpassen naar 6,6 | - |
| Ultra zuiver water | - | Vulling tot 990 mL | - |
| Na Autoclaveren: | |||
| Samengestelde | Voorraad concentratie | Hoeveelheid per liter medium | Eindconcentratie |
| MgSO4· 7h2O | 1,04 M | 2 mL | 2,08 mM |
| Na2dus4 | 0,35 M | 2 mL | 0,70 mM |
| NH4No3 | 0,18 M | 2 mL | 0,36 mM |
| CaCl2· 2H2O | 0,75 M | 2 mL | 1,5 mM |
| Fe (III)-citraat | 27 mM | 2 mL | 54 μM |
Tabel 3: samenstelling van 1 L gemodificeerd ekm medium31 gebruikt voor P. andersonii is assay. De samenstelling van de 500x micro-Elements stockoplossing staat vermeld in tabel 4. Voor de bereiding van 2% agar-versterkt EKM medium, Voeg 20 g DaiShin agar toe vóór Autoclaveren. Autoclaaf de MgSO4· 7h2O, na2dus4, CACL2· 2H2O, en Fe (III)-citraat voorraden om te steriliseren. Filter steriliseren NH4No3 stockoplossing om te steriliseren.
| Samengestelde | Hoeveelheid per liter | Voorraad concentratie |
| MnSO4 | 500 mg | 3,31 mM |
| ZnSO4· 7h2O | 125 mg | 0,43 mM |
| CuSO4· 5H2O | 125 mg | 0,83 mM |
| H3Bo3 | 125 mg | 2,02 mM |
| Na2MoO4· 2H2O | 50 mg | 0,21 mM |
Tabel 4: samenstelling van de 500x micro-Elements stockoplossing gebruikt voor de bereiding van gemodificeerd EKM medium. Bewaar de micro-elementen stockoplossing bij 4 °C.
| Verbindingen | Voorraad concentratie | Hoeveelheid per liter medium | Eindconcentratie |
| K2HPO4 | 20 mM | 1 mL | 0,2 mM |
| NH4No3 | 0,28 M | 10 mL | 2,8 mM |
| MgSO4 | 40 mM | 10 mL | 0,4 mM |
| K2zo4 | 40 mM | 10 mL | 0,4 mM |
| Fe (II)-EDTA | 9 mM | 10 mL | 0,9 mM |
| CaCl2 | 80 mM | 10 mL | 0,8 mM |
| 50x micro-Elements stockoplossing | - | 10 mL | - |
Tabel 5: samenstelling van 1/2-Hoagland32 medium gebruikt voor mycorrhization testen. De samenstelling van de 50x micro-Elements Stock Solution staat vermeld in tabel 6. Bereid de FE (II)-EDTA-oplossing door FeSO4· 7h2O (9 mm) en na2· te combineren EDTA (9 mM) in 1 stamoplossing en bewaren bij 4 °C. Stel de pH van het medium in op 6,1 met 1 M KOH en vul met ultra zuiver water aan 1 L.
| Verbindingen | Hoeveelheid per liter | Voorraad concentratie |
| H3Bo3 | 71,1 mg | 1,15 mM |
| MnCl2· 4h2O | 44,5 mg | 0,22 mM |
| CuSO4· 5H2O | 3,7 mg | 23,18 μM |
| ZnCl2 | 10,2 mg | 74,84 μM |
| Na2Moo4· 2H2O | 1,2 mg | 4,96 μM |
Tabel 6: samenstelling van de 50x micro-Elements stockoplossing gebruikt voor de bereiding van 1/2-Hoagland medium.
| Leeftijd van explantaten | Efficiëntie van transformatie |
| Jonge | 69,4 ± 6,2% (n = 2) |
| Oudere | 18,3 ± 10,2% (n = 15) |
Tabel 7: transformatie-efficiëntie van P. andersonii. Hier wordt transformatie-efficiëntie gedefinieerd als het percentage van explantaten dat ten minste 1 transgene Callus of shoot vormt. Transformatie-efficiëntie werd gescoord na 6 weken na transformatie en wordt afgebeeld als gemiddelde ± SD. n geeft het aantal transformatie experimenten aan waaruit de transformatie efficiëntie is bepaald.
Aanvullend bestand 1: overzicht van niveau 1-en niveau 2-constructies die worden gebruikt voor CRISPR/Cas9-mutagenese. Klik hier om dit bestand te downloaden.
Discussion
Peulvruchten en het verre-gerelateerde Cannabaceae-geslacht Parasponia representeren de enige twee clades van plantensoorten die een endosymbiotische relatie met stikstoffixatie van Rhizobia kunnen vestigen en wortel knobbeltjes vormen. Vergelijkende studies tussen soorten van beide clades zijn zeer relevant om inzicht te geven in de belangrijkste genetische netwerken die deze symbiose mogelijk maken. Momenteel worden genetische studies voornamelijk gedaan in peulvruchten; vooral de twee model soorten M. truncatula en L. japonicus. Om een aanvullend experimenteel platform te bieden en vergelijkende studies te faciliteren met een nodulating non-legume, beschrijven we hier een gedetailleerd protocol voor stabiele transformatie en omgekeerde genetische analyses in P. andersonii. Het gepresenteerde protocol gebruikt in vitro vermeerdering van T0 transgene P. andersonii lijnen, waardoor fenotypische analyse kan worden gestart binnen 4 maanden na A. tumefaciens co-teelt. Dit is aanzienlijk sneller dan de huidige protocollen die zijn vastgesteld voor stabiele transformatie van peulvruchten33. Dit maakt P. andersonii een aantrekkelijk onderzoeksmodel.
Het hier beschreven protocol bevat verschillende kritieke stappen. Het eerste betreft zaadkieming. Om P. andersonii zaden voor kieming voor te bereiden, moeten zaden worden geïsoleerd van de bessen. Dit wordt gedaan door de bessen op een stukje tissuepapier te wrijven of tegen de binnenkant van een theezeef. Deze procedure moet voorzichtig worden uitgevoerd om beschadiging van de zaadmantel te voorkomen. Als de zaadmantel beschadigd raakt, kan bleekmiddel het zaad binnengaan tijdens sterilisatie, wat de levensvatbaarheid van het zaad vermindert. Om zaad Kiemrust te breken, zaden worden onderworpen aan een 10-daagse temperatuur cyclus. Ondanks deze behandeling wordt de kiemkracht echter niet volledig gesynchroniseerd. Over het algemeen tonen de eerste zaden uitstulping opkomst na 7 dagen, maar anderen kunnen enkele dagen langer duren om te ontkiemen.
Kritische punten in de transformatie procedure betreffen de keuze van het uitgangsmateriaal en de duur van de co-teelt stap. Om een efficiënte transformatie te bereiken, is het het beste om gezonde en jonge stengels of petiolen van niet-steriele kas-gekweekte planten als uitgangsmateriaal te gebruiken. Om de groei van jonge takken te stimuleren, is het raadzaam om de Parasponia bomen elke 2-3 maanden te trimmen en de bomen een keer per jaar te verversen. Bovendien moet de co-teelt stap alleen worden uitgevoerd voor 2 dagen. Langdurige co-teelt bevordert de overkolonisatie van weefsel explantaten door A. tumefaciens en vermindert over het algemeen de efficiëntie van de transformatie. Om te voorkomen dat overkolonisatie door A. tumefaciens is het ook belangrijk om regelmatig de platen waarop de explantaten worden geteeld vernieuwen. In het geval dat overkolonisatie optreedt, kunnen weefsel explantaten worden gewassen (zie paragraaf 3,8) om een. tumefaciens cellen te verwijderen. Wij adviseren het toevoegen van bleekwater aan de SH-10 oplossing die wordt gebruikt voor het wassen (uiteindelijke concentratie: ~ 2% hypochloriet). Het is belangrijk op te merken dat deze extra wasstap mogelijk niet werkt op zwaar geïnfecteerde explantaten (Figuur 2b). In het geval dat een transformatie met een CRISPR/Cas9-constructie slechts een beperkt aantal van putge-getransformeerde scheuten oplevert of als mutagenese van een bepaald gen naar verwachting problemen in de regeneratie veroorzaakt, is het raadzaam om een lege Vector controle constructie op te nemen als de positieve controle. Tot slot is het belangrijk ervoor te zorgen dat alle geselecteerde transgene lijnen voortvloeien uit onafhankelijke T-DNA-integratie gebeurtenissen. Daarom geven we opdracht om slechts één putatief-transgene shoot van elke kant van een explant te nemen. We beseffen echter dat dit het potentiële aantal onafhankelijke lijnen vermindert. Als er veel lijnen nodig zijn, kunnen onderzoekers besluiten om putatief getransformeerde Calli van de oorspronkelijke explantaten te scheiden wanneer deze Calli ≥ 2 mm groot zijn en deze Calli onafhankelijk van elkaar. Op deze manier kunnen meerdere lijnen worden geïsoleerd van elke explant, wat het aantal potentiële transgene lijnen verhoogt.
In het huidige protocol worden transgene lijnen van P. andersonii vegetatief vermeerderd door middel van in vitro vermeerdering. Het voordeel hiervan is dat veel transgene plantlets in een relatief korte tijdsperiode kunnen worden gegenereerd. Deze methode heeft echter ook een aantal beperkingen. Ten eerste, het onderhoud van T0 transgene lijnen door in vitro propagatie is arbeidsintensief en kan resulteren in ongewenste genetische of epigenetische wijzigingen34,35. Ten tweede bevatten T0 -lijnen nog steeds een kopie van het T-DNA, inclusief de antibioticaresistentie cassette. Dit beperkt het aantal mogelijke hertransformaties, omdat er voor elke hertransformatie verschillende selectiemarkeringen nodig zijn. Momenteel hebben we alleen transformatie getest met behulp van kanamycine of hygromycine selectie (gegevens niet weergegeven). Bovendien compliceert de aanwezigheid van de Cas9-encoding sequentie en sgRNAs in de T0 transgene lijnen complementatie studies. Complementatie testen zijn mogelijk, maar vereisen dat de sgRNA doelsite (s) als zodanig worden gemuleerd dat genbewerking van de complementatie constructie wordt voorkomen. Ten derde, een nadeel van het werken met T0 lijnen is dat crispr/Cas9 mutanten misschien Chimeric. Om fenotypische analyse van chimeer Mutant Lines te voorkomen, raden we aan om de genotypering te herhalen na in vitro vermeerdering op minstens 3 verschillende scheuten. Hoewel, het aantal chimeer mutanten verkregen met behulp van het protocol hier beschreven is beperkt, ze worden soms waargenomen10. Om de beperkingen van het werken met T0 lijnen te overwinnen, konden P. andersonii mutanten lijnen generatief worden vermeerderd. P. andersonii bomen zijn tweehuizig en wind-bestuikte2. Dit betekent dat elke transgene lijn zo moet worden gemanipuleerd dat mannelijke en vrouwelijke bloemen worden geproduceerd op één individu, en vervolgens als zodanig worden gekweekt dat kruisbestuiving niet optreedt. Aangezien P. andersonii een snel groeiende boom is, is er een aanzienlijke hoeveelheid ruimte nodig in een tropische kas (28 °c, ~ 85% relatieve vochtigheid). Daarom, hoewel technisch mogelijk, generatieve voortplanting van P. andersonii transgene lijnen is logistisch uitdagend.
In het protocol sectie, we beschreven 3 methoden voor is van P. andersonii. Het voordeel van de plaat-en Pouch-systemen is dat de wortels gemakkelijk toegankelijk zijn, wat de spot-inoculatie van bacteriën mogelijk maakt en de knobbel vorming na verloop van tijd kan volgen. Het plaat systeem is echter vrij arbeidsintensief, waardoor het minder geschikt is voor grootschalige is experimenten. Een nadeel van het buidel systeem is dat het moeilijk is om schimmel besmetting te voorkomen. Zakjes zijn niet steriel en daarom wordt schimmelgroei vaak waargenomen op de bovenste helft van het opvangzakje. Echter, dit heeft geen invloed op P. andersonii groei, en daarom niet interfereren met is testen. Bovendien is het opvangsysteem alleen geschikt voor zaailingen. Ondanks verschillende pogingen hebben we geen plantlets kunnen kweken die verkregen zijn door in vitro voortplanting in zakjes.
De P. andersonii reverse genetica pijpleiding beschreven hier biedt een aanzienlijke verbetering ten opzichte van de bestaande a. rhizogenesgebaseerde root transformatie methode11. Met behulp van de beschreven procedures kunnen stabiele transgene lijnen efficiënt worden gegenereerd en kunnen worden gehandhaafd via in-vitro vermeerdering. Daarentegen, A. rhizogenes transformatie is van voorbijgaande aard en resulteert alleen in de vorming van transgene wortels. Omdat elke transgene wortel voortvloeit uit een onafhankelijke transformatie, lijden A. op transformatie gebaseerde assays van rhizogenes aan een aanzienlijke fenotypische variatie. Deze variatie is veel minder in het geval van stabiele lijnen, hoewel in vitro propagatie ook een zekere mate van variatie creëert. Vanwege deze verminderde variatie en het feit dat meerdere plantlets voor elke stabiele lijn fenogetypt kunnen worden, zijn stabiele lijnen geschikter voor kwantitatieve testen in vergelijking met A. rhizogenes-getransformeerde wortels. Bovendien is de stabiele transformatie niet afhankelijk van de introductie van de A. rhizogenes wortel inducerende Locus (rol) die van invloed is op de endogene hormoonbalans15. Daarom zijn stabiele lijnen beter geschikt voor omgekeerde genetische analyse van genen die betrokken zijn bij hormoon homeostase in vergelijking met A. rhizogenes-getransformeerde wortels. Een meer algemeen voordeel van P. andersonii als onderzoeksmodel is dat het niet een recente hele genoom duplicatie (wgd) ervaren. De subfamilie van de Vlinderbloemigen Papilionoideae, met het model peulvruchten M. truncatula en L. japonicus, evenals de Salicaceae (orde Malpighiales) met de model boom Populus balsem ervaren wgds ~ 65 miljoen jaar geleden36,37. Veel van de door deze wgds resulterende paralogous gen kopieën worden bewaard in de genomen van M. truncatula, L. japonicus en P. balsem37,38,39, die redundantie die omgekeerde genetische analyses mogelijk compliceren. Aangezien p. andersonii een recente wgd niet heeft ervaren, zou een omgekeerde genetische analyse op P. andersonii mogelijk minder worden beïnvloed door de redundante werking van de kopieën van paralogous gen.
Samen bieden we een gedetailleerd protocol voor omgekeerde genetische analyse in P. andersonii. Met dit protocol kunnen enkelvoudige mutanten lijnen efficiënt worden gegenereerd in een tijdsbestek van 2-3 maanden10. Dit protocol kan worden uitgebreid om hogere orde mutanten te creëren door multiplexing van sgrna's die zich richten op verschillende genen tegelijk, zoals getoond voor andere plantensoorten40,41,42. Bovendien is de hier beschreven stabiele transformatie procedure niet beperkt tot het gebruik van CRISPR/Cas9 gentargeting, maar kan ook worden gebruikt om andere soorten constructies te introduceren (bijv. voor promotor-reporter assays, ectopische expressie of trans- complementatie). We hebben P. andersonii opgericht als een vergelijkend onderzoeksmodel om mutualistische symbiose te bestuderen met stikstoffixatie van Rhizobia of endomycorrhizaschimmels fungi. De hier beschreven protocollen bieden echter ook hulpmiddelen om andere aspecten van de biologie van deze tropische boom te bestuderen, zoals houtvorming, de ontwikkeling van bi-seksuele bloemen of de biosynthese van Cannabaceae-specifieke secundaire metabolieten.
Acknowledgements
De auteurs erkennen Mark Youles, Sophien Kamoun en Sylvestre Marillonnet voor het maken van Golden Gate kloon onderdelen beschikbaar via de Addgene database. Daarnaast willen we E. James, P. Hadobas en T. J. Higgens bedanken voor p. andersonii zaden. Dit werk werd gesteund door de Nederlandse organisatie voor wetenschappelijk onderzoek (NWO-VICI Grant 865.13.001; NWO-open Competition Grant 819.01.007) en het ministerie van onderzoek, technologie en hoger onderwijs van de Republiek Indonesië (RISET-PRO Grant 8245-ID).
Materials
| Name | Company | Catalog Number | Comments |
| Sigma-Aldrich | N0640 | NAA | |
| Duchefa Biochemie | M1503.0250 | MES | |
| Sigma-Aldrich | D134406 | Acetosyringone | |
| Duchefa Biochemie | X1402.1000 | X-Gal | |
| Merck | 101236 | For nucleic acid electrophoresis gel | |
| - | - | Pouches box material, hangers | |
| Merck | 101188 | NH4NO3 | |
| Sigma-Aldrich | B3408-1G | BAP | |
| Merck | 100156 | H3BO3 | |
| Thermo-Fisher | ER1011 | Used as restriction enzyme in Golden Gate cloning assembly | |
| Thermo-Fisher | 15561020 | Used in Golden Gate cloning assembly | |
| Merck | 137101 | CaCl2·2H2O | |
| Duchefa Biochemie | C0111.0025 | C16H16N5O7S2Na | |
| Thermo-Fisher | K1231 | Used for cloning the blunt-ended PCR amplicons in genotyping procedure | |
| Agronutrition | AP2011 | Containing Rhizophagus irregularis DAOM 197198 (1,000 spores/mL), used for mychorrization assay | |
| Merck | 102790 | CuSO4·5H2O | |
| Duchefa Biochemie | D1004.1000 | Used for plant tissue culture agar-based medium | |
| Merck | 105101 | K2HPO4 | |
| VWR Chemicals | 20302.293 | Na2·EDTA | |
| Duchefa Biochemie | M0803.1000 | C6H14O6 | |
| Thermo-Fisher | ER0291 | Used as restriction enzyme in Golden Gate cloning assembly | |
| Merck | 100983 | C2H5OH | |
| VWR Chemicals | BDH9232-500G | EDTA | |
| Sigma-Aldrich | Z377600-1PAK | Cellophane membrane | |
| Biomatters, Ltd. | R9 or higher | Bioinformatics software for in silico cloning and designing of sgRNAs | |
| Mega International | - | Technical information at https://mega-international.com/tech-info/ | |
| Sigma-Aldrich | 65882 | Used for fixating nodule tissues | |
| VWR Chemicals | 24385.295 | - | |
| Vink | 219341 | Pouches box material, bottom part | |
| Leica Biosystems | 14702218311 | Used as a template for plastic embedding | |
| Merck | 100317 | HCl | |
| Sigma-Aldrich | I5386-1G | IBA | |
| Merck | 103862 | C6H5FeO7 | |
| Merck | 103965 | FeSO4O·7H2O | |
| Duchefa Biochemie | I1401.0005 | IPTG | |
| Duchefa Biochemie | K0126.0010 | ||
| Sigma-Aldrich | L2000 | ||
| Merck | 105886 | MgSO4O·7H2O | |
| Merck | 105934 | MnCl2·4H2O | |
| Merck | 102786 | MnSO4O | |
| Duchefa Biochemie | M1002.1000 | Used for bacterial culture agar-based medium | |
| Manutan | 92007687 | Pouches material | |
| Paraxisdienst | 130774 | Elastic sealing foil | |
| Pull Rhenen | Agra-Perlite No.3 | Used as growing substrate in pots for nodulation assay | |
| VWR Chemicals | 391-0581 | Used as container for cellophane membranes | |
| Thermo-Fisher | F130WH | For genotyping transgenic lines | |
| Addgene | 50337 | Level 0 terminator, 3'UTR, 35s (Cauliflower Mosaic Virus) | |
| Addgene | 48017 | End-link 2 for assembling 2 level one part into a level 2 acceptor | |
| Addgene | 48018 | End-link 3 for assembling 3 level one part into a level 2 acceptor | |
| Addgene | 48001 | Level 1 acceptor. Position 5. Forward orientation | |
| Addgene | 48007 | Level 1 Acceptor. Position 1. Reverse orientation | |
| Addgene | 50268 | Level 0 promoter (0.4 kb), 35s (Cauliflower Mosaic Virus) + 5'UTR, Ω (Tobacco Mosaic Virus) | |
| Addgene | 46966 | Used for designing CRISPR/Cas9 module | |
| Addgene | 46968 | Used for designing CRISPR/Cas9 module | |
| Addgene | 50334 | Level 0 Kanamycin/Neomycin/Paromomycin resistance cassette | |
| Topzeven | - | Used as filters for washing spore suspension | |
| Sigma-Aldrich | 8.17003 | PEG400 | |
| Duchefa Biochemie | E1674.0001 | Pots to grow Parasponia plantlets/seedlings | |
| Merck | 104871 | KH2PO4 | |
| Merck | 105033 | KOH | |
| Merck | 105153 | K2SO4O | |
| Van Leusden b.v. | - | Used as growing substrate for mychorrhization assay | |
| Duchefa Biochemie | S0225.0050 | SH-basal salt medium | |
| Duchefa Biochemie | S0411.0250 | SH-vitamin mixture | |
| Lehle Seeds | VIS-02 | Used as non-ionic surfactant in the washing step of stable transformation | |
| Merck | 137017 | NaCl | |
| VWR Chemicals | 89230-072 | C6H11NaO7 | |
| Merck | 106521 | Na2MoO4·2H2O | |
| Merck | 106574 | Na2HPO4·7H2O | |
| Merck | 567549 | NaH2PO4·H2O | |
| Sigma-Aldrich | 239313 | Na2SO4O | |
| Duchefa Biochemie | S0809.5000 | C12H22O11 | |
| Thermo-Fisher | B69 | Used in Golden Gate cloning assembly | |
| Thermo-Fisher | EL0013 | Used in Golden Gate cloning assembly | |
| Kulzer-Mitsui Chemicals Group | 64708806 | Methyl methacrylate-based resin powder | |
| Kulzer-Mitsui Chemicals Group | 64709003 | HEMA (2-hydroxyethyl methacrylate)-based resin solution | |
| Kulzer-Mitsui Chemicals Group | 66022678 | Methyl methacrylate-based resin solution | |
| Merck | 1159300025 | ||
| Acros | 189350250 | ||
| VWR Chemicals | 663684B | Polysorbate 20 | |
| Stout Perspex | - | pouches box material, lid | |
| Duchefa Biochemie | Y1333.1000 | ||
| Merck | 108816 | ZnCl2 | |
| Alfa Aesar | 33399 | ZnSO4O·7H2O |
References
- Clason, E. W. THE VEGETATION OF THE UPPER-BADAK REGION OF MOUNT KELUT (EAST JAVA). Bulletin du Jardin Botanique de Buitenzorg. Serie III, 509-518 (1936).
- Soepadmo, E. Ulmaceae. Flora Malesiana-Series 1, Spermatophyta. 8, 31-76 (1974).
- Becking, J. H. The Rhizobium symbiosis of the nonlegume Parasponia. Biological Nitrogen Fixation. , 497-559 (1992).
- Oldroyd, G. E. D. Speak, friend, and enter: signalling systems that promote beneficial symbiotic associations in plants. Nature Reviews Microbiology. 11, 252-263 (2013).
- Gutjahr, C., Parniske, M. Cell and developmental biology of arbuscular mycorrhiza symbiosis. Annual Review of Cell and Developmental Biology. 29, 593-617 (2013).
- van Velzen, R., et al. Comparative genomics of the nonlegume Parasponia reveals insights into evolution of nitrogen-fixing rhizobium symbioses. Proceedings of the National Academy of Sciences of the United States of America. 115, E4700-E4709 (2018).
- van Velzen, R., Doyle, J. J., Geurts, R. A Resurrected Scenario: Single Gain and Massive Loss of Nitrogen-Fixing Nodulation. Trends in Plant Science. 24, 49-57 (2019).
- Griesmann, M., et al. Phylogenomics reveals multiple losses of the nitrogen-fixing root nodule symbiosis. Science. 1743, eaat1743 (2018).
- Becking, J. H. Root-Nodule Symbiosis Between Rhizobium And Parasponia (Ulmaceae). Plant and Soil. 51, 289-296 (1979).
- van Zeijl, A., et al. CRISPR/Cas9-Mediated Mutagenesis of Four Putative Symbiosis Genes of the Tropical Tree Parasponia andersonii Reveals Novel Phenotypes. Frontiers in Plant Science. 9, 284 (2018).
- Cao, Q., et al. Efficiency of Agrobacterium rhizogenes–mediated root transformation of Parasponia and Trema is temperature dependent. Plant Growth Regulation. 68, 459-465 (2012).
- Limpens, E., et al. RNA interference in Agrobacterium rhizogenes-transformed roots of Arabidopsis and Medicago truncatula. Journal of Experimental Botany. 55, 983-992 (2004).
- Boisson-Dernier, A., et al. Agrobacterium rhizogenes-Transformed Roots of Medicago truncatula for the Study of Nitrogen-Fixing and Endomycorrhizal Symbiotic Associations. Molecular Plant-Microbe Interactions. 14, 695-700 (2001).
- Kumagai, H., Kouchi, H. Gene Silencing by Expression of Hairpin RNA in Lotus japonicus Roots and Root Nodules. Molecular Plant-Microbe Interactions. 16, 663-668 (2003).
- Nilsson, O., Olsson, O. Getting to the root: The role of the Agrobacterium rhizogenes rol genes in the formation of hairy roots. Physiologia Plantarum. 100, 463-473 (1997).
- Davey, M. R., et al. Effective Nodulation of Micro-Propagated Shoots of the Non-Legume Parasponia andersonii by Bradyrhizobium. Journal of Experimental Botany. 44, 863-867 (1993).
- Webster, G., Poulton, P. R., Cocking, E. C., Davey, M. R. The nodulation of micro-propagated plants of Parasponia andersonii by tropical legume rhizobia. Journal of Experimental Botany. 46, 1131-1137 (1995).
- Op den Camp, R., et al. LysM-type mycorrhizal receptor recruited for rhizobium symbiosis in nonlegume Parasponia. Science. 331, 909-912 (2011).
- Weber, E., Engler, C., Gruetzner, R., Werner, S., Marillonnet, S. A Modular Cloning System for Standardized Assembly of Multigene Constructs. PLOS ONE. 6, e16765 (2011).
- Nekrasov, V., Staskawicz, B. J., Weigel, D., Jones, J. D. G., Kamoun, S. Targeted mutagenesis in the model plant Nicotiana benthamiana using Cas9 RNA-guided endonuclease. Nature Biotechnology. 31, 691-693 (2013).
- Bertani, G. Studies On Lysogenesis. I. The Mode Of Phage Liberation By Lysogenic Escherichia Coli. Journal of Bacteriology. 62, 293-300 (1951).
- Engler, C., et al. A Golden Gate modular cloning toolbox for plants. ACS Synthetic Biology. 3, 839-843 (2014).
- Fauser, F., Schiml, S., Puchta, H. Both CRISPR/Cas-based nucleases and nickases can be used efficiently for genome engineering in Arabidopsis thaliana. The Plant Journal. 79, 348-359 (2014).
- Lazo, G. R., Stein, P. A., Ludwig, R. A. A DNA Transformation-Competent Arabidopsis Genomic Library in Agrobacterium. Biotechnology. 9, 963-967 (1991).
- Op den Camp, R. H. M., et al. N Nonlegume Parasponia andersonii Deploys A Broad Rhizobium Host Range Strategy Resulting in Largely Variable Symbiotic Effectivenes. Molecular Plant-Microbe Interactions. 25, 954-963 (2012).
- Graham, P. H., Viteri, S. E., Mackie, F., Vargas, A. T., Palacios, A. Variation in acid soil tolerance among strains of Rhizobium phaseoli. Field Crops Research. 5, 121-128 (1982).
- Martinez-Romero, E., et al. Rhizobium tropici, A Novel Species Nodulating Phaseolus vulgaris L. Beans and Leucaena sp. Trees. International Journal of Systematic and Evolutionary Microbiology. 41, 417-421 (1991).
- Felten, J., et al. The Ectomycorrhizal Fungus Laccaria bicolor Stimulates Lateral Root Formation in Poplar and Arabidopsis through Auxin Transport and Signaling. Plant Physiology. 151, 1991-2005 (1991).
- Trouvelot, A., Kough, J. L., Gianinazzi-Pearson, V. Mesure du taux de mycorhization VA d’un systeme radiculaire. Recherche de methods d’estimation ayant une signification fonctionnelle. Aspects Physiologiques et Genetiques des Mycorhizes. , 217-221 (1986).
- Schenk, R. U., Hildebrandt, A. C. Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Canadian Journal of Botany. 50, 199-204 (1972).
- Becking, J. H. The Parasponia parviflora - Rhizobium symbiosis. Host specificity, growth and nitrogen fixation under various conditions. Plant and Soil. 75, 309-342 (1983).
- Hoagland, D. R., Arnon Revised, D. I., Arnon, D. I. The Water-Culture Method for Growing Plants without Soil. Circular California Agricultural Experiment Station. 347, 1-32 (1950).
- Wang, K. . Methods in Molecular Biology: Agrobacterium Protocols. 1, (2015).
- Smulders, M. J. M., de Klerk, G. J. Epigenetics in plant tissue culture. Plant Growth Regulation. 63, 137-146 (2011).
- Larkin, P. J., Scowcroft, W. R. Somaclonal variation — a novel source of variability from cell cultures for plant improvement. Theoretical and Applied Genetics. 60, 197-214 (1981).
- Cannon, S. B., et al. Legume genome evolution viewed through the Medicago truncatula and Lotus japonicus genomes. Proceedings of the National Academy of Sciences of the United States of America. 103, 14959-14964 (2006).
- Tuskan, G. A., et al. The Genome of Black Cottonwood, Populus trichocarpa (Torr. & Gray). Science. 313, 1596-1604 (2006).
- Young, N. D., et al. The Medicago genome provides insight into the evolution of rhizobial symbioses. Nature. 480, 520 (2011).
- Sato, S., et al. Genome Structure of the Legume, Lotus japonicus. DNA Research. 15, 227-239 (2008).
- Xing, H. L., et al. A CRISPR/Cas9 toolkit for multiplex genome editing in plants. BMC Plant Biology. 14, 327 (2014).
- Lowder, L. G., et al. A CRISPR/Cas9 Toolbox for Multiplexed Plant Genome Editing and Transcriptional Regulation. Plant Physiology. 169, 971 (2015).
- van Zeijl, A. . Dissecting Hormonal Pathways in Nitrogen-Fixing Rhizobium Symbioses. , (2017).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved