שינוי צורה, הגנום עריכת ופנוהקלדת החנקן-תיקון טרופי קנאביציים עץ Parasponia אנדרסונii
In This Article
Summary
Parasponia andersonii הוא עץ טרופי בצמיחה מהירה השייכת משפחת קנאביס (הקנאביים) והוא יכול ליצור חנקן לתקן גושים שורש בשיתוף עם ריזוזוביום. כאן, אנו מתארים פרוטוקול מפורט עבור ניתוחים גנטיים הפוכה P. אנדרסונב מבוסס על Agrobacterium tumefaciens-מתווכת יציבה שינוי מבוסס Crispr/Cas9 מבוססי הגנום עריכה.
Abstract
Parasponia andersonii הוא עץ טרופי בצמיחה מהירה השייכת משפחת קנאביס (קנאביים). יחד עם 4 מינים נוספים, הוא יוצר את השושלת הידועה היחידה שאינה מסוגלת ליצור בעזרת סימביוזה לתיקון חנקן עם ריזוביום. מחקרים השוואתיים בין קטניות לבין P. andersonii יכול לספק תובנה רבת ערך לתוך הרשתות הגנטיות הבסיס שורש היווצרות השורש. כדי להקל על מחקרים השוואתיים, אנחנו לאחרונה רצף הגנום P. אנדרסן והוקמה Agrobacterium tumefaciens-מתווכת יציבה שינוי הגנום Crispr/Cas9-מבוססי עריכת. כאן, אנו מספקים תיאור מפורט של שינוי והליכי עריכת הגנום שפותחו עבור P. אנדרסונii. בנוסף, אנו מתארים הליכים עבור נביטה הזרעים ואפיון של פנוטיפים סימביוטיים. באמצעות פרוטוקול זה, ניתן ליצור קווי מוטציה יציבים הניתנים להעברה בתקופה של 2-3 חודשים. וגטטיבי בהפצה מחוץ למבחנה של הקווים הטרנסגניים T0 מאפשר לערוך ניסויים פנוטיפים ליזום ב 4 חודשים לאחר הטיפוח -תרגול. לפיכך, פרוטוקול זה לוקח רק שולית יותר מאשר שיטת השינוי הבסיסי המבוסס Agrobacteriumהמבוססת על הבסיס עבור P. andersonii, למרות שהוא מציע כמה יתרונות ברורים. יחד, ההליכים המתוארים כאן לאפשר P. אנדרסן לשמש כמודל מחקר למחקרים שנועדו להבנת אסוציאציות סימביוטיות, כמו גם היבטים אחרים של הביולוגיה של העץ הטרופי הזה.
Introduction
Parasponia אנדרסונני הוא עץ טרופי השייכת משפחת קנאביס (קנאביים) והוא יליד פפואה גינאה החדשה ומספר איים באוקיינוס השקט1,2,3. יחד עם 4 מינים נוספים של Parasponia , היא מייצגת את השושלת היחידה שאינה התרמיל, שיכולה ליצור סימביוזה לתיקון חנקן עם ריזוביה. סימביוזה זו מלמדת היטב בתרמיל (פקליים) מודלים של מחלת התרופה, שהביאה לרכישת ידע מפורט של האופי הגנטי המולקולרי של היווצרות הגולה ותפקוד4. בנוסף, הוכח שסימביוזה הגולה בקטניות הינה מבוססת על הרבה יותר מבוגרת, והיא הנפוצה ביותר בשנת5. השוואות פילוגנומית מרמזות על כך שsymbioses החנקן מתקן את הקטניות, Parasponia, כמו גם, את המינים המכונים אקאורהיזל צמחים המארחים diazotrophic בקטריה frankia , יש מוצא אבולוציוני משותף . שש,שבע, שמונה כדי לקבוע אם הגנים המזוהים להיות מעורבים במערך הנודולי, הם חלק מהבסיס הגנטי הניתן לשימור, המחקרים על מינים שאינם בעלי התרמיל חיוניים. לשם כך, אנו מציעים להשתמש ב -P. אנדרסן כמודל מחקר השוואתי, לצד קטניות, כדי לזהות את הבסיס לרשתות גנטיות בסיס היווצרות השורש ותפקוד.
פ. אנדרסונב הוא חלוץ שניתן למצוא על מדרונות הגבעות הגעשיות. זה יכול לעמוד במהירויות צמיחה של 45 ס מ לחודש ולהגיע לאורכים של עד 10 מטר9. העצים של פ. אנדרזונii מואבקים ברוח, שהיא הקלה על ידי היווצרות פרחי זכר ונקבה נפרדים3,10. אנחנו לאחרונה רצף ומסומן הגנום דיפלואידי (2n = 20; 560 Mb/1c) של P. אנדרסונב, והתאספו רצפים הגנום הטיוטה של 2 מיני parasponia נוספים; פ. נוקשה ופ . רוגוסה6. זה חשף ~ 35,000 P. andersonii גנים מודלים כי ניתן לקבץ ב > 20000 מקובצים יחד עם הגנים מ -M. truncatula, סויה (גליצין מקסימום), arabidopsis thaliana, היער תות ( תותשדה ומסקה, צפצפה מכותנה שחורה ( פופולארה trichocarpa) ו eucalypt (אקליפטוס גרליס)6. בנוסף, השוואות השוואה בין התנועה מ-truncatula ו P. אנדרסונב זיהה סט של 290 הבנה orthologues המציגות דפוס ביטוי גולה משופרת בשני המינים6. הדבר מספק משאב מצוין למחקרים השוואתיים.
כדי ללמוד את פונקציית הגן ב P. אנדרסונii שורשים גושים, פרוטוקול של Agrobacterium ריזוגנים-שינוי בסיס תיווך הוקמה11. באמצעות פרוטוקול זה, צמחים מורכבים הנושאים שורשים טרנסגניים ניתן ליצור במסגרת זמן קצר יחסית. שיטה זו מיושמת בנוסף במחקר הסימביוזה של הקטניות12,13,14. עם זאת, החיסרון של שיטה זו הוא שרק שורשים משתנים וכי כל שורש טרנסגניים מייצג אירוע שינוי בלתי תלוי, והתוצאה היא וריאציה משמעותית. כמו כן, לא ניתן לתחזק את הטרנספורמציה של קווים ארעיים ושורות טרנסגניים. זה הופך את השינוי הבסיסי מבוססי. ריזוזוגניםמתאים פחות לעריכת הגנום CRISPR/Cas9-תיווך. בנוסף, א. ריזוגנס מעביר את הגנים השורשים שלה לוקוס ( rol) לגנום הצמח, אשר הביע פעם להפריע הומאוסטזיס הורמון15. זה הופך את התפקיד של הורמוני הצמח ב . ריזוזוגנים-שורשים שהפכו מאתגרת. כדי להתגבר על מגבלות אלה, פיתחנו לאחרונה פרוטוקול עבור Agrobacterium tumefaciensמבוססי שינוי מבוסס CRISPR/Cas9-תיווך מוטגנזה של P. אנדרסונב10.
כאן, אנו מספקים תיאור מפורט של הליך a. tumefaciens מבוססי שינויההליך הגנטיקה הפוכה שפותחה עבור P. אנדרסונii. בנוסף, אנו מספקים פרוטוקולים לטיפול במורד הזרם של שתילי הטרנסגניים, כולל בחני ללמוד אינטראקציות שיתופי. באמצעות הפרוטוקול המתואר כאן, ניתן ליצור קווים מרובים טרנסגניים בתקופה של 2-3 חודשים. בשילוב עם CRISPR/Cas9-תיווך מוטגנזה, זה מאפשר דור יעיל של מוטציה קווי הסתרה. קווי מוטציה אלה יכולים להיות מופץ באמצעות מבחנה10,16,17, אשר מאפשר לייצר חומר מספיק כדי להתחיל לאפיון פנוטיפקס ב 4 חודשים לאחר הליך השינוי יש יזמו10. ביחד, קבוצה זו של הליכים צריך לאפשר לכל מעבדה לאמץ את פ. אנדרסונב כמודל מחקר למחקרים שמטרתם הבנה של הליכי המחקר והאגודות המיקוריטיות, כמו גם היבטים אחרים של הביולוגיה של העץ הטרופי הזה.
Protocol
1. לגדול P. אנדרסונii עצים בחממה
-
לנבוט P. אנדרסונii WU1 זרעים18.
- השתמש בגרגרים Parasponia טריים או לטבול גרגרים יבשים במים עבור 2 h כדי להשקות מחדש. גרגרי סקווש על פיסת נייר טישו או לשפשף בתוך מסננת תה כדי להסיר את הזרעים.
- חיטוי זרעים באמצעות אקונומיקה מסחרי (~ 4% hypochlorite) עבור 15-20 דקות ולאחר מכן לשטוף את הזרעים 6 פעמים באמצעות מים מעוקר.
- להעביר את הזרעים כדי סטרילי 200 μL מנורות PCR. ממלאים את הצינורות עם מים מעוקרים, כך הזרעים הם שקועים לחלוטין. מודיית את הצינורות במשך 10 ימים בתוך התרמוטרטרר פועל התוכנית הבאה: 30 מחזורים (7 ° צ' עבור 4 h, 28 ° צ' עבור 4 h). אין להשתמש במכסה מחומם, כי זה עלול להרוג את הזרעים.
- הכינו את הצלחות SH-0 (ראו טבלה 1). להעביר את הזרעים כדי SH-0 לוחות ו-מודטה ב 28 ° c, 16 h:8h יום: לילה. סגור צלחות עם 2 שכבות של איטום בנייר אלסטי כדי למנוע ייבוש במהלך הדגירה ב 28 ° c.
- לאחר שתילים פיתחו את הקבוצה הראשונה של העלים האמיתיים (~ 3-4 שבועות לאחר הדגירה ב -28 ° c), העברת שתילים לסירים ממולאים אדמה השתילה מסחרי לכסות את השתילים עם גביע פלסטיק שקוף כדי למנוע התייבשות. המקום סירים ב 28 ° c בחדר האקלים או החממה, ~ 85% לחות יחסית, תחת 16 h:8 h יום: משטר הלילה.
- לאחר 1 שבוע, להסיר את הגביע פלסטיק שקוף. מים סירים באופן קבוע כאשר העצים לגדול תוספת גדולה עם דשן לקיים צמיחה.
2. שיבוט של בנייה עבור CRISPR/Cas9-תיווך מוטגנזה של פ. אנדרזונii
הערה: וקטורים סטנדרטיים של טרנספורמציה בינארית ניתן להשתמש עבור הטרנספורמציה יציבה של P. andersonii. כאן, לדוגמה, הוא תהליך ליצירת בנייה עבור CRISPR/Cas9-תיווך מוטגנזה באמצעות שיבוט מודולרי (למשל, שער הזהב)19.
- זיהוי רצפי היעד של RNA עבור הגן (s) של העניין, באמצעות התוכנה ביואינפורמטיקה הכוללת כלי עיצוב מובנה CRISPR. בחירת רצפי RNA מדריך הממוקם ב 5 '-סוף של רצף קידוד של הגן היעד כדי להגדיל את הסיכוי להשיג הסתרה מלאה. הקפד לבדוק את ההשפעות מחוץ ליעד על ידי חיפוש נגד הגנום P. אנדרסונii 6.
הערה: השתמש 2 sgRNAs לכל גן יעד, רצוי 200-300 bp נפרד. הדבר עשוי ליצור מחיקות שניתן לזהותה על-ידי ה-PCR ולאחר מכן על-ידי האלקטרופורזה בג ג'ל. - צור ברמה 1 בונה שער הזהב המכיל את רצפי sgRNA.
- עיצוב התחל כדי להגביר כל sgRNA הפרט על ידי החדרת רצף מדריך bp 20 במיקום של N(20) ברצף התחל הבא: 5 '-tgtggtctcaattgn(20) מגטבאגאגאכאג -3.
הערה: אם רצף ההנחות שווה ל-GN(19), הסר את ה-G בקצה הרציף של 5 ברצף ההדרכה לפני שתוסיף את הרצף התחל. - ה-PCR להגביר את הpICH86966:: AtU6p:: sgRNA_PDS20 באמצעות התחל הקדמי המתוכנן בשלב 2.2.1 ואת ההילוך ההפוך אוניברסלי: 5 '-TGTGGTCTCAAGCGTAATGCCAACTTTGTAC -3 '. השתמש באיכות גבוהה ביותר בחום-DNA פולימראז ו התנאים הבאים PCR: 98 ° צ' לשלושים; 30 מחזורים (98 מעלות צלזיוס עבור 10 ס מ; 53 ° צ' עבור 20 s; 72 ° צ' עבור 10 s); 72 ° c עבור 7 דקות. תגובות PCR מוצלחות להניב 165 bp amplicon.
- העמודה-לטהר את ה-pcr אמפליקון באמצעות ערכת טיהור מסחרי pcr. לאחר מכן, להגדיר את התגובות שער הזהב לשבט sgRNAs מאחורי Arabidopsis thaliana AtU6p מיזם RNA קטן: 10 Ng של Sgrnas PCR amplicon, 150 Ng של pICSL01009:: AtU6p20, 60 ng ברמה המתאימה 1 וקטור, 2 μl של T4 מאגר ליגאז, 2 μl 0.1% של סרום של שור (bsa), 0.5 μl של bsa, 0.5 μl של T4 ליגאז, למלא עד 20 μl עם מים אולטרה טהורים. ודא שכל sgRNAs ישוכפל באותו כיוון כדי למנוע היווצרות של סיכת ראש.
- התגובות הדגירה של הטרציקלונט פועל התוכנית הבאה: 37 ° צ' עבור 20 s; 26 מחזורים (37 ° צ') במשך 3 דקות; 16 ° צ' למשך 4 דקות; 50 ° צ' במשך 5 דקות; 80 ° צ' למשך 5 דקות. שינוי התגובות שער הזהב כדי es, coli הלוח על LB בינונית21 המכיל אמפיצילין (50 mg/l), X-גל (200 mg/l) ו-Iptg (1 מ"מ).
הערה: הכינו את פתרונות המניה של IPTG ו-X-גל במים טהורים במיוחד ודימתיפימיד, בהתאמה. המסנן מעקר את פתרונות המניה אמפיצילין ו-IPTG ומאחסן את כל המניות ב-20 ° c. לבש כפפות כשאתה מטפל בדימתיל. - בחר מושבות לבנות ובידוד פלמידים באמצעות ערכת הבידוד המסחרי פלמיד. הרצף מאמת פלמידים מבודדים לפני שתמשיך בהרכבה ברמה 2 של שער הזהב.
- עיצוב התחל כדי להגביר כל sgRNA הפרט על ידי החדרת רצף מדריך bp 20 במיקום של N(20) ברצף התחל הבא: 5 '-tgtggtctcaattgn(20) מגטבאגאגאכאג -3.
- להרכיב ברמה 2 מבנים שער הזהב לשינוי יציבה.
- לבצע תגובת שער הזהב באמצעות רמה 1 AtU6p:: sgRNA בנייה (שנוצר לפי סעיף 2.2) כמו גם pICH47802::Nptii, pICH47742:: 35sPro:: ΩNLS-ACas9:: 35 ster, ברמה 2 לקבלה pICSL4723 ואת המתאים מקשר קצה (ראה אנסלר ואח '22). לבצע תגובות כדלקמן: השימוש ~ 100 fmol של כל וקטור התורם ~ 20 למול של וקטור לקבלה להוסיף 2 μl של מאגר לליגאז T4, 2 μl של 0.1% bsa, 0.5 μl של bsa, 0.5 μl של T4 ליגאז, למלא עד 20 μl עם מים אולטרה טהורים.
הערה: רמה 1 פלמידים pICH47802::nptii, pICH47742:: 35spro:: ΩNLS-aCas9::ter 35s צריך להיות משוכפל הראשון (ראה קובץ משלים 1), כפי שמתואר עבור sgrnas תחת סעיף 2.220,22 ,23. - התגובות הדגירה כמו תחת שלב 2.2.4 ולהפוך ל -E. coli. צלחת על ליברות בינונית המכילה קאנאמיצין. למחרת, בחר מושבות. לבנות ובידוד פלמידים קבע את הרכבת הפלסטיות הנכונה באמצעות ניתוח הגבלת העיכול.
- לבצע תגובת שער הזהב באמצעות רמה 1 AtU6p:: sgRNA בנייה (שנוצר לפי סעיף 2.2) כמו גם pICH47802::Nptii, pICH47742:: 35sPro:: ΩNLS-ACas9:: 35 ster, ברמה 2 לקבלה pICSL4723 ואת המתאים מקשר קצה (ראה אנסלר ואח '22). לבצע תגובות כדלקמן: השימוש ~ 100 fmol של כל וקטור התורם ~ 20 למול של וקטור לקבלה להוסיף 2 μl של מאגר לליגאז T4, 2 μl של 0.1% bsa, 0.5 μl של bsa, 0.5 μl של T4 ליגאז, למלא עד 20 μl עם מים אולטרה טהורים.
- לשנות את רמת 2 בונה כדי Agrobacterium tumefaciens זן AGL124.
3. שינוי יציב של פ. אנדרזונii
- אינוחישוב 2 לוחות LB המכילים את האנטיביוטיקה המתאימה עם מאמץ tumefaciens AGL1 השתנה עם בניית העניין. לוחיות הדגירה ב -28 ° c במשך יומיים.
- מסיק ענפים צעירים מעצים שגדלו בחממה. השתמש כ-5 סניפים של 5-8 ס מ באורך עבור כל שינוי. ודא שהשימוש בענפים לא נגועים בריאים בלבד. הסר את העלים על ידי חיתוך אותם כגון זה ~ 1 ס מ2 של רקמת עלה נשאר בסוף כל פטוטרת. להיפטר העלים.
- חיטוי רקמות עבור 15 דקות באמצעות 1:1-מלבין מסחרי מדולל (~ 2% רדמה לאחר דילול) המכיל כמה טיפות של polysorbate 20. לאחר מכן, שטפו את הרקמה 6 פעמים במים אוטוקלבים.
הערה: שלב זה, כמו גם, את הצעדים הבאים צריך להתבצע בתוך ארון למטה למטה למטה לשמור על רקמות סטרילי. - השהה מחדש את התאים A. tumefaciens מ 1-2 לוחות ב 25 מ ל של הסתננות בינונית (לראות את שולחן 1) המכיל acetosyringone (20 מ"ג/L) ו מבקר לא יוני (0.001% v/v) כדי להגיע לצפיפות אופטית (OD600) של ~ 5.
הערה: הכינו את פתרון המניה הacetosyringone ב-70% אתנול ואחסן ב-20 ° c. החומרים שאינם יוניים צריך להיות מסנן מעוקר לפני הוספת מדיום חדירה. - חותכים הן את רקמת הגבעול והפטוטרת בחתיכות של ~ 1 ס מ אורך בתוך ההשעיה של א. tumefaciens , ובכך ליצור פצעים טריים בשני הצדדים. השאירו חתיכות רקמה בהשעיה של א. tumefaciens עבור 10-30 דקות.
- להכין את השתרשות בינוני (לראות את הטבלה 1) ולהוסיף acetosyringone (20 מ"ג/L) לאחר autoclaving ינג. חתיכות רקמה יבשה על חתיכת סטרילית של נייר סינון ומניחים אותו על המדיום (~ 10 explants/צלחת). לוחיות הזיהוי המחגרות באפילה ב -21 ° c במשך יומיים.
הערה: אפשר למדיום להתקרר עד ~ 60 ° צ' לפני הוספת acetosyringone. - לאחר יומיים, לבדוק צלחות פטרייתי או זיהום חיידקי ברור (חיידקים אחרים מ -tumefaciens). . צריך להיפטר מצלחות מזוהמות
- הכינו בינוני נוזלי של SH-10 (ראו טבלה 1). לאחר autoclaving ינג, להוסיף polysorbate 20 (0.01%, v/v). העברת חתיכות הרקמה ל 10 מ ל של SH-10 המכילים פוליסורbate 20. במהלך תקופה של לפחות 10 דקות, בעדינות מתפרעים כל 2-3 דקות כדי לשטוף את הרקמה.
- שטפו שתי פעמים נוספות עם שירות טרי-10 המכיל פוליסורbate 20. בזמנים אלה, זמן דגירה של 2-3 דקות לכל צעד שוטף הוא מספיק.
- להכין את השתרשות המדיום (לראות את שולחן 1). לאחר אוטוקלינג, להוסיף cefoסעה לי (300 mg/L) ו kanamycin (50 mg/L) ולמזוג צלחות. עבור טרנספורמציות משניות (העתקות של קווים עמידים בפני הטרנסגניים), להחיל hygromycin (15 מ"ג/L) בחירה.
- חתיכות רקמה יבשות על פיסות נייר מסנן. לאחר מכן, להעביר פיסות הרקמה ללוחות שהוכנו בשלב 3.9.
- לוחות דגירה 7 ימים ב 28 ° c, 16 h:8h יום: לילה. כל 2 ימים בדיקת לוחות פטרייתי או זיהום חיידקי וצמיחה מוגזמת של א. tumefaciens. במקרה של זיהום, להעביר חלקים לא נגועים לצלחת טרייה.
- לאחר 7 ימים, העברת חתיכות הרקמה הפצה בינונית (לראות את שולחן 1) המכיל cefoסעה (300 Mg/l) ו kanamycin (50 Mg/l). לוחות דגירה ב 28 ° c, 16 h:8h יום: לילה. לרענן את הצלחות פעם בשבוע עד שיורה הטרנסגניים מתפתח. ודא רק להעביר חתיכות רקמה שאינן נגוע לצלחות טריות. להשליך את חתיכות כי הם מגודלים על ידי . tumefaciens.
- לאחר שירה ≥-transgenic הם באורך 1 ס מ, לגזור יורה ותרבות אותם באופן עצמאי במדיום התפשטות המכיל cefoסעה me (300 mg/L) ו kanamycin (50 mg/L). כדי להבטיח כי יורה מייצג transformants עצמאית, לקחת רק לירות אחד מכל צד של החוקר.
- מפיץ וגיאני-התמרה-טרנסגניים כמתואר בשלב 5.2.
4. הדפס הגנוזה של הפוסדר
- עיצוב התחל לעצב את אתרי הזיהוי של sgRNA. כדי לאפשר ברצף של ה-PCR אמפליקון, בחר באפשרות התחל 150-250 bp הרחק מאתר הזיהוי של sgrna.
- גזור עצה עלה (~ 5 מ"מ) מכל לירות טרנסגניים להיות גנוזה. כמו כן, לקצור דגימת בקרה פראית.
- לבצע 50 μL ה-PCR תגובות באמצעות התחל שתוכנן בשלב 4.1 וערכה מסחרית כדי להגביר ישירות את הדנ א מדגימות הצמח. לחילופין, ניתן לבצע תגובות ה-PCR על דנ א מטוהר באמצעות פולימאז באיכות גבוהה.
- הפרד את המאגרציות ה-PCR על ג'ל הגברה של 1.5% 2
- לנתח את התוצאות של האלקטרופורזה ג'ל. בדוק אם יש דוגמאות להפקת להקות מרובות (יותר מ-1 allele) ו-PCR הגברה עם גדלים שונים מסוג פראי, המציין את נוכחותם של אינדלים בינוניים.
- . כדי לזהות את המוטציות המדויקות עבור דגימות של הפקת מוצרי PCR בודדים, ניתן לרצף מוצרים של PCR ישירות. דגימות המייצרים יותר מ 1 להקה לאחר האלקטרופורזה ג'ל או שנראה לheterozygous לאחר רצף ישיר של ה-PCR amplicon, צריך להיות משוכפל לתוך וקטור שיבוט בוטה הראשון. לאחר מכן, רצף שיבוטים מרובים עבור כל מדגם כדי לזהות את כל אללים האפשרי נוכח במדגם.
- יישר את תוצאות הרצף לגנים של עניין ובדוק את היישור כדי לבדוק מוטציות בקרבת אתר היעד sgRNA. לאחר מכן, בדוק אם מוטציות אלה יוצרות frameshifts. השמט קווים עם > 2 אללים, ושורות המכילות מוטציות במסגרת.
- בחר מספר שורות לניתוח נוסף.
- הפץ את השורות שנבחרו כמתואר בשלב 5.2.
- כאשר הקווים פיתחו מספר נצרי חדש, לקחת דגימות חדשות מ ≥ 3 עלה טיפים ולחזור על שלבים 4.3-4.7. קבע אם המוטציות הקיימות בכל אחת מהדגימות שמקורן באותה שורה, כמו גם דגימת ה-PCR המקורית זהה. קווים התשואות את אותם מוטציות בכל הדגימות הם מוטציה הומוגנבאופן שניתן להשתמש בהם לניסויים נוספים. התעלם משורות שאינן מפיקות את אותן תוצאות כמו הקווים האלה הם צ'יאריק.
5. הכנת שורשים מושבי פ. אנדרסונ2 לניסויים
-
התחל קו חדש של תרבות הרקמה של פ. אנדרזונii.
- הקציר ניצנים בתוך השחי, שירה אדונקית צעירה או רקמת עלים מעצים בריאים. לחילופין, ניתן להשתמש בשתילים כחומר התחלתי.
- חיטוי רקמות באמצעות 1:1-מלבין מסחרי מדולל (~ 2% רדמה לאחר דילול) המכיל כמה טיפות של polysorbate 20 עבור 15 דקות. לאחר מכן, לשטוף את הרקמה 6 פעמים באמצעות מים אוטוקלבים.
הערה: צעד זה, כמו גם, את הצעדים הבאים צריך להתבצע בתוך המטה למטה למטה או למינארי החוצה הארון לשמור על רקמות סטרילי. - העבר רקמות כדי להפיץ בינונית (ראה טבלה 1). לסגור צלחות עם 2 שכבות של לוחיות איטום גמישה נייר ולוחות דגירה ב 28 ° c, 16 h:8h יום: לילה.
- בדיקת צלחות מדי כמה ימים במהלך 2 השבועות הראשונים כדי להבטיח כי הרקמה היא בחינם מזיהום פטרייתי או חיידקי.
- הפץ את הרקמה על ידי הצבת ~ 10 יורה על צלחת טרייה של בינוני התפשטות ולסגור את הצלחת עם 2 שכבות של נייר איטום אלסטי. לוחות דגירה ב 28 ° c, 16 h:8h יום: לילה. חזור על שלב זה כל 4 שבועות.
- כאשר יורה הם > 1 ס מ אורך, לחתוך יורה בבסיס שלהם ומניחים אותם על המדיום השתרשות (לראות את שולחן 1). על 10 נצרי ניתן להציב על צלחת השתרשות אחת. מיקום יורה זקוף על ידי הוספת קצה הבסיס של לירות לתוך המדיום. השורשים מופיעים 10-14 ימים לאחר הדגירה של צלחות 28 ° c, 16 h:8h יום: לילה.
הערה: אין לשורש כל נצרי אלא לשמור על חלק להפצת תרבות רקמות (ראה שלב 5.2).
6. הNodulation של פ. אנדרסונ2 שתילי בעציצים
-
. הכן את ריזוביום
- האיחסן 10 מ ל של נוזל YEM בינונית (ראה שולחן 2) ממושבה אחת של mesorhizobium BOR26 ו-דגירה של 28 ° c עבור 2 ימים.
הערה: M. plurifarium BOR2 הוא המועדף כפי שהוא ביעילות no, P. אנדרסונii. עם זאת, זנים של ריזוביום אחרים יכולים לשמש גם לnodulation של פ. אנדרסונב ( למשל, בשנת WUR325, ריזוביום , מCIAT89926,27 או דופק איטי) sp. Kelud2A4). - השתמש בתרבות 10 mL כדי לחסן נפח גדול יותר של מדיום YEM נוזלי. כמות התרבות הזאת תלויה במספר הסירים שצריכים להיות מחוסנו.
- הכינו בינוני נוזלי EKM (ראו שולחנות 3, טבלה 4). צנטריפוגה את התרבות החיידקית עבור 10 דקות ב 3,500 x g כדי לקצור את התאים. לאחר מכן, להשעות מחדש את הגלולה החיידקית ב-EKM נוזלי (להשתמש באותו אמצעי אחסון כמו התרבות המקורית של YEM) ולקבוע את הדחיסות האופטית (OD600).
- האיחסן 10 מ ל של נוזל YEM בינונית (ראה שולחן 2) ממושבה אחת של mesorhizobium BOR26 ו-דגירה של 28 ° c עבור 2 ימים.
- עבור ~ 20 סירים, להכין 3 L של מדיום נוזלי EKM ומחסן עם ההשעיה הריון הכין בשלב 6.1.3. להגיע OD600 = 0.025.
- מערבבים 3 L של EKM המכיל ריזוזוביה עם 1,250 גרם של perlite. לאחר מכן, להוסיף 210 g של תערובת זו כדי סטרילי סירי פוליפרופילן שקוף. לחילופין, במקום פרלייט, השתמשו בחול כמצע לnodulation סקוס.
- צמח 1-3 P. אנדרסונ2 שתילי בכל סיר. כמו כן, הכינו מספר סירים המכילים שתילי P. אנדרסונב , שהפכו למבנה הבקרה של CRISPR (ראה טבלה משלימה 1). שוקלים כמה סירים כדי להיות מסוגל לקבוע אובדן המים במהלך הניסוי. לכסות את החלק התחתון של כל סיר כדי להגן על השורשים מפני חשיפה לאור.
- סירי הסירים בחדר הצמיחה climatized (28 ° צ', 16 h:8h יום: לילה) עבור 4-6 שבועות. פעם בשבוע, שוקלים מספר. סירים כדי לקבוע אובדן מים אם אובדן המים עולה על 10 מ ל, תוספת עם מים אולטרה טהורים כדי לפצות על אובדן.
- לאחר 4-6 שבועות, לנקות את השורשים מן אבקות פרלייט ולקבוע מספרים גולה באמצעות המשקפת לבחון את היעילות nodulation.
7. הNodulation של פ. אנדרסונ2 שתילי לוחות
-
הכנת ממברנות צלופן . עשריםושמונה
- חותכים את קרום צלופן כדי להתאים למשבצת 12 ס"מ x 12 ס"מ צלחת פטרי. חותכים את הקרומים קצת יותר קצר בחלק העליון כדי לאפשר מקום נצרי לצמוח.
- כדי להגדיל את החדירות של ממברנות צלופן, מרתיחים את הקרומים בתמיסה EDTA (1 g/L) עבור 20 דקות. לאחר מכן, לשטוף לפחות 6x עם מים מינרליות כדי להסיר את EDTA.
הערה: כאשר הקרום היבש נוטה לקמט כאשר במגע עם מים, יש לטבול את הקרומים היבשים אחד אחד לתוך הפתרון. - מסדרים את הקרומים אופקית בשכבת מים דקה בצלחת זכוכית עגולה. מחטא את הקרומים. באמצעות אוטוקלינג פעמיים
- מקום 1 ממברנה צלופן אוטומטי על ריבוע 12 x 12 ס מ צלחת פטרי המכילים בינונית EKM באגר (ראה שולחן 3, טבלה 4). מקום שני 3-שבוע שורשים P. אנדרזונii שתילים (ראה סעיף 5) או שתילי בן 4 שבועות (ראה סעיף 1.1) על גבי הקרום. ודא רק לבחור שתילי או שתילים עם שורשים בעלי טיפים לבנים שורש, המציין כי שורשים אלה עדיין גדל.
- בעדינות לכסות את השורשים עם קרום הצלופן השני, יצירת שכבת סנדוויץ '. חותם את הצלחת עם 3 שכבות של איטום נייר אלסטי. עוטפים את החצי התחתון של הצלחות עם רדיד אלומיניום, כדי לכסות את השורשים מחשיפה לאור.
- מודטה את הצלחות בחדר הצמיחה climatized (28 ° צ', 16 h:8h יום: לילה) עבור 3-4 שבועות. סמן את המיקום של קצות השורש כדי לעקוב אחר צמיחת השורש לאורך זמן.
- אם הצלחות EKM מתחילות להתייבש עקב דגירה ממושכת, להעביר את הצמחים ללוחות EKM טרי כמה ימים לפני החיסון חיידקי.
- הכינו את החיידק החיידקי כמתואר בשלב 6.1.
- הסירו את קרום הצלופן העליון והחילו 1 מ ל של תרבות ריזוביום (OD600 = 0.025) לשורשים. לאחר מכן, מניחים קרום צלופן חדש על השורשים שחוסנו. עוטפים את החלק החיצוני של הצלחת באמצעות רדיד אלומיניום כדי לכסות את השורשים מחשיפה לאור.
- לאחר 4 שבועות, לבחון מספרים גולה באמצעות המשקפת כדי לקבוע את היעילות nodulation.
8. הNodulation שתילים של P. אנדרסונ2 בתוך שקיות
- לנבוט P. אנדרסונii זרעים כפי שמתואר בסעיף 1.1. לאחר שהלוחות הופיעו במלואו (~ 12 ימים על לוחות SH-0 ב -28 ° c), העבירו את השתילים לשקיות.
- כדי להכין את השקית, לקרוע את החלק המקופל של הפתיל נייר ולהוסיף 7 מ ל של מדיום EKM שונה (ראה שולחן 3, טבלה 4).
- הוסף שתילים 1 או 2 על-ידי הצבת השורשים בין שני גיליונות נייר היוצרים את הפתיל נייר ואת גיליון פלסטיק הקדמי של הנרתיק.
- מגן על השורשים מפני חשיפה קלה, על ידי רדיד אלומיניום מתקפל סביב הכיס. השהה את השקית בקופסת פלסטיק מכוסה במכסה שקוף לשמירה על לחות גבוהה. מניחים את התיבה בחדר צמיחה climatized (28 ° c, 16 h:8h יום: לילה).
- מפצים על אידוי במים על ידי הוספת מים נקיים במיוחד, כך שפתיל הנייר נשאר לח (להימנע ממים עומדים בתחתית הנרתיק). לאחר השבוע הראשון, זה בדרך כלל דורש הוספת 2-3 ml כל 4 ימים.
- הכינו את החיידק החיידקי כמתואר בשלב 6.1.
- לאחר שתילים גדלו במשך 10-12 ימים בתוך שקיות, איחסן את מערכת השורש עם 500 μL של תרבות ריזוזוביום (OD600 = 0.025).
- בצע את היווצרות גולה בזמן. ארבעה שבועות פוסט חיסון, גושים ניתן לספור וקצרו כדי לקבוע יעילות nodulation.
9. גולה אנליזה ציטואדריכלות
- לאסוף 10-15 גושים 2 מ ל צינור המכיל קבע (5% גלוטארלדהיד ב 0.1 M מאגר פוספט, pH 7.2). החלת ואקום עבור 1/2-1 h ו-דגירה לילה ב 4 ° c. במהלך תקופה זו, הדגימות מטביעים את תחתית השפופרת.
הערה: ניתן לאחסן את הפתרון הקבע ב-4 ° צ' עבור ~ 2-4 שבועות לפני השימוש. הקפד ללבוש כפפות כאשר עובדים עם fixative רקמות. - לשטוף את גושי 2x עם 0.1 M פוספט מאגר, pH 7.2. החלת 10 דקות מרווחי זמן בין כל שלב כביסה.
- מייבשים את הדגימות על ידי הדגירה לאחר מכן ב 30%, 50%, 70%, ו 100% אתנול. כדי להבטיח כי כל המים מוסרים מן הדגימות, לחזור על 100% אתנול שלב 3x. החל 10 דקות במרווחי זמן בין כל שלב התייבשות.
- להכין את תערובת פילמור אני (PM-I) על ידי הוספת 1 חבילת של הררמר I כדי 2.5 mL של PEG400 מעורב עם 100 mL של HEMA (2-הידרוקסיל מתיונין) מבוססי שרף פתרון. מערבבים את הפתרון ל-~ 15 דקות כדי לפזר לחלוטין את האני. לאחר מכן, לאחסן PM-I ב-20 ° c.
- להסיר את האתנול משלב 9.3. ולחדור את הדגימות בסדר הבא: PM-I:100% אתנול (1:3, v/v), PM-I:100% אתנול (1:1, v/v), ו-PM-I:100% אתנול (3:1, v/v). מודטה את הדגימות בכל פתרון ב-RT עבור 1/2-1 h או עד הדגימות לשקוע לתחתית.
- מודטה דגימות לילה ב 4 ° צ' ב 100% PM-I פתרון.
- הכינו תערובת פלמור II על ידי ערבוב PM-I ו האררנר II ב 15:1 (v/v) יחס. ממלאים את העובש הפלסטי בתמיסה הפלמור, כיוון את הדגימות אופקית בתחתית העובש, ומכסים בנייר איטום אלסטי. הימנע היווצרות בועות אוויר.
הערה: ככל שהפתרון מתחיל להיות מהיר עם חשיפה ל-RT, נסה לכוון את הדגימות במהירות האפשרית במחזיק הפלסטיק. פלמור מושלם לאחר הדגירה של הלילה ב RT, או 1 h ב 37 ° c. - הסירו את מכסה האיטום האלסטי משלב 9.7 והניחו מחזיק בדגימות הפולימולן. כדי לטעון את המחזיק בדגימות, התמוססות 10 מ ל של אבקת שרף מתיל מתילתיאקריל בתוך 5 מ ל של תמיסת שרף מתיל. הוסף במהירות את הפתרון לחור בחלק העליון של המחזיק.
הערה: בצעו את שלב הפילמור במכסה המנוע (~ 30 דקות בשעה RT). - דגימות מקטע מיקרוטומה לעובי של 4-5 μm. מניחים שקופית מיקרוסקופ על צלחת חמה של 58 ° c ומוסיפים טיפה גדולה של מים לכל שקופית. מניחים את החלקים על החלק העליון של המים. ברגע שהמים התאדו, המקטעים יהיו נצמדים לשקופית.
- שקופיות כתם על ידי המאכשר ב 0.05% (w/v) כחול טולדין עבור 2 דקות. לאחר מכן, לשטוף שקופיות 3 x עם מים אולטרה טהור. ניתן לצפות בשקופיות בעזרת מיקרוסקופ שדה בהיר.
10. מיזוליזציה של פ. אנדרסונ2 שתילי
-
הכנת Rhizophagus irregularis נבגים ברשת
- להכין ערימה של פוליאסטר ארוגים מסננים עם הגדלים הבאים (מלמעלה למטה): 210 יקרומטר, 120 יקרומטר, ו 36 יקרומטר שינוי גודל.
- פיפטה את הסכום הנדרש של נבג הבולם המסחרי על ערימת מסנני פוליאסטר. לשטוף את המסננים 3x עם 100 mL של מים מינרלים אוטוקלבים. הנבגים נשמרים על פני השטח של מסנן יקרומטר 36.
הערה: להכין את הבולם נבג בארון הצלב למינאר כדי למנוע זיהום. - לפרק את מחסנית פוליאסטר ולשמור את המסנן 36 יקרומטר בלבד. חזרו על שלב השטיפה עם מים מינרלים באופן אוטומטי לפחות 6x.
- הניחו את הפילטר על צלחת פטרי והשהה מחדש את הנבגים במים בעלי מינרליזציה אוטומטית. השתמש באמצעי אחסון של מים השווה לנפח של ההשעיה נבג בשימוש צעד 10.1.2. העבר את הבולם נבג לצינור סטרילי על ידי ליטוף.
- מקום 5 טיפות של 20 μL של השעיית נבג על שקופית זכוכית ולספור את מספר הנבגים באמצעות מיקרוסקופ שדה בהיר. המרת ספירות נבג ליחס של נבגים/mL ולדלל את ההשעיה נבג עד שהוא מגיע 250 נבגים/mL. אחסן את ההשעיה נבג ב 4 ° c.
- ביצוע שיטת המיריזציה. למטרה זו, להוסיף 800 g של החול בלוק שיושלם עם 70 mL של 1/2-הוגי בינוני לכלי פוליפרופילן שקוף סטרילי (ראה שולחנות 5-6). מערבבים חול ובינוני ישירות בסיר על ידי טלטול נמרצות.
- מקום אחד P. אנדרזונii שתילים בכל סיר, ו פיפטה 1 מ ל של נבג מושעה ישירות על השורש של P. אנדרזונii שתילי. הקפידו לכלול מספר סירים המכילים שתילי P. אנדרסונב , שהפכו למבנה בקרת CRISPR (ראו טבלה משלימה 1).
- סירי העציצים בחדר הצמיחה climatized (28 ° צ', 16 h:8h יום: לילה) עבור 6 שבועות.
- להוציא את הצמחים מן הסירים ולשטוף את השורשים עם מים זורמים להסיר כמה חול ככל האפשר.
- גזור שורשים בחתיכות 1 ס מ ומרתיחים את חתיכות השורש ב 10% KOH (w/v) עבור 20 דקות ב 90 ° c. לאחר מכן, מניחים את השורשים מבושלים על מסננת תא עם גודל 100 יקרומטר שינוי ולשטוף 3x עם 50 mL של מים.
- שורשי כתם עם 0.05% (w/v) טריקון כחול ב לקטגליצרול (300 מ ל של חומצה לקטית; 300 mL של גליצרול; ו 400 mL של מים מינרלים) עבור 5 דקות ב-90 ° c באמבט מים או בבלוק חימום. לאחר מכן, העברת שורשים ל 30% גליצרול. דגימות השורש ניתן לאחסן ב RT.
- מניחים 15-25 שורש שברי על שקופית אחת במיקרוסקופ. מוסיפים 30% גליצרול ומכסים בזכוכית מכסה ומקישים עד שהחלקים השורשים הופכים לשטוחים. שימו לב לרסיסי השורש בעזרת מיקרוסקופ שדה בהיר והתוצאה היא מושבת המיקוריריזל.
הערה: שיטה לציון המיקוריזציה מתוארת על פי "טרובליט ואח '29. שיטה זו משתמשת במספר מחלקות (% F,% M ו-% A), המאפשרת הערכה מהירה של רמת מושבת המיקורילי של כל קטע שורש ושפע של ארבוסקלס.
Representative Results
P. אנדרסונii tריס ניתן לגדל בחממה ממוזג ב 28 ° צ' ו ~ 85% לחות יחסית (איור 1a). בתנאים אלה, עצים מתחילים פורח ב 6-9 חודשים לאחר נטיעת. הפרחים של האישה פ. אנדרזונii מייצרים גרגרים שכל אחד מהם מכיל זרע אחד. במהלך ההבשלה, הגרגרים לשנות צבע; ראשון מירוק ללבן ולאחר מכן מלבן לחום (איור 1B). זרעים שחולצו מן גרגרים חומים הבשיל, לנבוט היטב לאחר מחזור טמפרטורה של 10 ימים והדגירה של 7 ימים על SH-0 צלחות (איור 1C). זרעים מונבטים להמשיך להתפתח שתילים צעירים שניתן להשתמש בהם לניסויים לאחר ~ 4 שבועות (איור 1D).
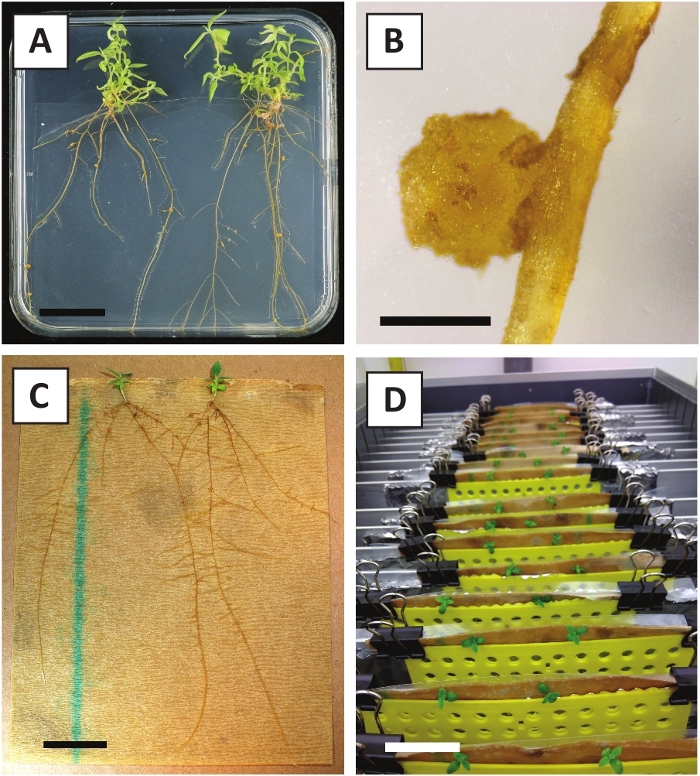
בעבר הצגנו כי הפטוטרות וחלקים של P. אנדרזונii הצעיר יכול להיות השתנה ביעילות באמצעות הזן tumefaciens AGL110. בתחילת הליך השינוי, הרקמות הממגרות מעובדות בשיתוף עם א. tumefaciens במשך יומיים ב -21 ° צ' (איור 2 א). שיתוף-טיפוח ממושך מביא לקולוניזציה של הרקמה על ידי א. tumefaciens , ולכן יש למנוע (איור 2b). לאחר תקופת הטיפוח-תרגול, הרחבות רקמות מועברות לאמצעי תקשורת סלקטיבית, המקדם את צמיחת הרקמה השונה. שניים עד שלושה שבועות מאוחר יותר, מיקרו-calli ירוק קטן הם נצפו בדרך כלל לאורך משטח הפצע המקורי (איור 2C). שיחות אלה צריך להמשיך לגדול ולפתח 1 או יותר לשנות את היורה באמצעות 6-8 שבועות לאחר הליך השינוי כבר יזם (איור 2D). בשלב זה, יעילות השינוי בדרך כלל נע בין ~ 10-30% עבור העתקות שיזם התקני הרקמות נלקח מענפים בוגרים ובחלקו (שולחן 7). אם שינויי הצורה מבוצעים עם explants נלקח מתוך טיפים צעירים וגדלים במהירות של סניפים שעדיין לא נושאת פרחים, יעילות שינוי של ~ 65-75% ניתן להשיג (טבלה 7). מדי פעם, הקריאה לבנבן נוצרות בצד של החוקר כי הוא לא בקשר עם המדיום, ולכן, לא לחוות בחירה של קאנאמיסינ '. שיחות אלה הן לעתים קרובות לא טרנסגניים כל יורה נוצר מן הçallı בדרך כלל אקונומיקה ולמות לאחר מגע ישיר עם kanamycin המכיל בינונית (איור 2e). במקרה שקצב השינוי נמוך ו/או החומר ההתחלתי היה מיטבי, הרקמה עשויה להפוך חום (איור 2F) ולסבול מריבוי התפשטות על ידי . tumefaciens (איור 2f). כדי למנוע . tumefaciens מפני התפשטות והגדלה תפשט בקרבת מקום, מרענן רגיל של המדיום נדרש, הרחבות נגועים בחומרה צריך להיות מוסר. ברגע שיורים הטרנסגניים בודדים ממוקמים במדיום התפשטות, התפשטות מעבר על ידי . tumefaciens בדרך כלל אינו מתרחש יותר (איור 2h). ניתן להכפיל את הנצרי הטרנסגניים באמצעות הפצת מבחנה, שתעניק עלייה לעשרות נצרי בתקופה של חודש אחד (איור 3א-ב). נצרי אלה ניתן להציב על השתרשות בינונית, אשר צריך לגרום שורש היווצרות אחרי ~ 2 שבועות (איור 3C-D). שתילי שורשים ניתן להשתמש לאחר מכן לניסויים.
כדי ליצור קווי הסתרה של מוטציה, אנו משתמשים ב-CRISPR/Cas9-תיווך מוטגנזה. לשם כך, אנו עושים שימוש וקטור בינארי המכיל את ההתנגדות kanamycin ' Nptii, רצף קידוד Cas9 מונע על ידי היזם CaMV35S ו 2 sgRNAs לכל גן היעד המבואים מתוך AtU6p היזם RNA קטן20. ייצוג גרפי של המבנה המשמש עבור CRISPR/Cas9-תיווך מוטגנזה של פ. אנדרסונii מסופק באיור 4a. באמצעות שיטה זו, עריכת הגנום הוא הבחין ב ~ 40% של הופך באופן השתנה לקריאה10. כדי לזהות קווי מוטציה, הצילומים שעברו השתנה בצורה משונה מבוססי מוטציות באתר היעד sgRNA (s) באמצעות התחל באזור המיועד. דוגמה לתוצאות הצפויות נתונה באיור 4. כפי שניתן לראות מתוך התמונה שצולמה לאחר האלקטרופורזה ג'ל, מספר דגימות לייצר ה-PCR אמפליקון עם גודל דומה לסוג פראי (איור 4b). צמחים אלה עשויים להכיל indels קטנים שאינם יכולים להיות מדמיינו על ידי אגנה ג'ל אלקטרופורזה או להישאר לא ערוך על ידי האנזים Cas9. בנוסף, מספר דוגמאות להקות מפיקות שונות בגודלן מסוג פראי (לדוגמה, קווים 2, 4, 7 ו -8 באיור 4B). בקווים אלה, 1 (קווים 4, 7 ו-8) או שניהם (קו 2) אללים מכילים indels גדולים שניתן לדמיין בקלות. האופי המדוייק של המוטציות באתר היעד מתגלה לאחר הרצף של ה-PCR. כפי שניתן לראות מתוך איור 4C, שני indels קטנים של 1-4 bp, כמו גם, מחיקות גדולות ניתן להשיג לאחר CRISPR/Cas9 מוטזיס. באיור 4C, הרצף של קו 1 זהה לזה של סוג פראי, המציין כי קו זה נמלט העריכה, ולכן, יש להיפטר. בין הקווים המכילים מוטציות, heterozygous, homozygous ו-bi-allelic מוטציות ניתן לזהות (איור 4C). עם זאת, המוטנטים הheterozygous הם בדרך כלל נדירים10. מוטציות Homozygous או bi-allelic הסתרה ניתן להפיץ ומלא כדי להשיג חומר מספיק לניתוח פנוטימית. כאשר הניתוח פנוטימית מבוצע בדור T0 , חשוב לבדוק אם קווי מוטציה עשויים להיות צ'יאריק. למטרה זו, יש לחזור על שלושה דגימות שונות שנלקחו מכל קו מוטציה. אם תוצאות ה-גנוזות זהות זו לזו והדגם המקורי (למשל, קו 8 באיור 4D), הקו משתנה באופן הומוגנטי וניתן להשתמש בו לניתוח נוסף. עם זאת, אם התוצאות משתנות בין דגימות עצמאיות (לדוגמה, קו 4 באיור 4D), קו המוטציה הוא צ'יאריק והוא צריך להיות מושלך.
החיסונים של פ. אנדרזונii עם M. plurifarium BOR2 תוצאות היווצרות גושים שורש (איור 5). כפי שניתן לראות באיור 5A, גושים אלה מופצים לאורך מערכת השורש. גושים של P. andersonii הם חום בהיר בצבע אבל יכול להיות מופלים בקלות מרקמת השורש על בסיס צורתם (איור 5b). ניסויים בכלי חרס בעציצים ובעקבות גידול במשך 4-6 שבועות בדרך כלל כתוצאה מהיווצרות של ~ 10-30 גושים (איור 6A). מספר דומה של גושים נוצר לאחר החיסונים של EKM לוחית של מגדל הצלחת P. אנדרסונ2 ב 4 שבועות לאחר החיסון (איור 6a). בתוך שקיות, שתילים P. andersonii בדרך כלל טופס ~ 5-15 גושים ב 5 שבועות פוסט החיסון (איור 5C-D, 6a). כדי לנתח את הארכיטקטורה הגולה, גושים יכולים להיות מנות ונצפו באמצעות מיקרוסקופ שדה בהיר. איור 6B מראה דוגמה של חתך האורך באמצע גולה של P. andersonii . סעיף זה מציג את צרור כלי הדם המרכזיים של גולה של P. אנדרזונii , אשר מוקף באונות גולה המכילה תאים נגועים (איור 6b).
. שתילי פ. אנדרסונ2 יכול להיות גם מסתורי לאחר 6 שבועות של חיסונים עם R. irregularis, תדירות הקולוניזציה mycorrhizal מגיע בדרך כלל > 80% (איור 6c). בשלב זה, בדרך כלל, כ-30% מהתאים מכילים ארבוסקלס (איור 6C). דמות ייצוגית של קטע שורש P. אנדרסונב המכיל ארבוסקלס מוצג באיור 6d.

איור 1: תמונות מייצגות של עץ, זרעים ושתילים של פ. אנדרסונ2 (א) בן שישה חודשים של פ. אנדרסונii שגדל באדמת השתילה בחממה ממוזג ב -28 ° c. (ב) דמות מייצגת המתארת את הענבים P. אנדרזונii בשלבים שונים של ההבשלה. ענבים צעירים P. andersonii (לא בשלים) ישתנה צבע מירוק ללבן ולבסוף חום (בשלים) על הבשלה. (ג) P. אנדרסונii זרעים מודבטים על SH-0 בינונית במשך שבוע אחד. עיגול שחור מצביע על שתיל מונבטים. (ד) שתילי P. אנדרזונii בן הארבע שבועות גדלו במדיום SH-0. סרגלי קנה מידה שווים ל -25 ס"מ (A) ו-1 ס מ ב (ב-ד). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
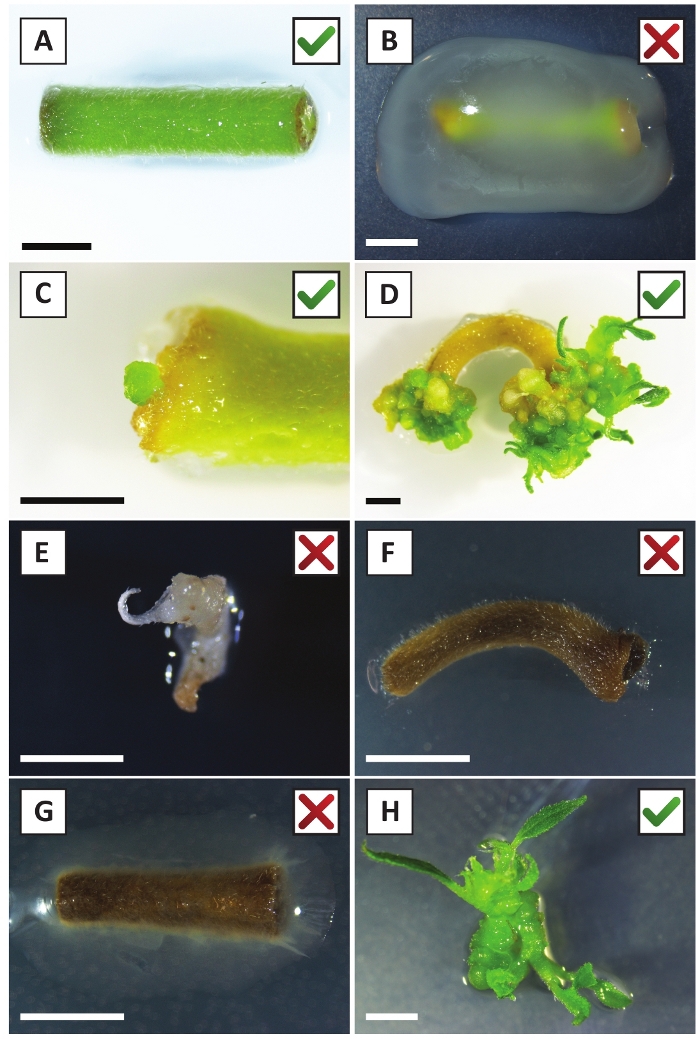
איור 2: תמונות מייצגות של האקסוצמחים בשלבים שונים של הליך השינוי היציב. (א) לחקור שיתוף מטופח עם א. tumefaciens. (ב) לחקור מגודלים על ידי א. tumefaciens במהלך 2 השבועיים הראשונים שלאחר השינוי. (ג) טרנסגניים מיקרו-callus נוצר ליד אתר הפצע של החוקר ב 2.5 שבועות לאחר הטיפוח-תרגול. (ד) דמות ייצוגית של התפתחות ב -6 שבועות פוסט טיפוח מראה את הופעתה של נצרי מ (הטרנסגניים) calli. (ה) דמות ייצוגית של לירות הופך לבנבן ובסופו של דבר מת כאשר במגע ישיר עם kanamycin המכיל בינוני. זה יורה הוא כנראה לא טרנסגניים ונמלט kanamycin ' בחירה כאשר מחוברים ההסבר. (ו) דמות ייצוגית של החוקר השונה ללא הצלחה. (ז) דמות ייצוגית של מעין הצלחה שהפכה להיות מכוסה על ידי א. tumefaciens. (ח) לירות טרנסגניים בודד גדל על התפשטות בינונית ב 8 שבועות post-טיפוח-תרגול עם A. tumefaciens. סרגלי קנה מידה שווים 2.5 מ"מ. תיבות המכילות סימוני ביקורת ירוקים או צלבים אדומים מצביעים על שינוי מוצלח או לא מוצלח של explants, בהתאמה. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.

איור 3: תמונות מייצגות של בתוך מבחנה הפצה. (א) יורה גדל על בינוני התפשטות. התמונה צולמה 1 שבוע לאחר שלוחות רועננו. (ב) יורה גדל על התפשטות בינונית. התמונה צולמה 4 שבועות לאחר רענון הצלחות. (ג) החתוכים טרי מניחים על השתרשות מדיום. (ד) יורה ב השתרשות המדיום במשך שבועיים. . שימו לב לנוכחות השורשים פסי הקנה מידה שווים ל 2.5 ס מ. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
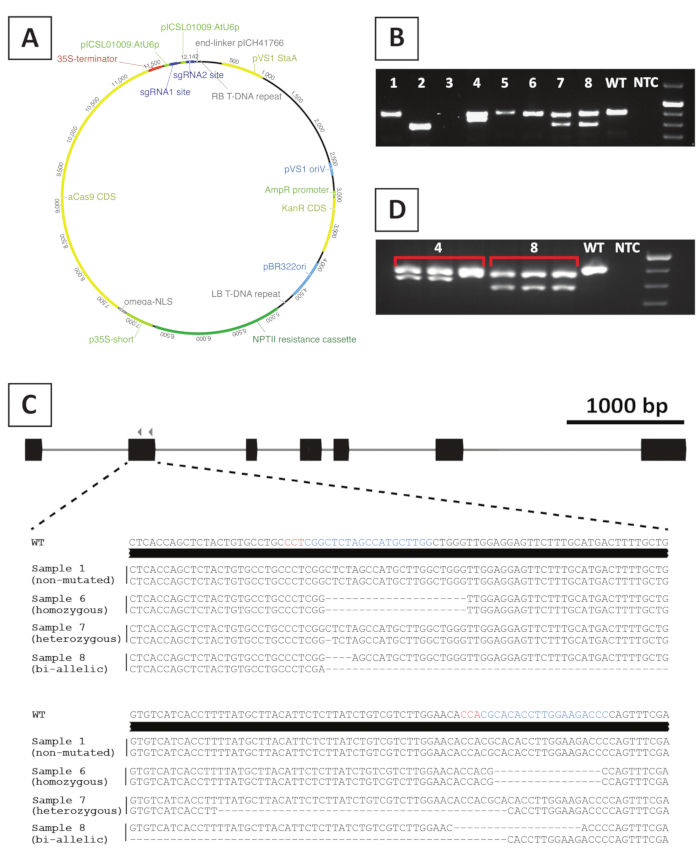
איור 4: תוצאות הנציגים לאחר הגנוזה של P. אנדרסונii T0 הטרנסגניים הCas9. (א) מפת מייצגים של וקטור בינארי המשמש ל CRISPR/Cas9-תיווך מוטגנזה של פ. אנדרסונii. (ב) מייצג לאחר ה-PCR המבוסס על שורות מוטציה של CRISPR פוטנציאלי/Cas9 מוטנטים באמצעות התחל באתר היעד sgRNA (s). המוצג הוא תמונה לאחר שעלה אלקטרופורזה ג'ל של הגברה. דגימות שנלקחו מקווים טרנסגניים בודדים מסומנות במספרים. סוג פראי (WT) וללא בקרת תבנית (NTC) מציינים נתיבים המכילים פקדים חיוביים ושליליים, בהתאמה. (ג) ייצוג סכמטי של אלולים מוטציות שהתקבלו לאחר CRISPR/Cas9-תיווך גן עריכה. מודגשים בצבעים כחולים ואדומים הם אתרי היעד sgRNA ו-רצפי פם, בהתאמה. (ד) הנציג מבוסס על הקרנה מבוססת-PCR עבור קווי פוטנציאל של מוטציה של צ'יאריק. המוצג הוא תמונה לאחר agarose ג'ל אלקטרופורזה של 3 דגימות בודדות נלקח מתוך קווי מוטציה 4 ו 8. שימו לב שהשורה הטרנסגניים מוטציה 4 היא צ'יאריק. אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
איור 5: תמונות מייצגות של nodulation בחני בצלחות וכיסי. (א) Nodulation על לוחיות המכילות בינוני ומחוסן של מדיום באגירה ב- M. plurifarium BOR2 במשך 4 שבועות. (ב) דמות מייצגת של גולה שורש P. אנדרסונ2 . התמונה צולמה במהלך 4 שבועות לאחר החיסון עם M. plurifarium BOR2. (ג) Nodulation בתוך שקיות המכילות מדיום נוזלי בגודל ekm. השתילים חוסנו עם הדופק האיטי ריזוזוביום Sp. Kelud2A4 במשך 5 שבועות. (ד) דמות מייצגת של התקנה שלמה המשמשת לnodulation בתוך שקיות. סרגלי קנה מידה שווים 2.5 ס מ ב (A, C), 1 מ"מ ב (ב) ו-5 ס מ (ד). אנא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
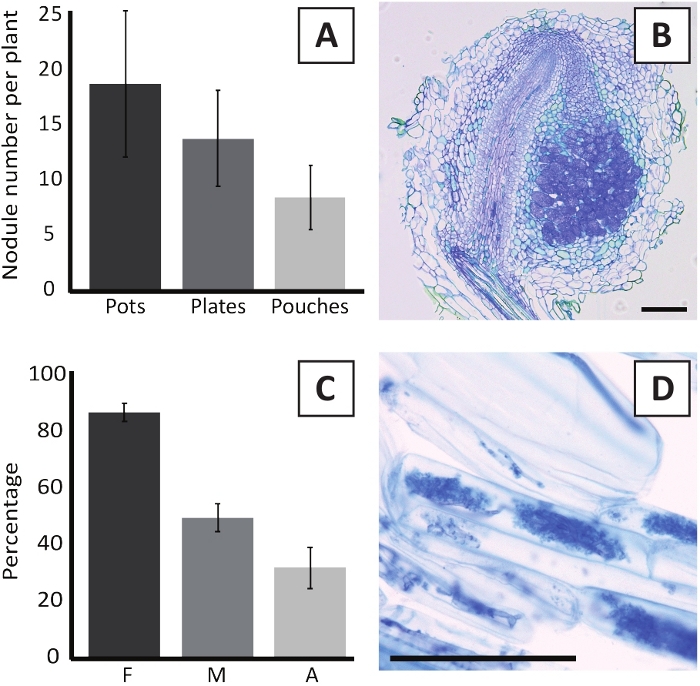
איור 6: תוצאות הנציג של הnodulation והמיקוריזציה. (א) גרף בר מייצג מראה את מספר גושים שנוצרו לכל צמח ב 4 שבועות פוסט החיסון עם M. plurifarium BOR2 בעציצים או על צלחות בפוסט 5 שבועות החיסון עם הדופק הראשון של הKelud2A4 בתוך כיסי. נתונים מייצגים ממוצע ± SD (n = 10). (ב) דמות מייצגת של קטע האורך דרך גולה הוקמה ב 4 שבועות פוסט החיסון עם M. plurifarium BOR2. המקטע מוכתם בכחול. (ג) גרף עמודות מייצג המציג כימות המיקוריזציה. משתנים בעלי כימות על פי טרובליט ואח '29 הם F, תדירות של שברי שורש מנותח כי הם mycorrhized; M, עוצמת הזיהום; A, שפע של ארבוסקלס בוגרת במערכת השורש הכולל. מיקוריזציה הייתה כמותית ב -6 שבועות לאחר החיסון עם R. irregularis (זן DAOM197198). נתונים מייצגים ממוצע ± SD (n = 10). (ד) דמות מייצגת של ארבוסקלס בוגרים נוכח בתאי השורש של P. אנדרסן בשבוע 6 שבועות פוסט החיסון עם R. irregularis. קנה מידה של פסים שווה 75 μm. נא לחץ כאן כדי להציג גירסה גדולה יותר של איור זה.
| מתחם | SH-0 | שלוש עשרה | אמצעי הפצה | השתרשות מדיום | מדיום הסתננות |
| מדיום למלח SH-בסיס | 3.2 גרם | 3.2 גרם | 3.2 גרם | 3.2 גרם | 3.2 גרם |
| ויטמין SH-תערובת | מיכל הג | מיכל הג | מיכל הג | מיכל הג | מיכל הג |
| סוכרוז | - | משחק 10 | 20 גר' | משחק 10 | משחק 10 |
| BAP (1 מ"ג/mL) | - | - | 1 מ ל (4.44 μM) | - | - |
| רשות השידור (1 מ"ג/mL) | - | - | 100 μL (0.49 μM) | 1 מ ל (4.92 μM) | - |
| NAA (1 מ"ג/mL) | - | - | - | 100 μL (0.54 μM) | - |
| 1 M MES = 5.8 | 3 מ ל | 3 מ ל | 3 מ ל | 3 מ ל | 3 מ ל |
| 1 M קו | התאם את ה-pH ל 5.8 | התאם את ה-pH ל 5.8 | התאם את ה-pH ל 5.8 | התאם את ה-pH ל 5.8 | התאם את ה-pH ל 5.8 |
| דיישין אגר | מיכל שמונה | - | מיכל שמונה | מיכל שמונה | - |
טבלה 1: הרכב של שתילים-הילדרנדט מבוסס30 מדיה המשמש לגידול שתילי P. אנדרסונב , טרנספורמציה יציבה, והפצת מבחנה. התמוססות תרכובות מוצקות לתוך 750 mL של מים אולטרה טהורים לפני הוספת מניות נוזלי. לאחר מכן, למלא את המדיום השלם ל 1 L. הכינו BAP, רשות השידור, NAA מניות ב 0.1 M KOH וחנות ב-20 oC.
| לפני התאמה אוטומטית: | ||
| מתחם | סכום לליטר | ריכוז סופי |
| ניטול | 5 גר' | 27.45 ממ ' |
| Na-גלוקונאט | 5 גר' | 22.92 ממ ' |
| תמצית שמרים | 0.5 גרם | - |
| מדחס4· 7h2O | 0.2 גרם | 0.81 ממ ' |
| מיכל שלמה | 0.1 גרם | 1.71 ממ ' |
| K2hpo4 | 0.5 גרם | 2.87 ממ ' |
| לאחר האוטוקלינג: | ||
| מתחם | סכום לליטר | ריכוז סופי |
| 1.5 מ ל2 | 1 מ ל | 1.5 ממ ' |
שולחן 2: הרכב של שמרים-Mannitol (YEM) בינוני המשמש לגידול ריזוביום. להתאים את ה-pH כדי 7.0 ולמלא עם מים אולטרה טהורים ל 1 L. כדי להכין את בינונית YEM בינוני, להוסיף 15 גרם של microagar לפני אוטוקלינג.
| לפני התאמה אוטומטית: | |||
| מתחם | ריכוז מניות | סכום בינוני לליטר | ריכוז סופי |
| KH2פו4 | 0.44 מ ' | הוסף 2 מ ל | 0.88 ממ ' |
| K2hpo4 | 1.03 מ ' | הוסף 2 מ ל | 2.07 ממ ' |
| 500x מיקרו רכיבים פתרון מניות | - | הוסף 2 מ ל | - |
| MES-pH = 6.6 | 1 מדיום | הוסף 3 מ ל | 3 ממ ' |
| HCl | 1 מדיום | התאם את ה-pH ל 6.6 | - |
| מים אולטרה טהורים | - | מילוי ל 990 mL | - |
| לאחר האוטוקלינג: | |||
| מתחם | ריכוז מניות | סכום בינוני לליטר | ריכוז סופי |
| מדחס4· 7h2O | 1.04 מ ' | 2 מ ל | 2.08 ממ ' |
| מבנה2SO4 | 0.35 מ ' | 2 מ ל | 0.70 ממ ' |
| NH4NO3 | 0.18 מ ' | 2 מ ל | 0.36 ממ ' |
| מדחס2· 2h2O | 0.75 מ ' | 2 מ ל | 1.5 ממ ' |
| Fe (III)-ציטראט | 27 ממ ' | 2 מ ל | 54 μM |
שולחן 3: הרכב של 1 L שונה בינוני EKM31 המשמש P. אנדרסונii nodulation שינוי. הרכב של פתרון המניה 500x מיקרו אלמנטים מופיע בטבלה 4. כדי להכין 2% אגר-בינונית בינוני EKM, להוסיף 20 גרם של דאישין אגר לפני אוטוקלינג. אוטוקלב את MgSO4· 7h2o, Na2כל כך4, cacl2· 2h2o, ו-Fe (III)-מניות ציטראט לחטא. מסנן לעקר NH4לא3 מלאי פתרון לחטא.
| מתחם | סכום לליטר | ריכוז מניות |
| מאוד מהנה | 500 מ ג | 3.31 ממ ' |
| . לעשות את זה4· 7h2או | 125 מ ג | 0.43 ממ ' |
| כיתה4· 5h2O | 125 מ ג | 0.83 ממ ' |
| H3בו3 | 125 מ ג | 2.02 ממ ' |
| Na2MoO4· 2h2O | 50 מ ג | 0.21 ממ ' |
טבלה 4: הרכב של מיקרו אלמנטים 500x מניות פתרון המשמש הכנת מדיום EKM שונה. אחסן את פתרון המלאי של מיקרו-רכיבים ב-4 ° c.
| תרכובות | ריכוז מניות | סכום בינוני לליטר | ריכוז סופי |
| K2hpo4 | 20 ממ ' | 1 מ ל | 0.2 ממ ' |
| NH4NO3 | 0.28 מ ' | 10 מ ל | 2.8 ממ ' |
| מיכל בע | 40 ממ ' | 10 מ ל | 0.4 ממ ' |
| K2כל כך4 | 40 ממ ' | 10 מ ל | 0.4 ממ ' |
| Fe (2)-EDTA | 9 ממ ' | 10 מ ל | 0.9 ממ ' |
| מיכל2 | 80 ממ ' | 10 מ ל | 0.8 ממ ' |
| 50x מיקרו רכיבים פתרון מניות | - | 10 מ ל | - |
שולחן 5: הרכב של 1/2-הוגי32 בינוני בשימוש עבור mycorrhization assays ספר. הרכב של 50 x מיקרו אלמנטים מניות פתרון רשום בטבלה 6. הכינו את הפתרון Fe (II)-EDTA על ידי שילוב FeSO4· 7h2O (9 מ"מ) ו-Na2· EDTA (9 מ"מ) לפתרון מניות 1, ולאחסן ב 4 ° c. להתאים את ה-pH של המדיום כדי 6.1 באמצעות קו 1 M ו למלא עם מים אולטרה טהורים ל 1 L.
| תרכובות | סכום לליטר | ריכוז מניות |
| H3בו3 | 71.1 מ ג | 1.15 ממ ' |
| מדחס2· 4h2O | 44.5 מ ג | 0.22 ממ ' |
| כיתה4· 5h2O | 3.7 מ ג | 23.18 μM |
| שפני העכבר2 | 10.2 מ ג | 74.84 μM |
| Na2MoO4· 2h2O | 1.2 מ ג | 4.96 μM |
טבלה 6: הרכב של 50 x מיקרו אלמנטים מניות פתרון המשמש להכנת 1/2-הוגי בינוני.
| גיל החפירה | נצילות שינוי |
| צעיר | 69.4 ± 6.2% (n = 2) |
| בוגר | 18.3 ± 10.2% (n = 15) |
שולחן 7: יעילות הטרנספורמציה של פ. אנדרסונii. כאן, יעילות השינוי מוגדרת כאחוז של explants היוצרים לפחות 1 הטרנסגניים יבלות או לירות. יעילות הטרנספורמציה הבקיע ב 6 שבועות לאחר ההמרה מתוארת כממוצע ± SD. n מציין את מספר הניסויים השינוי שממנו נקבע יעילות השינוי.
משלים קובץ 1: מבט כולל על בנייה ברמה 1 וברמה 2 המשמשת עבור CRISPR/Cas9 מוטגנזה. אנא לחץ כאן כדי להוריד קובץ זה.
Discussion
קטניות והקרובים ביותר הקשורים הקנאביריים סוג Parasponia מייצגים את שני clades של מינים צמח מסוגל להקים יחסים אנדוסימביוזה עם חנקן תיקון ריזוזוביה ושורש טופס גושים. מחקרים השוואתיים בין מינים של שתי הקלדות הם רלוונטיים ביותר כדי לספק תובנות לתוך הרשתות הגנטיות הליבה המאפשר סימביוזה זו. כיום, מחקרים גנטיים נעשים בעיקר בקטניות; במיוחד שני מיני הדגם M.. . כדי לספק פלטפורמה ניסיונית נוספת ולהקל על מחקרים השוואתיים עם שאינו תרמיל, אנו מתארים כאן פרוטוקול מפורט עבור שינוי יציב וניתוחים גנטיים הפוכה P. אנדרזונii. הפרוטוקול המוצג משתמש בהפצת מחוץ לתחום של T0 הטרנסגניים P. אנדרסונii , המאפשר ניתוח פנוטימית ליזום בתוך 4 חודשים לאחר הטיפוח-תרגול המשותף . זה מהיר באופן משמעותי מאשר הפרוטוקולים הנוכחיים שהוקמו לשינוי יציב של קטניות33. זה עושה P. אנדרסון מודל מחקר אטרקטיבי.
הפרוטוקול המתואר כאן מכיל מספר שלבים קריטיים. הראשון שמדאיג את נביטת הזרעים. כדי להכין את הזרעים של P. אנדרזונii לנביטה, הזרעים צריכים להיות מבודדים מן הגרגרים. זה נעשה על ידי שפשוף גרגרים על פיסת נייר טישו או נגד בתוך מסננת תה. הליך זה צריך להתבצע בעדינות כדי למנוע נזק למעיל הזרע. אם מעיל הזרע ניזוק, אקונומיקה יכול להיכנס לזרע במהלך עיקור, אשר מפחית את הכדאיות הזרעים. כדי לשבור זרעים dormancy, הזרעים חשופים מחזור טמפרטורה של 10 ימים. עם זאת, למרות טיפול זה, נביטה אינו מסונכרן לחלוטין. באופן כללי, הזרעים הראשונים להראות הקיצוניות הופעתה לאחר 7 ימים, אבל אחרים עשויים להימשך מספר ימים יותר כדי לנבוט.
נקודות קריטיות בשגרת השינוי נוגעות בבחירת החומר ההתחלתי ובמשך שלב הטיפוח-תרגול המשותף. כדי להגיע לטרנספורמציה יעילה, מומלץ להשתמש בגבעולים ובריאים וצעירים של צמחים לא-סטריליים הגדלים בחממה כחומר ההתחלתי. כדי לגרום לצמיחה של ענפים צעירים, מומלץ לקצץ עצים Parasponia מדי 2-3 חודשים ולרענן עצים פעם בשנה. בנוסף, יש לבצע את שלב הטיפוח-תרגול למשך יומיים בלבד. טיפוח-תרגול ממושך מקדם מושבת רקמות בידי א. tumefaciens ומפחית בדרך כלל את יעילות הטרנספורמציה. כדי למנוע התיישבות מחדש על ידי . tumefaciens חשוב גם לרענן באופן קבוע את לוחיות הרישוי שעליהן מעובדות האקסוצמחים. במקרה של מעבר-הקולוניזציה יתרחש, ניתן לשטוף רקמות (ראה סעיף 3.8) כדי להסיר תאים . tumefaciens . אנו מייעצים להוסיף אקונומיקה לפתרון SH-10 המשמש לשטיפה (ריכוז סופי: ~ 2% hypochlorite). חשוב לציין כי שלב זה כביסה נוספת עלול לא לעבוד על הרחבות נגועים בכבדות (איור 2B). במקרה של שינוי עם מבנה CRISPR/Cas9 מניב רק מספר מוגבל של נצרי שעברו המרה או אם מוטגנזה של גן מסוים צפוי לגרום בעיות התחדשות, מומלץ לכלול מבנה ריק בקרת וקטורי כמו שליטה חיובית. לבסוף, חשוב לוודא שכל הקווים הטרנסגניים הנבחרים כתוצאה מאירועים עצמאיים של שילוב T-DNA. לכן, אנו מורים לקחת רק לירות הטרנסטרגניים יחיד מכל צד של החוקר. עם זאת, אנו מבינים כי זה מפחית את המספר הפוטנציאלי של קווים עצמאיים. אם הקווים הרבים נדרשים, החוקרים יכולים להחליט להפריד את הקריאה באמצעות שינוי-הצורה המקורית מן האקסוצמחים המקורי כאשר אלה çallı הם ≥ 2 מ"מ בגודל ותרבות אלה çallı באופן עצמאי. בדרך זו, ניתן לבודד קווים מרובים מכל הדרכה, אשר מעלה את מספר הקווים הטרנסגניים הפוטנציאליים.
בפרוטוקול הנוכחי, הקווים הטרנסגניים של פ. אנדרסונב מופצים באמצעות הפצת מבחנה. היתרון של זה הוא כי שתילי הטרנסגניים רבים יכול להיווצר בפרק זמן קצר יחסית. עם זאת, לשיטה זו יש גם מספר מגבלות. ראשית, התחזוקה של הקווים הטרנסגניים T0 דרך הפצת מחוץ לתחום היא אינטנסיבית העבודה עלולה לגרום לא רצוי גנטי או epigenetic שינויים34,35. שנית, T0 שורות עדיין מכילים עותק של ה-DNA, כולל את הקלטת עמידות לאנטיביוטיקה. פעולה זו מגבילה את מספר ההמרות האפשריות, כאשר סמני בחירה שונים נדרשים עבור כל שינוי מחדש. כיום, יש לנו בדיקות שינוי רק באמצעות kanamycin או בחירה hygromycin (נתונים לא מוצגים). יתר על כן, הנוכחות של רצף קידוד Cas9 ו sgRNAs בקווים T0 הטרנסגניים מסבך את המחקרים הקומפלמנטציה. מערכת הקומפלמנטציה אפשרית אך מחייבת את אתר היעד sgRNA להיות מוטציה ככאלה שעריכת גנים של המבנה המלא נמנעת. שלישית, חיסרון של עבודה עם T0 שורות הוא מוטציות CRISPR/Cas9 עשוי להיות צ'יאריק. כדי למנוע ניתוח פנוטיפים של קווי מוטציה של צ'יאריק, אנו ממליצים לחזור על ניתוח ה-גנואיות לאחר הפצת החוץ הגופית על לפחות 3 נצרי שונים. למרות, מספר מוטציות צ'יאריק שהתקבלו באמצעות הפרוטוקול המתואר כאן הוא מוגבל, הם נצפו מדי פעם10. כדי להתגבר על מגבלות העבודה עם T0 שורות, P. שורות מוטציה של אנדרזונii ניתן להפיץ באופן כללי. העצים של פ. אנדרסונב הם דו-ביתי ומואבקי-רוח. משמעות הדבר היא שכל קו טרנסגניים צריך להיות מניפולציות ככזה שפרחים זכריים ונקביים מיוצרים על אדם אחד, ולאחר שגדלו כך האבקה לא מתרחשת. כמו P. andersonii הוא עץ הגדל מהר הוא דורש כמות משמעותית של שטח בחממה טרופית (28 ° צ', ~ 85% לחות יחסית). לכן, למרות שהדבר אפשרי מבחינה טכנית, התפשטות הגנרטיה של הקווים הטרנסגניים של P. אנדרסונב היא מאתגרת לוגיים.
בסעיף הפרוטוקול, תיארנו 3 שיטות לnodulation של פ. אנדרסונii. היתרון של מערכות הלוחית והפאוץ ' הוא שהשורשים נגישים בקלות, דבר שעלול לאפשר היווצרות של חיידקים ולאחר להיווצרות גולה לאורך זמן. עם זאת, מערכת הצלחות היא עבודה אינטנסיבית למדי, מה שהופך אותו פחות מתאים ניסויים nodulation בקנה מידה גדול. חיסרון של מערכת התיק הוא כי קשה למנוע זיהום פטרייתי. שקיות אינן סטריליות, ולכן הצמיחה פטרייתי היא לעתים קרובות לצפות על החלק העליון של התיק. עם זאת, זה לא משפיע על הצמיחה P. andersonii , ולכן אינו מפריע nodulation assays. בנוסף, מערכת הפאוץ ' מתאימה רק לשתילים. למרות מספר ניסיונות, לא הצלחנו לגדל שתילי באמצעות התפשטות חוץ גופית בתוך כיסי.
קו הגנטיקה הפוכה P. אנדרסונב המתואר כאן מציע שיפור משמעותי בהשוואה לשיטה הקיימת המבוססת על השורש המבוסס על שורש11. באמצעות ההליכים המתוארים, קווי טרנסגניים יציבים יכולים להיווצר ביעילות וניתן לתחזק אותם באמצעות הפצת מבחנה. לעומת זאת, הטרנספורמציה של "ריזוגנים " היא ארעית וגורמת רק להיווצרות שורשים טרנסגניים. מכיוון שכל השורש הטרנסגניים נובע משינוי בלתי תלוי, מבוסס על המרה מבוססת על שינוי הצורה. וריאציה זו היא הרבה פחות במקרה של קווים יציבים, למרות הפצת מבחנה גם יוצרת רמה מסוימת של וריאציה. בגלל זה וריאציה מופחתת ואת העובדה כי שתילי מרובות יכול להיות פנוטים עבור כל קו יציב, קווים יציבים מתאימים יותר עבור בחני כמותית לעומת השורשים השתנו. בנוסף, השינוי היציב אינו תלוי במבוא של השורש הגורם ללוקוס (rol) המשפיע על איזון ההורמונים האנדוגניים15. לכן, קווים יציבים מתאימים יותר עבור ניתוח גנטי הפוכה של גנים המעורבים הומאוסטזיס הורמונלי לעומת . ריזוגנים-השורשים השתנו. יתרון כללי יותר של P. andersonii כמודל מחקר הוא שזה לא חווה שכפול הגנום האחרון (wgd). התרמיל, שכולל את מודל הקטניות, הכוללת את מודלים המגוראוליים , ואת הערבוניים, כמו גם את הסליציים (סדר מלפיגאלס) הכולל את עץ הדגם פופולארה Trichocarpa חוו wgds ~ 65 . לפני מיליון שנים36,37 מספר רב של paralogous גנים הנובעים מwgds אלה נשמרים ב-גנום של M. truncatula, L. הפקוניקוס P. trichocarpa37,38,39, אשר יוצר יתירות שעלולה לסבך ניתוחים גנטיים הפוכים. כמו p. andersonii לא חווה wgd האחרונות, ניתוחים גנטיים הפוכה על P. אנדרזונii יכול להיות מושפע פחות על ידי תפקוד יתיר של עותקי גן paralogous.
ביחד, אנו מספקים פרוטוקול מפורט לניתוח גנטי הפוך ב -P. אנדרסונב. באמצעות פרוטוקול זה, ניתן להפיק ביעילות קווי מוטציה בודדים בפרק זמן של 2-3 חודשים10. פרוטוקול זה ניתן להרחיב כדי ליצור מוטציות בסדר גבוה יותר באמצעות ריבוב של sgrnas לפילוח גנים שונים בו זמנית, כפי שמוצג עבור מינים צמחים אחרים40,41,42. בנוסף, הליך השינוי היציב המתואר כאן אינו מוגבל CRISPR/Cas9 gene המיקוד אבל יכול לשמש גם כדי להציג סוגים אחרים של בנייה (למשל, עבור היזם-העיתונאי assays ביטוי חוץ רחמי או טרנס- קומפלמנטציה). הקמנו P. andersonii כמודל מחקר השוואתי כדי ללמוד הדדיות symbioses עם החנקן התיקון ריזוזוביה או הפטריות האנדומיקובית. עם זאת, הפרוטוקולים המתוארים כאן גם לספק כלים ללמוד היבטים אחרים של הביולוגיה של העץ הטרופי הזה, כגון היווצרות עץ, התפתחות של פרחים דו-מיניים או ביוסינתזה של מטבוליים משניים ספציפיים.
Acknowledgements
המחברים אוהבים להכיר במארק Youles, סופיזם כמון ו סילבאסטרה Marillonnet עבור הפיכת שער הזהב לשכפול חלקים הזמינים דרך מסד הנתונים של Addgene. בנוסף, היינו רוצים להודות ל ' ג'יימס, פ. הדובס, ו-T. J. היגיגנס עבור זרעי P. אנדרזונii . עבודה זו נתמכת על ידי ארגון הולנד למחקר מדעי (NWO-865.13.001 המענק; NWO-תחרות פתוחה מענק 819.01.007) ומשרד המחקר, הטכנולוגיה וההשכלה הגבוהה של הרפובליקה של אינדונזיה (RISET-PRO מענק 8245-ID).
Materials
| Name | Company | Catalog Number | Comments |
| Sigma-Aldrich | N0640 | NAA | |
| Duchefa Biochemie | M1503.0250 | MES | |
| Sigma-Aldrich | D134406 | Acetosyringone | |
| Duchefa Biochemie | X1402.1000 | X-Gal | |
| Merck | 101236 | For nucleic acid electrophoresis gel | |
| - | - | Pouches box material, hangers | |
| Merck | 101188 | NH4NO3 | |
| Sigma-Aldrich | B3408-1G | BAP | |
| Merck | 100156 | H3BO3 | |
| Thermo-Fisher | ER1011 | Used as restriction enzyme in Golden Gate cloning assembly | |
| Thermo-Fisher | 15561020 | Used in Golden Gate cloning assembly | |
| Merck | 137101 | CaCl2·2H2O | |
| Duchefa Biochemie | C0111.0025 | C16H16N5O7S2Na | |
| Thermo-Fisher | K1231 | Used for cloning the blunt-ended PCR amplicons in genotyping procedure | |
| Agronutrition | AP2011 | Containing Rhizophagus irregularis DAOM 197198 (1,000 spores/mL), used for mychorrization assay | |
| Merck | 102790 | CuSO4·5H2O | |
| Duchefa Biochemie | D1004.1000 | Used for plant tissue culture agar-based medium | |
| Merck | 105101 | K2HPO4 | |
| VWR Chemicals | 20302.293 | Na2·EDTA | |
| Duchefa Biochemie | M0803.1000 | C6H14O6 | |
| Thermo-Fisher | ER0291 | Used as restriction enzyme in Golden Gate cloning assembly | |
| Merck | 100983 | C2H5OH | |
| VWR Chemicals | BDH9232-500G | EDTA | |
| Sigma-Aldrich | Z377600-1PAK | Cellophane membrane | |
| Biomatters, Ltd. | R9 or higher | Bioinformatics software for in silico cloning and designing of sgRNAs | |
| Mega International | - | Technical information at https://mega-international.com/tech-info/ | |
| Sigma-Aldrich | 65882 | Used for fixating nodule tissues | |
| VWR Chemicals | 24385.295 | - | |
| Vink | 219341 | Pouches box material, bottom part | |
| Leica Biosystems | 14702218311 | Used as a template for plastic embedding | |
| Merck | 100317 | HCl | |
| Sigma-Aldrich | I5386-1G | IBA | |
| Merck | 103862 | C6H5FeO7 | |
| Merck | 103965 | FeSO4O·7H2O | |
| Duchefa Biochemie | I1401.0005 | IPTG | |
| Duchefa Biochemie | K0126.0010 | ||
| Sigma-Aldrich | L2000 | ||
| Merck | 105886 | MgSO4O·7H2O | |
| Merck | 105934 | MnCl2·4H2O | |
| Merck | 102786 | MnSO4O | |
| Duchefa Biochemie | M1002.1000 | Used for bacterial culture agar-based medium | |
| Manutan | 92007687 | Pouches material | |
| Paraxisdienst | 130774 | Elastic sealing foil | |
| Pull Rhenen | Agra-Perlite No.3 | Used as growing substrate in pots for nodulation assay | |
| VWR Chemicals | 391-0581 | Used as container for cellophane membranes | |
| Thermo-Fisher | F130WH | For genotyping transgenic lines | |
| Addgene | 50337 | Level 0 terminator, 3'UTR, 35s (Cauliflower Mosaic Virus) | |
| Addgene | 48017 | End-link 2 for assembling 2 level one part into a level 2 acceptor | |
| Addgene | 48018 | End-link 3 for assembling 3 level one part into a level 2 acceptor | |
| Addgene | 48001 | Level 1 acceptor. Position 5. Forward orientation | |
| Addgene | 48007 | Level 1 Acceptor. Position 1. Reverse orientation | |
| Addgene | 50268 | Level 0 promoter (0.4 kb), 35s (Cauliflower Mosaic Virus) + 5'UTR, Ω (Tobacco Mosaic Virus) | |
| Addgene | 46966 | Used for designing CRISPR/Cas9 module | |
| Addgene | 46968 | Used for designing CRISPR/Cas9 module | |
| Addgene | 50334 | Level 0 Kanamycin/Neomycin/Paromomycin resistance cassette | |
| Topzeven | - | Used as filters for washing spore suspension | |
| Sigma-Aldrich | 8.17003 | PEG400 | |
| Duchefa Biochemie | E1674.0001 | Pots to grow Parasponia plantlets/seedlings | |
| Merck | 104871 | KH2PO4 | |
| Merck | 105033 | KOH | |
| Merck | 105153 | K2SO4O | |
| Van Leusden b.v. | - | Used as growing substrate for mychorrhization assay | |
| Duchefa Biochemie | S0225.0050 | SH-basal salt medium | |
| Duchefa Biochemie | S0411.0250 | SH-vitamin mixture | |
| Lehle Seeds | VIS-02 | Used as non-ionic surfactant in the washing step of stable transformation | |
| Merck | 137017 | NaCl | |
| VWR Chemicals | 89230-072 | C6H11NaO7 | |
| Merck | 106521 | Na2MoO4·2H2O | |
| Merck | 106574 | Na2HPO4·7H2O | |
| Merck | 567549 | NaH2PO4·H2O | |
| Sigma-Aldrich | 239313 | Na2SO4O | |
| Duchefa Biochemie | S0809.5000 | C12H22O11 | |
| Thermo-Fisher | B69 | Used in Golden Gate cloning assembly | |
| Thermo-Fisher | EL0013 | Used in Golden Gate cloning assembly | |
| Kulzer-Mitsui Chemicals Group | 64708806 | Methyl methacrylate-based resin powder | |
| Kulzer-Mitsui Chemicals Group | 64709003 | HEMA (2-hydroxyethyl methacrylate)-based resin solution | |
| Kulzer-Mitsui Chemicals Group | 66022678 | Methyl methacrylate-based resin solution | |
| Merck | 1159300025 | ||
| Acros | 189350250 | ||
| VWR Chemicals | 663684B | Polysorbate 20 | |
| Stout Perspex | - | pouches box material, lid | |
| Duchefa Biochemie | Y1333.1000 | ||
| Merck | 108816 | ZnCl2 | |
| Alfa Aesar | 33399 | ZnSO4O·7H2O |
References
- Clason, E. W. THE VEGETATION OF THE UPPER-BADAK REGION OF MOUNT KELUT (EAST JAVA). Bulletin du Jardin Botanique de Buitenzorg. Serie III, 509-518 (1936).
- Soepadmo, E. Ulmaceae. Flora Malesiana-Series 1, Spermatophyta. 8, 31-76 (1974).
- Becking, J. H. The Rhizobium symbiosis of the nonlegume Parasponia. Biological Nitrogen Fixation. , 497-559 (1992).
- Oldroyd, G. E. D. Speak, friend, and enter: signalling systems that promote beneficial symbiotic associations in plants. Nature Reviews Microbiology. 11, 252-263 (2013).
- Gutjahr, C., Parniske, M. Cell and developmental biology of arbuscular mycorrhiza symbiosis. Annual Review of Cell and Developmental Biology. 29, 593-617 (2013).
- van Velzen, R., et al. Comparative genomics of the nonlegume Parasponia reveals insights into evolution of nitrogen-fixing rhizobium symbioses. Proceedings of the National Academy of Sciences of the United States of America. 115, E4700-E4709 (2018).
- van Velzen, R., Doyle, J. J., Geurts, R. A Resurrected Scenario: Single Gain and Massive Loss of Nitrogen-Fixing Nodulation. Trends in Plant Science. 24, 49-57 (2019).
- Griesmann, M., et al. Phylogenomics reveals multiple losses of the nitrogen-fixing root nodule symbiosis. Science. 1743, eaat1743 (2018).
- Becking, J. H. Root-Nodule Symbiosis Between Rhizobium And Parasponia (Ulmaceae). Plant and Soil. 51, 289-296 (1979).
- van Zeijl, A., et al. CRISPR/Cas9-Mediated Mutagenesis of Four Putative Symbiosis Genes of the Tropical Tree Parasponia andersonii Reveals Novel Phenotypes. Frontiers in Plant Science. 9, 284 (2018).
- Cao, Q., et al. Efficiency of Agrobacterium rhizogenes–mediated root transformation of Parasponia and Trema is temperature dependent. Plant Growth Regulation. 68, 459-465 (2012).
- Limpens, E., et al. RNA interference in Agrobacterium rhizogenes-transformed roots of Arabidopsis and Medicago truncatula. Journal of Experimental Botany. 55, 983-992 (2004).
- Boisson-Dernier, A., et al. Agrobacterium rhizogenes-Transformed Roots of Medicago truncatula for the Study of Nitrogen-Fixing and Endomycorrhizal Symbiotic Associations. Molecular Plant-Microbe Interactions. 14, 695-700 (2001).
- Kumagai, H., Kouchi, H. Gene Silencing by Expression of Hairpin RNA in Lotus japonicus Roots and Root Nodules. Molecular Plant-Microbe Interactions. 16, 663-668 (2003).
- Nilsson, O., Olsson, O. Getting to the root: The role of the Agrobacterium rhizogenes rol genes in the formation of hairy roots. Physiologia Plantarum. 100, 463-473 (1997).
- Davey, M. R., et al. Effective Nodulation of Micro-Propagated Shoots of the Non-Legume Parasponia andersonii by Bradyrhizobium. Journal of Experimental Botany. 44, 863-867 (1993).
- Webster, G., Poulton, P. R., Cocking, E. C., Davey, M. R. The nodulation of micro-propagated plants of Parasponia andersonii by tropical legume rhizobia. Journal of Experimental Botany. 46, 1131-1137 (1995).
- Op den Camp, R., et al. LysM-type mycorrhizal receptor recruited for rhizobium symbiosis in nonlegume Parasponia. Science. 331, 909-912 (2011).
- Weber, E., Engler, C., Gruetzner, R., Werner, S., Marillonnet, S. A Modular Cloning System for Standardized Assembly of Multigene Constructs. PLOS ONE. 6, e16765 (2011).
- Nekrasov, V., Staskawicz, B. J., Weigel, D., Jones, J. D. G., Kamoun, S. Targeted mutagenesis in the model plant Nicotiana benthamiana using Cas9 RNA-guided endonuclease. Nature Biotechnology. 31, 691-693 (2013).
- Bertani, G. Studies On Lysogenesis. I. The Mode Of Phage Liberation By Lysogenic Escherichia Coli. Journal of Bacteriology. 62, 293-300 (1951).
- Engler, C., et al. A Golden Gate modular cloning toolbox for plants. ACS Synthetic Biology. 3, 839-843 (2014).
- Fauser, F., Schiml, S., Puchta, H. Both CRISPR/Cas-based nucleases and nickases can be used efficiently for genome engineering in Arabidopsis thaliana. The Plant Journal. 79, 348-359 (2014).
- Lazo, G. R., Stein, P. A., Ludwig, R. A. A DNA Transformation-Competent Arabidopsis Genomic Library in Agrobacterium. Biotechnology. 9, 963-967 (1991).
- Op den Camp, R. H. M., et al. N Nonlegume Parasponia andersonii Deploys A Broad Rhizobium Host Range Strategy Resulting in Largely Variable Symbiotic Effectivenes. Molecular Plant-Microbe Interactions. 25, 954-963 (2012).
- Graham, P. H., Viteri, S. E., Mackie, F., Vargas, A. T., Palacios, A. Variation in acid soil tolerance among strains of Rhizobium phaseoli. Field Crops Research. 5, 121-128 (1982).
- Martinez-Romero, E., et al. Rhizobium tropici, A Novel Species Nodulating Phaseolus vulgaris L. Beans and Leucaena sp. Trees. International Journal of Systematic and Evolutionary Microbiology. 41, 417-421 (1991).
- Felten, J., et al. The Ectomycorrhizal Fungus Laccaria bicolor Stimulates Lateral Root Formation in Poplar and Arabidopsis through Auxin Transport and Signaling. Plant Physiology. 151, 1991-2005 (1991).
- Trouvelot, A., Kough, J. L., Gianinazzi-Pearson, V. Mesure du taux de mycorhization VA d’un systeme radiculaire. Recherche de methods d’estimation ayant une signification fonctionnelle. Aspects Physiologiques et Genetiques des Mycorhizes. , 217-221 (1986).
- Schenk, R. U., Hildebrandt, A. C. Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Canadian Journal of Botany. 50, 199-204 (1972).
- Becking, J. H. The Parasponia parviflora - Rhizobium symbiosis. Host specificity, growth and nitrogen fixation under various conditions. Plant and Soil. 75, 309-342 (1983).
- Hoagland, D. R., Arnon Revised, D. I., Arnon, D. I. The Water-Culture Method for Growing Plants without Soil. Circular California Agricultural Experiment Station. 347, 1-32 (1950).
- Wang, K. . Methods in Molecular Biology: Agrobacterium Protocols. 1, (2015).
- Smulders, M. J. M., de Klerk, G. J. Epigenetics in plant tissue culture. Plant Growth Regulation. 63, 137-146 (2011).
- Larkin, P. J., Scowcroft, W. R. Somaclonal variation — a novel source of variability from cell cultures for plant improvement. Theoretical and Applied Genetics. 60, 197-214 (1981).
- Cannon, S. B., et al. Legume genome evolution viewed through the Medicago truncatula and Lotus japonicus genomes. Proceedings of the National Academy of Sciences of the United States of America. 103, 14959-14964 (2006).
- Tuskan, G. A., et al. The Genome of Black Cottonwood, Populus trichocarpa (Torr. & Gray). Science. 313, 1596-1604 (2006).
- Young, N. D., et al. The Medicago genome provides insight into the evolution of rhizobial symbioses. Nature. 480, 520 (2011).
- Sato, S., et al. Genome Structure of the Legume, Lotus japonicus. DNA Research. 15, 227-239 (2008).
- Xing, H. L., et al. A CRISPR/Cas9 toolkit for multiplex genome editing in plants. BMC Plant Biology. 14, 327 (2014).
- Lowder, L. G., et al. A CRISPR/Cas9 Toolbox for Multiplexed Plant Genome Editing and Transcriptional Regulation. Plant Physiology. 169, 971 (2015).
- van Zeijl, A. . Dissecting Hormonal Pathways in Nitrogen-Fixing Rhizobium Symbioses. , (2017).
Explore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved