Dönüşüm, Genom Düzenleme ve Fenotipleme Azot sabitleme Tropikal Cannabaceae Ağaç Parasponia andersonii
In This Article
Summary
Parasponia andersonii, Kenevir ailesine (Cannabaceae) ait olan ve rizobium ile birlikte azot sabitleme kökü nodülleri oluşturabilen hızlı büyüyen tropikal bir ağaçtır. Burada, Agrobacterium tumefaciens-aracılı kararlı dönüşüm ve CRISPR/Cas9 tabanlı genom düzenlemesine dayalı P. andersonii'de ters genetik analizler için ayrıntılı bir protokol açıklıyoruz.
Abstract
Parasponia andersonii, Kenevir ailesine (Cannabaceae) ait hızlı büyüyen bir tropikal ağaçtır. 4 ek tür ile birlikte, rhizobium ile azot sabitleme nodül simbiyoz kurmak mümkün bilinen tek baklagil olmayan soy oluşturur. Baklagiller ve P. andersonii arasındaki karşılaştırmalı çalışmalar kök nodül oluşumunun altında yatan genetik ağlara değerli bir bakış açısı sağlayabilir. Karşılaştırmalı çalışmaları kolaylaştırmak için, yakın zamanda P. andersonii genomunu sıraladık ve Agrobacterium tumefaciens-aracılı kararlı dönüşüm ve CRISPR/Cas9 tabanlı genom düzenlemesini kurduk. Burada P. andersoniiiçin geliştirilen dönüşüm ve genom düzenleme prosedürlerinin ayrıntılı bir açıklamasını salıyoruz. Buna ek olarak, simbiyotik fenotiplerin tohum çimlenmesi ve karakterizasyonu için prosedürleri açıklar. Bu protokol kullanılarak 2-3 aylık bir sürede stabil transgenik mutant hatları oluşturulabilir. T0 transgenik hatlarının vitro yayılımı nda vegetatif, A. tumefaciens co-cultivation'dan 4 ay sonra fenotilik deneylerin başlatılmasını sağlar. Bu nedenle, bu protokol sadece marjinal geçici Agrobacterium rhizogenesdaha uzun sürer -P. andersoniiiçin kullanılabilir tabanlı kök dönüşüm yöntemi , ancak birkaç net avantajlar sunuyor. Burada açıklanan prosedürler, P. andersonii'nin simbiyotik çağrışımları ve bu tropik ağacın biyolojisinin potansiyel olarak diğer yönlerini anlamayı amaçlayan çalışmalarda bir araştırma modeli olarak kullanılmasına izin verebilmektedir.
Introduction
Parasponia andersonii, Kenevir ailesine (Cannabaceae) ait tropik bir ağaçtır vePapua Yeni Gine ve birkaç Pasifik Adaları 1,2,3'e özgüdür. 4 ek Parasponia türü ile birlikte, rhizobia ile azot sabitleme nodül simbiyoz kurabilirsiniz sadece non-baklagiller soy temsil eder. Bu simbiyoz iyi baklagiller (Fabaceae) modelleri Medicago truncatula ve Lotus japonicusçalışılmıştır , hangi nodül oluşumu moleküler genetik doğası ayrıntılı bilgi edinme sonuçlandı ve işleyişi4. Ayrıca baklagillerde kök nodül simbiyozçok çok daha eski ve yaygın arbusküler micorrhizal simbiyoz5üzerine kurulduğu gösterilmiştir. Filogenomik karşılaştırmalar, baklagiller, Parasponia,azot sabitleme nodül simbiyozlar yanı sıra, diazotrofik Frankia bakteri barındıran sözde actinorhizal bitki türleri, ortak bir evrimsel kökene sahip olduğunu göstermektedir 6,7,8. Baklagil nodül oluşumunda rol aldığı tespit edilen genlerin korunmuş genetik temelin bir parçası olup olmadığını belirlemek için baklagil dışı türler üzerinde yapılan çalışmalar esastır. Bu amaçla, p. andersonii'yi baklagillerin yanı sıra, kök nodül oluşumu ve işleyişinin altında yatan çekirdek genetik ağları tanımlamak için karşılaştırmalı bir araştırma modeli olarak kullanmayı öneriyoruz.
P. andersonii volkanik tepelerin yamaçlarında bulunabilir bir öncüdür. Ayda 45 cm'lik büyüme hızlarını karşılayabilir ve 10metreyekadar 9 metreye ulaşabilir. P. andersonii ağaçları rüzgar-tozlaşma, hangi ayrı erkek ve dişi çiçekler3,10oluşumu ile kolaylaştırılır. Yakın zamanda P. andersonii'nindiploid genomunu (2n = 20; 560 Mb/1C) sıraladık ve açıklamaladık ve 2 ek Parasponia türünün taslak genom dizilerini bir araya getirdik; P. rigida ve P. rugosa6. Bu ortaya ~ 35,000 P. andersonii gen modelleri içinde kümelenebilir >20,000 ortogruplar m. truncatulagenleri ile birlikte , soya (Glisin max), Arabidopsis thaliana, ormanlık çilek ( Fragaria vesca), Trema orientalis, siyah pamuk kavak (Populus trichocarpa) ve okaliptüs (Okaliptüs grandis)6. Ayrıca, M. truncatula ve P. andersonii arasındaki transkripsiyon karşılaştırmaları, her iki türde de nodül geliştirilmiş ifade deseni gösteren 290 putatif ortolog kümesini tanımlamışlardır6. Bu karşılaştırmalı çalışmalar için mükemmel bir kaynak sağlar.
P. andersonii kökleri ve nodüllerde gen fonksiyonunu incelemek için Agrobacterium rhizogenes-aracılı kök dönüşümü için bir protokol oluşturulmuştur11. Bu protokol kullanılarak, transgenik kökleri taşıyan bileşik bitkiler nispeten kısa bir zaman diliminde oluşturulabilir. Bu yöntem, aynı zamanda, yaygın baklagil-simbiyoz araştırma12,13,14uygulanır. Ancak, bu yöntemin dezavantajı sadece köklerin dönüştürülmesi ve her transgenik kökün bağımsız bir dönüşüm olayını temsil ederek önemli bir değişime yol açarak ortaya çıkan bir durumdur. Ayrıca, dönüşüm geçicidir ve transgenik çizgiler sürdürülemez. Bu, A. rhizogenesbazlı kök dönüşümünü CRISPR/Cas9 aracılı genom düzenlemesi için daha az uygun hale getirir. Ayrıca, A. rhizogenes kök indükleyen locus aktarAn (rol) bitki genomuna genler, hangi kez hormon homeostaz15müdahale ifade . Bu a. rhizogenes-dönüştürülmüş kökleri zorlu bitki hormonlarının rolünü çalışma yapar. Bu sınırlamaları aşmak için, son zamanlarda Agrobacterium tumefaciens-tabanlı dönüşüm ve CRISPR / Cas9-P. andersonii10aracılı mutagenezi için bir protokol geliştirdi.
Burada, P. andersoniiiçin geliştirilen A. tumefacienstabanlı dönüşüm prosedürü ve ters genetik boru hattının ayrıntılı bir açıklamasını salıyoruz. Ayrıca, simbiyotik etkileşimleri incelemek için tahliller de dahil olmak üzere transgenik plantetlerin aşağı doğru kullanımı için protokoller salıyoruz. Burada açıklanan protokol kullanılarak, 2-3 aylık bir süre içinde birden fazla transgenik hat oluşturulabilir. CRISPR/Cas9 aracılı mutagenez ile birlikte, bu nakavt mutant hatları verimli nesil sağlar. Bu mutant çizgiler vegetatif in vitro 10,16,17, dönüşüm prosedürü sonra 4 ay içinde henotipik karakterizasyon başlatmak için oluşturulacak yeterli malzeme sağlar yayılır olabilir 10başlatıldı . Birlikte, bu prosedürler insa edilen bu laboratuvar, herhangi bir laboratuvarın, bu tropik ağacın biyolojisinin potansiyel olarak diğer yönlerini nisabı ve mikizobial ilişkime yönelik çalışmalar için bir araştırma modeli olarak p. andersonii'yi benimsemesine olanak vermelidir.
Protocol
1. Serada P. andersonii Ağaçları Büyümek
-
Çimlenme P. andersonii WU1 tohumları18.
- Taze Parasponia meyveleri kullanın veya rehydrate için 2 saat suda kurutulmuş çilek ıslatın. Kabak çilek bir parça kağıt mendil veya tohumları kaldırmak için bir çay elek içine karşı ovmak.
- 15-20 dakika ticari çamaşır suyu (~4% hipoklorit) kullanarak tohumları dezenfekte ve daha sonra steril su kullanarak 6 kez tohumları yıkayın.
- Tohumları steril 200 μL PCR tüplere aktarın. Tüpleri steril ize edilmiş suyla doldurun, tohumlar tamamen batırılmış gibi. Tüpleri aşağıdaki programı çalıştıran bir termocycler içinde 10 gün kuluçkaya yatırın: 30 döngü (4 saat için 7 °C, 4 saat için 28 °C). Bu tohumları öldürebilir gibi, ısıtılmış bir kapak kullanmayın.
- SH-0 plakalarını hazırlayın (bkz. Tablo 1). Tohumları SH-0 plakalarına aktarın ve 28 °C'de 16 saat:8 saat gece kuluçkaya yatırın. 28 °C'de kuluçka sırasında kurumasını önlemek için 2 kat elastik sızdırmazlık folyosu ile plakaları kapatın.
- Fideler ilk gerçek yaprak setini geliştirdikten sonra (~3-4 hafta 28 °C'de kuluçkadan sonra), fidelerticari çömlekçilik toprağı ile dolu tencerelere aktarır ve kurutunmayı önlemek için fidelerin üzerini yarı saydam plastik bir kap ile kaplar. Tencereleri 28 °C'lik bir iklim odasına veya seraya yerleştirin, ~%85 RH, 16 saat:8 saat gün altında:gece rejimi altında.
- 1 hafta sonra, yarı saydam plastik bardak çıkarın. Su düzenli olarak tencere ve ağaçlar büyümeyi sürdürmek için gübre ile daha büyük ek büyümek.
2. P. andersonii CRISPR/Cas9 aracılı Mutagenez için Konstrüktif Klonlama
NOT: Standart ikili dönüşüm vektörleri P. andersoniikararlı dönüşümü için kullanılabilir. Burada, örnek olarak, modüler klonlama (örneğin, Golden Gate)19kullanarak CRISPR/Cas9 aracılı mutagenez için yapılar oluşturmak için bir prosedürdür.
- Dahili CRISPR tasarım aracına sahip biyoinformatik yazılımını kullanarak ilgi çeken gen(ler) için kılavuz RNA hedef dizilerini belirleyin. Tam nakavt elde etme şansını artırmak için hedef genin kodlama dizisinin 5'ucunda bulunan kılavuz RNA dizilerini seçin. P. andersonii genom 6'ya karşı arama yaparak hedefdışı etkileri kontrol ettiğinizden emin olun.
NOT: Hedef gen başına 2 sgRNA kullanın, tercihen 200-300 bp ayrı. Bu pcr tarafından tespit edilebilir deletions üretebilir ve daha sonra agarose jel elektroforez tarafından. - Seviye 1 Golden Gate yapıları sgRNA dizilerini içeren oluşturun.
- Aşağıdaki astar sırasına N(20) pozisyonunda 20 bp kılavuz sırasını ekleyerek her bir sgRNA'yı yükseltmek için tasarım astarları: 5'-TGTGGTCTCAATTGN(20) GTTTTAGAGTagTAGAAATAGCAAG-3'.
NOT: Kılavuz sırası GN'ye (19)eşitse, astar sırasına eklemeden önce kılavuz dizisinin 5' ucundaki G'yi çıkarın. - PCR pICH86966 gelen sgRNA'lar yükseltmek::AtU6p::sgRNA_PDS20 adım 2.2.1 ve evrensel ters astar tasarlanmış ileri astar kullanarak: 5'-TGTGGTCTCAAGCGTAATGCCAACTTTGTAC-3'. Yüksek doğrulukta ısı yada dna polimeraz ve aşağıdaki PCR koşullarını kullanın: 30 s için 98 °C; 30 döngü (10 s için 98 °C; 20 s için 53 °C; 10 s için 72 °C); 7 dk. Başarılı PCR reaksiyonları için 72 °C 165 bp amplicon verir.
- Ticari bir PCR arıtma kiti kullanarak PCR amplicon'u kolon temizleyici. Daha sonra, Arabidopsis thaliana AtU6p küçük RNA organizatörü arkasında klon sgRNA için Golden Gate reaksiyonlar kurmak: 10 sgRNA PCR amplicon ng, pICSL01009 150 ng::AtU6p20, uygun düzeyde 1 kabul vektörü 60 ng, T4 2 μL ligase tamponu, 2 μL %0.1 büyükbaş serum albumini (BSA), 0.5 μL BsaI, 0.5 μL T4 ligase, 20 μL'ye ultra saf su ile doldurun. Saç tokası oluşumunu önlemek için tüm sgRNA'ların aynı yönde klonlanmasını sağlayın.
- Aşağıdaki programı çalıştıran bir termocycler inkübat reaksiyonları: 20 s için 37 °C; 26 devir (37 °C 3 dk; 16 °C 4 dk için); 5 dk için 50 °C; 5 dk. 80 °C için Escherichia coli ve plaka için Lb orta 21 ampisilin (50 mg /L), X-Gal (200 mg /L) ve IPTG (1 mM) içeren Golden Gate reaksiyonları dönüştürün.
NOT: IPTG ve X-Gal'ın stok çözümlerini sırasıyla ultra saf su ve dimethylformamid olarak hazırlayın. Filtre ampisilin ve IPTG stok çözeltilerini sterilize edin ve tüm stokları -20 °C'de saklayın. Dimetilformamid ile çalışırken eldiven takın. - Beyaz koloniler seçin ve ticari plazmid izolasyon kiti kullanarak plazmidleri izole edin. Sıra Golden Gate seviye 2 montaj ile devam etmeden önce izole plazmidler doğrulayın.
- Aşağıdaki astar sırasına N(20) pozisyonunda 20 bp kılavuz sırasını ekleyerek her bir sgRNA'yı yükseltmek için tasarım astarları: 5'-TGTGGTCTCAATTGN(20) GTTTTAGAGTagTAGAAATAGCAAG-3'.
- Sağlam dönüşüm için seviye 2 Golden Gate yapılarını birleştirin.
- Seviye 1 AtU6p::sgRNA yapıları (bölüm 2.2 altında oluşturulan) yanı sıra pICH47802::NPTII, pICH47742::35Spro::ΩNLS-aCas9:35Ster, seviye 2 alıcı pICSL4723 ve uygun kullanarak bir Golden Gate reaksiyonu gerçekleştirin (bkz. Engler ve ark.22). Aşağıdaki gibi reaksiyonlar gerçekleştirin: her donör vektörünün ~100 fmol'ünü ve kabul vektörünün ~20 fmol'ünü kullanın ve 2 μL T4 ligase tampon, 2 μL %0,1 BSA, 0,5 μL BpiI, 0,5 μL T4 ligase, ultra saf su ile 20 μL doldurun.
NOT: Seviye 1 plazmids pICH47802::NPTII, pICH47742::35Spro::ΩNLS-aCas9::35Ster ilk klonlanmalı olmalıdır (Ek Dosya 1bakınız ), bölüm 2.220altında sgRNA'lar için açıklandığı gibi,22 ,23. - Adım 2.2.4 altında inkübreaksiyonları ve E. colidönüşür. Kanamisin içeren LB orta plaka. Ertesi gün, beyaz koloniler seçin ve plazmidler izole. Kısıtlama-sindirim analizi ile doğru plazmid montajını belirleyin.
- Seviye 1 AtU6p::sgRNA yapıları (bölüm 2.2 altında oluşturulan) yanı sıra pICH47802::NPTII, pICH47742::35Spro::ΩNLS-aCas9:35Ster, seviye 2 alıcı pICSL4723 ve uygun kullanarak bir Golden Gate reaksiyonu gerçekleştirin (bkz. Engler ve ark.22). Aşağıdaki gibi reaksiyonlar gerçekleştirin: her donör vektörünün ~100 fmol'ünü ve kabul vektörünün ~20 fmol'ünü kullanın ve 2 μL T4 ligase tampon, 2 μL %0,1 BSA, 0,5 μL BpiI, 0,5 μL T4 ligase, ultra saf su ile 20 μL doldurun.
- Transform seviye 2 Agrobacterium tumefaciens zorlanma AGL124için inşa eder.
3. P. andersonii Kararlı Dönüşümü
- A. tumefaciens zorlanma AGL1 ilgi yapısı ile dönüştürülmüş uygun antibiyotik içeren 2 LB plakaları aşılamak. 28 °C'de 2 gün boyunca kuluçka yada plakalar.
- Serada yetişen ağaçlardan genç dalları hasat edin. Her dönüşüm için uzunluğu 5-8 cm yaklaşık 5 dalları kullanın. Sadece sağlıklı enfekte olmayan dalları kullandığınızdan emin olun. Yaprakları keserek her petiole'nin sonunda ~1 cm2 yaprak dokusu bırakılır gibi çıkarın. Yaprakları atın.
- 1:1-seyreltilmiş ticari çamaşır suyu kullanarak 15 dakika doku dezenfekte (seyreltme sonrası~ 2% hipoklorit) polisorbat 20 birkaç damla içeren. Daha sonra, otoklavlı su ile 6 kez doku durulayın.
NOT: Bu adım, hem de, aşağıdaki adımları doku steril tutmak için bir laminar aşağı akış kabine içinde yapılmalıdır. - A. tumefaciens hücreleri 25 mL infiltrasyon ortamında 1-2 plakadan (bkz. Tablo1) asetoziringon (20 mg/L) ve iyonik olmayan bir yüzey aktif madde (0,001% v/v) içeren bir optik yoğunluğa (OD600)~5'e ulaşmak için yeniden askıya alın.
NOT: Asetozlu stok çözeltisini %70 etanol de hazırlayın ve -20 °C'de saklayın. Non-iyonik yüzey aktif sızma ortamına eklemeden önce filtre sterilize edilmesi gerekir. - A. tumefaciens süspansiyon içinde ~ 1 cm uzunluğunda parçalar halinde hem kök ve petiole doku kesin, bu nedenle her iki tarafta taze yaralar oluşturma. 10-30 dakika için A. tumefaciens süspansiyon doku parçaları bırakın.
- Kökleme ortamını hazırlayın (bkz. Tablo1) ve otoklavlamadan sonra asetozedicion (20 mg/L) ekleyin. Steril bir filtre kağıdı üzerine kuru doku parçaları ve orta (~ 10 explants / plaka) üzerine yerleştirin. 21 °C'de 2 gün boyunca karanlıkta kuluçka plakaları.
NOT: Asetoziringon eklemeden önce ortamın ~60 °C'ye soğumasını bekleyin. - 2 gün sonra, mantar veya bariz bakteriyel kontaminasyon (A. tumefaciensdışında bakteri) için plakaları inceleyin. Kirlenmiş plakaların atılması gerekir.
- Sıvı SH-10 ortamı hazırlayın (bkz. Tablo1). Otoklavlamadan sonra polisorbat 20 (%0.01, v/v) ekleyin. Doku parçalarını polisorbat 20 içeren SH-10'un 10 mL'sine aktarın. En az 10 dakika bir süre boyunca, yavaşça doku yıkamak için her 2-3 dakika çalkalayın.
- Polisorbat 20 içeren taze SH-10 ile iki kez daha yıkayın. Bu zamanlarda yıkama basamamı başına 2-3 dk kuluçka süresi yeterlidir.
- Kökleme ortamını hazırlayın (bkz. Tablo1). Otoklavlamadan sonra, sefotaksim (300 mg/L) ve kanamisin (50 mg/L) ekleyin ve plaka dökün. İkincil dönüşümler için (transgenik kanamisin dirençli hatların dönüşümleri), higromisin (15 mg/L) seçimi uygular.
- Steril filtre kağıdı parçaları üzerine kuru doku parçaları. Daha sonra, adım 3.9 hazırlanan plakalara doku parçaları aktarın.
- 28 °C'de 7 gün boyunca kuluçka plakaları, 16 saat:8 saat gün:gece. Her 2 günde bir mantar veya bakteriyel kontaminasyon ve A. tumefaciensaşırı büyüme için plakaları kontrol edin. Kontaminasyon durumunda, enfekte olmayan parçaları yeni bir tabağa aktarın.
- 7 gün sonra doku parçalarını projenasyon ortamına aktarın (bkz. Tablo1) içeren sefotaksim (300 mg/L) ve kanamisin (50 mg/L). 28 °C'de, gece saat 16:8'de kuluçka plakaları. Transgenik sürgünler gelişene kadar plakaları haftada bir yenileyin. Sadece enfekte olmayan doku parçalarını taze tabaklara aktardığından emin olun. A. tumefacienstarafından büyümüş parçaları atın.
- Putatif transgenik sürgünler ≥1 cm uzunluğunda, kesme sürgünleri ve kültür onları bağımsız olarak cefotaksim (300 mg/L) ve kanamisin (50 mg/L) içeren yayılma ortamında. Sürgünlerin bağımsız dönüştürücüleri temsil etmesini sağlamak için, bir ekstronun her iki tarafından yalnızca tek bir çekim çekin.
- Vegetatively adım 5.2 altında açıklandığı gibi putatif-transgenik sürgünler yaymak.
4. Putatively-transgenik Sürgünler Genotipleme
- SgRNA tanıma sitesine (ler) yayılan tasarım astarları. PCR amplicon dizilimi için sgRNA tanıma sitesinden (lar) 150-250 bp uzakta astar seçin.
- Genotipli olmak için her transgenik sürgünden bir yaprak ucu (~5 mm) kesin. Ayrıca, bir vahşi tip kontrol örneği hasat.
- 4.1 adımda tasarlanan astarları ve bitki örneklerinden DNA'yı doğrudan yükseltmek için ticari bir kit kullanarak 50°L PCR reaksiyonları gerçekleştirin. Alternatif olarak, PCR reaksiyonları yüksek sadakat polimeraz kullanılarak saflaştırılmış DNA üzerinde yapılabilir.
- Ayrı PCR amplicons 1.5-2% agarose jel.
- Jel elektroforez sonuçları analiz edin. Orta ölçekli indellerin varlığını gösteren, yabani tipten farklı boyutlarda birden fazla bant (1 alelden fazla) ve PCR amplicon üreten numuneleri kontrol edin.
- Tam mutasyonları belirlemek için PCR amperatörü sıralı. Tek bir PCR amplicon üreten numuneler için PCR ürünleri doğrudan sıralanabilir. Jel elektroforezinden sonra 1 bandından fazla üretim yapan veya PCR amplicon'un doğrudan sıralanmasından sonra heterozigot gibi görünen örneklerin önce künt uçlu klonlama vektörü içine klonlanması gerekir. Daha sonra, örnekte bulunan tüm olası alelleri tanımlamak için her örnek için birden fazla klon sıralayın.
- Sıralama sonuçlarını ilgi genine hizala ve sgRNA hedef bölgesi(ler) yakınındaki mutasyonları kontrol etmek için hizalamayı inceleyin. Daha sonra, bu mutasyonların kare kayması oluşturup oluşturmadığını kontrol edin. > 2 alel içeren satırları ve çerçeve içi mutasyonları içeren çizgileri atın.
- Daha fazla analiz için birkaç satır seçin.
- Adım 5.2 altında açıklandığı gibi seçili satırları yayı.
- Çizgiler birkaç yeni sürgün geliştirdiğinde, ≥3 yaprak uçlarından yeni örnekler alın ve 4.3-4.7 adımlarını tekrarlayın. Aynı hattan gelen örneklerin her birinde bulunan mutasyonların ve orijinal PCR örneğinin aynı olup olmadığını belirleyin. Tüm örneklerde aynı mutasyonları sağlayan çizgiler homojen bir şekilde mutasyona uğrar ve daha fazla deney için kullanılabilir. Bu satırlar chimeric ile aynı sonuçları vermeyen satırları atın.
5. Köklü P. andersonii Plantlets'in Deney Eki olarak Hazırlanması
-
P. andersoniiyeni bir doku kültür hattı başlatın.
- Hasat aksilla tomurcukları, genç maceracı sürgünler veya sağlıklı ağaçlardan yaprak doku. Alternatif olarak, fide bir başlangıç malzemesi olarak kullanılabilir.
- 1:1-seyreltilmiş ticari çamaşır suyu kullanarak doku dezenfekte (seyreltme sonrası~ 2% hipoklorit) 15 dakika için polisorbat 20 birkaç damla içeren.
NOT: Bu adım, hem de, aşağıdaki adımları bir laminar downflow veya laminar crossflow kabine içinde doku steril tutmak için yapılması gerekir. - Dokuları yayılma ortamına aktarın (bkz. Tablo1). 28 °C, 16 saat:8 saat gün:gece 2 kat elastik sızdırmazlık folyo ve kuluçka plakaları ile yakın plakalar.
- Doku mantar veya bakteriyel kontaminasyon ücretsiz olduğundan emin olmak için ilk 2 hafta boyunca her birkaç günde bir plakaları inceleyin.
- Taze bir yayılma ortamı tabağına ~10 sürgün ler yerleştirerek dokuyu çoğaltın ve plakayı 2 kat elastik sızdırmazlık folyosu ile kapatın. 28 °C'de, gece saat 16:8'de kuluçka plakaları. Bu adımı her 4 haftada bir tekrarlayın.
- Sürgünler >1 cm uzunluğunda olduğunda, tabanlarındaki sürgünleri kesin ve kökleme ortamına yerleştirin (Bkz. Tablo1). Yaklaşık 10 sürgünler tek bir kökleme plaka üzerine yerleştirilebilir. Pozisyon, çekimin bazal ucunu ortama yerleştirerek dik ateş eder. Kökler, 28 °C' de, gece 16 saat:8 saat tesbitinden 10-14 gün sonra ortaya çıkar.
NOT: Tüm sürgünleri köklendirmeyin, ancak doku kültürü yayılımı için bir parça tutun (bkz. adım 5.2).
6. Tencerede P. andersonii Plantlets Nodulation
-
Rhizobium inoculum hazırlayın.
- Mesorhizobium plurifarium BOR26 tek bir koloniden 10 mL sıvı YEM ortamı (bkz. Tablo2) aşılayınız ve 28 °C'de 2 gün kuluçkaya yatırın.
NOT: M. plurifarium BOR2, P. andersoniinodülatları verimli bir şekilde olduğu için tercih edilir. Ancak, diğer rhizobium suşları da P. andersonii (örneğin Bradyrhizobium elkanii WUR325, Rhizobium tropici CIAT89926,27 veya Bradirizobium nodulation için kullanılabilir sp. Kelud2A4). - Daha büyük bir sıvı YEM ortamı hacmini aşılamak için 10 mL kültürünü kullanın. Bu kültürün hacmi aşılanmış olması gereken kapların sayısına bağlıdır.
- Sıvı EKM ortamı hazırlayın (bkz. Tablo 3, Tablo4). Hücreleri hasat etmek için 3.500 x g 10 dakika için bakteri kültürü santrifüj. Daha sonra, sıvı EKM bakteriyel pelet yeniden askıya (orijinal YEM kültürü ile yaklaşık aynı hacimde kullanın) ve optik yoğunluğunu belirlemek (OD600).
- Mesorhizobium plurifarium BOR26 tek bir koloniden 10 mL sıvı YEM ortamı (bkz. Tablo2) aşılayınız ve 28 °C'de 2 gün kuluçkaya yatırın.
- ~20 tencere için, 3 L sıvı EKM orta ve adım 6.1.3 hazırlanan rizobial süspansiyon ile inoculate hazırlayın. OD600 = 0,025 ulaşmak için.
- 1.250 g perlit ile rhizobia içeren EKM 3 L karıştırın. Daha sonra, steril yarı saydam polipropilen kaplar için bu karışımın 210 g ekleyin. Alternatif olarak, perlit yerine, nodulation tahliller için bir substrat olarak kum kullanın.
- Bitki 1-3 P. andersonii plantlets her tencerede. Ayrıca, CRISPR-control yapısı ile dönüştürülmüş P. andersonii plantlets içeren birkaç tencere hazırlamak (Ek Tablo 1bakınız). Deney sırasında su kaybını tespit edebilmek için birkaç tencere tartın. Kökleri ışığa maruz kalmaktan korumak için her tencerenin altını kapatın.
- Bir klimalı büyüme odasında kuluçka kapları (28 °C, 16 h:8 h day:night:gece) 4-6 hafta. Haftada bir kez, su kaybını belirlemek için birkaç tencere tartın. Su kaybı 10 mL'yi aşarsa, kaybı telafi etmek için ultra saf su ile tamamlayın.
- 4-6 hafta sonra, perlit kökleri temiz ve nodül numaralarını bir dürbün kullanarak nodül verimliliğini incelemek için belirleyin.
7. Plakalar üzerinde P. andersonii Plantlets Nodulation
-
Selofan membranlarını hazırlama 28. yıl.
- Selofan zarını 12 cm x 12 cm Petri kabına sığacak şekilde kesin. Sürgünlerin büyümesi için yer sağlamak için membranları üstten biraz daha kısa kesin.
- Selofan zarlarının geçirgenliğini artırmak için, 20 dk. Daha sonra, EDTA kaldırmak için demineralize su ile en az 6x durulayın EDTA çözeltisi (1 g / L) membranlar kaynatın.
NOT: Kuru membran su ile temas ettiğinde kırışıklık eğiliminde olduğu için, kuru membranları çözeltiye tek tek batırın. - Yuvarlak cam bir tabaksu su ince bir tabaka halinde yatay membranlar düzenleyin. Membranları iki kez otoklavlayarak sterilize edin.
- 1 otoklavlı selofan membranı agar katılaşmış EKM ortamı içeren 12 x 12 cm Petri kabına yerleştirin (bkz. Tablo 3, Tablo4). Membranın üstüne iki tane 3 haftalık köklü P. andersonii fidanları (bkz. bölüm 5) veya 4 haftalık fideler (bkz. bölüm 1.1) yerleştirin. Sadece bu kökleri hala büyüyen olduğunu belirten, beyaz kök ipuçları olan kökleri ile fidan veya fide almak için emin olun.
- Yavaşça bir sandviç tabakası oluşturarak, ikinci bir selofan membran ile kökleri kaplayın. Plakayı 3 kat elastik sızdırmazlık folyosu ile kapatın. Işık maruziyetinden kaynaklanan kökleri kapsayacak şekilde plakaların alt yarısını alüminyum folyo ile sarın.
- Tabakları 3-4 hafta boyunca iklimlendirilmiş bir büyüme odasında (28 °C, 16 saat:8 saat gündüz:gece) kuluçkaya yatırın. Kök uçlarının konumunu işaretleyin ve zaman içinde kök büyümesini takip edin.
- EKM plakaları uzun süreli kuluçka nedeniyle kurumaya başlarsa, bitkileri bakteriyel aşılamadan birkaç gün önce taze EKM plakalarına aktarın.
- Adım 6.1'de açıklandığı gibi bakteriyel inokülhazırlayın.
- Üst selofan zarını çıkarın ve köklere 1 mL rizobium kültürü (OD600 = 0.025) uygulayın. Daha sonra, aşılanmış kökleri yeni bir selofan membran yerleştirin. Işık maruziyetinden kaynaklanan kökleri kapsayacak şekilde alüminyum folyo kullanarak plakanın dışını sarın.
- 4 hafta sonra, nodül sayısını dürbün kullanarak inceleyin.
8. Poşetlerde P. andersonii Fidelerinin Nodülasyonu
- Bölüm 1.1'de açıklandığı gibi P. andersonii tohumlarının çimlenmesi. Cotyledons tam olarak ortaya çıktıktan sonra (28 °C'de SH-0 plakaları üzerinde~12 gün), fideler torbalara aktarın.
- Poşetleri hazırlamak için kağıt fitilinin katlanmış kısmını yırtın ve değiştirilmiş EKM ortamının 7 mL'sini ekleyin (Bkz. Tablo 3, Tablo4).
- Kağıt fitili ve kese ön plastik levha oluşturan kağıt her iki yaprak arasında kökleri yerleştirerek 1 veya 2 fide yerleştirin.
- Kese etrafında alüminyum folyo katlayarak, ışık maruz kalma kökleri kalkan. Yüksek nemi korumak için yarı saydam bir kapakla kaplı plastik bir kutudaki poşetleri askıya alın. Kutuyu iklimlendirilmiş bir büyüme odasına yerleştirin (28 °C, 16 saat:8 saat gün:gece).
- Kağıt fitil nemli kalır gibi steril ultra saf su ekleyerek su buharlaşma telafi (kesenin altında duran su kaçının). İlk haftadan sonra, bu genellikle her 4 günde bir 2-3 ml eklemeyi gerektirir.
- Adım 6.1'de açıklandığı gibi bakteriyel inokülhazırlayın.
- Poşetlerde 10-12 gün boyunca fideler yetiştirildikten sonra, 500 μL'lik rhizobium kültürü (OD600 = 0,025) ile kök sistemini aşılamak.
- Nodül oluşumunu zaman içinde takip edin. Dört hafta sonra aşılama, nodüller sayılabilir ve nodülasyon verimliliğini belirlemek için hasat.
9. Nodül Sitomimari Analizi
- Fiksatif içeren 2 mL tüpte 10-15 nodül toplayın (0,1 M fosfat tamponunda %5 glutaraldehit, pH 7.2). 1/2-1 saat vakum uygulayın ve 4 °C'de bir gecede kuluçkaya yatırın. Bu dönemde numuneler tüpün dibine batar.
NOT: Fiksatif çözelti ~2-4 hafta önceden kullanım için 4 °C'de saklanabilir. Doku fiksatif ile çalışırken eldiven giymek emin olun. - Nodülleri 0,1 M fosfat tamponu, pH 7.2 ile yıkayın. Her yıkama adımı arasında 10 dk aralıklar uygulayın.
- Daha sonra %30, %50, %70 ve %100 etanolde kuluçkaya yatarak numuneleri dehydrate. Örneklerden tüm suyun çıkarıldığından emin olmak için %100 etanol adım3x'i tekrarlayın. Her dehidratasyon adımı arasında 10 dk aralıklarla uygulayın.
- 100 mL HEMA (2-hidroksitil metakrilat) bazlı reçiy çözeltisi ile karıştırılmış 2,5 mL PEG400'a 1 paket Hardener I ekleyerek polimerizasyon karışımı I (PM-I) hazırlayın. Hardener I'i tamamen eritmek için ~15 dk çözeltisini karıştırın. Daha sonra PM-I'yi -20 °C'de saklayın.
- Adım 9.3'ten etanol çıkarın. ve aşağıdaki sırayla örneklere sızmak: PM-I:100% etanol (1:3, v/v), PM-I:100% etanol (1:1, v/v) ve PM-I:100% etanol (3:1, v/v). Her çözeltideki numuneleri 1/2-1 saat veya numuneler dibe banına kadar inkübe edin.
- İnkübasyon örnekleri bir gecede 4 °C'de %100 PM-I çözeltisinde.
- POLIMERizasyon karışımı II'yi PM-I ve Hardener II'yi 15:1 (v/v) oranında karıştırarak hazırlayın. Plastik kalıbı polimerizasyon çözeltisi ile doldurun, numuneleri kalıbın alt kısmında yatay olarak yönlendirin ve üzerini elastik sızdırmazlık folyosu ile kapatın. Hava kabarcıkları oluşumunu önlemek.
NOT: Çözelti RT'ye maruz kaldıktan sonra polimerleşmeye başladığında, numuneleri plastik tutucuya mümkün olan en kısa sürede yönlendirmeye çalışın. Polimerizasyon, RT'de gece kuluçkadan sonra veya 37 °C'de 1 saat sonra tamamlanır. - Elastik sızdırmazlık folyo kapağını adım 9.7'den çıkarın ve tutucuyu polimerize numunelere yerleştirin. Tutucuyu numunelere monte etmek için 10 mL metil metakrilat bazlı rezorin tozunu 5 mL metil metakrilat bazlı rezorçözelti çözeltisinde çözün. Çözeltiyi tutucunun üst kısmındaki deliğe hızlıca ekleyin.
NOT: Duman kaputunda polimerizasyon adımını gerçekleştirin (RT'de ~30 dk). - 4-5 μm kalınlığa mikrotome kesit örnekleri 58 °C hot plate üzerine bir mikroskop slayt yerleştirin ve her slayt için su büyük bir damla ekleyin. Bölümleri suyun üstüne yerleştirin. Su buharlaştıktan sonra, kesitler kaydırakça yapışır.
- 2 dakika boyunca % 0,05 (w/v) toluidin mavisine batırarak lekeler. Daha sonra, ultra saf su ile 3x durulayın. Slaytlar parlak alan mikroskobu kullanılarak gözlemlenebilir.
10. P. andersonii Plantlets Mycorrhization
-
Rhizophagus irregularis spores'in inokülini hazırlayın
- Aşağıdaki boyutlarda (yukarıdan aşağıya) sahip bir yığın polyester dokuma filtre hazırlayın: 210 μm, 120 μm ve 36 m mesh boyutu.
- Pipet polyester filtreler yığını üzerine ticari bir spor süspansiyon gerekli miktarda. Filtreleri 100 mL otoklavlı demineralize su ile 3x durulayın. Sporlar 36 μm filtrenin yüzeyinde tutulur.
NOT: Kontaminasyonu önlemek için laminar çapraz akış kabininde spor süspansiyonunu hazırlayın. - Polyester yığınını sökün ve sadece 36 μm filtreyi saklayın. Otoklavlı demineralize su ile yıkama adımını en az 6x tekrarlayın.
- Filtreyi petri kabına yerleştirin ve sporları otoklavlı demineralize suda yeniden askıya alın. Adım 10.1.2'de kullanılan spor süspansiyonunun hacmine eşit bir su hacmi kullanın. Spor süspansiyonuna pipetleme ile steril bir boruya aktarın.
- Bir cam kaydırağa spor süspansiyonunun 20°L'lik 5 damlasını yerleştirin ve parlak alan mikroskobu kullanarak spor ların sayısını sayın. Spor sayılarını spor/mL oranına dönüştürün ve 250 spor/mL'ye ulaşana kadar spor süspansiyonuna seyreltin. Spor süspansiyonunu 4 °C'de saklayın.
- Mycorrhization tayini gerçekleştirin. Bu amaçla, steril yarı saydam polipropilen tencere için 1/2-Hoagland orta 70 mL ile desteklenen otoklavlı kum 800 g ekleyin (Tablo 5bakınız -6). Kum ve orta yı doğrudan tencerede şiddetle sallayarak karıştırın.
- Her tencereye bir P. andersonii plantlet ve spor süspansiyonunun pipet 1 mL'sini doğrudan P. andersonii bitkisinin köküne yerleştirin. CRISPR kontrol yapısıyla dönüştürülmüş P. andersonii plantlets içeren birkaç tencere içerdiğinden emin olun (Ek Tablo1'e bakınız).
- 6 hafta boyunca bir klimalı büyüme odasında (28 °C, 16 h:8 h day:night:gece) kuluçka kapları.
- Tencere bitkileri çıkarın ve mümkün olduğunca çok kum kaldırmak için akan su ile kökleri yıkayın.
- Kökleri 1 cm uzunluğunda parçalar halinde kesin ve kök parçalarını %10 KOH (w/v) halinde 90 °C'de 20 dk kaynatın. Daha sonra, 100 μm örgü boyutu ile bir hücre süzgeci üzerine haşlanmış kökleri yerleştirin ve 50 mL su ile 3x durulayın.
- Bir su banyosunda veya ısıtma bloğunda 90 °C'de 5 dk için %0,05 (w/v) laktogliserol (300 mL laktik asit; 300 mL gliserol; ve 400 mL demineralize su) ile leke kökleri. Daha sonra,% 30 gliserol kökleri transfer. Kök örnekleri RT'de depolanabilir.
- Tek bir mikroskop slaytına 15-25 kök parçası yerleştirin. % 30 gliserol ekleyin ve bir kapak cam ile kapak ve kök parçaları düz hale kadar basın. Parlak alan mikroskobu kullanarak kök parçalarını gözlemleyin ve mikorhizal kolonizasyonu skor.
NOT: Trouvelot ve ark. 29'a göremicorrhization skoru için kullanılan bir yöntem tanımlanmıştır. Bu yöntem, her kök parçasının mikoritik kolonizasyon seviyesinin hızlı bir şekilde tahmin edilebisve arbuskül bolluğu sağlayan çeşitli sınıflar (%F, %M ve %A) kullanır.
Representative Results
P. andersonii trees 28 °C ve ~% 85 bağıl nem (Şekil1A)şartlı serada yetiştirilebilir. Bu şartlar altında ağaçlar dikimden 6-9 ay sonra çiçeklenmeye başlarlar. Dişi P. andersonii çiçekleri her biri tek bir tohum içeren meyveleri üretir. Olgunlaşma sırasında, çilek renk değiştirir; önce yeşilden beyaza, daha sonra beyazdan kahverengiye (Şekil1B). Olgunlaşmış kahverengi meyvelerden elde edilen tohumlar, 10 günlük sıcaklık döngüsü nden ve SH-0 plakalarında 7 günlük kuluçkadan sonra iyice çimlenir (Şekil1C). Çimlenmiş tohumlar ~ 4 hafta sonra deney için kullanılabilir genç fideler haline gelişmeye devam (Şekil1D).
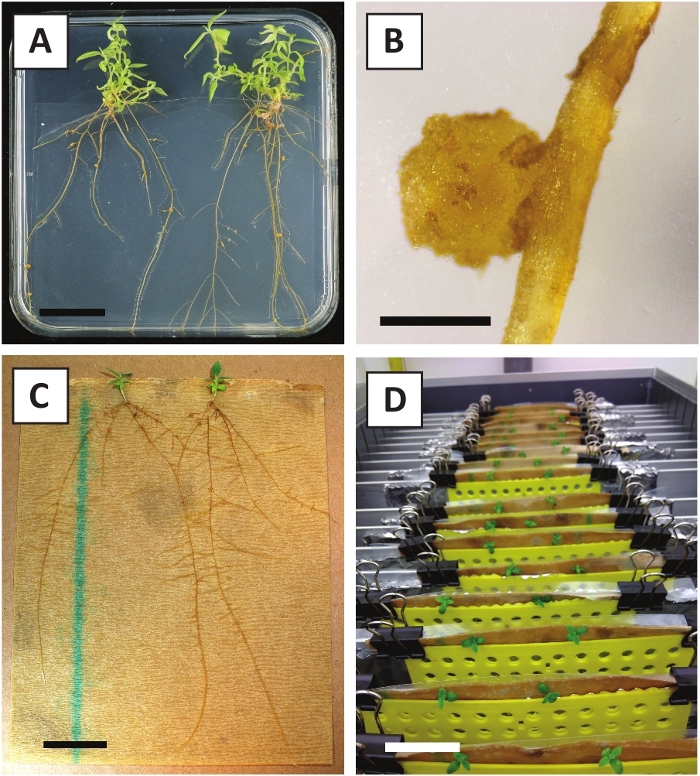
Daha önce genç P. andersonii saplarının petiollerinin ve segmentlerinin A. tumefaciens zorlanma AGL110kullanılarak verimli bir şekilde dönüştürülebileceğini göstermiştir. Dönüşüm işleminin başlangıcında doku eksplandisi 21 °C'de 2 gün boyunca A. tumefaciens (Şekil2A)ile birlikte yetiştirilir. Uzun süreli birlikte ekim, doku eksedelerinin A. tumefaciens tarafından aşırı kolonizasyonuna neden olur ve bu nedenle önlenmelidir (Şekil 2B). Ortak ekim döneminden sonra, doku ekspertisi selektif ortama aktarılır, bu da dönüştürülmüş dokunun büyümesini teşvik eder. İki ila üç hafta sonra, küçük yeşil mikro-calli genellikle orijinal yara yüzeyi boyunca gözlenir (Şekil2C). Bu calli, dönüşüm prosedürü başlatıldıktan 6-8 hafta sonra 1 veya daha fazla putatif olarak dönüştürülmüş sürgünler geliştirmeye ve büyümeye devam etmelidir (Şekil2D). Bu aşamada, dönüşüm verimliliği genellikle olgun ve kısmen odunsu dallardan alınan doku ekspları ile başlatılan dönüşümler için~10-30% arasında değişmektedir (Tablo 7). Henüz çiçek taşımayan dalların genç ve hızla büyüyen uçlarından alınan eksültasyonlarla dönüşümler başlatılırsa , ~65-75% dönüşüm verimliliği elde edilebilir (Tablo7). Bazen, beyazımsı calli orta ile temas halinde olmayan bir eksplant tarafında oluşur ve bu nedenle, kanamisin seçimi deneyimi yok. Bu calligenellikle transgenik değildir ve bu calli oluşan herhangi bir sürgünler genellikle çamaşır suyu ve kanamisin içeren orta ile doğrudan temas tan sonra ölür (Şekil2E). Dönüşüm oranının düşük olması ve/veya başlangıç materyalinin suboptimal olması durumunda, doku parçaları kahverengiye dönüşebilir (Şekil2F) ve A. tumefaciens (Şekil2G)tarafından aşırı çoğalma görülebilir. A. tumefaciens yayılmasını önlemek için ve yakındaki ekstesyenler overgrowing, orta düzenli ferahlık gereklidir, ve ciddi enfekte eksültüle çıkarılması gerekir. Bireysel transgenik sürgünler yayılma ortamına yerleştirildikten sonra, A. tumefaciens tarafından aşırı çoğalma genellikle artık oluşmaz (Şekil2H). Transgenik sürgünler in vitro yayılım yoluyla çarpılabilir, bu da bir aylık bir süre içinde onlarca sürgüne yol açar (Şekil3A-B). Bu sürgünler ~ 2 hafta sonra kök oluşumunu neden olmalıdır kökleme orta, yerleştirilebilir (Şekil3C-D). Köklü plantasyonlar daha sonra deney için kullanılabilir.
Nakavt mutant hatları oluşturmak için, CRISPR / Cas9 aracılı mutagenez yararlanmak. Bu amaçla, kanamisin direnç geni NPTIIiçeren bir ikili vektör kullanmak , Bir Cas9 kodlama dizisi CaMV35S organizatörü ve 2 sgRNA hedef gen başına atU6pküçük RNA organizatörü ifade edilmektedir 2. P. andersonii'nin CRISPR/Cas9 aracılı mutagenezi için kullanılan yapının grafiksel gösterimi Şekil 4A'daverilmiştir. Bu yöntem kullanılarak, genom düzenleme putatif olarak dönüştürülmüş sürgünler ~% 40 gözlenir10. Mutant hatları tanımlamak için, putatif olarak dönüştürülmüş sürgünler, hedeflenen bölgeye yayılan astarlar kullanılarak sgRNA hedef bölgesinde mutasyonlar için genotiplenir. Beklenen sonuçların bir örneği Şekil4'te verilmiştir. Jel elektroforezinden sonra çekilen fotoğraftan da görüleceği gibi, çeşitli örnekler yabani tipe benzer büyüklükte bir PCR amplicon üretir (Şekil4B). Bu bitkiler agarose jel elektroforezi ile görüntülenemeyen veya Cas9 enzimi tarafından düzenlenmemiş kalan küçük indeller içerebilir. Ayrıca, çeşitli örnekler, vahşi tipten farklı boyutlarda bantlar verir (örneğin, Şekil 4B'dekisatır 2, 4, 7 ve 8). Bu satırlarda, 1 (satır 4, 7 ve 8) veya her ikisi (satır 2) aleller kolayca görüntülenebilen daha büyük indeller içerir. Hedef alandaki mutasyonların tam niteliği PCR amplicon dizilimi nden sonra ortaya konur. Şekil4C'den de görülebileceği gibi, hem 1-4 bp'lik küçük indeller, hem de CRISPR/Cas9 mutagenezinden sonra daha büyük silmeler elde edilebilir. Şekil4C'de, satır 1'in sırası, bu satırın düzenlemeden kaçtığını ve bu nedenle atılması gerektiğini belirten vahşi türle aynıdır. Mutasyon içeren çizgiler arasında heterozigot, homozigot ve çift allelik mutantlar saptanabilir (Şekil4C). Ancak, heterozigot mutantlar genellikle nadirdir10. Homozigot veya çift allelic nakavt mutantlar vegetatively phenotik analiz için yeterli malzeme elde etmek için yayılabilir. T0 kuşağında henotik analiz yapıldığından mutant hatlarının chimeric olup olmadığını nisbeten kontrol etmek önemlidir. Bu amaçla, genotipleme her mutant hattından alınan en az 3 farklı örnek üzerinde tekrarlanması gerekir. Genotipleme sonuçları birbiriyle aynı ysa ve orijinal genotipleme örneği (şekil 4D'deki 8. satır) çizgi homojen bir şekilde mutasyona uğrar ve daha fazla analiz için kullanılabilir. Ancak, genotipleme sonuçları bağımsız örnekler arasında farklılık gösterirse (örneğin, Şekil 4D'dekisatır 4), mutant çizgisi chimerictir ve atılması gerekir.
P. andersonii'nin M. plurifarium BOR2 ile aşılanması kök nodüllerinin oluşumuna neden olabilir (Şekil 5). Şekil5A'da da görüleceği gibi, bu nodüller kök sistemi boyunca dağıtılır. P. andersonii nodülleri açık kahverengi renktedir ancak şekillerine göre kök dokusundan kolayca ayırt edilebilirler (Şekil 5B). Saksılarda aşılama deneyleri ve 4-6 hafta sonraki büyüme genellikle ~10-30 nodül oluşumuna neden olabilir (Şekil6A). Benzer sayıda nodül, ekm plakalı p. andersonii bitkilerinin aşılamadan 4 hafta sonra aşılanmasından sonra oluşur (Şekil6A). Poşetlerde, P. andersonii fideleri genellikle 5 hafta sonra aşılamada ~5-15 nodül oluştururlar (Şekil5C-D, 6A). Nodül sitomimarisini analiz etmek için nodüller kesitlenebilir ve parlak alan mikroskobu ile gözlenebilir. Şekil 6B, P. andersonii nodülünün ortasından boylamsal bir kesit örneği gösterir. Bu bölümde, enfekte hücreleri içeren nodül lobları ile çevrili bir P. andersonii nodülün merkezi vasküler demeti gösterilmektedir (Şekil6B).
P. andersonii plantlets de mycorrhized olabilir. R. irregularisile 6 haftalık aşılamadan sonra, mikorhizal kolonizasyon sıklığı genellikle %> %80'e ulaşır (Şekil 6C). Bu noktada, genellikle ~ 30% hücrelerin arbuscules içerir (Şekil6C). Arbuscles içeren p. andersonii kök segmentinin temsili bir görüntüsü Şekil 6D'degösterilmiştir.

Şekil 1: Bir temsili görüntüler P. andersonii ağacı, tohumları ve fideleri. (A) 28 °C'de şartlandırılmış bir serada çömlekçilik toprağında yetiştirilen altı aylık P. andersonii ağacı. (B) Olgunlaşmanın çeşitli aşamalarında P. andersonii meyveleri gösteren temsili resim. Genç P. andersonii meyveleri (olgunlaşmamış) olgunlaştıktan sonra yeşilden beyaza ve nihayet kahverengiye (olgunlaşmış) renk değiştirecek. (C) P. andersonii tohumları SH-0 orta 1 hafta kuluçka. Siyah bir daire çimlenmiş bir fide gösterir. (D) Sh-0 orta bölgesinde yetiştirilen dört haftalık P. andersonii fideleri. Ölçek çubukları 25 cm inç(A) ve 1 cm inç(B-D)eşittir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
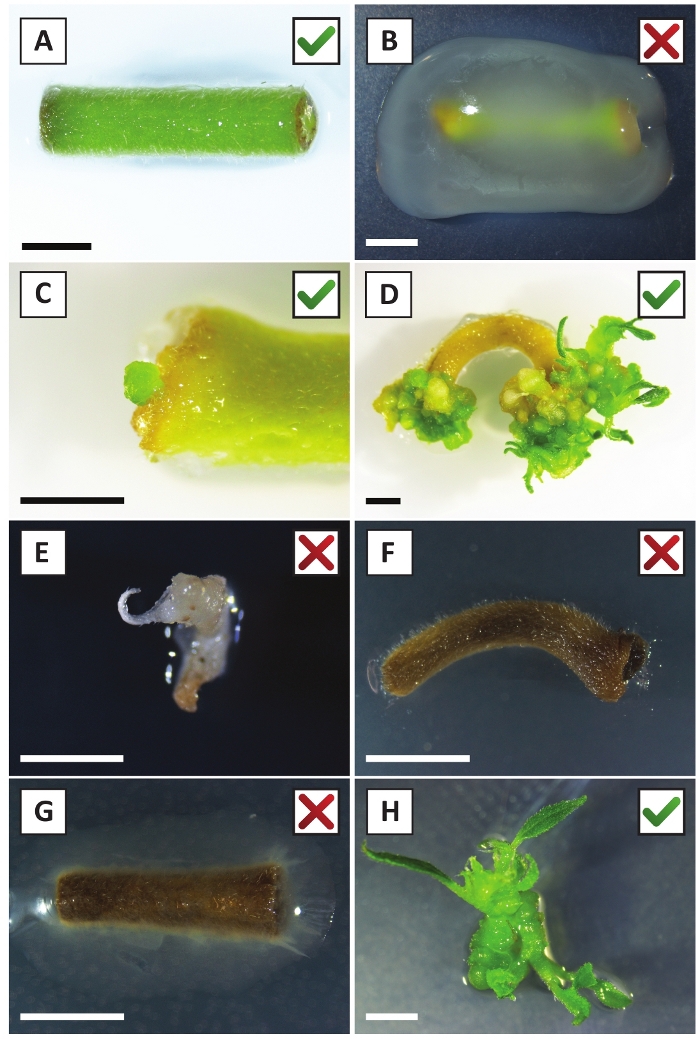
Şekil 2: Kararlı dönüşüm prosedürünün farklı aşamalarında eksebitkilerin temsili görüntüleri. (A) Explant a. tumefaciensile birlikte yetiştirilen . (B) Explant A. tumefaciens tarafından dönüşüm sonrası ilk 2 hafta boyunca büyümüş. (C) Transgenik mikro-kandus, birlikte ekimden 2,5 hafta sonra bir eksplantın yara bölgesi yakınında oluşur. (D) (transgenik) calli sürgünlerin ortaya çıkışını gösteren 6 hafta sonra bir eksplantın temsili görüntüsü. (E) Beyazımsı hale gelen ve kanamisin içeren ortamla doğrudan temas ettiğinde ölen bir çekimin temsili görüntüsü. Bu ateş büyük olasılıkla non-transgenik ve eksplant bağlı kanamisin seçimi kaçtı. (F) Başarısız bir şekilde dönüştürülmüş eksplantın temsili görüntüsü. (G) A. tumefacienstarafından aşırı büyümüş başarısız bir explant temsili görüntü . (H) Tek transgenik ateş 8 hafta sonra a. tumefaciensile birlikte ekimi sonrası yayılım orta büyüdü . Ölçek çubukları eşittir 2,5 mm. Yeşil onay işaretleri veya kırmızı haçlar içeren kutular, sırasıyla eksebitkilerin başarılı veya başarısız dönüşümlerini gösterir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.

Şekil 3: Temsili görüntüler in vitro yayılma. (A) Yayılma ortamıüzerinde yetiştirilen sürgünler. Görüntü, plakalar yenilendikten 1 hafta sonra çekildi. (B) Yayılma ortamıüzerinde yetiştirilen sürgünler. Görüntü, plakalar yenilendikten 4 hafta sonra çekildi. (C) Kökleme ortamına yerleştirilen taze kesilmiş sürgünler. (D) 2 hafta boyunca kökleme ortamında kuluçkaya yatırılatır. Köklerin varlığına dikkat edin. Ölçek çubukları 2,5 cm'ye eşittir.
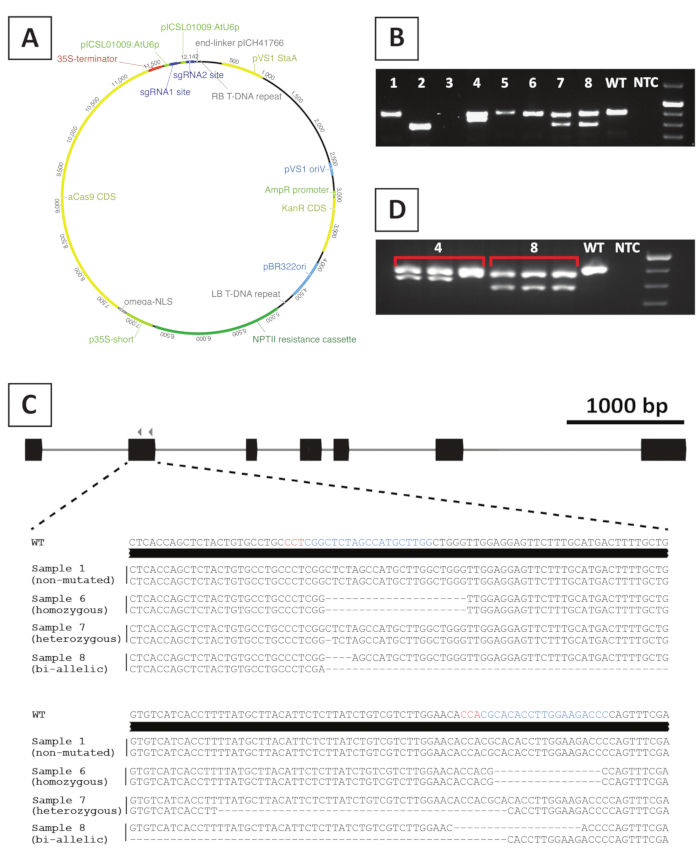
Şekil 4: P. andersonii T0 transgenik CRISPR/Cas9 mutant hatlarının genotiplemesi sonrası temsili sonuçlar. (A) P. andersonii'ninCRISPR/Cas9 aracılı mutagenezi için kullanılan ikili vektörün temsili haritası. (B) SgRNA hedef bölgesine (s) yayılan astarlar kullanarak potansiyel CRISPR/Cas9 mutant hatlarının PCR tabanlı genotiplemeden sonra temsili sonuç. Gösterilen amfuzların agarose jel elektroforezi sonra bir görüntüdür. Tek tek transgenik hatlardan alınan örnekler sayılarla gösterilir. Joker türü (WT) ve şablon denetimi (NTC) sırasıyla pozitif ve negatif denetimler içeren şeritleri gösterir. (C) CRISPR/Cas9 aracılı gen düzenlemesinden sonra elde edilen mutant alellerin şematik gösterimi. Mavi ve kırmızı renklerde vurgulanan sgRNA hedef siteleri ve PAM dizileri, sırasıyla vardır. (D) Potansiyel simerik mutant hatları için PCR tabanlı taramadan sonra temsili sonuç. Gösterilen mutant hatları 4 ve 8 alınan 3 ayrı örneklerin agarose jel elektroforezi sonra bir görüntüdür. Transgenik mutant hattı 4'ün chimeric olduğunu unutmayın. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
Şekil 5: Tabak ve keselerde burun sataşan resmi. (A) Agar katılaşmış EKM orta içeren ve 4 hafta boyunca M. plurifarium BOR2 ile aşılanmış plakalar üzerinde nodulation. (B) P. andersonii kök nodülünün temsili görüntüsü. Görüntü M. plurifarium BOR2 ile 4 hafta sonrası aşılama alınmıştır. (C) Sıvı EKM orta içeren torbalarda nodulation. Fideler 5 hafta boyunca Bradirizobium sp. Kelud2A4 ile aşılandı. (D) Keselerde nodulation için kullanılan tam bir kurulum temsili görüntü. Ölçek çubukları 2,5 cm içinde(A,C),1 mm in (B), 5 cm 'ye (D) eşittir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
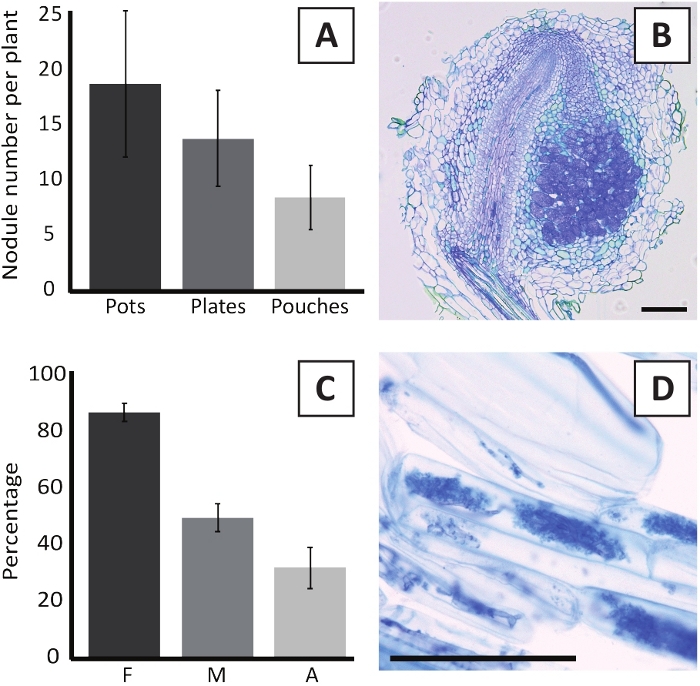
Şekil 6: Nodulation ve micorrhization tahlillerinin temsili sonuçları. (A) Bitki başına 4 hafta sonra kaplarda veya tabaklarda M. plurifarium BOR2 ile aşılama sonrası ve torbalarda Bradyrhizobium sp. Kelud2A4 ile 5 hafta sonrası aşılama da oluşan nodül sayısını gösteren temsili çubuk grafiği. Veriler ortalama ± SD'yi temsil eder (n = 10). (B) M. plurifarium BOR2 ile 4 hafta sonra aşılama sonrası oluşan bir nodül ile boylamsal bir bölümün temsili görüntüsü. Bölüm toluidin mavisi ile boyanmıştır. (C) Mikordemin niceliğini gösteren temsili çubuk grafiği. Trouvelot ve ark. 29'a göre ölçülen değişkenler, analiz edilmiş kök parçalarının mikorderize edilmiş frekansı olan F'dir; M, enfeksiyonun şiddeti; A, toplam kök sisteminde olgun arbuscules bolluğu. Mycorrhization R. irregularis (zorlanma DAOM197198) ile 6 hafta sonrası aşılama sayısallaştırılmıştır. Veriler ortalama ± SD'yi temsil eder (n = 10). (D) P. andersonii kök kortikal hücrelerinde bulunan olgun arbusküllerin temsili görüntüsü 6 hafta sonra R. irregularisile aşılama sonrası . Ölçek çubukları 75 μm'ye eşittir. Bu rakamın daha büyük bir sürümünü görüntülemek için lütfen buraya tıklayın.
| Bileşik | SH-0 | SH-10 | Yayılma ortamı | Kökleme orta | Sızma ortamı |
| SH-bazal tuz orta | 3.2 g | 3.2 g | 3.2 g | 3.2 g | 3.2 g |
| SH-vitamin karışımı | 1 g | 1 g | 1 g | 1 g | 1 g |
| Sakaroz | - | 10 g | 20 g | 10 g | 10 g |
| BAP (1 mg/mL) | - | - | 1 mL (4,44 μM) | - | - |
| IBA (1 mg/mL) | - | - | 100 μL (0,49 μM) | 1 mL (4,92 μM) | - |
| NAA (1 mg/mL) | - | - | - | 100 μL (0,54 μM) | - |
| 1 M MES pH=5.8 | 3 mL | 3 mL | 3 mL | 3 mL | 3 mL |
| 1 M KOH | pH'ı 5,8'e ayarlama | pH'ı 5,8'e ayarlama | pH'ı 5,8'e ayarlama | pH'ı 5,8'e ayarlama | pH'ı 5,8'e ayarlama |
| Daishin ağar | 8 g | - | 8 g | 8 g | - |
Tablo 1: P. andersonii fidelerinin yetiştirilmesinde kullanılan Schenk-Hildebrandt tabanlı30 ortamın bileşimi, kararlı dönüşüm ve in vitro yayılım. Sıvı stokları eklemeden önce katı bileşikleri 750 mL ultra saf suya çözün. Daha sonra, 1 L. 0,1 M KOH VE -20 oC de saklamak BAP, IBA, NAA stokları hazırlamak için tam orta doldurun.
| Otoklavlamadan önce: | ||
| Bileşik | Litre başına miktar | Son konsantrasyon |
| Mannitol | 5 g | 27,45 mM |
| Na-Glukonat | 5 g | 22,92 mM |
| Maya özü | 0,5 g | - |
| MgSO4·7H2O | 0,2 g | 0,81 mM |
| Nacl | 0,1 g | 1,71 mM |
| K2HPO4 | 0,5 g | 2,87 mM |
| Otoklavlamadan sonra: | ||
| Bileşik | Litre başına miktar | Son konsantrasyon |
| 1,5 M CaCl2 | 1 mL | 1,5 mM |
Tablo 2: Rhizobium büyümek için kullanılan Maya-Mannitol (YEM) ortamının bileşimi. pH'ı 7.0'a ayarlayın ve ultra saf suyla 1 L'ye doldurun. Agar katılaşmış YEM ortamını hazırlamak için, otoklavlamadan önce 15 g mikroagar ekleyin.
| Otoklavlamadan önce: | |||
| Bileşik | Stok konsantrasyonu | Litre orta başına miktar | Son konsantrasyon |
| KH2PO4 | 0.44 M | 2 mL ekle | 0,88 mM |
| K2HPO4 | 1.03 M | 2 mL ekle | 2,07 mM |
| 500x mikro elemanlı stok çözeltisi | - | 2 mL ekle | - |
| MES pH=6.6 | 1 M | 3 mL ekle | 3 mM |
| Hcl | 1 M | pH'ı 6,6'ya ayarlama | - |
| Ultra saf su | - | 990 mL'ye doldurma | - |
| Otoklavlamadan sonra: | |||
| Bileşik | Stok konsantrasyonu | Litre orta başına miktar | Son konsantrasyon |
| MgSO4·7H2O | 1.04 M | 2 mL | 2,08 mM |
| Na2SO4 | 0.35 M | 2 mL | 0,70 mM |
| NH4NO3 | 0.18 M | 2 mL | 0,36 mM |
| CaCl2·2H2O | 0.75 M | 2 mL | 1,5 mM |
| Fe(III)-sitrat | 27 mM | 2 mL | 54 μM |
Tablo 3: P. andersonii nodulation tsay için kullanılan 1 L modifiye EKM orta31 bileşimi. 500x mikro elementsi stok çözeltisinin bileşimi Tablo 4'te listelenmiştir. %2 agar katılaşmış EKM ortamı hazırlamak için, otoklavlamadan önce 20 g Daishin agar ekleyin. Otoklav MgSO4·7H2O, Na2SO4,CaCl2·2H2O, ve Fe(III)-sitrat stokları sterilize etmek. Filtre sterilize NH4NO3 stok çözeltisi sterilize etmek sterilize.
| Bileşik | Litre başına miktar | Stok konsantrasyonu |
| MnSO4 | 500 mg | 3.31 mM |
| ZnSO4·7H2O | 125 mg | 0,43 mM |
| CuSO4·5H2O | 125 mg | 0,83 mM |
| H3BO3 | 125 mg | 2,02 mM |
| Na2MoO4·2H2O | 50 mg | 0,21 mM |
Tablo 4: Modifiye EKM ortamının hazırlanmasında kullanılan 500x mikro elemanlı stok çözeltisinin bileşimi. Mikro elemanlar stok çözeltisini 4 °C'de saklayın.
| Bileşik | Stok konsantrasyonu | Litre orta başına miktar | Son konsantrasyon |
| K2HPO4 | 20 mM | 1 mL | 0,2 mM |
| NH4NO3 | 0.28 M | 10 mL | 2,8 mM |
| MgSO4 | 40 mM | 10 mL | 0,4 mM |
| K2SO4 | 40 mM | 10 mL | 0,4 mM |
| Fe(II)-EDTA | 9 mM | 10 mL | 0,9 mM |
| CaCl2 | 80 mM | 10 mL | 0,8 mM |
| 50x mikro elemanlı stok çözeltisi | - | 10 mL | - |
Tablo 5: Mikordezizasyon tahlillerinde kullanılan 1/2-Hoagland32 ortamının bileşimi. 50x mikro elementsstok çözeltisinin bileşimi Tablo 6'da listelenmiştir. FeSO4·7H2O (9 mM) ve Na 2'yi birleştirerek Fe(II)-EDTA çözeltisini hazırlayın · EDTA (9 mM) içine 1 stok çözeltisi ve 4 °C'de saklayın. 1 M KOH kullanarak ortamın pH'ını 6,1'e ayarlayın ve ultra saf suyla 1 L'ye doldurun.
| Bileşik | Litre başına miktar | Stok konsantrasyonu |
| H3BO3 | 71.1 mg | 1,15 mM |
| MnCl2·4H2O | 44.5 mg | 0,22 mM |
| CuSO4·5H2O | 3.7 mg | 23,18 μM |
| ZnCl2 | 10.2 mg | 74,84 μM |
| Na2MoO4·2H2O | 1.2 mg | 4,96 μM |
Tablo 6: 1/2-Hoagland ortamının hazırlanmasında kullanılan 50x mikro elementli stok çözeltisinin bileşimi.
| Eksbitki yaşı | Dönüşüm verimliliği |
| Genç | 69.4 ± %6.2 (n = 2) |
| Olgun | 18.3 ± %10.2 (n = 15) |
Tablo 7: P. andersoniidönüşüm verimliliği . Burada dönüşüm verimliliği, en az 1 transgenik nasır oluşturan eksültörlerin yüzdesi olarak tanımlanır. Dönüşüm verimliliği dönüşüm sonrası 6 hafta olarak puanlandı ve ortalama ± SD. n olarak gösterilmiştir.
Ek Dosya 1: CRISPR/Cas9 mutagenezi için kullanılan düzey 1 ve düzey 2 yapılarına genel bakış. Bu dosyayı indirmek için lütfen buraya tıklayınız.
Discussion
Baklagiller ve uzaktan ilişkili Cannabaceae cinsi Parasponia, azot sabitleme rizobiası ile endosimbiyotik ilişki kurabilen ve kök nodülleri oluşturabilen bitki türlerinin sadece iki clad'ını temsil eder. Her iki clades türleri arasındaki karşılaştırmalı çalışmalar son derece bu simbiyoz sağlayan çekirdek genetik ağlar içine anlayışlar sağlamak için ilgilidir. Şu anda, genetik çalışmalar ağırlıklı olarak baklagiller yapılır; özellikle iki model tür M. truncatula ve L. japonicus. Ek bir deneysel platform sağlamak ve bir nodulating olmayan baklagil ile karşılaştırmalı çalışmaları kolaylaştırmak için, burada p. andersoniiistikrarlı dönüşüm ve ters genetik analizler için ayrıntılı bir protokol açıklar. Sunulan protokolde T0 transgenik P. andersonii hatlarının in vitro yayılımı, A. tumefaciens co-cultivation'dan sonra 4 ay içinde fenotipik analize başlanmasına olanak tanımıştır. Bu baklagiller33istikrarlı dönüşümü için kurulmuş olan mevcut protokoller önemli ölçüde daha hızlıdır. Bu P. andersonii çekici bir araştırma modeli yapar.
Burada açıklanan protokol birkaç kritik adım içerir. Bunlardan ilki tohum çimlenmesiyle ilgilidir. Çimlenme için P. andersonii tohumları hazırlamak için, tohumlar meyveleri izole edilmesi gerekir. Bu bir kağıt mendil parçası veya bir çay elek içine karşı çilek sürtünme tarafından yapılır. Bu işlemin, tohum katın zarar görmesini önlemek için nazikçe yapılması gerekir. Eğer tohum kat zarar görürse, çamaşır suyu sterilizasyon sırasında tohum girebilirsiniz, hangi tohum canlılığını azaltır. Tohum atıllığını kırmak için tohumlar 10 günlük sıcaklık döngüsüne tabi tutulur. Ancak, bu tedaviye rağmen, çimlenme tamamen senkronize değildir. Genellikle, ilk tohumları radicle ortaya çıkması göstermek 7 gün sonra, ama diğerleri çimlenmek için birkaç gün daha uzun sürebilir.
Dönüşüm prosedüründeki kritik noktalar başlangıç materyalinin seçimi ve ortak yetiştirme adımının süresi ile ilgilidir. Verimli dönüşümulaşmak için, başlangıç malzemesi olarak steril olmayan sera yetiştirilen bitkilerin sağlıklı ve genç kaynaklanıyor veya petioles kullanmak en iyisidir. Genç dalların büyümesini sağlamak için, parasponia ağaçlarını her 2-3 ayda bir kesmeniz ve yılda bir kez ağaçları yenilemeleri tavsiye edilir. Ayrıca, ortak yetiştirme adımı sadece 2 gün için yapılmalıdır. Uzun süreli birlikte yetiştirme A. tumefaciens tarafından doku ekbitkileri aşırı kolonizasyon teşvik ve genellikle dönüşüm verimliliğini azaltır. A. tumefaciens tarafından aşırı kolonizasyon önlemek için de düzenli olarak eksültasyon ekili olan plakaları yenilemek için önemlidir. Aşırı kolonizasyon meydana gelirse, doku eksperiler yıkanabilir (Bkz. Bölüm 3.8) A. tumefaciens hücreleri kaldırmak için. Yıkamada kullanılan SH-10 çözeltisine çamaşır suyu eklemenizi tavsiye ederiz (son konsantrasyon: ~%2 hipoklorit). Bu ek yıkama adımının ağır enfekte ekbitkilerde işe yaramayabileceğini unutmayın (Şekil 2B). CRISPR/Cas9 yapısı ile yapılan bir dönüşümün sadece sınırlı sayıda putatif olarak dönüştürülmüş sürgünler üretmesi veya belirli bir genin mutagenezinin rejenerasyonda sorunlara yol açması bekleniyorsa, boş bir vektör kontrol yapısının pozitif kontrol. Son olarak, seçilen tüm transgenik çizgilerin bağımsız T-DNA tümleştirme olaylarından kaynaklandığından emin olmak önemlidir. Bu nedenle, bir eksplantın her iki tarafından sadece tek bir putatif-transgenik çekim almak için talimat. Ancak, bunun potansiyel bağımsız hat sayısını azalttığının farkındayız. Birçok satır gerekirse, araştırmacılar bu calli 'nin ≥2 mm boyutu ve kültürü bu calli bağımsız olduğunda putatif olarak dönüştürülmüş calli'yi orijinal ekspekten ayırmaya karar verebilirler. Bu şekilde, her eksplanttan birden fazla hat izole edilebilir, bu da potansiyel transgenik çizgilerin sayısını yükseltir.
Mevcut protokolde P. andersonii'nin transgenik çizgileri in vitro yayılım yoluyla bitkisel olarak yayılır. Bunun avantajı birçok transgenik plantlets nispeten kısa bir süre içinde oluşturulabilir olmasıdır. Ancak, bu yöntemde de çeşitli sınırlamalar vardır. Öncelikle, in vitro yayılım yoluyla T0 transgenik hatların bakımı emek yoğun ve istenmeyen genetik veya epigenetik değişikliklere neden olabilir34,35. İkinci olarak, T0 çizgileri hala Antibiyotik direnci kaseti de dahil olmak üzere T-DNA'sının bir kopyasını içerir. Bu, her yeniden dönüştürme için farklı seçim işaretleri gerektiğinden, olası yeniden dönüşüm lerin sayısını sınırlar. Şu anda, biz sadece kanamisin veya higromisin seçimi (veri gösterilmez) kullanarak dönüşüm test ettik. Ayrıca, T0 transgenik hatlarında Cas9 kodlama dizisi nin ve sgRNA'ların varlığı tamamlayıcı çalışmaları karmaşıkhale getirmiştir. Tamamlayıcı tahliller mümkündür, ancak sgRNA hedef alanının(lar) mutasyona uğramasını gerektirir, çünkü tamamlayıcı yapının gen düzenlemesi engellenir. Üçüncü olarak, T0 hatları ile çalışan bir dezavantajı CRISPR / Cas9 mutantlar chimeric olabilir. Simerik mutant hatlarının henotik analizini önlemek için, en az 3 farklı çekimde in vitro yayılım sonrası genotipleme analizini tekrarlamanızı öneririz. Burada açıklanan protokol kullanılarak elde edilen şimerik mutantların sayısı sınırlı olmasına rağmen, zaman zaman10gözlenir. T0 hatları ile çalışma sınırlamaları aşmak için, P. andersonii mutant hatları generatively yayılabilir. P. andersonii ağaçları dioecious ve rüzgar-tozlaşma2. Bu, her transgenik çizginin erkek ve dişi çiçeklerin tek bir birey üzerinde üretilmesi ve daha sonra çapraz tozlaşmanın oluşmaması gibi yetiştirilmesi gibi manipüle edilmesi gerektiği anlamına gelir. P. andersonii hızlı büyüyen bir ağaç olduğu için tropikal bir serada (28 °C, ~%85 bağıl nem) önemli miktarda yer gerektirir. Bu nedenle, teknik olarak mümkün olsa da, P. andersonii transgenik hatlarının generatif yayılımı lojistik açıdan zordur.
Protokol bölümünde P. andersoniinodulation için 3 yöntem açıklanmıştır. Plaka ve kese sistemlerinin avantajı, köklerin kolayca erişilebilir olmasıdır, bu da bakterilerin nokta aşılanmasına ve zamanla nodül oluşumunu takiben izin verebilir. Ancak, plaka sistemi oldukça emek yoğun, hangi daha az büyük ölçekli nodulation deneyler için uygun hale getirir. Kese sisteminin bir dezavantajı mantar kontaminasyonunu önlemenin zor olmasıdır. Keseler steril değildir ve bu nedenle poğaçanın üst yarısında genellikle mantar büyümesi görülür. Ancak, bu P. andersonii büyümesini etkilemez, ve bu nedenle nodulation tahlilleri ile müdahale etmez. Ayrıca, kese sistemi sadece fideler için uygundur. Çeşitli girişimlere rağmen, biz torbalarda in vitro yayılım yoluyla elde edilen plantlets büyümek mümkün olmuştur.
Burada açıklanan P. andersonii ters genetik boru hattı mevcut A. rhizogenestabanlı kök dönüşüm yöntemi11ile karşılaştırıldığında önemli bir iyileşme sunuyor. Açıklanan prosedürler kullanılarak, kararlı transgenik hatlar verimli bir şekilde oluşturulabilir ve in vitro yayılım yoluyla muhafaza edilebilir. Buna karşılık, A. rhizogenes dönüşümü geçicidir ve sadece transgenik köklerin oluşumuna neden olabilir. Çünkü her transgenik kök bağımsız bir dönüşümden kaynaklanır, A. rhizogenes transformasyon tabanlı tahliller önemli bir henotik varyasyon muzdarip. Bu varyasyon kararlı çizgiler durumunda çok daha azdır, ancak in vitro yayılım da bir miktar varyasyon oluşturur. Bu azaltılmış varyasyon ve birden fazla plantlets her kararlı çizgi için fenotip olabilir gerçeği nedeniyle, kararlı çizgiler a. rhizogenes-dönüştürülmüş kökleri ile karşılaştırıldığında nicel tahliller için daha uygundur. Ayrıca, kararlı dönüşüm endojen hormon dengesini etkileyen A. rhizogenes kök indükleyici lokus giriş bağlı değildir (rol) endojen hormon dengesini etkiler15. Bu nedenle, kararlı çizgiler daha iyi hormon homeostaz dahil genlerin ters genetik analizi için uygundur A. rhizogenes-dönüştürülmüş kökleri ile karşılaştırıldığında. Araştırma modeli olarak P. andersonii daha genel bir avantajı yeni bir bütün genom çoğaltma (WGD) yaşamadı olmasıdır. Baklagil Papilionoideae alt familyası, model baklagiller M. truncatula ve L. japonicusiçerir, yanı sıra Salicaceae (sipariş Malpighiales) model ağaç Populus trichocarpa deneyimli WGDs ~65 içerir milyon yıl önce36,37. Bu WGD'lerden kaynaklanan birçok paralog gen kopyası M. truncatula, L. japonicus ve P. trichocarpa37,38,39, ters genetik analizleri zorlaştırabilecek fazlalık. P. andersonii yeni bir WGD deneyimi yoktu gibi, P. andersonii üzerinde ters genetik analizler paralogous gen kopyalarının gereksiz işleyişinden daha az etkilenebilir.
Birlikte ele alındığında, Biz P. andersoniiters genetik analiz için ayrıntılı bir protokol sağlar. Bu protokol kullanılarak, tek mutant hatları verimli bir zaman dilimi içinde oluşturulabilir 2-3 ay10. Bu protokol, diğer bitki türleri40,41,42için gösterildiği gibi, aynı anda farklı genleri hedefleyen sgRNA'ların çoklama yoluyla daha yüksek sıra mutantlar oluşturmak için uzatılabilir. Ayrıca, burada açıklanan kararlı dönüşüm prosedürü CRISPR/Cas9 gen hedeflemesi ile sınırlı değildir, ancak diğer yapı türlerini tanıtmak için de kullanılabilir (örn. organizatör-muhabir tahlilleri, ektopik ifade veya trans- tamamlayıcı). Azot sabitleme rhizobia veya endomycorrhizal mantarları ile karşılıklı ortakyaşamları incelemek için karşılaştırmalı bir araştırma modeli olarak P. andersonii'yi kurduk. Ancak, burada açıklanan protokoller aynı zamanda bu tropik ağacın biyolojisinin diğer yönlerini incelemek için araçlar sağlar, örneğin odun oluşumu, bi-cinsel çiçeklerin geliştirilmesi veya Cannabaceae'ye özgü ikincil metabolitlerin biyosentezi gibi.
Acknowledgements
Yazarlar Mark Youles, Sophien Kamoun ve Sylvestre Marillonnet'i Addgene veritabanı nda Golden Gate klonlama parçalarını kullanıma savurduklarından dolayı kabul etmek isterler. Ayrıca, P. andersonii tohumları için E. James, P. Hadobas ve T. J. Higgens'a teşekkür ederiz. Bu çalışma Hollanda Bilimsel Araştırma Örgütü (NWO-VICI hibe 865.13.001; NWO-Açık Yarışma hibe 819.01.007) ve Endonezya Cumhuriyeti Araştırma, Teknoloji ve Yüksek Öğretim Bakanlığı (RISET-PRO hibe 8245-ID).
Materials
| Name | Company | Catalog Number | Comments |
| Sigma-Aldrich | N0640 | NAA | |
| Duchefa Biochemie | M1503.0250 | MES | |
| Sigma-Aldrich | D134406 | Acetosyringone | |
| Duchefa Biochemie | X1402.1000 | X-Gal | |
| Merck | 101236 | For nucleic acid electrophoresis gel | |
| - | - | Pouches box material, hangers | |
| Merck | 101188 | NH4NO3 | |
| Sigma-Aldrich | B3408-1G | BAP | |
| Merck | 100156 | H3BO3 | |
| Thermo-Fisher | ER1011 | Used as restriction enzyme in Golden Gate cloning assembly | |
| Thermo-Fisher | 15561020 | Used in Golden Gate cloning assembly | |
| Merck | 137101 | CaCl2·2H2O | |
| Duchefa Biochemie | C0111.0025 | C16H16N5O7S2Na | |
| Thermo-Fisher | K1231 | Used for cloning the blunt-ended PCR amplicons in genotyping procedure | |
| Agronutrition | AP2011 | Containing Rhizophagus irregularis DAOM 197198 (1,000 spores/mL), used for mychorrization assay | |
| Merck | 102790 | CuSO4·5H2O | |
| Duchefa Biochemie | D1004.1000 | Used for plant tissue culture agar-based medium | |
| Merck | 105101 | K2HPO4 | |
| VWR Chemicals | 20302.293 | Na2·EDTA | |
| Duchefa Biochemie | M0803.1000 | C6H14O6 | |
| Thermo-Fisher | ER0291 | Used as restriction enzyme in Golden Gate cloning assembly | |
| Merck | 100983 | C2H5OH | |
| VWR Chemicals | BDH9232-500G | EDTA | |
| Sigma-Aldrich | Z377600-1PAK | Cellophane membrane | |
| Biomatters, Ltd. | R9 or higher | Bioinformatics software for in silico cloning and designing of sgRNAs | |
| Mega International | - | Technical information at https://mega-international.com/tech-info/ | |
| Sigma-Aldrich | 65882 | Used for fixating nodule tissues | |
| VWR Chemicals | 24385.295 | - | |
| Vink | 219341 | Pouches box material, bottom part | |
| Leica Biosystems | 14702218311 | Used as a template for plastic embedding | |
| Merck | 100317 | HCl | |
| Sigma-Aldrich | I5386-1G | IBA | |
| Merck | 103862 | C6H5FeO7 | |
| Merck | 103965 | FeSO4O·7H2O | |
| Duchefa Biochemie | I1401.0005 | IPTG | |
| Duchefa Biochemie | K0126.0010 | ||
| Sigma-Aldrich | L2000 | ||
| Merck | 105886 | MgSO4O·7H2O | |
| Merck | 105934 | MnCl2·4H2O | |
| Merck | 102786 | MnSO4O | |
| Duchefa Biochemie | M1002.1000 | Used for bacterial culture agar-based medium | |
| Manutan | 92007687 | Pouches material | |
| Paraxisdienst | 130774 | Elastic sealing foil | |
| Pull Rhenen | Agra-Perlite No.3 | Used as growing substrate in pots for nodulation assay | |
| VWR Chemicals | 391-0581 | Used as container for cellophane membranes | |
| Thermo-Fisher | F130WH | For genotyping transgenic lines | |
| Addgene | 50337 | Level 0 terminator, 3'UTR, 35s (Cauliflower Mosaic Virus) | |
| Addgene | 48017 | End-link 2 for assembling 2 level one part into a level 2 acceptor | |
| Addgene | 48018 | End-link 3 for assembling 3 level one part into a level 2 acceptor | |
| Addgene | 48001 | Level 1 acceptor. Position 5. Forward orientation | |
| Addgene | 48007 | Level 1 Acceptor. Position 1. Reverse orientation | |
| Addgene | 50268 | Level 0 promoter (0.4 kb), 35s (Cauliflower Mosaic Virus) + 5'UTR, Ω (Tobacco Mosaic Virus) | |
| Addgene | 46966 | Used for designing CRISPR/Cas9 module | |
| Addgene | 46968 | Used for designing CRISPR/Cas9 module | |
| Addgene | 50334 | Level 0 Kanamycin/Neomycin/Paromomycin resistance cassette | |
| Topzeven | - | Used as filters for washing spore suspension | |
| Sigma-Aldrich | 8.17003 | PEG400 | |
| Duchefa Biochemie | E1674.0001 | Pots to grow Parasponia plantlets/seedlings | |
| Merck | 104871 | KH2PO4 | |
| Merck | 105033 | KOH | |
| Merck | 105153 | K2SO4O | |
| Van Leusden b.v. | - | Used as growing substrate for mychorrhization assay | |
| Duchefa Biochemie | S0225.0050 | SH-basal salt medium | |
| Duchefa Biochemie | S0411.0250 | SH-vitamin mixture | |
| Lehle Seeds | VIS-02 | Used as non-ionic surfactant in the washing step of stable transformation | |
| Merck | 137017 | NaCl | |
| VWR Chemicals | 89230-072 | C6H11NaO7 | |
| Merck | 106521 | Na2MoO4·2H2O | |
| Merck | 106574 | Na2HPO4·7H2O | |
| Merck | 567549 | NaH2PO4·H2O | |
| Sigma-Aldrich | 239313 | Na2SO4O | |
| Duchefa Biochemie | S0809.5000 | C12H22O11 | |
| Thermo-Fisher | B69 | Used in Golden Gate cloning assembly | |
| Thermo-Fisher | EL0013 | Used in Golden Gate cloning assembly | |
| Kulzer-Mitsui Chemicals Group | 64708806 | Methyl methacrylate-based resin powder | |
| Kulzer-Mitsui Chemicals Group | 64709003 | HEMA (2-hydroxyethyl methacrylate)-based resin solution | |
| Kulzer-Mitsui Chemicals Group | 66022678 | Methyl methacrylate-based resin solution | |
| Merck | 1159300025 | ||
| Acros | 189350250 | ||
| VWR Chemicals | 663684B | Polysorbate 20 | |
| Stout Perspex | - | pouches box material, lid | |
| Duchefa Biochemie | Y1333.1000 | ||
| Merck | 108816 | ZnCl2 | |
| Alfa Aesar | 33399 | ZnSO4O·7H2O |
References
- Clason, E. W. THE VEGETATION OF THE UPPER-BADAK REGION OF MOUNT KELUT (EAST JAVA). Bulletin du Jardin Botanique de Buitenzorg. Serie III, 509-518 (1936).
- Soepadmo, E. Ulmaceae. Flora Malesiana-Series 1, Spermatophyta. 8, 31-76 (1974).
- Becking, J. H. The Rhizobium symbiosis of the nonlegume Parasponia. Biological Nitrogen Fixation. , 497-559 (1992).
- Oldroyd, G. E. D. Speak, friend, and enter: signalling systems that promote beneficial symbiotic associations in plants. Nature Reviews Microbiology. 11, 252-263 (2013).
- Gutjahr, C., Parniske, M. Cell and developmental biology of arbuscular mycorrhiza symbiosis. Annual Review of Cell and Developmental Biology. 29, 593-617 (2013).
- van Velzen, R., et al. Comparative genomics of the nonlegume Parasponia reveals insights into evolution of nitrogen-fixing rhizobium symbioses. Proceedings of the National Academy of Sciences of the United States of America. 115, E4700-E4709 (2018).
- van Velzen, R., Doyle, J. J., Geurts, R. A Resurrected Scenario: Single Gain and Massive Loss of Nitrogen-Fixing Nodulation. Trends in Plant Science. 24, 49-57 (2019).
- Griesmann, M., et al. Phylogenomics reveals multiple losses of the nitrogen-fixing root nodule symbiosis. Science. 1743, eaat1743 (2018).
- Becking, J. H. Root-Nodule Symbiosis Between Rhizobium And Parasponia (Ulmaceae). Plant and Soil. 51, 289-296 (1979).
- van Zeijl, A., et al. CRISPR/Cas9-Mediated Mutagenesis of Four Putative Symbiosis Genes of the Tropical Tree Parasponia andersonii Reveals Novel Phenotypes. Frontiers in Plant Science. 9, 284 (2018).
- Cao, Q., et al. Efficiency of Agrobacterium rhizogenes–mediated root transformation of Parasponia and Trema is temperature dependent. Plant Growth Regulation. 68, 459-465 (2012).
- Limpens, E., et al. RNA interference in Agrobacterium rhizogenes-transformed roots of Arabidopsis and Medicago truncatula. Journal of Experimental Botany. 55, 983-992 (2004).
- Boisson-Dernier, A., et al. Agrobacterium rhizogenes-Transformed Roots of Medicago truncatula for the Study of Nitrogen-Fixing and Endomycorrhizal Symbiotic Associations. Molecular Plant-Microbe Interactions. 14, 695-700 (2001).
- Kumagai, H., Kouchi, H. Gene Silencing by Expression of Hairpin RNA in Lotus japonicus Roots and Root Nodules. Molecular Plant-Microbe Interactions. 16, 663-668 (2003).
- Nilsson, O., Olsson, O. Getting to the root: The role of the Agrobacterium rhizogenes rol genes in the formation of hairy roots. Physiologia Plantarum. 100, 463-473 (1997).
- Davey, M. R., et al. Effective Nodulation of Micro-Propagated Shoots of the Non-Legume Parasponia andersonii by Bradyrhizobium. Journal of Experimental Botany. 44, 863-867 (1993).
- Webster, G., Poulton, P. R., Cocking, E. C., Davey, M. R. The nodulation of micro-propagated plants of Parasponia andersonii by tropical legume rhizobia. Journal of Experimental Botany. 46, 1131-1137 (1995).
- Op den Camp, R., et al. LysM-type mycorrhizal receptor recruited for rhizobium symbiosis in nonlegume Parasponia. Science. 331, 909-912 (2011).
- Weber, E., Engler, C., Gruetzner, R., Werner, S., Marillonnet, S. A Modular Cloning System for Standardized Assembly of Multigene Constructs. PLOS ONE. 6, e16765 (2011).
- Nekrasov, V., Staskawicz, B. J., Weigel, D., Jones, J. D. G., Kamoun, S. Targeted mutagenesis in the model plant Nicotiana benthamiana using Cas9 RNA-guided endonuclease. Nature Biotechnology. 31, 691-693 (2013).
- Bertani, G. Studies On Lysogenesis. I. The Mode Of Phage Liberation By Lysogenic Escherichia Coli. Journal of Bacteriology. 62, 293-300 (1951).
- Engler, C., et al. A Golden Gate modular cloning toolbox for plants. ACS Synthetic Biology. 3, 839-843 (2014).
- Fauser, F., Schiml, S., Puchta, H. Both CRISPR/Cas-based nucleases and nickases can be used efficiently for genome engineering in Arabidopsis thaliana. The Plant Journal. 79, 348-359 (2014).
- Lazo, G. R., Stein, P. A., Ludwig, R. A. A DNA Transformation-Competent Arabidopsis Genomic Library in Agrobacterium. Biotechnology. 9, 963-967 (1991).
- Op den Camp, R. H. M., et al. N Nonlegume Parasponia andersonii Deploys A Broad Rhizobium Host Range Strategy Resulting in Largely Variable Symbiotic Effectivenes. Molecular Plant-Microbe Interactions. 25, 954-963 (2012).
- Graham, P. H., Viteri, S. E., Mackie, F., Vargas, A. T., Palacios, A. Variation in acid soil tolerance among strains of Rhizobium phaseoli. Field Crops Research. 5, 121-128 (1982).
- Martinez-Romero, E., et al. Rhizobium tropici, A Novel Species Nodulating Phaseolus vulgaris L. Beans and Leucaena sp. Trees. International Journal of Systematic and Evolutionary Microbiology. 41, 417-421 (1991).
- Felten, J., et al. The Ectomycorrhizal Fungus Laccaria bicolor Stimulates Lateral Root Formation in Poplar and Arabidopsis through Auxin Transport and Signaling. Plant Physiology. 151, 1991-2005 (1991).
- Trouvelot, A., Kough, J. L., Gianinazzi-Pearson, V. Mesure du taux de mycorhization VA d’un systeme radiculaire. Recherche de methods d’estimation ayant une signification fonctionnelle. Aspects Physiologiques et Genetiques des Mycorhizes. , 217-221 (1986).
- Schenk, R. U., Hildebrandt, A. C. Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Canadian Journal of Botany. 50, 199-204 (1972).
- Becking, J. H. The Parasponia parviflora - Rhizobium symbiosis. Host specificity, growth and nitrogen fixation under various conditions. Plant and Soil. 75, 309-342 (1983).
- Hoagland, D. R., Arnon Revised, D. I., Arnon, D. I. The Water-Culture Method for Growing Plants without Soil. Circular California Agricultural Experiment Station. 347, 1-32 (1950).
- Wang, K. . Methods in Molecular Biology: Agrobacterium Protocols. 1, (2015).
- Smulders, M. J. M., de Klerk, G. J. Epigenetics in plant tissue culture. Plant Growth Regulation. 63, 137-146 (2011).
- Larkin, P. J., Scowcroft, W. R. Somaclonal variation — a novel source of variability from cell cultures for plant improvement. Theoretical and Applied Genetics. 60, 197-214 (1981).
- Cannon, S. B., et al. Legume genome evolution viewed through the Medicago truncatula and Lotus japonicus genomes. Proceedings of the National Academy of Sciences of the United States of America. 103, 14959-14964 (2006).
- Tuskan, G. A., et al. The Genome of Black Cottonwood, Populus trichocarpa (Torr. & Gray). Science. 313, 1596-1604 (2006).
- Young, N. D., et al. The Medicago genome provides insight into the evolution of rhizobial symbioses. Nature. 480, 520 (2011).
- Sato, S., et al. Genome Structure of the Legume, Lotus japonicus. DNA Research. 15, 227-239 (2008).
- Xing, H. L., et al. A CRISPR/Cas9 toolkit for multiplex genome editing in plants. BMC Plant Biology. 14, 327 (2014).
- Lowder, L. G., et al. A CRISPR/Cas9 Toolbox for Multiplexed Plant Genome Editing and Transcriptional Regulation. Plant Physiology. 169, 971 (2015).
- van Zeijl, A. . Dissecting Hormonal Pathways in Nitrogen-Fixing Rhizobium Symbioses. , (2017).
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved