تحويل، تحرير الجينوم والفينولات في نتروجين تحديد شجرة كاناباسيا الاستوائية Parasponia أندرسوني
In This Article
Summary
Parasponia andersonii هي شجرة استوائية سريعة النمو تنتمي إلى عائلة القنب (Cannabaceae) ويمكن أن تشكل العقيدات الجذرية المثبتة للنيتروجين بالاشتراك مع الريزوبيوم. هنا، ونحن نصف بروتوكول مفصل للتحليلات الوراثية العكسية في P. أندرسوني على أساس Agrobacterium tumefaciens- بوساطة التحول مستقرة وتحرير الجينوم القائم على كريسبر / Cas9.
Abstract
Parasponia andersonii هي شجرة استوائية سريعة النمو تنتمي إلى عائلة القنب (Cannabaceae). وإلى جانب 4 أنواع إضافية، يشكل هذا النوع النسب الوحيد غير البقول المعروف القادر على إقامة تكافل بين عقيدات تثبيت النيتروجين مع الريزوبيوم. ويمكن أن توفر الدراسات المقارنة بين البقوليات وP. andersonii نظرة ثاقبة قيّمة في الشبكات الوراثية الكامنة وراء تكوين العقيدات الجذرية. لتسهيل الدراسات المقارنة، قمنا مؤخرا تسلسل الجينوم P. andersonii وأنشئت Agrobacterium tumefaciens- بوساطة التحول مستقرة وتحرير الجينوم القائم على كريسبر / Cas9. هنا، ونحن نقدم وصفا مفصلا للتحول والجينوم تحرير الإجراءات التي وضعت لP. andersonii. وبالإضافة إلى ذلك، ونحن نصف إجراءات لإنبات البذور وتوصيف الأنماط الظاهرية التكافلية. باستخدام هذا البروتوكول، يمكن إنشاء خطوط متحولة مستقرة جينيا في فترة 2-3 أشهر. يسمح الانتشار الخضري في المختبر للخطوط المعدلة وراثيا ً T0 ببدء تجارب النماذج الظاهرية في غضون 4 أشهر بعد زراعة A. tumefaciens المشتركة. ولذلك، فإن هذا البروتوكول يستغرق فقط وقتا أطول هامشيا من طريقة تحويل الجذر التي تعتمد على البكتيريا الزراعيةالعابرة المتاحة لP. andersonii، على الرغم من أنه يقدم العديد من المزايا الواضحة. معا، والإجراءات الموصوفة هنا تسمح P. andersonii لاستخدامها كنموذج بحثي للدراسات التي تهدف إلى فهم الجمعيات التكافلية، فضلا عن الجوانب الأخرى المحتملة من بيولوجيا هذه الشجرة الاستوائية.
Introduction
Parasponia andersonii هي شجرة استوائية تنتمي إلى عائلة القنب (كاناباسيا) وهي أصليةفي بابوا غينيا الجديدة والعديد من جزر المحيط الهادئ 1،2،3. جنبا إلى جنب مع 4 أنواع باراسبونيا إضافية، فإنه يمثل النسب الوحيد غير البقوليات التي يمكن أن تنشئ تكافل العقيدات تثبيت النيتروجين مع جذمور. ويدرس هذا التكافل بشكل جيد في البقول (Fabaceae) نماذج Medicago truncatula ولوتس جابونيكونكوس، مما أدى إلى الحصول على معرفة مفصلة من الطبيعة الوراثية الجزيئية لتكوين العقيدات وتعمل4. بالإضافة إلى ذلك، ثبت أن التعايش العقيدات الجذرية في البقوليات يقوم على التكافل mycorrhizal arbuscular على نطاق واسع5. تشير المقارنات الفيوجينية إلى أن التكافل بين العقيدات المثبتة للنيتروجين من البقوليات، باراسبونيا،وكذلك، ما يسمى بأنواع النباتات الأكتينوريزال التي تستضيف بكتيريا الفرانكويا الديازوجينية، لها أصل تطوري مشترك 6و7و8. ولتحديد ما إذا كانت الجينات التي تم تحديدها للمشاركة في تكوين العقيدات البقولية هي جزء من أساس وراثي محفوظ، فإن الدراسات المتعلقة بالأنواع غير البقولية ضرورية. ولهذا الغرض، نقترح استخدام P. andersonii كنموذج بحثي مقارن، إلى جانب البقوليات، لتحديد الشبكات الوراثية الأساسية التي يقوم عليها تكوين العقيدات الجذرية وأدائها.
P. andersonii هو رائد التي يمكن العثور عليها على منحدرات التلال البركانية. يمكن أن تلبي سرعات النمو من 45 سم شهريا وتصل إلى أطوال تصل إلى 10 متر9. P. أندرسوني الأشجار هي الرياح الملقحة، والتي يسهلها تشكيل الزهور الذكور والإناث منفصلة3،10. قمنا مؤخرًا بتسلسل وتعليق الجينوم الديبلويد (2n = 20؛ 560 Mb/1C) من P. andersonii، وتجميع ناصية تسلسل الجينوم من نوعين إضافيين من Parasponia؛ ب. rigida و P. rugosa6. هذا كشف ~ 35,000 P. أندرسوننماذج الجينات التي يمكن تجميعها في > 20,000 orthogroups جنبا إلى جنب مع الجينات من M. اقتطاعولا,فول الصويا (Glycineماكس), أرابيدوبيس ثاليانا,الغابات الفراولة ( فراجاريا فيسكا)، تريما أورينتاليس ، الحور القطن الأسود (بوبولوس تريتشوكاربا) والكافور (الكافور جرانديس)6. بالإضافة إلى ذلك، حددت مقارنات النسخ بين M. truncatula و P. andersonii مجموعة من 290 تقويم اكتية المفترضة التي تظهر نمط التعبير المعززة العقيدات في كلا النوعين6. وهذا يوفر موردا ممتازا للدراسات المقارنة.
لدراسة وظيفة الجينات في جذور P. andersonii والعقيدات، تم إنشاء بروتوكول لتحويل جذور جذور Agrobacteriumبوساطة11. وباستخدام هذا البروتوكول، يمكن توليد النباتات المركبة التي تحمل جذوراً معدلة وراثياً في إطار زمني قصير نسبياً. هذه الطريقة هي أيضا، تطبق على نطاق واسع في بحوث التكافل البقوليات12،13،14. ومع ذلك، فإن العيب في هذه الطريقة هو أن الجذور فقط يتم تحويلها وأن كل جذر المعدلة وراثيا يمثل حدث تحويل مستقل، مما أدى إلى اختلاف كبير. كما أن التحول عابر ولا يمكن الحفاظ على الخطوط المعدلة وراثيا. وهذا يجعل تحويل الجذر القائم على A. rhizogenesأقل ملاءمة لتحرير الجينوم كريسبر/ Cas9 بوساطة. بالإضافة إلى ذلك، A. rhizogenes ينقل جذرها تحفيز locus (رول) الجينات إلى الجينوم النبات، والتي أعرب مرة واحدة تتداخل مع هرمون التوازن15. وهذا يجعل دراسة دور الهرمونات النباتية في A. جذور جذورتحول تحديا. للتغلب على هذه القيود، وضعنا مؤخرا بروتوكول للتحول القائم على Tumefaciens AgrobacteriumوCRISPR / Cas9 بوساطة الطفرات من P. andersonii10.
هنا، نقدم وصفا مفصلا لعملية التحول المستندة إلى A. tumefaciensوخط أنابيب علم الوراثة العكسي وضعت لP. andersonii. بالإضافة إلى ذلك، نحن نقدم بروتوكولات للتعامل مع المصب من النباتات المعدلة وراثيا، بما في ذلك الاختبارات لدراسة التفاعلات التكافلية. باستخدام البروتوكول الموضح هنا، يمكن إنشاء خطوط متعددة المعدلة وراثيا في فترة 2-3 أشهر. في تركيبة مع الطفرات كريسبر/ كاس9 بوساطة، وهذا يسمح جيل فعال من خطوط متحولة بالضربة القاضية. هذه الخطوط المتحولة يمكن أن تنتشر نباتيا في المختبر10،16،17، والذي يسمح ما يكفي من المواد التي سيتم إنشاؤها لبدء توصيف phenotypic في 4 أشهر بعد إجراء التحول قد بدأت10. معا، هذه المجموعة من الإجراءات ينبغي أن تسمح لأي مختبر لاعتماد P. andersonii كنموذج بحثي للدراسات التي تهدف إلى فهم الجمعيات جذوبية وmycorrhizal، فضلا عن جوانب أخرى محتملة من بيولوجيا هذه الشجرة الاستوائية.
Protocol
1. تنمو P. أندرسوني الأشجار في الاحتباس الحراري
-
الإنبات ب. أندرسوني WU1 بذور18.
- استخدام التوت الطفيلية الطازجة أو نقع التوت المجفف في الماء لمدة 2 ساعة لإعادة ترطيب. الاسكواش التوت على قطعة من ورق الأنسجة أو فرك ضد داخل غربال الشاي لإزالة البذور.
- تطهير البذور باستخدام التبييض التجاري (~ 4٪ hypochlorite) لمدة 15-20 دقيقة، وبعد ذلك غسل البذور 6 مرات باستخدام المياه المعقمة.
- نقل البذور إلى أنابيب PCR معقمة 200 ميكرولتر. ملء الأنابيب مع الماء المعقم، بحيث يتم غمر البذور تماما. احتضان الأنابيب لمدة 10 أيام في دراجة حرارية تشغيل البرنامج التالي: 30 دورات (7 درجة مئوية لمدة 4 ساعة، 28 درجة مئوية لمدة 4 ساعة). لا تستخدم غطاء ساخن، لأن هذا قد يقتل البذور.
- إعداد لوحات SH-0 (انظر الجدول1). نقل البذور إلى لوحات SH-0 وحضانة في 28 درجة مئوية، 16 ح: 8 ح يوم: ليلة. إغلاق لوحات مع 2 طبقات من رقائق الختم مرنة لمنع التجفيف أثناء الحضانة في 28 درجة مئوية.
- بعد الشتلات وضعت أول مجموعة من الأوراق الحقيقية (~ 3-4 أسابيع بعد الحضانة في 28 درجة مئوية)، ونقل الشتلات إلى الأواني مليئة التربة وعاء التجارية وتغطي ة الشتلات مع كوب من البلاستيك شفافة لمنع جفاف. وضع الأواني في غرفة المناخ 28 درجة مئوية أو الدفيئة، ~ 85٪ RH، تحت 16 ح: 8 ساعة يوم: نظام الليل.
- بعد أسبوع واحد، قم بإزالة كوب من البلاستيك الشفاف. سقي الأواني بانتظام وعندما تنمو الأشجار تكملة أكبر مع الأسمدة للحفاظ على النمو.
2. استنساخ المنشآت لCRISPR / Cas9 بوساطة Mutagenesis من P. andersonii
ملاحظة: يمكن استخدام متجهات التحول الثنائي القياسية للتحول المستقر لـ P. andersonii. هنا، على سبيل المثال، هو إجراء لتوليد المنشآت لCRISPR / Cas9 بوساطة الطفرات باستخدام استنساخ وحدات (على سبيل المثال، البوابة الذهبية)19.
- حدد التسلسلات المستهدفة لـ RNA الإرشادية للجين (الجينات) ذات الأهمية، وذلك باستخدام برامج المعلوماتية الحيوية التي تحتوي على أداة تصميم كريسبر مدمجة. اختيار تسلسل الحمض النووي الريبي دليل يقع في 5'-نهاية تسلسل الترميز من الجين المستهدف لزيادة فرصة الحصول على الضربة القاضية الكاملة. تأكد من التحقق من الآثار خارج الهدف من خلال البحث ضد الجينوم P. andersonii 6.
ملاحظة: استخدم 2 sgRNAs لكل جين مستهدف، ويفضل أن يكون 200-300 نقطة أساس على حدة. وهذا قد يولد الحذف التي يمكن تحديدها من قبل PCR وبعد ذلك عن طريق الكهربائي هلام أغاروز. - إنشاء بناء اتّباع البوابة الذهبية من المستوى 1 التي تحتوي على تسلسلات sgRNA.
- تصميم التمهيديات لتضخيم كل sgRNA الفردية عن طريق إدراج تسلسل دليل 20 نقطة أساس في موقف N(20) في التسلسل التمهيدي التالي: 5'-TGTGTGTCTCAATTGN(20) GTTTTAGAGCTAGATAGAG-3'.
ملاحظة: إذا كان تسلسل الدليل يساوي GN(19)،قم بإزالة G في نهاية 5' من تسلسل الدليل قبل الإدراج في التسلسل التمهيدي. - PCR تضخيم sgRNAs من pICH86966::AtU6p::sgRNA_PDS20 باستخدام التمهيديات إلى الأمام مصممة في الخطوة 2.2.1 والتمهيدي العكسي العالمي: 5'-TGTGTGTAAGCGTAATAACTATGTAC-3'. استخدام بوليميراز الحمض النووي عالية الدقة مستقرة الحرارة وشروط PCR التالية: 98 درجة مئوية لمدة 30 ق. 30 دورة (98 درجة مئوية ل10 ق؛ 53 درجة مئوية ل20 ق؛ 72 درجة مئوية ل10 ق)؛ 72 درجة مئوية لمدة 7 دقائق.
- عمود تنقية amplicon PCR باستخدام مجموعة تنقية PCR التجارية. في وقت لاحق، إعداد ردود الفعل البوابة الذهبية لاستنساخ sgRNAs وراء AU6P rna العربية الصغيرة المروج: 10 نانوغرام من sgRNA PCR amplicon، 150 نانوغرام من pICSL01009::AtU6p20، 60 نانوغرام من مستوى مناسب 1 مقبول ناقلات، 2 ميكرولتر من T4 الليغاسي العازلة، 2 ميكرول 0.1٪ من الزلال المصل البقري (BSA)، 0.5 ميكرولتر من BsaI، 0.5 ميكرولتر من T4 ligase، وملء إلى 20 درجة مئوية مع المياه النقية جدا. تأكد من أن جميع sgRNAs يتم استنساخها في نفس الاتجاه لمنع تشكيل دبوس الشعر.
- ردود الفعل الحضانة في دراجة حرارية تشغيل البرنامج التالي: 37 درجة مئوية لمدة 20 ق; 26 دورة (37 درجة مئوية لمدة 3 دقائق؛ 16 درجة مئوية لمدة 4 دقائق)؛ 50 درجة مئوية لمدة 5 دقائق؛ 80 درجة مئوية لمدة 5 دقائق.
ملاحظة: إعداد حلول الأسهم من IPTG وX-غال في المياه النقية جدا وثنائي ميثيل فورماميد، على التوالي. تصفية تعقيم الحلول الأسهم أمبسيلين وIPTG وتخزين جميع الأسهم في -20 درجة مئوية. ارتداء القفازات عند التعامل مع ثنائي ميثيل فورماميد. - حدد المستعمرات البيضاء وعزل بلازميدات باستخدام مجموعة العزل بلازميد التجارية. تسلسل التحقق من بلازميدات معزولة قبل الاستمرار مع البوابة الذهبية مستوى 2 التجمع.
- تصميم التمهيديات لتضخيم كل sgRNA الفردية عن طريق إدراج تسلسل دليل 20 نقطة أساس في موقف N(20) في التسلسل التمهيدي التالي: 5'-TGTGTGTCTCAATTGN(20) GTTTTAGAGCTAGATAGAG-3'.
- تجميع المستوى 2 يبني البوابة الذهبية للتحول مستقرة.
- إجراء رد فعل البوابة الذهبية باستخدام مستوى 1 AtU6p::sgRNA المنشآت (ولدت تحت القسم 2.2) وكذلك pICH47802::NPTII,pICH47742::35Sبرو::ΩNLS-aCas9::35Ster,المستوى 2 مقبول pICSL4723 والمناسب نهاية linker (انظر Engler et al.22). أداء ردود الفعل على النحو التالي: استخدام ~ 100 فمول من كل ناقلات المانحوو ~ 20 فمول من ناقلات مقبول وإضافة 2 μL من T4 ligase العازلة، 2 μL من 0.1٪ BSA، 0.5 ميكرولتر من BpiI، 0.5 ميكرولتر من T4 ligase، وملء إلى 20 ميكرولتر مع الماء النقي جدا.
ملاحظة: المستوى 1 بلازميدس pICH47802::NPTII,pICH47742::35Spro::ΩNLS-aCas9::35Ster تحتاج إلى استنساخها أولا (انظر الملف التكميلي1), كما هو موضح لsgRNAs تحت القسم 2.220,22 ،23. - احتضان ردود الفعل كما هو الحال في إطار الخطوة 2.2.4 وتحويلها إلى E. القولونية. لوحة على LB المتوسطة التي تحتوي على كانامايسين. في اليوم التالي، حدد المستعمرات البيضاء وعزل البلازميدات. تحديد الجمعية بلازميد الصحيح عن طريق تحليل تقييد الهضم.
- إجراء رد فعل البوابة الذهبية باستخدام مستوى 1 AtU6p::sgRNA المنشآت (ولدت تحت القسم 2.2) وكذلك pICH47802::NPTII,pICH47742::35Sبرو::ΩNLS-aCas9::35Ster,المستوى 2 مقبول pICSL4723 والمناسب نهاية linker (انظر Engler et al.22). أداء ردود الفعل على النحو التالي: استخدام ~ 100 فمول من كل ناقلات المانحوو ~ 20 فمول من ناقلات مقبول وإضافة 2 μL من T4 ligase العازلة، 2 μL من 0.1٪ BSA، 0.5 ميكرولتر من BpiI، 0.5 ميكرولتر من T4 ligase، وملء إلى 20 ميكرولتر مع الماء النقي جدا.
- تحويل مستوى 2 يبني إلى التوميمينين الزراعية سلالة AGL124.
3. تحويل مستقر من P. أندرسوني
- تلقيح 2 لوحات LB التي تحتوي على المضادات الحيوية المناسبة مع A. tumefaciens سلالة AGL1 تحولت مع بناء الفائدة. لوحات الحضانة في 28 درجة مئوية لمدة 2 أيام.
- حصاد الفروع الشابة من الأشجار المزروعة بالدفيئة. استخدام حوالي 5 فروع من 5-8 سم في الطول لكل تحويل. تأكد من استخدام الفروع الصحية غير المصابة فقط. إزالة الأوراق عن طريق قطع لهم على هذا النحو أن يتم ترك ~ 1 سم2 من الأنسجة الورقية في نهاية كل petiole. تجاهل الأوراق.
- تطهير الأنسجة لمدة 15 دقيقة باستخدام التبييض التجاري المخفف 1:1 (~ 2٪ هيبوكلوريت بعد التخفيف) التي تحتوي على بضع قطرات من بوليسوربات 20. ثم، شطف الأنسجة 6 مرات بالماء الأوتوكلاف.
ملاحظة:هذه الخطوة، فضلا عن، الخطوات التالية تحتاج إلى أن تجرى داخل مجلس الوزراء تدفق أسفل لامينار للحفاظ على الأنسجة معقمة. - إعادة تعليق خلايا A. tumefaciens من 1-2 لوحات في 25 مل من التسلل المتوسطة (انظر الجدول1) التي تحتوي على acetosyringone (20 ملغ / لتر) وغير الأيونية السطحي (0.001٪ v / v) للوصول إلى كثافة بصرية (OD600)من ~ 5.
ملاحظة:إعداد حل الأسهم acetosyringone في الإيثانول 70٪ وتخزينها في -20 درجة مئوية. يجب تعقيم السطحي غير الأيوني قبل أن يضيف إلى وسيط التسلل. - قطع كل من الجذعية والأنسجة petiole في قطع من ~ 1 سم في الطول داخل تعليق tumefaciens A. ، وبالتالي خلق جروح جديدة في كلا الجانبين. ترك قطع الأنسجة في تعليق a. tumefaciens لمدة 10-30 دقيقة.
- إعداد وسيطة تأصيل (انظر الجدول1) وإضافة acetosyringone (20 ملغ / لتر) بعد الأوتوكلاف. قطع الأنسجة الجافة على قطعة معقمة من ورقة فلتر ووضعها على المتوسط (~ 10 explants / لوحة). لوحات الحضانة في الظلام في 21 درجة مئوية لمدة 2 أيام.
ملاحظة:السماح للوسط لتبرد إلى ~ 60 درجة مئوية قبل إضافة acetosyringone. - بعد 2 أيام، فحص لوحات للتلوث البكتيري الفطري أو الواضح (البكتيريا غير A. tumefaciens). يجب التخلص من الصفائح الملوثة.
- إعداد السائل SH-10 المتوسطة (انظر الجدول1). بعد الأوتوكلاف، إضافة بوليسوربات 20 (0.01٪، v/ v). نقل قطع الأنسجة إلى 10 مل من SH-10 التي تحتوي على بوليسوربات 20. خلال فترة لا تقل عن 10 دقائق، يهيّج بلطف كل 2-3 دقائق لغسل الأنسجة.
- اغسل مرتين إضافيتين مع SH-10 الطازجة التي تحتوي على بوليسوربات 20. في هذه الأوقات، و2-3 دقيقة مدة الحضانة لكل خطوة الغسيل يكفي.
- إعداد وسيطة التأصيل (انظر الجدول1). بعد الأوتوكلاف، إضافة سيفوتاكسيم (300 ملغ / لتر) وكاناميسين (50 ملغ / لتر) وصب لوحات. بالنسبة للتحولات الثانوية (تحويلات الخطوط المقاومة للكاناميسين المعدلة وراثياً)، قم بتطبيق اختيار الهيغرومايسين (15 ملغم/لتر).
- قطع الأنسجة الجافة على قطع معقمة من ورق ة التصفية. بعد ذلك، نقل قطع الأنسجة إلى لوحات أعدت في الخطوة 3.9.
- لوحات الحضانة لمدة 7 أيام في 28 درجة مئوية، 16 ح: 8 ح يوم: ليلة. كل يومين فحص لوحات للتلوث الفطري أو البكتيري والنمو المفرط من tumefaciens A.. في حالة التلوث، نقل القطع غير المصابة إلى لوحة جديدة.
- بعد 7 أيام، نقل قطع الأنسجة إلى وسائل الانتشار (انظر الجدول1) التي تحتوي على سيفوتاكسيم (300 ملغ / لتر) وكاناميسين (50 ملغ / لتر). لوحات الحضانة في 28 درجة مئوية، 16 ح: 8 ح اليوم: ليلة. تحديث لوحات مرة واحدة في الأسبوع حتى تبادل لاطلاق النار المعدلة وراثيا تتطور. تأكد فقط من نقل قطع الأنسجة غير المصابة إلى لوحات جديدة. تجاهل القطع التي يتم تجاوزها من قبل A. tumefaciens.
- مرة واحدة يطلق النار بشكل مفترض المعدلة وراثيا هي ≥ 1 سم في الطول، وقطع يطلق النار والثقافة لهم بشكل مستقل في وسائل الانتشار التي تحتوي على سيفوتاكسيم (300 ملغ / لتر) وكاناميسين (50 ملغ / لتر). لضمان أن يطلق النار تمثل التحويلات المستقلة، واتخاذ تبادل لاطلاق النار واحد فقط من كل جانب من explant.
- نشر Vegetatively-المعدلة وراثيا يطلق النار كما هو موضح تحت الخطوة 5.2.
4. علم الوراثة من البراعم المعدلة وراثيا
- تصميم التمهيديات التي تغطي موقع (مواقع) التعرف على sgRNA. للسماح لتسلسل amplicon PCR، اختر التمهيديات 150-250 نقطة أساس بعيداً عن موقع (مواقع) التعرف على sgRNA.
- قطع طرف ورقة (~ 5 ملم) من كل تبادل لاطلاق النار المعدلة وراثيا لتكون جينية. أيضا، حصاد عينة التحكم البرية من نوع.
- إجراء 50 ميكرولتر PCR ردود الفعل باستخدام التمهيديات المصممة في الخطوة 4.1 ومجموعة تجارية لتضخيم مباشرة الحمض النووي من عينات النبات. بدلا من ذلك، يمكن إجراء ردود فعل PCR على الحمض النووي النقي باستخدام بوليميراز عالية الدقة.
- أمبوليكون PCR منفصلة على هلام أغاروز 1.5-2٪.
- تحليل النتائج من الكهربائي هلام. تحقق من العينات التي تنتج نطاقات متعددة (أكثر من 1 أليل) وamplicons PCR مع أحجام مختلفة من النوع البري، مما يشير إلى وجود indels متوسطة الحجم.
- تسلسل PCR amplicons لتحديد الطفرات الدقيقة. بالنسبة للعينات التي تنتج أمبليكون PCR واحد، يمكن تسلسل منتجات PCR مباشرة. العينات التي تنتج أكثر من 1 الفرقة بعد الكهربائي هلام أو التي يبدو أن heterozygous بعد التسلسل المباشر للamplicon PCR، تحتاج إلى استنساخها في ناقلات استنساخ نهاية حادة أولا. فيما بعد، تسلسل استنساخ متعددة لكل عينة لتحديد جميع الأليلات الممكنة الموجودة في العينة.
- قم بمحاذاة نتائج التسلسل مع جين الاهتمام وفحص المحاذاة للتحقق من وجود طفرات بالقرب من الموقع (المواقع) المستهدفة لـ sgRNA. بعد ذلك، تحقق ما إذا كانت هذه الطفرات إنشاء إزاحات الإطار. تجاهل الخطوط باستخدام > 2 alleles، والخطوط التي تحتوي على طفرات في الإطار.
- حدد عدة أسطر لمزيد من التحليل.
- نشر الأسطر المحددة كما هو موضح ضمن الخطوة 5.2.
- عندما وضعت خطوط عدة يطلق النار جديدة، واتخاذ عينات جديدة من ≥ 3 نصائح ورقة وكرر الخطوات 4.3-4.7. تحديد ما إذا كانت الطفرات الموجودة في كل عينة من العينات الناشئة من نفس الخط وكذلك عينة PCR الأصلية متطابقة. أما الخطوط التي تسفر عن نفس الطفرات في جميع العينات فهي متحولة بشكل متجانس ويمكن استخدامها لإجراء مزيد من التجارب. تجاهل الأسطر التي لا تسفر عن نفس النتائج مثل هذه الخطوط هي chimeric.
5. إعداد الجذور ب. أندرسوني بلانتليت للتجريب
-
بدء خط جديد لثقافة الأنسجة من P. andersonii.
- حصاد براعم الإبطين، ويطلق النار على الشباب السبتية أو الأنسجة الورقية من الأشجار السليمة. بدلا من ذلك، يمكن استخدام الشتلات كمادة البداية.
- تطهير الأنسجة باستخدام التبييض التجاري المخفف 1:1 (~ 2٪ hypochlorite بعد التخفيف) التي تحتوي على بضع قطرات من بوليسوربات 20 لمدة 15 دقيقة.
ملاحظة:هذه الخطوة، فضلا عن، الخطوات التالية تحتاج إلى أن تجرى داخل تدفق اللامينار أو مجلس الوزراء تدفق عرضي لامينار للحفاظ على الأنسجة معقمة. - نقل الأنسجة إلى وسيط الانتشار (انظر الجدول1). إغلاق لوحات مع 2 طبقات من رقائق الختم مرنة ولوحات الحضانة في 28 درجة مئوية، 16 ح: 8 ساعة يوم: ليلة.
- فحص لوحات كل بضعة أيام خلال الأسبوعين الأولين للتأكد من أن الأنسجة خالية من التلوث الفطري أو البكتيري.
- نشر الأنسجة عن طريق وضع ~ 10 يطلق النار على لوحة جديدة من وسائل الانتشار وإغلاق لوحة مع 2 طبقات من رقائق الختم مرنة. لوحات الحضانة في 28 درجة مئوية، 16 ح: 8 ح اليوم: ليلة. كرر هذه الخطوة كل 4 أسابيع.
- عندما يطلق النار هي > 1 سم في الطول، وقطع يطلق النار في قاعدتهم ووضعها على وسيط تأصيل (انظر الجدول1). يمكن وضع حوالي 10 يطلق النار على لوحة تأصيل واحدة. موقف يطلق النار تستقيم عن طريق إدراج طرف القاعدية من تبادل لاطلاق النار في الوسط. تظهر الجذور في 10-14 يوما بعد حضانة لوحات في 28 درجة مئوية، 16 ح: 8 ح يوم: ليلة.
ملاحظة: لا الجذر كافة يطلق النار ولكن الاحتفاظ جزء لنشر زراعة الأنسجة (انظر الخطوة 5.2).
6. مقولة من P. أندرسوني بلانتليت في الأواني
-
إعداد ابيوم الجذوبيوم.
- تلقيح 10 مل من السائل YEM المتوسطة (انظر الجدول2) من مستعمرة واحدة من Mesorhizobium plurifarium BOR26 وحضانة في 28 درجة مئوية لمدة 2 أيام.
ملاحظة: يفضل M. multifarium BOR2 كما أنه بكفاءة nodulates P. andersonii. ومع ذلك، يمكن أيضا استخدام سلالات جذمور أخرى لإيماءة P. andersonii (على سبيل المثال براديهيزوبيوم الكاني WUR325، Rhizobium tropici CIAT89926،27 أو براديهيزوبيوم sp. Kelud2A4). - استخدام ثقافة 10 مل لتلقيح كمية أكبر من السائل YEM المتوسطة. يعتمد حجم هذه الثقافة على عدد الأواني التي تحتاج إلى تلقيح.
- إعداد السائل EKM المتوسطة (انظر الجداول 3، الجدول4). الطرد المركزي الثقافة البكتيرية لمدة 10 دقائق في 3500 × ز لحصاد الخلايا. فيما بعد, [ر-لقم] البيليه جرثوميّة في سائل [إكم] (إستعمال تقريبا ال نفسه حجم بما أنّ الأصليّة [يم] ثقافة) وحدّدت الكثافة بصريّة ([أد]600).
- تلقيح 10 مل من السائل YEM المتوسطة (انظر الجدول2) من مستعمرة واحدة من Mesorhizobium plurifarium BOR26 وحضانة في 28 درجة مئوية لمدة 2 أيام.
- ل ~ 20 الأواني، وإعداد 3 لتر من السائل EKM المتوسطة وتلقيح مع تعليق جذمور أعدت في الخطوة 6.1.3. للوصول إلى OD600 = 0.025.
- اخلط 3 لتر من EKM يحتوي على جذوبيا مع 1250 غرام من البيرلايت. في وقت لاحق، إضافة 210 غرام من هذا الخليط إلى الأواني البولي بروبلين شفافة معقمة. بدلا من ذلك، بدلا من البيرلايت، واستخدام وسادة كالركيزة لتجارب الإيماء.
- مصنع 1-3 P. أندرسوني النباتات في كل وعاء. أيضا، إعداد العديد من الأواني التي تحتوي على P. andersonii النباتات التي تحولت مع بناء كريسبر السيطرة (انظر الجدول التكميلي1). وزن العديد من الأواني لتكون قادرة على تحديد فقدان المياه خلال التجربة. تغطية الجزء السفلي من كل وعاء لحماية الجذور من التعرض للضوء.
- الأواني الحضانة في غرفة النمو المناخية (28 درجة مئوية، 16 ح: 8 ح اليوم: ليلة) لمدة 4-6 أسابيع. مرة واحدة في الأسبوع، تزن عدة الأواني لتحديد فقدان المياه. إذا تجاوز فقدان المياه 10 مل، تكملة مع المياه النقية جدا للتعويض عن الخسارة.
- بعد 4-6 أسابيع، وتنظيف الجذور من البيرلايت وتحديد أرقام العقيدات باستخدام منظار لفحص كفاءة الإيماءة.
7. مقولة من ب. أندرسوني بلانتليت على لوحات
-
إعداد أغشية السيلوفان 28.
- قطع غشاء السيلوفان لتناسب مربع 12 سم × 12 سم طبق بيتري. قطع الأغشية أقصر قليلا في الجزء العلوي للسماح لمساحة لاطلاق النار أن تنمو.
- لزيادة نفاذية أغشية السيلوفان، قم بغلي الأغشية في محلول EDTA (1 غرام/ لتر) لمدة 20 دقيقة بعد ذلك، اشطف 6 x على الأقل بالماء المنزوع المعادن لإزالة EDTA.
ملاحظة:كما الغشاء الجاف تميل إلى التجاعيد عندما في اتصال مع الماء، وغمر الأغشية الجافة واحدا تلو الآخر في الحل. - ترتيب الأغشية أفقيا في طبقة رقيقة من الماء في لوحة زجاجية مستديرة. تعقيم الأغشية عن طريق الأوتوكلاف مرتين.
- ضع 1 غشاء السيلوفان الأوتوكلاف على طبق بيتري مربع 12 × 12 سم يحتوي على agar-solided EKM المتوسطة (انظر الجدول 3، الجدول4). ضع اثنين من النباتات المتجذرة ب. أندرسوني البالغة من العمر 3 أسابيع (انظر القسم 5) أو الشتلات القديمة لمدة 4 أسابيع (انظر القسم 1.1) على الجزء العلوي من الغشاء. تأكد فقط من اختيار النباتات أو الشتلات ذات الجذور التي تحتوي على نصائح الجذر الأبيض، مما يشير إلى أن هذه الجذور لا تزال تنمو.
- تغطية بلطف الجذور مع غشاء السيلوفان الثاني، وخلق طبقة شطيرة. ختم لوحة مع 3 طبقات من رقائق الختم مرنة. التفاف النصف السفلي من لوحات مع رقائق الألومنيوم، لتغطية الجذور من التعرض للضوء.
- احتضان لوحات في غرفة النمو المناخية (28 درجة مئوية، 16 ح: 8 ح اليوم: ليلة) لمدة 3-4 أسابيع. وضع علامة على موقف نصائح الجذر لمتابعة نمو الجذر مع مرور الوقت.
- إذا بدأت لوحات EKM تجف بسبب الحضانة لفترات طويلة، نقل النباتات إلى لوحات EKM الطازجة قبل بضعة أيام من التطعيم البكتيري.
- إعداد التلقيح البكتيري كما هو موضح في الخطوة 6.1.
- إزالة غشاء السيلوفان العلوي وتطبيق 1 مل من ثقافة الريزوبيوم (OD600 = 0.025) على الجذور. في وقت لاحق، وضع غشاء السيلوفان جديد على الجذور الملقحة. التفاف خارج لوحة باستخدام رقائق الألومنيوم لتغطية الجذور من التعرض للضوء.
- بعد 4 أسابيع، فحص أرقام العقيدات باستخدام منظار لتحديد كفاءة الإيماء.
8. التموجات من شتلات P. أندرسوني في الحقائب
- بذور الإنبات P. andersonii كما هو موضح في القسم 1.1. بعد أن ظهرت الكُتِلِيْنتماماً (~12 يومًا على لوحات SH-0 عند درجة حرارة 28 درجة مئوية)، نقل الشتلات إلى الحقائب.
- لإعداد الحقائب، قم بتمزيق القسم المطوي من فتيل الورق وأضف 7 مل من متوسط EKM المعدل (انظر الجدول 3، الجدول4).
- إدراج 1 أو 2 الشتلات عن طريق وضع الجذور بين كل من ورقة من الورق التي تشكل الفتيل ورقة وورقة بلاستيكية الجبهة من الحقيبة.
- حماية الجذور من التعرض للضوء، عن طريق طي رقائق الألومنيوم حول الحقيبة. تعليق الحقائب في مربع من البلاستيك مغطاة غطاء شفاف للحفاظ على الرطوبة العالية. ضع الصندوق في غرفة نمو مُحْمَّلة (28 درجة مئوية، 16 ساعة: 8 ساعة يوم: ليل).
- تعويض عن تبخر المياه عن طريق إضافة المياه المعقمة فائقة النقية، على هذا النحو أن الفتيل ورقة لا تزال رطبة (تجنب المياه الدائمة في الجزء السفلي من الحقيبة). بعد الأسبوع الأول، وهذا يتطلب عموما إضافة 2-3 مل كل 4 أيام.
- إعداد التلقيح البكتيري كما هو موضح في الخطوة 6.1.
- بعد أن نمت الشتلات لمدة 10-12 يوما في الحقائب، وتلقيح نظام الجذر مع 500 ميكرولتر من ثقافة الجذمور (OD600 = 0.025).
- اتبع تشكيل العقيدات عبر الزمن. وبعد أربعة أسابيع من التلقيح، يمكن عد العقيدات وحصادها لتحديد كفاءة التموجات.
9 - تحليل هيكل العقيدات الخلوي
- جمع 10-15 العقيدات في أنبوب 2 مل تحتوي على المثبت (5٪ الجلوتارلديهايد في 0.1 M الفوسفات العازلة، درجة الحموضة 7.2). تطبيق فراغ ل1/2-1 ساعة وحضانة بين عشية وضحاها في 4 درجة مئوية. خلال هذه الفترة، تغرق العينات إلى الجزء السفلي من الأنبوب.
ملاحظة:يمكن تخزين الحل المثبت في 4 درجة مئوية للاستخدام قبل 2-4 أسابيع~ . تأكد من ارتداء القفازات عند العمل مع إصلاح الأنسجة. - غسل العقيدات 2X مع 0.1 M الفوسفات العازلة، والحموضة 7.2. تطبيق 10 دقائق فترات بين كل خطوة الغسيل.
- تجفيف العينات عن طريق الحضانة في وقت لاحق في 30٪، 50٪، 70٪، و 100٪ الإيثانول. لضمان إزالة جميع المياه من العينات، كرر خطوة الإيثانول 100٪ 3x. تطبيق 10 دقائق فترات بين كل خطوة الجفاف.
- إعداد خليط البلمرة I (PM-I) عن طريق إضافة 1 حزمة من تصلب الأول إلى 2.5 مل من PEG400 مختلطة مع 100 مل من HEMA (2-هيدروكسي إيثيل ميثاكريلات) القائم على حل الراتنج. تحريك الحل لمدة 15 دقيقة ~ لإذابة تماما تصلب الأول. في وقت لاحق، تخزين PM-I في -20 درجة مئوية.
- إزالة الإيثانول من الخطوة 9.3. والتسلل العينات في الترتيب التالي: PM-I:100٪ الإيثانول (1:3، V / V)، PM-I:100٪ الإيثانول (1:1، V / V)، وPM-I: 100٪ الإيثانول (3:1، V / V). احتضان العينات في كل حل في RT لمدة ساعة 1/2-1 أو حتى تغرق العينات إلى أسفل.
- احتضان عينات بين عشية وضحاها في 4 درجة مئوية في 100٪ PM-I الحل.
- إعداد خليط البلمرة الثاني عن طريق خلط PM-I وهاردلر الثاني في نسبة 15:1 (V/v). ملء القالب البلاستيك مع حل البلمرة، وتوجيه العينات أفقيا في الجزء السفلي من القالب، وتغطية مع قطعة من رقائق الختم مرنة. تجنب تشكيل فقاعات الهواء.
ملاحظة:كما يبدأ الحل للبلمرة عند التعرض لRT، في محاولة لتوجيه العينات في أسرع وقت ممكن في حامل البلاستيك. يتم الانتهاء من البلمرة بعد الحضانة بين عشية وضحاها في RT، أو 1 ساعة في 37 درجة مئوية. - إزالة غطاء رقائق الختم المرنة من الخطوة 9.7 ووضع حامل للعينات البوليمرية. لتركيب حامل إلى العينات، حل 10 مل من مسحوق الراتنج ميثاكريلات الميثيل القائم في 5 مل من محلول الراتنج القائم على ميثاكريلات الميثيل. بسرعة إضافة الحل إلى ثقب في الجزء العلوي من حامل.
ملاحظة:تنفيذ خطوة البلمرة في غطاء محرك الدخان (~ 30 دقيقة في RT). - عينات قسم Microtome إلى سمك 4-5 م. وضع شريحة المجهر على لوحة ساخنة 58 درجة مئوية وإضافة قطرة كبيرة من الماء إلى كل شريحة. ضع الأقسام في الجزء العلوي من الماء. بمجرد أن تتبخر المياه، فإن الأقسام التمسك الشريحة.
- شرائح وصمة عار عن طريق غمر في 0.05 ٪ (ث / الخامس) تولويدين الأزرق لمدة 2 دقيقة. في وقت لاحق، شطف الشرائح 3X مع الماء النقي جدا. يمكن ملاحظة الشرائح باستخدام مجهر حقل مشرق.
10. Mycorrhization من P. andersonii Plantlets
-
إعداد ابوتافاوس غير منتظم الجراثيم 'اوكولوم
- إعداد كومة من المرشحات المنسوجة البوليستر مع الأحجام التالية (من أعلى إلى أسفل): 210 ميكرومتر، 120 ميكرومتر، و 36 حجم شبكة.
- ماصة الكمية المطلوبة من تعليق بوغ التجارية على كومة من مرشحات البوليستر. شطف المرشحات 3X مع 100 مل من المياه الأوتوكلاف ة منزوعة المعادن. يتم الاحتفاظ الجراثيم على سطح مرشح 36 ميكرومتر.
ملاحظة:إعداد تعليق بوغ في مجلس الوزراء تدفق شامل لمنع التلوث. - تفكيك كومة البوليستر والحفاظ على مرشح 36 درجة مئوية فقط. كرر خطوة الغسيل مع المياه الأوتوكلافة منزوعة المعادن لمدة لا تقل عن 6X.
- ضع المرشح على طبق بيتري واعيد تعليق الجراثيم في المياه الأوتوكلافة المنزوعة المعادن. استخدم كمية من الماء تساوي حجم تعليق بوغ المستخدمة في الخطوة 10.1.2. نقل تعليق بوغ إلى أنبوب معقم عن طريق الأنابيب.
- ضع 5 قطرات من 20 درجة مئوية من تعليق بوغ على شريحة زجاجية وعد عدد الجراثيم باستخدام المجهر مشرق الميدان. تحويل التهم بوغ إلى نسبة من الجراثيم / مل وتخفيف تعليق بوغ حتى تصل إلى 250 الجراثيم / مل. تخزين تعليق بوغ في 4 درجة مئوية.
- قم بإجراء عملية تحديد التّسعام. ولهذه الغاية، أضف 800 غرام من الولاقم الأوتوكلاف المكمّل بـ 70 مل من 1/2-Hoagland متوسطة إلى معقمة من الأواني البولي بروبلين الشفافة (انظر الجداول5-6). خلط ة ومتوسطة مباشرة في وعاء عن طريق هز بقوة.
- وضع واحد P. أندرسوني بلانتليت في كل وعاء، وماصة 1 مل من تعليق بوغ مباشرة على جذر مصنع P. andersonii. التأكد من تضمين العديد من الأواني التي تحتوي على النباتات P. andersonii التي تم تحويلها مع بنية التحكم في كريسبر (انظر الجدول التكميلي1).
- الأواني الحضانة في غرفة النمو المناخية (28 درجة مئوية، 16 ح: 8 ح يوم: ليلة) لمدة 6 أسابيع.
- إخراج النباتات من الأواني وغسل الجذور بالماء الجاري لإزالة أكبر قدر ممكن من الفحم.
- قطع الجذور في 1 سم قطع طويلة ويغلي القطع الجذرية في 10٪ KOH (ث / الخامس) لمدة 20 دقيقة في 90 درجة مئوية. في وقت لاحق، وضع الجذور المسلوقة على مصفاة الخلية مع حجم شبكة 100 ميكرومتر وشطف 3X مع 50 مل من الماء.
- جذور وصمة عار مع 0.05٪ (ث / الخامس) التربان الأزرق في لاكتوباكليسرول (300 مل من حمض اللبنيك؛ 300 مل من الجلسرين؛ و 400 مل من المياه المنزوعة المعادن) لمدة 5 دقائق في 90 درجة مئوية في حمام الماء أو كتلة التدفئة. في وقت لاحق، نقل الجذور إلى 30٪ الجلسرين. يمكن تخزين عينات الجذر في RT.
- ضع 15-25 شظايا الجذر على شريحة المجهر واحد. يُضاف الجلسرين بنسبة 30% ويُغطّى بغلاف زجاجي ويُضغط حتى تصبح القطع الجذرية مسطحة. مراقبة شظايا الجذر باستخدام المجهر حقل مشرق ويسجل الاستعمار mycorrhizal.
ملاحظة:يتم وصف طريقة لتسجيل mycorrhization وفقا لTrouvelot وآخرون. يستخدم هذا الأسلوب عدة فئات (%F و%M و%A)، مما يسمح بتقدير سريع لمستوى الاستعمار mycorrhizal لكل جزء جذر ووفرة arbuscules.
Representative Results
P. andersonii رريس يمكن أن تزرع في الدفيئة مكيفة في 28 درجة مئوية و ~ 85٪ الرطوبة النسبية (الشكل1A). في ظل هذه الظروف، تبدأ الأشجار المزهرة في 6-9 أشهر بعد الزراعة. الإناث P. أندرسوني الزهور إنتاج التوت أن كل يحتوي على بذرة واحدة. خلال النضج، والتوت تغيير اللون. أولا من الأخضر إلى الأبيض، وبعد ذلك من الأبيض إلى البني (الشكل1B). البذور المستخرجة من التوت البني الناضجة، تنبت بشكل جيد بعد دورة درجة الحرارة لمدة 10 أيام وحضانة لمدة 7 أيام على لوحات SH-0 (الشكل1C). تستمر البذور الإنبات في التطور إلى شتلات صغيرة يمكن استخدامها للتجريب بعد حوالي 4 أسابيع (الشكل1D).
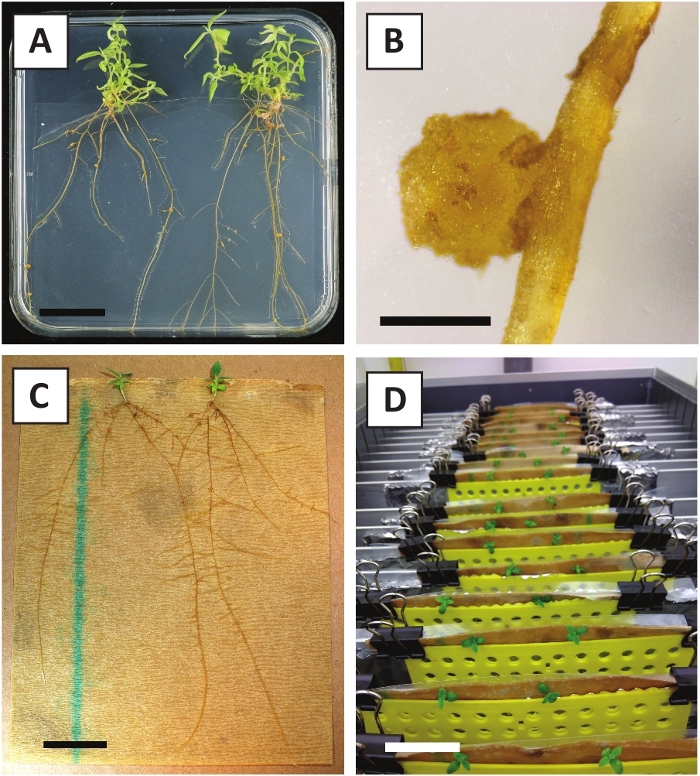
لقد أظهرنا سابقا أن petioles وشرائح من الشباب P. أندرسوني ينبع يمكن أن تتحول بكفاءة باستخدام A. tumefaciens سلالة AGL110. في بداية إجراء التحويل، يتم زراعة الأنسجة explants مع A. tumefaciens لمدة 2 أيام عند 21 درجة مئوية (الشكل2A). تؤدي الزراعة المشتركة المطولة إلى الإفراط في استعمار الأنسجة من قبل A. tumefaciens، وبالتالي ينبغي منعها (الشكل2B). بعد فترة الزراعة المشتركة، يتم نقل الأنسجة إلى وسائل الإعلام الانتقائية، مما يعزز نمو الأنسجة المحولة. بعد أسبوعين إلى ثلاثة أسابيع، لوحظ عموما صغيرة خضراء صغيرة صغيرة صغيرة صغيرة صغيرة على طول سطح الجرح الأصلي (الشكل2C). وينبغي أن تستمر هذه كالي في النمو وتطوير 1 أو أكثر من يطلق النار تحولت بشكل مفترض في 6-8 أسابيع بعد بدء إجراء التحويل (الشكل2D). في هذه المرحلة، عادة ما تتراوح كفاءة التحول من ~10-30٪ للتحولات التي بدأتمع explants الأنسجة المأخوذة من فروع ناضجة وخشبية جزئيا (الجدول 7). إذا بدأت التحولات مع explants مأخوذة من نصائح الشباب وسريعة النمو من الفروع التي لا تحمل الزهور حتى الآن،يمكن تحقيق كفاءة التحول من ~ 65-75٪ (الجدول 7). في بعض الأحيان، يتم تشكيل كالي بيضاء على جانب explant التي ليست على اتصال مع المتوسطة، وبالتالي، لا تواجه اختيار كاناميسين. هذه كالي في كثير من الأحيان ليست المعدلة وراثيا وأي يطلق النار شكلت من هذه كالي عموما سوف التبييض ويموت بعد الاتصال المباشر مع الكاناميسين التي تحتوي على المتوسطة (الشكل2E). في حالة انخفاض معدل التحول و /أو كانت المواد الأولية دون المستوى الأمثل، قد تتحول قطع الأنسجة إلى اللون البني (الشكل2F)وتعاني من الإفراط في الانتشار من قبل A. tumefaciens (الشكل2G). لمنع A. tumefaciens من الانتشار والإفراط في زراعة النباتات القريبة، مطلوب المرطبات العادية من المتوسط، والنباتات المصابة بشدة تحتاج إلى إزالة. وبمجرد وضع البراعم المعدلة وراثيا الفردية في وسط الانتشار، فإن الإفراط في الانتشار من قبل A. tumefaciens لا يحدث عموما بعد الآن (الشكل2H). يمكن أن تتضاعف عمليات إطلاق النار المعدلة وراثيا من خلال الانتشار في المختبر، والتي سوف تؤدي إلى عشرات من يطلق النار في فترة شهر واحد (الشكل3A-B). ويمكن وضع هذه يطلق النار على تأصيل المتوسطة، والتي ينبغي أن تحفز تشكيل الجذر بعد ~ 2 أسابيع (الشكل3C-D). ويمكن استخدام النباتات المتجذرة في وقت لاحق للتجريب.
لإنشاء خطوط متحولة بالضربة القاضية، ونحن الاستفادة من كريسبر / Cas9 بوساطة الطفرات. لهذه الغاية، ونحن الاستفادة من ناقلات ثنائية تحتوي على الجينات المقاومة كانامايسين NPTII، وهو تسلسل ترميز Cas9 مدفوعا المروج CaMV35S و 2 sgRNAs لكل جين الهدف التي يتم التعبير عنها من المروج RNA الصغيرة AtU6P20. ويرد في الشكل 4Aتمثيل رسومي للبناء المستخدم في الطفرات كريسبر/كاس9 بوساطة من P. andersonii . باستخدام هذه الطريقة، ويلاحظ تحرير الجينوم في ~ 40٪ من يطلق النار تحولت بشكل مفترض10. لتحديد خطوط المتحولين، يتم كتابة اللقطات التي تم تحويلها بشكل مفترض للطفرات في الموقع (المواقع) المستهدفة sgRNA باستخدام التمهيديات التي تغطي المنطقة المستهدفة. وترد في الشكل 4مثال على النتائج المتوقعة. كما يمكن أن نرى من الصورة التي اتخذت بعد الكهربائي هلام، والعديد من العينات تنتج amplicon PCR مع حجم مماثل لنوع البرية (الشكل4B). قد تحتوي هذه النباتات على الإندلات الصغيرة التي لا يمكن تصورها بواسطة الكهربائي هلام أغاروز أو تبقى غير محررة من قبل إنزيم Cas9. بالإضافة إلى ذلك، تنتج عدة عينات نطاقات مختلفة في الحجم عن النوع البري (على سبيل المثال، الخطوط 2 و4 و7 و8 في الشكل 4B). في هذه الأسطر، 1 (خطوط 4 و 7 و 8) أو كليهما (السطر 2) الأليلات تحتوي على الindels أكبر التي يمكن تصورها بسهولة. يتم الكشف عن الطبيعة الدقيقة للطفرات في الموقع (المواقع) المستهدفة بعد تسلسل amplicon PCR. كما يمكن أن نرى من الشكل 4C، كل من الإنديلات الصغيرة من 1-4 bp ، وكذلك ، يمكن الحصول على حذف أكبر بعد CRISPR / Cas9 mutagenesis. في الشكل 4C، تسلسل السطر 1 مطابق لتسلسل النوع البري، مما يشير إلى أن هذا السطر هرب من التحرير، وبالتالي، يجب التخلص منه. من بين الخطوط التي تحتوي على الطفرات، يمكن تحديد الطفرات، المتجانسة والمتحولين ثنائية الاليليك (الشكل4C). ومع ذلك، المسوخ heterozygous هي عموما نادرة10. يمكن نشر المتحولين المتجانسين أو ثنائية الاليليك بالضربة القاضية بشكل نباتي للحصول على مواد كافية للتحليل الفينوتيبيك. كما يتم إجراء التحليل phenotypic في جيل T 0، من المهم التحقق مما إذا كانت خطوط متحولة قد يكون chimeric. ولهذه الغاية، يجب تكرار الأنماط الجينية على ما لا يقل عن 3 عينات مختلفة مأخوذة من كل خط متحول. وإذا كانت نتائج النماذج الجينية متطابقة مع بعضها البعض وعينة النماذج الجينية الأصلية (مثل الخط 8 في الشكل 4دال)،فإن الخط متغيّر بشكل متجانس ويمكن استخدامه لمزيد من التحليل. ومع ذلك، إذا كانت نتائج النماذج الجينية تختلف بين العينات المستقلة (على سبيل المثال، الخط 4 في الشكل 4D)،فإن خط المتحولة هو chimeric ويحتاج إلى التخلص منها.
تلقيح P. andersonii مع M. multifarium BOR2 النتائج في تشكيل العقيدات الجذرية (الشكل5). وكما يتضح من الشكل 5ألف، فإن هذه العقيدات موزعة على طول النظام الجذري. العقيدات من P. andersonii هي البني الفاتح في اللون ولكن يمكن التمييز بسهولة من الأنسجة الجذرية على أساس شكلها (الشكل5B). وعادة ما تؤدي تجارب التلقيح في الأواني والنمو اللاحق لمدة 4-6 أسابيع إلى تكوين العقيدات التي تُعنى بحوالي 10-30 عقيدات (الشكل6ألف). يتم تشكيل عدد مماثل من العقيدات بعد تلقيح النباتات P. andersonii المزروعة بلوحة EKM في 4 أسابيع بعد التلقيح (الشكل6A). في الحقائب، عادة ما تشكل شتلات P. andersonii ~ 5-15 العقيدات في 5 أسابيع بعد التلقيح (الشكل5C-D، 6A). ولتحليل بنية العقيدات الخلوية، يمكن تقسيم العقيدات وملاحظتها باستخدام الفحص المجهري للحقول الساطعة. ويبين الشكل 6 باء مثالاً على مقطع طولي يمر عبر منتصف عقيدات P. andersonii. يُظهر هذا القسم الحزمة الوعائية المركزية لعقيدات P. andersonii، التي تحيط بها فصوص العقيدات التي تحتوي على خلايا مصابة (الشكل6B).
P. andersonii النباتات يمكن أيضا أن يكون mycorrhized. بعد 6 أسابيع من التلقيح مع R. عدم انتظام،تردد الاستعمار mycorrhizal عادة ما تصل إلى > 80٪ (الشكل6C). في هذه المرحلة الزمنية، عموما ~ 30٪ من الخلايا تحتوي على arbuscules (الشكل6C). تظهر صورة تمثيلية لجزء جذر P. andersonii يحتوي على arbuscles في الشكل 6D.

الشكل 1: الصور التمثيلية لـ P. أندرسونشجرة، والبذور والشتلات. (أ) شجرة P. andersonii عمرها ستة أشهر مزروعة في تربة بوتينغ في دفيئة مكيفة عند 28 درجة مئوية. (ب) صورة تمثيلية تصور التوت P. andersonii في مراحل مختلفة من النضج. الشباب P. أندرسوني التوت (غير ناضجة) سوف تغير اللون من الأخضر إلى الأبيض وأخيرا إلى البني (ناضجة) عند النضوج. (ج) ب. أندرسوني بذور احتضنت على SH-0 المتوسطة لمدة أسبوع واحد. دائرة سوداء تشير إلى شتلة إنبات. (د) أربعة أسابيع من العمر P. أندرسوني الشتلات نمت في SH-0 المتوسطة. قضبان مقياس تساوي 25 سمفي (أ) و 1 سم في(B-D). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
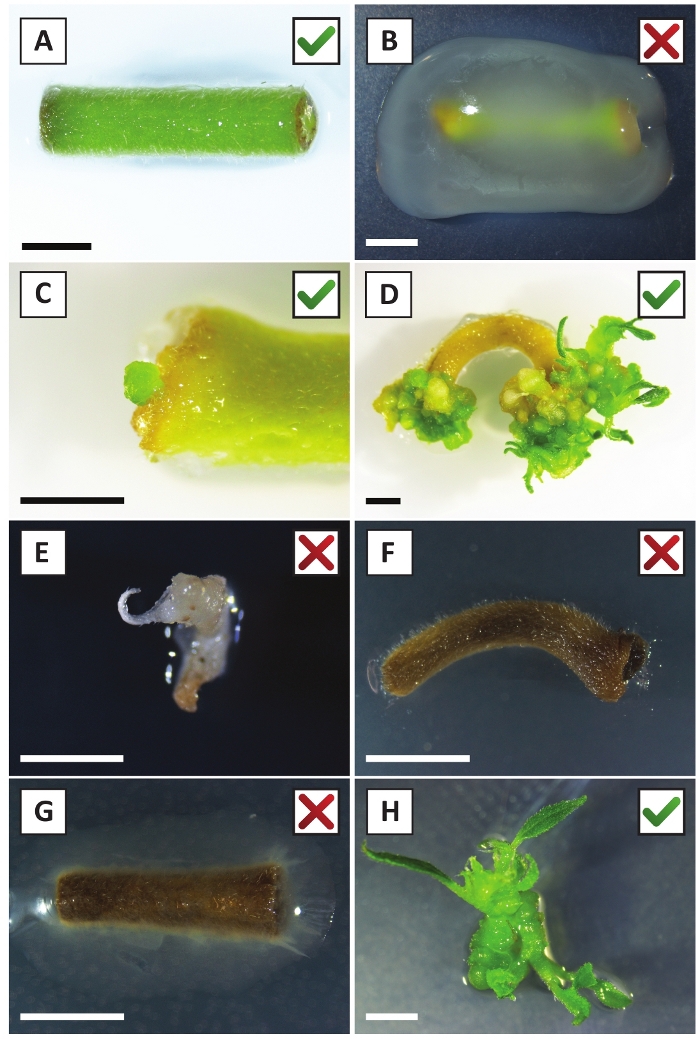
الشكل 2: الصور التمثيلية للنباتات في مراحل مختلفة من إجراء التحول المستقر. (أ) Explant المزروعة مع A. tumefaciens. (ب) Explant متضخمة من قبل A. tumefaciens خلال أول 2 أسابيع بعد التحول. (ج) الكالس الصغير المعدل وراثيا شكلت بالقرب من موقع الجرح من explant في 2.5 أسابيع بعد الزراعة المشتركة. (د) صورة تمثيلية لمصنع في 6 أسابيع بعد زراعة مشتركة تظهر ظهور يطلق النار من (المعدلة وراثيا) كالي. (E) صورة تمثيلية لاطلاق النار الذي يصبح أبيض ويموت في نهاية المطاف عندما يكون على اتصال مباشر مع المتوسطة التي تحتوي على كاناميسين. هذا تبادل لاطلاق النار هو على الأرجح غير المعدلة وراثيا وهرب اختيار كانامايسين عندما تعلق على explant. (F) صورة تمثيلية لمصنع تم تحويله دون جدوى. (ز) صورة تمثيلية لمصنع تحول دون جدوى متضخمة من قبل A. tumefaciens. (ح) تبادل لاطلاق النار واحدة المعدلة وراثيا نمت على وسائل الانتشار في 8 أسابيع بعد الزراعة المشتركة مع A. tumefaciens. أشرطة مقياس يساوي 2.5 مم. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 3: الصور التمثيلية في المختبر الانتشار. (أ) يطلق النار على وسائل الانتشار. تم التقاط الصورة بعد أسبوع واحد من تحديث اللوحات. (ب) يطلق النار على وسائل الانتشار. تم التقاط الصورة بعد 4 أسابيع من تحديث اللوحات. (C) قطع حديثا يطلق النار وضعت على تأصيل المتوسطة. (D) يطلق النار على تأصيل المتوسطة لمدة 2 أسابيع. لاحظ وجود الجذور. أشرطة مقياس تساوي 2.5 سم، يرجى النقر هنا لعرض نسخة أكبر من هذا الرقم.
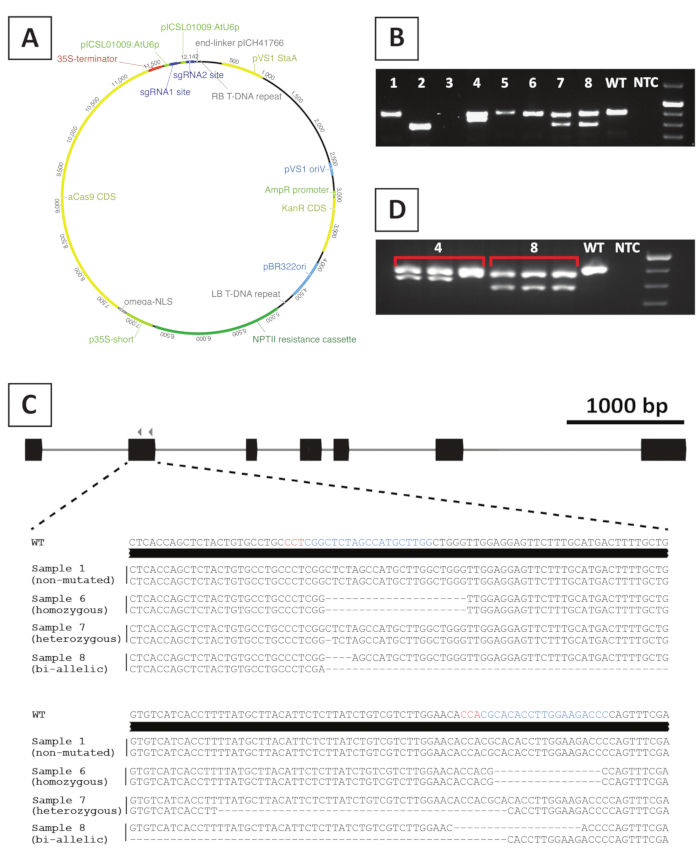
الشكل 4: النتائج التمثيلية بعد الكتابة الجينية لخطوط P. andersonii T0 المعدلة وراثيا CRISPR/Cas9 متحولة. (أ) خريطة تمثيلية لمتجه ثنائي يستخدم لـ CRISPR/Cas9-بوساطة الطفرات من P. andersonii. (ب) نتيجة تمثيلية بعد النمط الجيني القائم على PCR لخطوط متحولة كريسبر/كاس9 المحتملة باستخدام التمهيديات التي تغطي الموقع (المواقع) المستهدفة sgRNA. يظهر هو صورة بعد الأوروز جل الكهربائي من amplicons. وتشير الأرقام إلى العينات المأخوذة من خطوط فردية من الجينات. يشير النوع البري (WT) وعدم وجود عنصر تحكم قالب (NTC) إلى الممرات التي تحتوي على عناصر تحكم إيجابية وسلبية، على التوالي. (C) التمثيل التخطيطي للأليليس متحولة التي تم الحصول عليها بعد كريسبر / Cas9 بوساطة تحرير الجينات. أبرز في الألوان الزرقاء والحمراء هي المواقع المستهدفة sgRNA وتسلسل PAM، على التوالي. (د) نتيجة تمثيلية بعد الفحص القائم على PCR لخطوط متحولة chimeric المحتملة. يظهر هو صورة بعد الأوروز جل الكهربائي من 3 عينات الفردية مأخوذة من خطوط متحولة 4 و 8. لاحظ أن خط المتحولين المتحولين وراثيا 4 هو chimeric. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
الشكل 5: الصور التمثيلية لتجارب الإيماء في الصفائح والحقائب. (أ) الإنماء على لوحات تحتوي على AGAR-solidified EKM المتوسطة وتلقيحها مع M. multifarium BOR2 لمدة 4 أسابيع. (ب) صورة تمثيلية لعقيدات جذر P. andersonii. تم التقاط الصورة في 4 أسابيع بعد التلقيح مع M. multifarium BOR2. (ج) التموجات في الحقائب التي تحتوي على السائل EKM المتوسطة. تم تلقيح الشتلات مع براديهيزوبيوم sp. Kelud2A4 لمدة 5 أسابيع. (D) صورة تمثيلية لإعداد كامل يستخدم للإشارة في الحقائب. قضبان مقياس تساوي 2.5 سم في(A,C)،1 مم في (B)، و 5 سم في(D). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
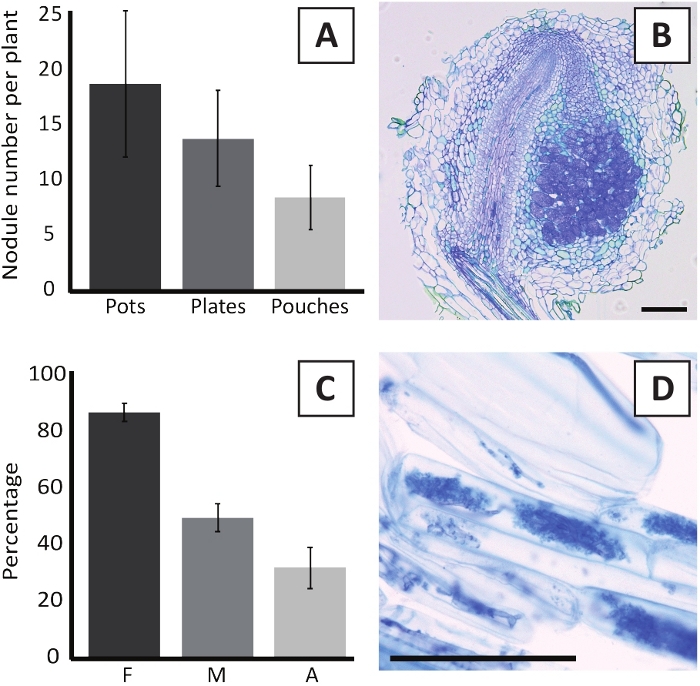
الشكل 6: النتائج التمثيلية لتجارب الإيماء وmycorrhization. (أ) رسم بياني تمثيلي شريط يبين عدد العقيدات التي تشكلت لكل مصنع في 4 أسابيع بعد التلقيح مع M. multifarium BOR2 في الأواني أو على لوحات وفي 5 أسابيع بعد التلقيح مع براديrhizobium sp. Kelud2A4 في الحقائب. البيانات تمثل المتوسط ± SD (n = 10). (ب) صورة تمثيلية للمقطع الطولي من خلال عقيدات تشكلت في 4 أسابيع بعد التلقيح مع M. multifarium BOR2. القسم ملطخ بالأزرق التولويدين. (C) الرسم البياني شريط ممثل يظهر القياس الكمي من mycorrhization. المتغيرات الكمية وفقا ً لـ Trouvelot وآخرون29 هي F، وتواتر الشظايا الجذرية التي تم تحليلها والموجودة في mycorrhized؛ M، شدة العدوى. A، وفرة من arbuscules ناضجة في نظام الجذر الكلي. تم تحديد كمية Mycorrhization في 6 أسابيع بعد التلقيح مع R. عدم انتظام (سلالة DAOM197198). البيانات تمثل المتوسط ± SD (n = 10). (د) صورة تمثيلية من arbuscules ناضجة موجودة في الخلايا القشرية الجذر P. andersonii في 6 أسابيع بعد التلقيح مع R. غير النظامية. أشرطة مقياس يساوي 75 درجة مئوية.
| مجمع | SH-0 | SH-10 | انتشار متوسط | تأصيل المتوسطة | تسلل وسط |
| SH-البازلة الملح المتوسطة | 3.2 غ | 3.2 غ | 3.2 غ | 3.2 غ | 3.2 غ |
| خليط فيتامين SH | 1 غرام | 1 غرام | 1 غرام | 1 غرام | 1 غرام |
| السكروز | - | 10 غ | 20 غ | 10 غ | 10 غ |
| BAP (1 ملغ / مل) | - | - | 1 مل (4.44 درجة مئوية) | - | - |
| IBA (1 ملغ / مل) | - | - | 100 ميكرولتر (0.49 درجة مئوية) | 1 مل (4.92 درجة مئوية) | - |
| NAA (1 ملغ / مل) | - | - | - | 100 ميكرولتر (0.54 درجة مئوية) | - |
| 1 M MES pH = 5.8 | 3 مل | 3 مل | 3 مل | 3 مل | 3 مل |
| 1 متر كوه | ضبط الحموضة إلى 5.8 | ضبط الحموضة إلى 5.8 | ضبط الحموضة إلى 5.8 | ضبط الحموضة إلى 5.8 | ضبط الحموضة إلى 5.8 |
| دايشين أجار | 8 غ | - | 8 غ | 8 غ | - |
الجدول 1: تكوين30 من الوسائط القائمة على Schenk-Hildebrandt المستخدمة لزراعة شتلات P. andersonii، والتحول المستقر، والانتشار في المختبر. إذابة المركبات الصلبة في 750 مل من المياه النقية جدا قبل إضافة مخزونات السائل. بعد ذلك، قم بتعبئة الوسائط الكاملة إلى 1 لتر إعداد BAP، IBA، NAA الأسهم في 0.1 M KOH وتخزينها في -20 درجة مئوية.
| قبل الأوتوكلاف: | ||
| مجمع | المبلغ لكل لتر | التركيز النهائي |
| مانيتول | 5 غ | 27.45 مليون متر مربع |
| نا غلوكونات | 5 غ | 22.92 مليون متر مربع |
| الخميرة استخراج | 0.5 غ | - |
| MgSO4·7H2O | 0.2 غ | 0.81 مليون متر مربع |
| فى الان | 0.1 غ | 1.71 مليون متر مربع |
| K2HPO4 | 0.5 غ | 2.87 مليون متر مربع |
| بعد الأوتوكلاف: | ||
| مجمع | المبلغ لكل لتر | التركيز النهائي |
| 1.5 M CaCl2 | 1 مل | 1.5 مليون متر مربع |
الجدول 2: تكوين الخميرة مانيتول (YEM) المتوسطة المستخدمة لزراعة جذمور. ضبط درجة الحموضة إلى 7.0 وملء مع المياه النقية جدا إلى 1 لتر. لإعداد وسط YEM المقوي بأجار، أضف 15 غرام من الميكرواغار قبل الأوتوكلاف.
| قبل الأوتوكلاف: | |||
| مجمع | تركيز المخزون | المبلغ لكل لتر متوسط | التركيز النهائي |
| KH2PO4 | 0.44 M | إضافة 2 مل | 0.88 مليون متر مربع |
| K2HPO4 | 1.03 M | إضافة 2 مل | 2.07 مليون متر مربع |
| 500x الصغيرة العناصر الأوراق المالية الحل | - | إضافة 2 مل | - |
| MES pH = 6.6 | 1 متر مربع | إضافة 3 مل | 3 مليون متر مربع |
| Hcl | 1 متر مربع | ضبط الحموضة إلى 6.6 | - |
| مياه نقية جداً | - | تعبئة إلى 990 مل | - |
| بعد الأوتوكلاف: | |||
| مجمع | تركيز المخزون | المبلغ لكل لتر متوسط | التركيز النهائي |
| MgSO4·7H2O | 1.04 M | 2 مل | 2.08 مليون متر مربع |
| Na2SO4 | 0.35 M | 2 مل | 0.70 متر مربع |
| NH4NO3 | 0.18 M | 2 مل | 0.36 مليون متر مربع |
| CaCl2·2H2O | 0.75 M | 2 مل | 1.5 مليون متر مربع |
| Fe(III)-سيترات | 27 مليون متر مربع | 2 مل | 54 ميكرومتر |
الجدول 3: تكوين 1 L المعدلة EKM المتوسطة31 المستخدمة لP. andersonii تحليل الإيماءة. ويرد في الجدول 4 تكوين محلول مخزون العناصر الدقيقة 500x. لإعداد 2٪ أجار المقوي EKM المتوسطة، إضافة 20 غرام من أجار دايشين قبل الأوتوكلاف. الأوتوكلاف وMgSO4·7H2O, Na2SO4,CaCl2·2H2O, و Fe(III)-citrate الأسهم لتعقيم. تصفية تعقيم NH4NO3 حل الأسهم لتعقيم.
| مجمع | المبلغ لكل لتر | تركيز المخزون |
| MnSO4 | 500 ملغ | 3.31 مليون متر مربع |
| ZnSO4·7H2O | 125 ملغ | 0.43 مليون متر مربع |
| CuSO4·5H2O | 125 ملغ | 0.83 مليون متر مربع |
| H3BO3 | 125 ملغ | 2.02 مليون متر مربع |
| Na2MoO4·2H2O | 50 ملغ | 0.21 مليون متر مربع |
الجدول 4: تكوين محلول مخزون العناصر الدقيقة 500x المستخدم لإعداد متوسط EKM المعدل. تخزين محلول مخزون العناصر الدقيقة عند درجة حرارة 4 درجة مئوية.
| المركبات | تركيز المخزون | المبلغ لكل لتر متوسط | التركيز النهائي |
| K2HPO4 | 20 مليون متر مربع | 1 مل | 0.2 مليون متر مربع |
| NH4NO3 | 0.28 M | 10 مل | 2.8 مليون متر مربع |
| MgSO4 | 40 مليون متر مربع | 10 مل | 0.4 مليون متر مربع |
| K2SO4 | 40 مليون متر مربع | 10 مل | 0.4 مليون متر مربع |
| Fe(II)-EDTA | 9 مليون متر مربع | 10 مل | 0.9 مليون متر مربع |
| كاليفورنيا2 | 80 مليون متر مربع | 10 مل | 0.8 مليون متر مربع |
| 50X الصغيرة العناصر الأوراق المالية الحل | - | 10 مل | - |
الجدول 5: تكوين 1/2-Hoagland32 المتوسطة المستخدمة في الاختبارات mycorrhization. ويرد في الجدول 6 تكوين محلول مخزون العناصر الدقيقة 50x. إعداد الحل Fe(II)-EDTA عن طريق الجمع بين FeSO4·7H2O (9 m) و Na2· EDTA (9 mM) في 1 حل الأسهم، وتخزينها في 4 درجة مئوية. ضبط درجة الحموضة من المتوسط إلى 6.1 باستخدام 1 M KOH وملء مع المياه النقية جدا إلى 1 لتر.
| المركبات | المبلغ لكل لتر | تركيز المخزون |
| H3BO3 | 71.1 ملغ | 1.15 مليون متر مربع |
| MnCl2·4H2O | 44.5 ملغ | 0.22 مليون متر مربع |
| CuSO4·5H2O | 3.7 ملغ | 23.18 درجة مئوية |
| ZnCl2 | 10.2 ملغ | 74.84 درجة مئوية |
| Na2MoO4·2H2O | 1.2 ملغ | 4.96 ميكرومتر |
الجدول 6: تكوين محلول مخزون العناصر الدقيقة 50x المستخدم لإعداد 1/2-Hoagland المتوسطة.
| عمر النباتات السابقة | كفاءة التحول |
| الشباب | 69.4 ± 6.2٪ (ن = 2) |
| ناضجه | 18.3 ± 10.2٪ (ن = 15) |
الجدول 7: كفاءة التحول في P. andersonii. هنا، يتم تعريف كفاءة التحول على أنها النسبة المئوية للexplants التي تشكل ما لا يقل عن 1 callus المعدلة وراثيا أو تبادل لاطلاق النار. تم تسجيل كفاءة التحول في 6 أسابيع بعد التحول ويصور على أنه يعني ± SD. ن يشير إلى عدد من تجارب التحول التي تم تحديد كفاءة التحول.
الملف التكميلي 1: نظرة عامة على بنيات المستوى 1 والمستوى 2 المستخدمة لـ CRISPR/Cas9 mutagenesis. الرجاء النقر هنا لتحميل هذا الملف.
Discussion
تمثل البقوليات وجنس القنب البعيد الصلة باراسبونيا اثنين فقط من الأنواع النباتية القادرة على إقامة علاقة بطانة الرحم مع جذوبية تحديد النيتروجين وتشكيل العقيدات الجذرية. الدراسات المقارنة بين الأنواع من كلا الكلدس هي ذات صلة للغاية لتوفير رؤى في الشبكات الوراثية الأساسية مما يسمح بهذا التكافل. وفي الوقت الراهن، تُجر الدراسات الجينية أساساً في البقوليات؛ خصوصا النوعين نموذج M. truncatula و L. japonicus. لتوفير منصة تجريبية إضافية وتسهيل الدراسات المقارنة مع عدم البقول، ونحن نصف هنا بروتوكول مفصل للتحول مستقرة والتحليلات الوراثية العكسية في P. andersonii. يستخدم البروتوكول المعروض الانتشار في المختبر لخطوط T0 المعدلة وراثياً P. andersonii، مما يسمح ببدء التحليل الفينوتي في غضون 4 أشهر بعد زراعة A. tumefaciens المشتركة. هذا هو أسرع بكثير من البروتوكولات الحالية التي تم وضعها لتحويل مستقر من البقوليات33. وهذا يجعل P. andersonii نموذج بحث جذاب.
يحتوي البروتوكول الموضح هنا على عدة خطوات هامة. الأول يتعلق بإنبات البذور. لإعداد بذور P. andersonii للإنبات، تحتاج البذور إلى أن تكون معزولة عن التوت. ويتم ذلك عن طريق فرك التوت على قطعة من ورق الأنسجة أو ضد داخل غربال الشاي. هذا الإجراء يحتاج إلى تنفيذ بلطف من أجل منع الأضرار التي لحقت معطف البذور. إذا كان معطف البذور يحصل التالفة، التبييض يمكن أن تدخل البذور أثناء التعقيم، مما يقلل من جدوى البذور. لكسر البذور الخاملة، تخضع البذور لدورة درجة حرارة لمدة 10 أيام. ومع ذلك ، على الرغم من هذا العلاج ، لا يتم مزامنة الإنبات تماما. عموما، تظهر البذور الأولى ظهور الراديوكل بعد 7 أيام، ولكن البعض الآخر قد يستغرق عدة أيام أطول لإنبات.
وتتعلق النقاط الحرجة في إجراء التحويل باختيار المواد الأولية ومدة خطوة الزراعة المشتركة. للوصول إلى التحول الفعال، فمن الأفضل استخدام ينبع صحية والشباب أو petioles من النباتات غير المعقمة التي تزرع في الدفيئة كمادة البداية. من أجل الحث على نمو الفروع الشابة، فمن المستحسن لتقليم أشجار باراسبونيا كل 2-3 أشهر وتحديث الأشجار مرة واحدة في السنة. بالإضافة إلى ذلك، يجب تنفيذ خطوة الزراعة المشتركة لمدة يومين فقط. الزراعة المشتركة لفترات طويلة تشجع الإفراط في استعمار الأنسجة explants من قبل A. tumefaciens ويقلل عموما من كفاءة التحول. لمنع الإفراط في الاستعمار من قبل A. tumefaciens من المهم أيضا لتحديث لوحات بانتظام التي تزرع explants. في حالة حدوث إفراط في الاستعمار، يمكن غسل الأنسجة المنفية (انظر القسم 3.8) لإزالة خلايا A. tumefaciens. ننصح بإضافة التبييض إلى الحل SH-10 المستخدمة لغسل (التركيز النهائي: ~ 2٪ هيبوكلوريت). من المهم أن نلاحظ أن هذه الخطوة الغسيل إضافية قد لا تعمل على explants المصابين بشدة (الشكل2B). في حالة التحول مع بناء كريسبر / Cas9 تسفر فقط عن عدد محدود من يطلق النار تحول المفترض أو إذا كان من المتوقع أن يسبب تحول جين معين مشاكل في التجديد، فإنه من المستحسن أن تشمل بناء مكافحة ناقلات فارغة كما السيطرة الإيجابية. وأخيراً، من المهم ضمان أن تكون جميع الخطوط المحورة وراثياً التي يتم اختيارها ناتجة عن أحداث تكامل الحمض النووي T المستقلة. لذلك، نحن تعليمات لاتخاذ واحد فقط من نوع واحد من النباتات. ومع ذلك، فإننا ندرك أن هذا يقلل من العدد المحتمل للخطوط المستقلة. إذا كانت هناك حاجة إلى العديد من الخطوط، يمكن للباحثين أن يقرروا فصل كالي تحويلها بشكل مفترض من explants الأصلي عندما تكون هذه كالي ≥ 2 ملم في الحجم والثقافة هذه كالي بشكل مستقل. وبهذه الطريقة، يمكن عزل خطوط متعددة عن كل مصنع سابق، مما يزيد من عدد الخطوط المعدلة وراثيا المحتملة.
في البروتوكول الحالي، يتم نشر خطوط المعدلة وراثيا من P. andersonii نباتيا من خلال الانتشار في المختبر. وميزة ذلك هي أن العديد من النباتات المعدلة وراثيا يمكن أن تولد في فترة زمنية قصيرة نسبيا. ومع ذلك، يحتوي هذا الأسلوب أيضاً على عدة قيود. أولا، الحفاظ على خطوط T0 المعدلة وراثيا من خلال الانتشار في المختبر هو كثيف العمالة ويمكن أن يؤدي إلى تغييرات وراثية غير مرغوب فيها أو الجيني34،35. ثانيا، خطوط T0 لا تزال تحتوي على نسخة من T-DNA، بما في ذلك كاسيت مقاومة المضادات الحيوية. وهذا يحد من عدد عمليات إعادة التحويل المحتملة، حيث أن علامات التحديد المختلفة مطلوبة لكل عملية إعادة تحويل. حاليا، لقد اختبرنا فقط التحول باستخدام اختيار كانامايسين أو هيغرومايسين (البيانات غير المعروضة). وعلاوة على ذلك، فإن وجود تسلسل ترميز Cas9 وsgRNAs في خطوط T0 المعدلة وراثيا يعقد دراسات التكملة. يمكن إجراء الاختبارات التكميلية ولكنها تتطلب تغيير الموقع (المواقع) المستهدفة لـ sgRNA على هذا النحو بحيث يتم منع تحرير الجينات من بناء التكملة. ثالثا، عيب في العمل مع خطوط T0 هو أن متحولين CRISPR / Cas9 قد يكون chimeric. لمنع التحليل الفينوتي للخطوط المتحولة الشميرية، نوصي بتكرار تحليل النماذج الجينية بعد الانتشار في المختبر على ما لا يقل عن 3 لقطات مختلفة. على الرغم من أن عدد المتحولين chimeric التي تم الحصول عليها باستخدام البروتوكول الموضح هنا محدود، لوحظ في بعض الأحيان10. للتغلب على قيود العمل مع خطوط T 0، P. أندرسوني خطوط متحولة يمكن نشرها توليديا. P. أشجار أندرسون هي dioecious والرياح الملقحة2. وهذا يعني أن كل خط المعدلة وراثيا يحتاج إلى التلاعب على هذا النحو أن يتم إنتاج الزهور الذكور والإناث على فرد واحد، وتنمو في وقت لاحق على هذا النحو أن التلقيح عبر لا يحدث. كما P. andersonii هو شجرة سريعة النمو فإنه يتطلب كمية كبيرة من الفضاء في الدفيئة الاستوائية (28 درجة مئوية، ~ 85٪ الرطوبة النسبية). ولذلك، على الرغم من أن الانتشار التوليدي للخطوط المعدلة وراثياP. andersonii ممكن من الناحية التقنية، فهو يشكل تحديا لوجستيا.
في قسم البروتوكول، وصفنا 3 طرق لإيماءة من P. andersonii. وميزة نظم الصفائح والحقيبة هي أن الجذور يمكن الوصول إليها بسهولة، مما قد يسمح بتلقيح البكتيريا على الفور وبعد تكوين العقيدات مع مرور الوقت. ومع ذلك، فإن نظام لوحة كثيفة العمالة تماما، مما يجعلها أقل ملاءمة لتجارب الإيماء على نطاق واسع. عيب في نظام الحقيبة هو أنه من الصعب منع التلوث الفطري. الحقائب ليست معقمة، وبالتالي غالبا ما لوحظ النمو الفطري في النصف العلوي من الحقيبة. ومع ذلك، هذا لا يؤثر على نمو P. andersonii، وبالتالي لا تتداخل مع الاختبارات التموجات. بالإضافة إلى ذلك، فإن نظام الحقيبة هو مناسبة فقط للشتلات. على الرغم من العديد من المحاولات، لم نتمكن من زراعة النباتات التي تم الحصول عليها من خلال الانتشار في المختبر في الحقائب.
خط أنابيب P. andersonii عكس علم الوراثة الموصوفة هنا يقدم تحسنا كبيرا بالمقارنة مع طريقة تحويل الجذر القائمة A. rhizogenesالقائمة11. وباستخدام الإجراءات الموصوفة، يمكن توليد خطوط مستقرة جينياً بكفاءة ويمكن الحفاظ عليها عن طريق الانتشار في المختبر. وعلى النقيض من ذلك، فإن تحويل الجينات الجذمورية A. عابر ولا يؤدي إلا إلى تكوين جذور جينية. لأن كل جذر المعدل وراثيا ينتج عن تحول مستقل، A. الاختبارات القائمة على التحول rhizogenes تعاني من اختلاف الفينوتيبيك كبيرة. وهذا التباين أقل بكثير في حالة وجود خطوط مستقرة، على الرغم من أن الانتشار في المختبر يخلق أيضاً مستوى ما من التباين. وبسبب هذا الاختلاف المنخفض وحقيقة أن النباتات المتعددة يمكن أن تكون فينوليت لكل خط مستقر، وخطوط مستقرة هي أكثر ملاءمة للتجارب الكمية مقارنة A. جذور rhizogenes-تحول. بالإضافة إلى ذلك، فإن التحول المستقر لا يعتمد على إدخال جذر الريزوجين A. تحفيز موضع (رول) الذي يؤثر على توازن هرمون الذاتية15. ولذلك، خطوط مستقرة هي الأنسب للتحليل الجيني العكسي للجينات المشاركة في التوازن الهرموني مقارنة A. جذور rhizogenes-تحول. ميزة أكثر عمومية من P. andersonii كنموذج البحوث هو أنه لم يواجه ازدواجية الجينوم كله مؤخرا (WGD). عائلة البابيليونوئية الفرعية البلينومة، والتي تشمل نموذج البقوليات M. truncatula و L. japonicus، فضلا عن Salicaceae (ترتيب Malpighiales) التي تشمل شجرة نموذج Populus trichocarpa من ذوي الخبرة WGDs ~ 65 مليون سنة مضت36،37. يتم الاحتفاظ بالعديد من نسخ الجينات paralogous الناتجة عن هذه WGDs في الجينوم من M. truncatula، L. japonicus و P. trichocarpa37،38،39، مما يخلق التكرار الذي قد يعقد التحليلات الوراثية العكسية. وبما أن P. andersonii لم يواجه الفريق العامل الأخير، فإن التحليلات الوراثية العكسية على P. andersonii قد تكون أقل تأثراً بالأداء الزائد للنسخ الجينية البارالوغوية.
إذا ما أخذنا معا، نقدم بروتوكول مفصل للتحليل الوراثي العكسي في P. andersonii. باستخدام هذا البروتوكول، يمكن إنشاء خطوط متحولة واحدة بكفاءة في إطار زمني من 2-3 أشهر10. ويمكن توسيع هذا البروتوكول لخلق أعلى ترتيب المسوخ من خلال تعدد الإرسال وsgRNAs استهداف جينات مختلفة في وقت واحد، كما هو مبين لأنواع النباتات الأخرى40،41،42. بالإضافة إلى ذلك، فإن إجراء التحول المستقر الموضح هنا لا يقتصر على استهداف الجينات CRISPR/Cas9 ولكن يمكن استخدامه أيضًا لإدخال أنواع أخرى من المنشآت (على سبيل المثال، لتجارب المروج والمراسل، أو التعبير خارج الرحم أو التحويل - التكامل). أنشأنا P. andersonii كنموذج بحثي مقارن لدراسة التكافل المتبادل مع جذوبية تحديد النيتروجين أو الفطريات endomycorrhizal. ومع ذلك، فإن البروتوكولات الموصوفة هنا توفر أيضا أدوات لدراسة جوانب أخرى من بيولوجيا هذه الشجرة الاستوائية، مثل تكوين الخشب، وتطوير الزهور ثنائية الجنس أو التركيب البيولوجي للأيض الثانوية الخاصة بالقنب.
Acknowledgements
يحب المؤلفون أن يعترفوا بمارك يوليس وصوفين كمون وسيلفستر ماريلونيه لجعل أجزاء استنساخ البوابة الذهبية متاحة من خلال قاعدة بيانات أدجين. بالإضافة إلى ذلك، نود أن نشكر إ. جيمس، ب. هادوباس، وت. ج. هيغينز على بذور P. andersonii. وقد دعمت هذا العمل المنظمة الهولندية للبحوث العلمية (منحة NWO-VICI 865.13.001؛ منحة المنافسة المفتوحة 819.01.007) ووزارة البحوث والتكنولوجيا والتعليم العالي في جمهورية إندونيسيا (منحة RISET-PRO 8245-ID).
Materials
| Name | Company | Catalog Number | Comments |
| Sigma-Aldrich | N0640 | NAA | |
| Duchefa Biochemie | M1503.0250 | MES | |
| Sigma-Aldrich | D134406 | Acetosyringone | |
| Duchefa Biochemie | X1402.1000 | X-Gal | |
| Merck | 101236 | For nucleic acid electrophoresis gel | |
| - | - | Pouches box material, hangers | |
| Merck | 101188 | NH4NO3 | |
| Sigma-Aldrich | B3408-1G | BAP | |
| Merck | 100156 | H3BO3 | |
| Thermo-Fisher | ER1011 | Used as restriction enzyme in Golden Gate cloning assembly | |
| Thermo-Fisher | 15561020 | Used in Golden Gate cloning assembly | |
| Merck | 137101 | CaCl2·2H2O | |
| Duchefa Biochemie | C0111.0025 | C16H16N5O7S2Na | |
| Thermo-Fisher | K1231 | Used for cloning the blunt-ended PCR amplicons in genotyping procedure | |
| Agronutrition | AP2011 | Containing Rhizophagus irregularis DAOM 197198 (1,000 spores/mL), used for mychorrization assay | |
| Merck | 102790 | CuSO4·5H2O | |
| Duchefa Biochemie | D1004.1000 | Used for plant tissue culture agar-based medium | |
| Merck | 105101 | K2HPO4 | |
| VWR Chemicals | 20302.293 | Na2·EDTA | |
| Duchefa Biochemie | M0803.1000 | C6H14O6 | |
| Thermo-Fisher | ER0291 | Used as restriction enzyme in Golden Gate cloning assembly | |
| Merck | 100983 | C2H5OH | |
| VWR Chemicals | BDH9232-500G | EDTA | |
| Sigma-Aldrich | Z377600-1PAK | Cellophane membrane | |
| Biomatters, Ltd. | R9 or higher | Bioinformatics software for in silico cloning and designing of sgRNAs | |
| Mega International | - | Technical information at https://mega-international.com/tech-info/ | |
| Sigma-Aldrich | 65882 | Used for fixating nodule tissues | |
| VWR Chemicals | 24385.295 | - | |
| Vink | 219341 | Pouches box material, bottom part | |
| Leica Biosystems | 14702218311 | Used as a template for plastic embedding | |
| Merck | 100317 | HCl | |
| Sigma-Aldrich | I5386-1G | IBA | |
| Merck | 103862 | C6H5FeO7 | |
| Merck | 103965 | FeSO4O·7H2O | |
| Duchefa Biochemie | I1401.0005 | IPTG | |
| Duchefa Biochemie | K0126.0010 | ||
| Sigma-Aldrich | L2000 | ||
| Merck | 105886 | MgSO4O·7H2O | |
| Merck | 105934 | MnCl2·4H2O | |
| Merck | 102786 | MnSO4O | |
| Duchefa Biochemie | M1002.1000 | Used for bacterial culture agar-based medium | |
| Manutan | 92007687 | Pouches material | |
| Paraxisdienst | 130774 | Elastic sealing foil | |
| Pull Rhenen | Agra-Perlite No.3 | Used as growing substrate in pots for nodulation assay | |
| VWR Chemicals | 391-0581 | Used as container for cellophane membranes | |
| Thermo-Fisher | F130WH | For genotyping transgenic lines | |
| Addgene | 50337 | Level 0 terminator, 3'UTR, 35s (Cauliflower Mosaic Virus) | |
| Addgene | 48017 | End-link 2 for assembling 2 level one part into a level 2 acceptor | |
| Addgene | 48018 | End-link 3 for assembling 3 level one part into a level 2 acceptor | |
| Addgene | 48001 | Level 1 acceptor. Position 5. Forward orientation | |
| Addgene | 48007 | Level 1 Acceptor. Position 1. Reverse orientation | |
| Addgene | 50268 | Level 0 promoter (0.4 kb), 35s (Cauliflower Mosaic Virus) + 5'UTR, Ω (Tobacco Mosaic Virus) | |
| Addgene | 46966 | Used for designing CRISPR/Cas9 module | |
| Addgene | 46968 | Used for designing CRISPR/Cas9 module | |
| Addgene | 50334 | Level 0 Kanamycin/Neomycin/Paromomycin resistance cassette | |
| Topzeven | - | Used as filters for washing spore suspension | |
| Sigma-Aldrich | 8.17003 | PEG400 | |
| Duchefa Biochemie | E1674.0001 | Pots to grow Parasponia plantlets/seedlings | |
| Merck | 104871 | KH2PO4 | |
| Merck | 105033 | KOH | |
| Merck | 105153 | K2SO4O | |
| Van Leusden b.v. | - | Used as growing substrate for mychorrhization assay | |
| Duchefa Biochemie | S0225.0050 | SH-basal salt medium | |
| Duchefa Biochemie | S0411.0250 | SH-vitamin mixture | |
| Lehle Seeds | VIS-02 | Used as non-ionic surfactant in the washing step of stable transformation | |
| Merck | 137017 | NaCl | |
| VWR Chemicals | 89230-072 | C6H11NaO7 | |
| Merck | 106521 | Na2MoO4·2H2O | |
| Merck | 106574 | Na2HPO4·7H2O | |
| Merck | 567549 | NaH2PO4·H2O | |
| Sigma-Aldrich | 239313 | Na2SO4O | |
| Duchefa Biochemie | S0809.5000 | C12H22O11 | |
| Thermo-Fisher | B69 | Used in Golden Gate cloning assembly | |
| Thermo-Fisher | EL0013 | Used in Golden Gate cloning assembly | |
| Kulzer-Mitsui Chemicals Group | 64708806 | Methyl methacrylate-based resin powder | |
| Kulzer-Mitsui Chemicals Group | 64709003 | HEMA (2-hydroxyethyl methacrylate)-based resin solution | |
| Kulzer-Mitsui Chemicals Group | 66022678 | Methyl methacrylate-based resin solution | |
| Merck | 1159300025 | ||
| Acros | 189350250 | ||
| VWR Chemicals | 663684B | Polysorbate 20 | |
| Stout Perspex | - | pouches box material, lid | |
| Duchefa Biochemie | Y1333.1000 | ||
| Merck | 108816 | ZnCl2 | |
| Alfa Aesar | 33399 | ZnSO4O·7H2O |
References
- Clason, E. W. THE VEGETATION OF THE UPPER-BADAK REGION OF MOUNT KELUT (EAST JAVA). Bulletin du Jardin Botanique de Buitenzorg. Serie III, 509-518 (1936).
- Soepadmo, E. Ulmaceae. Flora Malesiana-Series 1, Spermatophyta. 8, 31-76 (1974).
- Becking, J. H. The Rhizobium symbiosis of the nonlegume Parasponia. Biological Nitrogen Fixation. , 497-559 (1992).
- Oldroyd, G. E. D. Speak, friend, and enter: signalling systems that promote beneficial symbiotic associations in plants. Nature Reviews Microbiology. 11, 252-263 (2013).
- Gutjahr, C., Parniske, M. Cell and developmental biology of arbuscular mycorrhiza symbiosis. Annual Review of Cell and Developmental Biology. 29, 593-617 (2013).
- van Velzen, R., et al. Comparative genomics of the nonlegume Parasponia reveals insights into evolution of nitrogen-fixing rhizobium symbioses. Proceedings of the National Academy of Sciences of the United States of America. 115, E4700-E4709 (2018).
- van Velzen, R., Doyle, J. J., Geurts, R. A Resurrected Scenario: Single Gain and Massive Loss of Nitrogen-Fixing Nodulation. Trends in Plant Science. 24, 49-57 (2019).
- Griesmann, M., et al. Phylogenomics reveals multiple losses of the nitrogen-fixing root nodule symbiosis. Science. 1743, eaat1743 (2018).
- Becking, J. H. Root-Nodule Symbiosis Between Rhizobium And Parasponia (Ulmaceae). Plant and Soil. 51, 289-296 (1979).
- van Zeijl, A., et al. CRISPR/Cas9-Mediated Mutagenesis of Four Putative Symbiosis Genes of the Tropical Tree Parasponia andersonii Reveals Novel Phenotypes. Frontiers in Plant Science. 9, 284 (2018).
- Cao, Q., et al. Efficiency of Agrobacterium rhizogenes–mediated root transformation of Parasponia and Trema is temperature dependent. Plant Growth Regulation. 68, 459-465 (2012).
- Limpens, E., et al. RNA interference in Agrobacterium rhizogenes-transformed roots of Arabidopsis and Medicago truncatula. Journal of Experimental Botany. 55, 983-992 (2004).
- Boisson-Dernier, A., et al. Agrobacterium rhizogenes-Transformed Roots of Medicago truncatula for the Study of Nitrogen-Fixing and Endomycorrhizal Symbiotic Associations. Molecular Plant-Microbe Interactions. 14, 695-700 (2001).
- Kumagai, H., Kouchi, H. Gene Silencing by Expression of Hairpin RNA in Lotus japonicus Roots and Root Nodules. Molecular Plant-Microbe Interactions. 16, 663-668 (2003).
- Nilsson, O., Olsson, O. Getting to the root: The role of the Agrobacterium rhizogenes rol genes in the formation of hairy roots. Physiologia Plantarum. 100, 463-473 (1997).
- Davey, M. R., et al. Effective Nodulation of Micro-Propagated Shoots of the Non-Legume Parasponia andersonii by Bradyrhizobium. Journal of Experimental Botany. 44, 863-867 (1993).
- Webster, G., Poulton, P. R., Cocking, E. C., Davey, M. R. The nodulation of micro-propagated plants of Parasponia andersonii by tropical legume rhizobia. Journal of Experimental Botany. 46, 1131-1137 (1995).
- Op den Camp, R., et al. LysM-type mycorrhizal receptor recruited for rhizobium symbiosis in nonlegume Parasponia. Science. 331, 909-912 (2011).
- Weber, E., Engler, C., Gruetzner, R., Werner, S., Marillonnet, S. A Modular Cloning System for Standardized Assembly of Multigene Constructs. PLOS ONE. 6, e16765 (2011).
- Nekrasov, V., Staskawicz, B. J., Weigel, D., Jones, J. D. G., Kamoun, S. Targeted mutagenesis in the model plant Nicotiana benthamiana using Cas9 RNA-guided endonuclease. Nature Biotechnology. 31, 691-693 (2013).
- Bertani, G. Studies On Lysogenesis. I. The Mode Of Phage Liberation By Lysogenic Escherichia Coli. Journal of Bacteriology. 62, 293-300 (1951).
- Engler, C., et al. A Golden Gate modular cloning toolbox for plants. ACS Synthetic Biology. 3, 839-843 (2014).
- Fauser, F., Schiml, S., Puchta, H. Both CRISPR/Cas-based nucleases and nickases can be used efficiently for genome engineering in Arabidopsis thaliana. The Plant Journal. 79, 348-359 (2014).
- Lazo, G. R., Stein, P. A., Ludwig, R. A. A DNA Transformation-Competent Arabidopsis Genomic Library in Agrobacterium. Biotechnology. 9, 963-967 (1991).
- Op den Camp, R. H. M., et al. N Nonlegume Parasponia andersonii Deploys A Broad Rhizobium Host Range Strategy Resulting in Largely Variable Symbiotic Effectivenes. Molecular Plant-Microbe Interactions. 25, 954-963 (2012).
- Graham, P. H., Viteri, S. E., Mackie, F., Vargas, A. T., Palacios, A. Variation in acid soil tolerance among strains of Rhizobium phaseoli. Field Crops Research. 5, 121-128 (1982).
- Martinez-Romero, E., et al. Rhizobium tropici, A Novel Species Nodulating Phaseolus vulgaris L. Beans and Leucaena sp. Trees. International Journal of Systematic and Evolutionary Microbiology. 41, 417-421 (1991).
- Felten, J., et al. The Ectomycorrhizal Fungus Laccaria bicolor Stimulates Lateral Root Formation in Poplar and Arabidopsis through Auxin Transport and Signaling. Plant Physiology. 151, 1991-2005 (1991).
- Trouvelot, A., Kough, J. L., Gianinazzi-Pearson, V. Mesure du taux de mycorhization VA d’un systeme radiculaire. Recherche de methods d’estimation ayant une signification fonctionnelle. Aspects Physiologiques et Genetiques des Mycorhizes. , 217-221 (1986).
- Schenk, R. U., Hildebrandt, A. C. Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Canadian Journal of Botany. 50, 199-204 (1972).
- Becking, J. H. The Parasponia parviflora - Rhizobium symbiosis. Host specificity, growth and nitrogen fixation under various conditions. Plant and Soil. 75, 309-342 (1983).
- Hoagland, D. R., Arnon Revised, D. I., Arnon, D. I. The Water-Culture Method for Growing Plants without Soil. Circular California Agricultural Experiment Station. 347, 1-32 (1950).
- Wang, K. . Methods in Molecular Biology: Agrobacterium Protocols. 1, (2015).
- Smulders, M. J. M., de Klerk, G. J. Epigenetics in plant tissue culture. Plant Growth Regulation. 63, 137-146 (2011).
- Larkin, P. J., Scowcroft, W. R. Somaclonal variation — a novel source of variability from cell cultures for plant improvement. Theoretical and Applied Genetics. 60, 197-214 (1981).
- Cannon, S. B., et al. Legume genome evolution viewed through the Medicago truncatula and Lotus japonicus genomes. Proceedings of the National Academy of Sciences of the United States of America. 103, 14959-14964 (2006).
- Tuskan, G. A., et al. The Genome of Black Cottonwood, Populus trichocarpa (Torr. & Gray). Science. 313, 1596-1604 (2006).
- Young, N. D., et al. The Medicago genome provides insight into the evolution of rhizobial symbioses. Nature. 480, 520 (2011).
- Sato, S., et al. Genome Structure of the Legume, Lotus japonicus. DNA Research. 15, 227-239 (2008).
- Xing, H. L., et al. A CRISPR/Cas9 toolkit for multiplex genome editing in plants. BMC Plant Biology. 14, 327 (2014).
- Lowder, L. G., et al. A CRISPR/Cas9 Toolbox for Multiplexed Plant Genome Editing and Transcriptional Regulation. Plant Physiology. 169, 971 (2015).
- van Zeijl, A. . Dissecting Hormonal Pathways in Nitrogen-Fixing Rhizobium Symbioses. , (2017).
Explore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved