窒素固定熱帯カンナバ科の木パラスポニア・アンダーソンニの変形、ゲノム編集、表現型
In This Article
Summary
パラスフォニア・アンデネリニは、大麻科(カンナバ科)に属し、リゾビウムに関連して窒素固定根結節を形成することができる急速に成長している熱帯の木です。ここでは、アグロバクテリウム・トゥメファシエンス-媒介安定な形質転換とCRISPR/Cas9ベースのゲノム編集に基づくP.andersoniiiにおける逆遺伝子解析のための詳細なプロトコルについて説明する。
Abstract
パラスコーニア・アンダーソンニは、大麻科(カンナバ科)に属する急速に成長している熱帯の木です。4つの追加種と共に、それはリゾビウムとの窒素固定結節共生を確立することができる唯一の既知の非レグメ系統を形成する。豆類とP.andersoniiiの比較研究は、根結節形成の基礎となる遺伝的ネットワークに貴重な洞察を提供することができる。比較研究を容易にするために、我々は最近、P.アンダーソンイゲノムを配列し、アグロバクテリウム・トゥメファシエンス-安定な形質転換およびCRISPR/Cas9ベースのゲノム編集を確立した。ここでは、P.andersoniiのために開発された変換およびゲノム編集手順の詳細な説明を提供する。また、共生表現型の種子発芽と特性化の手順について述べた。このプロトコルを使用して、安定したトランスジェニック変異線を2〜3ヶ月の期間で生成することができる。T0トランスジェニックラインのインビトロ伝播は、A.ツメファシアンの共同栽培後4ヶ月で表現型実験を開始することを可能にする。したがって、このプロトコルは、P.andersoniiで利用可能な一過性アグロバクテリウム根茎ベースの根変換方法よりもわずかに長くしかかからずかかりますが、いくつかの明確な利点があります。一緒に、ここで説明する手順は、P.andersoniiは、この熱帯の木の生物学の潜在的な他の側面だけでなく、共生関係を理解することを目的とした研究の研究モデルとして使用されることを可能にします。
Introduction
パラスコーニア・アンデネリニは、大麻科(カンナバ科)に属する熱帯の木であり、パプアニューギニアといくつかの太平洋諸島1、2、3にネイティブです。4つの追加のパラスフォニア種と共に、それは根茎と窒素固定結節共生を確立することができる唯一の非レグメ系統を表す。この共生は、レグメ(Fabaceae)モデルメディカゴ・トランカチュラおよびロータス・ジャポニカスでよく研究され、結節形成および機能4の分子遺伝的性質に関する詳細な知識を得た。さらに、豆類における根結節共生は、はるかに古く、広範囲にわたる耳上筋膜共生5に基づいていることが実証された。系統的な比較は、窒素固定節順子が豆類、パラスポニア、ならびにジアゾトロフィックフランシア細菌を宿主とするいわゆるアクチノリザル植物種が共有進化起源を有することを示唆している。6,7,8.レグメ結節形成に関与することが同定された遺伝子が保存された遺伝的基盤の一部であるかどうかを決定するためには、非レグメ種に関する研究が不可欠である。そこで、P.andersoniiを比較研究モデルとして、豆類とともに、根の節目の形成と機能の根の中核的な遺伝的ネットワークを同定することを提案する。
P.アンダーソンリは、火山の丘の斜面に見つけることができるパイオニアです。それは月あたり45 cmの成長速度を満たし、10メートル9までの長さに達することができる。P.アンダーソンの木は、別々の男性と女性の花3、10の形成によって促進される風受粉である。我々は最近、P.andersoniiのジプロイドゲノム(2n = 20;560 Mb/1C)を配列し、注記し、2つの追加のパラスポニア種のドラフトゲノム配列を組み立てた。P. リジダとP.ルゴサ6.このことから、M.トランカチュラ、大豆(グリシンマックス)、アラビドプシスタリアナ、森林イチゴ()の遺伝子と共に>20,000オルソグループに集結できる約35,000 P.アンダーソンジ遺伝子モデルが明らかになった。フラガリア・ベスカ、トレマ・オリエンタリス、ブラックコットン・ポプラ(ポプルス・トリコカルパ)、ユーカリ(ユーカリ・グランディス)6.さらに、M.トランカツラとP.andersoniiとの間のトランスクリプトーム比較は、両方の種6で結節増強発現パターンを示す290の形成オルソログのセットを同定した。これは、比較研究のための優れたリソースを提供します。
P.アンダーソンイ根および結節における遺伝子機能を研究するために、アグロバクテリウム・根形成-媒介根形体変換のためのプロトコルが確立された11.このプロトコルを用いて、トランスジェニック根を有する化合物植物を比較的短い時間枠で生成することができる。この方法は、また、レグメ共生研究12、13、14に広く適用される。ただし、この方法の欠点は、ルートのみが変換され、各トランスジェニック ルートが独立した変換イベントを表し、実質的な変動が生じる点です。また、変換は一時的であり、トランスジェニックラインは維持できません。これにより、A.根源ベースの根変換はCRISPR/Cas9媒介ゲノム編集に適していません。さらに、A.根茎は、その根誘導遺伝子(rol)遺伝子を植物ゲノムに伝達し、これはかつてホルモン恒常性15を妨害する。これにより、A.根茎の植物ホルモンの役割を研究することは困難な根を形成します。これらの制限を克服するために、我々は最近、P.アンダーソン10のアグロバクテリウム・トゥメファシエンスベースの変換とCRISPR/Cas9媒介変異体のプロトコルを開発した。
ここでは、P.andersoniiのために開発されたA.ツメファシエンスベースの変換手順と逆遺伝学パイプラインの詳細な説明を提供します。さらに、共生相互作用を研究するためのアッセイを含むトランスジェニックプラントレットの下流処理のためのプロトコルを提供します。ここで説明するプロトコルを使用して、2〜3ヶ月の期間で複数のトランスジェニックラインを生成することができる。CRISPR/Cas9媒介変異体形成と組み合わせることで、ノックアウト変異線の効率的な生成が可能になります。これらの変異線は、インビトロ10、16、17で栄養的に伝播することができ、これは、変換手順の4ヶ月後に見価特性を開始するのに十分な材料を生成することを可能にする10が開始されました。一緒に、この一連の手順は、任意のラボが根茎と菌性の関連を理解することを目的とした研究モデルとしてP.andersoniiiを採用することを可能にするだけでなく、この熱帯木の生物学の潜在的な他の側面を可能にする必要があります。
Protocol
1. 温室でP.アンダーソンの木を育てる
-
発芽P.アンダーソンIIWU1種子18.
- 新鮮なパラスパウニアベリーを使用するか、水を2時間水に浸して水分補給します。ティッシュペーパーの上にベリーをスカッシュするか、種子を除去するためにティーふるいの内側にこすります。
- 市販の漂白剤(以下、次亜塩素酸塩)を15~20分間使用して種子を消毒し、その後、殺菌水を使用して種子を6回洗浄します。
- 種子を無菌の200 μL PCRチューブに移します。種子が完全に水没するので、殺菌された水でチューブを埋めます。次のプログラムを実行しているサーモサイクラーで10日間チューブをインキュベート:30サイクル(4時間のための7 °C、4時間のための28 °C)。これは種子を殺す可能性があるため、加熱された蓋を使用しないでください。
- SH-0プレートを準備してください(表1を参照)。種子をSH-0プレートに移し、28°C、16 h:8 hデイナイトでインキュベートします。28°Cでのインキュベーション中の乾燥を防ぐように、弾性シール箔の2層でプレートを閉じます。
- 苗が真の葉の最初のセット(28°Cでインキュベーション後〜3〜4週間)を開発した後、市販のポッティング土壌で満たされたポットに苗を転送し、乾燥を防ぐために半透明のプラスチックカップで苗を覆います。ポットを28°Cの気候室または温室(約85%RH)に置き、16 h:8 hの日の下に置きます。.
- 1週間後、半透明のプラスチックカップを取り除きます。定期的にポットに水を与え、木が成長を維持するために肥料でより大きなサプリメントを成長するとき。
2. CrispR/Cas9媒介変異体の構造のクローニング
注:標準のバイナリ変換ベクトルは、P. andersoniiiの安定した変換に使用できます。ここで、一例として、モジュラークローニング(例えば、ゴールデンゲート)19を用いてCRISPR/Cas9媒介変異体の構築物を生成する手順である。
- 組み込みのCRISPR設計ツールを備えたバイオインフォマティクスソフトウェアを使用して、目的の遺伝子のガイドRNA標的配列を特定します。標的遺伝子のコード配列の5'末端にあるガイドRNA配列を選択して、完全なノックアウトを得る可能性を高める。P.アンダーソンゲノム6に対して検索することにより、オフターゲット効果を確認してください。
注:標的遺伝子当たり2 sgRNAを使用し、好ましくは200~300bp離れて使用してください。これは、PCRによって識別することができ、その後、アガロースゲル電気泳動によって欠損を生成する可能性があります。 - sgRNA配列を含むレベル1ゴールデンゲート構築物を生成します。
- 次のプライマー配列でN(20)の位置に20bpガイド配列を挿入することにより、個々のsgRNAを増幅するプライマーを設計する:5'-TGTGGTCTCAATGN(20)GTTTTAGAGTTAGAATAGCAAG-3'。
注: ガイドシーケンスが GN(19)と等しい場合は、プライマーシーケンスに挿入する前に、ガイドシーケンスの5'末端にあるGを取り外します。 - PCR は pICH86966::AtU6p::sgRNA_PDS20ステップ 2.2.1 で設計されたフォワード プライマーとユニバーサル リバース プライマーを使用して sgRNA を増幅します: 5'-TGTTTCTCAAGCCTTTTTGTAC-3'高忠実度の熱安定なDNAポリメラーゼと次のPCR条件を使用してください:30sの場合は98°C。30サイクル(10sのための98 °C、20 sのための53 °C、10 sのための72 °C);。7分間72°Cの成功したPCR反応は165 bpアンプリコンを得る。
- 市販のPCR精製キットを用いてPCRアンプリコンをカラム精製する。続いて、アラビドプシスタリアナAtU6p小型RNAプロモーターの背後にあるsgRNAをクローンに対するゴールデンゲート反応を設定する:sgRNA PCRアンプリコンの10ng、pICSL01009の150 ng::AtU6p20、適切なレベル1アクセプターベクターの60ng、T4の2μLリゲスバッファーは、ウシ血清アルブミン(BSA)の2μL 0.1%、BsaIの0.5μL、T4リゲスの0.5μL、超純水で20μLに充填する。ヘアピンの形成を防ぐために、すべての sgRNA が同じ向きでクローンされていることを確認します。
- 次のプログラムを実行しているサーモサイクラーで反応をインキュベート: 20 sのための37 °C;26 サイクル (3 分 3 分、4 分間 16 °C)50 °C 5分;80 °C 5分の間、アンピシリン(50mg/L)、X-Gal(200mg/L)およびIPTG(1mM)を含むLB培地21上の大腸菌およびプレートに対するゴールデンゲート反応を変換する。
注:IPTGとX-Galのストックソリューションを、それぞれ超純水とジメチルホルミドで準備します。フィルターはアンピシリンおよびIPTGのストック解決を殺菌し、-20 °Cですべての在庫を貯える。ジメチルホルミドを取り扱う場合は手袋を着用してください。 - 白いコロニーを選択し、市販のプラスミド絶縁キットを使用してプラスミドを分離します。ゴールデンゲートレベル2アセンブリを続行する前に、単離されたプラスミドをシーケンス検証します。
- 次のプライマー配列でN(20)の位置に20bpガイド配列を挿入することにより、個々のsgRNAを増幅するプライマーを設計する:5'-TGTGGTCTCAATGN(20)GTTTTAGAGTTAGAATAGCAAG-3'。
- 安定した変換のためのレベル2ゴールデンゲート構築を組み立てます。
- レベル 1 AtU6p::sgRNA コンストラクト (セクション 2.2 の下で生成される) と pICH47802::NPTII、 pICH47742::35S pro::ΩNLS-aCas9:35Ster、レベル 2 の受け入れpICSL4723 と適切なエンドリンカー (Engler et al.22を参照)次のように反応を行います:各ドナーベクターベクターの〜100 fmolおよびエンパシーベクターベクターの〜20 fmolを使用し、T4リゲスバッファーの2μL、0.1%BSAの2μL、BpiIの0.5 μL、T4リゲスの0.5 μL、超純水で20μLに充填します。
注: レベル 1 プラスミド pICH47802::NPTII, pICH4742::35Spro::ΩNLS-aCas9::35Sterは最初にクローンを作成する必要があります (補足ファイル 1を参照してください)。 、23. - ステップ2.2.4の下で反応をインキュベートし、大腸菌に変換します。カナマイシンを含むLB培地上のプレート。翌日、白いコロニーを選択し、プラスミドを分離します。制限消化分析により、正しいプラスミドアセンブリを決定します。
- レベル 1 AtU6p::sgRNA コンストラクト (セクション 2.2 の下で生成される) と pICH47802::NPTII、 pICH47742::35S pro::ΩNLS-aCas9:35Ster、レベル 2 の受け入れpICSL4723 と適切なエンドリンカー (Engler et al.22を参照)次のように反応を行います:各ドナーベクターベクターの〜100 fmolおよびエンパシーベクターベクターの〜20 fmolを使用し、T4リゲスバッファーの2μL、0.1%BSAの2μL、BpiIの0.5 μL、T4リゲスの0.5 μL、超純水で20μLに充填します。
- アグロバクテリウム・トゥメファシエンス株AGL124に対する変換レベル2の構築物。
3. P.アンダーソンの安定的な変容
- A.ツメファシエン株AGL1を有する適切な抗生物質を含む2LBプレートを接種し、目的の構成物と共に形質転換する。プレートを28°Cで2日間インキュベートします。
- 温室で育った木から若い枝を収穫する。変換ごとに長さ5〜8センチメートルの約5つの枝を使用してください。感染していない正常なブランチのみを使用してください。葉を切って切り取り、葉組織の約1cm2が各ペチオールの末端に残るようにします。葉を捨てなさい
- ポリソルベート20の数滴を含有する1:1希釈された市販の漂白剤(希釈後約2%次亜塩素酸塩)を用いて15分間組織を消毒する。次に、オートクレーブ水で組織を6回すすいでください。
注:このステップだけでなく、以下のステップは、組織を無菌に保つために層下流キャビネット内で行う必要があります。 - アセトシリンゴン(20mg/L)と非イオン界面活性剤(0.001%v/v)を含む浸潤培地(表1参照)の1-2プレートからA.ツメファシエンス細胞を再中断し、~5の光学密度(OD600)に到達する。
注:70%エタノールでアセトシリンゾンストック溶液を調製し、-20°Cで保存します。非イオン界面活性剤は、浸潤培地に添加する前にフィルター殺菌する必要があります。 - 茎と小柄な組織の両方をA.ツメファシエンス懸濁液の中の長さ約1cmの断片で切断し、それによって両側に新鮮な傷を作成する。A.チュメファシエンス懸濁液にティッシュピースを10〜30分間残します。
- 根源培地を調味し(表1参照)、オートクレーブ後にアセトシリンゴ(20mg/L)を加えます。無菌のフィルターペーパーにティッシュ片を乾かし、媒体(~10本の切り出し/プレート)に置きます。21 °Cで2日間暗い中でプレートをインキュベートします。
注:アセトシリンゾンを添加する前に、培地を~60°Cまで冷却します。 - 2日後、真菌または明らかな細菌汚染(A.ツメファシエンス以外の細菌)のプレートを検査する。汚染されたプレートは廃棄する必要があります。
- 液体SH-10培地を調製する(表1参照)。オートクレーブ後、ポリソルベート20(0.01%、v/v)を追加します。組織片をポリソルベート20を含むSH-10の10mLに移す。少なくとも10分の期間中に、組織を洗浄するために2〜3分ごとに穏やかに攪拌する。
- ポリソルベート20を含む新鮮なSH-10で2回追加回を洗浄します。これらの時間は、洗浄工程当たり2〜3分のインキュベーション時間で十分である。
- ルートメディアを準備する (表 1を参照)。オートクレーブ後、セフォタキシム(300mg/L)とカナマイシン(50mg/L)を追加し、プレートを注ぎます。二次変換(トランスジェニックカナマイシン耐性線の変換)の場合は、ヒグロマイシン(15mg/L)選択を適用します。
- 無菌のフィルターペーパーの乾燥したティッシュ片。その後、ステップ3.9で調製したプレートに組織片を移す。
- 28 °C で 7 日間プレートをインキュベート, 16 h:8 h 昼:夜.真菌または細菌汚染およびA.ツメファシエンの過剰な増殖のためのプレートを2日ごとにチェックする。汚染の場合は、感染していない部分を新鮮なプレートに移します。
- 7日後、組織片を伝播培地(表1参照)に移し、セフォタキシム(300mg/L)およびカナマイシン(50mg/L)を含む。プレートを28°C、16 h:8 h日:夜にインキュベートします。トランスジェニックシュートが発達するまで、週に一度プレートをリフレッシュします。感染していない組織片のみを新鮮なプレートに移してください。A.トゥメファシアンによって生い茂った部分を捨てる。
- 一度置き換えトランスジェニック芽は、長さが≥1センチメートルであり、セフォタキシム(300mg/L)およびカナマイシン(50mg/L)を含む伝播媒体で独立して撮影し、培養する。シュートが独立した変圧体を表すことを確認するには、植生の両側から 1 回だけ撮影します。
- ステップ5.2に記載されているように、栄養的にトランスジェニックシュートを伝播する。
4. プトアティブトランスジェニックシュートのジェノタイピング
- sgRNA認識部位にまたがる設計プライマー。PCRアンプリコンシーケンスを許可するには、sgRNA認識部位から150~250bp離れたプライマーを選択します。
- 遺伝子型を入力する各トランスジェニックシュートから葉の先端(約5mm)を切り取る。また、野生型制御サンプルを収穫する。
- ステップ4.1で設計されたプライマーと、植物サンプルから直接DNAを増幅する市販キットを使用して、50 μL PCR反応を実行します。あるいは、PCR反応は、高忠実度ポリメラーゼを用いて精製DNA上で行うことができる。
- 1.5-2%のアガロースゲルにPCRアンプリコンを分離します。
- ゲル電気泳動の結果を分析します。野生のタイプとは異なるサイズの複数のバンド(1つ以上の対立遺伝子)とPCRアンプリコンを生産するサンプルを確認します。
- 正確な突然変異を同定するためにPCRアンプリコンを配列する。単一のPCRアンプリコンを産生するサンプルのために、PCRプロダクトは直接配列することができる。ゲル電気泳動後に1つ以上のバンドを産生するサンプル、またはPCRアンプリコンの直接シーケンシング後にヘテロ接点と思われるサンプルは、まず鈍エンドクローニングベクトルにクローニングする必要があります。続いて、各サンプルに対して複数のクローンを配列し、サンプル内に存在する可能性のあるすべての対立を特定します。
- シーケンシング結果を目的の遺伝子に合わせ、位置合わせを検査してsgRNA標的部位付近の変異を検査します。その後、これらの突然変異がフレームシフトを作成するかどうかを確認します。> 2 つのア列を持つ行と、フレーム内の突然変異を含むラインを破棄します。
- さらに分析するには、複数の行を選択します。
- ステップ 5.2 で説明されているように、選択した行を伝播します。
- ラインがいくつかの新しいシュートを開発したら、≥3リーフの先端から新しいサンプルを取り、手順4.3-4.7を繰り返します。元の PCR サンプルと同じ行から発生する各サンプルに存在する変異が同一であるかどうかを判断します。すべてのサンプルで同じ突然変異を生み出すラインは均質に変異され、さらなる実験に使用できます。これらの行と同じ結果が得られなかった行はキメラです。
5. 実験用根付きP.アンダーソンイプラントレットの調製
-
P.アンダーソンリの新しい組織培養ラインを開始します。
- 収穫軸芽、若い冒険的な芽や健康な木から葉の組織。あるいは、苗を出発材料として用いることができる。
- 1:1希釈された市販の漂白剤(希釈後約2%)を用いて組織を消毒し、数滴のポリソルベート20を15分間含有し、その後、オートクレーブ水を用いて組織を6回すすいで消毒する。
注:このステップは、同様に、以下のステップは、組織を無菌に保つために層下流または層状クロスフローキャビネット内で行われる必要があります。 - 組織を伝播媒体に移す(表1参照)。弾性シールホイルの2層でプレートを閉じ、28 °C、16 h:8 h日:夜にプレートをインキュベートします。
- 最初の2週間の間に数日おきにプレートを検査し、組織に真菌や細菌の汚染がないことを確認します。
- 伝播媒体の新鮮なプレートに〜10シュートを置くことによって組織を伝播し、弾性シール箔の2層でプレートを閉じます。プレートを28°C、16 h:8 h日:夜にインキュベートします。この手順を 4 週間ごとに繰り返します。
- シュートの長さが >1 cmの場合は、そのベースで撮影をカットし、応援媒体の上に置きます(表1参照)。1枚の根付きプレートに約10発のシュートを配置できます。位置は、撮影の基底先端を媒体に挿入することによって直立撮影します。根は28°C、16 h:8 h日:夜でプレートのインキュベーション後10〜14日に現れる。
注:すべてのシュートを根付かせず、組織培養伝播のために一部を維持してください(ステップ5.2を参照)。
6. ポットにおけるP.アンダーソンイ植物の結節化
-
リゾビウム接種を準備します。
- メソルリゾビウムプリファリウムBOR26の単一コロニーから液体YEM培地の10mLを接種し、2日間28°Cでインキュベートする。
注:M.プリファリウムBOR2は、P.アンダーソンを効率的に昇華させるので好ましい。しかし、他のリゾビウム株は、P.アンダーソンイの結節化にも使用することができます(例えば、ブラジリゾビウムエルカニイWUR325、リゾビウム熱帯チチCIAT899 26、27またはブラジリゾビウム)sp. Kelud2A4)。 - 10 mL培養を使用して、より多くの量の液体YEM培地を接種します。このカルチャの量は、接種する必要があるポットの数に依存します。
- 液体EKM培地を調記します(表3、表4参照)。細胞を収穫するために3,500 x gで10分間細菌培養を遠心分離する。続いて、液体EKM中の細菌ペレットを再定時停止し(元のYEM培養とほぼ同じ体積を使用)、光学密度(OD600)を決定する。
- メソルリゾビウムプリファリウムBOR26の単一コロニーから液体YEM培地の10mLを接種し、2日間28°Cでインキュベートする。
- 〜20ポットの場合は、液体EKM培地の3Lを調製し、ステップ6.1.3で調製した根茎懸濁液で接種する。OD600 = 0.025 に到達します。
- 根茎を含むEKMの3Lを1,250gのパーライトと混合する。続いて、この混合物の210gを無菌半透明のポリプロピレンポットに加える。あるいは、パーライトの代わりに、うなずきアッセイの基板として砂を使用してください。
- 各ポットに植物1-3 P.アンダーソンイ植物を植えます。また、CRISPR制御構造体で変換されたP.andersonii植物を含むいくつかのポットを準備する(補足表1を参照)。実験中に水の損失を決定できるように、いくつかのポットの重量を量ります。各ポットの底を覆い、光の露出から根を保護します。
- 気候化された成長室(28°C、16 h:8 h日:夜)で4〜6週間ポットをインキュベートします。週に一度、水の損失を決定するためにいくつかのポットの重量を量ります。水の損失が10 mLを超える場合は、損失を補うために超純粋な水を補います。
- 4-6週間後、パーライトから根をきれいにし、結節効率を調べるために双眼鏡を使用して結節数を決定します。
7. プレート上のP.アンダーソンイ植物の結節化
-
セロファン膜の調剤28.
- セロファン膜を正方形の12 cm x 12 cmペトリ皿に収まるようにカットします。上部の膜をもう少し短くして、撮影のスペースを増やします。
- セロファン膜の透過性を高めるため、EDTA溶液(1g/L)で膜を20分間沸騰させ、その後、少なくとも6倍の脱塩水ですすいでEDTAを除去する。
注:乾燥膜は水と接触するとしわになる傾向がありますので、乾燥膜を溶液に一つずつ浸します。 - 丸いガラス板に水の薄い層に膜を水平に配置します。2回オートクレーブで膜を殺菌します。
- 寒天固化EKM培地を含む正方形12 x 12cmペトリ皿上に1オートクレーブセロファン膜を置きます(表3、表4参照)。膜の上に2つの3週齢の根付いたP.アンダーソンの植物(セクション5を参照)または4週間の古い苗(セクション1.1を参照)を置きます。これらの根がまだ成長していることを示す、白い根の先端を持つ根を持つ植物や苗だけを選ぶようにしてください。
- 第2のセロファン膜で根を優しく覆い、サンドイッチ層を作ります。弾性シールホイルの3層でプレートを密封します。プレートの下半分をアルミホイルで包み、光の露出から根を覆います。
- 3-4週間、気候化された成長室(28°C、16 h:8 h日:夜)でプレートをインキュベートします。ルートヒントの位置をマークして、時間の経過に合ったルートの成長に従います。
- EKMプレートが長時間のインキュベーションのために乾燥し始めた場合は、細菌接種の数日前に新鮮なEKMプレートに植物を移します。
- ステップ6.1で説明するように細菌の接種を調出す。
- 上部セロファン膜を取り除き、根元に1mLのリゾビウム培養(OD600= 0.025)を塗布します。その後、接種された根に新しいセロファン膜を置きます。アルミホイルを使用してプレートの外側を包み、光の露出から根を覆います。
- 4週間後、結節数を双眼で調べて結節効率を決定する。
8. パウチにおけるP.アンダーソンの苗の結節化
- セクション1.1に記載されているように、P.アンダーソンの種子を発芽する。コチルドンが完全に出現した後(28°CでSH-0プレートで〜12日)、苗をパウチに移します。
- パウチを準備するには、ペーパーウィックの折り畳まれた部分を引き裂き、改変されたEKM培地の7 mLを加えます(表3、表4参照)。
- ペーパーウィックを形成する紙の両方のシートとポーチの前面プラスチックシートの間に根を置くことによって、1つまたは2つの苗を挿入します。
- パウチの周りにアルミホイルを折りたたむことで、光の露出から根を保護します。高湿度を維持するために半透明の蓋で覆われたプラスチック製の箱にパウチを吊り下げます。箱を気候化された成長室(28°C、16 h:8 h day:night)に置きます。
- 無菌の超純水を加えて水蒸発を補い、紙の芯が湿ったまま(パウチの底に水を立たないように)。最初の週の後、これは一般的に4日ごとに2-3 mlを追加する必要があります。
- ステップ6.1で説明するように細菌の接種を調出す。
- 苗をパウチで10~12日間栽培した後、根系に500μLのリゾビウム培養(OD600= 0.025)を接種する。
- 時間を通して節形の形成に従ってください。接種後4週間、結節を数え、採取して結節効率を決定することができる。
9. ヌードルサイトアーキテクチャ解析
- 固定性を含む2 mLチューブに10~15個の節状を集める(0.1Mリン酸バッファー、pH 7.2で5%グルタルアルデヒド)。1/2-1 hの真空を適用し、4 °Cで一晩インキュベートします。この期間中、サンプルはチューブの底部に沈みます。
注:固定液は、使用前〜2〜4週間の4°Cで保存することができます。組織固定剤を使用する場合は、必ず手袋を着用してください。 - 0.1 Mリン酸バッファー、pH 7.2で結節2xを洗浄します。各洗浄工程の間に10分間隔を適用します。
- その後、30%、50%、70%、100%エタノールでインキュベートしてサンプルを脱水します。すべての水がサンプルから除去されるようにするには、100%エタノールステップ3倍を繰り返します。各脱水ステップの間に10分間隔を適用します。
- 重合混合混合I(PM-I)を1パックのPEG400に1パック加え、HEMA(2-ヒドロキセチルメタクリレート)系樹脂溶液100mLと混合して調製する。硬化剤Iを完全に溶解させるために〜15分間溶液をかき混ぜます。その後、PM-Iを-20°Cに保管します。
- ステップ 9.3 からエタノールを取り除く。PM-I:100% エタノール (1:3, v/v), PM-I:100% エタノール (1:1, v/v), PM-I:100% エタノール (3:1, v/v) の順にサンプルを浸潤します。RTで各溶液のサンプルを1/2-1 hまたはサンプルが底部に沈むまでインキュベートします。
- 100%PM-I溶液で4°Cで一晩サンプルをインキュベートします。
- PM-Iと硬化器IIを15:1(v/v)比で混合して重合混合混合物IIを調製する。プラスチック金型を重合液で充填し、試料を金型の底部に水平方向に向け、弾性シール箔で覆う。気泡の形成を避けてください。
注:溶液がRTへの曝露時に重合し始めると、プラスチックホルダーでできるだけ早くサンプルの向きを試してみてください。重合はRTで一晩インキュベーションした後、または37°Cで1hに完了する。 - ステップ9.7から弾性シールホイルカバーを取り外し、重合されたサンプルにホルダーを置きます。ホルダーを試料に取り付けるには、メチルメタクリレート系樹脂粉末を5mLのメチルメタクリレート系樹脂溶液に10mL溶解する。ホルダー上部の穴に溶液をすばやく追加します。
注:ヒュームフードで重合工程を実行します(RTで約30分)。 - マイクロトームセクションサンプルを4-5 μmの厚さにし、58°Cのホットプレートに顕微鏡スライドを置き、各スライドに大きな水滴を加えます。水の上にセクションを配置します。水が蒸発すると、セクションはスライドに付着します。
- 0.05%(w/v)トルイジンブルーに2分間浸漬してスライドを染色します。その後、超純水で3倍のすすりが滑ります。スライドは明視野顕微鏡を使用して観察することができる。
10. P.アンダーソンイプラントレットの菌化
-
根茎の不規則性胞子の接種を準備する
- 次のサイズ(上から下)のポリエステル織りフィルターのスタックを準備します:210 μm、120 μm、および36 μmメッシュサイズ。
- ポリエステルフィルターのスタックに市販の胞本懸濁液の必要量をピペット。オートクレーブド脱塩水の100 mLでフィルター3xをすすいでください。胞子は36 μmフィルターの表面に保持される。
注:汚染を防ぐために層クロスフローキャビネットの胞着懸濁液を準備します。 - ポリエステルスタックを分解し、36 μmフィルターのみを保持します。オートクレーブド脱塩水で洗浄工程を少なくとも6倍繰り返します。
- ペトリ皿の上にフィルターを置き、オートクレーブされた脱塩水で胞子を再び中断します。ステップ 10.1.2 で使用する胞間懸濁液の体積と同じ量の水量を使用します。スポア懸濁液をピペッティングにより無菌チューブに移します。
- ガラススライドに胞子懸濁液の20 μLの5滴を配置し、明視野顕微鏡を使用して胞子の数を数えます。胞子カウントを胞子/mLの比率に変換し、胞子懸濁液が250胞子/mLに達するまで希釈する。胞本懸濁液を4°Cに保管してください。
- 菌食機能アッセイを行います。この目的のために、1/2-ホアグランド培地の70 mLを添加したオートクレーブ砂の800gを無菌半透明のポリプロピレンポットに加える(表5-6参照)。激しく振って鍋に直接砂と中火を混ぜます。
- 各ポットにP.アンダーソンイ植物を1つ置き、P.アンダーソンイ植物の根に直接胞毛懸濁液のピペット1mLを置きます。CRISPR制御構造体で変換されたP.andersonii植物を含むいくつかのポットを含むようにしてください(補足表1を参照)。
- 気候化された成長室(28°C、16 h:8 h日:夜)で6週間ポットをインキュベートします。
- 鍋から植物を取り出し、できるだけ多くの砂を除去するために流水で根を洗います。
- 根を1cmの長さの部分に切り、根片を10%KOH(w/v)で90°Cで20分間沸騰させます。その後、100 μm メッシュサイズのセルストレーナーに沸騰した根を置き、50 mLの水で3倍をすすいでください。
- ラクトグリセロール(乳酸300mL、グリセロール300mL、脱塩水400mL)で0.05%(w/v)のトリパンブルーを水浴または加熱ブロックで90°Cで5分間染色します。その後、30%グリセロールに根を移す。ルートサンプルはRTに保存できます。
- 1つの顕微鏡スライドに15~25個の根片を置きます。30%のグリセロールを追加し、カバーガラスでカバーし、根の部分が平らになるまで押します。明視野顕微鏡を使用して根片を観察し、菌細皮のコロニー化をスコア付けします。
注:Mycorrhizationを採点する方法は、Trouvelot et al.29に従って記述されている。この方法では、いくつかのクラス(%F、%M、および%A)を使用して、各根断片のミコルリザルコロニー化のレベルとアービュカルの豊富さの迅速な推定を可能にします。
Representative Results
P.アンダーソン・t・リースは、28°Cおよび〜85%の相対湿度で条件付き温室で栽培することができる(図1A)。これらの条件下で、木は植え付け後6-9ヶ月で開花を開始します。メスP.アンダーソンの花は、それぞれが単一の種子を含むベリーを生成します。成熟の間、ベリーは色を変えます。最初に緑から白へ、その後白から茶色に(図1B)。熟した茶色の果実から抽出された種子は、10日間の温度サイクルとSH-0プレート上の7日間のインキュベーションの後によく発芽する(図1C)。発芽した種子は、約4週間後に実験に使用できる若い苗に発達し続ける(図1D)。
我々は以前に、若いP.アンダーソンジイ茎のペチオールおよびセグメントがA.tumefaciens株AGL110を用いて効率的に形質転換できることを示した。 形質転換手順の開始時に、組織移植は21°C(図2A)で2日間A.ツメファシエンと共培養される。長期の共培養は、A.ツメファシエンスによる組織移植の過剰コロニー化をもたらすので、従って、予防されるべきである(図2B)。共培養期間の後、組織移植は選択的培養物に移され、形質転換組織の増殖を促進する。2~3週間後、小さな緑色のマイクロカリが一般に元の創傷面に沿って観察される(図2C)。これらのカリは、変換手順が開始されてから6~8週間後に1つ以上の形質転換されたシュートを成長させ続けるべきである(図2D)。この段階では、変換効率は通常、成熟した枝と部分的に木質の枝から採取された組織移植で開始された変換に対して〜10〜30%の範囲である(表7)。まだ花を産んでいない枝の若くて急速に成長している先端から取られた移植で変換を開始すれば、約65-75%の変換効率を達成することができます(表7)。時折、白っぽいカリは、媒体と接触していない植生の側に形成され、したがって、カナマイシンの選択を経験しない。これらのカリはトランスジェニックではないことが多く、これらのカリから形成された芽は、一般的にカナマイシン含有培地と直接接触した後に漂白し、死ぬ(図2E)。形質転換率が低い場合や出発物質が最適でない場合、組織片が茶色に変わり(図2F)、A.ツメファシアン(図2G)による過剰増殖に苦しむ可能性があります。A.ツメファシアンが近くの移植所に広がり、過剰に成長するのを防ぐためには、培地の定期的なリフレッシュが必要であり、重度に感染した移植所を除去する必要がある。個々のトランスジェニック芽が伝播媒体に入れられると、A.ツメファシアンによる過剰増殖は一般に起こらない(図2H)。トランスジェニックシュートはインビトロ伝播で乗算でき、1ヶ月で数十発のシュートを発生させる(図3A-B)。これらの芽は、〜2週間後に根形成を誘導する必要がある根系に置くことができる(図3C-D)。根付いた植物は、その後実験に使用することができます。
ノックアウト変異線を作成するために、CRISPR/Cas9媒介変異体を利用します。この目的のために、我々は、カナマイシン耐性遺伝子NPTIIを含むバイナリベクター、CaMV35Sプロモーターによって駆動されるCas9-コード配列およびAtU6p小型RNAプロモーター20から発現される標的遺伝子当たり2sgRNAを利用する。P.アンダーソンのCRISPR/Cas9媒介変異に使用される構成物のグラフィカルな表現は、図4Aに提供される。この方法を用いて、ゲノム編集は、プチン剤変換された芽10の約40%で観察される。変異線を同定するために、標的領域にまたがるプライマーを用いてsgRNA標的部位の突然変異に対して、突起形された芽を遺伝子型化する。期待される結果の例を図 4に示します。ゲル電気泳動後に撮影した写真から分かるように、いくつかのサンプルは野生型と同様の大きさのPCRアンプリコンを産生する(図4B)。これらの植物は、アガロースゲル電気泳動によって視覚化することができない小さなインデルを含んでいるか、またはCas9酵素によって未編集のままである可能性があります。さらに、いくつかのサンプルは、野生のタイプとは異なるサイズのバンドを生成します(例えば、図4Bの2、4、7、8行)。これらのラインでは、1(ライン4、7、8)または両方(ライン2)の対数は、容易に視覚化することができるより大きなインデルを含んでいます。標的部位における変異の正確な性質は、PCRアンプリコンシーケンシング後に明らかにされる。図4Cから分かるように、1〜4bpの小さなインデルの両方が、CRISPR/Cas9変異後に、より大きな欠損を得ることができる。図 4Cでは、行 1 のシーケンスは野生の型のシーケンスと同じであり、この行が編集をエスケープしたことを示しているため、破棄する必要があります。突然変異を含む線の中で、ヘテロ接性、ホモ接性および二ア列変異体を同定することができる(図4C)。しかし、ヘテロジゴス変異体は一般的に稀な10である。ホモ接性ノックアウト変異体は、植物性を伝播し、植物学的分析に十分な材料を得ることができる。T0世代では表現型解析が行われるため、変異線がキメラであるかどうかを確認することが重要です。この目的のために、ジェノタイピングは、各変異線から採取された少なくとも3つの異なるサンプルで繰り返される必要があります。ジェノタイピング結果が互いに同一であり、元のジェノタイピングサンプル(図4Dの8行線など)の場合、線は均質に変異し、さらなる分析に使用できます。ただし、ジェノタイピング結果が独立したサンプル間で異なる場合(図4Dの4行線など)、変異線はキメラであり、廃棄する必要があります。
M.プリファリウムBOR2を用いたP.アンダーソンニの接種は、根結節の形成をもたらす(図5)。図5Aに見られるように、これらの節はルートシステムに沿って分布する。P.andersoniiiの節目は、色は明るい茶色であるが、その形状に基づいて根組織から容易に区別することができる(図5B)。ポットでの接種実験およびその後の4〜6週間の成長は、典型的には〜10〜30結節の形成をもたらす(図6A)。同様の数の結節は、接種後4週間でEKMプレート成長P.アンダーソンジ植物所の接種後に形成される(図6A)。パウチでは、P.アンダーソンの苗は通常、接種後5週間で~5〜15結節を形成する(図5C-D,6A)。 節子細胞構造を分析するために、基管を切り取り、明視野顕微鏡を用いて観察することができる。図6Bは、P.アンダーソンイ節の中央を通る縦断の例を示す。このセクションは、感染細胞を含む結節葉によって側面にあるP.アンダーソンイ結節の中央血管束を示す(図6B)。
P.アンダーソンジイ植物はまた、菌腐食することができる。R.不規則性症との接種の6週間後、菌食症のコロニー形成頻度は通常> 80%に達する(図6C)。この時点で、一般に細胞の約30%が樹木を含んでいる(図6C)。樹図 6Dに、樹型を含むP. andersoniiルート セグメントの代表的な画像を示します。

図1:代表的な画像P.アンダーゴニの木、種子と苗。(A) 生後6ヶ月のP.アンダーソンリイの木は、28°Cで調容した温室でポッティング土壌で栽培した。(B) 成熟の様々な段階でP.アンダーソンリ果実を描いた代表的な画像。若いP.アンデネリベリー(未熟)は、熟成時に緑から白に色を変更し、最終的に茶色(熟した)に変わります。(C)P.アンダーソンイ種子をSH-0培地で1週間インキュベートした。黒い円は発芽した苗を示します。(D)SH-0培地で成長した4週齢P.アンダーソンニの苗。スケールバーは(A)で25cm、B-Dで1cmに等しい。この図のより大きなバージョンを表示するには、ここをクリックしてください。
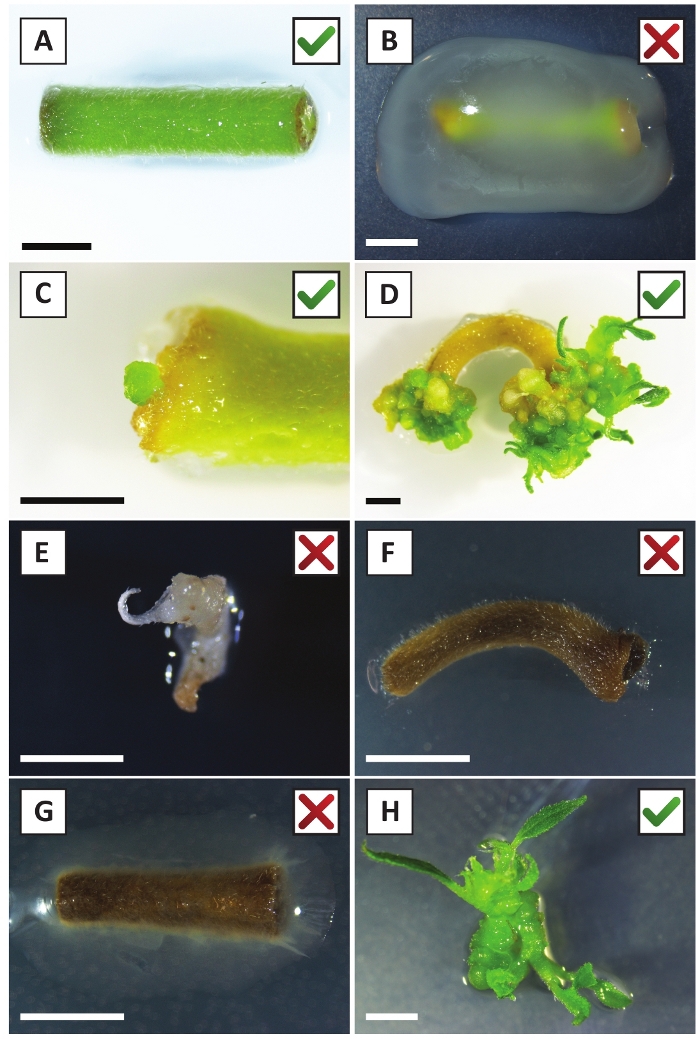
図2:安定な形質転換手順の異なる段階における移植の代表的な画像。(A) A. ツメファシアンと共同栽培された植物.(B)最初の2週間の変換後の間にA.ツメファシアンによって過剰に成長した植物。(C)トランスジェニックマイクロカルスは、共栽培後2.5週で移植の創傷部位付近に形成された。(D)(トランスジェニック)カリからの芽の出現を示す6週間後の共同栽培における移植の代表的な画像。(E) カナマイシン含有培地と直接接触すると白っぽくなり、最終的に死んでしまう撮影の代表的な画像。この撮影は、移植所に取り付けた場合に非トランスジェニックおよびエスケープされたカナマイシン選択である可能性が最も高い。(F) 正常に変換された植生の代表的な画像。(G) A. トゥメファシアンによって生い茂った形質転換に失敗した植生の代表的なイメージ.(H)A.ツメファシアンとの共同栽培後8週間で伝播培地上で成長した単一トランスジェニックシュート。スケール バーは 2.5 mm に等し、緑色のチェック マークまたは赤い十字を含むボックスは、それぞれ、植生の変換に成功または失敗した場合を示します。この図のより大きなバージョンを表示するには、ここをクリックしてください。

図3:代表画像インビトロ伝播。(A) 伝播媒体で成長したシュート。画像は、プレートをリフレッシュした後1週間撮影した。(B)伝播媒体上で成長したシュート。画像は、プレートをリフレッシュした4週間後に撮影した。(C) 根付き媒体に置かれた新鮮なカットシュート。(D)発根培地で2週間インキュベートしたシュート。ルートの存在に注意してください。スケールバーは2.5cmに等しいです。
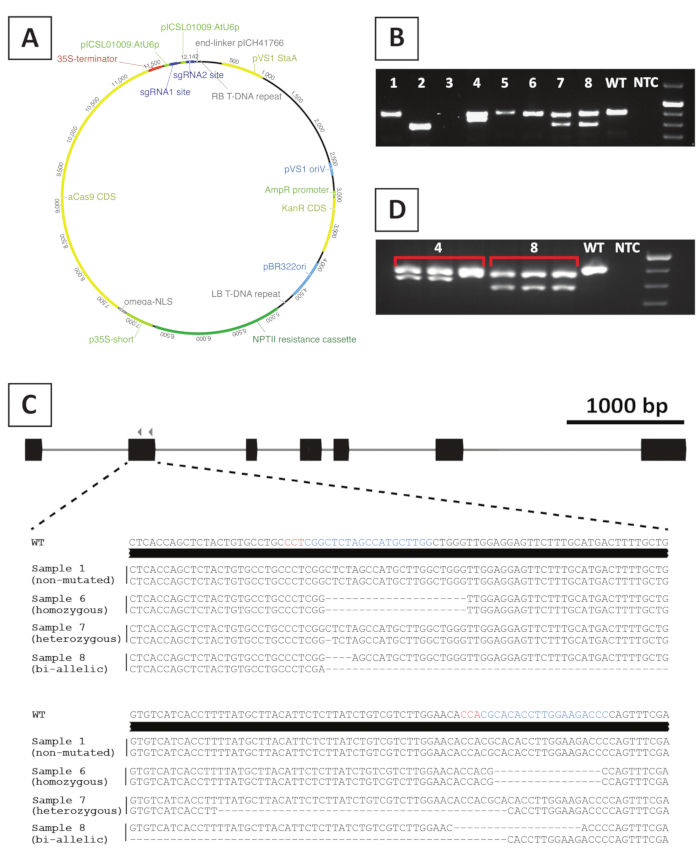
図4:P.アンダーソンIIT0トランスジェニックCRISPR/Cas9変異線のジェノタイピング後の代表的な結果。(A) P.アンダーソンのCRISPR/Cas9媒介変異に使用されるバイナリベクターの代表的な地図。(B) sgRNA標的部位にまたがるプライマーを用いて、潜在的なCRISPR/Cas9変異線のPCRベースのジェノタイピング後の代表的な結果。図示は、アンプリコンのアガロースゲル電気泳動後の画像である。個々のトランスジェニックラインから採取したサンプルは、数字で示されます。ワイルド タイプ (WT) とテンプレート コントロールなし (NTC) は、それぞれ正と負のコントロールを含むレーンを示します。(C) CRISPR/Cas9媒介遺伝子編集後に得られた変異型アエレの概略表現。青と赤の色で強調表示されているのは、それぞれsgRNAターゲット部位およびPAM配列である。(D) 潜在的なキメラ変異線に対するPCRベースのスクリーニング後の代表的な結果。図示は、変異線4および8から採取した3つの個々のサンプルのアガロースゲル電気泳動後の画像である。トランスジェニック変異線4行はキメラである。この図のより大きなバージョンを表示するには、ここをクリックしてください。
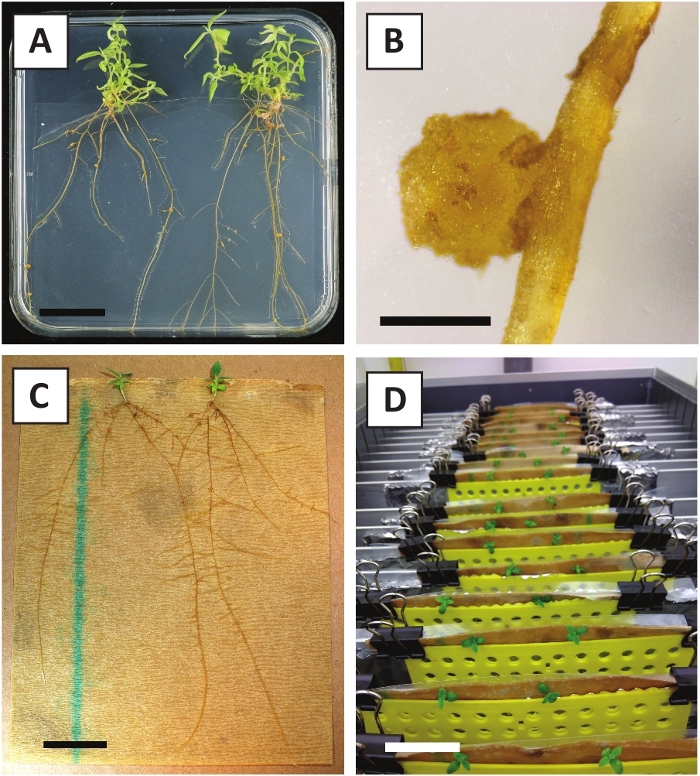
図5:プレートおよびパウチ中のノドレーションアッセイの代表的な画像。(A)寒天固化EKM培地を含むプレート上のノドレーションを、M.プリファリウムBOR2で4週間接種した。(B) P.アンダーソンイ根節の代表的な画像。画像はM.多量便BOR2で接種後4週間で撮影した。(C) 液体EKM培地を含むパウチ中の結節性。苗木を5週間ブラジリゾビウムsp.Kelud2A4で接種した。(D) パウチのうなずきに使用される完全なセットアップの代表的な画像。スケール バーは、2.5 cm インチ (A,C)、1 mm (B)、および 5 cm インチ (D) に等しくなります。この図のより大きなバージョンを表示するには、ここをクリックしてください。
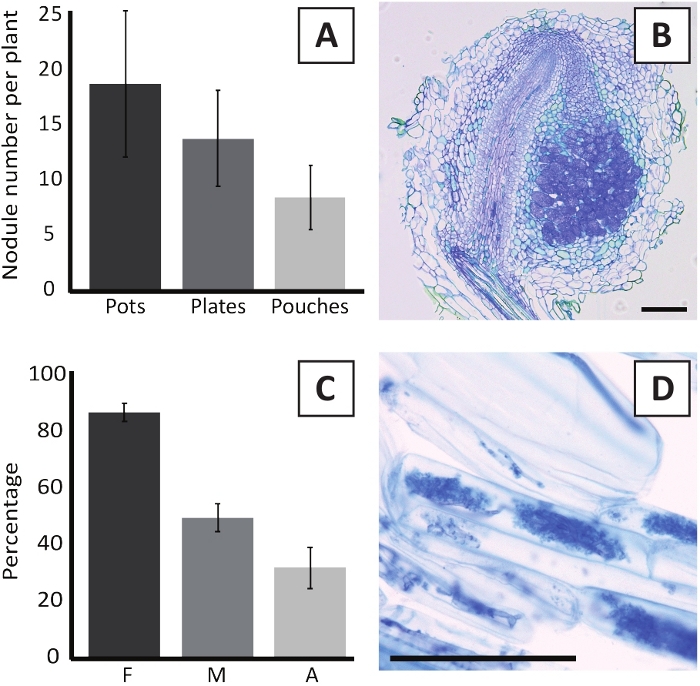
図6:結節および菌腐食アッセイの代表的な結果。(A) ポットまたはプレート上のM.プリファリウムBOR2による接種後4週間およびパウチ中のブラジリゾビウムsp. Kelud2A4の接種後4週間で植物当たり形成された結節数を示す代表的な棒グラフ。データは平均±SD(n=10)を表す。(B)M.多量尿ファリウムBOR2を接種後4週間で形成した結節を通る縦断の代表的な画像。セクションはトルイジンブルーで染色されています。(C) マイコーライゼーションの定量化を示す代表的な棒グラフ。Trouvelot et al.29に従って定量化された変数は、Fであり、分析された根断片の頻度は、mycorrh化されている。M, 感染の強度;A、総根系における成熟した樹毛の豊富さ。菌歯状化は、R.イレギュラー(株DAOM197198)を用いて接種後6週間で定量した。データは平均±SD(n=10)を表す。(D) R.イレギュラーとの接種後6週間におけるP.アンダーソンイ根皮質細胞に存在する成熟した関節の代表的な画像。スケールバーは75 μmに等しいです。
| 化合 物 | SH-0 | SH-10 | 伝播媒体 | 根源媒体 | 浸潤媒体 |
| SH塩媒体 | 3.2グラム | 3.2グラム | 3.2グラム | 3.2グラム | 3.2グラム |
| SH-ビタミン混合物 | 1 グラム | 1 グラム | 1 グラム | 1 グラム | 1 グラム |
| ショ糖 | - | 10グラム | 20グラム | 10グラム | 10グラム |
| バプ (1 mg/mL) | - | - | 1 mL (4.44 μM) | - | - |
| IBA (1 mg/mL) | - | - | 100 μL (0.49 μM) | 1 mL (4.92 μM) | - |
| NAA (1 mg/mL) | - | - | - | 100 μL (0.54 μM) | - |
| 1 M MES pH=5.8 | 3 mL | 3 mL | 3 mL | 3 mL | 3 mL |
| 1 M コー | pH を 5.8 に調整する | pH を 5.8 に調整する | pH を 5.8 に調整する | pH を 5.8 に調整する | pH を 5.8 に調整する |
| 大神寒天 | 8グラム | - | 8グラム | 8グラム | - |
表1:P.アンダーソンの苗、安定な形質転換、およびインビトロ伝播に使用されるシェンク・ヒルデブラントベースの30媒体の組成。 液体ストックを追加する前に、固形化合物を750mLの超純水に溶解します。その後、完全な媒体を1Lに記入し、BAP、IBA、NAA株を0.1M KOHで準備し、-20°Cで保存します。
| オートクレーブする前: | ||
| 化合 物 | リットル当たりの金額 | 最終濃度 |
| マンニトール | 5グラム | 27.45メートル |
| ナグルコネート | 5グラム | 22.92メートル |
| 酵母エキス | 0.5グラム | - |
| MgSO4・7H2O | 0.2グラム | 0.81メートル |
| 塩化 ナトリウム | 0.1グラム | 1.71 mM |
| K2HPO4 | 0.5グラム | 2.87 mM |
| オートクレーブ後: | ||
| 化合 物 | リットル当たりの金額 | 最終濃度 |
| 1.5 M カクル2 | 1 mL | 1.5 mM |
表2:リゾビウムの増育に用いられる酵母マンニトール(YEM)培地の組成。pHを7.0に調整し、超純水を1Lに充填します。寒天固化YEM培地を調製するには、オートクレーブする前に15gのマイクロアガーを加えます。
| オートクレーブする前: | |||
| 化合 物 | ストック濃度 | リットル媒体当たりの量 | 最終濃度 |
| KH2PO4 | 0.44メートル | 2 mL を追加 | 0.88 mM |
| K2HPO4 | 1.03メートル | 2 mL を追加 | 2.07 mM |
| 500倍マイクロエレメントストックソリューション | - | 2 mL を追加 | - |
| MES pH=6.6 | 1 M | 3 mL を追加 | 3 mM |
| Hcl | 1 M | pH を 6.6 に調整する | - |
| 超純水 | - | 990 mLまで塗りつぶす | - |
| オートクレーブ後: | |||
| 化合 物 | ストック濃度 | リットル媒体当たりの量 | 最終濃度 |
| MgSO4・7H2O | 1.04メートル | 2 mL | 2.08 mM |
| ナ2SO4 | 0.35メートル | 2 mL | 0.70メートル |
| NH4いいえ3 | 0.18メートル | 2 mL | 0.36 mM |
| カクル2・2H2O | 0.75メートル | 2 mL | 1.5 mM |
| Fe(III)-ク硝酸塩 | 27 mM | 2 mL | 54 μM |
表3:P.アンダーソンイ結節アッセイに用いられる1L修飾EKM培地31の組成物。 500xマイクロエレメントストックソリューションの組成は、表4に記載されている。寒天固化EKM培地を2%調製するには、オートクレーブする前に20gの大神寒天を加えます。MgSO4·7H2O、Na2SO 4、CaCl2~2H2O、および Fe(III)-クエン酸ストックを殺菌する。フィルターは殺菌するNH4NO3ストックソリューションを殺菌する。
| 化合 物 | リットル当たりの金額 | ストック濃度 |
| MnSO4 | 500 mg | 3.31 mM |
| ZnSO4・7H2O | 125 mg | 0.43メートル |
| CuSO4・5H2O | 125 mg | 0.83メートル |
| H3BO3 | 125 mg | 2.02 mM |
| Na2MoO4・2H2O | 50 mg | 0.21 mM |
表4:改変EKM培地の準備に用いられる500倍マイクロエレメントストック溶液の組成。マイクロエレメントストック溶液を4°Cに保管します。
| 化合 物 | ストック濃度 | リットル媒体当たりの量 | 最終濃度 |
| K2HPO4 | 20 mM | 1 mL | 0.2 mM |
| NH4いいえ3 | 0.28メートル | 10 mL | 2.8 mM |
| MgSO4 | 40 mM | 10 mL | 0.4 mM |
| K2SO4 | 40 mM | 10 mL | 0.4 mM |
| フェ(II)-EDTA | 9 mM | 10 mL | 0.9 m |
| カクル2 | 80 mM | 10 mL | 0.8 mM |
| 50倍マイクロエレメントストックソリューション | - | 10 mL | - |
表5:マイコーライゼーションアッセイに用いられる1/2-ホアグランド32培地の組成物。50倍マイクロエレメントストック溶液の組成は、表6に記載されている。FeSO4・7H2O(9 mM)とNa2を組み合わせてFe(II)-EDTAソリューションを準備する ~EDTA(9mM)を1つのストック溶液に入れ、4°Cで保存します。1 M KOH を使用して培地の pH を 6.1 に調整し、超純水を 1 L に充填します。
| 化合 物 | リットル当たりの金額 | ストック濃度 |
| H3BO3 | 71.1 の mg | 1.15 mM |
| MnCl2·4H2O | 44.5 mg | 0.22 mM |
| CuSO4・5H2O | 3.7 mg | 23.18 μM |
| ZnCl2 | 10.2 の mg | 74.84 μM |
| Na2MoO4・2H2O | 1.2 mg | 4.96 μM |
表6:1/2-ホアグランド培地の準備に用いられる50倍マイクロエレメントストック溶液の組成。
| 移植の年齢 | 変換効率 |
| 若い | 69.4 ± 6.2% (n = 2) |
| 成熟 | 18.3 ± 10.2% (n = 15) |
表 7: P. andersonii の変換効率 .ここで、変換効率は、少なくとも1トランスジェニックカルスまたはシュートを形成する移植のパーセンテージとして定義される。変換効率は、変換後6週間でスコア付けされ、平均±SD.nとして描かれ、変換効率が決定された変換実験の数を示す。
補足ファイル 1: CRISPR/Cas9 変異に使用されるレベル 1 およびレベル 2 の構成要素の概要。このファイルをダウンロードするには、ここをクリックしてください。
Discussion
豆類と遠く関連するカンナバ科属パラスフォニアは、窒素固定根茎と内因性関係を確立し、根結節を形成することができる植物種の唯一の2つのクレードを表します。両方のクレードの種間の比較研究は、この共生を可能にするコア遺伝的ネットワークへの洞察を提供するために非常に関連しています。現在、遺伝子研究は主に豆類で行われています。特に2つのモデル種M.トランカチュラとL.ジャポニカス.追加の実験プラットフォームを提供し、非レグメを結節性のない比較研究を容易にするために、P.andersoniiiの安定的な変換と逆遺伝子解析のための詳細なプロトコルをここで説明する。提示されたプロトコルは、T0トランスジェニックP.アンダーソンニラインのインビトロ伝播を使用し、A.ツメファシアン共培養後4ヶ月以内にフェノイピック分析を開始することを可能にする。これは、豆類33の安定的な変換のために確立された現在のプロトコルよりも実質的に高速です。これはP.アンダーソンリを魅力的な研究モデルにします。
ここで説明するプロトコルには、いくつかの重要な手順が含まれています。最初は種子の発芽に関するものです。発芽のためのP.アンダーソンの種子を準備するには、種子はベリーから分離する必要があります。これは、ティッシュペーパーの一部にベリーをこするか、ティーシーブの内側に対して行われます。シードコートの損傷を防ぐために、この手順を穏やかに行う必要があります。種子コートが損傷した場合、漂白剤は殺菌中に種子に入り、種子の生存率を低下させる可能性があります。種子休眠を破るために、種子は10日間の温度サイクルを受ける。しかし、この治療にもかかわらず、発芽は完全に同期されていません。一般的に、最初の種子は7日後に輝きの出現を示すが、他の種子は発芽するのに数日かかることがある。
変換手順の重要なポイントは、開始材料の選択と共栽培ステップの持続時間に関する。効率的な変換に到達するためには、非滅菌温室栽培植物の健康で若い茎やペチオールを出発材料として使用するのが最善です。若い枝の成長を誘発するために、2-3ヶ月ごとにパラスパウニアの木をトリミングし、年に一度木をリフレッシュすることをお勧めします。さらに、共同栽培工程は2日間のみ行う必要があります。長期の共同栽培は、A.ツメファシアンによる組織移植の過剰植民地化を促進し、一般的に変換効率を低下させる。A.ツメファシエンスによる過剰植民地化を防ぐためには、定期的に移植所が栽培されているプレートをリフレッシュすることも重要です。過剰コロニー化が起こった場合、組織の移植は洗浄され(セクション3.8参照)、A.ツメファシエンス細胞を除去することができる。洗浄に使用するSH-10溶液(最終濃度:約2%以下の塩酸塩)に漂白剤を添加することをお勧めします。この追加の洗浄ステップは、感染の多い移植所では機能しない可能性があります(図2B)ことに注意することが重要です。CRISPR/Cas9コンストラクトを用いた変換では、限られた数のプタブル変換された芽しか得られなかったり、特定の遺伝子の変異が再生に問題を引き起こすと予想される場合は、空のベクター制御構造を含めるのが良いでしょう。ポジティブコントロール。最後に、選択されたすべてのトランスジェニックラインが独立したT-DNA統合イベントから生じていることを確認することが重要です。したがって、我々は、移植片の両側から単一のプトアティブトランスジェニックシュートのみを取るように指示します。しかし、これは独立したラインの潜在的な数を減らすことを認識しています。多くの行が必要な場合、研究者は、これらのカリのサイズと培養が≥2 mm の場合に、元の移植所から移植性に変換されたカリを分離することを決定できます。このようにして、複数のラインを各移植から分離することができ、潜在的なトランスジェニックラインの数を増加させます。
現在のプロトコルでは、P.andersoniiiのトランスジェニックラインは、体外伝播を介して栄養的に伝播される。この利点は、多くのトランスジェニックプラントレットが比較的短い期間で生成できることです。ただし、この方法にはいくつかの制限もあります。第一に、インビトロ伝播を介したT0トランスジェニックラインの維持は労働集約的であり、望ましくない遺伝的またはエピジェネティックな変化をもたらす可能性がある34,35。第二に、T0ラインは、抗生物質耐性カセットを含むT-DNAのコピーをまだ含んでいる。これにより、再変換ごとに異なる選択マーカーが必要になるように、可能な再変換の数が制限されます。現在、カナマイシンまたはハイグロマイシン選択を用いてのみ変換をテストしています(データは示されていません)。さらに、T0トランスジェニックラインにおけるCas9エンコード配列およびsgRNAの存在は、補体研究を複雑にする。補体アッセイは可能であるが、補体構造の遺伝子編集が防止されるよう、sgRNA標的部位を変異させる必要がある。第三に、T0ラインを操作する場合の欠点は、CRISPR/Cas9 変異体がキメラである可能性がある点です。キメラ変異線の表現型解析を防ぐために、少なくとも3つの異なる芽にインビトロ伝播後にジェノタイピング分析を繰り返すことをお勧めします。しかし、ここで説明するプロトコルを用いて得られたキメラ変異体の数は限られているが、それらは時折10を観察される。T0ラインでの作業の限界を克服するために、P.アンダーソンジ変異線は生成的に伝播することができる。P.アンダーソンの木は、気まぐれで風受粉2.つまり、オスとメスの花が1個の個体で生産され、その後、クロス受粉が起こらないように成長するように、各トランスジェニックラインを操作する必要があります。P.andersoniiは急速に成長している木なので、熱帯温室(28°C、相対湿度〜85%)のかなりのスペースを必要とします。したがって、技術的には可能であるが、P.アンダーソンニトランスジェニックラインの生成伝播はロジスティックに困難である。
プロトコルセクションでは、P.andersoniiiの結節化のための3つの方法を説明した。プレートおよびパウチシステムの利点は、根が容易にアクセス可能であり、細菌のスポット接種を可能にし、時間の経過とともに節位形成に続く可能性があることです。しかし、プレートシステムは非常に労働集約的であり、大規模な結節実験にはあまり適していません。パウチシステムの欠点は、真菌汚染を防ぐのが難しいことです。パウチは無菌ではないため、真菌の成長は、多くの場合、パウチの上半分に観察されます。しかし、これはP.アンダーソンの成長に影響を与えないため、ノドレーションアッセイを妨げません。さらに、パウチシステムは苗に適しています。何度か試みたにもかかわらず、パウチのインビトロ伝播を通じて得られた植物を栽培することができませんでした。
ここで説明するP.andersonii逆遺伝学パイプラインは、既存のA.根源ベースの根形質法11と比較して実質的な改善を提供する。記載された手順を使用して、安定したトランスジェニックラインを効率的に生成することができ、インビトロ伝播を介して維持することができる。対照的に、A.根茎形質転換は一過性であり、トランスジェニック根の形成をもたらすだけである。各トランスジェニック根は独立した形質転換から生じるので、A.根茎変換ベースのアッセイは実質的な表現型変動に苦しむ。このバリエーションは、安定したラインの場合ははるかに少なくなりますが、インビトロ伝播は、ある程度のバリエーションを作成します。この変動が減少し、各安定ラインに対して複数の植物を表現できるため、安定したラインはA.根形成根と比較して定量アッセイに適しています。さらに、安定な形質転換は、内因性ホルモンバランス15に影響を与えるA.根根根誘導遺伝子(rol)の導入に依存しない。したがって、安定した線は、A.根形成根と比較してホルモン恒常性に関与する遺伝子の逆遺伝子解析に適しています。研究モデルとしてのP.andersoniiのより一般的な利点は、最近の全ゲノム複製(WGD)を経験しなかったことである。モデルの豆類M.トランカトゥラとL.ジャポニカスを含むレグメパピリオノディアディアサブファミリー、ならびにモデルツリーポピュラストリコカルパを含むサリカ科(順マルピヒアレス)はWGDs~65を経験しました百万年前36,37.これらのWGDから生じる多くのパラロゴ遺伝子コピーは、M.トランカツラ、L.ジャポニカスおよびP.トリコカルパ37、38、39のゲノムに保持され、作成される逆の遺伝的分析を複雑にする可能性のある冗長性。P.andersoniiは最近のWGDを経験しなかったので、P.andersoniiiの逆遺伝子解析は、パラロゴス遺伝子コピーの冗長な機能によって影響を受けにくいかもしれません。
一緒に、我々はP.andersoniiの逆遺伝子解析のための詳細なプロトコルを提供する。このプロトコルを使用すると、単一の変異線を2〜3ヶ月10の時間枠で効率的に生成することができる。このプロトコルは、他の植物種40、41、42に示すように、異なる遺伝子を同時に標的とするsgRNAの多重化を通じて高次変異体を作成するために拡張することができる。さらに、ここで説明する安定な形質転換手順は、CRISPR/Cas9遺伝子標的化に限定されるものではなく、他のタイプの構成要素(例えば、プロモーターレポーターアッセイ、異所性発現またはトランス) を導入するためにも使用することができる。補完)。窒素固定性根茎や内耳菌菌との相互共生を研究する比較研究モデルとしてP.andersoniiを設立しました。しかし、ここで説明するプロトコルはまた、木材形成、バイセクシャルフラワーの開発、またはカンナバ科特異的二次代謝物の生合成など、この熱帯木の生物学の他の側面を研究するためのツールを提供します。
Acknowledgements
著者たちは、マーク・ワイルズ、ソフィーン・カムーン、シルヴェストル・マリオンネットが、アドジーン・データベースを通じてゴールデンゲートのクローン部品を入手できるようにしたことを認めたい。さらに、P.アンゴネリの種子に対してE・ジェームズ、P・ハドバス、T.J.ヒッゲンスに感謝したいと思います。この研究は、オランダ科学研究機構(NWO-VICI助成金865.13.001)によって支援されました。NWO-Openコンペティション助成金 819.01.007)とインドネシア共和国研究技術高等教育省(RISET-PRO助成金8245-ID)。
Materials
| Name | Company | Catalog Number | Comments |
| Sigma-Aldrich | N0640 | NAA | |
| Duchefa Biochemie | M1503.0250 | MES | |
| Sigma-Aldrich | D134406 | Acetosyringone | |
| Duchefa Biochemie | X1402.1000 | X-Gal | |
| Merck | 101236 | For nucleic acid electrophoresis gel | |
| - | - | Pouches box material, hangers | |
| Merck | 101188 | NH4NO3 | |
| Sigma-Aldrich | B3408-1G | BAP | |
| Merck | 100156 | H3BO3 | |
| Thermo-Fisher | ER1011 | Used as restriction enzyme in Golden Gate cloning assembly | |
| Thermo-Fisher | 15561020 | Used in Golden Gate cloning assembly | |
| Merck | 137101 | CaCl2·2H2O | |
| Duchefa Biochemie | C0111.0025 | C16H16N5O7S2Na | |
| Thermo-Fisher | K1231 | Used for cloning the blunt-ended PCR amplicons in genotyping procedure | |
| Agronutrition | AP2011 | Containing Rhizophagus irregularis DAOM 197198 (1,000 spores/mL), used for mychorrization assay | |
| Merck | 102790 | CuSO4·5H2O | |
| Duchefa Biochemie | D1004.1000 | Used for plant tissue culture agar-based medium | |
| Merck | 105101 | K2HPO4 | |
| VWR Chemicals | 20302.293 | Na2·EDTA | |
| Duchefa Biochemie | M0803.1000 | C6H14O6 | |
| Thermo-Fisher | ER0291 | Used as restriction enzyme in Golden Gate cloning assembly | |
| Merck | 100983 | C2H5OH | |
| VWR Chemicals | BDH9232-500G | EDTA | |
| Sigma-Aldrich | Z377600-1PAK | Cellophane membrane | |
| Biomatters, Ltd. | R9 or higher | Bioinformatics software for in silico cloning and designing of sgRNAs | |
| Mega International | - | Technical information at https://mega-international.com/tech-info/ | |
| Sigma-Aldrich | 65882 | Used for fixating nodule tissues | |
| VWR Chemicals | 24385.295 | - | |
| Vink | 219341 | Pouches box material, bottom part | |
| Leica Biosystems | 14702218311 | Used as a template for plastic embedding | |
| Merck | 100317 | HCl | |
| Sigma-Aldrich | I5386-1G | IBA | |
| Merck | 103862 | C6H5FeO7 | |
| Merck | 103965 | FeSO4O·7H2O | |
| Duchefa Biochemie | I1401.0005 | IPTG | |
| Duchefa Biochemie | K0126.0010 | ||
| Sigma-Aldrich | L2000 | ||
| Merck | 105886 | MgSO4O·7H2O | |
| Merck | 105934 | MnCl2·4H2O | |
| Merck | 102786 | MnSO4O | |
| Duchefa Biochemie | M1002.1000 | Used for bacterial culture agar-based medium | |
| Manutan | 92007687 | Pouches material | |
| Paraxisdienst | 130774 | Elastic sealing foil | |
| Pull Rhenen | Agra-Perlite No.3 | Used as growing substrate in pots for nodulation assay | |
| VWR Chemicals | 391-0581 | Used as container for cellophane membranes | |
| Thermo-Fisher | F130WH | For genotyping transgenic lines | |
| Addgene | 50337 | Level 0 terminator, 3'UTR, 35s (Cauliflower Mosaic Virus) | |
| Addgene | 48017 | End-link 2 for assembling 2 level one part into a level 2 acceptor | |
| Addgene | 48018 | End-link 3 for assembling 3 level one part into a level 2 acceptor | |
| Addgene | 48001 | Level 1 acceptor. Position 5. Forward orientation | |
| Addgene | 48007 | Level 1 Acceptor. Position 1. Reverse orientation | |
| Addgene | 50268 | Level 0 promoter (0.4 kb), 35s (Cauliflower Mosaic Virus) + 5'UTR, Ω (Tobacco Mosaic Virus) | |
| Addgene | 46966 | Used for designing CRISPR/Cas9 module | |
| Addgene | 46968 | Used for designing CRISPR/Cas9 module | |
| Addgene | 50334 | Level 0 Kanamycin/Neomycin/Paromomycin resistance cassette | |
| Topzeven | - | Used as filters for washing spore suspension | |
| Sigma-Aldrich | 8.17003 | PEG400 | |
| Duchefa Biochemie | E1674.0001 | Pots to grow Parasponia plantlets/seedlings | |
| Merck | 104871 | KH2PO4 | |
| Merck | 105033 | KOH | |
| Merck | 105153 | K2SO4O | |
| Van Leusden b.v. | - | Used as growing substrate for mychorrhization assay | |
| Duchefa Biochemie | S0225.0050 | SH-basal salt medium | |
| Duchefa Biochemie | S0411.0250 | SH-vitamin mixture | |
| Lehle Seeds | VIS-02 | Used as non-ionic surfactant in the washing step of stable transformation | |
| Merck | 137017 | NaCl | |
| VWR Chemicals | 89230-072 | C6H11NaO7 | |
| Merck | 106521 | Na2MoO4·2H2O | |
| Merck | 106574 | Na2HPO4·7H2O | |
| Merck | 567549 | NaH2PO4·H2O | |
| Sigma-Aldrich | 239313 | Na2SO4O | |
| Duchefa Biochemie | S0809.5000 | C12H22O11 | |
| Thermo-Fisher | B69 | Used in Golden Gate cloning assembly | |
| Thermo-Fisher | EL0013 | Used in Golden Gate cloning assembly | |
| Kulzer-Mitsui Chemicals Group | 64708806 | Methyl methacrylate-based resin powder | |
| Kulzer-Mitsui Chemicals Group | 64709003 | HEMA (2-hydroxyethyl methacrylate)-based resin solution | |
| Kulzer-Mitsui Chemicals Group | 66022678 | Methyl methacrylate-based resin solution | |
| Merck | 1159300025 | ||
| Acros | 189350250 | ||
| VWR Chemicals | 663684B | Polysorbate 20 | |
| Stout Perspex | - | pouches box material, lid | |
| Duchefa Biochemie | Y1333.1000 | ||
| Merck | 108816 | ZnCl2 | |
| Alfa Aesar | 33399 | ZnSO4O·7H2O |
References
- Clason, E. W. THE VEGETATION OF THE UPPER-BADAK REGION OF MOUNT KELUT (EAST JAVA). Bulletin du Jardin Botanique de Buitenzorg. Serie III, 509-518 (1936).
- Soepadmo, E. Ulmaceae. Flora Malesiana-Series 1, Spermatophyta. 8, 31-76 (1974).
- Becking, J. H. The Rhizobium symbiosis of the nonlegume Parasponia. Biological Nitrogen Fixation. , 497-559 (1992).
- Oldroyd, G. E. D. Speak, friend, and enter: signalling systems that promote beneficial symbiotic associations in plants. Nature Reviews Microbiology. 11, 252-263 (2013).
- Gutjahr, C., Parniske, M. Cell and developmental biology of arbuscular mycorrhiza symbiosis. Annual Review of Cell and Developmental Biology. 29, 593-617 (2013).
- van Velzen, R., et al. Comparative genomics of the nonlegume Parasponia reveals insights into evolution of nitrogen-fixing rhizobium symbioses. Proceedings of the National Academy of Sciences of the United States of America. 115, E4700-E4709 (2018).
- van Velzen, R., Doyle, J. J., Geurts, R. A Resurrected Scenario: Single Gain and Massive Loss of Nitrogen-Fixing Nodulation. Trends in Plant Science. 24, 49-57 (2019).
- Griesmann, M., et al. Phylogenomics reveals multiple losses of the nitrogen-fixing root nodule symbiosis. Science. 1743, eaat1743 (2018).
- Becking, J. H. Root-Nodule Symbiosis Between Rhizobium And Parasponia (Ulmaceae). Plant and Soil. 51, 289-296 (1979).
- van Zeijl, A., et al. CRISPR/Cas9-Mediated Mutagenesis of Four Putative Symbiosis Genes of the Tropical Tree Parasponia andersonii Reveals Novel Phenotypes. Frontiers in Plant Science. 9, 284 (2018).
- Cao, Q., et al. Efficiency of Agrobacterium rhizogenes–mediated root transformation of Parasponia and Trema is temperature dependent. Plant Growth Regulation. 68, 459-465 (2012).
- Limpens, E., et al. RNA interference in Agrobacterium rhizogenes-transformed roots of Arabidopsis and Medicago truncatula. Journal of Experimental Botany. 55, 983-992 (2004).
- Boisson-Dernier, A., et al. Agrobacterium rhizogenes-Transformed Roots of Medicago truncatula for the Study of Nitrogen-Fixing and Endomycorrhizal Symbiotic Associations. Molecular Plant-Microbe Interactions. 14, 695-700 (2001).
- Kumagai, H., Kouchi, H. Gene Silencing by Expression of Hairpin RNA in Lotus japonicus Roots and Root Nodules. Molecular Plant-Microbe Interactions. 16, 663-668 (2003).
- Nilsson, O., Olsson, O. Getting to the root: The role of the Agrobacterium rhizogenes rol genes in the formation of hairy roots. Physiologia Plantarum. 100, 463-473 (1997).
- Davey, M. R., et al. Effective Nodulation of Micro-Propagated Shoots of the Non-Legume Parasponia andersonii by Bradyrhizobium. Journal of Experimental Botany. 44, 863-867 (1993).
- Webster, G., Poulton, P. R., Cocking, E. C., Davey, M. R. The nodulation of micro-propagated plants of Parasponia andersonii by tropical legume rhizobia. Journal of Experimental Botany. 46, 1131-1137 (1995).
- Op den Camp, R., et al. LysM-type mycorrhizal receptor recruited for rhizobium symbiosis in nonlegume Parasponia. Science. 331, 909-912 (2011).
- Weber, E., Engler, C., Gruetzner, R., Werner, S., Marillonnet, S. A Modular Cloning System for Standardized Assembly of Multigene Constructs. PLOS ONE. 6, e16765 (2011).
- Nekrasov, V., Staskawicz, B. J., Weigel, D., Jones, J. D. G., Kamoun, S. Targeted mutagenesis in the model plant Nicotiana benthamiana using Cas9 RNA-guided endonuclease. Nature Biotechnology. 31, 691-693 (2013).
- Bertani, G. Studies On Lysogenesis. I. The Mode Of Phage Liberation By Lysogenic Escherichia Coli. Journal of Bacteriology. 62, 293-300 (1951).
- Engler, C., et al. A Golden Gate modular cloning toolbox for plants. ACS Synthetic Biology. 3, 839-843 (2014).
- Fauser, F., Schiml, S., Puchta, H. Both CRISPR/Cas-based nucleases and nickases can be used efficiently for genome engineering in Arabidopsis thaliana. The Plant Journal. 79, 348-359 (2014).
- Lazo, G. R., Stein, P. A., Ludwig, R. A. A DNA Transformation-Competent Arabidopsis Genomic Library in Agrobacterium. Biotechnology. 9, 963-967 (1991).
- Op den Camp, R. H. M., et al. N Nonlegume Parasponia andersonii Deploys A Broad Rhizobium Host Range Strategy Resulting in Largely Variable Symbiotic Effectivenes. Molecular Plant-Microbe Interactions. 25, 954-963 (2012).
- Graham, P. H., Viteri, S. E., Mackie, F., Vargas, A. T., Palacios, A. Variation in acid soil tolerance among strains of Rhizobium phaseoli. Field Crops Research. 5, 121-128 (1982).
- Martinez-Romero, E., et al. Rhizobium tropici, A Novel Species Nodulating Phaseolus vulgaris L. Beans and Leucaena sp. Trees. International Journal of Systematic and Evolutionary Microbiology. 41, 417-421 (1991).
- Felten, J., et al. The Ectomycorrhizal Fungus Laccaria bicolor Stimulates Lateral Root Formation in Poplar and Arabidopsis through Auxin Transport and Signaling. Plant Physiology. 151, 1991-2005 (1991).
- Trouvelot, A., Kough, J. L., Gianinazzi-Pearson, V. Mesure du taux de mycorhization VA d’un systeme radiculaire. Recherche de methods d’estimation ayant une signification fonctionnelle. Aspects Physiologiques et Genetiques des Mycorhizes. , 217-221 (1986).
- Schenk, R. U., Hildebrandt, A. C. Medium and techniques for induction and growth of monocotyledonous and dicotyledonous plant cell cultures. Canadian Journal of Botany. 50, 199-204 (1972).
- Becking, J. H. The Parasponia parviflora - Rhizobium symbiosis. Host specificity, growth and nitrogen fixation under various conditions. Plant and Soil. 75, 309-342 (1983).
- Hoagland, D. R., Arnon Revised, D. I., Arnon, D. I. The Water-Culture Method for Growing Plants without Soil. Circular California Agricultural Experiment Station. 347, 1-32 (1950).
- Wang, K. . Methods in Molecular Biology: Agrobacterium Protocols. 1, (2015).
- Smulders, M. J. M., de Klerk, G. J. Epigenetics in plant tissue culture. Plant Growth Regulation. 63, 137-146 (2011).
- Larkin, P. J., Scowcroft, W. R. Somaclonal variation — a novel source of variability from cell cultures for plant improvement. Theoretical and Applied Genetics. 60, 197-214 (1981).
- Cannon, S. B., et al. Legume genome evolution viewed through the Medicago truncatula and Lotus japonicus genomes. Proceedings of the National Academy of Sciences of the United States of America. 103, 14959-14964 (2006).
- Tuskan, G. A., et al. The Genome of Black Cottonwood, Populus trichocarpa (Torr. & Gray). Science. 313, 1596-1604 (2006).
- Young, N. D., et al. The Medicago genome provides insight into the evolution of rhizobial symbioses. Nature. 480, 520 (2011).
- Sato, S., et al. Genome Structure of the Legume, Lotus japonicus. DNA Research. 15, 227-239 (2008).
- Xing, H. L., et al. A CRISPR/Cas9 toolkit for multiplex genome editing in plants. BMC Plant Biology. 14, 327 (2014).
- Lowder, L. G., et al. A CRISPR/Cas9 Toolbox for Multiplexed Plant Genome Editing and Transcriptional Regulation. Plant Physiology. 169, 971 (2015).
- van Zeijl, A. . Dissecting Hormonal Pathways in Nitrogen-Fixing Rhizobium Symbioses. , (2017).
Explore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved