حقل ما بعد الوفاة داء الكلب اختبار تشخيصية مناعية سريعة لإعدادات الموارد المحدودة مع مزيد من التطبيقات الجزيئية
In This Article
Summary
نقدم بروتوكولًا كاملًا لتشخيص داء الكلب الحيواني بعد الوفاة في ظل الظروف الميدانية باستخدام اختبار تشخيصي مناعي سريع (RIDT) ، من أخذ عينات من خزعة الدماغ إلى التفسير النهائي. كما أننا نُصف التطبيقات الأخرى التي تستخدم الجهاز للتحليل الجزيئي وgenotyping الفيروسي.
Abstract
نظم مراقبة داء الكلب الوظيفية حاسمة لتوفير بيانات موثوقة وزيادة الالتزام السياسي اللازم لمكافحة الأمراض. حتى الآن، يجب تقديم الحيوانات المشتبه في أنها إيجابية لداء الكلب إلى تأكيد ما بعد الوفاة باستخدام أساليب مختبرية كلاسيكية أو جزيئية. ومع ذلك، فإن معظم المناطق المتوطنة تقع في البلدان المنخفضة الدخل والبلدان المتوسطة الدخل حيث يقتصر تشخيص داء الكلب على المختبرات البيطرية المركزية. ويؤدي ضعف توافر الهياكل الأساسية للمراقبة إلى نقص خطير في الإبلاغ عن الأمراض من المناطق النائية. وقد تم مؤخراً وضع العديد من البروتوكولات التشخيصية التي تتطلب خبرة تقنية منخفضة، مما أتاح الفرصة لإنشاء تشخيص داء الكلب في المختبرات اللامركزية. نقدم هنا بروتوكول كامل للتشخيص الميداني بعد الوفاة من داء الكلب الحيواني باستخدام اختبار تشخيصي مناعي سريع (RIDT)، من أخذ عينات خزعة الدماغ إلى التفسير النهائي. نكمل البروتوكول من خلال وصف استخدام إضافي للجهاز للتحليل الجزيئي وgenotyping الفيروسية. RIDT يكتشف بسهولة فيروس داء الكلب وغيرها من الفيروسات في عينات الدماغ. مبدأ هذه الاختبارات بسيط: يتم تطبيق مواد الدماغ على شريط اختبار حيث ترتبط الأجسام المضادة ذات الاقتران بالذهب على وجه التحديد بداء الكلب المستضدات. ترتبط مجمعات الأجسام المضادة للمضدادات بالأجسام المضادة الثابتة على خط الاختبار، مما يؤدي إلى خط أرجواني واضح. يتم تعطيل الفيروس في شريط الاختبار، ولكن يمكن استخراج الحمض النووي الريبي الفيروسي في وقت لاحق. وهذا يسمح شريط الاختبار، بدلا من عينة الدماغ المعدية، أن ترسل بأمان وسهولة إلى مختبر مجهزة لتأكيد والكتابة الجزيئية. بناء على تعديل بروتوكول الشركة المصنعة، وجدنا زيادة حساسية الاختبار، لتصل إلى 98٪ مقارنة مع الطريقة المرجعية القياسية الذهبية، واختبار الأجسام المضادة المناعية المباشرة. مزايا الاختبار عديدة: سريعة وسهلة الاستخدام، منخفضة التكلفة ولا حاجة للبنية التحتية للمختبر، مثل المجهر أو الامتثال للسلسلة الباردة. وتمثل هذه الأساليب بديلا مفيدا للمناطق التي لا تتوفر فيها طرق تشخيص مرجعية.
Introduction
داء الكلب الكلاب هو السبب الرئيسي لداء الكلب البشري، وهو مسؤول عالمياً عن حوالي 59,000 حالة وفاة بشرية سنوياً، وكلها تقريباً تحدث في البلدان المنخفضة والمتوسطة الدخل في آسيا وأفريقيا1. العامل المسببات الرئيسية هو فيروس الكلب الكلاسيكي المرتبط بجلب الكلاب العصبية (RABV، Rhabdoviridaeالأسرة ، فيروس جنس Lyssa ،أنواع داء الكلب lyssavirus). ومع ذلك ، فإن غيرها من داء الكلب ذات الصلة lyssaviruses ، ومعظمها في أنواع الخفافيش ، كما تسبب المرض2،3. في المناطق المتضررة، وغالبا ما يعوق مراقبة الأمراض والسيطرة عليها الالتزام السياسي مستوى منخفض من المرجح بسبب عدم وجود بيانات موثوقة4,5,6. ومن أسباب نقص الإبلاغ عن الأمراض عدم وجود تشخيص مختبري، ويرجع ذلك جزئيا إلى محدودية الوصول إلى المختبرات المجهزة والموظفين المدربين فضلا عن صعوبات شحن العينات. التشخيص المختبري ضروري لتأكيد حالات داء الكلب ويسمح بالإضافة إلى ذلك بالتوصيف الجيني للسلالات المعنية ، وتوفير نظرة ثاقبة على انتقال الفيروس على المستوى الإقليمي4،5،7.
المعايير الحالية لـ "الذهب" لتشخيص داء الكلب بعد الوفاة، التي وافقت عليها كل من منظمة الصحة العالمية والمنظمة العالمية لصحة الحيوان (OIE)، هي اختبار الأجسام المضادة الفلورية المباشر (DFAT)، واختبار الكيمياء المناعية السريعة المباشرة (DRIT) والأساليب الجزيئية (مثل تفاعل سلسلة البوليميراز النسخ العكسي (RT-PCR))4،8. غير أن التطبيق السليم في البلدان الجزرية المُمَرِّزة لا يزال محدوداً بسبب عدم كفاية المرافق المختبرية التي لا تُزوّد بإمدادات الطاقة، ولا تُنقل عينات من الأراضي، ولا نظام لإدارة الجودة. ولأن تشخيص داء الكلب الحيواني لا يتم عادة إلا في المختبرات البيطرية المركزية في LMICs، فإن بيانات الترصد الموجودة تعكس بشكل رئيسي حالة داء الكلب في المناطق الحضرية.
وضعت مؤخرا بدائل التكنولوجيا التشخيصية المنخفضة توفر فرصا لإنشاء تشخيص داء الكلب في المناطق النائية ومختبرات داء الكلب اللامركزية4,8,9. إن اختبار التشخيص المناعي السريع (RIDT) هو اختبار تدفق أفقي يستند إلى التصوير المناعي باستخدام أجسام مضادة للكشف عن داء الكلب والمترافقة بالذهب وهي أداة تشخيصية واعدةجداً 10،11،12،13. المبدأ بسيط: بعد التخفيف ، يتم خلط مواد الدماغ في المخزن المؤقت المقدم ، ويتم تطبيق بضع قطرات على شريط الاختبار حيث ترتبط الأجسام المضادة أحادية النسيلة الذهبية على وجه التحديد بداء الكلب ، وأساساً مضادات النيوكلوبروتينات (الشكل 1). بعد ذلك، تخضع مجمعات الأجسام المضادة للضد إلى هجرة التدفق الجانبي، وتجليدها عند خط الاختبار (T-line) للأجسام المضادة الثابتة ضد مستضدات داء الكلب، مما يؤدي إلى خط أرجواني واضح. أما الأجسام المضادة المترافقة مع الذهب المتبقية غير المرتبطة بداء داء الكلب، فتواصل الهجرة والإصلاح إلى الغشاء من خلال أجسام مضادة إضافية لاستهدافه، مما يؤدي إلى وجود خط تحكم أرجواني واضح (خط C).
طريقة خطوة واحدة، منخفضة التكلفة سريعة وسهلة للغاية ولا تتطلب معدات باهظة الثمن أو ظروف تخزين خاصة. مع تعديل بروتوكول الشركة المصنعة للقضاء على خطوة التخفيف، يتم تضمين ما يقرب من جميع المعدات والكواشف المطلوبة لتنفيذ الاختبار في مجموعة14. وتُقرأ النتيجة بعد 5-10 دقائق دون مجهر. وهذه ميزة كبيرة على اختبار DFAT، الذي يتطلب مجهر fluorescence ومقارنة مناعية، جنبا إلى جنب مع النقل المبرد وتخزين العينة. حتى اختبار DRIT ، الذي يمكن إجراؤه باستخدام مجهر خفيف ، يتطلب سلسلة تبريد مستمرة لتخزين الأجسام المضادة لداء الكلب ، والتي لم تكن متاحة تجاريًا أيضًا. وبالمقارنة مع هذا النظام، لا يتطلب النظام الدولي للمواد الكيميائية السمية أية مواد كيميائية، وهي ميزة خاصة في البلدان التي يكون فيها التخلص من النفايات غير منظم بشكل جيد. الاختبار السريع هو أقل استهلاكا للوقت مع تفسير أسهل بكثير بالمقارنة مع معيار الذهب اختبارات DFAT وDIT. وهذا يسمح بإجراء اختبارات في الموقع من قبل أفراد ذوي خبرة تقنية محدودة.
وبناءً على خصائص الاختبار هذه، يصبح التشخيص الفوري للحيوانات المشتبه بها في المناطق النائية أمراً ممكناً، مما يسهل تنفيذ الوقاية اللاحقة من التعرض (PEP) للأشخاص المعرضين في أقرب وقت ممكن. وبالإضافة إلى ذلك، فإن النقل عن بعد لعينات داء الكلب ليس ضروريا، مما يؤدي إلى تحسين نوعية العينة في وقت الاختبار. ومع ذلك، يجب تأكيد النتائج التي تم الحصول عليها من اختبارات RIDT حاليا باستخدام اختبار تشخيص مرجعي مثل DFAT أو DRIT.
وقد تم تقييم تقنيات RIDT للكشف عن فيروس الـ RABV وغيره من فيروسات ليسيسا. واحدة من الدراسات الأولى التي أجراها الباحثون الكورية في 200710. بالمقارنة مع طريقة DFAT ، في 51 عينة حيوانية و 4 ISOLATEV ، أظهر RIDT حساسية وخصوصية بنسبة 91.7٪ و 100 ٪ على التوالي. وقد تأكدت هذه النتائج في وقت لاحق مع 110 عينات الدماغ الحيوانية من كوريا، مع حساسية وخصوصية، مقارنة DFAT، من 95٪ و 98.9٪، على التوالي15. وفي الآونة الأخيرة، قيمت دراسات أخرى أداء هذا RIDT باستخدام عزلات الفيروس و/أو عينات الدماغ المصابة من مختلف الحيوانات ذات الأصول الجغرافية المختلفة. تم الكشف بنجاح عن لوحة مكونة من 21 عينة، بما في ذلك 100% من فيروس الـ RABV الأفريقي وفيروسات الليسيسا الأفريقية الأخرى (DUVENHage virus (DUVV)، وفيروس لاغوس الخفافيش (LBV)، وفيروس موكولا (MOKV))، مع حساسية تبلغ 100% مقارنة بـ DFAT16. حساسية عالية مماثلة (96.5٪ ) وخصوصية (100%) تم الحصول على القيم من لوحة من 115 عينات الدماغ من إثيوبيا17. دراسة أخرى تقييم العزل RABV الأوروبية, اثنين من الفيروسات الأوروبية الأخرى (الأوروبية الخفافيش فيروس lyssa من النوع 1 (EBLV-1) والنوع 2 (EBLV-2)), والاسترالية الخفافيش lyssavirus (ABLV)18. استنادا إلى تحليل 172 عينات الدماغ الحيوانية، وكان مجموعة RIDT حساسية 88.3٪ و 100٪ خصوصية مقارنة DFAT، وتم الكشف عن ثلاثة فيروس من الفيروسات المرتبطة بداء الكلب بنجاح. في هذه الدراسة, جاءت بعض النتائج السلبية الكاذبة من عينات الدماغ المخزنة في عازلة الجلسرين, مما يشير إلى أن إزالة الجلسرين غير لائق أثرت تدفق الشعيرات الدموية أو الأجسام المضادة ملزمة. وأكد تحليل حديث لـ 43 عينة سريرية من الخفافيش الأسترالية نتائج الاختبار السابقة، مع التوافق الكامل مع DFAT19. أجريت دراستان في الهند باستخدام RIDT على عدد محدود من العينات السريرية (11 و 34 عينة). مقارنة DFAT، كانت حساسية بين 85.7٪ و 91.7٪ وكانت خصوصية 100٪20،21. وحصل تقييم آخر لهذه المجموعة باستخدام 80 عينة من مخ الحيوانات من أفريقيا وأوروبا والشرق الأوسط على توافق تام مع DFAT لخصوصية (100%). ولكن حساسية أعلى (96.9%) مقارنة بالدراسات السابقة22. في مقارنة بين المختبرات الأخيرة من هذا RIDT أجريت في 22 مختبرات مختلفة باستخدام لوحة من 10 عينات، التوافق الكلي كان 99.5٪23.
وأظهرت دراسة واحدة فقط متعددة المراكز الأخيرة غير مرضية أداء RIDT العام24. وتم اختبار عينات من ثلاث مجموعات بيانات مختلفة وقدمت قيماً متغيرة للحساسية وخصوصية مقارنة مع DFAT. على سبيل المثال، أعطت الحساسية وخصوصية مع اللوحة الأولى (n = 51) واللوحة الثانية (n = 31) من عينات من الحيوانات المصابة التجريبية، وكلها تم اختبارها في المختبر A، حساسية بنسبة 16٪ و 43٪، على التوالي، في حين كانت 100٪ لكل منهما. وعلى العكس من ذلك، فإن نتائج اللوحة الثالثة (n= 30) من العينات السريرية الميدانية التي تم تحليلها من قبل المختبر B قدمت توافقًا كاملًا مع نتائج DFAT، والتي تم تأكيدها بشكل كامل من قبل المختبر A (حساسية 85٪ و100٪ خصوصية). واقترح التباين من دفعة إلى دفعة كتفسير محتمل للحساسية المنخفضة نسبياً المتقلبة مع RIDT24.
وفي الوقت نفسه، أجرت دراسة أخرى عملية تحقق مماثلة من RIDT الموصوف أعلاه، مع تعديل البروتوكول14الموصى به من قبل الشركة المصنعة . تم حذف خطوة ما قبل التخفيف (1:10) في برنامج تلفزيوني أثناء إعداد مواد الدماغ. وبناء على هذا البروتوكول المعدل الأبسط، حصل المؤلفون على حساسية وخصوصية بنسبة 95.3% و93.3% على التوالي، مقارنة بـ DFAT عن طريق اختبار، في ظل ظروف مختبرية، مجموعة بيانات من 73 عينة دماغ حيوانية، مصابة بشكل طبيعي أو تجريبي بسلالات مختلفة من الـ RABV. وعرضت الدراسة التقييم الأول لهذه الدراسة في إطار ميداني (تشاد، أفريقيا). في 48 عينة الدماغ السريرية, كانت حساسية وخصوصية 94.4% و 100%, على التوالي. وكانت التناقضات بين DFAT و RIDT بسبب نتائج إيجابية كاذبة مع DFAT ، تم تحديدها بعد تأكيدها باستخدام RT-PCR. وعندما تم حذف هذه النتائج، كان هناك توافق تام، وأظهر أن RIDT كان أكثر موثوقية أن DFAT في ظل هذه الظروف الميدانية14. لم يتم ملاحظة أي تباين من المجموعة إلى دفعة باستخدام البروتوكول المعدل. عندما تم تطبيق البروتوكول المعدل على عدد قليل من عينات DFAT / RIDT المتباينة (n = 8) في دراسة Eggerbauer et al.24، تم العثور على جميع متطابق (حساسية 100٪).
ميزة رئيسية أخرى من RIDT هو استخدام ثانوي للكشف عن الحمض النووي الريبي الفيروسي ثابتة على الشريط باستخدام التقنيات الجزيئية (مثل RT-PCR) وgenotyping اللاحقة14،24. بعد خطوة الاستخراج، أظهر Léchenne وآخرون14 RNA الفيروسية ثابتة على غشاء جهاز أنيغن باستخدام RT-PCR مع حساسية 86.3٪ في لوحة من 51 عينة (بما في ذلك 18 عينة اختبارها وشحنها من تشاد في درجة الحرارة المحيطة). وكان من الممكن حدوث جينوتيبينغ لاحقاً في 93 في المائة من العينات الـ 14 التي تم اختبارها. واستخدمت تسلسل السانجر لـ PCR amplicons التي لا تقل عن 500 نيوكليوتيدات في الطول. بالإضافة إلى عزل RABV ، اكتشف الاختبار أربعة أنواع أخرى من فيروسات ليسيسا ، DUVV ، EBLV -1 ، EBLV -2 و Bokeloh bat lyssavirus (BBLV) ، خلال اختبار مختبر دولي متوافق تمامًا14. وكانت حساسية الكشف عن الحمض النووي الريبي الفيروسي أعلى (100%) في دراسة Eggerbauer وآخرون، استنادا إلى فحص العينات المختبرية24. وأظهرت الدراسة الأخيرة أيضا أن العازلة المستخدمة في مجموعة RIDT الفيروس المعطل. وبالتالي، يمكن شحن الأجهزة بسهولة، في درجة الحرارة المحيطة دون احتياطات السلامة الحيوية محددة للمختبرات المرجعية، للتأكيد الجزيئية وgenotyping.
واستناداً إلى التقييمات السابقة، توفر أدوات RIDT مزايا عديدة للاستخدام في البيئات الميدانية، خاصة عندما لا تكون تقنيات التشخيص المرجعي متاحة. ومع ذلك، هذا الاختبار أيضا بعض القيود، وعلى وجه الخصوص، حساسية منخفضة من الكشف عن المستضد14،24. ينطبق الاختبار على العينات التي تحتوي على كميات عالية من المستضدات الفيروسية، مثل عينات الدماغ. ومع ذلك، فإنه ليس من المناسب للعينات الأخرى مثل اللعاب أو سوائل الجسم الأخرى. عيب آخر هو تكلفة الجهاز (حوالي 5-10 يورو في أوروبا)، وهو أقل تكلفة بالمقارنة مع تكلفة أداء DFAT، RT-PCR أو DRIT، ولكن التي لا تزال مرتفعة بالنسبة LMICs. غير أن تطوير أفرقة مماثلة من شركات أخرى والتحقق منها في المستقبل يمكن أن يؤديا إلى انخفاض الأسعار. وأفادت إحدى الدراسات عن اختلافات من دفعة إلى دفعة. ومع أن الآخرين لم يبلغوا عن ذلك، فإنه ينبغي مع ذلك تنفيذ ضوابط صارمة على الجودة عند اختبار دفعة جديدة، كما هو الحال بالنسبة لأي كاشف يستخدم في بيئة إدارة الجودة. لم يتم تغيير استخدام البروتوكول المعدل عند استخدام دفعات مختلفة14. وأظهرت جميع الدراسات باستثناء واحدة أن حساسية RDIT كانت عالية بالمقارنة مع DFAT (حوالي 90٪ -95٪). لأن داء الكلب دائماً قاتلة, لا يزال من المستحسن بشدة لتأكيد أي نتائج سلبية مع RDIT باستخدام اختبار تشخيصي مرجعي مثل DFAT, DRIT أو RT-PCR14.
في هذه المخطوطة، نقدم بروتوكولاً كاملاً للتشخيص الميداني بعد الوفاة لداء الكلب الحيواني استناداً إلى مثال لـ RIDT مُزَمَّر، من جمع عينة الدماغ إلى تطبيق بروتوكول معدَّل مقارنة بتوصيات الشركة المصنعة (التي تم التحقق من صحتها سابقاً14)والتحليل الجزيئي اللاحق. وقد تم تطبيق هذا البروتوكول والتحقق منه عدة مرات في ظل الظروف الميدانية في غرب ووسط أفريقيا، حيث كان يستخدم بشكل روتيني في تشخيص داء الكلب إلى جانب اختبار DFAT. بالإضافة إلى ذلك، نُظهر تطبيقًا ثانيًا للجهاز، في إعدادات المختبر، لاستخراجه واكتشافه باستخدام RT-PCR من الحمض النووي الريبي الفيروسي المثبت على الجهاز.
Protocol
1. جمع عينة عبر ماغنوم foramen (طريق القذالي)25
ملاحظة: يمكن تنفيذ هذه التقنية في ظروف المختبر أو في إعدادات الحقل. يجب معالجة العينات في أقرب وقت ممكن بعد وفاة الحيوان المشتبه به أو الاحتفاظ بها في درجة حرارة باردة (مبردة أو مجمدة ، إذا أمكن) لتجنب التحلل الذي يمكن أن يؤثر على النتائج. وعلى غرار التقنيات المرجعية الأخرى القائمة على اكتشاف مستضدات الفيروسات اللينيسا مثل DFAT وDIT، لا ينبغي اختبار العينات المتحللة لأنها يمكن أن تؤثر على النتيجة (خطر النتيجة السلبية الكاذبة).
تنبيه: ينبغي اعتبار جميع العينات من المحتمل أن تكون معدية. وينبغي اتباع أنظمة وإجراءات السلامة بدقة، حتى في إعدادات الحقل4. على وجه الخصوص، وارتداء معدات الحماية الشخصية المناسبة بما في ذلك قناع، والنظارات، والقفازات ومعطف المختبر. استخدام المطهر المناسب للمواد والعينة إزالة التلوث (على سبيل المثال، هيبوكلوريت الصوديوم مع التخفيفات المصنعة الموصى بها، 70٪ الكحول - الإيثانول أو الأيزوبروبانول، 1٪ محلول الصابون). وينبغي تطعيم جميع الأفراد الذين يتعاملون مع العينات ضد داء الكلب.
- إزالة رأس الحيوان بسكين قبل الفقرة العنقية الأولى (فقرة أطلسية) للوصول إلى ماغنوم الفراطين.
ملاحظة: لتقليل الهباء الجوي المعدي، تجنب استخدام منشار يدوي أو أداة مماثلة. - جمع جذع الدماغ (medulla oblongata) عينة باستخدام ماصة بلاستيكية المتاح (الشكل 2أ)، قش الشرب (الشكل 2ب) ، المشبك (الشكل 2ج) أو القطارة (الموردة مع RIDT) (الشكل 2D).
ملاحظة: يجب إيلاء اهتمام خاص عند جمع العينة، لأنها خطوة مهمة للغاية لموثوقية النتائج. بالإضافة إلى الفيديو المرتبطة التي تبين بطريقة بسيطة كيفية جمع جزء من جذع الدماغ من الفائدة، ويوصى بشدة خطوة التدريب للتأكد من جمع القسم التشريحية الصحيحة. - اختياريا وبالإضافة إلى جذع الدماغ (نخاع أولونغاتا)، وجمع أجزاء أخرى من جذع الدماغ أو الدماغ (المخيخ، قرن آمون، المهاد والقشرة) من قبل نفس الطريق القذالي عن طريق دفع وتناوب ماصة بلاستيكية أو القش نحو مقبس العين (الشكل 3).
- إذا كان استخدام القش أو ماصة، والضغط بلطف على إيداع عينة الدماغ (0.5-2 ز) في أنبوب لتحليل لاحق و / أو المصرفية الحيوية.
ملاحظة: لا ينصح تخزين العينة في الجلسرين، كما يبدو أن تؤثر على تدفق الشعيرات الدموية أو خطوة ربط الأجسام المضادة منRIDT 18.
2- تنفيذ بروتوكول RIDT المعدل14
ملاحظة: هذا التعديل حذف خطوة التخفيف (1:10) في برنامج تلفزيوني كما هو محدد في بروتوكول الشركة المصنعة (كافة الإصدارات) ، ويمكن تنفيذها تحت إعدادات الحقل أو المختبر.
- استخدام مسحة / القطارة لجمع ما يعادل نصف الفول السوداني أو البازلاء (0.1-0.5 غرام) من المواد في الدماغ ووضعها في أنبوب عينة العازلة.
ملاحظة: بالنسبة للبروتوكول المعدل، يتم تضمين جميع الكواشف/المواد الاستهلاكية في المجموعة (لا يوجد برنامج تلفزيوني أو أنبوب إضافي مطلوب)(الشكل 4). قم بتوثيق رقم المجموعة للمجموعة والتحقق من صحة تاريخ انتهاء الصلاحية. - سحق بعناية المواد المخ مباشرة في أنبوب مع مسحة أو القطارة لحوالي 30 s حتى يتم الحصول على تعليق متجانسة.
ملاحظة: تعطيل التفاعل العازلة العدوى الفيروس في ظروف بروتوكول الشركة المصنعة24. - باستخدام القطارة، إيداع أربع قطرات (حوالي 100 ميكرولتر) من التعليق في مدخل العينة على جهاز الاختبار.
- انتظر ترحيل العينة الكامل (1-5 دقيقة) قبل قراءة جهاز الاختبار. وينبغي أن تبدأ الهجرة بسرعة بعد إيداع العينة (1-5 دقيقة).
- في حالة التأخير (بسبب تعليق اللزوجة العالية) أو لتسريع بدء الهجرة ، خدش بلطف الجزء السفلي من موقع الإيداع للجهاز مع القطارة (1-5 مرات) وإضافة 1-2 قطرات أخرى في نهاية المطاف. وينبغي أن تبدأ عملية الهجرة بعد ذلك مباشرة.
- قراءة نتيجة الاختبار في نافذة الكشف بعد 5-10 دقيقة، وليس أكثر من 20 دقيقة، بعد نهاية الهجرة.
- تفسير النتيجة على أساس وجود أو غياب خط التحكم (C-line) وخط الاختبار (خط T) (خطوط أرجوانية) في نافذة الكشف، وفقاً للرقم 5. النظر في العينة إيجابية عندما يكون سطرين مرئية(الشكل 5أ)، سالب إذا كان فقط C-الخط موجود(الشكل 5ب)وغير صالح إذا كان الخط T فقط هو الحاضر أو إذا لم تكن خطوط مرئية(الشكل 5C).
ملاحظة: يجب تكرار النتائج غير الصحيحة مرة واحدة على الأقل. وينبغي تنفيذ تقنيات أخرى إذا كانت النتائج لا تزال غير صالحة. يجب تأكيد النتائج السلبية التي تم الحصول عليها باستخدام RIDT في وقت لاحق باستخدام طريقة مرجعية قياسية ذهبية، مثل DFAT و DRIT والطرق الجزيئية (تفاعل البوليميراز المتسلسل أو البوليميراز). على الرغم من أن حساسية هذا الاختبار عالية (انظر النتائج التمثيلية)، إلا أنها ليست 100٪ - تخزين الأجهزة المستعملة في درجة حرارة الغرفة، أو التبريد/التجميد عند الإمكان، للتحليل الجزيئي اللاحق (انظر القسم 4). تجميد تعليق العينة المتبقية في -20 درجة مئوية / -80 درجة مئوية في أنبوب العازلة لتكرار الاختبار إذا لزم الأمر أو للتحليل الجزيئي اللاحق.
3. RNA استخراج والكشف عن طريق RT-qPCR من جهاز RIDT
ملاحظة: لا يمكن تنفيذ هذه الخطوة إلا في ظل ظروف مختبرية مع بيئة مكيفة ومعدات مناسبة للتشخيص الجزيئي. ويمكن القيام به بعد وقت قصير من اختبار RIDT أو بأثر رجعي على أجهزة RIDT المؤرشفة، وتخزينها في درجة حرارة الغرفة (15-30 درجة مئوية)، المبردة أو المجمدة.
- استخراج RNA
ملاحظة: لمراقبة خطوة الاستخراج، من المستحسن استخدام التحكم الداخلي الذي يمكن أن يكون مرنا الذاتية (مثل ß-actin) أو مراقبة خارجية (مثل الحمض النووي الريبي الاصطناعية eGFP) ارتفعت مباشرة في العينة خلال الخطوات الأولى من استخراج26،27.- افتح الجهاز بعناية وقم بإزالة ورق التصفية.
- قطع منطقة إيداع العينة ووضعها في أنبوب يحتوي على 1 مل من LS ثلاثي كاشف. احتضان في RT لمدة 1 ساعة مع التحريض اليدوي العادي اللطيف.
- تنفيذ استخراج وفقا لتوصيات الشركة المصنعة، كما سبق وصفها27. في هذه الخطوة، يمكن إضافة المراقبة الداخلية الخارجية.
- خلال هذه العملية، إضافة 2 ميكرولتر من الجليكوجين لتسهيل هطول الأمطار من رنا، وفقا لتوصيات الشركة المصنعة.
- ضبط حجم النهائي لرنا resuspension في المياه الخالية من النوى، مع حجم 50 μL تستخدم عموما.
ملاحظة: في نهاية خطوة الطرد المركزي لفصل المرحلة المائي والعضوي (بعد إضافة 200 ميكرولتر من الكلوروفورم إلى ثلاثية كاشف LS)، ستكون قطعة الغشاء من الجهاز في الجزء السفلي من الأنبوب ولا تتداخل مع جمع المرحلة مائي العليا. بدلا من ذلك، يمكن استخدام بروتوكولات سهلة وسريعة أخرى، على سبيل المثال، باستخدام الكواشف القائمة على الفينول وأغشية السيليكا28.
- الكشف عن طريق RT-qPCR26
ملاحظة: يمكن أن يتم الكشف عن الحمض النووي الريبي الفيروسي المحتمل الموجود في العينات المستخرجة باستخدام تقنيات جزيئية مختلفة، مثل النسخ العكسي لـ PCR أو التقليدية (نقطة النهاية) أو PCR في الوقت الحقيقي (qPCR). تتوفر عدة طرق، مثل الـ RT-PCR27،,29 أو RT-qPCR26،,30 التي تستهدف النيوكليوبروتين الفيروسي أو جين البوليميراز. وسيتم تقديم مثال واحد أدناه على أساس ثنائي مشترك بين عموم lyssavirus RT-qPCR تستهدف منطقة محفوظة بين البوليميراز الفيروسي. هذه التقنية RT-qPCR إقران اثنين مختلفة RT-qPCR: واحد استناداً إلى تقنية التحقيق TaqMan (pan-RABV RT-qPCR) والآخر باستخدام الكشف عن SyBR الأخضر (pan-lyssa RT-qPCR). بالإضافة إلى ذلك، يتم الكشف عن الرقابة الداخلية الخارجية (eGFP RNA) التي تم ارتفاعها مباشرة أثناء عملية الاستخراج من قبل جهاز RT-qPCR قائم على المسبار TaqMan (eGFP RT-qPCR). التحقق الدقيق في الموقع من التقنيات الجزيئية المختارة للكشف عن الحمض النووي الريبي الفيروسي مهم ، على وجه الخصوص ، للتحقق من أن التمهيديات ، والتحقيقات في الوقت الحقيقي RT -PCR ، يتم تكييفها للكشف عن السلالات المتداولة في المنطقة ذات الاهتمام4.- تمييع عينة الحمض النووي الريبي إلى 1:10 في المياه الحرة النوكلاز. اختبر كل عينة RNA في تكرار، وذلك باستخدام لوحة رد فعل 96-جيدا أو غيرها من الأشكال. استخدام الضوابط الإيجابية والسلبية لكل فحص واختبار على الأقل في مكررة.
- إعداد حل التفاعل مزيج الرئيسي لفرزات RT-qPCR الثلاثة المختلفة وفقا للجدول 1، ومع التمهيديات / تحقيقات المشار إليها في الجدول 2.
- إضافة 5 ميكرولتر من عينات الحمض النووي الريبي المخفف و 15 ميكرولتر من مزيج رئيسي لكل من ثلاثة مقايسات مختلفة. يمكن أن تدور مقايسة PAN-RABV RT-qPCR وم مقايسة eGFP RT-qPCR في نفس اللوحة.
- تشغيل المقايسات المختلفة بعد ظروف الدراجات الحرارية المشار إليها في الجدول 3. إذا كان يتوفر دورة حرارية واحدة فقط PCR، ابدأ باللوحة RT-qPCR المقلاة RABV والاحتفاظ باللوحة الخاصة باللوحة RT-qPCR عند 4 درجات مئوية حتى نهاية الـ PAN-RABV RT-qPCR.
- تحليل النتائج التي تم الحصول عليها مع ثلاثة مقايسات وفقا للجدول 4.
4. Genotyping بعد استخراج RNA من جهاز RIDT
- النسخ العكسي RT27,29
- إعداد مزيج رئيسي مع 6 ميكرولتر من RNA، 2 ميكرولتر من pd(N) 6 التمهيديات عشوائية (200 ميكروغرام /ميكرولتر) و 2 ميكرولتر من المياه الخالية من النوى لحجم النهائي من 10 ميكرولتر.
- احتضان في 65 درجة مئوية لمدة 10 دقائق في كتلة الحرارة ثم تخزينها على الجليد.
- إعداد مزيج رئيسي مع 6 ميكرولتر من 5x أول ستراند العازلة، 2 ميكرولتر من 0.1 M dithiothreitol (DTT)، 1 ميكرولتر (200 U) من النسخ العكسي الفائق الثاني، 2 ميكرولتر (80 U) من RNasin، 2 ميكرولتر من مزيج dNTP (10 ميكرومتر) وكاملة مع المياه الخالية من النيوكلاسي للحصول على حجم نهائي من 20 ميكرولتر لكل عينة.
- أضف المزيج الرئيسي (20 ميكرولتر) إلى العينة (10 ميكرولتر) (الحجم النهائي 30 ميكرولتر) وحضن عند 42 درجة مئوية لمدة 90 دقيقة في كتلة الحرارة.
- انتقل إلى الخطوة التالية مع تضخيم PCR أو تخزين cDNA عند -20 درجة مئوية.
- PCR التقليدية27،29،31
ملاحظة: تقنيات مختلفة من PCR التقليدية متوفرة لgenotyping. يتم تقديم اثنين، على حد سواء PCR المُعَقَّق بالهيمي، الذي يستهدف جزءًا من البروتين النووي أو جزءًا من البروتين الفيروسي لفيروس ليسا. البروتوكول هو نفسه لكل من هذه المقايسات، باستثناء التمهيديات وظروف ركوب الدراجات. وينبغي أن تدرج في كل سلسلة وكل جولة من الضوابط من نظام التحكم بخلل في الانبعاثات (RNA) الإيجابية والسلبية (الضوابط السلبية لـ cDNA و/أو المياه الخالية من النوى).- الاستعداد لكل عينة في microtube 0.2 مل حل التفاعل مزيج الرئيسي لخطوة PCR الأولى. هذا المزيج يحتوي على 5 ميكرولتر من 10x NH4 التفاعل العازلة، 2.5 ميكرولتر من مغل2 حل (50 مل), 1 ميكرولتر من dNTP Mix (10 ميكرومتر), 1 ميكرولتر من كل التمهيدي (10 ميكرومتر), 0.2 ميكرولتر (1 يو) من بوليمرات الحمض النووي Biotaq و 37.3 ميكرولتر من المياه الخالية من النوى (الحجم النهائي من 48 ميكرولتر). يشار إلى التمهيديات في الجدول 5.
- إضافة 2 μL من cDNA في كل أنبوب ودورة على دورة حرارية PCR التقليدية منفصلة لكل مُقايسة، وفقا للجدول 6.
- إعداد حل تفاعل المزيج الرئيسي الثاني المطابق للسابق باستخدام التمهيديات المناسبة (الجدول 5) لتفاعل PCR المُتداخلة بالهيامي.
- إضافة 2 μL من أول جولة PCR المنتج ودورة على دورة حرارية PCR التقليدية باستخدام معلمات الدراجات المشار إليها في الجدول 6.
- تصور مختلف منتجات PCR (الجولة الأولى والثانية PCR) بعد تحميلها على هلام agarose 1٪ (100 مل من تريس خلات EDTA العازلة 1x - TAE 1x) مع بروميد الإتهيديوم (التركيز النهائي حوالي 0.01٪) وتشغيل الجل خلال 30 دقيقة في 120 V. ويلاحظ نتيجة إيجابية PCR في شكل شريط مشرق من الحجم المتوقع(الجدول 5).
- تسلسل سانجر
- تنفيذ تسلسل سانجر من amplicons التي تم الحصول عليها مع عموم lyssavirus هيمي المتداخلة PCR واستكمال تحليل genotyping.
Representative Results
كما هو الحال مع أي أسلوب التشخيص، جمع العينة من الأهمية القصوى لموثوقية النتائج، خاصة عندما يتم تنفيذها في إعدادات الحقل. وينبغي أن تكون عملية جمع العينات بسيطة قدر الإمكان لضمان جمع عينات عالية الجودة. جمع خزعة الدماغ (جذع الدماغ مع النخاع oblongata) عبر الطريق ماغنوم for for forsmortem تشخيص داء الكلب الحيوانية يفي بهذا الشرط, كما هو مبين في الشكل 2A-D25.
بعد جمع, يتم تقديم عينة الدماغ إلى البروتوكول المعدلة من RIDT, ملخص في الشكل 6. وكما هو مبين في قسم البروتوكول، فإن التكييف الرئيسي من الجهة المصنعة المقدمة هو حذف خطوة التخفيف في برنامج تلفزيوني، الذي يبسط الإجراء والمواد الاستهلاكية الضرورية/الكواشف، وبالتالي فإن جميع المواد المدرجة في المجموعة(الشكل 4).
تم تنفيذ هذا البروتوكول المعدل وتقييمه في خمسة مختبرات مختلفة، بما في ذلك مركز تعاوني لمنظمة الصحة العالمية حول داء الكلب (مختبر 1، فرنسا)، ومركز مرجعي واحد لمنظمة الأغذية والزراعة لداء الكلب (مختبر 5، إيطاليا) وثلاثة مختبرات مرجعية تقع في البلدان الأفريقية الازحلية، تشاد (مختبر 2)، ساحل العاج (مختبر 3)، ومالي (مختبر 4). وفي تشاد، تم تقييم التقييم في المختبرات وبيئات الميدان.
مقارنة مع تقنية DFAT المرجعية ، كانت حساسية وخصوصية RDIT عالية لجميع المختبرات ، مع 96٪ إلى 100٪ و 93.7٪ إلى 100 ٪، على التوالي(الجدول 7). تم الحصول على أدنى حساسية وخصوصية لـ RDIT للمختبر 1 (فرنسا) أثناء خطوة التحقق من صحة المختبر. استناداً إلى العدد التراكمي للعينات المختبرة (n = 162) (الجدول التكميلي 1)،كانت الحساسية الكلية وخصوصية مقارنة DFAT 98.2٪ و 95.8٪ على التوالي(الجدول 7). غير أن هذه النتائج الأولية والمبشرة بالخير قد تم الحصول عليها على عينة محدودة من مجموعة البيانات، وهي بحاجة إلى مزيد من التأكيد على عدد كبير من العينات الإيجابية والسلبية، لا سيما بالنسبة لتلك التي تم اختبارها في المناطق الزهنية، لتجنب أي تقدير محتمل أو تحيز بسبب مجموعات البيانات الهتروجينية الحالية.
اختبار RIDT مناسب للكشف عن فيروس ليسا في خزعات الدماغ من الحيوانات المصابة ، حيث مستوى مستضدات فيروس ليسا مهم. ومع ذلك، فإن حد الاختبار للكشف لا يزال مرتفعا عند اختبار تعليق الفيروس titrated(الجدول 8; الشكل 7).
يُظهر الجدول 9 (من Léchenne 201614)مثالاً على النتائج التي تم الحصول عليها بعد الكشف عن الحمض النووي الريبي بواسطة الفيروس اللينكائي RT-qPCR الذي يستهدف البوليميراز الفيروسي لفيروس ليسا. تم اختبار لوحة مكونة من 51 اختبارًا إيجابيًا من اختبارات RIDT أجريت في ظروف المختبر (المختبر 1، n=32) أو في تشاد (المختبر 2، n=19) ثم شحنها في درجة الحرارة المحيطة إلى المختبر 1. وتم الكشف عن 18 (94.7 في المائة)، و 26 (81.2 في المائة) في عام 2008. و44 (86.3%) عينات من مختبر 1، مختبر 2 واثنين مجتمعة، على التوالي. وبالإضافة إلى ذلك، تم إجراء جينوتيبينينغ لـ 14 من هذه العينات (10 من المختبر 1 و4 من المختبر 2) باستخدام PCR المتداخلة هيمي التي تستهدف جينات بروتينات النيوكلين الجزئية وكانت ناجحة لـ 13 منها (93%) (من لينين وآخرون. 201614).
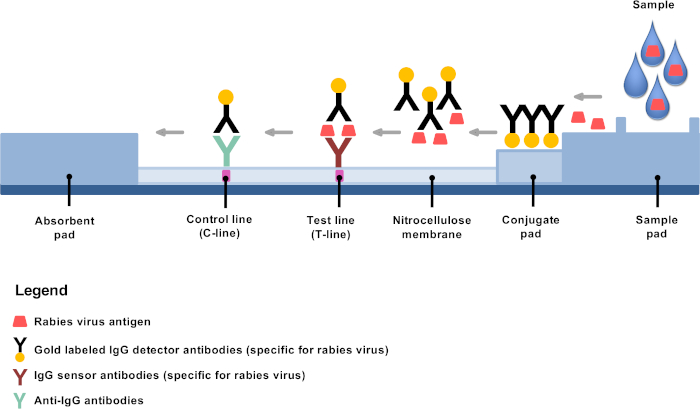
الشكل 1: التمثيل التخطيطي لهيكل RIDT لتشخيص داء الكلب. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 2: أمثلة على تقنيات بسيطة سريعة لجمع عينات الدماغ (جذع الدماغ مع النخاع oblongata) في الحيوانات (الكلب هو مبين هنا) عن طريق القذالي في الأماكن الميدانية (مالي). ( أ) جمع مع ماصة بلاستيكية يمكن التخلص منها (B) مجموعة مع القشة البلاستيكية الشرب (C) مجموعة مع المشبك (D) مجموعة مع القطارة التخلص المقدمة في مجموعة RIDT. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
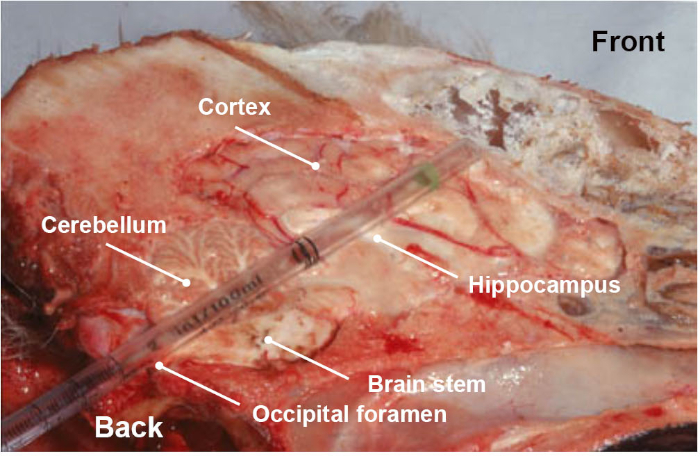
الشكل 3: مقطع تشريحي طولي لرأس الكلب، يظهر الأجزاء المختلفة من الدماغ (جذع الدماغ، المخيخ، قرن آمون، المهاد والقشرة) التي تم جمعها عند دفع، في حركة دورانية، ماصة بلاستيكية يمكن التخلص منها عبر طريق القاصية القذالي. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 4: وصف محتويات مجموعة RIDT، بما في ذلك الجهاز، وقطة بلاستيكية يمكن التخلص منها، ومسحة يمكن التخلص منها، ومزيل المقايسة. لا يتم توفير الأنبوب الذي سيتم جمع العينة وتخزينه. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
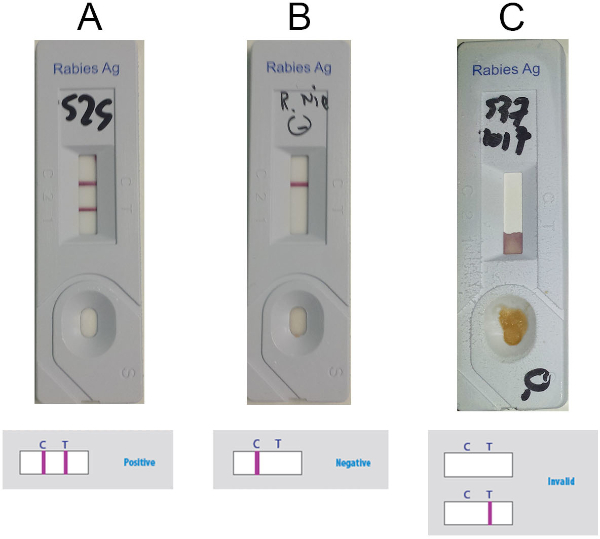
الشكل 5: نتائج تمثيلية لتفسير Anigen RIDT. (أ) نتائج إيجابية (وجود مرئي من خطين، C-الخط و T-line) (ب) نتائج سلبية (وجود مرئي من C-line فقط) (C) نتائج غير صالحة (عدم وجود خط C مرئي). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.

الشكل 6: التمثيل التخطيطي لبروتوكول RIDT، المقتبس من تعليمات الشركة المصنعة. (A) تعديل نسخة من البروتوكول، مع حذف خطوة التخفيف التي أوصت بها الشركة المصنعة (B) البروتوكول الأولي الموصى به من قبل الشركة المصنعة، مع خطوة التخفيف قبل 1:10 في برنامج تلفزيوني لعينات الدماغ. يشار إلى الخطوات المحذوفة في النسخة المعدلة من البروتوكول (المعروضة في الشكل 6أ)بخط أحمر. الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
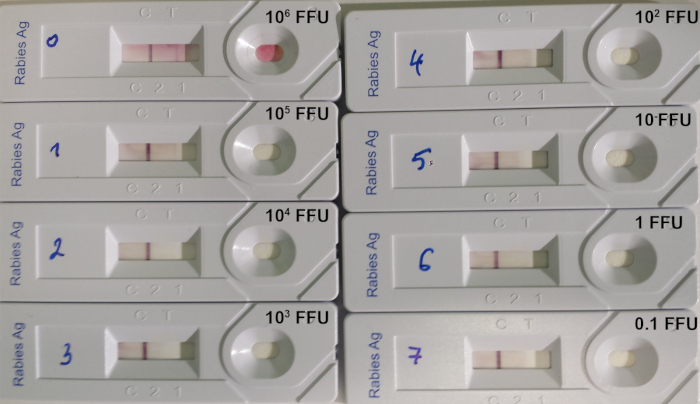
الشكل 7: مثال على تحديد حد الكشف عن RIDT14. تم استخدام 10:1 تخفيف المسلسل من فيروس داء الكلب titrated من سلالة 9704ARG. يشار إلى كمية الفيروس المودعة على كل جهاز في FFU (وحدات تشكيل التركيز الفلورسنت). الرجاء النقر هنا لعرض نسخة أكبر من هذا الرقم.
| Pan-RABV RT-qPCR مقايسة | |
| كاشف | μL / رد فعل |
| 2X مزيج التفاعل (عازلة تحتوي على 0.4 mM من كل dNTP و 6 M M MgSO4) | 10 |
| نوكلاز المياه الحرة | 1.5 |
| Taq3long (إلى الأمام) [10 μM] | 1 |
| Taq17revlong (عكس) [10 μM] | 1 |
| RABV4 [10 μM] | 0.3 |
| RABV5 [10 μM] | 0.3 |
| MgSO4 [50-mM] (المقدمة في مجموعة) | 0.25 |
| ROX صبغة مرجعية (25 μM) (المقدمة في مجموعة) | 0.05 |
| RNasin (40U/μL) (بروميغا) | 0.2 |
| SuperScript III RT/Platinum Taq Mix | 0.4 |
| المجموع لكل رد فعل | 15 |
| eGFP RT-qPCR مقايسة | |
| كاشف | μL / رد فعل |
| 2X مزيج التفاعل (عازلة تحتوي على 0.4 mM من كل dNTP و 6 M M MgSO4) | 10 |
| نوكلاز المياه الحرة | 2.8 |
| EGFP1F (إلى الأمام) [10 μM] | 0.5 |
| EGFP2R (عكس) [10 μM] | 0.5 |
| eGFP التحقيق [10 μM] | 0.3 |
| MgSO4 [50-mM] (المقدمة في مجموعة) | 0.25 |
| ROX صبغة مرجعية (25 μM) (المقدمة في مجموعة) | 0.05 |
| RNasin (40U/μL) (بروميغا) | 0.2 |
| SuperScript III RT/Platinum Taq Mix | 0.4 |
| المجموع لكل رد فعل | 15 |
| Pan-lyssa RT-qPCR مقايسة | |
| كاشف | μL / رد فعل |
| 2x SYBR مزيج التفاعل الأخضر | 10 |
| نوكلاز المياه الحرة | 2.1 |
| Taq5long (إلى الأمام) [10 μM] | 1 |
| Taq16revlong (عكسي) [10 μM] | 1 |
| MgSO4 [50-mM] (المقدمة في مجموعة) | 0.25 |
| صبغة مرجعية ROX (25 ميكرومتر) | 0.05 |
| RNasin (40U/μL) (بروميغا) | 0.2 |
| SuperScript III RT/Platinum Taq Mix | 0.4 |
| المجموع لكل رد فعل | 15 |
الجدول 1: وصف حل التفاعل المزجي الرئيسي لم مقايسات RT-qPCR الثلاثة المختلفة (pan-RABV RT-qPCR و pan-lyssa RT-qPCR و eGFP RT-qPCR).
| المقايسة RT-qPCR | اسم | نوع | طول | تسلسل (5'-3') | معني | موقف |
| pan-RABV RT-qPCR مقايسة | Taq3long | التمهيدي | 22 | ATG AGA AGT GGA AYA AYC ATC A | S | 7273-7294(أ) |
| Taq17revlong | التمهيدي | 25 | GAT CTG TCT GAA TAA TAG AYC CAR G | مثل | 7390-7414(أ) | |
| RABV4 | المسبار (FAM/TAMRA) | 29 | AAC ACY TGA TCB AGK ACA GAR AAY ACA TC | مثل | 7314-7342a | |
| RABV5 | المسبار (FAM/TAMRA) | 32 | AGR GTG TTT TCY AGR ACW CAY GAG TTT TTY CA | S | 7353-7384(أ) | |
| Pan-lyssa RT-qPCR مقايسة | Taq5long | التمهيدي | 23 | TAT GAG AAA TGG AAC AAY CAY CA | S | 7272-7294(أ) |
| Taq16revlong | التمهيدي | 25 | GAT TTT TGA AAG AAC TCA TGK GTY C | مثل | 7366-7390a | |
| eGFP RT-qPCR مقايسة | EGFP1F | التمهيدي | 20 | GAC CAC TAC CAG CAG AAC AC | S | 637-656b |
| EGFP2R | التمهيدي | 19 | GAA CTC CAG CAG GAC CAT G | مثل | 768-750b | |
| EGFP | المسبار (FAM/TAMRA) | 22 | AGC ACC CAG TCC دول مجلس التعاون الخليجي CTG AGC A | S | 703-724b |
الجدول 2: وصف ال التمهيدي/المسابير للتشبيرات الثلاث المختلفة لـ RT-qPCR (pan-RABV RT-qPCR و pan-lyssa RT-qPCR و eGFP RT-qPCR). (أ) وفقا لفيروس باستور (PV) تسلسل الجينوم RABV (جينبانك رقم الانضمام M13215). (ب) وفقا لاستنساخ ناقلات pEGFP-1 تسلسل (GenBank الانضمام رقم U55761).
| Pan-RABV RT-qPCR و eGFP RT-qPCR مقايسات | ||||
| خطوه | دوره | Temp | الوقت | جمع البيانات |
| عكس النسخ | 1 | 45 درجة مئوية | 15 دقيقة | |
| RT تعطيل / التسخين الأولي | 1 | 95 درجة مئوية | 3 دقائق | |
| التضخيم | 40 | 95 درجة مئوية | 15 س | |
| 61 درجة مئوية | 1 دقيقة | نقطة النهاية | ||
| Pan-lyssa RT-qPCR مقايسة | ||||
| خطوه | دوره | Temp | الوقت | جمع البيانات |
| عكس النسخ | 1 | 45 درجة مئوية | 15 دقيقة | |
| RT تعطيل / التسخين الأولي | 1 | 95 درجة مئوية | 3 دقائق | |
| التضخيم | 40 | 95 درجة مئوية | 15 س | |
| 55 درجة مئوية | 1 دقيقة | نقطة النهاية | ||
| منحنى الانفصام | 1 | 95 درجة مئوية | 15 س | زيادة 0.1 درجة مئوية/س، 55-95 درجة مئوية |
| 55 درجة مئوية | 1 دقيقة | |||
| 95 درجة مئوية | 15 س | |||
| 55 درجة مئوية | 15 س | |||
الجدول 3: وصف ظروف الدراجات الحرارية لم مقايسات RT-qPCR الثلاثة المختلفة (pan-RABV RT-qPCR، pan-lyssa RT-qPCR و eGFP RT-qPCR).
| مقايسه | تحليل | نتائج | تفسير |
| eGFP RT-qPCR | Cq في فترة القبول | استخراج التحقق من صحتها | تحليل من المقايسات الأخرى يمكن أن يتم |
| Cq من فترة القبول | الاستخراج لم يتم التحقق من صحته | إعادة اختبار العينة (كرر تشغيل أو /و/و الاستخراج)، طلب عينة أخرى إذا لزم الأمر | |
| بان-رابف RT-qPCR | Cq <38 | موجب | الكشف الإيجابي للرنا الفيروسي |
| Cq ≥ 38 | سالب | تحليل مقايسة عموم ليسا RT-qPCR | |
| عموم-ليسا RT-qPCR | منحنى الذوبان يعتبر إيجابيا | موجب | الكشف الإيجابي للرنا الفيروسي |
| منحنى الذوبان يعتبر سالب | سالب | عدم الكشف عن الحمض النووي الريبي الفيروسي |
الجدول 4: التفسير العام للتشايس المزدوج المدمج بين فيروس عموم lyssavirus RT-qPCR.
| هيمي المتداخلة المقايسة PCR التقليدية | جولة PCR | اسم | طول | تسلسل (5'-3') | معني | الموضعa | حجم أمبيركون (bp) |
| PCR المُعشَّشة بالهيمي التي تستهدف جين البوليميراز | الجولة الأولى | PVO5m | 20 | ATG ACA GAC AAY YTG AAC AA | S | 7170-7189 | 320 |
| PVO9 | 19 | TGA CCA TTC سيارة GTN G | مثل | 7471-7489 | |||
| الجولة الثانية | PVO5m | 20 | ATGA CAG ACA AYY TGA ACA A | S | 7170-7189 | 250 | |
| PVO8 | 22 | GGT CTG ATC TRT CWG ARY AAT A | مثل | 7398-7419 | |||
| PCR المُعشَّش بالهيمي الذي يستهدف جينات البروتين النووي | الجولة الأولى | N127 | 20 | ATG TAA CAC CTC TAC AAT GG | S | 55-74 | 1532 |
| N8m | 19 | CAG TCT CYT CNG CCA TCT C | مثل | 1568-1586 | |||
| الجولة الثانية | N127 | 20 | ATG TAA CAC CTC TAC AAT GG | S | 55-74 | 845 | |
| N829 | 19 | دول مجلس التعاون الخليجي CTG GTT CGA ACA TTC T | مثل | 881-899 |
الجدول 5: وصف التمهيديات المستخدمة ل PCR التقليدية ذات التكتل الهيمي.
| PCR المُعشَّشة بالهيمي التي تستهدف جين البوليميراز | ||||
| خطوه | دوره | درجه الحراره | الوقت | |
| الجولتين الأولى والثانية | التكون الأولي | 1 | 94 درجة مئوية | 3 دقائق |
| التشبع بالدن | 35 | 94 درجة مئوية | 30 س | |
| تهجين | 56 درجة مئوية | 45 س | ||
| استطاله | 72 درجة مئوية | 40 س | ||
| الاتسطيب النهائي | 1 | 72 درجة مئوية | 3 دقائق | |
| PCR المُعشَّش بالهيمي الذي يستهدف جينات البروتين النووي | ||||
| خطوه | دوره | درجه الحراره | الوقت | |
| الجولة الأولى | التكون الأولي | 1 | 94 درجة مئوية | 3 دقائق |
| التشبع بالدن | 35 | 94 درجة مئوية | 30 س | |
| تهجين | 56 درجة مئوية | 30 س | ||
| استطاله | 72 درجة مئوية | 45 س | ||
| الاتسطيب النهائي | 1 | 72 درجة مئوية | 3 دقائق | |
| الجولة الثانية | التكون الأولي | 1 | 94 درجة مئوية | 3 دقائق |
| التشبع بالدن | 35 | 94 درجة مئوية | 30 س | |
| تهجين | 58 درجة مئوية | 30 س | ||
| استطاله | 72 درجة مئوية | 30 س | ||
| الاتسطيب النهائي | 1 | 72 درجة مئوية | 3 دقائق | |
الجدول 6: وصف ظروف الدراجات الحرارية ل PCR التقليدي المتداخلة بالهيمي.
| مختبر | البلد | فترة التقييم | NB من العينات | نتائج DFAT | نتائج RIDT | حساسيه | خصوصيه | ||
| Pos | Neg | Pos | Neg | ||||||
| مختبر 1 | فرنسا | 2015 | 82 | 50 | 32 | 50 | 32 | 96% | 93.7% |
| مختبر 2 | تشاد | 2012-2015 | 44 | 33 | 11 | 33 | 11 | 100% | 100% |
| مختبر 3 | ساحل العاج | 2017 | 10 | 8 | 2 | 8 | 2 | 100% | 100% |
| مختبر 4 | مالي | 2017 | 18 | 15 | 3 | 15 | 3 | 100% | 100% |
| مختبر 6 | إيطاليا | 2016 | 8 | 8 | 0 | 8 | 0 | 100% | - |
| جميع | 2015-2017 | 162 | 114 | 48 | 114 | 48 | 98.2% | 95.8% | |
الجدول 7: تحديد البارامترات الجوهرية (الحساسية، التحديد) لاختبار RIDT مقارنة بطريقة DFAT المرجعية، استناداً إلى تحليل ما مجموعه 162 عينة وبمشاركة 5 مختبرات مختلفة.
| سلالة الفيروسa | المضيف الأصلي | موقع | التركيز الأولي (FFU/mL)ب | حد الكشف (FFU / مل)ج |
| 9147FRA | الثعلب الأحمر | فرنسا | 3.1 x 107 | 106 |
| السير الذاتيه | عزل المختبر | - | 1.6 x 107 | 106 |
| 8743ثا | الانسان | تايلاند | 8.1 x 107 | > 8.1 x 106 |
| 9508CZK (SAD) | عزل المختبر | - | 5.4 x 108 | 107 |
| الكهروضوئيه | عزل المختبر | - | 4.3 x 107 | 106 |
| 9001FRA | الكلب | غيانا الفرنسية | 2.4 x 106 | > 2.4 × 105 |
| 9704ARG | الخفافيش | الأرجنتين | 9.5 × 107 | 105 |
| 04030 في | الانسان | الفلبين | 2.5 x 107 | 105 |
الجدول 8: حد الكشف عن الـ RIDT باستخدام 8 حالات مختلفة من حالات إيقاف فيروس داء الكلب (من Léchenne et al. 201614). (أ) CVS: سلالة فيروس التحدي، SAD: شارع ألاباما Dufferin، PV: فيروس باستور. (ب) عدد وحدات تشكيل التركيز الفلورسنت (FFU) لكل مل. (ج) عدد وحدات تشكيل التركيز الفلورسنت (FFU) المودعة على الشريط.
| RIDT التي تم تنفيذها في | ||||||||||
| مختبر 1 | مختبر 2 | مجتمعه | ||||||||
| موجب | سالب | مجموع | موجب | سالب | مجموع | موجب | سالب | مجموع | ||
| الكشف عن الحمض النووي الريبي الفيروسي | موجب | 18 | 1 | 19 | 26 | 0 | 32 | 44 | 7 | 51 |
| سالب | 0 | 0 | 0 | 0 | 0 | 3 | 0 | 3 | 3 | |
| مجموع | 18 | 1 | 19 | 26 | 0 | 35 | 44 | 10 | 54 | |
الجدول 9: الكشف عن الحمض النووي الريبي الفيروسي مع RT-qPCR على شريط اختبار أنيغن المستخدم في ظروف المختبر (المختبر 1)، في ظروف الحقل وشحنها في درجة الحرارة المحيطة (مختبر 2) أو مجتمعة (من Léchenne وآخرون. 201614).
الجدول التكميلي 1: وصف العينات الـ 162 التي تم اختبارها مع اختبار RIDT لتحديد بارامتراتها الجوهرية الواردة في الجدول 7. الرجاء النقر هنا لعرض هذا الجدول (انقر بزر الماوس الأيمن للتحميل).
Discussion
وريد هو طريقة بسيطة وسريعة ومنخفضة التكلفة لتشخيص داء الكلب بعد الوفاة، وميدان بديل واعدة للاختبارات المختبرية. ومن شأن تطبيق هذا الاختبار، لا سيما في المناطق اللامركزية في البلدان المنخفضة الدخل والبلدان المتوسطة الدخل، أن يحسن فهم انتشار فيروس داء الكلب وانتقاله على الصعيد المحلي وعلى الصعيد الوطني المحتمل. عندما يقترن مع طريقة جمع عينة الدماغ السريع (دون necropsy كامل)، ميزة كبيرة هي أن الاختبار يمكن أن يؤديها تماما في وضع الحقل، بعيدا عن المرافق المختبرية. يمكن استخدام عينات الدماغ التي تم جمعها عبر ماغنوم الهدّان للاختبار ، وبالتالي لا يلزم فتح جمجمة الحيوان تمامًا. إن الاختبار بسيط في الأداء والتفسير، وهو مناسب بشكل خاص لأنشطة المراقبة الميدانية14. المزايا الأخرى للEDT على DFAT أو DRIT ليست هناك حاجة للضوابط الإيجابية والسلبية وتخزين عدة في درجة حرارة الغرفة. وبالإضافة إلى ذلك، فإن البروتوكول المعدل، حيث يتم حذف خطوة التخفيف (1:10) إلى برنامج تلفزيوني، لا يتطلب الكواشف الإضافية لإجراء الاختبار ويبسط الإجراء بشكل أكبر في ظل الظروف الميدانية.
النقطة الرئيسية هي نوعية عينات الدماغ. وينبغي جمع العينات واختبارها في أقرب وقت ممكن بعد وفاة الحيوان المشتبه فيه، أو الاحتفاظ بها في درجة حرارة باردة قبل الاختبار، لتجنب التدهور. لا ينبغي اختبار العينات المتحللة لأنها يمكن أن تؤثر على النتيجة (خطر نتيجة سلبية كاذبة). على الرغم من عدم توفر أي بيانات حتى الآن بشأن فقدان حساسية RIDT بمرور الوقت لعينات الدماغ، فإننا افترضنا أنه مشابه مقارنة باختبار DFAT32. ومع ذلك ، يمكن تقليل الوقت بين وفاة الحيوان وأداء الاختبار ، حيث يمكن إجراء الاختبار بسرعة ومباشرة في الميدان. وهكذا، هناك بشكل عام خطر أقل من العينات المتحللة.
خطوة أخرى هامة ضمن البروتوكول هي ترحيل تعليق العينة. يجب أن تبدأ عملية الترحيل مباشرة بعد إيداع العينة (1-5 دقيقة). لذلك يمكن لللزوجة العالية للتعليق أن تؤثر سلبا على الهجرة. بلطف الخدش الجزء السفلي من موقع إيداع الجهاز مع القطارة وإضافة 1-2 قطرات أكثر غالبا ما يحل هذه المشكلة، وتبدأ الهجرة مباشرة بعد.
أجريت معظم اختبارات RIDT في المختبرات الأفريقية (تشاد وساحل العاج ومالي) في درجة الحرارة المحيطة التي يمكن أن تتجاوز 30 درجة مئوية، في حين أن نطاق درجة الحرارة للتخزين والاستخدام الذي أوصت به الشركة المصنعة هو 15 درجة مئوية - 30 درجة مئوية. على الرغم من أننا لم نحدد أي تأثير لدرجات الحرارة العالية على أداء اختبار RIDT ، فمن الضروري تقييمه بعناية أكبر. وبالمثل، فإن تأثير ارتفاع درجة الحرارة أثناء التخزين والنقل للجهاز بعد استخدامه للكشف عن الحمض النووي الريبي الفيروسي وgenotyping يحتاج إلى تقييم إضافي. حساسية الكشف عن الحمض النووي الريبي الفيروسي من قبل RT-qPCR من قطاع RIDT يمكن أن تتأثر بنوعية عينة الدماغ المستخدمة في البداية في الاختبار، ولكن أيضا من قبل حالة تخزين اختبارات RIDT بعد الاستخدام. على سبيل المثال، كانت حساسية الكشف عن الحمض النووي الريبي أعلى عندما تم تخزين اختبارات RIDT المستخدمة في ظروف المختبر الخاضعة للرقابة (94.7%) مقارنة بالظروف الميدانية (مثل تشاد) (81.2%)14 قد تؤثر هذه الشروط أيضا على سلامة (وخاصة طول) من RNA ثابتة على الشريط، وربما يفسر حساسية معتدلة لgenotyping على أساس أطول PCR amplicons (على سبيل المثال، > 500 النيوكليوتيدات)14. وكانت حساسية RT-qPCR التي أجريت على شريط الاختبار أقل من تلك التي تم الحصول عليها باستخدام بطاقات Whatman FTA (80.6٪14. على غرار التقنيات الجزيئية الأخرى ، يمكن أن يؤثر الحمل الفيروسي أيضًا على نجاح genotyping استنادًا إلى شرائط RDIT ، مع نتائج سلبية محتملة للعينات ذات الحمل الفيروسي المنخفض14.
ولا توصي منظمة الصحة العالمية ومنظمة الصحة العالمية حالياً بإجراء الاختبار للتشخيص الروتيني ومراقبة الأمراض، ولا يمكن استخدام نتيجة من تلقاء نفسها لتوجيه عملية اتخاذ قرار برنامج "بيب". ولا تزال هناك حاجة إلى مزيد من التحقق من صحة الاختبار. ومع ذلك ، فإن التشخيص الدقيق لداء الكلب السريع هو عنصر حاسم في أنظمة مراقبة داء الكلب المستمرة التي تعمل بشكل جيد ، وهو فعال لزيادة الالتزام السياسي ، وهو أمر مهم للغاية لسرعة السيطرة على داء الكلبالمستدامة 33. وتوفر اختبارات ريدت فرصاً جديدة لتشخيص داء الكلب في هذا السياق، وهي أداة مفيدة لتوسيع نطاق مراقبة داء الكلب الحيواني في الميدان في المناطق المنخفضة أو المتوسطة الدخل.
Acknowledgements
وقد تم دعم هذا العمل من خلال التحالف العالمي للقاحات والتحصين ،ومؤسسة وولفرمان نغيلي ، والتعاون العلمي الأفريقي السويسري (SARECO) ، SWF Stiftung für wissenschaftliche Forschung ، Freiwillige Akademische Gesellschaft (FAG) بازل ، وبرنامج التعاون الثنائي في العلوم والتكنولوجيا في سويسرا مع آسيا ، ومؤسسة نوفارتس لبحوث الطب الحيوي.
ونحن نشكر خصوصا أصحاب الكلاب، والعاملين البيطريين وموظفي المختبر لالتزامهم الكبير. نريد أيضا أن نعترف ليزا كرومب لتحرير اللغة.
Materials
| Name | Company | Catalog Number | Comments |
| Anti-Rabies Nucleocapsid Conjugate (lyophilizied, adsorbed) | Bio-Rad, France | 3572112 | Fluorescein-5-isothiocyanate (FITC) conjugated polyclonal antibody against the nucleocapsid of rabies virus. Use for the DFAT reference tecnnique. |
| Applied Biosystems 7500 Real-Time PCR System | Applied Biosystems, France | 4351104 | Amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| Disposable plastic pipette, drinking straw, clamp, dropper | - | - | Equipment used for the collection of the brain stem (medulla oblongata) via the foramen magnus (occipital route). |
| Evans Blue Solution 1% | Bio-Rad, France | 3574911 | Counter-coloration used for the DFAT to facilite the reading under UV microscope. |
| Primer eGFPF1 | Eurofins Genomics, Germany | - | Forward primer for the amplification of the internal control eGFP by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-GACCACTACCAGCAGAACAC-3'. |
| Primer eGFPR2 | Eurofins Genomics, Germany | - | Reverse primer for the amplification of the internal control eGFP by RT-qPCR after extraction from the RIDT device, sequence: 5'-GAACTCCAGCAGGACCATG-3'. |
| Primer Taq17 revlong | Eurofins Genomics, Germany | - | Reverse primer for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-ATGAGAAGTGG AAYAAYCATCA-3'. |
| Primer Taq3 long | Eurofins Genomics, Germany | - | Forward primer for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-GATCTGTCTGAA TAATAGAYCCARG-3'. |
| Probe eGFP FAM/TAMRA | Eurofins Genomics, Germany | - | Forward primer for the amplification of the internal control by RT-qPCR after extraction from the RIDT device, sequence: 5'-AGCACCCAGT CCGCCCTGAGCA-3'. |
| Probe RABV4 FAM/TAMRA | Eurofins Genomics, Germany | - | Probe for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-AACACYTGATCBA GKACAGARAAYACATC-3'. |
| Probe RABV5 FAM/TAMRA | Eurofins Genomics, Germany | - | Probe for the amplification of the viral RNA by RT-qPCR after RNA extraction from the RIDT device, sequence: 5'-AGRGTGTTTTCYAG RACWCAYGAGTTTTTYCA-3'. |
| Rapid Rabies Ag Test Kit | BioNote Inc., Republic of Korea | RG18-01DD | Rapid immunochromatographic diagnostic test (RIDT, also named lateral flow device or LFD) for the post-mortem diagnosis of rabies. |
| Recombinant RNasin Ribonuclease Inhibitor | Promega, USA | N2515 | Enzyme used with the kit for the amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| SuperScript III Platinum One-Step qRT-PCR Kit | Invitrogen, France | 11732-020 | Kit for the amplification of the viral RNA by RT-qPCR after extraction from the RIDT device. |
| TRIzol Reagent | Invitrogen, France | 15596026 | Phenol/chloroforme based total RNA extraction using the cellulose membrane of the RIDT. |
References
- Hampson, K., et al. Correction: Estimating the Global Burden of Endemic Canine Rabies. PLoS Neglected Tropical Diseases. 9 (5), e0003786 (2015).
- Rupprecht, C., Kuzmin, I., Meslin, F. Lyssaviruses and rabies: current conundrums, concerns, contradictions and controversies. F1000Research. 6, 184 (2017).
- Walker, P. J., et al. ICTV Virus Taxonomy Profile: Rhabdoviridae. The Journal of General Virology. 99 (4), 447-448 (2018).
- World Health Organization (WHO). WHO Expert Consultation on Rabies, third report. HO Technical Report Series, No. 1012. , (2018).
- Dacheux, L., et al. More Accurate Insight into the Incidence of Human Rabies in Developing Countries through Validated Laboratory Techniques. PLoS Neglected Tropical Diseases. 4 (11), e765 (2010).
- Welburn, S. C., Beange, I., Ducrotoy, M. J., Okello, A. L. The Neglected Zoonoses - The Case for Integrated Control and Advocacy. Clinical Microbiology and Infection: The Official Publication of the European Society of Clinical Microbiology and Infectious Diseases. , (2015).
- Dacheux, L., Bourhy, H. Diagnostic tests for human rabies. Revue Scientifique Et Technique (International Office of Epizootics). 37 (2), 581-593 (2018).
- Kasempimolporn, S., Saengseesom, W., Lumlertdacha, B., Sitprija, V. Detection of rabies virus antigen in dog saliva using a latex agglutination test. Journal of Clinical Microbiology. 38 (8), 3098-3099 (2000).
- Kang, B., et al. Evaluation of a rapid immunodiagnostic test kit for rabies virus. Journal of Virological Methods. 145 (1), 30-36 (2007).
- Nishizono, A., et al. A simple and rapid immunochromatographic test kit for rabies diagnosis. Microbiology and Immunology. 52 (4), 243-249 (2008).
- Kasempimolporn, S., Saengseesom, W., Huadsakul, S., Boonchang, S., Sitprija, V. Evaluation of a rapid immunochromatographic test strip for detection of Rabies virus in dog saliva samples. Journal of Veterinary Diagnostic Investigation: Official Publication of the American Association of Veterinary Laboratory Diagnosticians, Inc. 23 (6), 1197-1201 (2011).
- Ahmed, K., et al. Evaluation of a monoclonal antibody-based rapid immunochromatographic test for direct detection of rabies virus in the brain of humans and animals. The American Journal of Tropical Medicine and Hygiene. 86 (4), 736-740 (2012).
- Léchenne, M., et al. Validation of a Rapid Rabies Diagnostic Tool for Field Surveillance in Developing Countries. PLoS Neglected Tropical Diseases. 10 (10), e0005010 (2016).
- Yang, D. K., et al. Comparison of four diagnostic methods for detecting rabies viruses circulating in Korea. Journal of Veterinary Science. 13 (1), 43-48 (2012).
- Markotter, W., et al. Evaluation of a rapid immunodiagnostic test kit for detection of African lyssaviruses from brain material. The Onderstepoort Journal of Veterinary Research. 76 (2), 257-262 (2009).
- Reta, T., et al. Evaluation of Rapid Immunodiagnostic Test for Rabies Diagnosis Using Clinical Brain Samples in Ethiopia. Journal of Veterinary Science & Medical Diagnosis. 2 (3), 1-3 (2013).
- Servat, A., Picard-Meyer, E., Robardet, E., Muzniece, Z., Must, K., Cliquet, F. Evaluation of a Rapid Immunochromatographic Diagnostic Test for the detection of rabies from brain material of European mammals. Biologicals: Journal of the International Association of Biological Standardization. 40 (1), 61-66 (2012).
- Certoma, A., et al. Assessment of a Rabies Virus Rapid Diagnostic Test for the Detection of Australian Bat Lyssavirus. Tropical Medicine and Infectious Disease. 3 (4), (2018).
- Ahmad, A., Singh, C. K. Comparison of rapid immunodiagnosis assay kit with molecular and immunopathological approaches for diagnosis of rabies in cattle. Veterinary World. 9 (1), 107-112 (2016).
- Sharma, P., Singh, C. K., Narang, D. Comparison of immunochromatographic diagnostic test with Hheminested Reverse transcriptase polymerase chain reaction for detection of rabies virus from brain samples of various species. Veterinary World. 8 (2), 135-138 (2015).
- Voehl, K. M., Saturday, G. A. Evaluation of a rapid immunodiagnostic rabies field surveillance test on samples collected from military operations in Africa, Europe, and the Middle East. U.S. Army Medical Department Journal. , 27-32 (2014).
- Servat, A., Robardet, E., Cliquet, F. An inter-laboratory comparison to evaluate the technical performance of rabies diagnosis lateral flow assays. Journal of Virological Methods. 272, 113702 (2019).
- Eggerbauer, E., et al. Evaluation of Six Commercially Available Rapid Immunochromatographic Tests for the Diagnosis of Rabies in Brain Material. PLoS Neglected Tropical Diseases. 10 (6), e0004776 (2016).
- Barrat, J., Meslin, F. X., Kaplan, M. M., Koprowski, H. Simple technique for the collection and shipment of brain specimens for rabies diagnosis. Laboratory techniques in rabies. , 425-432 (1996).
- Dacheux, L., et al. Dual Combined Real-Time Reverse Transcription Polymerase Chain Reaction Assay for the Diagnosis of Lyssavirus Infection. PLoS Neglected Tropical Diseases. 10 (7), e0004812 (2016).
- Dacheux, L., et al. A reliable diagnosis of human rabies based on analysis of skin biopsy specimens. Clinical Infectious Diseases: An Official Publication of the Infectious Diseases Society of America. 47 (11), 1410-1417 (2008).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Application of next generation sequencing to rabies virus and other lyssaviruses. Laboratory techniques in rabies. 2, 49-61 (2019).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Conventional pan-lyssavirus reverse transcriptase polymerase chain reaction. Laboratory techniques in rabies. 2, 1-16 (2019).
- Rupprecht, C., Fooks, A. R., Abela-Ridder, B. Rabies real-time reverse transcriptase polymerase chain reaction. Laboratory techniques in rabies. 2, 17-34 (2019).
- Talbi, C., et al. Evolutionary history and dynamics of dog rabies virus in western and central Africa. The Journal of General Virology. 90 (Pt 4), 783-791 (2009).
- McElhinney, L. M., Marston, D. A., Brookes, S. M., Fooks, A. R. Effects of carcase decomposition on rabies virus infectivity and detection. Journal of Virological Methods. 207, 110-113 (2014).
- Vigilato, M. A. N., et al. Progress towards eliminating canine rabies: policies and perspectives from Latin America and the Caribbean. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 368 (1623), 20120143 (2013).
Explore More Articles
This article has been published
Video Coming Soon
ABOUT JoVE
Copyright © 2025 MyJoVE Corporation. All rights reserved